Seminario Aminas SÍNTESIS Y REACTIVIDAD. Química Orgánica I. Plan 2008 Dra. M. Gabriela Lorenzo
|
|
|
- Emilio Alvarado Fidalgo
- hace 6 años
- Vistas:
Transcripción
1 Seminario Aminas SÍNTESIS Y REACTIVIDAD Química Orgánica I. Plan 2008 Dra. M. Gabriela Lorenzo 1
2 2 Ejemplos de algunas aminas biológicamente activas
3 Alcaloides Muchas drogas de adicción son alcaloides 3
4 Estructura de las aminas El amoníaco tiene una estructura tetraédrica algo distorsionada, con una de las posiciones del tetraedro ocupada por un par de electrones no enlazantes. Esta geometría es debida a la hibridación sp 3 del nitrógeno, de forma que el par de electrones solitario hace que el ángulo H-N-H se comprima desde 109,5º (ángulo de la estructura tetraédrica perfecta) hasta 107º. 4
5 Propiedades físicas de las aminas Las aminas son fuertemente polares debido a que el gran momento dipolar del par de electrones solitario se suma a los momentos dipolares de los enlaces C-N y H-N. El enlace de hidrógeno N-H es más débil que el enlace de hidrógeno O-H, por tanto las aminas tienen puntos de ebullición más bajos que los alcoholes con masas moleculares similares. 5
6 Estabilización por el grupo alquilo de las aminas Los grupos alquilo son donantes de electrones. Como la metilamina tiene un grupo metilo, éste ayuda a estabilizar la carga positiva del nitrógeno. Esta estabilización disminuye la energía potencial del catión metilamonio, haciendo que la metilamina sea una base más fuerte que el amoníaco. Las alquilaminas sencillas tienden a ser bases más fuertes que el amoníaco. 6
7 Estabilización de la anilina La anilina está estabilizada por el traslapamiento del par solitario con el anillo aromático. En el ión anilinio no es posible este traslapamiento. El nitrógeno de la anilina tiene los electrones no enlazantes paralelos a los orbitales p del anillo, por lo que se puede producir solapamiento. 7
8 Efectos de la hibridación En la piridina los electrones no enlazantes ocupan un orbital sp 2, con mayor carácter s y con electrones más retenidos que los de un orbital sp 3 de una amina alifática. Los electrones no enlazantes de la piridina están menos disponibles para enlazarse a un protón. La piridina es menos básica que las aminas alifáticas, pero es más básica que el pirrol porque no pierde su aromaticidad en la protonación. 8
9 Basicidad de Compuestos Nitrogenados FACTORES A TENER EN CUENTA: Disponibilidad del par electrónico sobre el N: Efectos electrónicos (Inductivos y Mesoméricos) Hibridación del N: a mayor elctronegatividad menor basicidad Electronegatividad del N: sp > sp2 > sp3 Basicidad: Nitrilos < Iminas < Aminas Efectos de Solvatación 9
10 Anilinas para-sustituidas SUSTITUYENTE pka (ácidos conjugados) CH 3 O 5.34 CH H 4.60 Cl 3.98 CN 1.74 NO Recordar: AAA (Atractores Aumentan Acidez) 10
11 Problema Formule en orden CRECIENTE de BASICIDAD los siguientes compuestos: Dietilamina Anilina Butanonitrilo p-nitroanilina Acetamida p-metoxianilina Ciclohexilamina Amoníaco 11
12 Solubilidad de las aminas La mayoría de las aminas, que contienen más de seis átomos de carbono, son relativamente insolubles en agua. En presencia de ácido diluido (en disolución acuosa), estas aminas forman las sales de amonio correspondientes, por lo que se disuelven en agua. Cuando la solución se transforma en alcalina, se regenera la amina La amina regenerada o bien se separa de la solución acuosa, o se extrae con un disolvente orgánico. 12
13 Solubilidad de las aminas y las sales de amonio 13 La mayoría de las aminas, que contienen más de seis átomos de carbono, son relativamente insolubles en agua. En presencia de ácido diluido (en disolución acuosa), estas aminas forman las sales de amonio correspondientes, por lo que se disuelven en agua. La formación de una sal soluble es una de las pruebas características para el grupo funcional amina. Una amina puede convertirse en sal de amonio mediante un tratamiento con ácido. La sal de amonio es soluble en agua. Al tratar la sal de amonio con soluciones básicas la volverá a convertir en la amina. ESTE ES EL FUNDAMENTO DE LAS EXTRACCIONES ÁCIDO/BASE.
14 Diagrama de energía potencial de la reacción de disociación básica de una amina. Los grupos alquilo estabilizan el ión amonio, haciendo que la amina sea una base más fuerte. Sin embargo, las aminas primarias, secundarias y terciarias muestran basicidades similares debido a los efectos de disolución. 14
15 15 Aislamiento o Separación de aminas
16 16 Síntesis de Aminas 1º Aminas 2º Aminas 3º SÍNTESIS DE AMINAS Reacciones Síntesis de Gabriel Aminación Reductiva Reducción de Amidas Reducción de Nitrocompuestos Transposición de Hofmann de Amidas Reducción de nitrilos Aminación Reductiva Reducción de Amidas Aminación Reductiva Reducción de Amidas
17 Síntesis de Gabriel El anión ftalimidato es un nucleófilo fuerte, que desplaza a un ión haluro o tosilato de un buen sustrato SN 2. La polialquilación no se produce porque la N-alquil ftalimida no es nucleofílica y no existen protones ácidos adicionales en el nitrógeno. Al calentar la N-alquil ftalimida con hidrazina, ésta desplaza a la amina primaria y se forma la ftalhidrazida (muy estable). La síntesis de Gabriel es una forma rápida y fácil de obtener aminas primarias sin productos polialquilados 17
18 Reducción de nitrocompuestos Los grupos nitro aromáticos y alifáticos se reducen fácilmente a grupos amino. La forma más frecuente de llevarlo a cabo es por hidrogenación catalítica o mediante reducción con un metal activo, en medio ácido. 18 La reducción se utiliza mayormente en la síntesis de los derivados anilínicos.
19 Aminación reductiva: síntesis de aminas primarias Las aminas primarias se obtienen a partir de la condensación de amoníaco o hidroxilamina (sin grupos alquilo) con una cetona o un aldehído, seguida de la reducción del producto. En el caso de la formación de oximas, la reacción conveniene porque la mayoría de ellas son estables, y por lo tanto son compuestos fácilmente aislables. H 2 /Ni, NaBH 4, NaBH 3 CN se pueden utilizar como reductores. En el caso de partir desde oximas se puede utilizar también LiAlH 4. 19
20 20 Aminación reductiva: síntesis de aminas primarias.
21 21 Aminación reductiva: síntesis de aminas primarias.
22 Aminación reductiva: síntesis de aminas secundarias La condensación de una cetona o un aldehído con una amina primaria da lugar a una imina N-sustituida (base de Schiff). La reducción de la imina N-sustituida da lugar a una amina secundaria. 22 LiAlH 4 o NaBH 3 CN se pueden utilizar para reducir la imina. Para ver una animación del mecanismo de formación de la imina consultar: x/iminefm.htm
23 Aminación reductiva: síntesis de aminas terciarias Se propone que la condensación de una cetona o un aldehído con una amina secundaria daría lugar a una enamina. Un agente reductor en la solución reduce la enamina para fomar la amina terciaria Es mejor la utilización de NaBH 3 CN porque reducirá selectivamente la enamina y no el grupo carbonilo precursor. 23
24 Síntesis de aminas por acilación-reducción: Reducción de Amidas Igual que en la aminación reductiva, en la acilación-reducción se añade un grupo alquilo al átomo de nitrógeno de la amina de partida. La acilación de la amina de partida mediante un cloruro de ácido da lugar a una amida, que no tiene tendencia a poliacilarse. La reducción de LiAlH 4 da lugar a la amina correspondiente. 24 Dependiendo de la amina utilizada como material de partida podemos obtener una amina primaria, secundaria o terciaria como producto. El uso de amoníaco dará lugar a una amina primaria tras la acilaciónreducción. La reacción de una amina primaria producirá una amina secundaria y la reacción de una amina secundaria producirá una amina terciaria tras acilación-reducción.
25 Reordenamiento o transposición de Hofmann de amidas En presencia de una base fuerte, las amidas primarias reaccionan con cloro o bromo para dar lugar a aminas, con la pérdida del átomo de carbono carbonílico. Esta reacción, denominada reordenamiento de Hofmann, se utiliza para sintetizar alquil y arilaminas primarias. 25 El producto tendrá un carbono menos (por carbonilo) que el material de partida.
26 Mecanismo del reordenamiento de Hofmann: paso 1 El primer paso consiste en la sustitución de uno de los átomos de hidrógeno del nitrógeno por un halógeno La amida desprotonada es nucleofílica y atacará a la molécula de bromo formando la N-bromo amida. 26
27 Mecanismo del reordenamiento de Hofmann: paso 2 La desprotonación de la N-bromo amida da lugar a otro anión estabilizado por resonancia. El átomo de bromo de la N - bromo amida desprotonada es un grupo saliente potencial. Sin embargo, para que el bromuro se elimine, el grupo alquilo ha de emigrar hacia el nitrógeno. El paso del reordenamiento, da lugar a la formación de un isocianato intermedio 27
28 Mecanismo del reordenamiento de Hofmann: paso 3 Los isocianatos reaccionan rápidamente con agua para dar lugar a ácidos carbámicos. Un grupo hidroxilo del agua ataca al carbono del isocianato, y tras la protonación, produce el ácido 28
29 Mecanismo del reordenamiento de Hofmann: paso 4 La descarboxilación del ácido carbámico da lugar a la amina y a dióxido de carbono. Un grupo hidroxilo desprotona al ácido carbámico, haciendo que comience una reacción de descarboxilación. La amina producida se protona por agua. 29
30 Problema Prob. 4 (pág. 35): Sobre la base de los precedentes que Ud. Conoce Cuál sería la ruta más adecuada para intentar la obtención de la terbutilamina? a) Por amonólisis del derivado halogenado b) Por síntesis de Gabriel c) Por aminación reductiva d) Por reducción de una amida e) Por degradación de Hofmann Explique en cada caso sus conclusiones y, una vez elegido el procedimiento, formule la transformación 30
31 Problema: Rta Prob. 4 (pág. 35): Por degradación de Hofmann CH 3 CH 3 C C CH 3 O Br 2 NH 2 NaOH CH 3 CH 3 C CH 3 NH 2 31
32 REACTIVIDAD DE LAS AMINAS Una amina es un nucleófilo (una base de Lewis) debido a que el par solitario de electrones no enlazantes pueden formar un enlace con un electrófilo. Una amina también puede actuar como base de Brönsted-Lowry, aceptando un protón de un ácido. Cuando una amina actúa como un nucleófilo, se forma un enlace N-C. Cuando actúa como una base, se forma un enlace N-H. 32
33 33 Reactividad de las aminas
34 Activación del benceno por medio del grupo amino El grupo amino es un activador fuerte y orto, para-director. Los electrones no enlazantes del nitrógeno estabilizan el complejo cuando el ataque se produce en las posiciones orto o para. El nitrógeno puede utilizar sus electrones no enlazantes para estabilizar la carga positiva del complejo sigma 34
35 Problema Efectúe las siguientes transformaciones indicando tipo de reacción en cada paso: a. Benceno en p-nitroanilina b. Benceno en m-nitroanilina 35
36 Alquilación de aminas con haluros de alquilo. Las aminas reaccionan con haluros de alquilo primarios para dar lugar a haluros de amonio alquilados. 36 La polialquilación es un problemas cuando se alquilan las aminas a través de este método.
37 Acilación de aminas Las aminas primarias y secundarias reaccionan con haluros de ácido para formar amidas. El nitrógeno de la amina atacará al carbono carbonílico y desplazará al cloruro. 37
38 Acilación de aminas El cloruro de ácido es más reactivo que la cetona o el aldehído debido a que el átomo electronegativo de cloro sustrae densidad electrónica del carbono carbonílico, haciéndolo más electrofílico. 38 El nitrógeno de la amina ataca al carbono carbonílico formando un intermedio tetraédrico. El desplazamiento del cloruro y la desprotonación dan lugar a la amida como producto final.
39 Síntesis de sulfonamidas Una amina primaria o secundaria ataca a un cloruro de sulfonilo y desplaza al ión cloruro para dar lugar a una amida. Las amidas de los ácidos sulfónicos se denominan sulfonamidas. Las sulfas son una clase de sufonamidas utilizadas como agentes antibacterianos. 39
40 Productos de oxidación de una amina Algunos estados de oxidación de las aminas y sus productos de oxidación. 40 Las aminas se pueden oxidar fácilmente con peróxido de hidrógeno o MCPBA. También se pueden oxidar mediante el aire.
41 Reacciones de aminas con ácido nitroso En una solución ácida, el ácido nitroso se puede protonar y perder agua para dar lugar al ión nitrosonio, + N=O. El ión nitrosonio parece ser el intermedio reactivo de la mayoría de las reacciones de las aminas con el ácido nitroso. El ión nitrosonio se estabiliza por medio de dos estructuras de resonancia. 41
42 FORMACIÓN DE SALES DE DIAZONIO Las aminas primarias reaccionan con ácido nitroso, vía ión nitrosonio, para formar cationes diazonio. Este procedimiento se denomina diazoación de una amina. La amina ataca al ión nitrosonio y formar una N-nitrosoamina. La transferencia de protones, seguida de protonación y la pérdida de agua dan lugar al catión diazonio. 42 La transferencia de un protón (tautomería) del nitrógeno al oxígeno forma un grupo hidroxilo y un segundo enlace N-N. La protonación del grupo hidroxilo, seguida de la pérdida de agua, da lugar al catión diazonio La transferencia de protones, seguida de protonación y la pérdida de agua dan lugar al catión diazonio.
43 Reacciones de las sales de diazonio aromáticas Las sales de arenodiazonio se forman por la diazotación de una amina aromática primaria. Las aminas aromáticas primarias se suelen preparar por nitración de un anillo aromático seguida de la reducción del grupo nitro hasta un grupo amino. Si después esta amina se somete a diazotación, para convertirla en la sal de diazonio, esta posición aromática está activada para ser transformada en una gran variedad de grupos funcionales 43 Una vez se haya formado el ión diazonio, se puede sustituir fácilmente por otros grupos funcionales.
44 Hidrólisis del grupo diazonio. La hidrólisis se produce cuando una solución de una sal de arenodiazonio se acidifica fuertemente (generalmente añadiendo H 2 SO 4 ) y se calienta. 44 El grupo hidroxilo del agua sustituye al N 2, originando un fenol.
45 REACCIÓN DE SANDMEYER Las sales de cobre (I) tienen una afinidad especial por las sales de diazonio. El cloruro, el bromuro o el cianuro de cobre (I) reaccionan con las sales de arenodiazonio para dar lugar a cloruros, bromuros o cianuros de arilo La reacción de Sandmeyer, cuando se utiliza cianuro de cobre (I), es un buen método para añadir otro sustituyente carbonado a un anillo aromático. 45
46 Síntesis de los fluoruros de arilo Cuando se trata una sal de arenodiazonio con ácido tetrafluorobórico (HBF 4 ), precipita el tetrafluoroborato de arenodiazonio. Si esta sal precipitada se filtra y, a continuación, se calienta, se descompone y se obtiene el fluoruro de arilo. 46 Las sales diazonio son explosivas, por lo que esta reacción tiene que llevarse a cabo con extremo cuidado.
47 Síntesis de los yoduros de arilo Los yoduros de arilo se obtienen tratando sales de arenodiazonio con yoduro de potasio. Éste es uno de los mejores métodos para obtener derivados de yodobenceno. 47
48 Desaminación de anilinas El ácido hipofosforoso (H 3 PO 2 ) reacciona con las sales de arenodiazonio, reemplazando el grupo diazonio por hidrógeno. 48 El grupo amino también se puede utilizar para activar el anillo y beneficiarse de su capacidad de direccionamiento.
49 Acoplamiento diazo: Copulación de sales de diazonio Los iones arenodiazonio actúan como electrófilos débiles en las sustituciones electrofílicas aromáticas. Los productos tienen la estructura Ar-N=N-Ar, conteniendo la unión azo -N=N-; por este motivo, a los productos se les denomina azocompuestos y a la reacción acoplamiento diazo. 49 La reacción necesita anillos fuertemente activados para reaccionar con la sal de arenodiazonio
Estructura del grupo carbonilo
 TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
LAS AMINAS. Se pueden considerar compuestos derivados del amoníaco (NH 3
 LAS AMIAS Se pueden considerar compuestos derivados del amoníaco ( 3 ) al sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o aromáticos. Según el número de hidrógenos que se substituyan
LAS AMIAS Se pueden considerar compuestos derivados del amoníaco ( 3 ) al sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o aromáticos. Según el número de hidrógenos que se substituyan
DERIVADOS HALOGENADOS. Estructura
 TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
Tema 17. AMINAS. Altramuz salvaje
 Tema 17. AMINAS Altramuz salvaje 2.- Principales familias de compuestos orgánicos: - Compuestos halogenados. - Hidrocarburos alifáticos: alcanos,, alquenos y alquinos. - Hidrocarburos aromáticos. - Alcoholes,
Tema 17. AMINAS Altramuz salvaje 2.- Principales familias de compuestos orgánicos: - Compuestos halogenados. - Hidrocarburos alifáticos: alcanos,, alquenos y alquinos. - Hidrocarburos aromáticos. - Alcoholes,
F FA AC C U ULTAD LTAD D D E
 FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
Conceptos basicos (III)
 erramientas de la Química rgánica erramientas de la Química rgánica ompuestos carbonílicos onceptos basicos (III) δ δ plano 120 º = polar sp 2 Z Z Z Z = ó Ar Z = ó Ar aldehídos cetonas María Font. Dpto.
erramientas de la Química rgánica erramientas de la Química rgánica ompuestos carbonílicos onceptos basicos (III) δ δ plano 120 º = polar sp 2 Z Z Z Z = ó Ar Z = ó Ar aldehídos cetonas María Font. Dpto.
Reacciones de Sustitución Electrofílica Aromática (S E Ar) Halogenación: Bromación y Cloración. Alquilación de Friedel-Crafts
 TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Estructura e las Aminas
 AMINAS Estructura e las Aminas Se pueden considerar a las aminas como compuestos nitrogenados derivados d del amoniaco (:NH3) en el que uno o más grupos alquilo o arilo están unidos al nitrógeno. El átomo
AMINAS Estructura e las Aminas Se pueden considerar a las aminas como compuestos nitrogenados derivados d del amoniaco (:NH3) en el que uno o más grupos alquilo o arilo están unidos al nitrógeno. El átomo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
Desconexión del cloruro de t-butilo
 Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres
Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres
Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno
 Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno Química orgánica I Químicos Escuela de vacaciones junio 2016 Licda. Jaqueline Carrera. Propiedades de los éteres
Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno Química orgánica I Químicos Escuela de vacaciones junio 2016 Licda. Jaqueline Carrera. Propiedades de los éteres
REACTIVIDAD DE LOS COMPUESTOS ORGÁNICOS
 REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
QUÍMICA. 2º Bachilerrato orgánica Estereoisomería:
 TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
Los enlaces C F son polares pero la geometría tetraédrica
 1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
Plan de Estudios Licenciatura en Química
 Plan de Estudios CONTENIDOS 1) Presentación 5) Objetivos 2) Requisitos 6) Cursos Obligatorios 3) Plan de Estudios / Duración 7) Cursos Sugeridos 4) Tabla de Créditos 1) Presentación Su programa de Licenciatura
Plan de Estudios CONTENIDOS 1) Presentación 5) Objetivos 2) Requisitos 6) Cursos Obligatorios 3) Plan de Estudios / Duración 7) Cursos Sugeridos 4) Tabla de Créditos 1) Presentación Su programa de Licenciatura
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA. 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué?
 REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
ORGÁNICA I. 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua.
 ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
Tema 9.- Aldehídos y cetonas. El grupo carbonilo
 Tema 9.- Aldehídos y cetonas El grupo carbonilo Los aldehídos y cetonas son las funciones que vamos a estudiar en este Tema, probablemente uno de los más importantes de la asignatura. Nomenclatura propanal
Tema 9.- Aldehídos y cetonas El grupo carbonilo Los aldehídos y cetonas son las funciones que vamos a estudiar en este Tema, probablemente uno de los más importantes de la asignatura. Nomenclatura propanal
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre Fase específica OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
Reacciones de reducción
 idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
MÓDULO A: ácido-base y espectroscópicas de los compuestos orgánicos
 MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos orgánicos MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos
MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos orgánicos MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos
Reacciones de Eliminación 26/06/2012
 Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Ácido carboxílico Halogenuro de ácido Anhídrido de ácido Ester Amida O O R SR' O - R O O -
 X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
ACIDOS Y BASES. QUÍMICA ORGÁNICA I (Q) Facultad de CC.QQ. y Farmacia USAC Segundo Semestre 2014
 ACIDOS Y BASES QUÍMICA ORGÁNICA I (Q) Facultad de CC.QQ. y Farmacia USAC Segundo Semestre 2014 Ácidos y Bases Los términos acido y base pueden tener diferente significado, dependiendo del contexto. La
ACIDOS Y BASES QUÍMICA ORGÁNICA I (Q) Facultad de CC.QQ. y Farmacia USAC Segundo Semestre 2014 Ácidos y Bases Los términos acido y base pueden tener diferente significado, dependiendo del contexto. La
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
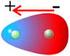 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
ESTRUCTURA DE LA MATERIA QCA 01 ANDALUCÍA. 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad.
 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA II NITO Y SULFOCOMPUESTOS: CAPITULO I: NITROCOMPUESTOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA II INTEGRANTES: Herrera Natalia Álvarez Santiago BIQUIMICA CLINICA QUIMICA NITO Y SULFOCOMPUESTOS: CAPITULO I: NITROCOMPUESTOS
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA II INTEGRANTES: Herrera Natalia Álvarez Santiago BIQUIMICA CLINICA QUIMICA NITO Y SULFOCOMPUESTOS: CAPITULO I: NITROCOMPUESTOS
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
Los principales grupos funcionales son los siguientes:
 GRUPOS FUNCIONALES Qué es un grupo funcional? Hemos visto que los hidrógenos de los hidrocarburos pueden ser sustituidos por átomos de otro metal o por un agrupamiento de átomos para obtener compuestos
GRUPOS FUNCIONALES Qué es un grupo funcional? Hemos visto que los hidrógenos de los hidrocarburos pueden ser sustituidos por átomos de otro metal o por un agrupamiento de átomos para obtener compuestos
QUÍMICA ORGÁNICA BÁSICA
 QUÍMICA ORGÁNICA BÁSICA 1. INTRODUCCIÓN: NATURALEZA DE LA QUÍMICA ORGÁNICA Panorama histórico y situación actual El carácter químico especial del carbono Fuentes y transformaciones de los compuestos orgánicos.
QUÍMICA ORGÁNICA BÁSICA 1. INTRODUCCIÓN: NATURALEZA DE LA QUÍMICA ORGÁNICA Panorama histórico y situación actual El carácter químico especial del carbono Fuentes y transformaciones de los compuestos orgánicos.
Tema 9. Química Orgánica
 Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 11. CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN
 PRACTICAS DE LABORATORIO QUIMICA 2010 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN I. INTRODUCCIÓN Los compuestos orgánicos que se presentan en la
PRACTICAS DE LABORATORIO QUIMICA 2010 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN I. INTRODUCCIÓN Los compuestos orgánicos que se presentan en la
N H H H 3 C CH 3. amoniaco. trimetilamina
 Química rgánica 1. Estructura de las aminas. omenclatura. Basicidad de las aminas. eacción de las aminas como nucleófilos. Síntesis controlada de aminas. Sales de amonio cuaternario: reacción de eliminación
Química rgánica 1. Estructura de las aminas. omenclatura. Basicidad de las aminas. eacción de las aminas como nucleófilos. Síntesis controlada de aminas. Sales de amonio cuaternario: reacción de eliminación
Ecuación de Hammett 1
 Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
Biopolímero s (4831)
 Biopolímero s (4831) 4.3. Conceptos de catálisis química. 4.3.3. Ejemplos de tipos de catálisis. Aplicación a la catálisis enzimática Los iones metálicos como catalizadores Como se dijo anteriormente los
Biopolímero s (4831) 4.3. Conceptos de catálisis química. 4.3.3. Ejemplos de tipos de catálisis. Aplicación a la catálisis enzimática Los iones metálicos como catalizadores Como se dijo anteriormente los
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II
 SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
Nomenclatura IUPAC. Ácido -oico. Ácido -carboxílico. Ácido butírico. Ácido acético. Ácido cólico Ácido oleico. ácido 3-bromociclohexanocarboxilico
 Ácido acético Ácido butírico Ácido cólico Ácido oleico omenclatura IUPAC Ácido -oico 3 1 2 ácido propanoico 5 4 3 1 2 ácido 4-metilpentanoico 2 1 3 5 7 6 8 4 ácido 3-etil-6-metiloctanodioico Ácido -carboxílico
Ácido acético Ácido butírico Ácido cólico Ácido oleico omenclatura IUPAC Ácido -oico 3 1 2 ácido propanoico 5 4 3 1 2 ácido 4-metilpentanoico 2 1 3 5 7 6 8 4 ácido 3-etil-6-metiloctanodioico Ácido -carboxílico
REACCIONES DE SÍNTESIS DE LOS ÁCIDOS CARBOXÍLICOS
 EAIES DE SÍTESIS DE LS ÁIDS ABXÍLIS 1.- xidación de los alcoholes primarios y aldehídos. En los temas anteriores ya se ha estudiado la oxidación de alcoholes primarios que mediante oxidantes fuertes se
EAIES DE SÍTESIS DE LS ÁIDS ABXÍLIS 1.- xidación de los alcoholes primarios y aldehídos. En los temas anteriores ya se ha estudiado la oxidación de alcoholes primarios que mediante oxidantes fuertes se
H 2 SO 4 + Cu CuSO 4 + SO 2 + H 2 O. SO H e - SO H 2 O. Cu Cu e - Cu Cu e - +
 1 Universidad de Castilla la Mancha Selectividad Junio 2.01 Opción A 1.- El ácido sulfúrico (tetraoxosulfato (VI) de hidrógeno) reacciona con el cobre para dar sulfato de cobre (II) (tetraoxosulfato (VI)
1 Universidad de Castilla la Mancha Selectividad Junio 2.01 Opción A 1.- El ácido sulfúrico (tetraoxosulfato (VI) de hidrógeno) reacciona con el cobre para dar sulfato de cobre (II) (tetraoxosulfato (VI)
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 015 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
Definición Bronsted-Lowry
 TEMA 4.- Acidos y bases. Propiedades ácido-base de los compuestos orgánicos. Grupos funcionales con carácter ácido. Grupos funcionales con carácter básico. Fuerza de los ácidos. Fuerza de las bases. Acidez
TEMA 4.- Acidos y bases. Propiedades ácido-base de los compuestos orgánicos. Grupos funcionales con carácter ácido. Grupos funcionales con carácter básico. Fuerza de los ácidos. Fuerza de las bases. Acidez
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Modelo Curso 2009-2010 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Modelo Curso 2009-2010 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
2ª Parte: Estructura y reactividad de
 2ª Parte: Estructura y reactividad de los compuestos CMPUESTS orgánicos. CARBNÍLICS 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos
2ª Parte: Estructura y reactividad de los compuestos CMPUESTS orgánicos. CARBNÍLICS 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos
Tema 12. PREPARACIÓN DE ALQUENOS
 Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS
 TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
Adición. Eliminación. Sustitución
 Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
Tema 5 Estructura de las aminas amoniaco trimetilamina
 Química rgánica 1. Estructura de las aminas. omenclatura. Basicidad de las aminas. eacción de las aminas como nucleófilos. Síntesis controlada de aminas. Sales de amonio cuaternario: reacción de eliminación
Química rgánica 1. Estructura de las aminas. omenclatura. Basicidad de las aminas. eacción de las aminas como nucleófilos. Síntesis controlada de aminas. Sales de amonio cuaternario: reacción de eliminación
Modelo Pregunta 1A a) b) Septiembre Pregunta A1.- a) b) c) d) Junio Pregunta 1A a) b) c) d) Solución. Modelo Pregunta 1B.
 Modelo 2014. Pregunta 1A.- Cuando una muestra de átomos del elemento con Z = 19 se irradia con luz ultravioleta, se produce la emisión de electrones, formándose iones con carga +1. a) Escriba la configuración
Modelo 2014. Pregunta 1A.- Cuando una muestra de átomos del elemento con Z = 19 se irradia con luz ultravioleta, se produce la emisión de electrones, formándose iones con carga +1. a) Escriba la configuración
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
SGUICEL009QM11-A16V1. Ácido base I: conceptos y teorías
 SGUICEL009QM11-A16V1 Ácido base I: conceptos y teorías Ítem Alternativa Habilidad 1 B Reconocimiento 2 A Comprensión 3 E Reconocimiento 4 E Comprensión 5 E ASE 6 E Comprensión 7 D Comprensión 8 E Comprensión
SGUICEL009QM11-A16V1 Ácido base I: conceptos y teorías Ítem Alternativa Habilidad 1 B Reconocimiento 2 A Comprensión 3 E Reconocimiento 4 E Comprensión 5 E ASE 6 E Comprensión 7 D Comprensión 8 E Comprensión
GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN
 GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN 1. REVISIÓN DE TABLA PERIÓDICA 1.1 Completa el siguiente cuadro. Configuración electrónica externa Bloque
GUIA DE ESTUDIO Nº 1 TABLA PERIÓDICA ENLACE QUÍMICO NÚMERO DE OXIDACIÓN - COMPUESTOS DE COORDINACIÓN 1. REVISIÓN DE TABLA PERIÓDICA 1.1 Completa el siguiente cuadro. Configuración electrónica externa Bloque
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
UNIDAD IV ALCOHOLES. Alcoholes: Usos, propiedades y aplicaciones. Pte. M. en C.Q. Macaria Hernández Chávez
 UNIDAD IV ALCOHOLES Alcoholes: Usos, propiedades y aplicaciones Pte. M. en C.Q. Macaria Hernández Chávez ALCOHOLES Introducción. La mayor parte de los alcoholes comunes, hasta con 11 ó 12 átomos de carbono,
UNIDAD IV ALCOHOLES Alcoholes: Usos, propiedades y aplicaciones Pte. M. en C.Q. Macaria Hernández Chávez ALCOHOLES Introducción. La mayor parte de los alcoholes comunes, hasta con 11 ó 12 átomos de carbono,
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace.
 EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
EL ENLACE QUÍMICO 1. El enlace químico. 2. Enlace intramolecular. 3. Enlace intermolecular. 4. Propiedades del enlace. Química 1º bachillerato El enlace químico 1 1. EL ENLACE QUÍMICO El enlace químico
TEMA 4. ESTRUCTURA DE LAS MOLÉCULAS ORGÁNICAS
 W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
ANDALUCÍA / JUNIO 2000 LOGSE / QUÍMICA / OPCIÓN A /EXAMEN COMPLETO OPCIÓN A
 OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
Capítulo- 14 ácidos carboxílicos, esteres, aminas y amidas 14.4 Aminas
 Capítulo- 14 ácidos carboxílicos, esteres, aminas y amidas 1 14.4 Aminas Aminas 2 Aminas Son compuestos derivados orgánicos del amoniaco, NH 3 contiene un atomo de N unido a uno o más grupos alquilo o
Capítulo- 14 ácidos carboxílicos, esteres, aminas y amidas 1 14.4 Aminas Aminas 2 Aminas Son compuestos derivados orgánicos del amoniaco, NH 3 contiene un atomo de N unido a uno o más grupos alquilo o
RESPUESTA Guía de ejercicios #5 Enlace químico
 Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
2x = x = M. 100 = α = % NOCl eq K C =
 1 Universidad de Castilla la Mancha Selectividad Septiembre.013 Opción A SEPTIEMBRE 013 1.- El cloruro de nitrosilo es un gas utilizado en la síntesis de productos farmacéuticos. Se descompone a altas
1 Universidad de Castilla la Mancha Selectividad Septiembre.013 Opción A SEPTIEMBRE 013 1.- El cloruro de nitrosilo es un gas utilizado en la síntesis de productos farmacéuticos. Se descompone a altas
TEMA 5. ESTRUCTURA Y PROPIEDADES MOLECULARES
 TEMA 5. ESTRUTURA Y PRPIEDADES MLEULARES 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la
TEMA 5. ESTRUTURA Y PRPIEDADES MLEULARES 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la
JUNIO FASE ESPECÍFICA. QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Disponemos de los pares redox (Fe 2+ /Fe) y (O 2 /H 2 O), con potenciales estándar de reducción 0,44 V y +1,23 V, respectivamente. Con ellos
JUNIO 2011. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Disponemos de los pares redox (Fe 2+ /Fe) y (O 2 /H 2 O), con potenciales estándar de reducción 0,44 V y +1,23 V, respectivamente. Con ellos
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES
 GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS.
 ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
TEMAS/SUBTEMAS OBJETIVOS ESPECÍFICOS HORAS ACTIVIDADES TAREAS MATERIAL BIBLIOGRAFÍA SOFTWARE. 14 McMURRY, 6a. ED EJERCICIOS DE NOMENCLATURA
 DEPARTAMENTO DE QUÍMICA PLAN DE MATERIA POR SEMESTRE MATERIA: QUÍMICA ORGÁNICA AVANZADA ACADEMIA: QUÍMICA ORGÁNICA CLAVE: QM415 CARGA HORARIA DE TEORÍA: 68 VALOR EN CRÉDITOS: 9 (NUEVE) CARGA HORARIA DE
DEPARTAMENTO DE QUÍMICA PLAN DE MATERIA POR SEMESTRE MATERIA: QUÍMICA ORGÁNICA AVANZADA ACADEMIA: QUÍMICA ORGÁNICA CLAVE: QM415 CARGA HORARIA DE TEORÍA: 68 VALOR EN CRÉDITOS: 9 (NUEVE) CARGA HORARIA DE
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Carrera: Ingeniero Químico Asignatura: Química Orgánica II. 781114 Licenciatura Ingeniero Químico. 3 (h/sem)
 Carrera: Ingeniero Químico Asignatura: Química Orgánica II Ciencias Básicas Generales de la Asignatura: Nombre de la Asignatura: Clave Asignatura: Nivel: Carrera: Frecuencia (h/semana): Teoría: Laboratorio:
Carrera: Ingeniero Químico Asignatura: Química Orgánica II Ciencias Básicas Generales de la Asignatura: Nombre de la Asignatura: Clave Asignatura: Nivel: Carrera: Frecuencia (h/semana): Teoría: Laboratorio:
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13
 CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
CONTENIDO T1 EL ÁTOMO Y EL SISTEMA PERIÓDICO...3 T2 EL ENLACE QUÍMICO...7 T3 FORMULACIÓN Y NOMENCLATURA INORGÁNICA...13 T4 REACCIONES QUÍMICAS: Cálculos, Energías y Velocidades...19 T5 ESTUDIO DEL MOVIMIENTO...25
CONFERENCIA No. 1 Página 1 de 4. DE: Septiembre 7 del 2015 A : Septiembre 25 del 2015
 CONFERENCIA No. 1 Página 1 de 4 ÁREA: TEMA: PROFESOR: TIEMPO DE REALIZACIÓN: CIENCIAS NATURALES Y EDUCACIÓN GRADO: DÉCIMO AMBIENTAL - QUÍMICA Nomenclatura y reacciones de obtención de óxido, ácidos, bases
CONFERENCIA No. 1 Página 1 de 4 ÁREA: TEMA: PROFESOR: TIEMPO DE REALIZACIÓN: CIENCIAS NATURALES Y EDUCACIÓN GRADO: DÉCIMO AMBIENTAL - QUÍMICA Nomenclatura y reacciones de obtención de óxido, ácidos, bases
Quimica orgánica básica
 Quimica orgánica básica Química orgánica básica La química orgánica es el estudio de los compuestos de carbono. Los átomos de carbono son únicos en su habilidad de formar cadenas muy estables y anillos,
Quimica orgánica básica Química orgánica básica La química orgánica es el estudio de los compuestos de carbono. Los átomos de carbono son únicos en su habilidad de formar cadenas muy estables y anillos,
Tema 14. ALQUINOS. 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos.
 Tema 14. ALQUINOS 2.- Principales familias de compuestos orgánicos: - idrocarburos alifáticos: alcanos, alquenos y alquinos. - idrocarburos aromáticos. - Aminas. -Compuestos halogenados. - Compuestos carbonílicos.
Tema 14. ALQUINOS 2.- Principales familias de compuestos orgánicos: - idrocarburos alifáticos: alcanos, alquenos y alquinos. - idrocarburos aromáticos. - Aminas. -Compuestos halogenados. - Compuestos carbonílicos.
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
TEMA 5 ESTRUCTURA Y PROPIEDADES MOLECULARES
 TEMA 5 ETRUCTURA Y PRPIEDADE MLECULARE 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la estructura
TEMA 5 ETRUCTURA Y PRPIEDADE MLECULARE 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la estructura
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO.
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 010-011 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN La
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 010-011 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN La
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD
 TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO EL ENLACE QUÍMICO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
UNIVERSDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA III. Integrante: Fecha de entrega: 26/06/2011 Giselle Velasco
 UNIVERSDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA III Integrante: Fecha de entrega: 6/06/011 Giselle Velasco Carrera: Quimica Pura. Trabajo # Tema: Acidez de los Acidos Carboxílicos
UNIVERSDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA III Integrante: Fecha de entrega: 6/06/011 Giselle Velasco Carrera: Quimica Pura. Trabajo # Tema: Acidez de los Acidos Carboxílicos
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
1. Los elementos químicos
 RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
REACCIONES DE TRANSFERENCIA DE PROTONES
 QUÍMICA 2º BACHILLERATO EJERCICIOS PAU REACCIONES DE TRANSFERENCIA DE PROTONES 1. PAU-16M A. Un vinagre que contiene un 5 % en masa de ácido acético tiene un ph de 2,4. Calcule: a) La concentración molar
QUÍMICA 2º BACHILLERATO EJERCICIOS PAU REACCIONES DE TRANSFERENCIA DE PROTONES 1. PAU-16M A. Un vinagre que contiene un 5 % en masa de ácido acético tiene un ph de 2,4. Calcule: a) La concentración molar
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Tema 7 CO 2. PCl 5. Los enlaces múltiples se tratan como los sencillos en RPECV 1 enlace doble 1 enlace simple 109,5º.
 Tema 7: El Enlace Químico (III): moléculas poliatómicas 7.1 Geometría molecular: teoría RPEV (AJ3.1-3, P12, W8, 10) 7.2 Orbitales híbridos (AJ3.5-7) 7.3 Orbitales moleculares deslocalizados: compuestos
Tema 7: El Enlace Químico (III): moléculas poliatómicas 7.1 Geometría molecular: teoría RPEV (AJ3.1-3, P12, W8, 10) 7.2 Orbitales híbridos (AJ3.5-7) 7.3 Orbitales moleculares deslocalizados: compuestos
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO
 PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
Tema 4. Propiedades generales. Propiedades generales de los elementos no metálicos. Propiedades generales de los óxidos y de los haluros a lo largo
 Tema 4. Propiedades generales. Propiedades generales de los elementos no metálicos. Propiedades generales de los óxidos y de los haluros a lo largo del sistema periódico. Variación del carácter iónicocovalente.
Tema 4. Propiedades generales. Propiedades generales de los elementos no metálicos. Propiedades generales de los óxidos y de los haluros a lo largo del sistema periódico. Variación del carácter iónicocovalente.
ALCOHOLES. Estructura: grupo
 TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES
 TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
QUÍMICA // 2º BACHILLERATO.
 QUÍMICA // 2º BACHILLERATO. FORMULACIÓN Y NOMENCLATURA QUÍMICA ORGANICA. TEMA 2 TEMARIO QUÍMICA.. I.E.S. FERNANDO DE LOS RÍOS (QUINTANAR DEL REY) Temario Química. Tema 2. 2 Índice de Contenido. 1. INTRODUCCIÓN....
QUÍMICA // 2º BACHILLERATO. FORMULACIÓN Y NOMENCLATURA QUÍMICA ORGANICA. TEMA 2 TEMARIO QUÍMICA.. I.E.S. FERNANDO DE LOS RÍOS (QUINTANAR DEL REY) Temario Química. Tema 2. 2 Índice de Contenido. 1. INTRODUCCIÓN....
