CAPÍTULO OCHO. Cicatrización de la Herida Restauración Cutánea Láser
|
|
|
- Esther Salas Gallego
- hace 6 años
- Vistas:
Transcripción
1 CAPÍTULO OCHO Hilario Robledo M.D., Ph.D. Cicatrización de la Herida Restauración Cutánea Láser Edición 2016 para los profesionales médicos Dr. Hilario Robledo. -
2 Cicatrización de la Herida 1 CAPÍTULO OCHO Dr. Hilario Robledo Cicatrización de la Herida y Cuidado Postoperatorio: Restauración Cutánea Láser La restauración cutánea láser, tanto la de superficie total como la parcial (fraccional, también llamada restauración cutánea ablativa fraccional producida mediante fototermólisis fraccional), generan una herida de grosor parcial que cicatriza por segunda intención. Los principios de la cicatrización de la herida producida por un láser quirúrgico son muy parecidos a los principios de cicatrización de las heridas de profundidad media producidos por agentes químicos o por la dermabrasión. A diferencia con la dermabrasión en la que hay muy poco tejido necrótico en la herida y la cicatrización comienza rápidamente, la ablación por agentes químicos y el láser crean una zona de necrosis (una química y la otra láser) que la separa del tejido de coagulación cicatricial. Es necsario el cuidado meticuloso de la herida para impedir que el coágulo interfiera con la cicatrización y se convierta en un foco de infección, reacción a cuerpo extraño o un retraso en la cicatrización. Con frecuencia se intercambian los términos de cicatrización de herida y el de reparación de herida, pero son entidades muy diferentes en cuanto al suceso de acontecimientos y de resultados. La cictarización de la herida es un término que debería ser utilizado técnicamente sólo en el contexto de regeneración, cuando la arquitectura original y la estructura de un órgano o de una parte anatómica se restauran completamente al estado en que estaban antes de la lesión. Los animales más primitivos, como los pequeños anfibios y reptiles son capaces todavía de este tipo de regeneración. Sin embargo, cuando los animales llegaron a ser evolutivamente mayores y más complejos, no fue posible este tipo de regeneración. En los humanos adultos, con la posible excepción del hígado, no sucede una verdadera regeneración. Más bien, los humanos y otros vertebrados, cicatrizan por un proceso de reparación, mediante el cual el resultado eventual no es el de la restauración anatómica sino el de un compromiso funcional. Teleológicamente y desde un punto de vista evolucionario, el proceso de reparación para los animales de la escala evolutiva más alta necesita ser rápido para permitir una supervivencia inmediata del organismo. Como se detallará posteriormente, este tipo de reparación se caracteriza por una cantidad sustancial de cicatrización y fibrosis. Otra consideración es que la mayoría de los mecanismos en la reparación de la herida que han evolucionado apuntan en la dirección de la herida aguda del tejido. Desde un punto de vista evolucionista, no se supuso que los humanos desarrollasen enfermedades degenerativas de larga evolución como para dar lugar a úlceras arteriales, venosas y de decúbito o úlceras de origen neuropático por diabetes mellitus. Por lo tanto, los humanos no están lo suficientemente preparados para ese tipo de heridas crónicas y no hay mecanismos específicos que se hayan desarrollado para tratar con ellas de un modo eficaz. Existen tres fases reconocidas que caracterizan el proceso de reparación cutánea: la fase Dr. Hilario Robledo
3 Cicatrización de la Herida 2 inflamatoria, la fase proliferativa o migratoria (formación tisular) y la fase de remodelación (figura 8-1), se discutirá cada fase individualmente y se identificarán los componentes y los sucesos principales que caracterizan a cada una de ellas. No obstante, se debe resaltar que la clasificación del proceso total de la reparación de la herida en estas tres fases es algo artificial debido a que se superponen unas con otras. Fase Inflamatoria (Fase I) La primera fase, inflamatoria, comienza inmediatamente después de una lesión aguda. La disrrupción de los vasos sanguíneos produce la liberación local de céluas sanguíneas y otros elementos que dan lugar a la formación del coágulo. Mientras que el coágulo en el interior de los vasos proporciona hemostasia, el coágulo dentro del sitio de la lesión actúa como una matriz provisional para la migración celular. La fase inflamatoria está dominada por las plaquetas que dirigen la coagulación de la herida por las vías de la coagulación intrínseca y extrínseca. Las plaquetas también liberan varios factores quimiotácticos que atraen a otras plaquetas, leucocitos y fibribastos al lugar de la herida. La fase inflamatoria continúa cuando los lecucocitos, específicamente los neutrófilos y los macrófagos, entran en escena. Su papel inicial es desbridar la herida fagocitando las bacterias y los detritus celulares. Sin embargo, debe resaltarse que los neutrófilos y los macrófagos también liberan factores de crecimiento y otros mediadores importantes durante este periodo de tiempo. Esta primera fase puede entenderse mejor si se subdivide en los siguientes componentes: 1. Liberación de plaquetas y agregación, 2. Proceso de coagulación e inflamación y 3. Figura 8-1. Representación esquemática de las diferentes fases de la reparación de la herida con todas las células y sucesos involucrados en diferentes puntos en el tiempo: ECM, matriz extracelular, MMP, matriz metaloproteinasa. Dr. Hilario Robledo
4 Cicatrización de la Herida 3 Agregación leucocitaria. Liberación de Plaquetas y Agregación Las plaqetas son componentes esenciales en el proceso de reparación y son críticas para lograr una hemostasia eficaz. La lesión tisular origina daño de los vasos sanguíneos, liberación de plaquetas y activación de la coagulación. Las plaquetas primero se adhieren al tejido conectivo intersticial y posteriormente se agregan. Las plaquetas en el lugar de la lesión están expuestas a la trombina y al colágeno fibrilar, que desencadenan su activación, adhesión y agregación. Durante la agregación, las plaquetas liberan muchos mediadores, incluyendo la adenosina difosfato (ADP) y también varios factores de la coagulación rápidos en su superficie celular. El proceso de coagulación se facilita mucho por estos productos plaquetarios que, por su parte, conducen a una activación plaquetaria adicional. Además del ADP, los mediadores liberados por los gránulos alfa de las plaquetas activadas incluyen varias proteínas adhesivas, como el fibrinógeno, fibronectina, tromboplastina y factor VIII de von Willebrand. El fibrinógeno, fibronectina y la tromboplastina sirven como enlace para la agregación plaquetaria, mientras que el factor VIII de von Willebrand facilita la adhesión plaquetaria al colágeno fibrilar. Estas actividades resultan en la formación del coágulo plaquetario. La polimerización de la trombina del fibrinógeno produce fibrina, que amplifica el coágulo y formará parte de la matriz extracelular provisional que será necesaria para la migración de las células en la herida. Debe subrayarse que ninguna actuación celular única en cualquier estadío produce la cicatrización de la herida. Por ejemplo, en esta fase dominada por las plaquetas, las células endoteliales producen varios factores que limitan la agregación plaquetaria y la formación del coágulo en el área de la lesión. Entre estas actividades están la inhibición de la agregación plaquetaria (por prostaciclina), la inhibición de la actividad de la trombina (por la proteína C 3 ) y la inhibición de la lisis del coágulo mediante la conversión de plasminógeno en plasmina por el activador del plasminógeno. En adición de estos papeles críticos en la formación del coágulo y de la fase inflamatoria de la reparación de la herida, las plaquetas también liberan un número de factores de crecimiento y citoquinas. Estos factores participan en la fase inflamatoria inicial, pero igualmente importante, también sirven como señales para la migración de ciertas células críticas al lugar de la herida. Entre estos factores de crecimiento están el factor de crecimiento derivado de las plaquetas (PDGF), el factor de crecimiento transformante ß 1 (TGF-ß 1 ), el factor plaquetario 4, el péptido activador del tejido conectivo (CTAP-III), la tromboglobulina-beta y el péptido activador neutrofílico 2 (NAP-2). Debe resaltarse que las plaquetas son el sitio de almacenamiento del TGF-ß 1, uno de los tres TGF-ß isomorfos, que juegan un papel crítico en la reparación de la herida. Proceso de Coagulación y de Inflamación Durante el proceso de coagulación, el plasma y otros elementos sanguíneos salen de los vasos dañados y contribuyen a la formación de un trombo por las vías intrínseca y extrínseca. La vía intrínseca se inicia cuando la sangre se expone al tejido subendotelial, un suceso que origina la activación del factor X. Contrariamente, la vía extrínseca se incia cuando la trom- Dr. Hilario Robledo
5 Cicatrización de la Herida 4 boplastina activa el factor VII. Las dos vías, extrínseca e intrínseca, conducen a la formación de trombina que estimula a los fibrinopéptidos A y B al igual que a otros fragmentos del fibrinógeno que por último conduce a la polimerización del fibrinógeno en fibrina. Sin embargo, la estabilidad de la fibrina y en efecto de su actividad biológica son muy dependientes de sus enlaces, que suceden por la acción del factor VIII. La coagulación sanguínea finaliza cuando se resuelven los diferentes estímulos que inician la cascada de la coagulación. No obstante, también hay procesos activos en su lugar que subregulan la cascada de la coagulación. Entre ellos están la inhibición de la agregación plaquetaria por la prostaciclina, inhibición de la actividad de la trombina cuando esta molécula se une a la antitrombina III, la acción de la proteína C y el factor anticoagulante que degrada los factores V y VIII. Dr. Hilario Robledo
6 Cicatrización de la Herida 5 La migración de las células clave al lugar de la lesión, como los queratinocitos, fibroblastos, células endoteliales y monocitos, se estimula mediante sus receptores para varios componentes del trombo. Sin embargo, se produce un estímulo de otros mediadores y juega un papel importante en la amplificación de la fase inflamatoria/coagulación. Por ejemplo, la formación de bradiquinina al igual que el C3a y C5a se estimulan por el factor de Hageman activado. El resultado final de la acción de estos y otros mediadores es aumentar la permeabilidad vascular, agregación de neutrófilos y monocitos y la liberación de factores por los mastocitos. La división del fibrinógeno, como se ha mencionado, produce un número de fragmentos activos, como los fibrinopéptidos, que son importantes en la estimulación de la migración de ciertas células al lugar de la herida, incluyendo a los fibroblastos. Agregación de Leucocitos Hay una cascada constante de moléculas inflamatorias y de agregación de células de la inflamación durate las fases iniciales de la cicatrización de la herida. Los neutrófilos y los monocitos llegan al lugar de la herida al mismo tiempo. Inicialmente, los neutrófilos están presentes en mayor número debido a que constituyen la mayor fracción de las células blancas periféricas. Ambos, los neutrófilos y los monocitos son atraídos a la herida por factores quimiotácticos como la calicreína, fibrinopéptidos liberados por el fibrinógeno y productos de la degradación de la fibrina. No obstante, la lista de reactantes y de agentes quimiotácticos es larga. En adición a los factores de crecimiento liberados por las plaquetas y os fragmentos resultantes de de la polimeración y de los enlaces del fibrinógeno, hay otros paraproductos de la proteólisis y otros componentes de la matriz, al igual que péptidos formil metionil liberados de las proteínas bacterianas. Estos y otros factores quimiotácticos estimulan también la expresión del complejo CD11/CD18 en la superficie de los neutrófilos, aumentando de esta forma la adherencia de los neutrófilos al endotelio de los vasos sanguíneos y facilitando su diapedesis entre las células endoteliales adyacentes. Es importante entender que para entrar en la herida, los leucocitos deben salir de la circulación, un proceso que está altamente regulado por los cambios moleculares en la superficie de las células endoteliales en los vasos sanguíneos dentro y adyacentes a la herida. Esta interacción leucocito-endotelial proporciona el medio para seleccionar los tipos de leucocitos que entran en el lugar de la lesión. Como una respuesta a la herida, las células endoteliales liberan selectinas, que por sus propiedades adhesivas originan una circulación lenta de los leucocitos siendo arrastrados por la sangre. Probablemente, ambas, las selectinas E y P son necesarias para la agregación total de los neutrófilos y de los macrófagos. Una vez que estas adhesiones más débiles hacen la circulación de los leucocitos más lenta, las adhesiones más estrechas proporcionadas por las integrinas ß 2 hacen que los leucocitos negocien el espacio entre células endoteliales y alcancen la herida. Los neutrófilos son importantes en el desbridamiento tisular y en la muerte de las bacterias, sucesos que producen además productos de activación del complemento con propiedades inflamatorias y quimiotácticas. Nuevas evidencias sugieren que los neutrófilos son también una fuente rica de citoquinas, tales como las moléculas PDGF-like. El factor de crecimiento del tejido conectivo (CTGF) es uno de dichos péptidos. La acción de los neutrófilos está aumentada por las integrinas, receptores de la superficie celular que facilitan las interacciones célulo-matriciales. Sin embargo, los neutrófilos no parecen ser absolutamente críticos para la reparación de la herida, ya que la neutropenia por sí misma no interfiere con el proceso de cicatrización. De forma similar, los cerdos de guinea deplecionados de neutrófilos son capaces de cicatrizar Dr. Hilario Robledo
7 Cicatrización de la Herida 6 normalmente. Ya que el proceso inflamatorio continúa, dentro de las 24 a las 48 horas después de la herida, los monocitos reemplazan a los neutrófilos y llegan a ser los leucocitos predominantes. Los monocitos son atraídos a la herida por alguno de los mismos quimioatrayentes responsables de la agregación de los neutrófilos, como la calicreína, fibrinopéptidos y productos de la degradación de la fibrina. Otros quimioatrayentes más específicos entonces asumen la agregación de los monocitos e incluyen fragmentos del colágeno, fibronectina, elastina y TGF-ß 1. Los monocitos sufren un cambio fenotípico a macrófagos tisulares y a diferencia de los neutrófilos, son críticos para la progresión de la cicatrización de la herida. Los macrófagos fagocitan, matan bacterias y remueven el detritus tisular. También liberan varios factores del crecimiento, incluyendo PDGF, factor de crecimiento del fibroblasto (FGP), TGF-ß y TGF-a, por lo que estimulan la migración y la proliferación de fibroblastos. al igual que la producción y modulación de la matriz extracelular. Se ha afirmado durante mucho tiempo que el macrófago es la célula central y crítica para la reparación de la herida. La base para esta aseveración son los estudios experimentales en los que los animales deplecionados de macrófagos por la utilización de suero antimacrófago y esteroides no cicatrizan apropiadamente. Sin embargo, es importante considerar que lo que puede retrasar o empeorar la cicatrización no es tanto la presencia o ausencia de inflamación y ciertas células, sino más bien una respuesta inflamatoria inapropiada. Por el contrario, experimentos en ratones en los que se estimula la producción de la citoquina quimiotáctica IP-10 muestra que un infiltrado inflamatorio intenso puede empeorar la neovascularización y la formación de un tejido de granulación apropiado. Por lo tanto, el verdadero papel de la inflamación en la reparación tisular permanece algo controvérsico desde un punto de vista experimental. Desde un punto de vista clínico, puede hacerse la observación que en ciertas heridas cutáneas, como en el pénfigo o en el pioderma gangrenoso, la subregulación de la inflamación con la utilización de glucocorticoides es generalmente de ayuda. Posiblemente la modulación y la corrección de la respuesta inflamatoria mediante glucocorticoides puede ser útil en estas entidades clínicas seleccionadas. Dr. Hilario Robledo
8 Cicatrización de la Herida 7 Unos pocos días después de la lesión tisular, los neutrófilos restantes son fagocitados por los macrófagos tisulares y llega a su fin la primera fase de la cicatrización de la herida, mientras que se pone en marcha la segunda fase de proliferación y formación de tejido. Fase de Proliferación y Formación Tisular (Fase II) La primera fase de la reparación de herida hace el trabajo preliminar para la segunda fase más formativa de proliferación y formación de tejido (Figura 8-5). El término de formación tisular, mejor que el de proliferación, es el más apropiado. En esta fase de la reparación de la herida se trata con ambos procesos, el de la proliferación y el de la migración celular que están apoyados por una serie de sucesos como el de la hipoxia, al igual que el de la adhesión específica de las proteínas y de los componentes extracelulares de Figura 8-5. Diagrama esquemático representando el bode epidérmico de una herida cicatrizando normalmente (izquierda) y de una herida que no cicatriza (derecha). La herida que cicatriza muestra separación de la lámina basal subyacente y una lengüeta epitelial gruesa. La herida crónica muestra la típica epidermis acantótica. La parte de fondo de la figura muestra los sucesos de acontecimientos en la dermis durante la reparación. Dr. Hilario Robledo
9 Cicatrización de la Herida 8 la matriz. La agregación plaquetaria y liberación, el proceso inflamatorio inicial y la entrada en la heriada de los neutrófilos y subsecuentemente monocitos-macrófagos, han proporcionado un número de funciones que permiten y facilitan ahora la proliferación de células residentes claves, como los fibroblastos, la migración de células endoteliales, el proceso de neovascularización y la migración de queratinocitos. Los queratinocitos sufren un cambio notable en cuanto a su morfología y función, migran al lecho de la herida, liberan un número de proteínas y enzimas que facilita la migración y otras funciones celulares y por último reconstruyen la epidermis dañada y la membrana basal. En los últimos estadios de la segunda fase de reparación de la herida se caracteriza por la formación de tejido de granulación, la reconstitución de la matriz dérmica (fibroplasia) y el desarrollo de nuevos vasos sanguíneos (angiogénesis) (Figuras 8-5 y 8-6). Los fibroblastos y las células endoteliales experimentan una activación, alteración fenotípica y una migración muy parecida a la de los queratinocitos. Otro componente crítico de fondo es la hipoxia que empieza inmedia-tamente después de la lesión y ruptura de los vasos sanguíneos cuyos efectos tienen un impacto profundo en la migración y en la proliferación de fibroblastos al igual que en las células endoteliales y posiblemente en la migración de los queratinocitos. En el contexto de esta segunda fase de la reparación de la herida, se discutirán los siguientes componentes y sucesos: 1. hipoxia, 2. fibroplasia, 3. angiogénesis, 4. migración de los queratinocitos, 5. producción de la matriz extracelular y 6. el papel de las integrinas. Hipoxia Inmediatamente después de la lesión aguda, la herida llega a estar temporalmente hipóxica debido a la ruptura de los vasos sanguíneos. Existe alguna confusión en cuanto al papel de la hipoxia en la reparación de la herida, posiblemente por dos razones. La primera y la principal es que se considera equivalente erróneamente a la isquemia. En la isquemia el flujo sanguíneo y la entrega de oxígeno están deteriorados. Sin embargo, la hipoxia en sí misma, sin una disminución significante en el flujo sanguíneo, puede tener diferentes consecuencias biológicas. La segunda razón por la que se tiene una idea errónea sobre la hipoxia es que las heridas crónicas a menudo se tratan con oxígeno hiperbárico. Si este tipo de tratamiento es beneficioso o no está fuera del ámbito de esta discusión. No obstante, el hecho por el que algunos médicos lo emplean para tratar heridas difíciles de curar es que una tensión baja de oxígeno es siempre indeseable. Dr. Hilario Robledo
10 Cicatrización de la Herida 9 A pesar de eso, desde un punto de vista fisiológico, hay pruebas de que una tensión baja de oxígeno de hecho juega un papel estimulador importante en el proceso de reparación tisular inicial. Existen pruebas evidenciales que señalan a la tensión baja de oxígeno como un estímulo inicial importante para la activación de los fibroblastos y de las células endoteliales. La replicación y la longevidad de los fibroblastos están aumentadas en la hipoxia e igualmente una tensión baja de oxígeno estimula la expansión clonal de los fibroblastos dérmicos como células únicas. Además, se aumenta la síntesis de varios factores del crecimiento en las células hipóxicas. Los macrófagos segregan una sustancia angiogénica solamente cuando están expuestos a una tension baja de oxígeno. Este efecto reversible se observó cuando la presión de oxígeno era de mmhg. La transcripción de TGF-ß1 y síntesis de péptido están aumentados en los cultivos de fibroblastos humanos dérmicos cuando se exponen a un nivel similar de hipoxia. Además, la hipoxia regula la síntesis de endotelina-1, PDGF cadena B y VEGF en la células endoteliales. Parece, que al menos en algunos casos, el efecto de las condiciones hipóxicas está mediado por el factor inducible hipóxico 1 (HIF-1), un enlace complejo del DNA muestra que al menos contiene dos hélices-giro-hélices básicas de proteínas PAS dominantes. En un ambiente totalmente anaeróbico (anoxia), el procolágeno sintetizado está subhidroxilado y se acumula intracelularmente. Así, en los estudios donde los fibroblastos fueron expuestos a una anoxia temporal absoluta (90 minutos) seguida por reexposición a oxígeno atmosférico a 37 ºC, aproximadamente el 15% del procolágeno secretado estaba subhidroxilado. Mientras que la hipoxia aumenta los niveles de mrna, puede ser necesaria la reoxigenación para la secreción de un producto funcional final. Hay, por supuesto, una probablidad alta de que los períodos de reoxigenación sean comunes en las heridas. Como los radicales de oxígeno formados durante la reoxigenación afecta a la síntesis de colágeno no se conoce todavía. Estas especies de oxígeno altamente reactivas incluyen al anión superóxido, peróxido de hidrógeno y al radical hidroxil. Sin embargo, se ha mostrado que la interleuquina 1a (IL-1a) y la IL-6 están aumentadas en las células endoteliales expuestas a un ciclo de hipoxia/reoxigenación. Interesantemente, la dismutasa y la glutatión peroxidasa impidieron el aumento de la IL-1 y de la IL-6, sugiriendo que juegan un papel en el oxígeno derivado de los radicales libres en la síntesis de citoquinas. Dr. Hilario Robledo
11 Cicatrización de la Herida 10 Fibroplasia Durante el proceso de reepitelización, en la herida también hay fibroplasia y angiogénesis. La fibroplasia se refiere a la formación de tejido de granulación y reconstitución de la matriz dérmica. La célula clave en este aspecto de la reparación de la herida es el fibroblasto. Generalmente se acepta que el fibroblasto migra a la herida, produce grandes cantidades de colágeno, proteoglicanes, elastina y otras proteínas matriciales y participa en la contracción de la herida. Los fibroblastos, como los queratinocitos, sufren cambios fenotípicos que modifican sus interacciones con la matriz extracelular, mostrando que realizan un número de funciones. Hay evidencias de la existencia de subpoblaciones de fibroblastos, siendo cada subpoblación responsable de un aspecto diferente de la cicatrización. Por ejemplo, la clonación de las poblaciones de fibroblastos a ciertas señales, incluyendo a los factores de crecimiento, es bastante heterogénea. Debido a que los fibroblastos y otras células mesenquimales y epiteliales no tienen unos marcadores fácilmnente definibles, como los linfocitos, no se comprende esta heterogeneidad en las subpoblaciones de fibroblastos. No obstante en los próximos años es probable que se logren mejoras en las técnicas disponibles para identificar a las células mesenquimales y epiteliales del mismo linaje. Poco después de la herida, la formación del coágulo, proporciona una matriz inicial apropiada para la migración celular. La fibrina y la fibroconectina, componentes de este coágulo, actúan como la matriz provisional para la migración fibroblástica. La conducta de los fibroblastos está íntimamente ligada al PDGF, un péptido al cual son expuestos inmediatamente después de la herida. Debe conocerse que los fibroblastos en la piel no herida están rodeados por una matriz rica en colágeno, son biosintéticamente inactivos y expresan altos niveles del colágeno integrina receptor a 2. Esto cambia de una forma dramática cuando los fibroblastos llegan a la matriz provisional y están expuestos a varios péptidos altamente activos, incluyendo al PDGF. Los fibroblastos en el ambiente de la fibrina-fibroconectina de la matriz provisional que están expuestos al PDGF, supraregulan las subunidades de integrina a 3 y a 5. La gelsolina, proteína globular, encontrada en los macrófagos y amebas, que impide la polimerización de los filamentos de actina, convirtiendo el citoplasma celular de estado gel a estado sol y, por tanto, haciendo más fluido el citoplasma celular, puede ser crítica al movimiento subsecuente relacionado a la actinomiosina durante la migración fibroblástica. Estas integrinas facilitan la migración de los fibroblastos en el lecho de la herida, donde los fibroblastos puedens ser influenciados por otros factores del crecimiento y citoquinas para proliferar o sufrir más cambios fenotípicos. Por último, como la herida cicatriza, el nuevo colágeno rico en matriz extracelular producirá una subregulación de las integrinas fibrobásticas a 3 y a 5 mientras que incrementan los niveles de la a 2. Otros factores son influyentes en la regulación de fibroblastos en la migración de la herida. La gelsolina tiene un efecto de disminución de Rac, una molécula GTPasa que es inactivada por el PDGF. Como esto atrae a los monocitos y a los neutrófilo al área de la herida. El TGF-ß1 también ha sido involucrado como un importante quimioatrayente de los fibroblastos. Como se ha afirmado anteriormente, el TGF-ß1 subregula la expresión de las integrinas a 5 ß 1 y a v ß 3 de la matriz provisional. Sin embargo, hay otros mecanismos por los cuales el TGF-ß1 puede afectar a la locomoción. Se ha mostrado que la producción de hialuronan (HA) y RHAMM un receptor de la superficie celular del HA, está aumentado por el TGF-ß1 y es necesario para la locomoción de las células tumorales. Otro receptor HA, el CD44, tiene unas funciones ligeramente diferentes a las del receptor RHAMM, ya que media finalmente en el movimiento de los fibroblastos en los sustratos Dr. Hilario Robledo
12 Cicatrización de la Herida 11 HA. Los fibroblastos en las cicatrices hipertróficas tienen grandes cantidades de CD44 y una internalización disminuida de CD44 en presencia de HA. Los fibroblastos comienzan a migrar a la herida 48 horas después de producirse la misma. Se mueven a lo largo de la matriz de ficrina-fibroconectina depositada en el coágulo inicial y producen fibroconectina que facilita más su movimiento. Otros componentes de la matriz extracelular, como las tenascina (una glicoproteína hexamérica de la matriz extracelular) son señales adicionales para la adhesión y movimiento de los fibroblastos. El tetrapéptido Arg-Gly- Asp-Ser (RGDS) que es común para estas y otras proteínas matriciales extracelulares, es importante para la unión de estas moléculas a los receptores de integrinas de la superficie celular. Los fibroblastos producen otros componentes matriciales extracelulares, que incluyen al colágeno tipo I y III, elastina, glucosaminoglicanes y proteoglicanes. El colágeno tipo III, que está presente en grandes cantidades en la dermis fetal pero no en la dermis del adulto, es el tipo de colágeno predominante en las fases iniciales de la reparación de la herida. La síntesis de colágeno tipo III es máxima a los 5-7 días después de la lesión. El TGF-ß ha mostrado estimular la producción fibroblástica de colágeno de los tipo I y III in vitro e in vivo. Existen evidencias de que los fibroblastos se clonan a un fenotipo con una mayor síntesis de colágeno durante los estadios iniciales de la reparación de la herida. Según se forma el nuevo tejido conectivo, algunos fibroblastos sufren un cambio fenotípico mayor a miofibroblastos ricos en actina. Estas células muestran algunas de las características de los fibroblastos y de las células musculares lisas. Contienen una red extensa de retículos endoplásmicos primitivos, que supuestamente se necesitan para producir grandes cantidades de proteínas matriciales. Los miofibroblastos son los mayores responsables de la contracción de la herida y están presentes de forma muy notable en el tejido de granulación. A diferencia de otras células involucradas en el proceso de la reparación de la herida, los miofibroblastos se disponen en formaciones organizadas a lo largo de las líneas de contracción. La exposición a varios mediadores, incluyendo la angiotensina, prostaglandinas, bradiquininas y endotelinas, induce a la contracción muscular de los miofibroblastos. Las isoformas PDGF AB y BB juegan también un papel importante en la contracción de los miofibroblastos en la matriz de colágeno. La comprensión de los miofibroblastos y de sus funciones tiene otras implicaciones además de la reparación de la herida. Las cicatrices hipertróficas y la enfermedad de Dupuytren son condiciones en las cuales los miofibroblastos juegan un papel importante. Dr. Hilario Robledo
13 Cicatrización de la Herida 12 La cuantía final de la contracción de la herida depende en gran medida de la profundidad de la herida. Las heridas de la piel pueden clasificarse en dos categorías: de espesor parcial o total. En las heridas de espesor total, la lesión se extiende más profunda que sus anejos. Estas heridas cicatrizan al menos en parte por contracción que resulta en una reducción aproximada del 40% de su tamaño inicial. En las heridas de espesor total, la epitelización ocurre solamente desde el borde de la herida a diferencia de las que no son tan profundas y parte de los anejos permanecen en el lecho de la herida. Las heridas de espesor parcial muestran menos contracción y la epitelización ocurre desde el borde de la herida y de las estructuras anexas en el lecho de la herida. Angiogénesis La antiogénesis describe el proceso por el cual crecen nuevos vasos, denominado neovascularización. La angiogénesis sucede al mismo tiempo que la fibroplasia y de hecho son interdependientes. Como con el otro proceso de reparación de la herida, la formación de nuevos vasos sucede en el contexto de una matriz extracelular cambiante. La célula principal de la angiogénesis es la célula endotelial, que como los queratinocitos y los fibroblastos, deben sufrir cambios específicos para migrar al lecho de la herida, proliferan y dirigen la formación de nuevos vasos. La migración de las células endoteliales en la herida depende de señales quimotácticas proporcionadas por la matriz extracelular y las células colindantes. El FGF-2 o factor de crecimiento fibroblástico básico, tiene una importancia crítica para estos procesos. Por ejemplo, el bloqueo de este péptido intefiere de forma importante con la angiogénesis (figura 8-12). Alguno de los efectos del PGF-2 están mediados a través del factor de crecimiento vásculo-endotelial (VEGF) (figura 8-13), aunque este péptido también puede ser estimulado en la herida por el factor de crecimiento queratinocítico (KGF) y transformarse en factor de crecimiento a (TGF-a). Los receptores de estos péptidos están supraregulados por las células endoteliales en el lugar de la herida. Entre ellos están el flt-1, el receptor VEGF. El receptor VEGF-2 y su correceptor neuropilina 1 también están supraregulados. Existen evidencias que al igual que en la reepitelización, la migración celular es un componente más importante en la angiogénesis que la proliferación. Sin embargo, muchas señales que están involucradas en la migración celular endotelial, como la fibroconectina y la heparina, pueden estimular también la proliferación. Dr. Hilario Robledo
14 Cicatrización de la Herida 13 Además de su función en la angiogénesis, las céulas endoteliales juegan un activo papel en la fase inflamatoria de la cicatrización de la herida. Producen varios factores que controlan la propagación del coágulo inicial, por lo que limitan la agregación plaquetaria y la formación del coágulo al área de la lesión. Estos mediadores incluyen la prostaciclina que inhibe la agregación plaquetaria; la antitrombina III que inhibe la actividad de la trombina; la proteína C que degrada los factores de la coagulación V y VIII; y más importante, el activador del plasminógeno que inicia la lisis del coágulo convirtiendo el plasminógeno en plasmina. Modelos experimentales con córnea avascular han mostrado que la alteración fenotípica de las células endoteliales durante la cicatrización de la herida incluye el desarrollo de pseudopedia que se proyecta a través de las membranas basales fragmentadas. El estímulo para este cambio fenotípico no ha podido ser explicado igual que para los queratinocitos y fibroblastos. Al segundo día de la lesión aguda, las células endoteliales en el borde de la herida comienzan a migrar al espacio perivascular. y las que permanecen en los vasos sanguíneos empiezan a proliferar. Se han implicado a un número de factores que estimulan la angiogénesis. Como se ha descrito anteriormente, la baja tensión de oxígeno en la herida inicial parece potenciar la angiogénesis y los fibroblastos. Una baja tensión de oxígeno también estimula a los macrófagos para que produzcan y segreguen factores angiogénicos. Los factores del crecimiento que han mostrado ser angiogénicos incluyen a TGF-ß 1 y el FGF. Es de interés que el TGF-ß 1 sea un potente inhibidor de la proliferación de las células endoteliales, aún esto induce una respuesta angiogénica dramática cuando se inyecta en la dermis. Esto es así probablemente debido a que el TGF-ß induce al agrupamiento de los macrófagos, que en cambio segregan sustancias que Dr. Hilario Robledo
15 Cicatrización de la Herida 14 estimulan en crecimiento de células endoteliales. Este ejemplo subraya la complejidad involucrada en esta fase de la reparación de la herida y la dificultad en asignar los efectos definitivos a un factor o a una célula en particular. Sin embargo, parece que la familia del FGF es con mucho el estimulador más importante de la angiogénesis. Estos péptidos son liberados por los macrófagos e interactúan con la heparina, que aumenta su actividad biológica. Como se ha mencionado anteriormente, los macrófagos son esenciales en el proceso de la reparación de la herida. La matriz extracelular, como hace en otras fases de la cicatrización de la herida, juega un papel crítico en la angiogénesis. Un componente de la matriz provisional es la proteína secretada ácida y rica en cisteína (SPARC) (Secreted Protein Acidic and Rich in Cytsteine). Liberada por los fibroblastos y los macrófagos, SPARC o sus fragmentos proteolíticos, estimulan la angiogénesis durante la formación del tejido de granulación. La proteína SPARC, la tenascina y la trompondina son todas componentes de la matriz inicial provisional y pueden encontrarse también en los tejidos donde las células se están dividiendo o migrando. Son consideradas proteínas antiadhesivas y se ha mostrado que promueven el doblamiento y la separación parcial de la célula. En adición a estos efectos, la SPARC puede estimular también la producción de colagenasa, estromalisina y de gelatinasa. La heparina y la fibronectina, otros dos componented de la matriz inicial, estimulan a las células endoteliales a proyectar pseudopedia a través de los defectos en la membrana basal en el lugar de la lesión. El FGF estimula además a las células para liberar procolagenasa y activador del plasminógeno (PA). El PA convierte el plasminógeno en plasmina y activa la colagenasa. Estos enzimas ayudan a la rotura de la membrana basal y facilitan la migración de las células endoteliales al espacio perivascular. Como en otras etapas de la cicatrización de la herida, las interacciones célulo-celulares y célulo-matriciales desempeñan un papel fundamental en la determinación de la invasión, migración y de la proliferación de als células endoteliales. Durante la reparación de la herida, se segregan varias proteínas adhesivas en la membrana basal de los vasos sanguíneos, incluyendo la vwf, la fibronectina y el fibrinógeno. Varios estudios han mostrado que diversos receptores de integrinas, especialmente el a v b 3, están supraregulados en la superficie de las células musculares lisas y de las células endoteliales durante la angiogénesis. El a v b 3 es el receptor de las células endoteliales para la vwf, fibrinógeno/fibrina y de la fibronectina. En un estudio, el a v b 3 fue encontrado en los vasos sanguíneos recién formados en el tejido de granulación pero no en la piel normal no lesionada. Migración de los Queratinocitos El proceso de reepitelización comienza varias horas después de la lesión tisular. La migración queratinocítica, más bien que la proliferación, es de hecho la responsable de la mayoría de las restauraciones cutáneas de los defectos epidérmicos. El proceso por el cual sucede la reepitelización en las heridas agudas es muy diferente del que se observa en las heridas crónicas. La Figura 8-5 muestra una representación esquemática de la migración de la lengua epitelial en las heridas agudas en contraste al de la epidermis acantótica que se ve en las heridas que no cicatrizan. Este punto será discutido con más detalle más adelante ya que es pertinente entender la totalidad de los mecanismos de la reparación de la herida. Los sucesos que regulan la migración de los queratinocitos son muy heterogéneos y están muy interrelacionados. Estos acontecimientos tienen que ver con los cambios de la forma de los queratinocitos, en Dr. Hilario Robledo
16 Cicatrización de la Herida 15 la reestructuración de su citoesqueleto y la secreción de queratina y de proteasas. La alteración fenotípica de los queratinocitos los capacita para migrar desde el borde de la herida y desde las estructuras anexiales que permanecen en el lecho de la herida. Uno o dos días después de la lesión inicial, las céulas epidérmicas en el borde de la herida y dentro de la herida comienzan a dividirse y a proliferar contribuyendo de esta forma a la población de las células en migración. En las heridas pequeñas, la fase proliferativa es menor y probablemente no tan importante. Sin embargo, en las grandes heridas, hay una muy dramática explosión de actividad proliferativa sin la que no podría ocurrir una restauración cutánea apropiada y oportuna. Esta discrepancia entre heridas pequeñas y grandes ha producido alguna confusión y con frecuencia se escucha la afirmación errónea de que la proliferación no es importante en la migración de los queratinocitos. De todos modos, varios estudios han mostrado eso, en su sentido puro, la migración y la proliferación de los queratinocitos pueden considerarse como dos procesos independientes. Una forma de investigar este hecho es bloquear la proliferación de queratinocitos con TGF-ß, que es un potente e importante inhibidor del crecimeinto de células endoteliales. En dicho estudio, los investigadores expusieron los queratinocitos a una matriz de colágeno que estimulaba notablemente la motilidad y posteriormente al TGF-ß, lo que produjo una inhibición marcada de la proliferación. A pesar de este efecto, los queratinocitos continuaron migrando. De hecho, la migración era estimulada por el TGF-ß. Como se ha mencionado previamente, los queratinocitos sufren grandes cambios en su morfología según migran, o quizás denominado más correctamente, cuando son autorizados para migrar. Los queratinocitos basales sufren un cambio morfológico de su forma normal cuboidal a células aplanadas con extensiones del citoesqueleto actínico (lamelípodos) que se Dr. Hilario Robledo
17 Cicatrización de la Herida 16 proyectan en el lecho de la herida. Los hemidesmosomas se repliegan de la membrana plasmática y aumenta el número de huecos entre las uniones. La expresión de los receptores de integrinas cambia para facilitar el movimiento de los queratinocitos sobre el colágeno y los queratinocitos comienzan a sintetizar y liberar colagenasas tipo I y IV. La secreción de nuevas integrinas ayuda claramente a la migración queratinocítica. Por ejemplo, la capacidad de los queratinocitos para fijarse y migrar sobre la matriz provisional está íntimamente ligada a su expresión de receptores de fibronectina/tenascina a 5 b 1 y a v b 6. La vitronectina y su receptor de integrina (a v b 5 ) son también unos componentes críticos de esta migración. De hecho, en un modelo de piel obtenido mediante bioingeniería, la vitronectina y su integrina homóloga, han mostrado ser esenciales para la migración de los queratinocitos sobre la superficie construida (epiboly). La migración de queratinocitos comienza y está asociada con varios cambios morfológicos y bioquímicos. Los queratinocitos en los bordes de la herida regulan las proteasas para permitir su migración en el contexto de un coágulo de fibrina. Observaciones experimentales indican que el proceso de oclusión favorece de forma importante esta migración y que en tales circunstancias los queratinocitos efectivamente pueden migrar indiscriminadamente sobre un número de superficies colocadas dentro de la herida. Así la oclusión puede acelerar la reepitelización estimulando a los queratinocitos a migrar de forma menos específica. Para que migren los queratinocitos, deben liberarse de la lámina basal a la cual están adheridos mediante las hemidesmosomas, el anclaje de contactos que unen a la proteína laminina vía a 6 b 6 a la red de filamentos de queratina de los queratinocitos. La migración de los queratinocitos sobre la matriz extracelular, al igual que la matriz provisional de la herida está favorecida por la secreción de nuevas integrinas, principalmente por los receptores de fibroconectina/tenascina a 5 b 1 y a v b 6 y por los receptores de vitronectina a v b 5. El movimiento sobre el colágeno requiere la integrina a 2 b 1. El arrastre de los queratinocitos sobre estas superficies se logra mediante los cambios morfológicos y el movimiento lamelopodial. El citoesqueleto es crítico para estos cambios y para la migración celular. Así la contracción de los filamentos de actinomiosina insertas en complejos de adherencias resulta en y facilita el avance celular lento. Se piensa actualmente que el arrastre y el movimiento no están confinados a los queratinocitos basales en el borde de la herida. Más bien, los queratinocitos suprabasales parecen saltar las células basales. La queratina proporciona la fuerza para la locomoción de los queratinocitos que son importantes tanto en el avance lento lamelopodial como en el cierre tipo bolsa de tabaco observado en las heridas embriónicas. En el borde de la herida se induce la queratina 6, 16 y 17. Dr. Hilario Robledo
18 Cicatrización de la Herida 17 Diversas citoquinas y proteínas matriciales estimulan la migración de los queratinocitos en el lecho de la herida. Los promotores de tejido conjuntivo de la migración incluyen a la fibronectina y al colágeno tipo IV, ambos de los cuales pueden ser sintetizados por los queratinocitos y por el colágeno Tipo I nativo desnaturalizado. Los factores de crecimiento, como el TGF-ß y el factor de crecimiento epidérmico (EGP), estimulan la migración de los queratinocitos. El TGF-ß también incrementa la producción queratinocítica de fibroconectina. Las señales críticas vía transducción para la migración de los queratinocitos están siendo elucidados. La vía p38-mapk/sapk se requiere para la migración de los queratinocitos al sustrato de colágeno. Como en otros procesos fisiológicos, las paradas o los frenos están en el lugar de la lesión para permitir el final de los acontecimientos que facilitan la migración de los queratinocitos. Una de estas señales es la reconstitución de la proteína laminina, que es el componente importante de la zona de la lámina lúcida de la membrana basal (la laminina básicamente es una proteína que se encuentra en la matriz extracelular las capas de proteínas que forman el sustrato de todos los órganos internos también llamados membranas del depósito Tiene 4 brazos que pueden formar otras 4 moléculas. Los brazos largos tienen la capacidad de conectar las células quienes ayudan a los órganos actuales de las moléculas. Estas son familia de las glicoproteínas que son una parte integral de la estructura que casi todos los animales también tienen. Laminins están incorporadas dentro de las células asociadas con las matrices. La laminina es vital para asegurar de que todas las estructuras del cuerpo se mantengan juntas. La laminina es una glicoproteína que forma parte de la lámina basal asociada a otras proteínas como el colágeno, entactina, proteoglucanos y fibronectinas. Tiene una longitud de 120 nm, y atraviesa toda las capas de la lámina basal. Su función sería la de anclar las células epiteliales a la lámina densa pues tiene sitios de unión para moléculas de integrinas de la membrana celular de la base celular. La laminina I es una gran complejo proteico flexible formado por tres largas cadenas polipeptídicas (α, β, γ) dispuestas en forma de cruz y unidas mediante puentes disulfuro. Cada una de las cadenas polipeptídicas esta constituida por más de 1500 aminoácidos; se han identificado 5 tipos de cadenas α, 3 de tipo β y 3 tipos de cadena γ, las cuales pueden asociarse formando 45 isoformas diferentes de laminina; algunas de ellas han sido caracterizadas y presentan una distribución tisular característica. La laminina-i es un componente de la mayoría de los heterotrímeros cuya importancia queda de manifiesto por la muerte que se observa en embriones que carecen de la proteína, los cuales son incapaces de formar una lamina basal. Además la laminina tiene diferentes dominios funcionales, uno de los cuales presenta alta afinidad por el perlecano, otros por el nidógeno y al menos dos por el receptor celular de la laminina. La Dr. Hilario Robledo
19 Cicatrización de la Herida 18 composición exacta de la lámina basal varía de un tejido a otro, e incluso de una región a otra en la misma lamina, pero la mayoría de las láminas basales maduras contienen colágeno de tipo IV, proteoglicanos del tipo heparán sulfato (perlecano) y glicoproteínas como la laminina y el nidógeno. Estudios recientes relacionan la laminina II, muy abundante en los nervios periféricos y en el músculo estriado, como el lugar de unión de mycobacterium leprae (responsable de la lepra) siendo esta laminina la entrada de acción de esta enfermedad). En la piel intacta sin lesión, esta grande glicoproteína actúa previniendo el contacto entre los queratinocitos y el colágeno contenido dentro de la membrana basal (tipos IV y VII) y de la dermis (tipos I, III y VI). Con la lesión en la piel, se altera el componente laminin y este suceso permite el contacto de los queratinocitos con el colágeno subyacente, por lo que se estimula la migración. Se ha mostrado que la laminina reaparace en la unión dermo-epidérmica después de que los queratinocitos han migrado y han restaurado la herida y de esta forma sirve como señal para que los queratinocitos paren de migrar. El proceso de reepitelización no podría ocurrir libremente sin la secreción apropiada y la acción de los enzimas que se necesitan para disolver los sustratos y los materiales de la matriz para que migren los queratinocitos. Finalmente, esas enzimas también juegan un papel fundamental en la remodelación tisular. La migración de los queratinocitos supraregulan el activador del plasminógeno tipo tisular (tpa), el activador del plasminógeno tipo uroquinasa (upa) y su receptor. Estas enzimas son críticas para el movimiento de los queratinocitos a través del coágulo de fibrina. Otras proteasas también son importantes. La familia de las enzimas metaloproteinasas matriciales (MMPs) comprenden más de 20 tipos diferentes, algunas de las cuales, durante el proceso de la reparación cutánea, son segregadasy reguladas de forma importante. Las MMPs son endopeptidasas zinc-dependientes que son activadas por otras proteinasas como la plasmina. Su actividad está bloqueada o subregulada por los inhibidores tisulares de las metaloproteinasas. La colagenasa I (MMP-I), la estromelisina (MMP-10) y la gelatinasa (MMP-9) son secretadas por los qeratinocitos en el borde de la herida. La MMP-I es necesaria para la migración de los queratinocitos en el colágeno tipo I y está supraregulada en los queratinocitos que están muy al borde de la herida, después de que las células se hayan liberado así mismas de la lámina basal, un proceso que está apoyado por la MMP-9. La MMP-10 degrada un número de proteínas matriciales extracelulares diferentes al colágeno. Otras MMPs están suprareguladas espacialmente justo proximales al borde de la herida. En esta categoría están la estromelisina-2 (MMP-10) y la recientemente descrita epilisina (MMP-28) que está asociada con la proliferación de queratinocitos más que con la migración durante la reparación de la herida. Existen evidencias de que la migración de los queratinocitos se bloquea por inhibidores de las MMPs. La secreción de integrina también está regulada por los factores de crecimiento, incluyendo el TGF-ß, el PDGF y el VEGF. La secreción de a 5 b 1 y a v b 3 en los cultivos de fibroblastos y la subunidad b 1 en los cultivos de queratinocitos se incrementa por la TGFb-1. Esta citoquina también supraregula la a 5 b 1 y a v b en los queratinocitos. El efecto de las citoquinas y de los factores de crecimiento en la regulación de la secreción de integrina debe ser vista en el contexto de la matriz que rodea la céula diana. Se ha mostrado que la PDGF-BB, es un componente predominante en el ambiente inicial de la herida, supraregula la secreción de a 5 b 1 y de a 3 b 1 en los fibroblastos que crecen en los cultivos de fibrina ricos en fibroconectina tisular. Sin embargo, los fibroblastos que crecen en geles de colágeno, aproximándose así a la dermis normal o ambiente final de la herida, no muestra supraregulación (estimulación de la secreción) de estas integrinas, aún en presencia de PDGFF-BB. La gran mayoría de citoquinas que afectan Dr. Hilario Robledo
20 Cicatrización de la Herida 19 a la secreción de integrina son liberadas inicialmente por la agregación de las plaquetas en la heridfa inicial. Posteriormente son producidas por los fibroblastos, queratinocitos, monocitos y macrófagos. Remodelación Tisular (Fase III) En la tercera y última fase de la reparación de la herida, se degrada y remodela el tejido que se ha formado previamente y las células sufren apoptosis y otros cambios drásticos. Típicamente, esta fase puede durar varios meses. Aunque el resultado funcional no es ideal, en el tejido que no ha ocurrido regeneración el proceso que remodela permite que el anfitrión desarrolle una cicatriz estable que tiene aproximadamente el 70 por ciento de la fuerza original. El cierre de la herida es de capital importancia desde el punto de vista de la supervivencia y de la evolución y el resultado de la reparación refleja esta prioridad y es un compromiso entre las necesidades funcionales y estructurales. Desde muchos puntos de vista, esta fase de la reparación de la herida se parece a muchos otros procesos fisiológicos no relacionados en los cuales el resultado inicial es exagerado. Así, durante el proceso de reparación de la herida, hay probablemente una sobre abundancia de migración celular y de proliferación e incluso un depósito excesivo de muchos tipos de componentes de la matriz extracelular. Esta exageración de la respuesta de reparación es importante en la aseguración de la reacción inflamatoria apropiada y la eliminación de bac- Dr. Hilario Robledo
21 Cicatrización de la Herida 20 terias, desbridamiento de la herida y de la extracción del tejido necrótico. La fibroplasia y la angiogénesis son críticas para el desarrollo del lecho de la herida apropiado que se necesita para la migración de queratinocitos y reepitelización. Sin embargo, como ya se ha afirmado, la abundancia de células y material de la matriz extracelular debe tratarse ahora y es necesario un proceso de remodelación para subregular la respuesta y volver a un estado aproximado al de antes de la lesión. Los mecanismos apoptóticos y la actividad enzimática de las MMPs y de otras proteinasas deberán conseguir un equilibrio dentro de la herida recién epitelizada. Los acontecimientos de la remodelación están estrechamente unidos a aquellos que han permitido el depósito de ciertos componentes de la matriz extracelular y la migración celular al sitio de la herida en primer lugar. El motivo para esto es que la remodelación no puede tener lugar a menos que las señales estimulantes primarias hayan finalizado. Por lo tanto, la discusión sobre lo que es crítico para que la formación tisular sea apropiada cuando se visualiza en el contexto de como se forma el tejidos se modifica ahora. Desde luego, esta tercera fase de la reparación del tejido no está igual de estudiada como los procesos de inflamación y de proliferación, y por tanto, quedan muchas incógnitas. También debe reconocerse que la fase de remodelación no sucede homogéneamente dentro de la herida, ya sea en la localización como en el tiempo. En el contexto de la fase de remodelación en la reparación de la herida se discutirán los acontecimientos siguientes y componentes clave de la matriz extracelular: 1. fibronectina y Dr. Hilario Robledo
22 Cicatrización de la Herida 21 componentes asociados; 2. ácido hialurónico y proteoglicanos; 3. colágeno; y 4. aparición de miofibroblastos y contracción. Fibronectina y Componentes Asociados Los fibroblastos producen fibroconectina según entran en la herida y al menos inicialmente, la concentración de fibronectina es muy alta. A los 4-5 días de la lesión, la red de fibronectina está bien establecida. Es importante resaltar que el proceso por el que los fibroblastos dejan su entorno rico en colágeno para entrar en el lugar de la herida requiere que se modifiquen su conducta y características. Para que se activen los fibroblastos, es necesario que se modifique su repertorio de integrinas, las cuales dictan a donde irán y a lo que se unen. Hasta cierto punto, está regulado por las citoquinas. Por ejemplo, la exposición de los fibroblastos a la PDGF puede supraregular las subunidades de las integrinas a 3 y a 5, que están consideradas las que más se adaptan a la unión de los componentes matriciales provisionales de la herida. Inversamente, la subunidad de la integrina a 2, se supraregula en los fibroblastos con un entorno rico en colágeno. La producción de fibronectina se estimula por varios factores del crecimiento, pero seguramente por el TGF-b, que tambien subregula (inhibe la secreción) a los receptores de integrinas que se unen a la fibronectina. Esta citoquina es crítica en el depósito de la matriz extracelular y a menudo está implicada en la patogénesis de la fibrosis y de la cicatrización excesiva. El TGF-b es un quimioatractor de los fibroblastos y estimula su proliferación, al igual que origina un incremento global en la formación de la matriz extracelular. Hay una direccionalidad para el depósito de fibronectina, que es importante en el modo en las que se depositan otras proteínas de la matriz extracelular. Por ejemplo, el depósito de colágeno se alineará después del modelo de fibronectina, que refleja el eje de alineación de los fibroblastos. Finalmente, durante la remodelación y la contracción, los miofibroblastos harán uso de la red de fibronectina para originar la contracción de la herida. Se han propuesto varias hipótesis para explicar los mecanismos por los cuales la fibronectina es la base de la adherencia de los fibroblastos a la matrix extracelular. Una de estas hipótesis se basa en las proteinasas donde el ensanblaje del citoesqueleto actínico está determinado por la acción de las proteinasas en lugares específicos del tejido. El depósito de ECM asociado a moléculas, como la tenascina, SPRC, trombospondina y el sulfato de dermatán, es otra forma de influenciar y modificar la totalidad de la confección de la ECM (matriz extracelular). Por ejemplo, la SPARC (secreted protein acidic and rich in cysteine) subregula la secreción de metaloproteinasas por los fibroblastos, especialmente la colagenasa, mientras que la trombospondina y la tenascina, ambas tienen propiedades adhesivas y antiadhesivas. En gran medida, la regulación de como la SPARC induce la secreción de colagenasa está relacionado a que componentes de ECM de los fibroblastos están expuestos a la colagenasa. De esta forma, la SPARC induce la producción de colagenasa en fibroblastos cultivados en colágeno tpo I, II, III y V y en vitronectina, pero no en colágeno tipo IV. Tarde o temprano, el entorno rico en fibronectina de la herida inicial, se modifica y se remodela por las células y las proteasas plasmáticas. Con el tiempo, la fibronectina se reemplaza por colágeno tipo III y finalmente por colágeno tipo I. Ácido Hialurónico y Proteoglicanos El ácido hialurónico glucosaminoglicano (hyaluronan) es también un abundante com- Dr. Hilario Robledo
23 Cicatrización de la Herida 22 ponente de la matriz provisional y cuyo depósito debe ser modificado durante el proceso de remodelación. En el proceso inicial embrionario hay unos altos niveles de ácido hialurónico, en el cual se cree que ofrece una menor resistencia a la migración celular. De hecho, la reparación de embriones se caracteriza por un medio ambiente rico en ácido hialurónico, se cree que es al menos en parte responsable de la curación sin cicatriz de las heridas embrionarias. Los fibroblastos del tejido de granulación inicial producen grandes cantidades de ácido hialurónico y secreción de las células de proliferación de CD44, que es el receptor de la molécula GAG. Además de ofrecer menos resistencia al movimiento celular, el ácido hialurónico puede estimular la movilidad celular alterando las adhesiones célulo-matriciales. Un ejemplo de esto es que el ácido hialurónico debilita las adhesiones del heparán sulfato y fibronectina. Quizás más importante desde un punto de vista físico-espacial es que el ácido hialurónico crea una estructura altamente hidratada que conduce a la hinchazón tisular y de los espacios intersticiales, originando así un ambiente más propicio para el movimiento celular. Los efectos del ácido hialurónico están regulados también por los factores de crecimiento y las citoquinas. El TGF-b1 que estimula la motilidad de los fibroblastos, subregula la secreción de ácido hialurónico y de sus receptores (ej.: RHAAMM). Tarde o temprano, según ocurre la remodelación, el ácido hialurónico se degrada por la hialuronidasa y es reemplazado por proteoglicanos sulfatados, que aportan un mayor papel estructural en el tejido de granulación final y en la formación de cicatrices, mientras que son menos capaces de estimular el movimiento celular. Los fibroblastos maduros de la cicatriz producen dos proteoglicanos principales: el sulfato de condroitina y el sulfato de dermatán. Colágeno Normalmente en el tejido conectivo están presentes tres tipos principales de colágeno: colágenos fibrilares (tipo I, III y V), colágeno de la membrana basal (tipo IV) y otros colágenos intersticiales (tipos VI, VII y VIII). Estos son ejemplos simples de los muchos tipos de colágenos diferentes que existen en la piel. No obstante, de forma importante, el colágeno fibrilar sirve como uno de los colágenos estructurales principales de todos los tejidos conectivos. Durante las fases iniciales de la cicatrización, parece que la herida tiende a reproducir los procesos que están involucrados en la embriogénesis. De tal forma que el tejido de granulación está compuesto inicialmente por grandes cantidades de de colágeno tipo III, el cual es un componente menor de la dermis adulta y sin embargo está presente en grandes cantidades en la reparación de la herida fetal. Durante la fase de remodelación, sobre un período de un año o más, el colágeno tipo III se reemplaza gradualmente por el colágeno tipo I. La sustitución por el colágeno tipo I está asociado al aumento de la fuerza tensora. Sin embargo, la fuerza tensora final de la cicatriz es de solo alrededor del 70% de la piel antes de la lesión. El proceso de conversión del contenido de colágeno de la dermis del colágeno tipo III al colágeno tipo I está controlado por las interacciones que están involucradas en la síntesis del nuevo colágeno y en la lisis del colágeno previo. La clave para este proceso de conversión son las metaloproteinasas y específicamente las colagenasas. La degradación de la matriz por las metaloproteinasas (MMP) que son proenzimas que necesitan ser activadas y se considera que son los mediadores fisiológicos de la degradación matricial. La MMP prototipo es la colagenasa intersticial, pero se han descrito sobre 20 de Dr. Hilario Robledo
24 Cicatrización de la Herida 23 dichas enzimas. Hay tres clases amplias de estas enzimas dependientes del zinc: colagenasas, gelatinasas y estromelisinas. Las colagenasas contienen la colagenasa (colagenasa fibroblástica, MMP-1) que actúan sobre el tipo colágeno I, II, III, VII y X. El colágeno tipo II es un sustrato particularmente bueno para la MMP-1, que también degrada el colágeno tipo II y III, pero es especialmente activo frente al colágeno tipo I. Las gelatinasas desnaturalizan el colágeno (gelatina). Entre las gelatinasas más importantes están la gelatinasa A (MMP-2), que degrada las gelatinas, colágeno IV y elastina. Otra gelatinasa clave es la gelatinasa B (MMP-9) que es producida por la mayoría de las células incluyendo a los macrófagos, neutrófilos y a los queratinocitos. Las estromelisinas tienen una especificidad para los sustratos relativamente amplia. Tanto la estromelisina 1 (MMP-3) como la 2 (MMP-10) actúan sobre los proteoglicanos, fibronectina, laminina, gelatinas y colágenos III, IV y IX. Otro miembro de la familia de las estromelisinas es la matrilisina (MMP-7) que degrada principalmente la fbronectina, gelatinas y elastina. Uno de los miembros más recientes de la familia MMP, es la epilisina (MMP-28) que parece ser producida por los queratinocitos que proliferan en el borde distal de la herida y puede ser necesaria para la restructuración de la membrana basal. La estimulación para la producción de las MMP y de su activación no solo son por los factores de crecimiento y las citoquinas como la IL-1, sino también por los componentes de la matriz extracelular y otros compuestos químicos. Por ejemplo, la tripsina, los órganomercuriales, la plasmina y la SDS pueden activar als MMP, mientras que el calcio las estabiliza. Como ya se ha indicado, las MMP dependientes del cinc, que están localizadas en el centro de la molécula en una secuencia conservada y conocida como HEXGH. Varios quelantes incluyendo al inhibidor tisular de las metaloproteinasas (TIMP), inhiben diferentes miembros de la familia de las MMP, mientras que la macroglobulina a 2 las atrapan. La fase de remodelación es más que un proceso de rotura de excesos de macromoléculas formadas durante la fase de proliferación de la cicatrización de la herida. Las células en el interior de la herida retornan a un fenotipo estable, el material de la matriz exracelular está alterado (e.j.: el colágeno tipo III a tipo I) y el tejido de granulación que era tan exuberante durante la fase inicial de la cicatrización de la herida desaparece. Miofibroblastos y Contracción En los estadíos iniciales de la reparación de la herida, que empieza alrededor del día 4 después de la lesión, se forma tejido de granulación. El tejido de granulación se llama así debido a su aspecto parecido a gránulos rico en estructuras vasculares. En las heridas más maduras y durante la fase de remodelación, este tejido de granulación tiene que ser modificado. Uno de los sucesos primarios es la contracción de la herida. Existen diferentes grados de contracción. Existen diferentes grados de contracción dependientes del huésped, la localización de la herida y de su profundidad. Por ejemplo, los roedores cicatrizan en gran medida por la contracción, que debe ser tenido en cuenta cuando se extrapolan al humano los resultados de las heridas inducidas experimentalmente en ratones y en ratas. También es importante a localización de la herida, parece ocurrir mucha más contracción sobre las superficies redondeadas como los hombros y en la nariz. Los motivos para estas diferencias debidas a la localización no son conocidas. Seguramente, puede ocurrir una mayor tensión en ciertas localizaciones y esta podría modificar el tipo de la matriz extracelular que se crea, así como tener un efecto en la selección y del fenotipo de los fibroblastos. Sin embargo, el factor más importante que determina el desarrollo y la exten- Dr. Hilario Robledo
25 Cicatrización de la Herida 24 sión de la contracción es la profundidad de la herida. Las heridas de grosor parcial, que llegan solo a la dermis papilar, curan con menos cicatriz y contracción. Las heridas de espesor total, que abarcan el tejdo celular subcutáneo, tienden a curar con mucha más cicatriz y dependen de la contracción para una reparación más rápida. De todos modos, la masa de tejido que se ha formado en las fases más iniciales de la reparación de herida debe hacerse ahora más pequeña y la contracción es un modo eficaz de conseguirlo. Los miofibroblasros juegan un papel crítico en el proceso de contracción. Se suele leer que los miofibroblastos son fibroblastos transformados de la herida que segregan una actina a de músculo liso y que son células como el músculo liso. El término transformado es incorrecto, ya que la transformación es usada correctamente sólo en el contexto de la vía a la neoplasia. El mecanismo principal del fenotipo de los miofibroblastos es desconocido en su mayor parte, pero ciertos factores de crecimiento como el TGF-b1, puede regular este proceso. También es conocido que los miofibroblastos pueden jugar un papel fundamental en ciertas condiciobes fibróticas, como la contractura de Dupuytren y tienen unas consecuencias críticas para la expresión clínica de ciertas otras condiciones. Por ejemplo, las cicatrices hipertróficas son ricas en miofibroblastos y ambas contraen aunque finalmente se resuelven con el tiempo. Por el contrario, en los queloides falta un componente significante de los miofibroblastos por lo que no se contraen ni se resuelven fácilmente. El Mundo de las Heridas Crónicas En las secciones anteriores la explicación se ha centrado en la reparación cutánea de la herida después de una lesión aguda. Debe reconocerse que la aplicabilidad de estos acontecimientos y procesos es limitada cuando sucede en las heridas crónicas que se desarrollan Dr. Hilario Robledo
26 Cicatrización de la Herida 25 en patologías previas como la diabetes, insuficiencia arterial y venosa, y en una variedad de situaciones complicadas con procesos crónicos y respuestas defectuosas por el huésped. Las heridas agudas, como las producidas por la cirugía, láser o los traumatismos, tienen un margen de tiempo para la curación previsible y generalmente curan bastante répidamente. Sin embargo, las heridas crónicas muestran lo que ha sido llamado un fracaso de la cicatrización. Se han realizado varias observaciones en cuanto a las heridas crónicas y se han propuesto varias hipótesis para explicar este fallo en la cicatrización. El rigor científico de estas hipótesis y de sus posibles mecanismos es menor de lo que ha descrito en los procesos anteriores de los principios generales de la reparación de la herida y por este motivo es más dificultoso el estudio de las heridas crónicas en los humanos y los modelos experimentales de lesión crónica están lejos de lo que sería lo ideal. Aún así, es útil describir brevemente algunas de las anormalidades que han sido encontradas y proporcionan un contraste de los principios altamente regulados de las diferentes fases de la reparación de la herida. Quizá el mejor ejemplo donde se ha hecho algún progreso en el entendimiento de las heridas crónicas y su insuficiencia cicatricial sea en las úlceras debidas a insuficiencia venosa. La anormalidad fundamental en el desarrollo de las úlceras venosas es la hipertensión venosa, que se refiere a la incapacidad para disminuir la presión venosa en el pie en respuesta al ejercicio. En este sentido, el término hipertensión es un nombre poco apropiado, ya que la presión no esté aumentada en un sentido absoluto. La hipertensión venosa es frecuentemente el resultado de válvulas defectuosas en las extremidades inferiores, con o sin el bloqueo del flujo de sangre en las venas profundas. Sin embargo, debe recordarse que el bombeo de la musculatura de la pantorrilla, responsable de la propulsión de la sangre hacia el corazón, actúa como una unidad compuesta de músculos y venas. De tal forma, que una disminución en la función muscular también podría resultar en hipertensión venosa. La primera hipótesis verdadera que aborda la Dr. Hilario Robledo
27 Cicatrización de la Herida 26 patofisiología de la ulceración venosa de una forma racional, sugiere que la pérdida de la integridad tisular y el desarrollo de la ulceración venosa es el resultado de la hipertensión venosa y el escape de fibrinógeno del compartimento intravascular. El fibrinógeno se polimeriza rápidamente a fibrina alrededor de los vasos (manguitos de fibrina). Se ha supuesto que estos manguitos de fibrina podrían prevenir la difusión de oxígeno y nutrientes de los vasos a la dermis. Esta isquemia funcional conduce a la pérdida de la intergridad del tejido y por último a la ulceración. Ya que la hipótesis de los manguitos de fibrina fue la primera propuesta, ha habido una revalori- Dr. Hilario Robledo
Cicatrización de la Herida y Cuidado Postoperatorio: Restauración Cutánea Láser
 CAPÍTULO OCHO Dr. Hilario Robledo Cicatrización de la Herida y Cuidado Postoperatorio: Restauración Cutánea Láser La restauración cutánea láser, tanto la de superficie total como la parcial (fraccional,
CAPÍTULO OCHO Dr. Hilario Robledo Cicatrización de la Herida y Cuidado Postoperatorio: Restauración Cutánea Láser La restauración cutánea láser, tanto la de superficie total como la parcial (fraccional,
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I
 Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I Tema 29 Prof. Miguel Skirzewski Prevención de la pérdida de
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I Tema 29 Prof. Miguel Skirzewski Prevención de la pérdida de
COAGULACIÓN SANGUÍNEA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la Hemostasia Vasoconstricción
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la Hemostasia Vasoconstricción
COAGULACIÓN SANGUÍNEA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la
Diferenciaciones de la membrana plasmática. Microvellosidades
 Diferenciaciones de la membrana plasmática Son regiones de la membrana plasmática que presentan modificaciones estructurales especializadas para cumplir diferentes funciones. Un típico ejemplo lo ofrecen
Diferenciaciones de la membrana plasmática Son regiones de la membrana plasmática que presentan modificaciones estructurales especializadas para cumplir diferentes funciones. Un típico ejemplo lo ofrecen
Tejido Conjuntivo TEJIDO CONJUNTIVO. Constituyentes y variedades. Curso Biología Celular y Tisular, Componentes:
 Universidad de la República Facultad de Medicina Escuelas de Tecnología Médica Tejido Conjuntivo Constituyentes y variedades Componentes: Células del tejido conjuntivo. Matriz extracelular (Sustancia fundamental
Universidad de la República Facultad de Medicina Escuelas de Tecnología Médica Tejido Conjuntivo Constituyentes y variedades Componentes: Células del tejido conjuntivo. Matriz extracelular (Sustancia fundamental
A. Díaz Salas. TEMA 8: La reparación por tejido conjuntivo: Fibrosis. Curación de las heridas.
 A. Díaz Salas TEMA 8: La reparación por tejido conjuntivo: Fibrosis. Curación de las heridas. Dicimebre de 2006 Cicatrización, regeneración y reparación de los tejidos: Introducción. Curación de las heridas.
A. Díaz Salas TEMA 8: La reparación por tejido conjuntivo: Fibrosis. Curación de las heridas. Dicimebre de 2006 Cicatrización, regeneración y reparación de los tejidos: Introducción. Curación de las heridas.
Lic. Jürgen Freer B.
 Lic. Jürgen Freer B. Distintos estudios han demostrado una relación entre la desestabilización del control fisiológico de la hemostasia y la incidencia de enfermedades cardiovasculares. Así la angina de
Lic. Jürgen Freer B. Distintos estudios han demostrado una relación entre la desestabilización del control fisiológico de la hemostasia y la incidencia de enfermedades cardiovasculares. Así la angina de
TEJIDO CONECTIVO -1. Dr. Carlos Martín. Profesor Adjunto Cátedra de Citología, Histología y Embriología A. Facultad de Ciencias Médicas.
 TEJIDO CONECTIVO -1 Dr. Carlos Martín Profesor Adjunto Cátedra de Citología, Histología y Embriología A. Facultad de Ciencias Médicas. UNLP Membrana Basal Estructura que se ubica entre el epitelio y el
TEJIDO CONECTIVO -1 Dr. Carlos Martín Profesor Adjunto Cátedra de Citología, Histología y Embriología A. Facultad de Ciencias Médicas. UNLP Membrana Basal Estructura que se ubica entre el epitelio y el
Apoptosis. Término que hace referencia a los procesos morfológicos que llevan a la autodestrucción celular controlada
 APOPTOSIS Apoptosis Término que hace referencia a los procesos morfológicos que llevan a la autodestrucción celular controlada Esta muerte es necesaria y parte integral del ciclo de vida de los organismos
APOPTOSIS Apoptosis Término que hace referencia a los procesos morfológicos que llevan a la autodestrucción celular controlada Esta muerte es necesaria y parte integral del ciclo de vida de los organismos
TEJIDO CONJUNTIVO. Composición: Células. Matriz extracelular
 Clase II TEJIDO CONJUNTIVO Composición: Células Matriz extracelular Matriz amorfa o sustancia fundamental Proteoglucanos Glucosaminoglicanos Glucoproteínas estructurales o de adhesión Fibras Fibras colágenas
Clase II TEJIDO CONJUNTIVO Composición: Células Matriz extracelular Matriz amorfa o sustancia fundamental Proteoglucanos Glucosaminoglicanos Glucoproteínas estructurales o de adhesión Fibras Fibras colágenas
Taller Factores de Crecimiento Plasmático. 29 de Noviembre de 2013
 Taller Factores de Crecimiento Plasmático Mercedes Corbacho Francisca Muñoz 29 de Noviembre de 2013 Regeneración Proceso fisiológico Actividad continua de los tejidos Durante toda la vida Tejidos dañados
Taller Factores de Crecimiento Plasmático Mercedes Corbacho Francisca Muñoz 29 de Noviembre de 2013 Regeneración Proceso fisiológico Actividad continua de los tejidos Durante toda la vida Tejidos dañados
Inflamación, Daño y Reparación en Enfermedades Reumáticas
 Medwave. Año VIII, No. 6, Julio 2008. Derechos Reservados Inflamación, Daño y Reparación en Enfermedades Reumáticas Dra. María Angélica Marinovic M. Sección Inmunología y Alergología, Hospital Clínico
Medwave. Año VIII, No. 6, Julio 2008. Derechos Reservados Inflamación, Daño y Reparación en Enfermedades Reumáticas Dra. María Angélica Marinovic M. Sección Inmunología y Alergología, Hospital Clínico
Tema 22 Hematopoyesis. Esquema general. Elementos formes de la sangre
 Tema 22 Hematopoyesis. Esquema general. Elementos formes de la sangre 1. Hematopoyesis. 2. Elementos formes de la sangre. 2.1 Eritrocitos. 2.1.1. Función de le eritropoyetina en la producción de hematíes.
Tema 22 Hematopoyesis. Esquema general. Elementos formes de la sangre 1. Hematopoyesis. 2. Elementos formes de la sangre. 2.1 Eritrocitos. 2.1.1. Función de le eritropoyetina en la producción de hematíes.
-Definición de Reparación: -Factores a considerar: -La reparación puede ser: Reparación tisular.
 Reparación tisular. *Indispensable para la homeostasis. *Fin último de la inflamación -Definición de Reparación: Es el proceso de sustitución de células muertas por células nuevas, sanas, derivadas del
Reparación tisular. *Indispensable para la homeostasis. *Fin último de la inflamación -Definición de Reparación: Es el proceso de sustitución de células muertas por células nuevas, sanas, derivadas del
El proceso fisiológico de la hemostasia y sus dianas terapéuticas.
 El proceso fisiológico de la hemostasia y sus dianas terapéuticas. Madrid 7-Octubre-2015 Dr. Jose A. Romero Garrido.. Hospital Universitario La Paz. INTRODUCCIÓN: Sistema Circulatorio INTRODUCCIÓN: Sangre
El proceso fisiológico de la hemostasia y sus dianas terapéuticas. Madrid 7-Octubre-2015 Dr. Jose A. Romero Garrido.. Hospital Universitario La Paz. INTRODUCCIÓN: Sistema Circulatorio INTRODUCCIÓN: Sangre
REACCION BASICA DE LA COAGULACION. cascada de la coagulación. trombina. fibrina (polímero insoluble) tico. fibrinolisis cicatrización
 HEMOSTASIA II REACCION BASICA DE LA COAGULACION fibrinógeno (proteína soluble) cascada de la coagulación trombina fibrina (polímero insoluble) tapón n plaquetario tapón n hemostático tico fibrinolisis
HEMOSTASIA II REACCION BASICA DE LA COAGULACION fibrinógeno (proteína soluble) cascada de la coagulación trombina fibrina (polímero insoluble) tapón n plaquetario tapón n hemostático tico fibrinolisis
- Microtúbulos - Microfilamentos - Filamentos intermedios
 Citoesqueleto Cómo se mantiene la forma de una célula? Cómo se transportan proteínas y otras sustancias a través del citoplasma? Cómo se ubican las distintas organelas? La respuesta a estas y otras preguntas
Citoesqueleto Cómo se mantiene la forma de una célula? Cómo se transportan proteínas y otras sustancias a través del citoplasma? Cómo se ubican las distintas organelas? La respuesta a estas y otras preguntas
En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida.
 HISTOLOGIA ANIMAL En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida. Tejidos Los animales pueden alcanzar grandes tallas
HISTOLOGIA ANIMAL En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida. Tejidos Los animales pueden alcanzar grandes tallas
Bloque II: Estructura y fisiología de la célula TEMA 10: LA CÉLULA EUCARIOTA: ESTRUCTURAS Y ORGÁNULOS NO MEMBRANOSOS.
 Bloque II: Estructura y fisiología de la célula TEMA 10: LA CÉLULA EUCARIOTA: ESTRUCTURAS Y ORGÁNULOS NO MEMBRANOSOS. PARED CELULAR Envoltura gruesa y rígida. En plantas, hongos, algas y bacterias. LA
Bloque II: Estructura y fisiología de la célula TEMA 10: LA CÉLULA EUCARIOTA: ESTRUCTURAS Y ORGÁNULOS NO MEMBRANOSOS. PARED CELULAR Envoltura gruesa y rígida. En plantas, hongos, algas y bacterias. LA
FACTORES DE CRECIMIENTO
 CURACIÓN FACTORES DE CRECIMIENTO Prof. Edgar Lopategui Corsino M.A.,., Fisiología a del Ejercicio Saludmed 2012, por Edgar Lopategui Corsino, se encuentra bajo una licencia "Creative Commons", de tipo:
CURACIÓN FACTORES DE CRECIMIENTO Prof. Edgar Lopategui Corsino M.A.,., Fisiología a del Ejercicio Saludmed 2012, por Edgar Lopategui Corsino, se encuentra bajo una licencia "Creative Commons", de tipo:
Tejido Conectivo. Kinesiologia. Professor: Verónica Pantoja. Lic. MSP. Objetivo de la clase :Describir, Identificar y clasificar el Tejido conectivo
 Tejido Conectivo Professor: Verónica Pantoja. Lic. MSP. Kinesiologia Objetivo de la clase :Describir, Identificar y clasificar el Tejido conectivo IPCHILE - DOCENTE: Veronica Pantoja S. 2013 Tejido que
Tejido Conectivo Professor: Verónica Pantoja. Lic. MSP. Kinesiologia Objetivo de la clase :Describir, Identificar y clasificar el Tejido conectivo IPCHILE - DOCENTE: Veronica Pantoja S. 2013 Tejido que
1. Qué son y como actúan los factores de crecimiento?
 FACTORES DE CRECIMIENTO. PLASMA RICO EN PLAQUETAS. 1. Qué son y como actúan los factores de crecimiento? El factor de crecimiento derivado de plaquetas (en inglés, PDGF, por platelet derived growth factor)
FACTORES DE CRECIMIENTO. PLASMA RICO EN PLAQUETAS. 1. Qué son y como actúan los factores de crecimiento? El factor de crecimiento derivado de plaquetas (en inglés, PDGF, por platelet derived growth factor)
Autoras: Leonor Prieto - Farmacéutica Mercedes Abarquero - Farmacéutica TEMA 1: LA PIEL-ESTRUCTURA Y FUNCIONES
 Autoras: Leonor Prieto - Farmacéutica Mercedes Abarquero - Farmacéutica TEMA 1: -ESTRUCTURA Y FUNCIONES Conceptos Básicos Estructura macroscópica: Recubre toda la superficie corporal, acabando donde comienzan
Autoras: Leonor Prieto - Farmacéutica Mercedes Abarquero - Farmacéutica TEMA 1: -ESTRUCTURA Y FUNCIONES Conceptos Básicos Estructura macroscópica: Recubre toda la superficie corporal, acabando donde comienzan
COAGULACIÓN SANGUÍNEA. Dr. Mynor A. Leiva Enríquez
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Respiración Nutrición y excresión
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Respiración Nutrición y excresión
MATRIZ EXTRACELULAR CONJUNTIVA. MEMBRANA BASAL
 7 MATRIZ EXTRACELULAR CONJUNTIVA. MEMBRANA BASAL ESTRUCTURA DEL TEMA: 7.1 Generalidades. 7.2 Proteoglicanos. 7.3 Glicoproteínas. 7.4 Membrana basal. 7.1. GENERALIDADES El tejido conjuntivo está formado
7 MATRIZ EXTRACELULAR CONJUNTIVA. MEMBRANA BASAL ESTRUCTURA DEL TEMA: 7.1 Generalidades. 7.2 Proteoglicanos. 7.3 Glicoproteínas. 7.4 Membrana basal. 7.1. GENERALIDADES El tejido conjuntivo está formado
La Sangre. Universidad Autónoma del Estado de Morelos Escuela de Técnicos Laboratoristas Anatomía y Fisiología
 La Sangre Universidad Autónoma del Estado de Morelos Escuela de Técnicos Laboratoristas Anatomía y Fisiología Alumna: Carpinteiro Morales Alexa Karina Semestre y grupo: 5to A2 Cuestionario 1.- Qué es la
La Sangre Universidad Autónoma del Estado de Morelos Escuela de Técnicos Laboratoristas Anatomía y Fisiología Alumna: Carpinteiro Morales Alexa Karina Semestre y grupo: 5to A2 Cuestionario 1.- Qué es la
REGENERACIÓN. Proceso de reparación tisular consistente en la neoformación del tejido preexistente
 REGENERACIÓN Proceso de reparación tisular consistente en la neoformación del tejido preexistente - Regeneración epitelial o reepitelización, sucede desde las primeras horas tras la lesión - Más rápida
REGENERACIÓN Proceso de reparación tisular consistente en la neoformación del tejido preexistente - Regeneración epitelial o reepitelización, sucede desde las primeras horas tras la lesión - Más rápida
Variedad de tejidos que se caracterizan por: CONECTAR (conectivo), UNIR, y proporcionar NUTRICIÓN, SOPORTE Y PROTECCIÓN.
 TEJIDO CONECTIVO Área Morfología Bioq, María Eugenia Biancardi GRUPO DIVERSO DE CÉLULAS INCLUÍDAS EN UNA MATRIZ EXTRACELULAR HISTOESPECÍFICA CARACTERÍSTICAS Variedad de tejidos que se caracterizan por:
TEJIDO CONECTIVO Área Morfología Bioq, María Eugenia Biancardi GRUPO DIVERSO DE CÉLULAS INCLUÍDAS EN UNA MATRIZ EXTRACELULAR HISTOESPECÍFICA CARACTERÍSTICAS Variedad de tejidos que se caracterizan por:
COAGULACIÓN SANGUÍNEA. Dr. Mynor A. Leiva Enríquez
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Nutrición y excreción Defensa:
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Nutrición y excreción Defensa:
ATLAS de HISTOLOGÍA VEGETAL y ANIMAL HISTOLOGÍA ANIMAL 3. TEJIDO CONJUNTIVO SANGRE
 ATLAS de HISTOLOGÍA VEGETAL y ANIMAL HISTOLOGÍA ANIMAL 3. TEJIDO CONJUNTIVO SANGRE Pilar Molist Manuel A. Pombal Manuel Megías Depto. de Biología Funcional y Ciencias de la Salud Facultad de Biología Universidad
ATLAS de HISTOLOGÍA VEGETAL y ANIMAL HISTOLOGÍA ANIMAL 3. TEJIDO CONJUNTIVO SANGRE Pilar Molist Manuel A. Pombal Manuel Megías Depto. de Biología Funcional y Ciencias de la Salud Facultad de Biología Universidad
Composición Líquido Elementos formes
 Composición Líquido Elementos formes Plasma Glóbulos blancos Glóbulos rojos Plaquetas Transporte de sustancias Homeostasis de los líquidos l corporales Protección TRANSPORTE O 2 desde los pulmones a los
Composición Líquido Elementos formes Plasma Glóbulos blancos Glóbulos rojos Plaquetas Transporte de sustancias Homeostasis de los líquidos l corporales Protección TRANSPORTE O 2 desde los pulmones a los
Guía de actividades de Clase II medio. Glándulas Páncreas - Suprarrenales. Nombre: Curso: Fecha:
 Guía de actividades de Clase II medio Glándulas Páncreas - Suprarrenales Nombre: Curso: Fecha: Instrucciones: 1. Desarrolla la siguiente guía con la información obtenida en clases y con apoyo de internet
Guía de actividades de Clase II medio Glándulas Páncreas - Suprarrenales Nombre: Curso: Fecha: Instrucciones: 1. Desarrolla la siguiente guía con la información obtenida en clases y con apoyo de internet
Capítulo 12 REGULACIÓN DE LA EXPRESIÓN GÉNICA. Factores de Transcripción. Metilación. Procesamiento del ARN. Post-traduccional
 REGULACIÓN DE LA EXPRESIÓN GÉNICA - Mecanismos de Regulación Regulación Procariontes Eucariontes Operón Lactosa Operón Triptofano Transcripcional Procesamiento del ARN Traduccional Post-traduccional Factores
REGULACIÓN DE LA EXPRESIÓN GÉNICA - Mecanismos de Regulación Regulación Procariontes Eucariontes Operón Lactosa Operón Triptofano Transcripcional Procesamiento del ARN Traduccional Post-traduccional Factores
En un organismo unicelular, como una bacteria o un protista, la célula única debe realizar todas las funciones necesarias para la vida.
 HISTOLOGIA HUMANA OBJETIVOS: Conocer los diferentes tipos de tejido que posee el cuerpo humano. Aprender a diferenciar los 4 tipos de tejidos fundamentales y conocer sus funciones. Conocer superficialmente
HISTOLOGIA HUMANA OBJETIVOS: Conocer los diferentes tipos de tejido que posee el cuerpo humano. Aprender a diferenciar los 4 tipos de tejidos fundamentales y conocer sus funciones. Conocer superficialmente
TEJIDO CONJUNTIVO. Generalidades. Composición Células Matriz extracelular
 Clase I TEJIDO CONJUNTIVO TEJIDO CONJUNTIVO Generalidades Composición Células Matriz extracelular Células del tejido conjuntivo Residentes (fijas): fibroblastos células reticulares células mesenquimáticas
Clase I TEJIDO CONJUNTIVO TEJIDO CONJUNTIVO Generalidades Composición Células Matriz extracelular Células del tejido conjuntivo Residentes (fijas): fibroblastos células reticulares células mesenquimáticas
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS
 FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Entender los mecanismos que regulan la Hemostasia. 2.- Clasificar los fármacos
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Entender los mecanismos que regulan la Hemostasia. 2.- Clasificar los fármacos
La Célula Animal en su Contexto Social: Interacciones intercelulares y matriz extracelular
 La Célula Animal en su Contexto Social: Interacciones intercelulares y matriz extracelular La Célula en su Contexto Social Debajo del epitelio en tubo digestivo, sistema urinario y respiratorio. Fibrous
La Célula Animal en su Contexto Social: Interacciones intercelulares y matriz extracelular La Célula en su Contexto Social Debajo del epitelio en tubo digestivo, sistema urinario y respiratorio. Fibrous
ATEROSCLEROSIS. Factores No Modificables. Factores Modificables. Dislipemias Tabaquismo Hipertensión arterial Insulino-resistencia Obesidad Diabetes
 ATEROSCLEROSIS Factores No Modificables Edad Género Antecedentes familiares Alteraciones genéticas Factores Modificables Dislipemias Tabaquismo Hipertensión arterial Insulino-resistencia Obesidad Diabetes
ATEROSCLEROSIS Factores No Modificables Edad Género Antecedentes familiares Alteraciones genéticas Factores Modificables Dislipemias Tabaquismo Hipertensión arterial Insulino-resistencia Obesidad Diabetes
NUEVAS TERAPEÚTICAS: UTILIZACIÓN DEL PLASMA RICO EN PLAQUETAS
 NUEVAS TERAPEÚTICAS: UTILIZACIÓN DEL PLASMA RICO EN PLAQUETAS Conceptos generales de Citoquinas Señales biológicas y coordinación de: Funciones celulares Factores de crecimiento Factores de crecimiento
NUEVAS TERAPEÚTICAS: UTILIZACIÓN DEL PLASMA RICO EN PLAQUETAS Conceptos generales de Citoquinas Señales biológicas y coordinación de: Funciones celulares Factores de crecimiento Factores de crecimiento
Definiciones de Inmunología
 Definiciones de Inmunología Son sustancias extrañas a nuestro organismo que desencadenan la formación de Anticuerpos (Ac). La unión entre Ag y Ac es de naturaleza no covalente. Hay complementariedad entre
Definiciones de Inmunología Son sustancias extrañas a nuestro organismo que desencadenan la formación de Anticuerpos (Ac). La unión entre Ag y Ac es de naturaleza no covalente. Hay complementariedad entre
Tejido Muscular. La célula o fibra muscular es la unidad estructural y funcional del tejido muscular
 Tejido Muscular La célula o fibra muscular es la unidad estructural y funcional del tejido muscular Cuando decimos fibra muscular no nos estamos refiriendo a un tipo de fibra extracelular, como es el caso
Tejido Muscular La célula o fibra muscular es la unidad estructural y funcional del tejido muscular Cuando decimos fibra muscular no nos estamos refiriendo a un tipo de fibra extracelular, como es el caso
INTERACCIONES CÉLULA-CÉLULA Y CÉLULA-ME. Proteínas de adhesividad celular (CAMs)
 INTERACCIONES CÉLULA-CÉLULA Y CÉLULA-ME Proteínas de adhesividad celular (CAMs) Cadherinas, selectinas, integrinas y CAMs de la superfamilia de las inmunoglobulinas Conexiones en células animales: tipos
INTERACCIONES CÉLULA-CÉLULA Y CÉLULA-ME Proteínas de adhesividad celular (CAMs) Cadherinas, selectinas, integrinas y CAMs de la superfamilia de las inmunoglobulinas Conexiones en células animales: tipos
Capítulo 36 HEMOSTASIA Y COAGULACIÓN DE LA SANGRE
 CCáát tt eeddr raa ddee FFi iissi iiool llooggí ííaa II I TTeer rcc eer r SSeemeesst ttr ree FFaaccuul llt tt aadd ddee Meeddi iicci iinnaa,, UU...AA..EE..M... 1 Capítulo 36 HEMOSTASIA Y COAGULACIÓN DE
CCáát tt eeddr raa ddee FFi iissi iiool llooggí ííaa II I TTeer rcc eer r SSeemeesst ttr ree FFaaccuul llt tt aadd ddee Meeddi iicci iinnaa,, UU...AA..EE..M... 1 Capítulo 36 HEMOSTASIA Y COAGULACIÓN DE
1. Citosol 2. Citoesqueleto 3. Cilios y flagelos 4. El centrosoma. 1. El Citosol
 1. Citosol 2. Citoesqueleto 3. Cilios y flagelos 4. El centrosoma 1. El Citosol El Citosol, también denominado hialoplasma es el medio acuoso del citoplasma en el que se encuentran inmersos los orgánulos
1. Citosol 2. Citoesqueleto 3. Cilios y flagelos 4. El centrosoma 1. El Citosol El Citosol, también denominado hialoplasma es el medio acuoso del citoplasma en el que se encuentran inmersos los orgánulos
La cicatrización es un proceso biológico encaminado
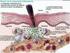 FORMACIÓNDERMATOLÓGICA La Cicatrización de las Heridas V. Lucha Fernández, V. Muñoz Mañez y B. Fornes Pujalte. Enfermeros Servicio de Dermatología-CHGUV. M. Garcia Garcerá. Biologo Servicio de Dermatología-CHGUV.
FORMACIÓNDERMATOLÓGICA La Cicatrización de las Heridas V. Lucha Fernández, V. Muñoz Mañez y B. Fornes Pujalte. Enfermeros Servicio de Dermatología-CHGUV. M. Garcia Garcerá. Biologo Servicio de Dermatología-CHGUV.
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Estructura y dinámica del citoesqueleto
 Estructura y dinámica del citoesqueleto Dr. Julio Tapia Pineda Programa de Biología Celular y Molecular ICBM, Facultad de Medicina TERAPIA OCUPACIONAL Abril 2012 Compartimentalización de una célula eucarionte
Estructura y dinámica del citoesqueleto Dr. Julio Tapia Pineda Programa de Biología Celular y Molecular ICBM, Facultad de Medicina TERAPIA OCUPACIONAL Abril 2012 Compartimentalización de una célula eucarionte
TEMA 1. ORGANIZACIÓN DEL CUERPO HUMANO
 TEMA 1. ORGANIZACIÓN DEL CUERPO HUMANO I.- NIVELES DE ORGANIZACIÓN DE LOS SERES HUMANOS. Elementos o átomos C H O N P S Moléculas sencillas H 2 O O 2 Aminoácido Monosacárido Moléculas complejas Células
TEMA 1. ORGANIZACIÓN DEL CUERPO HUMANO I.- NIVELES DE ORGANIZACIÓN DE LOS SERES HUMANOS. Elementos o átomos C H O N P S Moléculas sencillas H 2 O O 2 Aminoácido Monosacárido Moléculas complejas Células
Selectinas e Inflamación. Dr. Iván Martínez Duncker R.
 Selectinas e Inflamación Dr. Iván Martínez Duncker R. Qué es la inflamación? Estimulos nocivos causan una reacción vascular protectora llamada inflamación que puede ser aguda o crónica Diluir Destruir
Selectinas e Inflamación Dr. Iván Martínez Duncker R. Qué es la inflamación? Estimulos nocivos causan una reacción vascular protectora llamada inflamación que puede ser aguda o crónica Diluir Destruir
Repaso: Química celular (biomoléculas)
 Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
P é ptidos Gonadales. Regulación Intraovárica. Dr. Alfredo Celis L.
 P é ptidos Gonadales Regulación Intraovárica Dr. Alfredo Celis L. Foliculogenesis Folículo es unidad funcional Foliculos : Primordiales (90%) Reserva folicular Folículo primario Folículo preantral Folículo
P é ptidos Gonadales Regulación Intraovárica Dr. Alfredo Celis L. Foliculogenesis Folículo es unidad funcional Foliculos : Primordiales (90%) Reserva folicular Folículo primario Folículo preantral Folículo
Actualizaciones. Eritropoyetina
 Actualizaciones Eritropoyetina Acciones de la eritropoyetina. La eritropoyetina es una glicoproteína plasmática que estimula la eritropoyesis y actúa además sobre otras células de la sangre como los granulocitos,
Actualizaciones Eritropoyetina Acciones de la eritropoyetina. La eritropoyetina es una glicoproteína plasmática que estimula la eritropoyesis y actúa además sobre otras células de la sangre como los granulocitos,
Reparación de la vía Periodontal
 Reparación de la vía Periodontal 08-06- 09 Lorena Ponce Esta clase esta apuntada a los fenómenos biológicos que ocurren en la reparación del periodonto después de la terapia mecánica, con algunas extrapolaciones
Reparación de la vía Periodontal 08-06- 09 Lorena Ponce Esta clase esta apuntada a los fenómenos biológicos que ocurren en la reparación del periodonto después de la terapia mecánica, con algunas extrapolaciones
6. Integración n de la respuesta inmune
 Bioquímica inmunológica 6. Integración n de la respuesta inmune El timo, timo,lugar de formación n de los linfocitos T El timo se localiza entre el corazón y el esternón. Es el lugar de maduración de los
Bioquímica inmunológica 6. Integración n de la respuesta inmune El timo, timo,lugar de formación n de los linfocitos T El timo se localiza entre el corazón y el esternón. Es el lugar de maduración de los
El hígado en el obeso
 14/8/2014 INIGEM Mesa Redonda: Complicaciones en órganos «blanco» de la obesidad El hígado en el obeso Dra. Alejandra Claudia Cherñavsky nstituto de Inmunología, Genética y Metabolismo. CONICET-UBA, Buenos
14/8/2014 INIGEM Mesa Redonda: Complicaciones en órganos «blanco» de la obesidad El hígado en el obeso Dra. Alejandra Claudia Cherñavsky nstituto de Inmunología, Genética y Metabolismo. CONICET-UBA, Buenos
PLAQUETAS E INFLAMACIÓN
 PLAQUETAS E INFLAMACIÓN Simposio: Endotelio, Plaquetas, Inflamación Disertante: Elisa Malaver. Laboratorio Trombosis I. Instituto de Medicina Experimental, Academia Nacional de Medicina Relaciones financieras:
PLAQUETAS E INFLAMACIÓN Simposio: Endotelio, Plaquetas, Inflamación Disertante: Elisa Malaver. Laboratorio Trombosis I. Instituto de Medicina Experimental, Academia Nacional de Medicina Relaciones financieras:
La célula. Unidad Los seres vivos están formados por células
 La célula Unidad Los seres vivos están formados por células Definición de célula. Es la unidad anatómico y funcional de todo ser vivo. Tiene función de autoconservación y autorreproducción. Es por esto,
La célula Unidad Los seres vivos están formados por células Definición de célula. Es la unidad anatómico y funcional de todo ser vivo. Tiene función de autoconservación y autorreproducción. Es por esto,
Revisión- Opción Múltiple Procesamiento de energía
 Revisión- Opción Múltiple Procesamiento de energía 1. El mmetabolismo es considerado como las "reacciones químicas totales que ocurren dentro de un organismo". Estas reacciones químicas pueden estar vinculados
Revisión- Opción Múltiple Procesamiento de energía 1. El mmetabolismo es considerado como las "reacciones químicas totales que ocurren dentro de un organismo". Estas reacciones químicas pueden estar vinculados
Experimentos: [Ca 2+ ] media de la tensión desarrollada y representarla frente al logaritmo de [Ca 2+ ]. Determinar la EC 50.
![Experimentos: [Ca 2+ ] media de la tensión desarrollada y representarla frente al logaritmo de [Ca 2+ ]. Determinar la EC 50. Experimentos: [Ca 2+ ] media de la tensión desarrollada y representarla frente al logaritmo de [Ca 2+ ]. Determinar la EC 50.](/thumbs/52/28982569.jpg) Fisiol Hum Farmacia. (2008-2009) Dr. Guadalberto Hernández Dr. Juan Vicente.Sánchez Fisiología del músculo liso. Motilidad intrínseca. Influencia del sistema nervioso autónomo: efecto de drogas simpático
Fisiol Hum Farmacia. (2008-2009) Dr. Guadalberto Hernández Dr. Juan Vicente.Sánchez Fisiología del músculo liso. Motilidad intrínseca. Influencia del sistema nervioso autónomo: efecto de drogas simpático
METABOLISMO DE LIPIDOS
 METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
CLAUDIA OTERO V. Especialista de Producto HARVEST TERUMO COLOMBIA ANDINA
 CLAUDIA OTERO V. Especialista de Producto HARVEST TERUMO COLOMBIA ANDINA ELULAS MADRES DEFINICIÓN Es una célula que tiene la capacidad de autorrenovarse mediante divisiones mitóticas o bien continuar la
CLAUDIA OTERO V. Especialista de Producto HARVEST TERUMO COLOMBIA ANDINA ELULAS MADRES DEFINICIÓN Es una célula que tiene la capacidad de autorrenovarse mediante divisiones mitóticas o bien continuar la
Histología. Definición Tejidos: concepto Clasificación n de los tejidos a animales fundamentales: criterios morfológicos y funcionales
 Histología Definición Tejidos: concepto Clasificación n de los tejidos a animales fundamentales: criterios morfológicos y funcionales Tejido Epitelial Todos los epitelios se originan de las tres hojas
Histología Definición Tejidos: concepto Clasificación n de los tejidos a animales fundamentales: criterios morfológicos y funcionales Tejido Epitelial Todos los epitelios se originan de las tres hojas
Anatomía humana I. Epidermis
 Epidermis Es la parte más extensa y externa de la piel, formada por un tejido epitelial. Está estructurada por cinco estratos celulares: 1) estrato basal o germinativo 2) estrato espinoso 3) estrato granuloso
Epidermis Es la parte más extensa y externa de la piel, formada por un tejido epitelial. Está estructurada por cinco estratos celulares: 1) estrato basal o germinativo 2) estrato espinoso 3) estrato granuloso
Estructura celular. Teoría Celular. Cap. 4. Los organismos se componen de una o más células. La célula es la unidad más pequeña de la vida.
 Estructura celular Cap. 4 Teoría Celular Los organismos se componen de una o más células. Procesos metabólicos y de la herencia ocurren dentro de la célula. La célula es la unidad más pequeña de la vida.
Estructura celular Cap. 4 Teoría Celular Los organismos se componen de una o más células. Procesos metabólicos y de la herencia ocurren dentro de la célula. La célula es la unidad más pequeña de la vida.
Reparación de heridas cutáneas
 Rev Asoc Col Dermatol. Volumen 16, número 1, marzo de 2008, pág 29, 35. Artículo de revisión Rev Asoc Col Dermatol Reparación de heridas cutáneas Cutaneus wound healing. Joaquin Benavides. 1 1. Residente
Rev Asoc Col Dermatol. Volumen 16, número 1, marzo de 2008, pág 29, 35. Artículo de revisión Rev Asoc Col Dermatol Reparación de heridas cutáneas Cutaneus wound healing. Joaquin Benavides. 1 1. Residente
INMUNOMODULADORES EN ÉQUIDOS
 INMUNOMODULADORES EN ÉQUIDOS Patología Médica y de la Nutrición 4º Curso de Licenciatura Veterinaria Facultad de Veterinaria de Zaragoza Maldonado Sacasa,, Guillermo Mediano Martín-Maestro, Maestro, Diego
INMUNOMODULADORES EN ÉQUIDOS Patología Médica y de la Nutrición 4º Curso de Licenciatura Veterinaria Facultad de Veterinaria de Zaragoza Maldonado Sacasa,, Guillermo Mediano Martín-Maestro, Maestro, Diego
Anexo al TEMA 3: Factores de crecimiento
 E. Murakami Anexo al TEMA 3: Factores de crecimiento Enero de 2007. Revisado Enero de 2008. Factor de Crecimiento Epitelial (EGF) / Factor de Crecimiento Transformante alfa (TGF-alpha) Factor de Crecimiento
E. Murakami Anexo al TEMA 3: Factores de crecimiento Enero de 2007. Revisado Enero de 2008. Factor de Crecimiento Epitelial (EGF) / Factor de Crecimiento Transformante alfa (TGF-alpha) Factor de Crecimiento
PRACTICAS 9-10. UNIDAD III TEJIDO CONJUNTIVO
 UNIVERSIDAD DE CARABOBO FACULTAD DE CIENCIAS DE LA SALUD- SEDE CARABOBO ESCUELA DE CIENCIAS BIOMÉDICAS Y TECNOLÓGICAS DEPARTAMENTO DE CIENCIAS MORFOLÓGICAS Y FORENSES HISTOLOGÍA Y EMBRIOLOGÍA PRACTICAS
UNIVERSIDAD DE CARABOBO FACULTAD DE CIENCIAS DE LA SALUD- SEDE CARABOBO ESCUELA DE CIENCIAS BIOMÉDICAS Y TECNOLÓGICAS DEPARTAMENTO DE CIENCIAS MORFOLÓGICAS Y FORENSES HISTOLOGÍA Y EMBRIOLOGÍA PRACTICAS
República Bolivariana de Venezuela. Ministerio del Poder Popular para la Educación U.E. CABIMBU. Valencia Edo. Carabobo. GUIA SISTEMA CIRCULATORIO
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. CABIMBU Valencia Edo. Carabobo. GUIA SISTEMA CIRCULATORIO 1ER AÑO Marzo 2013 APARATO CIRCULATORIO Es un conjunto de
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. CABIMBU Valencia Edo. Carabobo. GUIA SISTEMA CIRCULATORIO 1ER AÑO Marzo 2013 APARATO CIRCULATORIO Es un conjunto de
Láminas epiteliales y uniones célula a célula
 Láminas epiteliales y uniones célula a célula Tomado y modificado de ALBERTS. B. BRAY D. JOHNSON A. LEWIS J. RAFF M. ROBERTS K. WALTER P.: Introducción a la Biología Celular (2ª edición 2006) Editorial
Láminas epiteliales y uniones célula a célula Tomado y modificado de ALBERTS. B. BRAY D. JOHNSON A. LEWIS J. RAFF M. ROBERTS K. WALTER P.: Introducción a la Biología Celular (2ª edición 2006) Editorial
TEÒRICO 4 INMUNOLOGÌA 2010
 TEÒRICO 4 INMUNOLOGÌA 2010 Indique el enunciado incorrecto: a) Los queratinocitos expresan receptores de reconocimiento de patrones (RRP). b) La proteína C reactiva es una proteína de fase aguda y un RRP.
TEÒRICO 4 INMUNOLOGÌA 2010 Indique el enunciado incorrecto: a) Los queratinocitos expresan receptores de reconocimiento de patrones (RRP). b) La proteína C reactiva es una proteína de fase aguda y un RRP.
UNIVERSIDAD SANTO TOMÁS SECCIONAL BUCARAMANGA. División de Ingenierías - Facultad de Química Ambiental
 UNIVERSIDAD SANTO TOMÁS SECCIONAL BUCARAMANGA División de Ingeniería Facultad de Química Ambiental Nombre de Asignatura: BIOLOGÍA Àrea: Ciencias Exactas y Naturales- Biología Créditos: 3 Código de Asignatura:
UNIVERSIDAD SANTO TOMÁS SECCIONAL BUCARAMANGA División de Ingeniería Facultad de Química Ambiental Nombre de Asignatura: BIOLOGÍA Àrea: Ciencias Exactas y Naturales- Biología Créditos: 3 Código de Asignatura:
Antígeno completo (inmunógeno)= inmunogenicidad+ antigenicidad
 TEMA 5. Antígenos e inmunógenos. Definición de: Antígeno, Inmunógeno, Hapteno, Tolerógeno, Alergeno, Vacuna, Toxoide. Epitopos o determinantes antigénicos. Factores que afectan a la inmunogenicidad. Antígenos
TEMA 5. Antígenos e inmunógenos. Definición de: Antígeno, Inmunógeno, Hapteno, Tolerógeno, Alergeno, Vacuna, Toxoide. Epitopos o determinantes antigénicos. Factores que afectan a la inmunogenicidad. Antígenos
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Respuesta Inmune en la Enfermedad Infecciosa. T.M. Carlos ivovic O. Profesor de Microbiología Escuela de Medicina Universidad Pedro de Valdivia
 Respuesta Inmune en la Enfermedad Infecciosa T.M. Carlos ivovic O. Profesor de Microbiología Escuela de Medicina Universidad Pedro de Valdivia Curso de la Enfermedad Infecciosa Factores Determinantes de
Respuesta Inmune en la Enfermedad Infecciosa T.M. Carlos ivovic O. Profesor de Microbiología Escuela de Medicina Universidad Pedro de Valdivia Curso de la Enfermedad Infecciosa Factores Determinantes de
PATÓGENA: Entamoeba histolytica COMENSALES: diferenciar, índice de fecalismo.
 AMEBIASIS PATÓGENA: Entamoeba histolytica COMENSALES: diferenciar, índice de fecalismo. Citoplasma Dos zonas: Endoplasma: granuloso Ectoplasma: hialino Se movilizan por pseudópodos. Pseudópodos: extensiones
AMEBIASIS PATÓGENA: Entamoeba histolytica COMENSALES: diferenciar, índice de fecalismo. Citoplasma Dos zonas: Endoplasma: granuloso Ectoplasma: hialino Se movilizan por pseudópodos. Pseudópodos: extensiones
HISTOLOGÍA ANIMAL BIOLOGÍA 1º DE BACHILLERATO
 HISTOLOGÍA ANIMAL BIOLOGÍA 1º DE BACHILLERATO TEJIDO EPITELIAL Sólo está constituido por células que están muy próximas unas a otras. Entre las células existen mecanismos de unión que son especializaciones
HISTOLOGÍA ANIMAL BIOLOGÍA 1º DE BACHILLERATO TEJIDO EPITELIAL Sólo está constituido por células que están muy próximas unas a otras. Entre las células existen mecanismos de unión que son especializaciones
LA CÉLULA Y SUS ORGANELOS. Colegio Internacional Montessori Ciencias Naturales-1ro Básico Walter Moscoso Zschech
 LA CÉLULA Y SUS ORGANELOS Colegio Internacional Montessori Ciencias Naturales-1ro Básico Walter Moscoso Zschech LA CÉLULA Es la unidad básica de la vida. Según la teoría celular todos los organismos vivos:
LA CÉLULA Y SUS ORGANELOS Colegio Internacional Montessori Ciencias Naturales-1ro Básico Walter Moscoso Zschech LA CÉLULA Es la unidad básica de la vida. Según la teoría celular todos los organismos vivos:
Inmunología de transplantes. Dra. Cecilia Sepúlveda C. 2 mayo 2001
 Inmunología de transplantes Dra. Cecilia Sepúlveda C. 2 mayo 2001 Definiciones básicas Transplante: proceso de tomar cél, tejidos u órganos (el Tx o injerto) de un individuo y colocarlos en otro diferente
Inmunología de transplantes Dra. Cecilia Sepúlveda C. 2 mayo 2001 Definiciones básicas Transplante: proceso de tomar cél, tejidos u órganos (el Tx o injerto) de un individuo y colocarlos en otro diferente
Es la capacidad de realizar un trabajo. A pesar que existen varias formas de energía: química, luminosa, mecánica, etc., solo hay dos tipos básicos:
 Es la capacidad de realizar un trabajo. A pesar que existen varias formas de energía: química, luminosa, mecánica, etc., solo hay dos tipos básicos: Potencial: es la capacidad de realizar trabajo como
Es la capacidad de realizar un trabajo. A pesar que existen varias formas de energía: química, luminosa, mecánica, etc., solo hay dos tipos básicos: Potencial: es la capacidad de realizar trabajo como
Servicio de Cirugía Plástica y Reparadora Hospital 12 de Octubre- Madrid
 Servicio de Cirugía Plástica y Reparadora Hospital 12 de Octubre- Madrid ÍNDICE Etiopatogenía/ Fisiopatología de la Respuesta inflamatoria local. Infecciones piógenas de la piel: Celulitis/ Erisipela Foliculitis
Servicio de Cirugía Plástica y Reparadora Hospital 12 de Octubre- Madrid ÍNDICE Etiopatogenía/ Fisiopatología de la Respuesta inflamatoria local. Infecciones piógenas de la piel: Celulitis/ Erisipela Foliculitis
David H. Solo sé que nada sé, pero aún sé más de lo que se me ignora Sócrates
 CITOQUINAS David H. Solo sé que nada sé, pero aún sé más de lo que se me ignora Sócrates Las citoquinas son proteínas (polipéptidos) secretadas por las células de la inmunidad innata y de la inmunidad
CITOQUINAS David H. Solo sé que nada sé, pero aún sé más de lo que se me ignora Sócrates Las citoquinas son proteínas (polipéptidos) secretadas por las células de la inmunidad innata y de la inmunidad
Son estructuras que rodean a la membrana plasmática. Sus funciones son: la unión entre células y mantener la estructura celular.
 1 Envueltas Externas Son estructuras que rodean a la membrana plasmática. Sus funciones son: la unión entre células y mantener la estructura celular. Pared Vegetal Es una cubierta gruesa y rígida que rodea
1 Envueltas Externas Son estructuras que rodean a la membrana plasmática. Sus funciones son: la unión entre células y mantener la estructura celular. Pared Vegetal Es una cubierta gruesa y rígida que rodea
Tema 24 Sistema cardiovascular. Ciclo cardiaco. Sístole y diástole. Fases.
 Tema 24 Sistema cardiovascular. Ciclo cardiaco. Sístole y diástole. Fases. 1. Músculo cardiaco. 1.1. Anatomía del músculo cardiaco. 2. Actividad eléctrica del corazón. 2.1.Potencial de acción en el miocardio.
Tema 24 Sistema cardiovascular. Ciclo cardiaco. Sístole y diástole. Fases. 1. Músculo cardiaco. 1.1. Anatomía del músculo cardiaco. 2. Actividad eléctrica del corazón. 2.1.Potencial de acción en el miocardio.
BIOQUIMICA DE LA VISIÓN
 BIOQUIMICA DE LA VISIÓN Bloque 1: Biomoléculas 1.El agua y los fluidos oculares. Propiedades fisicoquímicas de los fluidos oculares. 2.Carbohidratos: características generales. Importancia de los carbohidratos
BIOQUIMICA DE LA VISIÓN Bloque 1: Biomoléculas 1.El agua y los fluidos oculares. Propiedades fisicoquímicas de los fluidos oculares. 2.Carbohidratos: características generales. Importancia de los carbohidratos
Fisiología de la grasa y celulitis Principios de la acción de CRYO MAX Guía de tratamiento
 Fisiología de la grasa y celulitis Principios de la acción de CRYO MAX Guía de tratamiento CAPA DE GRASA EN LA PIEL Como una parte especial de organización del cuerpo, se distribuye en varias partes debajo
Fisiología de la grasa y celulitis Principios de la acción de CRYO MAX Guía de tratamiento CAPA DE GRASA EN LA PIEL Como una parte especial de organización del cuerpo, se distribuye en varias partes debajo
1 Los niveles de organización
 1 La organización del ser humano 1 Los niveles de organización LOS NIVELES DE ORGANIZACIÓN DE LOS SERES VIVOS de menor a mayor complejidad, son Nivel atómico y molecular Los bioelementos, como el carbono,
1 La organización del ser humano 1 Los niveles de organización LOS NIVELES DE ORGANIZACIÓN DE LOS SERES VIVOS de menor a mayor complejidad, son Nivel atómico y molecular Los bioelementos, como el carbono,
Membrana (IV parte) Introducción. Zónula ocluyente. Prof. Iván Rebolledo
 Membrana (IV parte) Prof. Iván Rebolledo Introducción Una propiedad fundamental de las células que conforman un epitelio es su extenso, firme e impenetrable sistema de unión para formar láminas continuas.
Membrana (IV parte) Prof. Iván Rebolledo Introducción Una propiedad fundamental de las células que conforman un epitelio es su extenso, firme e impenetrable sistema de unión para formar láminas continuas.
Se ha documentado reciéntenme mayor riesgo de ruptura del tendón con GCI orales y además mayor riesgo de fractura de columna con GCI epidurales.
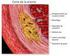 RESEÑA CLUB DE REVISTA POSGRADO DE MEDICINA DE LA ACTIVIDAD FÍSICA Y EL DEPORTE - FUCS TÍTULO DEL ARTÍCULO AUTOR Los riesgos y beneficios de tratamiento con glucocorticoides en tendinopatía: una revisión
RESEÑA CLUB DE REVISTA POSGRADO DE MEDICINA DE LA ACTIVIDAD FÍSICA Y EL DEPORTE - FUCS TÍTULO DEL ARTÍCULO AUTOR Los riesgos y beneficios de tratamiento con glucocorticoides en tendinopatía: una revisión
La oficina de farmacia y el cáncer Terapias oncológicas. Manipulación de antineoplásicos, recomendaciones al paciente
 La oficina de farmacia y el cáncer Terapias oncológicas. Manipulación de antineoplásicos, recomendaciones al paciente que recibe quimioterapia Farmacéuticos: Coassolo Alicia - Imhoff Andrea Schonfeld Jose
La oficina de farmacia y el cáncer Terapias oncológicas. Manipulación de antineoplásicos, recomendaciones al paciente que recibe quimioterapia Farmacéuticos: Coassolo Alicia - Imhoff Andrea Schonfeld Jose
Estamos formados por células
 SESIÓN Nº 01 Estamos formados por células Lo que debo lograr: Identificar a la célula como unidad básica de los seres vivos, reconociendo algunos componentes básicos. Identificar en una representación
SESIÓN Nº 01 Estamos formados por células Lo que debo lograr: Identificar a la célula como unidad básica de los seres vivos, reconociendo algunos componentes básicos. Identificar en una representación
Organización Funcional y el Medio Interno
 Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
Teoría celular (1) Idea: la célula es la unidad básica de la vida
 LA CÉLULA Tema 2 Teoría celular (1) Idea: la célula es la unidad básica de la vida Primeras células observadas. Celdillas de corcho (R. Hooke, 1665) Animales microscópicos (A. Van Leeuwenhoek,1675) todos
LA CÉLULA Tema 2 Teoría celular (1) Idea: la célula es la unidad básica de la vida Primeras células observadas. Celdillas de corcho (R. Hooke, 1665) Animales microscópicos (A. Van Leeuwenhoek,1675) todos
7. Respuesta del sistema inmune frente a agentes patógenos y tumores.
 Bioquímica inmunológica 7. Respuesta del sistema inmune frente a agentes patógenos y tumores. Donde y cómo c tiene lugar la respuesta inmune? Donde tiene lugar la captación n de antígenos? Los antígenos
Bioquímica inmunológica 7. Respuesta del sistema inmune frente a agentes patógenos y tumores. Donde y cómo c tiene lugar la respuesta inmune? Donde tiene lugar la captación n de antígenos? Los antígenos
sus inmediaciones, que afectan sólo a otras células cercanas. sus inmediaciones, que afectan sólo a otras células cercanas.
 BANCO DE PREGUNTAS BIOLOGÍA 8 MULTIPLE CHOICE. Choose the one alternative that best completes the statement or answers the question. 1) Los esteroides anabólicos son 1) A) indetectables después de 24 horas.
BANCO DE PREGUNTAS BIOLOGÍA 8 MULTIPLE CHOICE. Choose the one alternative that best completes the statement or answers the question. 1) Los esteroides anabólicos son 1) A) indetectables después de 24 horas.
Nombres alternativos de la Respuesta Inmune Adaptativa
 Nombres alternativos de la Respuesta Inmune Adaptativa Inmunidad Adaptativa: Porque se produce como respuesta a la infección y se adapta a esta Inmunidad Específica: Porque es capaz de distinguir entre
Nombres alternativos de la Respuesta Inmune Adaptativa Inmunidad Adaptativa: Porque se produce como respuesta a la infección y se adapta a esta Inmunidad Específica: Porque es capaz de distinguir entre
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
ESTUDIO TECNICO ANVICAR
 EFECTIVIDAD DEL OXIDO DE ZINC EN EL TRATAMIENTO Y LA PREVENCION DE LESIONES EN LA PIEL ESTUDIO TECNICO ANVICAR DR. ANTONIO VICENTE CARVAJAL SOLANO INTRODUCCION Son muchas las investigaciones que se han
EFECTIVIDAD DEL OXIDO DE ZINC EN EL TRATAMIENTO Y LA PREVENCION DE LESIONES EN LA PIEL ESTUDIO TECNICO ANVICAR DR. ANTONIO VICENTE CARVAJAL SOLANO INTRODUCCION Son muchas las investigaciones que se han
Inmunidad Innata y Adaptativa
 Inmunidad Innata y Adaptativa Nombre: Curso: Fecha: Unidad : Microorganismos y Sistemas de defensa Objetivo de la guía Comprender los diferentes mecanismos de inmunidad, comparando y reconociendo la importancia
Inmunidad Innata y Adaptativa Nombre: Curso: Fecha: Unidad : Microorganismos y Sistemas de defensa Objetivo de la guía Comprender los diferentes mecanismos de inmunidad, comparando y reconociendo la importancia
