PROTOCOLO DE ENSAYO CLÍNICO. Fármacos: Lenalidomida (Revlimid ) y MLN9708. Código de protocolo: GEM2014MAIN. Fecha de protocolo: 20 de mayo de 2014
|
|
|
- Veronica Maldonado Carmona
- hace 8 años
- Vistas:
Transcripción
1 PROTOCOLO DE ENSAYO CLÍNICO Fármacos: Lenalidomida (Revlimid ) y MLN9708. Código de protocolo: GEM2014MAIN Fecha de protocolo: 20 de mayo de 2014 Título del estudio: Estudio fase III nacional, multicéntrico, abierto, aleatorizado, de tratamiento de mantenimiento con Lenalidomida y dexametasona versus Lenalidomida, dexametasona y MLN9708 tras trasplante autólogo de progenitores hematopoyéticos para pacientes con mieloma múltiple sintomático de nuevo diagnóstico. Fase de desarrollo: III Número de EudraCT: Promotor: Fundación PETHEMA Coordinador del ensayo: Dr. Joan Bladé, Hospital Clínico de Barcelona En colaboración con los co-investigadores: Dra. Laura Rosiñol, Hospital Clínico, Barcelona Dr. Juan José Lahuerta, Hospital Doce de Octubre, Madrid Dr. Jesús San Miguel, Clínica Universitária de Navarra, Pamplona Dr. Javier de la Rubia, Hospital La Fe, Valencia Dra. Mª Victoria Mateos, Hospital Clínico, Salamanca ENTIDADES COLABORADORAS: Celgene, Millennium CONFIDENCIAL PROPIEDAD DE FUNDACIÓN PETHEMA NO PUEDE SER UTILIZADO, DIVULGADO O PUBLICADO SIN EL CONSENTIMIENTO DE LA FUNDACIÓN PETHEMA. 1
2 PÁGINA DE FIRMAS DEL PROTOCOLO Código de protocolo: GEM2014MAIN He leído este protocolo y acepto supervisar y dirigir la realización de este ensayo de acuerdo con todas las estipulaciones del protocolo, consentimiento informado, directrices de la buena práctica clínica e ICH y de la Declaración de Helsinki. Firma del personal de Fundación PETHEMA Dr. J. Bladé (Coordinador del ensayo) Firma Fecha Dr. Joaquín Díaz Mediavilla (Representante F. PETHEMA) Firma Fecha Investigador Principal: Nombre Firma Fecha 2
3 LISTA DE ABREVIATURAS Abreviatura AA AAG ALT AST CEIC CM CRD CTC ECOG EMR G-CSF GEM ICH IF IMWG IV LSN Mg Ml MM mm 3 Mmol MO NCI NYHA PH RC RP SAE sflc SG SLP SNMP VGPR Definición Acontecimiento Adverso Acontecimiento Adverso Grave Alanina transaminasa Aspartato transaminasa Comité Ético de Investigación Clinica Componente Monoclonal Cuaderno de Recogida de Datos (NCI) Criterios de toxicidad común Eastern Cooperative Oncology Group Enfermedad Minima Residual Granulocite-colony stimulating factor Grupo Español de Mieloma International Conference on Harmonisation Inmunofijación International Myeloma Working Group Intravenoso Limite Superior de Normalidad Miligramo Mililitro Mieloma Múltiple Milímetro cúbico Milimol Médula ósea Instituto Nacional del Cáncer New York Heart Association Progenitores Hematopoyeticos Remisión completa Remisión parcial Serious Adverse Event Cadenas ligeras libres en suero Supervivencia Global Supervivencia Libre de Progresión Segundas Neoplasias Malignas Primarias Very Good Partial Response 3
4 1. RESUMEN 1.1. Tipo de solicitud Ensayo clínico con un con un producto en fase de investigación clínica (PEI) Identificación del promotor Fundación PETHEMA CIF: G Representante: Dr. Joaquín Díaz Mediavilla Servicio de Hematología Hospital Clínico San Carlos C/ Profesor Martín Lagos s/n Madrid Telf: Fax: Correo electrónico: 1.3. Título del ensayo clínico Estudio fase III nacional, multicéntrico, abierto, aleatorizado, de tratamiento de mantenimiento con Lenalidomida y dexametasona versus Lenalidomida, dexametasona y MLN9708 tras trasplante autólogo de progenitores hematopoyéticos para pacientes con mieloma múltiple sintomático de nuevo diagnóstico Código del protocolo GEM2014MAIN 1.5. Coordinadores del ensayo Dr. J. Bladé Servicio de Hematología Hospital Clínic Villarroel, Barcelona, España Telf:
5 En colaboración con: Dra. Laura Rosiñol Servicio de Hematología Hospital Clínic Villarroel, Barcelona, España Telf: Dr Juan José Lahuerta Servicio de Hematología Hospital Universitario 12 de Octubre Ctra. Andalucía, Km 5, Madrid Telf: Drs. Jesús San Miguel Servicio de Hematología Clínica Universitaria de Navarra Av. Pio XII, Pamplona / Iruña Telf: María Victoria Mateos Servicio de Hematología Hospital de Salamanca Paseo de San Vicente, Salamanca Telf: Dr. Javier de la Rubia Servicio de Hematología Hospital La Fe C/Bulevar Sur, s/n Valencia Telf:
6 1.6. Nombre y calificación de las personas responsables de la monitorización Trial Form Support (TFS) 1.7. Fármacos experimentales y control: dosis, forma farmacéutica, vía de administración y grupo terapéutico Fármaco experimental: Lenalidomida (Revlimid ) Forma farmacéutica: cápsulas Vía de administración: oral Grupo terapéutico: inmunomodulador (L04AX04) Fármaco experimental: MLN9708 Forma farmacéutica: capsulas Vía de administración: oral Grupo terapéutico: Inhibidor del proteasoma. Antineoplásicos (L01XX32) 1.8. Fase del ensayo clínico Fase III 1.9. Objetivos del ensayo Los objetivos primarios de este estudio son: Impacto en la supervivencia libre de progresión (SLP) al añadir MLN9708 al tratamiento de mantenimiento postrasplante con Lenalidomida/dexametasona en pacientes con mieloma múltiple. Los objetivos secundarios de este estudio son: Evaluar la evolución y el significado clínico de la enfermedad mínima residual (EMR) desde el inicio del mantenimiento y anualmente durante 5 años. Supervivencia global (SG) Evaluar la seguridad y tolerabilidad del tratamiento de mantenimiento. 6
7 1.10. Diseño Este protocolo es un estudio fase III, nacional, multicéntrico, comparativo, abierto y aleatorizado para comparar la SLP de dos esquemas de mantenimiento postrasplante (Lenalidomida/dexametasona vs. Lenalidomida/dexametasona/MLN9708). Todos los pacientes incluídos deberán haber sido homogéneamente tratados con VRD-GEM de inducción, trasplante autólogo de progenitores hematopoyéticos acondicionado con Melfalán-200 o bien con Busulfan endovenoso junto a melfalan-140 y consolidación con VRD-GEM (ensayo clínico GEM2012MENOS65). El período pre-tratamiento incluye la visita de selección en la que se cumplimenta el consentimiento informado por escrito para participar en el estudio. Posteriormente se evalúa al paciente para determinar su elegibilidad. Los procedimientos para la selección se realizarán en un período de 21 días antes de la primera dosis de medicación (días -21 al 0). Todos los procedimientos del período pre-tratamiento se realizarán tras la finalización de los 2 ciclos de consolidación postrasplante con VRD coincidiendo con la visita final de estudio del ensayo clínico GEM2012MENOS65. En el periodo de tratamiento los pacientes elegibles serán incluidos en el estudio y recibirán tratamiento de mantenimiento con Lenalidomida / dexametasona versus Lenalidomida /dexametasona /MLN9708. Cada ciclo tendrá una duración de 28 días. La rama A de tratamiento consistirá en la administración de Lenalidomida 15 mg/día/oral los días 1-21 y dexametasona 20 mg/día los días 1-4 y 9-12 por vía oral durante un período de dos años. La rama B de mantenimiento será igual a la rama A con la adición de MLN9708 durante los dos años de mantenimiento, a la dosis de 4 mg/día los días 1, 8 y 15 del ciclo. Los pacientes con EMR negativa a los dos años de tratamiento de mantenimiento finalizarán el tratamiento. Los pacientes con EMR positiva seguirán con el tratamiento con Lenalidomida/dexametasona hasta completar 5 años de mantenimiento. En este caso, la dexametasona de 20 mg/d se administrará sólo los días 1-4 del ciclo mientras que la dosis de Lenalidomida no se modificará (siempre que no fuera preciso para el tratamiento de efectos adversos). Una vez finalizada la fase de tratamiento activo, los pacientes entrarán en la fase de seguimiento a largo plazo en que se visitarán cada 3 meses para evaluación de la progresión y de la supervivencia Enfermedad en estudio Mieloma múltiple (MM). 7
8 1.12. Variables principales de valoración Las variables de eficacia principales son: Supervivencia libre de progresión (SLP) tras los dos regímenes de mantenimiento. Las variables de eficacia secundaria son: Estudios secuenciales de enfermedad mínima residual negativa (EMR) al inicio y anual durante 5 años. Supervivencia global desde el inicio del mantenimiento. Evaluar la seguridad y tolerabilidad del tratamiento de mantenimiento Población del estudio Población en estudio Pacientes con mieloma múltiple sintomático de nuevo diagnóstico que hayan sido tratados previamente dentro del ensayo clínico GEM2012MENOS65, y que tras completar las fases iniciales del tratamiento (inducción, trasplante autólogo y consolidación) presenten al menos una respuesta mínima y no toxicidad limitante atribuible a la Lenalidomida, bortezomib, dexametasona o al trasplante. Número de pacientes Se incluirán al menos 316 pacientes. La inclusión será competitiva, por lo que no se prevé un número limitado de pacientes por centro participante Duración del tratamiento Los pacientes incluidos en el ensayo recibirán tratamiento de mantenimiento con ciclos mensuales durante dos años. Aquellos pacientes que al finalizar el mantenimiento persistan con EMR positiva continuarán con mantenimiento con Lenalidomida/dexametasona hasta completar 5 años de mantenimiento Calendario y fecha prevista de finalización El inicio del ensayo está previsto aproximadamente para septiembre de 2014; se estima que el reclutamiento estará finalizado en septiembre de 2018, de forma que el último paciente reclutado complete los dos años de mantenimiento en septiembre de El informe final deberá ser realizado antes de diciembre de
9 2. INDICE PÁGINAS DE FIRMAS DEL PROTOCOLO..2 LISTA DE ABREVIATURAS RESUMEN Tipo de solicitud Identificación del promotor Título den ensayo clínico Código del protocolo Coordinadores del ensayo Nombre y calificación de las personas responsables de la monitorización Fármacos experimentales y control: dosis, forma farmacéutica, vía de administración y grupo terapéutico Fase del ensayo clínico Objetivos del ensayo Diseño Enfermedad en estudio Variables principales de valoración Población del estudio Duración del tratamiento Calendario y fecha prevista de finalización INDICE INFORMACIÓN GENERAL Identificación del ensayo Código de protocolo Título del ensayo Tipo de ensayo clínico Descripción de los productos del ensayo Datos relativos al promotor Identificación del monitor Duración prevista del ensayo Número de pacientes previstos Lista de tablas en el texto INTRODUCCION Y JUSTIFICACIÓN DEL ESTUDIO Antecedentes científicos Repaso general del mieloma múltiple Tratamiento actual del mieloma múltiple Justificación del estudio Objetivos del ensayo Objetivos Primarios Objetivos secundarios
10 . 5. TIPO DE ENSAYO Diseño global Plan de estudio Procedimiento del estudio POBLACIÓN OBJETO DEL ESTUDIO Criterios de inclusión Criterios de exclusión Número de sujetos previstos Retirada de los pacientes del ensayo DESCRIPCIÓN DEL TRATAMIENTO DEL ENSAYO Materiales del ensayo clínico Preparación, cuidados y almacenamiento de los fármacos del ensayo Administración y esquema de tratamiento Modificación de dosis y retrasos Lenalidomida Dexametasona MLN Envasado y etiquetado Tratamiento de soporte Tratamiento de los efectos adversos Medicaciones permitidas Medicaciones prohibidas Precauciones y restricciones Cumplimiento del tratamiento Riesgos asociados a los medicamentos experimentales DESARROLLO DEL ENSAYO Y EVALUACIÓN DE LA RESPUESTA Variables principales y secundarias Valoración de la respuesta ACONTECIMIENTOS ADVERSOS Información mínima Acontecimientos adversos Acontecimientos adversos graves (AAG) Calificación de un acontecimiento adverso Procedimientos para la comunicación de AAG del investigador al promotor Notificación a la Autoridades Sanitarias y a los Comités Éticos Embarazo Mujeres con capacidad de gestación Varones
11 10. ASPECTOS ÉTICOS Buena práctica clínica Consideraciones éticas Información al paciente y consentimiento informado Confidencialidad de los pacientes Cumplimiento del protocolo Finalización prematura del estudio Responsabilidad y seguro CONSIDERACIONES PRÁCTICAS Responsabilidades de todos los participantes en el ensayo Investigador Monitor Promotor Auditoria Contabilidad de la medicación Custodia de los registros Publicaciones de los resultados del ensayo y uso de la información Normativa básica del ensayo Condiciones de publicación del grupo PETHEMA ANÁLISIS ESTADÍSTICO Estimación del tamaño de la muestra Población para el análisis Procedimientos para el manejo de los datos inexistentes, no usados y confusos Métodos estadísticos Análisis de eficacia Comparaciones basales Procedimientos para la comunicación de desviaciones del plan estadístico original Análisis preliminar REFERENCIAS BIBLIOGRÁFICAS ANEXOS ANEXO 1: ESQUEMA DE VISITAS. 63 ANEXO 2: ESCALAS ECOG Y KARNOFSKY PARA EL ESTADO GENERAL...64 ANEXO 3: CRITERIOS DIAGNÓSTICOS DE MIELOMA ANEXO 4: CRITERIOS DE RESPUESTA ANEXO 5: CENTRALIZACIÓN DE MUESTRAS ANEXO 6: DECLARACIÓN DE HELSINKI ANEXO 7: PROGRAMA DE PREVENCIÓN DE EMBARAZO (PPE)-LENALIDOMIDA. 75 ANEXO 8: FORMULARIO PARA REPORTAR EFECTOS ADVERSOS GRAVES.85 ANEXO 9: FORMULARIO PARA REPORTAR EMBARAZOS
12 3. INFORMACIÓN GENERAL 3.1. Identificación del ensayo Código de protocolo GEM2014MAIN Título del ensayo Estudio fase III nacional, multicéntrico, abierto, aleatorizado, de tratamiento de mantenimiento con Lenalidomida y dexametasona versus Lenalidomida, dexametasona y MLN9708 tras trasplante autólogo de progenitores hematopoyético para pacientes con mieloma múltiple sintomático de nuevo diagnóstico Tipo de ensayo clínico Ensayo clínico con un fármaco en nuevas condiciones de uso Descripción de los productos del ensayo Lenalidomida (Revlimid ) Cápsulas duras de 15 mg, 10 mg y 5 mg Administración oral Celgene MLN9708 (Ixazomib) Cápsulas de 4,0, 3,0 y 2,3 mg Administración oral Millennium: The Takeda Oncology Company 3.4. Datos relativos al promotor Fundación PETHEMA CIF: G Representante: Dr. Joaquín Díaz Mediavilla Servicio de Hematología Hospital Clínico San Carlos C/Profesor Martín Lagos s/n Madrid Telf: Fax: Correo electrónico: pethema@pethema.es 12
13 3.5. Identificación del monitor Trial Form Support (TFS) Dirección: C/Arturo Soria, 336, 7º Izda Madrid Telf: Fax: Responsables principales: Beatriz Lastra/ Begoña García Móvil: / Correos electrónicos: beatriz.lastra@tfscro.com /begona.garcia@tfscro.com 3.6. Duración prevista del ensayo Inclusión: desde septiembre de 2014 hasta septiembre de 2018 Periodo de tratamiento activo: desde septiembre de 2014 hasta septiembre de 2020 Informe final: antes de diciembre de Número de pacientes previstos 316 pacientes Lista de tablas en el texto Tabla 1: Niveles de ajuste de dosis Tabla 2: Modificaciones de dosis de Lenalidomida y MLN9708 por trombocitopenia intraciclo Tabla 3: Modificaciones de dosis de Lenalidomida y MNL9708 por neutropenia intraciclo Tabla 4: Ajustes de dosis de Lenalidomida y MLN9708 por rash cutáneo Tabla 5: Manejo de la neuropatía periférica relacionada con MLN9708 Tabla 6: Modificaciones de dosis de Lenalidomida por insuficiencia renal 4. INTRODUCCIÓN Y JUSTIFICACIÓN DEL ESTUDIO 4.1. Antecedentes científicos Repaso general del mieloma múltiple El mieloma múltiple (MM) es una neoplasia de células B en sus últimos estadios de maduración (células plasmáticas). Representa la segunda neoplasia hematológica más común con una incidencia anual de aproximadamente 4 casos por habitantes. El MM sigue siendo una enfermedad incurable. A medida que la enfermedad avanza, la disminución de la resistencia a las infecciones, la importante destrucción del esqueleto (con dolores óseos, fracturas patológicas e hipercalcemia), la anemia, la insuficiencia renal y, con menor frecuencia, las complicaciones neurológicas y la 13
14 hiperviscosidad son responsables de la morbilidad y posterior mortalidad de estos pacientes¹. La supervivencia de los pacientes con MM ha mejorado significativamente en los últimos años, especialmente para aquellos pacientes diagnosticados a partir del año 2001². Esta mejoría en la supervivencia se ha observado fundamentalmente en los pacientes jóvenes, menores de 65 años y candidatos a recibir un trasplante autólogo, gracias, en parte, a la introducción de los nuevos fármacos. Sin embargo, incluso en los pacientes que han recibido los nuevos fármacos durante la inducción pretrasplante, la SLP se sitúa alrededor de los 33 meses³, hecho que justifica la búsqueda de nuevas opciones de tratamiento para mejorar el pronóstico de esta enfermedad Tratamiento actual del mieloma múltiple El tratamiento de elección de los pacientes jóvenes con mieloma múltiple (MM) consiste en un tratamiento de inducción seguido de una intensificación con altas dosis de quimioterapia y trasplante de progenitores hematopoyéticos (TASP). Sin embargo, la obtención de la remisión completa (RC) postrasplante es crucial para obtener una SLP y SG prolongadas 4. Así, en la experiencia del MD Anderson, la supervivencia mediana de los pacientes en RC postrasplante oscila de 8 a 14 años frente a tan sólo 4-5 años para los pacientes en respuesta parcial 5,6. En un estudio del grupo español se demuestra que la obtención de la RC postrasplante se asocia con una SG y SLP prolongadas 7. El estudio mediante técnicas más sensibles como la citometría de flujo permite determinar grados de remisión completa más profundos que tienen mayor impacto en la SLP y SG. En este sentido, los recientes estudios del grupo español 8,9 demuestran que la obtención de una RC con enfermedad mínima residual negativa (EMR) por citometría de flujo se asocia a una SLP y SG más prolongadas que los pacientes en RC y en los que se detecta enfermedad residual. Con el uso de los regímenes de inducción convencionales, la tasa de RC postrasplante se sitúa entre el 20-30%, la supervivencia global mediana alrededor de los 6 años y la proporción de pacientes cuya remisión se mantiene durante 10 o más años es inferior al 10% 4. La asociación de talidomida/dexametasona (TD) y bortezomib / dexametasona (VD) se han investigado como tratamientos de inducción pretrasplante. Hay una evidencia creciente que TD es un régimen subóptimo por su limitada eficacia en pacientes con citogenética de alto riesgo (del 17p o t(4;14)) así como en los que presentan enfermedad extramedular 16. Aunque los regímenes que contienen bortezomib pueden vencer parcialmente el mal pronóstico de la citogenética de alto riesgo 17-19, con el uso de VD la tasa de remisiones completas no es superior al 35% obtenido con la quimioterapia convencional. Más prometedores son los llamados regímenes triples como bortezomib/adriamicina/dexametasona (PAD) 20,21, Bortezomib/talidomida/ dexametasona (VTD) 18,22 o bortezomib/lenalidomida/dexametasona (VRD) 23,24 con una tasa de RC que oscila entre el 43%-46%. La consolidación y el mantenimiento postrasplante con los nuevos fármacos constituyen opciones muy prometedoras en el MM. Así, 14
15 recientemente se ha referido que la consolidación postrasplante con Lenalidomida, bortezomib o VTD aumenta la profundidad de la respuesta El papel del mantenimiento en el MM continúa siendo controvertido. Por lo que respecta al uso de los nuevos fármacos, el mantenimieto con talidomida tras trasplante autólogo ha prolongado la SG en dos series 30,31. Por otro lado, la adición de talidomida en el programa de la Terapia Total II mejora significativamente la SLP así como la duración de la RC y SG en el subgrupo de pacientes con anomalías citogenéticas determinadas por citogenética convencional y mejora los resultados de la Terapia Total I que usa mantenimiento con interferón en monoterapia en términos de duración de la RC, SLP y SG 32. Los grupos del CALGB e IFM han publicado recientemente resultados prometedores, particularmente en tiempo hasta la progresión, con Lenalidomida en monoterapia como mantenimiento postrasplante 25,33. No obstante, en ambos estudios se ha detectado un incremento en la incidencia de segundas neoplasias. Finalmente, el grupo HOVON acaba de publicar que el mantenimiento con bortezomib mejora la SLP en comparación con talidomida 34 y los resultados preliminares de nuestro ensayo PETHEMA/GEM muestran que la combinación de bortezomib y talidomida es superior a talidomida sola y a interferón en términos de SLP 35. Por otro lado, la EMR determinada por citometría de flujo multiparamétrica o técnicas de biología molecular puede ser muy útil para establecer durante cuánto tiempo es necesario un tratamiento. Basado en las anteriores consideraciones, en el presente ensayo clínico se comparará la eficacia y seguridad del tratamiento de mantenimiento postrasplante con Lenalidomida y dexametasona (se adiciona dexametasona a Lenalidomida debido al sinergismo entre ambos fármacos y a la potencial disminución en la incidencia de segundas neoplasias) versus Lenalidomida, dexametasona y el inhibidor oral del proteasoma MLN9708, con una duración basada en los estudios de EMR Justificación del estudio El tratamiento actual del MM en pacientes jóvenes incluye una inducción seguida de una intensificación con dosis altas de quimioterapia seguida de trasplante de progenitores hematopoyéticos. No obstante, eventualmente todos los pacientes progresan y fallecen a consencuencia de la enfermedad. El objetivo del mantenimiento postrasplante es prolongar la duración de la respuesta. Los estudios de mantenimeinto utilizando corticoides o interferón mostraron que tan solo una pequeña proporción de pacientes se beneficiaban del mismo Sin embargo, con la introducción de los nuevos fármacos, los resultados obtenidos han sido más prometedores. Tanto talidomida 30,31,40-42 como bortezomib 34,35 y Lenalidomida 25,33 muestran una prolongación significativa de la SLP y en algunos estudios se obtiene un beneficio en términos de SG 30,31. Por otra parte, la 15
16 limitación más importante de bortezomib para su uso a largo plazo es la neuropatía periférica. En este sentido, el nuevo inhibidor del proteasoma MLN9708 ha demostrado ser menos neurotóxico y además tiene la ventaja sobre bortezomib de administrarse por vía oral, hecho que facilita su cumplimiento en tratamientos prolongados. Por otra parte, se desconoce la duración idónea de un tratamiento de mantenimiento. En este sentido, los estudios de mantenimiento realizados con Lenalidomida han sido hasta progresión de la enfermedad 30,33. Sin embargo, el aumento inesperado en la incidencia de segundas neoplasias ha motivado que se replantee el beneficio de un tratamiento de mantenimiento indefinido versus un tratamiento de duración limitada. En este sentido, los estudios de EMR secuenciales permiten detectar a los pacientes en remisión completa en los que sería factible limitar la duración del mantenimiento, evitando así sobretratamiento y toxicidad. En este estudio está previsto realizar un seguimiento exhaustivo de los pacientes con estudios de EMR. Los pacientes con EMR negativa tras dos años de tratamiento suspenderán el mantenimiento mientras que aquellos con EMR positiva proseguirán con Lenalidomida/dexametasona hasta completar 5 años de tratamiento Objetivos del ensayo Objetivos primarios Los objetivos primarios de este estudio son: Impacto en la supervivencia libre de progresión (SLP) al añadir MLN9708 al tratamiento de mantenimiento postrasplante con Lenalidomida/dexametasona en pacientes con mieloma múltiple Objetivos secundarios Los objetivos secundarios de este estudio son: Evaluar la evolución y el significado clínico de la enfermedad mínima residual (EMR) desde el inicio del mantenimiento y anualmente durante 5 años. Supervivencia global (SG) desde el inicio del tratamiento de mantenimiento Evaluar la seguridad y tolerabilidad del tratamiento de mantenimiento 16
17 5. TIPO DE ENSAYO CLINICO Y DISEÑO 5.1. Diseño global Este es un estudio nacional, multicéntrico, comparativo, abierto y aleatorizado fase III para comparar la eficacia, en términos de SLP de dos regímenes de mantenimiento postrasplante (Lenalidomida y dexametasona versus Lenalidomida, dexametasona y MLN9708). Todos los pacientes incluídos deberán haber sido homogéneamente tratados con VRD-GEM de inducción, trasplante autólogo con melfalán-200 o melfalán-140 y busulfan ev y consolidación con VRD-GEM (ensayo GEM2012MENOS65). La respuesta será evaluada según los criterios del IMWG el día 1 (+/- 4 días) de cada ciclo de mantenimiento. Adicionalmente se efectuarán estudios de EMR al inicio y anualmente hasta completar 5 años desde el inicio del tratamiento de mantenimiento. Se evaluará la seguridad de los fármacos mediante seguimiento clínico y de laboratorio Plan de estudio Los pacientes serán evaluados en visitas a lo largo de tres períodos: pre-tratamiento, tratamiento y seguimiento. El período pre-tratamiento incluye la visita de selección en la que se cumplimenta el consentimiento informado por escrito para participar en el estudio. Este período de selección coincidirá con la visita final de estudio tras los dos ciclos de consolidación del ensayo GEM2012MENOS65 (un mes después de finalizar el segundo ciclo de consolidación). Período de tratamiento. Los pacientes elegibles serán incluidos en el estudio y recibirán mantenimiento con Lenalidomida y dexametasona versus Lenalidomida, dexametasona y MLN9708. Cada ciclo tendrá una duración de 4 semanas. La Lenalidomida se administrará los días 1-21 del ciclo y la dexametasona los días 1-4 y 9-12 del ciclo. MLN9708 se administrará por vía oral los días 1, 8 y 15. Los pacientes con EMR negativa a los dos años del mantenimiento finalizarán el tratamiento mientras que los pacientes con EMR positiva continuarán con mantenimiento con Lenalidomida y dexametasona hasta completar 5 años de mantenimiento. En todos los pacientes se hará un seguimiento anual de la EMR hasta el quinto año de mantenimiento. 17
18 Periodo de Seguimiento. Una vez efectuada la visita fin de tratamiento ( ) se efectuarán las visitas habituales de seguimiento cada 3 meses para evaluar la progresión y la supervivencia (práctica habitual en pacientes con MM). La visita fin de estudio se realizará a los 5 años de iniciado el mantenimiento o antes en caso de progresión o discontinuación por otros motivos (toxicidad, retirada del consentimiento, u otros). En el anexo 1 se detalla el esquema de las visitas Procedimientos del estudio En el anexo 1 se incluye un diagrama del programa de procedimientos del estudio. Antes de iniciar el fármaco en estudio: Advertencia sobre embarazos Lenalidomida induce en primates malformaciones similares a las descritas con talidomida por lo que aunque no se conoce es esperable que sea teratogénica en humanos si se toma durante el embarazo. Todas las mujeres potencialmente fértiles o la pareja de una mujer potencialmente fértil deben emplear métodos anticonceptivos durante el tratamiento con Lenalidomida. Se considera que una mujer tiene capacidad de gestación a menos que se cumpla alguno de los siguientes criterios: Edad 50 años y amenorrea natural desde hace 1 año (la amenorrea secundaria al tratamiento quimioterápico no descarta la capacidad de gestación). Fallo ovárico prematuro confirmado por un ginecólogo. Salpingooforectomía bilateral o histerectomía. Genotipo XY, síndrome de Turner o agenesia uterina. Segundas neoplasias malignas primarias (SNMP) En caso de detectar segundas neoplasias malignas primarias de tipo hematológico durante el estudio se llevará a cabo la recogida de muestras biológicas y se remitirán al centro de referencia del Hospital de Salamanca para su análisis centralizado y el posterior envío de los resultados a Celgene. En caso de SNMP no hematológicas se llevará a cabo una recogida estricta de todos los datos del paciente que pudieran ser de interés para una evaluación detallada. Procedimientos de selección Cada paciente debe firmar y fechar el modelo de consentimiento informado antes de llevar a cabo cualquier procedimiento del estudio. Son válidos para la selección todos los procedimientos que se han efectuado como parte de la visita de fin de estudio tras la consolidación del estudio 18
19 GEM2012MENOS65. Los procedimientos para la selección se realizarán en un período de 21 días antes de la primera dosis de medicación (días -21 al 0). Procedimientos durante la Visita de Selección: Presentación del consentimiento informado por escrito. Historia médica, incluyendo enfermedades concomitantes. No deberá registrarse la medicación concomitante en el ecrd, excepto aquella que pueda tener actividad antimieloma como los corticoides o claritromicina. Examen físico completo, peso, talla, constantes vitales, valoración del estado funcional (ECOG). Electrocardiograma. Serie ósea para documentar lesiones óseas Reevaluación de los plasmocitomas que existieran al momento de su inclusión en el estudio, utilizando la misma técnica de imagen que se empleó al inicio, sólo en aquellos pacientes a los que, tras la inducción y el trasplante no hayan desaparecido por completo los plasmocitomas. Hemograma. Bioquímica general (incluyendo proteína C reactiva, beta-2-microglobulina). Estudio proteico completo en suero y orina: proteínas totales, electroforesis en suero, proteinuria de 24 horas y electroforesis en orina, dosificación de inmunoglobulinas, inmunofijación en suero y orina. Cadenas ligeras libres en suero (sflc). Aspirado de médula ósea, incluyendo morfología y citometría de flujo (para estudio de la EMR). Los estudios de EMR se realizarán de forma centralizada en laboratorios de referencia (anexo 5). Test de embarazo (ver Anexo 7). Valoración de la respuesta a la enfermedad Procedimientos generales del período de mantenimiento El día 1 de cada ciclo (+/- 4 días), se realizarán las siguientes evaluaciones: Exploración física. Valoración del estado funcional (ECOG). Hemograma. Bioquímica sérica general. Electroforesis de proteínas en suero y orina para cuantificación del componente monoclonal. Inmunofijación (IF) si el espectro electroforético (EEF) es negativo. 19
20 Aspirado de médula ósea anual durante 5 años, incluyendo morfología y citometría de flujo para estudio de EMR (centralizado en laboratorio de referencia). Administración de bisfosfonatos hasta completar un total de dos años desde el diagnóstico Test de embarazo (ver Anexo 7). Toxicidad/efectos adversos de acuerdo a los criterios comunes de toxicidad NCI presentados durante el ciclo anterior. Valoración de la respuesta a la enfermedad. A los dos años del mantenimiento, en aquellos pacientes que tenían plasmocitomas extramedulares en el momento de iniciar el mantenimiento se evaluarán con la misma técnica (TAC, PET/TAC, RNM) que se utilizó en el momento del diagnóstico para evaluar la respuesta. Notas: En los primeros dos ciclos de mantenimiento se efectuará un hemograma el día 14 del ciclo para evaluar la toxicidad hematológica Los pacientes con EMR negativa a los dos años del mantenimiento pasarán a visitarse trimestralmente con analítica que incluya electroforesis de proteínas en suero y orina para cuantificación del componente monoclonal e inmunofijación de suero y orina Visita fin de estudio La visita fin de estudio se realizará a los 5 años de iniciado el mantenimiento, tanto en los pacientes que están en abstención terapéutica por tener EMR negativa al segundo año de mantenimiento como en los que han continuado el tratamiento con Lenalidomida y dexametasona por tener EMR positiva a los dos años de iniciado el mantenimiento. También se hará la visita fin de estudio a los pacientes que se discontinuen precozmente por toxicidad, progresión u otros motivos. En los pacientes que han estado recibiendo tratamiento con Lenalidomida/dexametasona durante los 5 años, la visita fin de estudio se realizará al menos 4 semanas después de haber finalizado el último ciclo de tratamiento. Se realizarán las siguientes evaluaciones: Exploración física Hemograma. Bioquímica sérica general, incluyendo creatinina, calcio, LDH, proteína-c-reactiva y beta-2- microglobulina. 20
21 Electroforesis de proteínas en suero y orina para cuantificación del componente monoclonal. Inmunofijación (IF) si el espectro electroforético (EEF) es negativo. Determinación de cadenas ligeras libre en suero. La serie ósea no se practicará a no ser que existan datos clínicos que sugieran incremento o aparición de nuevas lesiones óseas. En caso de plasmocitomas extramedulares se realizará la misma técnica que se utilizó en el momento del diagnóstico para evaluar la respuesta. Si previamente el plasmocitoma ya estaba en respuesta no será necesario reevaluarlo. Aspirado medular incluyendo morfología y citometría de flujo para estudio de EMR (centralizado en laboratorio de referencia). Toxicidad/efectos adversos de acuerdo a los criterios comunes de toxicidad NCI presentados durante el ciclo anterior. Valoración del estado funcional (ECOG. Valoración de la respuesta a la enfermedad. Test de embarazo (ver Anexo 7). Procedimiento de aleatorización para el tratamiento de mantenimiento En el momento del registro del paciente en el CRD electrónico, una vez cumplimentados los datos de inclusión/exclusión, todos los pacientes serán aleatorizados y asignados en una proporción 1:1 para recibir uno de los dos regímenes de mantenimiento previstos (Lenalidomida y dexametasona versus Lenalidomida, dexametasona y MLN9708). La aleatorización se realizará electrónicamente y de forma automática tras la inclusión de los pacientes en el CRD. La estratificación partirá de la aleatorización previa para el tratamiento de acondicionamiento (MEL vs BUMEL) asignando a los pacientes en proporción 1:1, dentro de cada subgrupo de tratamiento previo..el estudio es abierto por lo que tanto el investigador, el personal del centro así como el propio paciente conocerán la rama de tratamiento asignada. Se le asignará un número que será usado para identificar al paciente en el CRD. Procedimientos durante la fase de seguimiento Una vez efectuada la visita fin de estudio el paciente saldrá del estudio. Siguiendo la práctica clínica asistencial se efectuará una visita de seguimiento cada 3 meses que servirá como seguimiento a largo plazo al objeto de documentar: 1.- Fecha de progresión 2.- Fecha de inicio de tratamiento de rescate 3.- Supervivencia 21
22 6. POBLACIÓN OBJETO DEL ESTUDIO 6.1. Criterios de inclusión Todos los pacientes deben cumplir los siguientes criterios de inclusión: El paciente debe, en opinión del investigador, ser capaz de cumplir con todos los requerimientos del ensayo. Consentimiento informado firmado Edad entre años Estado funcional ECOG 2 (ó 3 si el ECOG se debe al mieloma, por ej. fractura patológica) Paciente que haya sido incluído en el ensayo GEM2012MENOS65 y que se encuentre al menos con respuesta mínima tras la consolidación Esperanza de vida > 3 meses. El paciente debe tener los siguientes valores de laboratorio en los 21 días previos al inicio del tratamiento (día 1, ciclo 1): Recuento de plaquetas 100 x 109/L y recuento absoluto de neutrófilos 1.0 x 109/L. No se permiten las trasfusiones de plaquetas para cumplir con este criterio de inclusión,. Calcio sérico corregido < 14 mg/dl. Aspartato transaminasa (AST) y alanina transaminasa (ALT) 2.5 x el límite superior de normalidad (LSN). Bilirrubina total dentro de los límites de normalidad. Aclaramiento de Creatinina estimado > 30 ml/min. Las pacientes mujeres deberán: Haber entrado en la menopausia al menos 1 año antes de la visita de selección, O BIEN Haber sido esterilizadas quirúrgicamente, O BIEN Si están en edad fértil, deberán estar de acuerdo en utilizar 2 métodos anticonceptivos eficaces (de forma simultánea), desde el momento en el que se firme el consentimiento informado, hasta el 90º día posterior a la última dosis del fármaco del estudio, Y Deberán seguir las directrices de cualquier programa anticonceptivo específico del tratamiento, si corresponde, O Deberán estar de acuerdo en practicar una abstinencia real, si ello es una decisión coherente con el estilo de vida de la paciente. (La abstinencia periódica [por ejemplo, por métodos basados en el calendario, la ovulación, variaciones térmicas o la estimación del período posovulatorio] así como el coitus interruptus no son métodos anticonceptivos aceptables). 22
23 Los pacientes varones, incluso aquellos que hayan sido sometidos a esterilización quirúrgica (vasectomía), deben comprometerse a cumplir 1 de las siguientes opciones: Deberán comprometerse a utilizar métodos anticonceptivos de barrera eficaces, tanto durante la totalidad del período de tratamiento del estudio como durante los 90 días posteriores a la última dosis del fármaco del estudio, O Deberán seguir las directrices de cualquier programa anticonceptivo específico del tratamiento, si se realiza, O Deberán estar de acuerdo en practicar una abstinencia real, si ello es una decisión coherente con el estilo de vida del paciente. (La abstinencia periódica [por ejemplo, por métodos basados en el calendario, la ovulación, variaciones térmicas o la estimación del período posovulatorio] así como el coitus interruptus no son métodos anticonceptivos aceptables) Criterios de exclusión Los pacientes que presenten alguno de los siguientes criterios de exclusión no podrán ser incluidos en el ensayo clínico: Pacientes no incluidos en el ensayo clínico GEM2012MENOS65 Pacientes incluidos en el GEM2012MENOS65 que no se encuentren al menos con respuesta mínima tras la consolidación. Pacientes incluidos en el GEM2012MENOS65 y que tuvieron que ser discontinuados prematuramente por toxicidad o por progresión de la enfermedad Pacientes femeninas que estén en período de lactancia o presenten un resultado positivo en una prueba de embarazo en suero realizada durante el período de selección. Afectación del sistema nervioso central. Infección que requiera la administración de un tratamiento con antibióticos sistémicos u otra infección grave, en el transcurso de los 14 días previos al reclutamiento en el estudio. Tratamiento sistémico con inhibidores potentes del CYP1A2 (fluvoxamina, enoxacina, ciprofloxacina), inhibidores potentes del CYP3A (claritromicina, telitromicina, itraconazol, voriconazol, ketoconazol, nefazodona, posaconazol) o inductores potentes del CYP3A (rifampina, rifapentina, rifabutina, carbamazepina, fenitoína, fenobarbital) o haber recibido Ginkgo biloba o hierba de San Juan en el transcurso de los 14 días previos a la primera dosis de MLN9708. Presentar una enfermedad grave (incluidos los trastornos psiquiátricos) que, en opinión del investigador, pudiera interferir con el cumplimiento terapéutico del paciente, de acuerdo con este protocolo. Enfermedad o procedimiento GI que pueda interferir con la absorción oral u tolerancia de MLN9708, incluida la dificultad para tragar. 23
24 Haber sido diagnosticado o haber recibido tratamiento para otra neoplasia maligna en el transcurso de los 2 años previos al reclutamiento en el estudio, o haber sido diagnosticado previamente con otra neoplasia maligna y presentar indicios de enfermedad residual. No se excluirá a los pacientes con cáncer de piel no melanomatoso o carcinoma in situ de cualquier tipo, siempre que se hayan sometido a una resección completa. Neuropatía periférica grado 2 dentro de los 21 días previos a su inclusión. Hipersensibilidad conocida a la Lenalidomida o al MLN9708, fármacos análogos o excipientes presentes en diversas formulaciones de los mismos. Paciente que haya tenido un infarto de miocardio en los 6 meses previos a la inclusión en el ensayo clínico o posea una clase funcional III o IV de acuerdo con la New York Heart Association (NYHA), insuficiencia cardiaca, angina no controlada, arritmias ventriculares no controladas o isquemia aguda detectada electrocardiográficamente o trastornos del sistema de conducción. Pacientes que estén actualmente en otro ensayo clínico o recibiendo cualquier agente en investigación. Serología positiva para VHB, VHC o VIH Número de sujetos previstos Se incluirán un total de al menos 316 pacientes con mieloma múltiple sintomático de nuevo diagnóstico que han participado en el ensayo clínico GEM2012MENOS65 y que estén al menos en respuesta mínima tras la consolidación Retirada de los pacientes del ensayo Los pacientes serán retirados del ensayo cuando cumplan alguno de los siguientes criterios: Progresión confirmada de la enfermedad. Toxicidad inaceptable. Los pacientes serán informados de que pueden abandonar el ensayo clínico en el momento que ellos quieran sin que ello conlleve perjuicio alguno para su atención médica posterior. El investigador también podrá, a su criterio, suspender el tratamiento en pacientes en que aparezca alguna de las siguientes circunstancias: Violaciones mayores al protocolo. Requerimiento del paciente. No cumplimiento con las visitas establecidas. Pérdida de seguimiento 24
25 Embarazo o deficiente uso de métodos anticonceptivos Razones administrativas justificadas. Cambios específicos o generales en el paciente que hagan que, a criterio del investigador, no deba recibir más medicación del régimen previsto en el ensayo. Los pacientes que abandonen el ensayo por cualquier motivo, no podrán volver a ser incluidos. En el momento de abandonar el ensayo, la razón principal para la retirada del ensayo debe ser registrada y, si es posible, el paciente deberá ser reevaluado. 7. DESCRIPCIÓN DEL TRATAMIENTO DEL ENSAYO 7.1. Materiales del ensayo clínico Lenalidomida (Revlimid ) para administración oral viene presentado en cápsulas de 15 mg, 10 mg y 5 mg. Será suministrado en nombre del promotor, por Celgene a través de Almac Clinical Service Limited y posterior distribución por Farmavénix, S.A., de forma gratuita para la conducción del ensayo clínico. Dexametasona para administración oral, presentado en cápsulas de 20 mg, 10 mg, y 5 mg. Dexametasona no será suministrado por el promotor por ser un fármaco de uso habitual en el tratamiento del MM y formar parte de la terapia farmacológica de base que es obligada para el tratamiento de este tipo de pacientes. Se utilizarán las presentaciones comerciales que cada centro utilice habitualmente. MlN9708 para administración oral, presentado en cápsulas de 4,0 mg, 3,0 mg y 2,3 mg. Será suministrado en nombre del promotor, por Millennium -The Takeda Oncology Conpany y posterior distribución por Farmavénix, S.A. o distribuidor análogo, de forma gratuita para la conducción del ensayo clínico 7.2. Preparación, cuidados y almacenamiento de los fármacos del ensayo La dexametasona se conservará en las condiciones habituales de mantenimiento de cada hospital. Lenalidomida (Revlimid ): Las cápsulas de Lenalidomida deberán ser almacenadas bien cerradas y protegidas de la luz, y según se indica en la etiqueta. 25
26 MlN9708: las cápsulas de MLN9708 se almacenarán en los blisters 1x3 y protegidas en material de cartón dentro de un envase a prueba de niños hasta su dispensación. Deben almacenarse estancos a una temperatura de entre 2º y 8ºC Administración y esquema de tratamiento Los pacientes serán aleatorizados a recibir dos esquemas de mantenimiento con Lenalidomida y dexametasona versus Lenalidomida dexametasona y MLN9708. Los ciclos se administrarán cada 4 semanas durante dos años. - RAMA A: Lenalidomida (Revlimid ) 15 mg por vía oral los días 1-21 y dexametasona 20 mg por vía oral los días 1-4 y RAMA B: Lenalidomida (Revlimid ) 15 mg por vía oral los días 1-21, dexametasona 20 mg por vía oral los días 1-4 y Y MLN mg por vía oral los día 1,8 y 15 del ciclo. (igual que la rama A añadiendo MLN9708) NOTA: Los pacientes con EMR positiva a los dos años del mantenimiento continuarán recibiendo tratamiento con Lenalidomida 15 mg por vía oral los días 1-21 y dexametasona 20 mg por vía oral los día 1-4 del ciclo hasta completar 5 años de mantenimiento MLN9708 debe tomarse en ayunas, al menos 1 hora antes o 2h después de las comidas. La cápsula debe tomarse entera, sin partir, con agua (al menos 240 ml). Las cápsulas no deben abrirse, romperse, ni masticarse. Si se olvida una dosis, podrá tomarla siempre y cuando falten 72 horas o más para la siguiente dosis programada. No debe tomarse una dosis doble por el hecho de haberse olvidado una dosis. Si vomita una toma no debe tomar una segunda dosis, sino reanudar la administración en el momento de la siguiente dosis programada. 26
27 Esquema de tratamiento de la rama A Revlimid 15 mg Dexametasona 20 mg D e s c a n s o Esquema de tratamiento de la rama B MLN mg Revlimid 15 mg Dexametasona 20 mg D e s c a n s o 7.4. Modificación de dosis y retrasos Todos los pacientes serán evaluados el día 1 de cada nuevo ciclo (± 4 días). El día 1 de cada ciclo el paciente debe tener: Recuento de neutrófilos 1.000/mm3 Recuento de plaquetas /mm3 Todas las toxicidades no hematológicas deben haber vuelto a grado 1 o a la condición basal del paciente En los primeros dos ciclos se efectuará un hemograma el día 14 del ciclo (antes de la dosis del día +15 de MLN9708 en el caso de pacientes incluidos en la rama B de tratamiento) 27
28 Como regla general, si no se observase recuperación de la toxicidad hematológica o no hematológica tras 4 semanas de retraso, el paciente podrá continuar en el ensayo suspendiendo el fármaco que se crea directamente relacionado con la toxicidad y continuando el tratamiento con el resto de fármacos. Las toxicidades serán manejadas de acuerdo a los Criterios de Toxicidad Común del NCI (CTC), versión Tabla 1. Niveles de ajuste de dosis Nivel de dosis Lenalidomida Dexametasona MLN9708 Dosis plena 15 mg 40 mg 4 mg Nivel mg 20 mg 3 mg Nivel -2 5 mg 10 mg 2,3 mg Lenalidomida MODIFICACIONES POR TOXICIDAD HEMATOLÓGICA DE LENALIDOMIDA En el día 1 de cada ciclo se requerirán al menos: neutrófilos 1000/mm 3, plaquetas /mm 3. Si el paciente no presentara estos valores, se realizará un hemograma semanal hasta que se recupere de la toxicidad. El ciclo podrá ser retrasado un máximo de 4 semanas. Si pasado este tiempo no se ha recuperado la toxicidad, podrá iniciar el ciclo suspendiendo el fármaco que se sospeche que está relacionado directamente con la toxicidad. El día 14 de los ciclos 1 y 2 se realizará un hemograma de control. La toxicidad intraciclo se manejará según las tablas 2 y 3. Se permite administrar G-CSF según criterio clínico. MODIFICACIONES POR TOXICIDAD NO HEMATOLÓGICA DE LENALIDOMIDA Si el paciente experimenta cualquier toxicidad no hematológica grado 3 considerado por el investigador en relación con Lenalidomida, esta debe suspenderse hasta que la toxicidad vuelva a ser grado 1 o a niveles basales. Posteriormente la dosis será reducida un nivel (tabla 1). En insuficiencia renal, aplicar los ajustes reflejados en la tabla 6 En caso de trombosis/embolismo grado 2, interrumpir la Lenalidomida e iniciar anticoagulación. Reinicar a la misma dosis cuando el paciente esté adecuadamente anticoagulado. 28
29 Los pacientes que presenten toxicidad cutánea serán manejados de acuerdo a la tabla 4. En caso de angioedema, síndrome de Stevens-Johnson y síndrome de necrolisis epidérmica se discontinuará definitivamente la Lenalidomida Dexametasona MODIFICACIONES POR TOXICIDAD NO HEMATOLÓGICA DE DEXAMETASONA Si el paciente experimenta cualquier toxicidad no hematológica grado 3 relacionada con dexametasona, esta será suspendida hasta que la toxicidad revierta a un grado 2 y reiniciar la dosis a un nivel inferior (tabla 1). Una hiperglucemia grado 3 se deberá tratar con insulina o antidiabéticos orales. No se disminuirá la dosis de dexametasona excepto en casos de glucemias incontrolables con tratamiento antidiabético adecuado MLN9708 MODIFICACIONES POR TOXICIDAD HEMATOLÓGICA DE MLN9708 En el día 1 de cada ciclo se requerirán al menos: neutrófilos 1000/mm 3, plaquetas /mm 3. Si el paciente no presentara estos valores, se realizará un hemograma semanal hasta que se recupere de la toxicidad. El ciclo podrá ser retrasado un máximo de 4 semanas. Si pasado este tiempo no se ha recuperado la toxicidad, podrá iniciar el ciclo suspendiendo el fármaco que se sospeche que está relacionado directamente con la toxicidad. El día 14 de los ciclos 1 y 2 se realizará un hemograma de control. La toxicidad intraciclo se manejará según las tablas 2 y 3. Se permite administrar G-CSF según criterio clínico. MODIFICACIONES POR TOXICIDAD NO HEMATOLÓGICA DE MLN9708 Si el paciente experimenta cualquier toxicidad no hematológica grado 3 considerado por el investigador en relación con MLN9708, este debe ser suspendido hasta que la toxicidad vuelva a ser grado 1 o a niveles basales. Posteriormente la dosis será reducida un nivel (tabla 1). Los pacientes que presenten toxicidad cutánea serán manejados de acuerdo a la tabla 4 Los pacientes que presenten dolor neuropático y/o neuropatía periférica serán manejados de acuerdo a la tabla 5 29
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO
 ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
Importancia de la investigación clínica EN ONCOLOGÍA. ONCOvida. oncovida_20.indd 1 10/10/11 12:53
 Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
POR QUÉ YA NO SE RECOMIENDA ESPERAR 3 MESES PARA HACERSE LA PRUEBA DEL VIH?
 QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
Fármacos: Bortezomib (Velcade ), Lenalidomida (Revlimid ) y Busulfán ev (Busilvex ).
 PROTOCOLO DE ENSAYO CLÍNICO Fármacos: Bortezomib (Velcade ), Lenalidomida (Revlimid ) y Busulfán ev (Busilvex ). Código de protocolo: GEM2012MENOS65 Fecha de protocolo: 28 de diciembre de 2012 Título del
PROTOCOLO DE ENSAYO CLÍNICO Fármacos: Bortezomib (Velcade ), Lenalidomida (Revlimid ) y Busulfán ev (Busilvex ). Código de protocolo: GEM2012MENOS65 Fecha de protocolo: 28 de diciembre de 2012 Título del
Generalitat de Catalunya Departament de Salut Direcció General de Recursos Sanitaris
 MODELO DE CONTRATO PARA ENSAYOS CLÍNICOS CON MEDICAMENTOS CONTRATO ENTRE (nombre de la entidad promotora) Y EL (nombre del centro donde se realizará el ensayo) PARA LA REALIZACIÓN DEL ENSAYO CLÍNICO (título
MODELO DE CONTRATO PARA ENSAYOS CLÍNICOS CON MEDICAMENTOS CONTRATO ENTRE (nombre de la entidad promotora) Y EL (nombre del centro donde se realizará el ensayo) PARA LA REALIZACIÓN DEL ENSAYO CLÍNICO (título
Nota de Información al cliente ISO/IEC 22301 Proceso de auditoría
 Nota de Información al cliente ISO/IEC 22301 Proceso de auditoría La presente Nota de Información al Cliente explica las principales fases del proceso de certificación y auditoría de Sistemas de Gestión
Nota de Información al cliente ISO/IEC 22301 Proceso de auditoría La presente Nota de Información al Cliente explica las principales fases del proceso de certificación y auditoría de Sistemas de Gestión
SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg
 SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
SUNITINIB CÁPSULAS DURAS DE 12,5-25 y 50 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
Ensayos Clínicos en Oncología
 Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
en tratamiento con Toctino ... Nombre de la paciente (alitretinoína) Para el médico Soluciones pensando en ti
 (alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
(alitretinoína) Tarjeta Restaura de seguimiento desde el interiorde la Paciente en con Toctino... Nombre de la paciente Para el médico Soluciones pensando en ti www.almirall.es www.solucionesalmirall.com
Operación 8 Claves para la ISO 9001-2015
 Operación 8Claves para la ISO 9001-2015 BLOQUE 8: Operación A grandes rasgos, se puede decir que este bloque se corresponde con el capítulo 7 de la antigua norma ISO 9001:2008 de Realización del Producto,
Operación 8Claves para la ISO 9001-2015 BLOQUE 8: Operación A grandes rasgos, se puede decir que este bloque se corresponde con el capítulo 7 de la antigua norma ISO 9001:2008 de Realización del Producto,
RESUMEN PROTOCOLO DE ENSAYO CLÍNICO
 RESUMEN PROTOCOLO DE ENSAYO CLÍNICO Estudio fase II abierto de ketoconazol como inhibidor de la enzima CYP17 en cáncer de la granulosa ovárica localmente avanzado o diseminado. Estudio GreKo. Código de
RESUMEN PROTOCOLO DE ENSAYO CLÍNICO Estudio fase II abierto de ketoconazol como inhibidor de la enzima CYP17 en cáncer de la granulosa ovárica localmente avanzado o diseminado. Estudio GreKo. Código de
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
1.- JUSTIFICACIÓN 2.- OBJETO DEL CONTRATO
 PLIEGO DE PRESCRIPCIONES TÉCNICAS QUE REGIRÁ EL CONCURSO PARA LA GESTION DE LA PRODUCCIÓN TÉCNICA DE EXPOSICIONES QUE SE REALICEN EN LAS SALAS DEL CENTRO CULTURAL DEL MATADERO, ENTRE OTRAS. 1.- JUSTIFICACIÓN
PLIEGO DE PRESCRIPCIONES TÉCNICAS QUE REGIRÁ EL CONCURSO PARA LA GESTION DE LA PRODUCCIÓN TÉCNICA DE EXPOSICIONES QUE SE REALICEN EN LAS SALAS DEL CENTRO CULTURAL DEL MATADERO, ENTRE OTRAS. 1.- JUSTIFICACIÓN
Capítulo 6. Reclamaciones, Devoluciones, Sospechas de medicamentos falsificados y medicamentos retirados Capítulo 9. Transporte.
 Capítulo 6. Reclamaciones, Devoluciones, Sospechas de medicamentos falsificados y medicamentos retirados Capítulo 9. Transporte. Concepción Betés Servicio de Control Farmacéutico y Productos Sanitarios
Capítulo 6. Reclamaciones, Devoluciones, Sospechas de medicamentos falsificados y medicamentos retirados Capítulo 9. Transporte. Concepción Betés Servicio de Control Farmacéutico y Productos Sanitarios
PROCEDIMIENTO INTEGRADO SOBRE NOTIFICACIÓN DE ACCIDENTES E INVESTIGACIÓN DE INCIDENTES
 SOBRE NOTIFICACIÓN DE ACCIDENTES E INVESTIGACIÓN DE INCIDENTES Hoja 1 de 7 PROCEDIMIENTO INTEGRADO SOBRE NOTIFICACIÓN DE ACCIDENTES E Realizado por Revisado por Aprobado por Fco. Javier Martí Bosch Comité
SOBRE NOTIFICACIÓN DE ACCIDENTES E INVESTIGACIÓN DE INCIDENTES Hoja 1 de 7 PROCEDIMIENTO INTEGRADO SOBRE NOTIFICACIÓN DE ACCIDENTES E Realizado por Revisado por Aprobado por Fco. Javier Martí Bosch Comité
RED VALENCIANA DE BIOBANCOS. Consentimiento informado para la donación voluntaria de muestras biológicas para investigación al biobanco del (1 de 6)
 1. Identificación y descripción del procedimiento Consentimiento informado para la donación voluntaria (1 de 6) El procedimiento que se le propone consiste en donar voluntariamente muestra/s biológica/s
1. Identificación y descripción del procedimiento Consentimiento informado para la donación voluntaria (1 de 6) El procedimiento que se le propone consiste en donar voluntariamente muestra/s biológica/s
CONDICIONES DE CONTRATACIÓN
 INGENIERIA RIOJANA DE SOLUCIONES IT AVENIDA DE LA SIERRA 5, BAJO. 26007 LOGROÑO (LA RIOJA) TEL: 941545000 info@irsoluciones.com DESARROLLO DE PROYECTOS Primero.- Colaboración del cliente y su responsabilidad
INGENIERIA RIOJANA DE SOLUCIONES IT AVENIDA DE LA SIERRA 5, BAJO. 26007 LOGROÑO (LA RIOJA) TEL: 941545000 info@irsoluciones.com DESARROLLO DE PROYECTOS Primero.- Colaboración del cliente y su responsabilidad
ANÁLISIS DE LAS CARACTERÍSTICAS EN LA RECAÍDA/PROGRESIÓN Y RESPUESTA A LA SEGUNDA LÍNEA DE TRATAMIENTO EN EL PROTOCOLO GEM2005MAS65.
 ANÁLISIS DE LAS CARACTERÍSTICAS EN LA RECAÍDA/PROGRESIÓN Y RESPUESTA A LA SEGUNDA LÍNEA DE TRATAMIENTO EN EL PROTOCOLO GEM2005MAS65. Nº Identificación del paciente: Hospital: Médico responsable: 1/6 Características
ANÁLISIS DE LAS CARACTERÍSTICAS EN LA RECAÍDA/PROGRESIÓN Y RESPUESTA A LA SEGUNDA LÍNEA DE TRATAMIENTO EN EL PROTOCOLO GEM2005MAS65. Nº Identificación del paciente: Hospital: Médico responsable: 1/6 Características
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
ÍNDICE. Introducción. Alcance de esta NIA Fecha de vigencia
 NORMA INTERNACIONAL DE AUDITORÍA 706 PARRAFOS DE ÉNFASIS EN EL ASUNTO Y PARRAFOS DE OTROS ASUNTOS EN EL INFORME DEL AUDITOR INDEPENDIENTE (En vigencia para las auditorías de estados financieros por los
NORMA INTERNACIONAL DE AUDITORÍA 706 PARRAFOS DE ÉNFASIS EN EL ASUNTO Y PARRAFOS DE OTROS ASUNTOS EN EL INFORME DEL AUDITOR INDEPENDIENTE (En vigencia para las auditorías de estados financieros por los
PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD
 PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD 1. Detección de la infección tuberculosa. Prueba de la tuberculina. El diagnóstico de la infección se basa en el viraje
PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD 1. Detección de la infección tuberculosa. Prueba de la tuberculina. El diagnóstico de la infección se basa en el viraje
Detalle del Estudio - REec-2013-0445
 Identificadores del Estudio Código de Registro REec-2013-0445 Fecha de Registro 21/10/2013 de reclutamiento En marcha EUDRACT Nr. 2013-001194-25 Descripción del estudio Título no científico Título científico
Identificadores del Estudio Código de Registro REec-2013-0445 Fecha de Registro 21/10/2013 de reclutamiento En marcha EUDRACT Nr. 2013-001194-25 Descripción del estudio Título no científico Título científico
EXTRACTO Descripción del uso y manejo de SIRAIS 1.2
 Manual de usuario EXTRACTO Descripción del uso y manejo de ELABORADO POR Dr. Javier Rodríguez Suárez Director General de Difusión e Investigación Ing. José Joel Lucero Morales Jefe de Enseñanza de la Dirección
Manual de usuario EXTRACTO Descripción del uso y manejo de ELABORADO POR Dr. Javier Rodríguez Suárez Director General de Difusión e Investigación Ing. José Joel Lucero Morales Jefe de Enseñanza de la Dirección
AUDITORÍA INTERNA. Resumen de ediciones Número Fecha Motivo de modificación 00 23/07/2015 Edición inicial. Aprobado por:
 Índice 1. Objeto 2. Ámbito de aplicación 3. Definiciones 4. Responsabilidades 5. Desarrollo 6. Medición, análisis y mejora continua 7. Documentos internos 8. Registros 9. Rendición de cuentas 10. Diagrama
Índice 1. Objeto 2. Ámbito de aplicación 3. Definiciones 4. Responsabilidades 5. Desarrollo 6. Medición, análisis y mejora continua 7. Documentos internos 8. Registros 9. Rendición de cuentas 10. Diagrama
Se coloca dentro del útero para ofrecer protección anticonceptiva y tiene unos hilos guía para su localización y extracción.
 Qué es el DIU? El DIU (Dispositivo Intrauterino) es un objeto pequeño de plástico (polietileno) flexible que mide 4 cm aproximadamente. Existen varios tipos de DIU, los más comunes son: Los que contienen
Qué es el DIU? El DIU (Dispositivo Intrauterino) es un objeto pequeño de plástico (polietileno) flexible que mide 4 cm aproximadamente. Existen varios tipos de DIU, los más comunes son: Los que contienen
USO SEGURO DE LOS MEDICAMENTOS LMCV 05-2012
 Guía para pacientes acerca del uso seguro de los medicamentos Este corto vital ha sido pensado para ayudar a los pacientes a tomar sus medicinas de forma segura. Conviértase en un paciente informado Disponer
Guía para pacientes acerca del uso seguro de los medicamentos Este corto vital ha sido pensado para ayudar a los pacientes a tomar sus medicinas de forma segura. Conviértase en un paciente informado Disponer
Condiciones generales
 Condiciones generales Objeto. Descripción de los servicios IURISCAR S.L. domiciliada en C/ Fuencarral nº 135, 3º exterior izda. 28010 Madrid, CIF: B-83610352, es el creador y propietario de la Base de
Condiciones generales Objeto. Descripción de los servicios IURISCAR S.L. domiciliada en C/ Fuencarral nº 135, 3º exterior izda. 28010 Madrid, CIF: B-83610352, es el creador y propietario de la Base de
SEGURIDAD DE LOS SISTEMAS DE INFORMACIÓN Política General de Seguridad aplicable al usuario final del SCS
 SEGURIDAD DE LOS SISTEMAS DE INFORMACIÓN Política General de Seguridad aplicable al usuario final del SCS A través de las Políticas de Seguridad recogidas en el Documento de Seguridad se describen las
SEGURIDAD DE LOS SISTEMAS DE INFORMACIÓN Política General de Seguridad aplicable al usuario final del SCS A través de las Políticas de Seguridad recogidas en el Documento de Seguridad se describen las
PROCEDIMIENTO DE EVALUACIONES MÉDICAS OCUPACIONALES
 Revisó: Jefe División Recursos Humanos Profesional Seguridad y Salud Ocupacional Profesional Planeación Aprobó: Rector Página: 1 de 9 Fecha de aprobación: Agosto 19 de 2011 Resolución No. 1324 OBJETIVO
Revisó: Jefe División Recursos Humanos Profesional Seguridad y Salud Ocupacional Profesional Planeación Aprobó: Rector Página: 1 de 9 Fecha de aprobación: Agosto 19 de 2011 Resolución No. 1324 OBJETIVO
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
Trasplante renal. Dudas más frecuentes
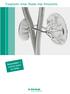 Trasplante renal. Dudas más frecuentes Por qué el trasplante de riñón? Cuando aparece una insuficiencia renal crónica irreversible, se plantean tres tipos de tratamiento: Hemodiálisis Diálisis peritoneal
Trasplante renal. Dudas más frecuentes Por qué el trasplante de riñón? Cuando aparece una insuficiencia renal crónica irreversible, se plantean tres tipos de tratamiento: Hemodiálisis Diálisis peritoneal
PROGRAMA DE AYUDAS PYME Y GRAN EMPRESA SECTOR INDUSTRIAL PROCEDIMIENTO DE CERTIFICACIÓN DE LA AYUDA
 PROGRAMA DE AYUDAS PYME Y GRAN EMPRESA SECTOR INDUSTRIAL PROCEDIMIENTO DE CERTIFICACIÓN DE LA AYUDA Procedimiento de Certificación FNEE - Industria 16/12/2015 OBJETO El objeto de este documento es definir
PROGRAMA DE AYUDAS PYME Y GRAN EMPRESA SECTOR INDUSTRIAL PROCEDIMIENTO DE CERTIFICACIÓN DE LA AYUDA Procedimiento de Certificación FNEE - Industria 16/12/2015 OBJETO El objeto de este documento es definir
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
GARANTÍA DE CALIDAD Y BUENAS PRÁCTICAS DE LABORATORIO
 MINISTERIO DE SANIDAD Y CONSUMO GARANTÍA DE CALIDAD Y BUENAS PRÁCTICAS DE LABORATORIO DOCUMENTO Nº 2 2ª Versión Noviembre 2001 AGENCIA ESPAÑOLA DEL MEDICAMENTO SUMARIO 1.- Introducción. 2.- Funciones del
MINISTERIO DE SANIDAD Y CONSUMO GARANTÍA DE CALIDAD Y BUENAS PRÁCTICAS DE LABORATORIO DOCUMENTO Nº 2 2ª Versión Noviembre 2001 AGENCIA ESPAÑOLA DEL MEDICAMENTO SUMARIO 1.- Introducción. 2.- Funciones del
NORMA TÉCNICA DE AUDITORÍA SOBRE CONSIDERACIONES RELATIVAS A LA AUDITORÍA DE ENTIDADES QUE EXTERIORIZAN PROCESOS DE ADMINISTRACIÓN
 Resolución de 26 de marzo de 2004, del Instituto de Contabilidad y Auditoría de Cuentas, por la que se publica la Norma Técnica de Auditoría sobre consideraciones relativas a la auditoría de entidades
Resolución de 26 de marzo de 2004, del Instituto de Contabilidad y Auditoría de Cuentas, por la que se publica la Norma Técnica de Auditoría sobre consideraciones relativas a la auditoría de entidades
QUÉ ES LA HEPATITIS C? CÓMO SE CONTAGIA?
 QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
REMS. Guía para el paciente de. Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy)
 Guía para el paciente de REMS Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy) Esta guía le brinda información importante sobre lo siguiente:
Guía para el paciente de REMS Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy) Esta guía le brinda información importante sobre lo siguiente:
RED / CONSEJO IBEROAMERICANO DE DONACIÓN Y TRASPLANTES 1ª REUNIÓN MAR DEL PLATA. 15 17 DE NOVIEMBRE DEL 2005
 RED / CONSEJO IBEROAMERICANO DE DONACIÓN Y TRASPLANTES 1ª REUNIÓN MAR DEL PLATA. 15 17 DE NOVIEMBRE DEL 2005 RECOMENDACIÓN REC - CIDT 2005 (2) SOBRE EL PAPEL Y LA FORMACIÓN DE LOS PROFESIONALES RESPONSABLES
RED / CONSEJO IBEROAMERICANO DE DONACIÓN Y TRASPLANTES 1ª REUNIÓN MAR DEL PLATA. 15 17 DE NOVIEMBRE DEL 2005 RECOMENDACIÓN REC - CIDT 2005 (2) SOBRE EL PAPEL Y LA FORMACIÓN DE LOS PROFESIONALES RESPONSABLES
6 METAS INTERNACIONALES PARA UNA CLÍNICA SEGURA
 6 METAS INTERNACIONALES PARA UNA CLÍNICA SEGURA Ayúdenos a cumplir y hacer cumplir estas políticas para brindarle una atención más segura. Actualmente la Clínica Foianini está trabajando para alcanzar
6 METAS INTERNACIONALES PARA UNA CLÍNICA SEGURA Ayúdenos a cumplir y hacer cumplir estas políticas para brindarle una atención más segura. Actualmente la Clínica Foianini está trabajando para alcanzar
Acuerdo de prestación de servicios ofrecidos por la compañía vía online:
 CONTRATO: Contrato prestación de servicios. Acuerdo de prestación de servicios ofrecidos por la compañía vía online: 1. En el acuerdo se utilizan las siguientes nociones y definiciones: 1.1. El acuerdo:
CONTRATO: Contrato prestación de servicios. Acuerdo de prestación de servicios ofrecidos por la compañía vía online: 1. En el acuerdo se utilizan las siguientes nociones y definiciones: 1.1. El acuerdo:
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC
 6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
GUÍA TÉCNICA PARA LA DEFINICIÓN DE COMPROMISOS DE CALIDAD Y SUS INDICADORES
 GUÍA TÉCNICA PARA LA DEFINICIÓN DE COMPROMISOS DE CALIDAD Y SUS INDICADORES Tema: Cartas de Servicios Primera versión: 2008 Datos de contacto: Evaluación y Calidad. Gobierno de Navarra. evaluacionycalidad@navarra.es
GUÍA TÉCNICA PARA LA DEFINICIÓN DE COMPROMISOS DE CALIDAD Y SUS INDICADORES Tema: Cartas de Servicios Primera versión: 2008 Datos de contacto: Evaluación y Calidad. Gobierno de Navarra. evaluacionycalidad@navarra.es
Planilla Para Evaluación de Protocolos Con Animales de Experimentación
 Planilla Para Evaluación de Protocolos Con Animales de Experimentación 1.- Identificación Fecha de recepción: N de protocolo N designado por el Comité: Tipo de investigación: Investigadores/docentes Telf:
Planilla Para Evaluación de Protocolos Con Animales de Experimentación 1.- Identificación Fecha de recepción: N de protocolo N designado por el Comité: Tipo de investigación: Investigadores/docentes Telf:
H A B L E M O S A C E R C A D E T R A S P L A N T E S
 H A B L E M O S A C E R C A D E T R A S P L A N T E S Preguntas y respuestas para candidatos a trasplantes sobre el nuevo sistema de asignación de riñones United Network for Organ Sharing (UNOS, Red unida
H A B L E M O S A C E R C A D E T R A S P L A N T E S Preguntas y respuestas para candidatos a trasplantes sobre el nuevo sistema de asignación de riñones United Network for Organ Sharing (UNOS, Red unida
MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD DIRECCIÓN GENERAL DE CARTERA BÁSICA DE SERVICIOS DEL SISTEMA NACIONAL DE SALUD Y FARMACIA
 MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD DIRECCIÓN GENERAL DE CARTERA BÁSICA DE SERVICIOS DEL SISTEMA NACIONAL DE SALUD Y FARMACIA SUBDIRECCIÓN GENERAL DE CARTERA BÁSICA DE SERVICIOS DEL SISTEMA
MINISTERIO DE SANIDAD, SERVICIOS SOCIALES E IGUALDAD DIRECCIÓN GENERAL DE CARTERA BÁSICA DE SERVICIOS DEL SISTEMA NACIONAL DE SALUD Y FARMACIA SUBDIRECCIÓN GENERAL DE CARTERA BÁSICA DE SERVICIOS DEL SISTEMA
PROCEDIMIENTO OPERATIVO INVESTIGACION DE ACCIDENTES Y ESTADISTICA DE SINIESTRALIDAD DPMPO09
 Página: 1 PROCEDIMIENTO OPERATIVO ESTADISTICA DE SINIESTRALIDAD Página: 2 Edición Motivo cambio Firma Fecha 0 Edición Inicial 6.05.2002 Página: 3 I N D I C E 1. OBJETO 4 2. AMBITO DE APLICACIÓN 4 3. NORMATIVA
Página: 1 PROCEDIMIENTO OPERATIVO ESTADISTICA DE SINIESTRALIDAD Página: 2 Edición Motivo cambio Firma Fecha 0 Edición Inicial 6.05.2002 Página: 3 I N D I C E 1. OBJETO 4 2. AMBITO DE APLICACIÓN 4 3. NORMATIVA
Documento 8. Documento de Empresa Participante Programa PIPE 2007-2013
 Documento 8 Documento de Empresa Participante Programa PIPE 2007-2013 Regiones Convergencia, Phasing Out, Phasing In (Empresas con financiación FEDER a través del CSC) DM0711 1 Documento de Empresa Participante
Documento 8 Documento de Empresa Participante Programa PIPE 2007-2013 Regiones Convergencia, Phasing Out, Phasing In (Empresas con financiación FEDER a través del CSC) DM0711 1 Documento de Empresa Participante
Evaluación de la capacidad óptima de medida y alcance de la acreditación de un laboratorio de calibración
 Evaluación de la capacidad óptima de medida y alcance de la acreditación de un laboratorio de calibración Fernández Pareja, Mª Teresa te_fer@topografia.upm.es Departamento de Ingeniería Topográfica y Cartografía
Evaluación de la capacidad óptima de medida y alcance de la acreditación de un laboratorio de calibración Fernández Pareja, Mª Teresa te_fer@topografia.upm.es Departamento de Ingeniería Topográfica y Cartografía
Relaciones profesionales
 Asesoría Jurídica de fepfi Relaciones profesionales Con empleados y colaboradores Por TERESA MORÁN GARRIDO Relaciones profesionales con empleados y colaboradores. A veces un fotógrafo contrata a otro para
Asesoría Jurídica de fepfi Relaciones profesionales Con empleados y colaboradores Por TERESA MORÁN GARRIDO Relaciones profesionales con empleados y colaboradores. A veces un fotógrafo contrata a otro para
La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares.
 Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
PROCEDIMIENTO DE GESTIÓN DE LOS ASPECTOS AMBIENTALES
 H. R. U. CARLOS HAYA SERVICIO ANDALUZ DE SALUD Fecha: 13/12/2007 PROCEDIMIENTO DE Nombre y Cargo Firma Fecha Elaborado Sergio Pérez Ortiz 12/12/2007 Responsable Operativo del Sistema de Gestión Ambiental
H. R. U. CARLOS HAYA SERVICIO ANDALUZ DE SALUD Fecha: 13/12/2007 PROCEDIMIENTO DE Nombre y Cargo Firma Fecha Elaborado Sergio Pérez Ortiz 12/12/2007 Responsable Operativo del Sistema de Gestión Ambiental
BASES DE LA CONVOCATORIA
 RESOLUCIÓN DEL DIRECTOR DE LA FUNDACIÓN PARA LA FORMACIÓN E INVESTIGACIÓN SANITARIAS DE LA REGIÓN DE MURCIA POR LA QUE SE CONVOCA CONCURSO PARA LA CONTRATACIÓN DE UNA PLAZA DE UN/A LICENCIADO/A EN MEDICINA
RESOLUCIÓN DEL DIRECTOR DE LA FUNDACIÓN PARA LA FORMACIÓN E INVESTIGACIÓN SANITARIAS DE LA REGIÓN DE MURCIA POR LA QUE SE CONVOCA CONCURSO PARA LA CONTRATACIÓN DE UNA PLAZA DE UN/A LICENCIADO/A EN MEDICINA
NOTIFICACIÓN DE MOVIMIENTOS DE ESTUPEFACIENTES POR PARTE DE LOS LABORATORIOS FARMACÉUTICOS Y ALMACENES MAYORISTAS DE DISTRIBUCIÓN
 NOTIFICACIÓN DE MOVIMIENTOS DE ESTUPEFACIENTES POR PARTE DE LOS LABORATORIOS FARMACÉUTICOS Y ALMACENES MAYORISTAS DE DISTRIBUCIÓN GUÍA PARA LA PRESENTACIÓN DE NOTIFICACIONES Versión: 27/06/2012-1 ÍNDICE:
NOTIFICACIÓN DE MOVIMIENTOS DE ESTUPEFACIENTES POR PARTE DE LOS LABORATORIOS FARMACÉUTICOS Y ALMACENES MAYORISTAS DE DISTRIBUCIÓN GUÍA PARA LA PRESENTACIÓN DE NOTIFICACIONES Versión: 27/06/2012-1 ÍNDICE:
GARANTÍAS MÍNIMAS DE CALIDAD EN LA PRODUCCIÓN DE PLASMA RICO EN PLAQUETAS (PRP)
 GARANTÍAS MÍNIMAS DE CALIDAD EN LA PRODUCCIÓN DE PLASMA RICO EN PLAQUETAS (PRP) Existen diferentes modalidades de producción de PRP y es necesario establecer las garantías mínimas de calidad en la producción,
GARANTÍAS MÍNIMAS DE CALIDAD EN LA PRODUCCIÓN DE PLASMA RICO EN PLAQUETAS (PRP) Existen diferentes modalidades de producción de PRP y es necesario establecer las garantías mínimas de calidad en la producción,
Cómo puede usted contribuir a la investigación médica?
 National Cancer Institute Cómo puede usted contribuir a la investigación médica? U.S. DEPARTMENT OF HEALTH AND HUMAN SERVICES National Institutes of Health Done su sangre, sus tejidos y otras muestras
National Cancer Institute Cómo puede usted contribuir a la investigación médica? U.S. DEPARTMENT OF HEALTH AND HUMAN SERVICES National Institutes of Health Done su sangre, sus tejidos y otras muestras
FASE 1. Solicitud de Autorización. Contratación de Personal por Obra o Servicio. Página 1 de 20
 Aplicación para la Gestión de Contratos por Obra o Servicio Determinado con cargo a Proyectos de Investigación, Convenios o Contratos, para los Grupos Profesionales 1 y 2 del Convenio Único de la AGE.
Aplicación para la Gestión de Contratos por Obra o Servicio Determinado con cargo a Proyectos de Investigación, Convenios o Contratos, para los Grupos Profesionales 1 y 2 del Convenio Único de la AGE.
norma técnica Estándar de Seguridad y Salud: Evaluación del desempeño en seguridad y salud de las empresas colaboradoras Código: NT.00047.GN-SP.
 norma técnica Estándar de Seguridad y Salud: Evaluación del desempeño en seguridad y salud de las empresas colaboradoras Código: NT.00047.GN-SP.ESS Edición: 1 Histórico de Revisiones Edición Fecha Motivo
norma técnica Estándar de Seguridad y Salud: Evaluación del desempeño en seguridad y salud de las empresas colaboradoras Código: NT.00047.GN-SP.ESS Edición: 1 Histórico de Revisiones Edición Fecha Motivo
BECAS FUNDACIÓN BBVA-FUNDACIÓN CAROLINA MASTER EN ESPACIOS NATURALES PROTEGIDOS Año 2008 FICHA TÉCNICA
 BECAS FUNDACIÓN BBVA-FUNDACIÓN CAROLINA MASTER EN ESPACIOS NATURALES PROTEGIDOS Año 2008 FICHA TÉCNICA Duración del Programa 10 meses y medio (Febrero a mediados de Diciembre 2008) Nº de becas 12 Requisitos
BECAS FUNDACIÓN BBVA-FUNDACIÓN CAROLINA MASTER EN ESPACIOS NATURALES PROTEGIDOS Año 2008 FICHA TÉCNICA Duración del Programa 10 meses y medio (Febrero a mediados de Diciembre 2008) Nº de becas 12 Requisitos
MANUAL DEL SISTEMA DE EVALUACIÓN DEL DESEMPEÑO
 MANUAL DEL SISTEMA DE EVALUACIÓN DEL DESEMPEÑO 1 INDICE 1. Introducción 2. Normativa 3. Objetivos 4. Visión global 5. Ámbito de aplicación. 6. Desarrollo del proceso 7. Valores relativos o pesos, criterio
MANUAL DEL SISTEMA DE EVALUACIÓN DEL DESEMPEÑO 1 INDICE 1. Introducción 2. Normativa 3. Objetivos 4. Visión global 5. Ámbito de aplicación. 6. Desarrollo del proceso 7. Valores relativos o pesos, criterio
ISO 27001- Anexo A OBJETIVOS DE CONTROL Y CONTROLES DE REFERENCIA DANIELA RAMIREZ PEÑARANDA 1150453 WENDY CARRASCAL VILLAMIZAR 1150458
 ISO 27001- Anexo A OBJETIVOS DE CONTROL Y CONTROLES DE REFERENCIA DANIELA RAMIREZ PEÑARANDA 1150453 WENDY CARRASCAL VILLAMIZAR 1150458 UNIVERSIDAD FRANCISCO DE PAULA SANTANDER INGENIERIA DE SISTEMAS SEGURIDAD
ISO 27001- Anexo A OBJETIVOS DE CONTROL Y CONTROLES DE REFERENCIA DANIELA RAMIREZ PEÑARANDA 1150453 WENDY CARRASCAL VILLAMIZAR 1150458 UNIVERSIDAD FRANCISCO DE PAULA SANTANDER INGENIERIA DE SISTEMAS SEGURIDAD
PROCEDIMIENTO AUDITORIA INTERNA
 Procedimiento AUDITORIA INTERNA Página 1 de 9 PROCEDIMIENTO AUDITORIA INTERNA Nota importante: El presente documento es de exclusiva propiedad de LUTROMO INDUSTRIAS LTDA. El contenido total o parcial no
Procedimiento AUDITORIA INTERNA Página 1 de 9 PROCEDIMIENTO AUDITORIA INTERNA Nota importante: El presente documento es de exclusiva propiedad de LUTROMO INDUSTRIAS LTDA. El contenido total o parcial no
1/ Frecuencia y fechas de reunión programada del CEIC.
 1/ Frecuencia y fechas de reunión programada del CEIC. El CEIC tiene programadas reuniones mensuales, excepto en el mes de Agosto. Estas reuniones tienen lugar entre los días 21 y 30 de cada mes (Normalmente
1/ Frecuencia y fechas de reunión programada del CEIC. El CEIC tiene programadas reuniones mensuales, excepto en el mes de Agosto. Estas reuniones tienen lugar entre los días 21 y 30 de cada mes (Normalmente
Prospecto: información para el usuario. Sorbenor 1g solución oral Aspartato de Arginina
 Prospecto: información para el usuario Sorbenor 1g solución oral Aspartato de Arginina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: información para el usuario Sorbenor 1g solución oral Aspartato de Arginina Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
La solidaridad corre por tus venas, dona sangre, dona vida!!!
 La solidaridad corre por tus venas, dona sangre, dona vida!!! Existen varios tipos de donación de sangre: De sangre, propiamente dicho. Este es el tipo más común de la donación de sangre, durante el cual
La solidaridad corre por tus venas, dona sangre, dona vida!!! Existen varios tipos de donación de sangre: De sangre, propiamente dicho. Este es el tipo más común de la donación de sangre, durante el cual
PROTECCION DE LAS FUENTES DE INFORMACION Y SU USO, OBTENIDA POR MEDIO DE RECOPILACION Y PROCESAMIENTO DE DATOS SOBRE SEGURIDAD OPERACIONAL
 Propuesta de Modelo de Ley PROTECCION DE LAS FUENTES DE INFORMACION Y SU USO, OBTENIDA POR MEDIO DE RECOPILACION Y PROCESAMIENTO DE DATOS SOBRE SEGURIDAD OPERACIONAL Artículo 1: NATURALEZA Esta ley es
Propuesta de Modelo de Ley PROTECCION DE LAS FUENTES DE INFORMACION Y SU USO, OBTENIDA POR MEDIO DE RECOPILACION Y PROCESAMIENTO DE DATOS SOBRE SEGURIDAD OPERACIONAL Artículo 1: NATURALEZA Esta ley es
Analizan los beneficios vasculares
 Analizan los beneficios vasculares Artículo: La terapia con estatinas reduce el riesgo de presentar eventos vasculares graves, sin importar la concentración basal de proteína C reactiva que presente el
Analizan los beneficios vasculares Artículo: La terapia con estatinas reduce el riesgo de presentar eventos vasculares graves, sin importar la concentración basal de proteína C reactiva que presente el
RECOMENDACIONES PARA DESARROLLAR UN PROGRAMA DE ATENCIÓN FARMACÉUTICA AL PACIENTE VIH
 RECOMENDACIONES PARA DESARROLLAR UN PROGRAMA DE ATENCIÓN FARMACÉUTICA AL PACIENTE VIH INTRODUCCIÓN La atención al paciente HIV se ha convertido en estos últimos años en una de las áreas más importantes
RECOMENDACIONES PARA DESARROLLAR UN PROGRAMA DE ATENCIÓN FARMACÉUTICA AL PACIENTE VIH INTRODUCCIÓN La atención al paciente HIV se ha convertido en estos últimos años en una de las áreas más importantes
PROGRAMACIÓN DIDÁCTICA
 PROGRAMACIÓN DIDÁCTICA CICLO FORMATIVO DE GRADO MEDIO: TÉCNICO EN SISTEMAS MICROINFORMÁTICOS Y REDES MÓDULO PROFESIONAL: FORMACIÓN EN CENTROS DE TRABAJO Módulo Formación en Centros de Trabajo. Curso Segundo
PROGRAMACIÓN DIDÁCTICA CICLO FORMATIVO DE GRADO MEDIO: TÉCNICO EN SISTEMAS MICROINFORMÁTICOS Y REDES MÓDULO PROFESIONAL: FORMACIÓN EN CENTROS DE TRABAJO Módulo Formación en Centros de Trabajo. Curso Segundo
NORMATIVA DE RECONOCIMIENTO ACADÉMICO PARA ESTUDIANTES DE INTERCAMBIO EN EL MARCO DEL PROGRAMA SÓCRATES, OTROS PROGRAMAS INTERNACIONALES Y DE
 NORMATIVA DE RECONOCIMIENTO ACADÉMICO PARA ESTUDIANTES DE INTERCAMBIO EN EL MARCO DEL PROGRAMA SÓCRATES, OTROS PROGRAMAS INTERNACIONALES Y DE CONVENIOS BILATERALES El constante incremento que la Universidad
NORMATIVA DE RECONOCIMIENTO ACADÉMICO PARA ESTUDIANTES DE INTERCAMBIO EN EL MARCO DEL PROGRAMA SÓCRATES, OTROS PROGRAMAS INTERNACIONALES Y DE CONVENIOS BILATERALES El constante incremento que la Universidad
ORDENACIÓN DE LAS ACTUACIONES PERÍODICAS DEL CONSEJO SOCIAL EN MATERIA ECONÓMICA
 Normativa Artículo 2, 3 y 4 de la Ley 12/2002, de 18 de diciembre, de los Consejos Sociales de las Universidades Públicas de la Comunidad de Madrid Artículo 14 y 82 de la Ley Orgánica 6/2001, de 21 de
Normativa Artículo 2, 3 y 4 de la Ley 12/2002, de 18 de diciembre, de los Consejos Sociales de las Universidades Públicas de la Comunidad de Madrid Artículo 14 y 82 de la Ley Orgánica 6/2001, de 21 de
8. RESULTADOS PREVISTOS
 8. RESULTADOS PREVISTOS Para determinar las tasas de graduación, eficiencia y abandono es recomendable partir de los resultados obtenidos en los últimos años: E.U. de Magisterio de Guadalajara. Tasa de
8. RESULTADOS PREVISTOS Para determinar las tasas de graduación, eficiencia y abandono es recomendable partir de los resultados obtenidos en los últimos años: E.U. de Magisterio de Guadalajara. Tasa de
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
CUADERNO DE PRÁCTICAS CURSO 2010-2011 ADMINISTRACIÓN DE SERVICIOS DE ENFERMERÍA
 CUADERNO DE PRÁCTICAS CURSO 2010-2011 ADMINISTRACIÓN DE SERVICIOS DE ENFERMERÍA ATENCIÓN HOSPITALARIA ALUMNO: CENTRO/UNIDAD: COORDINADOR: PROFESOR TUTOR: FECHA DE REALIZACIÓN: 1 ADMINISTRACIÓN DE SERVICIOS
CUADERNO DE PRÁCTICAS CURSO 2010-2011 ADMINISTRACIÓN DE SERVICIOS DE ENFERMERÍA ATENCIÓN HOSPITALARIA ALUMNO: CENTRO/UNIDAD: COORDINADOR: PROFESOR TUTOR: FECHA DE REALIZACIÓN: 1 ADMINISTRACIÓN DE SERVICIOS
UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA FORMULACIÓN Y EVALUACIÓN DEL PROYECTO: BLUMEN: CENTRO DE ESTIMULACIÓN TEMPRANA Y PROBLEMAS DE APRENDIZAJE
 UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA FORMULACIÓN Y EVALUACIÓN DEL PROYECTO: BLUMEN: CENTRO DE ESTIMULACIÓN TEMPRANA Y PROBLEMAS DE APRENDIZAJE TESINA Previa a la obtención del: DIPLOMADO EN GESTIÓN EN
UNIVERSIDAD TÉCNICA PARTICULAR DE LOJA FORMULACIÓN Y EVALUACIÓN DEL PROYECTO: BLUMEN: CENTRO DE ESTIMULACIÓN TEMPRANA Y PROBLEMAS DE APRENDIZAJE TESINA Previa a la obtención del: DIPLOMADO EN GESTIÓN EN
REGLAMENTO DE EXAMEN DE GRADO
 PONTIFICIA UNIVERSIDAD CATOLICA DE VALPARAISO FACULTAD DE FILOSOFIA Y EDUCACION ESCUELA DE PSICOLOGIA REGLAMENTO DE EXAMEN DE GRADO TITULO PRIMERO: DISPOSICIONES GENERALES ART. 1: Para los efectos de aplicación
PONTIFICIA UNIVERSIDAD CATOLICA DE VALPARAISO FACULTAD DE FILOSOFIA Y EDUCACION ESCUELA DE PSICOLOGIA REGLAMENTO DE EXAMEN DE GRADO TITULO PRIMERO: DISPOSICIONES GENERALES ART. 1: Para los efectos de aplicación
TABLA No 01. TASA DE MORTALIDAD PERU POR DPTOS 1992 TASA x 100,00 MUJERES 15 AÑOS
 II.- INTRODUCCIÓN El cáncer cervical es uno de los cánceres más comunes, el cual representa el 6% de todas las neoplasias malignas en mujeres. Se estima que cada año hay 16,000 casos nuevos de cáncer cervical
II.- INTRODUCCIÓN El cáncer cervical es uno de los cánceres más comunes, el cual representa el 6% de todas las neoplasias malignas en mujeres. Se estima que cada año hay 16,000 casos nuevos de cáncer cervical
PROCEDIMIENTO DE GESTIÓN AMBIENTAL:
 Fecha: 06/05/2015 PROCEDIMIENTO DE GESTIÓN AMBIENTAL: Nombre y Cargo Firma Fecha Elaborado Pilar Rueda de la Puerta 06/05/2015 Revisado Responsable de Gestión Ambiental Luis M. López Siles Director Económico-Administrativo
Fecha: 06/05/2015 PROCEDIMIENTO DE GESTIÓN AMBIENTAL: Nombre y Cargo Firma Fecha Elaborado Pilar Rueda de la Puerta 06/05/2015 Revisado Responsable de Gestión Ambiental Luis M. López Siles Director Económico-Administrativo
PRÁCTICAS ADMINISTRATIVAS
 DIPLOMATURA EN GESTIÓN Y ADMINISTRACIÓN PÚBLICA PROGRAMA DE LA ASIGNATURA PRÁCTICAS ADMINISTRATIVAS Código: 445 (16 créditos) CURSO 2011-12 Coordinadora: Mª Teresa Balaguer Coll Departamento de Finanzas
DIPLOMATURA EN GESTIÓN Y ADMINISTRACIÓN PÚBLICA PROGRAMA DE LA ASIGNATURA PRÁCTICAS ADMINISTRATIVAS Código: 445 (16 créditos) CURSO 2011-12 Coordinadora: Mª Teresa Balaguer Coll Departamento de Finanzas
El Estudio PARTNER. Le han propuesto incorporarse a este estudio porque es parte de una pareja como miembro VIH positivo.
 Información para los participantes y Consentimiento Informado para el miembro de la pareja VIH positivo El Estudio PARTNER El estudio PARTNER se realiza con parejas en las que: (i) uno de los miembros
Información para los participantes y Consentimiento Informado para el miembro de la pareja VIH positivo El Estudio PARTNER El estudio PARTNER se realiza con parejas en las que: (i) uno de los miembros
Acuerdo de aprobación de la Normativa Básica de Correo Electrónico de la Universidad Miguel Hernández.
 Acuerdo de aprobación de la Normativa Básica de Correo Electrónico de la Universidad Miguel Hernández. Con el fin de regular el uso de los recursos informáticos y telemáticos del servicio de correo en
Acuerdo de aprobación de la Normativa Básica de Correo Electrónico de la Universidad Miguel Hernández. Con el fin de regular el uso de los recursos informáticos y telemáticos del servicio de correo en
Capítulo 8 - Reglas adicionales para ISO9001: 2008
 Capítulo 8 - Reglas adicionales para ISO9001: 2008 TABLA DE CONTENIDOS Artículo 8.1 Tipos de auditorías... 2 Artículo 8.2 Clasificación de no conformidades... 3 Artículo 8.3 Sanciones y condiciones para
Capítulo 8 - Reglas adicionales para ISO9001: 2008 TABLA DE CONTENIDOS Artículo 8.1 Tipos de auditorías... 2 Artículo 8.2 Clasificación de no conformidades... 3 Artículo 8.3 Sanciones y condiciones para
GESTIÓN DE LA DOCUMENTACIÓN
 Página: 1 de 8 Elaborado por: Revidado por: Aprobado por: Comité de calidad Responsable de calidad Director Misión: Controlar los documentos y registros del Sistema de Gestión de Calidad para garantizar
Página: 1 de 8 Elaborado por: Revidado por: Aprobado por: Comité de calidad Responsable de calidad Director Misión: Controlar los documentos y registros del Sistema de Gestión de Calidad para garantizar
PROTOCOLO DE ENSAYO CLÍNICO
 PROTOCOLO DE ENSAYO CLÍNICO Fármacos: Bortezomib (Velcade ) y Lenalidomida Código de Protocolo: GEM2010MAS65 Título del estudio: Estudio Fase IIb Nacional, Abierto, Multicéntrico, Randomizado, Comparativo
PROTOCOLO DE ENSAYO CLÍNICO Fármacos: Bortezomib (Velcade ) y Lenalidomida Código de Protocolo: GEM2010MAS65 Título del estudio: Estudio Fase IIb Nacional, Abierto, Multicéntrico, Randomizado, Comparativo
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
Informe de Seguimiento. Graduado o Graduada en Administración y Dirección de Empresas. Empresas de la Universidad de Cádiz
 Informe de Seguimiento Graduado o Graduada en Administración y Dirección de Empresas de la Universidad de Cádiz 1. ÁMBITO NORMATIVO El artículo 27 del Real Decreto 1393/2007, de 29 de octubre, modificado
Informe de Seguimiento Graduado o Graduada en Administración y Dirección de Empresas de la Universidad de Cádiz 1. ÁMBITO NORMATIVO El artículo 27 del Real Decreto 1393/2007, de 29 de octubre, modificado
PROTOCOLO PARA LA AUTO - GRABACIÓN DEL VIDEO DE AULA
 PROTOCOLO PARA LA AUTO - GRABACIÓN DEL VIDEO DE AULA Introducción El presente manual es un elemento fundamental para garantizar la calidad y claridad de la grabación de la práctica docente que será usada
PROTOCOLO PARA LA AUTO - GRABACIÓN DEL VIDEO DE AULA Introducción El presente manual es un elemento fundamental para garantizar la calidad y claridad de la grabación de la práctica docente que será usada
INDICADORES. PROBLEMAS ASOCIADOS A SU SELECCIÓN PARA MEDIR SUSTENTABILIDAD Y EFICIENCIA AMBIENTAL
 FUNDACION NEXUS ciencias sociales medio ambiente salud INDICADORES. PROBLEMAS ASOCIADOS A SU SELECCIÓN PARA MEDIR SUSTENTABILIDAD Y EFICIENCIA AMBIENTAL Por Daniel Fernández Dillon Ingeniería Sanitaria
FUNDACION NEXUS ciencias sociales medio ambiente salud INDICADORES. PROBLEMAS ASOCIADOS A SU SELECCIÓN PARA MEDIR SUSTENTABILIDAD Y EFICIENCIA AMBIENTAL Por Daniel Fernández Dillon Ingeniería Sanitaria
MANUAL DE CALIDAD MANUAL DE CALIDAD. COPIA NO CONTROLADA Empresa S.A.
 Página : 1 de 14 MANUAL DE CALIDAD Empresa S.A. Esta es una copia no controlada si carece de sello en el reverso de sus hojas, en cuyo caso se advierte al lector que su contenido puede ser objeto de modificaciones
Página : 1 de 14 MANUAL DE CALIDAD Empresa S.A. Esta es una copia no controlada si carece de sello en el reverso de sus hojas, en cuyo caso se advierte al lector que su contenido puede ser objeto de modificaciones
CONVENCIÓN INTERNACIONAL CONTRA EL DOPAJE EN EL DEPORTE. Anexo II - Normas para la concesión de autorizaciones para uso con fines terapéuticos
 Resolución 2CP/10 CONVENCIÓN INTERNACIONAL CONTRA EL DOPAJE EN EL DEPORTE Anexo II - Normas para la concesión de autorizaciones para uso con fines terapéuticos París, 1º de enero de 2011 - 2 - Extracto
Resolución 2CP/10 CONVENCIÓN INTERNACIONAL CONTRA EL DOPAJE EN EL DEPORTE Anexo II - Normas para la concesión de autorizaciones para uso con fines terapéuticos París, 1º de enero de 2011 - 2 - Extracto
EchinaMed Junior, comprimidos
 EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
Podrá participar en el presente Juego cualquier persona física que cumpla los siguientes requisitos:
 BASES LEGALES DEL JUEGO JubiGame 1.- Organización y objeto del Juego A continuación se detallan los términos y condiciones (Bases) del Juego JubiGame (Juego o Jubigame) promovido por Banco Bilbao Vizcaya
BASES LEGALES DEL JUEGO JubiGame 1.- Organización y objeto del Juego A continuación se detallan los términos y condiciones (Bases) del Juego JubiGame (Juego o Jubigame) promovido por Banco Bilbao Vizcaya
Guía del paciente. Braquiterapia: El mejor modo de tratar el cáncer. Porque la vida es para vivirla
 Guía del paciente Braquiterapia: El mejor modo de tratar el cáncer Porque la vida es para vivirla El objetivo de este folleto es ayudar a aquellas personas que han recibido un diagnóstico de cáncer, así
Guía del paciente Braquiterapia: El mejor modo de tratar el cáncer Porque la vida es para vivirla El objetivo de este folleto es ayudar a aquellas personas que han recibido un diagnóstico de cáncer, así
ENCUESTA DE AUTO-EVALUACIÓN DE LOS HOSPITALES
 ENCUESTA DE AUTO-EVALUACIÓN DE LOS HOSPITALES INICIATIVA HOSPITAL AMIGO DE LOS NIÑOS DE LA OMS/UNICEF Cómo utilizar el cuestionario de Auto-evaluación Este cuestionario de auto-evaluación permite a los
ENCUESTA DE AUTO-EVALUACIÓN DE LOS HOSPITALES INICIATIVA HOSPITAL AMIGO DE LOS NIÑOS DE LA OMS/UNICEF Cómo utilizar el cuestionario de Auto-evaluación Este cuestionario de auto-evaluación permite a los
8. MEDICIÓN, ANÁLISIS Y MEJORA
 Página 1 de 12 8.1 Generalidades La Alta Gerencia de La ADMINISTRACIÓN DE LA ZONA LIBRE DE COLÓN planea e implementa los procesos de seguimiento, medición, análisis y mejoras necesarias para: Demostrar
Página 1 de 12 8.1 Generalidades La Alta Gerencia de La ADMINISTRACIÓN DE LA ZONA LIBRE DE COLÓN planea e implementa los procesos de seguimiento, medición, análisis y mejoras necesarias para: Demostrar
Informe final de evaluación del seguimiento de la implantación de títulos oficiales MÁSTER UNIVERSITARIO EN PERIODISMO MULTIMEDIA PROFESIONAL
 Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2013 MÁSTER UNIVERSITARIO EN PERIODISMO MULTIMEDIA PROFESIONAL Facultad de Ciencias de la Información UCM INFORMACIÓN
Informe final de evaluación del seguimiento de la implantación de títulos oficiales 2013 MÁSTER UNIVERSITARIO EN PERIODISMO MULTIMEDIA PROFESIONAL Facultad de Ciencias de la Información UCM INFORMACIÓN
Suplemento Enero 2014
 DOCUMENTOS BÁSICOS Volumen I Edición de 2010 Suplemento Enero 2014 En su 109º periodo de sesiones, celebrado del 5 al 9 de noviembre de 2012, el Consejo aprobó enmiendas al Reglamento que rige las resoluciones
DOCUMENTOS BÁSICOS Volumen I Edición de 2010 Suplemento Enero 2014 En su 109º periodo de sesiones, celebrado del 5 al 9 de noviembre de 2012, el Consejo aprobó enmiendas al Reglamento que rige las resoluciones
VIGILANCIA EPIDEMIOLÓGICA DEL SIDA REGIÓN DE MURCIA. RESUMEN DE SITUACIÓN A 30 DE JUNIO DE 2010
 VIGILANCIA EPIDEMIOLÓGICA DEL SIDA REGIÓN DE MURCIA. RESUMEN DE SITUACIÓN A 0 DE JUNIO DE A nivel mundial la epidemia de sida está comenzando a cambiar su curso, pues el número de nuevas infecciones por
VIGILANCIA EPIDEMIOLÓGICA DEL SIDA REGIÓN DE MURCIA. RESUMEN DE SITUACIÓN A 0 DE JUNIO DE A nivel mundial la epidemia de sida está comenzando a cambiar su curso, pues el número de nuevas infecciones por
NORMATIVA DEL TRABAJO FIN DE CARRERA DE LAS TITULACIONES LDO.
 NORMATIVA DEL TRABAJO FIN DE CARRERA DE LAS TITULACIONES LDO. en ADE y DIPLOMADO EN GAP DE LA FACULTAD DE ADE (Aprobada en Junta de Centro septiembre de 2010) Modificaciones: Comisión Permanente de la
NORMATIVA DEL TRABAJO FIN DE CARRERA DE LAS TITULACIONES LDO. en ADE y DIPLOMADO EN GAP DE LA FACULTAD DE ADE (Aprobada en Junta de Centro septiembre de 2010) Modificaciones: Comisión Permanente de la
6. LOS PROCEDIMIENTOS Y CRITERIOS DE EVALUACIÓN, PROMOCIÓN DEL ALUMNADO Y TITULACIÓN DEL ALUMNADO.
 6. LOS PROCEDIMIENTOS Y CRITERIOS DE EVALUACIÓN, PROMOCIÓN DEL ALUMNADO Y TITULACIÓN DEL ALUMNADO. Los criterios de evaluación en las distintas enseñanzas que se imparten en el centro están recogidos en
6. LOS PROCEDIMIENTOS Y CRITERIOS DE EVALUACIÓN, PROMOCIÓN DEL ALUMNADO Y TITULACIÓN DEL ALUMNADO. Los criterios de evaluación en las distintas enseñanzas que se imparten en el centro están recogidos en
