Unidad 2. Técnicas básicas de microbiología Práctica 5. Preparaciones Microbiológicas
|
|
|
- José Ángel Ruiz Olivera
- hace 7 años
- Vistas:
Transcripción
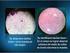
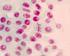
1 Unidad 2. Técnicas básicas de microbiología Práctica 5. Preparaciones Microbiológicas Objetivos Realizar diferentes preparaciones microbiológicas a partir de muestras naturales y cultivos puros. Describir las características morfológicas y de locomoción de microorganismos que se encuentran en muestras naturales en una preparación húmeda sin teñir. Reconocer las características morfológicas microscópicas de los hongos filamentosos saprófitos empleando una preparación húmeda teñida. Describir las características microscópicas morfológicas y de agrupación de bacterias y hongos levaduriformes empleando una tinción simple. Aplicar tinciones diferenciales e identificar las características estructurales mediante las afinidades tintoriales de las bacterias. Localizar y describir las características de las endosporas bacterianas aplicando una tinción selectiva. Identificar las cápsulas microbianas en cultivos puros y muestras naturales empleando una tinción negativa. Introducción El tamaño de los microorganismos impide detectarlos a simple vista, por lo que es esencial el uso del microscopio. Para que un objeto pueda ser percibido a través del microscopio, este debe poseer cierto grado de contraste con el medio circundante. Para aumentar el contraste de los microorganismos y lograr una mejor observación de los mismos, se emplean diferentes técnicas de tinción, las cuales se basan en la capacidad de los microorganismos para retener (o no) ciertos colorantes lo que depende de la carga de la célula y del colorante. Las tinciones diferenciales de Gram y de Ziehl Neelsen se basan en la composición y estructura de la pared celular de las bacterias, que determina que unas bacterias retengan el primer colorante, en tanto que otras lo pierdan, lo que les permite reaccionar con el colorante de contraste. Las tinciones selectivas son aquéllas que permiten observar una estructura celular determinada, algunas bacterias tienen la capacidad de producir endosporas y/o producir exopolisacáridos conocidos como cápsulas. Las endosporas bacterianas estructuras de resistencia que se caracterizan por presentar varias capas compuestas de proteínas y azúcares complejos, mientras que en el protoplasto de la misma existe un complejo de dipicolinato de calcio, debido a esta composición, es muy difícil que los colorantes penetren, por lo que al aplicar una tinción simple, estas aparecen como cuerpos incoloros (dentro o fuera de la célula). No obstante es posible teñirlas mediante la aplicación de métodos drásticos. Con respecto a la cápsula, esta es una cubierta extracelular constituida por agua y polisacáridos que se acumulan alrededor de la célula, estos componentes no se combinan con los colorantes, por lo que para la observación de la misma se emplean tinciones negativas con las que se oscurece el fondo de la preparación y de esta manera se contrastan las cápsulas. ME /1 - Práctica 5 - Página 1
2 1ª sesión 5.1. Preparaciones húmedas 5.2. Preparación húmeda teñida (impronta) 5.3. Preparaciones fijas 5.4. Tinción simple Materiales Muestras: Agua de charco Alimento enmohecido Pulque Cultivos puros de: Bacillus sp. Micrococcus luteus Saccharomyces cerevisiae Serratia marcescens Staphylococcus sp Streptococcus sp Streptomyces sp Material por equipo: 1 Microscopio Aceite de inmersión Pipetas Pasteur con bulbo Preparaciones fijas 1 frasco gotero con Azul de metileno 1 frasco gotero con safranina 1 frasco gotero con cristal violeta 1 frasco gotero con azul de algodón lactofenol Material que deben tener los alumnos: 2 Mecheros 2 Asas Portaobjetos Cubreobjetos Charola para tinción Puente de vidrio Piseta Pinzas Paño limpio Papel seda Letras pequeñas recortadas Agua de charco o pulque ME /1 - Práctica 5 - Página 2
3 Metodología Lavar y desengrasar los portaobjetos y cubreobjetos. Para ello emplear jabón líquido y agua; enjuagar varias veces con alcohol al 95 %, ponerlos a secar y flamearlos 2 a 3 veces Preparaciones húmedas 1. Con una pipeta Pasteur colocar una gota de la muestra (agua o de pulque) en el centro del portaobjetos, cubrir la gota con un cubreobjetos. 2. Observar al microscopio con los objetivos de 10x y 40x, nunca con el objetivo de inmersión. 3. Esquematizar la morfología y movimiento de los microorganismos observados. 4. Registrar las observaciones de la siguiente manera. Dibujar observación Fecha: Muestra: Tinción: Aumento: Descripción: 5.2. Preparación húmeda teñida de hongos filamentosos (técnica de impronta con diurex) 1. Cortar un pedazo de diurex de aproximadamente 1.5 cm. 2. Colocar una gota de lactofenol azul de algodón en un portaobjetos limpio y desengrasado. 3. Esterilizar el asa micológica y dejar enfriar. 4. Colocar el diurex en el extremo del asa y presionar el diurex sobre el cultivo de hongo en caja cuidando de no frotar (figura 1). 5. Con ayuda del asa bacteriológica depositar el diurex (con la muestra hacia el colorante) en el portaobjetos (figura 2). 6. Agregar una gota de colorante sobre el diurex para evitar la formación de burbujas. 7. Colocar un cubreobjetos (figura 3). 8. Observar al microscopio con los objetivos 10x y 40x. Figura 1. Figura 2. Figura 3. Asa micológica Diurex Muestra Colorante 10x 40x Cubreobjetos Colorante Diurex con muestra Colorante ME /1 - Práctica 5 - Página 3
4 5.3. Preparaciones fijas 1. Etiquetar los portaobjetos en uno de sus extremos. 2. Colocar una pequeña gota en el centro del portaobjetos. 3. Esterilizar el asa de siembra y en condiciones asépticas tomar una pequeña cantidad del cultivo en medio sólido. 4. Con el asa mezclar suavemente el cultivo con el agua hasta obtener una suspensión homogénea y extenderla en el centro del portaobjetos. 5. Esterilizar el asa. 6. Si la muestra se toma de un cultivo líquido, no es necesario poner la gota de agua, sino que se extiende directamente sobre el portaobjetos. 7. Dejar secar totalmente la preparación a temperatura ambiente. 8. Fijar el frote con calor. Cuando el frote está perfectamente seco pasar de cuatro a cinco veces el portaobjetos por la flama del mechero y dejar enfriar Tinción simple 1. Cubrir el frote fijo con 3 gotas del colorante básico (azul de metileno, safranina o cristal violeta) y dejar actuar durante 1 minuto. 2. Sobre una charola escurrir el colorante y lavar la preparación con agua, para ello inclinar el portaobjetos y en la parte superior aplicar el agua con una pizeta de manera que resbale sobre el frote. 3. Colocar el portaobjetos inclinado sobre una toalla de papel absorbente y dejar secar a temperatura ambiente. 4. Observar al microscopio con los objetivos de 10x, 40x y 100x (inmersión). 5. Esquematizar sus observaciones y describir las características de los microorganismos observados empleando los términos adecuados respecto a la morfología, agrupación y estructuras. Ejemplos: bacilos largos con extremos redondos, cocos agrupados en cadenas denominadas estreptococos, célula de forma ovoide con estructuras internas Tinciones diferenciales Tinción de Gram Tinción de Ziehl Neelsen 2ª sesión Materiales Cepas control Staphylococcus aureus ATCC Escherichia coli ATCC Cepas de prueba (X) Bacillus sp Streptococcus viridans Moraxella sp o Neisseria sp Mycobacterium sp Nocardia sp ME /1 - Práctica 5 - Página 4
5 Material por equipo: 1 Microscopio Aceite de inmersión 1 charola de metal 1 tripié 1 cuadro de papel filtro 1 gradilla 1 vaso de precipitados de 250mL 1 juego de reactivos para tinción de Gram 1 frasco gotero con Fucsina fenicada 1 frasco gotero con Azul de metileno de Loeffler 1 frasco gotero con Alcohol ácido Material que deben tener los alumnos: 2 Mecheros 2 Asas Portaobjetos Cubreobjetos Charola para tinción Puente de vidrio para tinciones Pinzas Piseta Paño limpio y papel seda Metodología Lavar y desengrasar los portaobjetos y cubreobjetos. Para ello emplear jabón líquido y agua; enjuagar varias veces con alcohol al 95 %, ponerlos a secar y flamearlos 2 a 3 veces Tinciones diferenciales Tinción de Gram: 1. Etiquetar tres portaobjetos por uno de sus extremos con los nombres de: Staphylococcus aureus, Escherichia coli y el tercero con la bacteria X. 2. Preparar los frotes bacterianos a partir de cultivos líquidos o sólidos. 3. Fijar con calor. 4. Agregar cristal violeta en cantidad suficiente para cubrir el frote (2 a 3 gotas) y dejar actuar 1 minuto. 5. Lavar con agua para eliminar el exceso de colorante. 6. Agregar lugol en cantidad suficiente para cubrir el frote (2 a 3 gotas) y dejar actuar 1 minuto. 7. Lavar con agua para eliminar el exceso de mordente. 8. Decolorar con alcohol acetona hasta que el efluente salga incoloro. 9. Lavar con agua para eliminar el exceso de disolvente. 10. Agregar safranina en cantidad suficiente hasta cubrir el frotis (2 ó 3 gotas) y dejar actuar 1 minuto. 11. Lavar con agua para eliminar el exceso del colorante de contraste. 12. Dejar secar la preparación a temperatura ambiente. 13. Observar al microscopio con los objetivos de 10x, 40x y 100x (inmersión). ME /1 - Práctica 5 - Página 5
6 14. Esquematizar las observaciones realizadas con el objetivo de mayor aumento y describir las características de los microorganismos observados e indicar si son Gram positivos o Gram negativos (Cuadro 1). Tinción de Ziehl Neelsen: 1. Etiquetar los portaobjetos por uno de sus extremos 2. En el portaobjetos colocar 1 gota del cultivo de Mycobacterium sp y 1 gota del cultivo de Staphylococcus aureus o Micrococcus luteus. 3. Con el asa mezclar las dos suspensiones. 4. Secar al aire y fijar con calor. 5. Cubrir la preparación con un papel filtro y saturarla con fucsina básica fenicada, calentar la preparación pasando la flama del mechero. Dejar actuar el colorante durante 10 minutos cuidando que no se seque la preparación. 6. Con unas pinzas largas retirar el papel filtro y colocarlo en un frasco para su posterior desecho. 7. Lavar con abundante agua (hasta que el efluente salga incoloro). 8. Decolorar con alcohol ácido el que se agrega gota a gota hasta que el efluente salga incoloro. 9. Lavar la preparación. 10. Cubrir la preparación con 2 a 3 gotas de azul de metileno de Loeffler y dejar actuar 2 minutos. 11. Lavar el exceso de colorante con agua. 12. Secar al aire. 13. Observar al microscopio con el objetivo de inmersión (100x). 14. Esquematizar sus observaciones y describir las características de los microorganismos observados e indicar si son Bacterias Ácido Alcohol Resistentes (BAAR) o bacterias No Ácido Alcohol Resistentes (cuadro 2). Discusión de resultados Cuadro 1. Resultados de la tinción de Gram Microorganismo Forma Agrupación Gram Ilustración Forma: Bacilo, coco, otro. Agrupación: Pares, cadena, racimo, ninguno, otro. Gram: Positivo, negativo, no determinado. Cuadro 2. Resultados de la tinción de Ziehl Neelsen Microorganismo Forma Agrupación Ácido resistencia Ilustración ME /1 - Práctica 5 - Página 6
7 1. Comparar los resultados obtenidos de la bacteria X con las cepas control 2. Analizar las posibles causas de error en el procedimiento o los factores que contribuyeron a la correcta tinción de las bacterias en estudio. 3. Puede una bacteria Gram positiva teñirse como Gram negativa? Por qué? 5.6. Tinción selectiva y tinción negativa Tinción de endosporas bacterianas Tinción negativa de cápsula 3ª sesión Materiales Cultivos puros de Azotobacter sp Leuconostoc mesenteroides Bacillus cereus Clostridium sp Enterobacter sp Muestra de pulque Material por equipo 1 microscopio 1 vaso de precipitados de 250 ml 1 charola de metal 1 tripie 1 gradilla 1 cuadro de papel filtro 1 frasco gotero con Verde de malaquita 1 frasco gotero con Safranina al 0.5% 1 frasco gotero con Azul de metileno 1 frasco gotero con Tinta china (1:1) 1 frasco gotero con Cristal violeta al 1.0 % 1 frasco gotero con Safranina al 0.25% 1 frasco con aceite de inmersión Material que deben tener los alumnos: 2 Mecheros 2 Asas Portaobjetos Cubreobjetos Charola para tinción Puente de vidrio para tinción Pinzas Piseta Paño limpio Papel seda ME /1 - Práctica 5 - Página 7
8 Metodología Lavar y desengrasar los portaobjetos y cubreobjetos. Para ello emplear jabón líquido y agua; enjuagar varias veces con alcohol al 95 %, ponerlos a secar y flamearlos 2 a 3 veces Tinción selectiva y tinción negativa Tinción de endosporas: 1. Etiquetar los portaobjetos por uno de sus extremos. 2. Preparar 2 frotes fijos a partir de los cultivos de Bacillus cereus, Clostridium sp y Enterobacter sp. 3. Aplicar una tinción simple a uno de los frotes. 4. Cubrir el segundo frote de cada microorganismo con papel filtro y saturarlo con verde de malaquita. 5. Calentar la preparación sobre un vaso de precipitados con emisión de vapores de agua durante 10 minutos, cuidando que el colorante no hierva y mantener la preparación húmeda. 6. Retirar el papel filtro con unas pinzas y colocarlo en un frasco para su posterior desecho. 7. Lavar con agua. 8. Agregar 3 gotas de una solución de safranina al 0.5 % y dejarla reaccionar durante 30 segundos. 9. Lavar, dejar secar al aire y observar con el objetivo de inmersión. Tinción negativa de cápsula: 1. En el extremo del portaobjetos, colocar una gota de agua y una de tinta china y mezclar. 2. Suspender una asada de Leuconostoc sp en la mezcla anterior. 3. Colocar el borde de otro portaobjetos sobre la gota y deslizar éste sobre el portaobjetos que contiene la muestra formando una película delgada. 4. Dejar secar al aire (no fijar la preparación). 5. Cubrir el frote con cristal violeta o safranina al 0.5%, dejar actuar durante un minuto. 6. Lavar, dejar secar al aire y observar la preparación con el objetivo de inmersión. 7. Repetir el procedimiento con los cultivos de Azotobacter sp y con la muestra de pulque. Disposición de desechos 1. Después de efectuar las observaciones, los portaobjetos se sumergen durante 10 minutos en una solución sanitizante de hipoclorito de sodio al 10 % a partir de una solución comercial, después se lavan con detergente líquido, se enjuagan y se sumergen en alcohol al 95 % durante 24 horas. 2. En caso de que las preparaciones se rompan, envolverlas en papel, esterilizar en autoclave y desecharlas en el contenedor exclusivo para material roto de vidrio. 3. Los portaobjetos rotos o dañados que se encuentren limpios se colocan directamente en el mismo contenedor 4. Esterilizar en autoclave los cultivos bacterianos y muestras empleadas y desecharlas 5. Los desechos de colorantes se colocan en los contenedores dispuestos para este fin en cada laboratorio. Posteriormente se someten a adsorción con carbón activado y el agua libre de colorante es desechada ME /1 - Práctica 5 - Página 8
9 Bibliografía complementaria Cappuccino, James G. and Sherman Natalie Microbiology: a laboratory manual. 7 th edition. Pearson/Benjamin Cummings. USA. QR63 C Leboffe Michael J. and Burton E. Pierce Microbiology laboratory theory and application. 2 nd edition, Morton Publishing Co. USA. QR63 L Madigan, M. T. and J. M. Martinko Brock Biology of microorganisms. 11 th edition. Pearson Prentice Hall. USA. QR41.2 B Prescott Lansing M., Harley John P. and Klein Donald A Microbiology. 6 th edition. McGraw-Hill. USA. QR41.2 P Tortora Gerard J., Funke Berdell R. and Case Christine L Microbiology: an introduction. 9th edition. Benjamin Cummings. USA. QR41.2 T ME /1 - Práctica 5 - Página 9
Unidad 2. Técnicas básicas de microbiología Práctica 3. Preparaciones Microbiológicas
 Unidad 2. Técnicas básicas de microbiología Práctica 3. Preparaciones Microbiológicas Objetivos Realizar diferentes preparaciones microbiológicas a partir de muestras naturales y cultivos puros. Describir
Unidad 2. Técnicas básicas de microbiología Práctica 3. Preparaciones Microbiológicas Objetivos Realizar diferentes preparaciones microbiológicas a partir de muestras naturales y cultivos puros. Describir
Protocolos Laboratorio de Microbiología Experimental 2014 PREPARACIONES MICROBIOLÓGICAS
 PREPARACIONES MICROBIOLÓGICAS Objetivos PREPARACIONES HÚMEDAS (EN FRESCO) Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales.
PREPARACIONES MICROBIOLÓGICAS Objetivos PREPARACIONES HÚMEDAS (EN FRESCO) Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales.
PRÁCTICA 2.2 Preparaciones microbiológicas
 PRÁCTICA 2.2 Preparaciones microbiológicas Objetivos Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales y cultivos puros.
PRÁCTICA 2.2 Preparaciones microbiológicas Objetivos Al finalizar esta práctica el alumno será capaz de: Realizar diferentes preparaciones microbiológicas a partir de muestras naturales y cultivos puros.
Materiales. Cultivos puros de bacterias: Streptomyces griseus Streptomyces erythraeus
 Unidad 3. Estudio de cultivos bacterianos puros y Unidad 4. Estudio microscópico y cultivo de hongos, algas y protozoarios Práctica 6. Técnicas de siembra y cultivo de actinomicetos y hongos Objetivos
Unidad 3. Estudio de cultivos bacterianos puros y Unidad 4. Estudio microscópico y cultivo de hongos, algas y protozoarios Práctica 6. Técnicas de siembra y cultivo de actinomicetos y hongos Objetivos
PREPARACIONES Y TINCIONES
 PREPARACIONES Y TINCIONES PREPARACIONES En fresco Temporales: Microcultivos de hongos, preparaciones de tejidos Fijas: Gram, Ziehl Nielsen, Sheaffer y fulton, SEM, TEM, naranja de acridina. CONTRASTE DE
PREPARACIONES Y TINCIONES PREPARACIONES En fresco Temporales: Microcultivos de hongos, preparaciones de tejidos Fijas: Gram, Ziehl Nielsen, Sheaffer y fulton, SEM, TEM, naranja de acridina. CONTRASTE DE
MANUAL DE OPERACIONES. DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 15 SUBDIRECCIÓN DE INVESTIGACIÓN BIOMÉDICA MANUAL DE TINCIONES
 A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
Uso y cuidado del microscopio de campo claro.
 OBJETIVOS. Uso y cuidado del microscopio de campo claro. Al finalizar la práctica el estudiante será capaz de: Aplicar los cuidados básicos de un microscopio óptico de campo claro. Identificar las partes
OBJETIVOS. Uso y cuidado del microscopio de campo claro. Al finalizar la práctica el estudiante será capaz de: Aplicar los cuidados básicos de un microscopio óptico de campo claro. Identificar las partes
Preparaciones Microbiológicas. Preparaciones en fresco (microorganismos vivos) Preparaciones fijas y teñidas (microorganismos muertos)
 Preparaciones Microbiológicas Preparaciones en fresco (microorganismos vivos) Preparaciones fijas y teñidas (microorganismos muertos) Frotis Una capa delgada de muestra extendida sobre un portaobjetos
Preparaciones Microbiológicas Preparaciones en fresco (microorganismos vivos) Preparaciones fijas y teñidas (microorganismos muertos) Frotis Una capa delgada de muestra extendida sobre un portaobjetos
2.8 Estudio microscópico de los microorganismos.
 2.8 Estudio microscópico de los microorganismos. http://es.dreamstime.com/imagenes-de-archivo-microscopio-y-bacterias-image29404744 Preparaciones Microbiológicas Preparaciones en fresco (microorganismos
2.8 Estudio microscópico de los microorganismos. http://es.dreamstime.com/imagenes-de-archivo-microscopio-y-bacterias-image29404744 Preparaciones Microbiológicas Preparaciones en fresco (microorganismos
PRÁCTICA 5.1 Aislamiento de Microorganismos
 PRÁCTICA 5.1 Aislamiento de Microorganismos Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para el aislamiento
PRÁCTICA 5.1 Aislamiento de Microorganismos Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para el aislamiento
Materiales. Cultivos puros de hongos: Saccharomyces cerevisiae Rhodototula sp Penicillum sp Aspergillus niger Rhizopous sp Alternaria sp Fusarium sp
 Unidad 3. Estudio de cultivos bacterianos puros y Unidad 4. Estudio microscópico y cultivo de hongos algas y protozoarios Práctica 5. Técnicas de siembra y cultivo de bacterias y hongos Objetivos Aplicar
Unidad 3. Estudio de cultivos bacterianos puros y Unidad 4. Estudio microscópico y cultivo de hongos algas y protozoarios Práctica 5. Técnicas de siembra y cultivo de bacterias y hongos Objetivos Aplicar
PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión)
 PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para
PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON
 PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES
 ESCUELA DE SALUD GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia
ESCUELA DE SALUD GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA Departamento de Biología PROTOCOLO DE PRÁCTICAS MICROBIOLOGÍA EXPERIMENTAL
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA Departamento de Biología PROTOCOLO DE PRÁCTICAS MICROBIOLOGÍA EXPERIMENTAL 2012 INDICE Página UNIDAD I. INTRODUCCIÓN A LA MICROBIOLOGÍA PRÁCTICA
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA Departamento de Biología PROTOCOLO DE PRÁCTICAS MICROBIOLOGÍA EXPERIMENTAL 2012 INDICE Página UNIDAD I. INTRODUCCIÓN A LA MICROBIOLOGÍA PRÁCTICA
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA Departamento de Biología PROTOCOLO DE PRÁCTICAS MICROBIOLOGÍA EXPERIMENTAL
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA Departamento de Biología PROTOCOLO DE PRÁCTICAS MICROBIOLOGÍA EXPERIMENTAL Semestre 2014-1 INDICE Página UNIDAD I. INTRODUCCIÓN A LA MICROBIOLOGÍA
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE QUÍMICA Departamento de Biología PROTOCOLO DE PRÁCTICAS MICROBIOLOGÍA EXPERIMENTAL Semestre 2014-1 INDICE Página UNIDAD I. INTRODUCCIÓN A LA MICROBIOLOGÍA
EXPLICACIÓN DE TRABAJOS PRÁCTICOS COLORACIONES
 EXPLICACIÓN DE TRABAJOS PRÁCTICOS COLORACIONES Microbiología General Carrera: Tecnicatura Universitaria en Esterilización Analista Biológico 2015 DIFERENCIA ENTRE CÉLULA PROCARIOTA Y CÉLULA EUCARIOTA Morfología
EXPLICACIÓN DE TRABAJOS PRÁCTICOS COLORACIONES Microbiología General Carrera: Tecnicatura Universitaria en Esterilización Analista Biológico 2015 DIFERENCIA ENTRE CÉLULA PROCARIOTA Y CÉLULA EUCARIOTA Morfología
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE
 PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
Objetivos Describir los efectos de diferentes factores físicos en el crecimiento de bacterias.
 Unidad 8. Condiciones ambientales para el desarrollo, inhibición y destrucción de microorganismos. Práctica 8. Efecto de los factores ambientales y químicos Objetivos Describir los efectos de diferentes
Unidad 8. Condiciones ambientales para el desarrollo, inhibición y destrucción de microorganismos. Práctica 8. Efecto de los factores ambientales y químicos Objetivos Describir los efectos de diferentes
PRACTICA 2 TINCION DE GRAM
 PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
Unidad 3. Estudio de cultivos bacterianos puros Práctica 4. Técnicas de siembra y cultivo de bacterias
 Unidad 3. Estudio de cultivos bacterianos puros Práctica 4. Técnicas de siembra y cultivo de bacterias Objetivos Aplicar las diferentes técnicas de siembra que se emplean para el estudio y asilamiento
Unidad 3. Estudio de cultivos bacterianos puros Práctica 4. Técnicas de siembra y cultivo de bacterias Objetivos Aplicar las diferentes técnicas de siembra que se emplean para el estudio y asilamiento
Explique el significado de los términos magnificación, resolución y apertura numérica. Cuál es su importancia en microscopía?
 Fecha: dd / mm / aa Datos alumno Nombre: Informe de laboratorio Prácticas 2, 3, 4 y 5 PDF para impresión 1. Preguntas Explique el significado de los términos magnificación, resolución y apertura numérica.
Fecha: dd / mm / aa Datos alumno Nombre: Informe de laboratorio Prácticas 2, 3, 4 y 5 PDF para impresión 1. Preguntas Explique el significado de los términos magnificación, resolución y apertura numérica.
1ª sesión. Unidad 2. Técnicas básicas de microbiología. Práctica 2. Esterilización y preparación de medios de cultivo
 Unidad 2. Técnicas básicas de microbiología. Práctica 2. Esterilización y preparación de medios de cultivo Objetivos Explicar el concepto de esterilización y su utilidad en microbiología. Preparar correctamente
Unidad 2. Técnicas básicas de microbiología. Práctica 2. Esterilización y preparación de medios de cultivo Objetivos Explicar el concepto de esterilización y su utilidad en microbiología. Preparar correctamente
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO. OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico.
 GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
Importancia. Una de las técnicas más utilizadas en los laboratorios para clasificar microorganismos.
 Tinciones OBJETIVOS Estudiar las bases teóricas y químicas de una tinción biológica Realizar la preparación de un frotis Hacer una tinción simple Efectuar una tinción diferencial (Tinción Gram) Estudia
Tinciones OBJETIVOS Estudiar las bases teóricas y químicas de una tinción biológica Realizar la preparación de un frotis Hacer una tinción simple Efectuar una tinción diferencial (Tinción Gram) Estudia
PRÁCTICO N 3. Técnicas para la observación, aislamiento y conservación de microorganismos
 PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
Técnicas de observación de microorganismos
 Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
1ª PRÁCTICA DE MICROBIOLOGÍA:
 1ª PRÁCTICA DE MICROBIOLOGÍA: INTRODUCCIÓN A LAS TÉCNICAS DE CULTIVO EN MICROBIOLOGÍA (O COMO HACER VISIBLES ORGANISMOS INVISIBLES) INTRODUCCIÓN El objetivo de esta práctica es aislar y observar algunos
1ª PRÁCTICA DE MICROBIOLOGÍA: INTRODUCCIÓN A LAS TÉCNICAS DE CULTIVO EN MICROBIOLOGÍA (O COMO HACER VISIBLES ORGANISMOS INVISIBLES) INTRODUCCIÓN El objetivo de esta práctica es aislar y observar algunos
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
PRÁCTICA PARA EL ESTUDIO DE CULTIVOS BACTERIANOS PUROS (Siembra)
 PRÁCTICA PARA EL ESTUDIO DE CULTIVOS BACTERIANOS PUROS (Siembra) OBJETIVOS GENERALES. Al finalizar este ejercicio el alumno será capaz de: Aplicar las diferentes técnicas de siembra que se emplean para
PRÁCTICA PARA EL ESTUDIO DE CULTIVOS BACTERIANOS PUROS (Siembra) OBJETIVOS GENERALES. Al finalizar este ejercicio el alumno será capaz de: Aplicar las diferentes técnicas de siembra que se emplean para
Práctica 3. ESTUDIO DE CULTIVOS BACTERIANOS PUROS Práctica 4. ESTUDIO MICROSCÓPICO Y CULTIVO DE HONGOS
 Práctica 3. ESTUDIO DE CULTIVOS BACTERIANOS PUROS Práctica 4. ESTUDIO MICROSCÓPICO Y CULTIVO DE HONGOS OBJETIVOS GENERALES. Al finalizar este ejercicio el alumno será capaz de: Aplicar las diferentes técnicas
Práctica 3. ESTUDIO DE CULTIVOS BACTERIANOS PUROS Práctica 4. ESTUDIO MICROSCÓPICO Y CULTIVO DE HONGOS OBJETIVOS GENERALES. Al finalizar este ejercicio el alumno será capaz de: Aplicar las diferentes técnicas
PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS
 PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS OBJETIVO DE LA PRACTICA Desarrollar las técnicas microscópicas comunes para observar, teñir y medir a las bacterias y sus estructuras. INTRODUCCION El
PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS OBJETIVO DE LA PRACTICA Desarrollar las técnicas microscópicas comunes para observar, teñir y medir a las bacterias y sus estructuras. INTRODUCCION El
Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias.
 Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias. Objetivos Relacionar la actividad metabólica de los microorganismos con los cambios producidos en diferentes
Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias. Objetivos Relacionar la actividad metabólica de los microorganismos con los cambios producidos en diferentes
LABORATORIO DE MICROBIOLOGÍA EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote
 Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
Laboratorio Nacional de Salud Pública
 1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
AcuaNatura ÍNDICE TÉCNICAS DE TINCIÓN
 TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
o Solución de KOH al 0,01% Disolver el colorante en el alcohol, y añadir la solución de KOH
 OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
LABORATORIO 8. REINO MÓNERA OBSERVACIÓN DE BACTERIAS COLORACIÓN DE GRAM
 LABORATORIO 8. REINO MÓNERA OBSERVACIÓN DE BACTERIAS COLORACIÓN DE GRAM Profesor: Luis Francisco Moreno B. Biólogo, M. Sc. Biología. El reino mónera es el grupo de microorganismos más pequeño que se puede
LABORATORIO 8. REINO MÓNERA OBSERVACIÓN DE BACTERIAS COLORACIÓN DE GRAM Profesor: Luis Francisco Moreno B. Biólogo, M. Sc. Biología. El reino mónera es el grupo de microorganismos más pequeño que se puede
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I
 PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I P # 1 P # 2 P # 3 P # 4 P # 5 P # 6 Uso y cuidados en el manejo del Microscopio Esterilización de materiales y medios Técnicas de Tinción
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I P # 1 P # 2 P # 3 P # 4 P # 5 P # 6 Uso y cuidados en el manejo del Microscopio Esterilización de materiales y medios Técnicas de Tinción
Tema 2.- Tinciones Bacteriológicas
 Tema 2.- Tinciones Bacteriológicas El contraste en una observación microscópica da cuenta de la diferencia de intensidad entre el objeto y el medio. Sin embargo, la mayoría de los microorganismos son prácticamente
Tema 2.- Tinciones Bacteriológicas El contraste en una observación microscópica da cuenta de la diferencia de intensidad entre el objeto y el medio. Sin embargo, la mayoría de los microorganismos son prácticamente
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I
 UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
OBJETIVOS CRECIMIENTO MICROBIANO EN MEDIO SÓLIDO
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA PROGRAMA: CIENCIAS AMBIENTALES ÁREA: AGRO Y MAR CÁTEDRA: Microbiología e Inmunología Veterinaria PROF: JOSÉ ARAUJO Actividad Prática 3 OBJETIVOS 1
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA PROGRAMA: CIENCIAS AMBIENTALES ÁREA: AGRO Y MAR CÁTEDRA: Microbiología e Inmunología Veterinaria PROF: JOSÉ ARAUJO Actividad Prática 3 OBJETIVOS 1
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO
 RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
UNIVERSIDAD AUTONOMA DE TAMAULIPAS
 R-RS-01-25-03 UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADÉMICA MULTIDISCIPLINARIA REYNOSA-AZTLÁN NOMBRE DE LA CARRERA LICENCIADO EN NUTRICION Y CIENCIA DE LOS ALIMENTOS NOMBRE DE LA ASIGNATURA LABORATORIO
R-RS-01-25-03 UNIVERSIDAD AUTONOMA DE TAMAULIPAS UNIDAD ACADÉMICA MULTIDISCIPLINARIA REYNOSA-AZTLÁN NOMBRE DE LA CARRERA LICENCIADO EN NUTRICION Y CIENCIA DE LOS ALIMENTOS NOMBRE DE LA ASIGNATURA LABORATORIO
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR X-1 Observación de halos de hemólisis en las placas de Agar Sangre nº 1 y nº 2 ANÁLISIS CUALITATIVO MUCOSA FARÍNGEA X-2 X-3 Tinción
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR X-1 Observación de halos de hemólisis en las placas de Agar Sangre nº 1 y nº 2 ANÁLISIS CUALITATIVO MUCOSA FARÍNGEA X-2 X-3 Tinción
FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA
 FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA UNIDAD DIDÁCTICA : CÉLULAS Y TEJIDOS 01.- Células animales y vegetales Duración Estimada: 1h 40 min Capacidad Terminal Observación de células animales y
FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA UNIDAD DIDÁCTICA : CÉLULAS Y TEJIDOS 01.- Células animales y vegetales Duración Estimada: 1h 40 min Capacidad Terminal Observación de células animales y
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD
 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD ESCUELA DE CIENCIAS BASICAS, TECNOLOGIA E INGENIERIA CURSO DE BIOLOGIA TUTORA: Yamile.cortes@unad.edu.co labbiologiayamilecortesunad.wordpress.com OBJETIVOS:
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD ESCUELA DE CIENCIAS BASICAS, TECNOLOGIA E INGENIERIA CURSO DE BIOLOGIA TUTORA: Yamile.cortes@unad.edu.co labbiologiayamilecortesunad.wordpress.com OBJETIVOS:
PRÁCTICA Esterilización y Preparación de Medios de Cultivo (1ª sesión)
 Objetivos PRÁCTICA Esterilización y Preparación de Medios de Cultivo (1ª sesión) Al finalizar este ejercicio el alumno será capaz de: Explicar el concepto de esterilización y su aplicación en microbiología.
Objetivos PRÁCTICA Esterilización y Preparación de Medios de Cultivo (1ª sesión) Al finalizar este ejercicio el alumno será capaz de: Explicar el concepto de esterilización y su aplicación en microbiología.
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
Asignaturas antecedentes y subsecuentes
 PROGRAMA DE ESTUDIOS Microbiología General Área a la que pertenece: AREA SUSTANTIVA PROFESIONAL Horas teóricas: 3 Horas practicas: 3 Créditos: 9 Clave: F0219 Ninguna. Asignaturas antecedentes y subsecuentes
PROGRAMA DE ESTUDIOS Microbiología General Área a la que pertenece: AREA SUSTANTIVA PROFESIONAL Horas teóricas: 3 Horas practicas: 3 Créditos: 9 Clave: F0219 Ninguna. Asignaturas antecedentes y subsecuentes
Sistema Integrado de Gestión GUÍA PRÁCTICA N 11
 Sistema Integrado de Gestión GUÍA PRÁCTICA N 11 PREPARACIÓN DE EXTENDIDOS Y TÉCNICAS DE TINCIÓN PROGRAMA DE Versión 3 Código: IV.4.1.19.03.16 Proceso: Investigación IV Febrero de 2016 Página 2 de 9 1.
Sistema Integrado de Gestión GUÍA PRÁCTICA N 11 PREPARACIÓN DE EXTENDIDOS Y TÉCNICAS DE TINCIÓN PROGRAMA DE Versión 3 Código: IV.4.1.19.03.16 Proceso: Investigación IV Febrero de 2016 Página 2 de 9 1.
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
UNIVERSIDAD AUTÓNOMA DE BAJA CALIFORNIA
 UNIVERSIDAD AUTÓNOMA DE BAJA CALIFORNIA CIENCIAS DE LA SALUD LABORATORIO DE BIOLOGÍA CELULAR PRÁCTICA 5: MICROSCOPÍA / DIVERSIDAD CELULAR I Introducción La microscopia es una de las herramientas que utiliza
UNIVERSIDAD AUTÓNOMA DE BAJA CALIFORNIA CIENCIAS DE LA SALUD LABORATORIO DE BIOLOGÍA CELULAR PRÁCTICA 5: MICROSCOPÍA / DIVERSIDAD CELULAR I Introducción La microscopia es una de las herramientas que utiliza
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRÁCTICA 2.3 Esterilización y Preparación de Medios de Cultivo
 PRÁCTICA 2.3 Esterilización y Preparación de Medios de Cultivo Objetivos Al finalizar este ejercicio el alumno será capaz de: Explicar el concepto de esterilización y su utilidad en microbiología. Preparar
PRÁCTICA 2.3 Esterilización y Preparación de Medios de Cultivo Objetivos Al finalizar este ejercicio el alumno será capaz de: Explicar el concepto de esterilización y su utilidad en microbiología. Preparar
PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Introducción
 PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Objetivos. Que el alumno aprenda las técnicas de cultivo y manipulación de diferentes tipos de hongos. Que el estudiante conozca las
PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Objetivos. Que el alumno aprenda las técnicas de cultivo y manipulación de diferentes tipos de hongos. Que el estudiante conozca las
Aislamiento de Microorganismos (1ª Sesión)
 Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para el aislamiento
Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para el aislamiento
ACIDOS CARBOXILICOS Y ESTERES. ELABORADO POR: Lic. Raúl Hernández Mazariegos
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA QUÍMICA, PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 ACIDOS CARBOXILICOS Y ESTERES ELABORADO POR: Lic. Raúl
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA QUÍMICA, PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 ACIDOS CARBOXILICOS Y ESTERES ELABORADO POR: Lic. Raúl
TRABAJO PRACTICO Nº 1 COMPOSICION QUIMICA DE LA CELULA
 TRABAJO PRACTICO Nº 1 COMPOSICION QUIMICA DE LA CELULA Alumno:..... Comisión:.. OBJETIVOS: - Identificar los compuestos orgánicos de importancia biológica. - Detectar la presencia de algunos tipos de biomoléculas
TRABAJO PRACTICO Nº 1 COMPOSICION QUIMICA DE LA CELULA Alumno:..... Comisión:.. OBJETIVOS: - Identificar los compuestos orgánicos de importancia biológica. - Detectar la presencia de algunos tipos de biomoléculas
Biología Celular Laboratorio. Mitosis en raíz de cebolla
 INTRODUCCIÓN El ciclo celular tiene tres etapas principales, la interfase, la mitosis o división del núcleo en dos células hijas y la citocinesis o división del citoplasma. La mitosis o fase M tiene como
INTRODUCCIÓN El ciclo celular tiene tres etapas principales, la interfase, la mitosis o división del núcleo en dos células hijas y la citocinesis o división del citoplasma. La mitosis o fase M tiene como
PRÁCTICA 6.1 Nutrición Microbiana y Requerimientos de Oxígeno
 PRÁCTICA 6.1 Nutrición Microbiana y Requerimientos de Oxígeno Objetivos Determinar las características nutricionales de diferentes microorganismos considerando las fuentes de carbono, energía y nitrógeno.
PRÁCTICA 6.1 Nutrición Microbiana y Requerimientos de Oxígeno Objetivos Determinar las características nutricionales de diferentes microorganismos considerando las fuentes de carbono, energía y nitrógeno.
Microscopio y observación de células
 I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
PRÁCTICA 8. CONDICIONES AMBIENTALES PARA EL DESARROLLO, INHIBICIÓN Y DESTRUCCIÓN DE LOS MICROORGANISMOS
 PRÁCTICA 8. CONDICIONES AMBIENTALES PARA EL DESARROLLO, INHIBICIÓN Y DESTRUCCIÓN DE LOS MICROORGANISMOS Objetivos Al finalizar este ejercicio el alumno será capaz de: Explicar el efecto de factores físicos
PRÁCTICA 8. CONDICIONES AMBIENTALES PARA EL DESARROLLO, INHIBICIÓN Y DESTRUCCIÓN DE LOS MICROORGANISMOS Objetivos Al finalizar este ejercicio el alumno será capaz de: Explicar el efecto de factores físicos
TEMA 9 MÉTODOS ÓPTICOS PARA EL DIAGNÓSTICO DE LABORATORIO DE ENFERMEDADES INFECCIOSAS
 TEMA 9 MÉTODOS ÓPTICOS PARA EL DIAGNÓSTICO DE LABORATORIO DE ENFERMEDADES INFECCIOSAS INDICE DE CONTENIDOS Introducción Tipos de microscopía óptica Microscopía de campo claro Microscopía de campo oscuro
TEMA 9 MÉTODOS ÓPTICOS PARA EL DIAGNÓSTICO DE LABORATORIO DE ENFERMEDADES INFECCIOSAS INDICE DE CONTENIDOS Introducción Tipos de microscopía óptica Microscopía de campo claro Microscopía de campo oscuro
Trabajo práctico Nº 6. Introducción. Ejercicio teórico MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS. Objetivo. Procedimiento.
 Introducción Ejercicio teórico Objetivo Trabajo práctico Nº 6 MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS Procedimiento Resultados Actividades adicionales Bibliografía INTRODUCCIÓN Una de las características
Introducción Ejercicio teórico Objetivo Trabajo práctico Nº 6 MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS Procedimiento Resultados Actividades adicionales Bibliografía INTRODUCCIÓN Una de las características
UNIVERSIDAD DE PUERTO RICO EN HUMACAO DEPARTAMENTO DE BIOLOGÍA PRONTUARIO DEL LABORATORIO DE MICROBIOLOGÍA GENERAL BIOL 3707
 UNIVERSIDAD DE PUERTO RICO EN HUMACAO DEPARTAMENTO DE BIOLOGÍA PRONTUARIO DEL LABORATORIO DE MICROBIOLOGÍA GENERAL BIOL 3707 Actualizado por: DR. HÉCTOR L. AYALA DEL RÍO 2005 UPR-H Departamento de Biología-BIOL
UNIVERSIDAD DE PUERTO RICO EN HUMACAO DEPARTAMENTO DE BIOLOGÍA PRONTUARIO DEL LABORATORIO DE MICROBIOLOGÍA GENERAL BIOL 3707 Actualizado por: DR. HÉCTOR L. AYALA DEL RÍO 2005 UPR-H Departamento de Biología-BIOL
Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo
 Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo Objetivos. Que el alumno conozca los principios generales de las técnicas de esterilización
Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo Objetivos. Que el alumno conozca los principios generales de las técnicas de esterilización
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA
 PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
UNIVERSIDAD JUAREZ AUTONOMA DE TABASCO DIVISIÓN ACADEMICA DE CIENCIAS BIOLOGICAS LICENCIATURA EN ECOLOGIA
 UNIVERSIDAD JUAREZ AUTONOMA TABASCO DIVISIÓN ACAMICA CIENCIAS BIOLOGICAS LICENCIATURA EN ECOLOGIA ASIGNATURA: MICROBIOLOGÍA AREA : SUSTANTIVA PROFESIONAL HORAS TEÓRICAS: 2 HORAS PRÁCTICAS: 4 CRÉDITOS:
UNIVERSIDAD JUAREZ AUTONOMA TABASCO DIVISIÓN ACAMICA CIENCIAS BIOLOGICAS LICENCIATURA EN ECOLOGIA ASIGNATURA: MICROBIOLOGÍA AREA : SUSTANTIVA PROFESIONAL HORAS TEÓRICAS: 2 HORAS PRÁCTICAS: 4 CRÉDITOS:
PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA.
 AMPLIACIÓN BIOLOGÍA 4º ESO Taller Biología 4º E.S.O. BLOQUE 2. MICROSCOPÍA Y CITOLOGÍA PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA. OBJETIVOS o Adquirir práctica
AMPLIACIÓN BIOLOGÍA 4º ESO Taller Biología 4º E.S.O. BLOQUE 2. MICROSCOPÍA Y CITOLOGÍA PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA. OBJETIVOS o Adquirir práctica
Clase. Los microorganismos que nos rodean
 Departamento de Microbiología y Parasitología Dr. David González Fernández http://www.unav.edu/departamento/microbiol/ Sabemos realmente qué nos rodea? Importancia de la microbiología. Ubicuidad de los
Departamento de Microbiología y Parasitología Dr. David González Fernández http://www.unav.edu/departamento/microbiol/ Sabemos realmente qué nos rodea? Importancia de la microbiología. Ubicuidad de los
Bacterias, Arqueas y una introducción a las tinciones bacterianas. Dr. Héctor L. Ayala del Río UPRH-BIOL3707. Organizando la Diversidad 5 Reinos
 Bacterias, Arqueas y una introducción a las tinciones bacterianas Dr. Héctor L. Ayala del Río UPRH-BIOL3707 Organizando la Diversidad 5 Reinos 1 Célula Eucariota Célula Procariota 2 Microbiología Acelulares
Bacterias, Arqueas y una introducción a las tinciones bacterianas Dr. Héctor L. Ayala del Río UPRH-BIOL3707 Organizando la Diversidad 5 Reinos 1 Célula Eucariota Célula Procariota 2 Microbiología Acelulares
COPIA NO VÁLIDA PARA TRÁMITE
 PÁGINA: 1 de 10 FACULTAD DE: CIENCIAS BÁSICAS PROGRAMA DE: BIOLOGÍA PLANEACIÓN DEL CONTENIDO DE CURSO 1. IDENTIFICACIÓN DEL CURSO NOMBRE : MICROBIOLOGÍA CÓDIGO : 20404 SEMESTRE : VI NUMERO DE CRÉDITOS
PÁGINA: 1 de 10 FACULTAD DE: CIENCIAS BÁSICAS PROGRAMA DE: BIOLOGÍA PLANEACIÓN DEL CONTENIDO DE CURSO 1. IDENTIFICACIÓN DEL CURSO NOMBRE : MICROBIOLOGÍA CÓDIGO : 20404 SEMESTRE : VI NUMERO DE CRÉDITOS
Laboratorio de Introducción a la Microbiología. Practico N 1
 Laboratorio de Introducción a la Microbiología Practico N 1 PREPARACIÓN PARA LA OBSERVACIÓN DE MICROORGANISMOS POR MICROSCOPIA Los microorganismos son demasiado pequeños para ser observados a simple vista,
Laboratorio de Introducción a la Microbiología Practico N 1 PREPARACIÓN PARA LA OBSERVACIÓN DE MICROORGANISMOS POR MICROSCOPIA Los microorganismos son demasiado pequeños para ser observados a simple vista,
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR. PRACTICA No. 3 TINCIONES
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR PRACTICA No. 3 TINCIONES Alumnos(as): Karla Ayde Sánchez Guillen Erika Vanessa Molina Murillo Yatzeny Gpe.
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR PRACTICA No. 3 TINCIONES Alumnos(as): Karla Ayde Sánchez Guillen Erika Vanessa Molina Murillo Yatzeny Gpe.
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA: BACTERIOLOGÍA Y MICOLOGÍA
 PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA: BACTERIOLOGÍA Y MICOLOGÍA Mª PAZ MERINO JIMÉNEZ MIREIA LLINARES MARCELO PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA: BACTERIOLOGÍA Y MICOLOGÍA A mi padre. M.
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA: BACTERIOLOGÍA Y MICOLOGÍA Mª PAZ MERINO JIMÉNEZ MIREIA LLINARES MARCELO PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA: BACTERIOLOGÍA Y MICOLOGÍA A mi padre. M.
Laboratorio 4: Tinción de microorganismos. Biol 3725L
 Laboratorio 4: Tinción de microorganismos Biol 3725L 1 ml 1 ml Repaso de diluciones 0.1 ml 1 ml 1 ml 9 ml 1 / 10 10-1 99 ml 9.9ml 9 ml 1 / 100 10-3 1 ml 0.1/ 10 1/ 100 10-5 1/10 10-6 1 ml 9 ml 1/10 10-7
Laboratorio 4: Tinción de microorganismos Biol 3725L 1 ml 1 ml Repaso de diluciones 0.1 ml 1 ml 1 ml 9 ml 1 / 10 10-1 99 ml 9.9ml 9 ml 1 / 100 10-3 1 ml 0.1/ 10 1/ 100 10-5 1/10 10-6 1 ml 9 ml 1/10 10-7
Bioseguridad en el Laboratorio de Microbiología
 Bioseguridad en el Laboratorio de Microbiología Objetivos Al finalizar la práctica el estudiante será capaz de: Aplicar las reglas básicas de higiene y seguridad para los laboratorios del área microbiológica.
Bioseguridad en el Laboratorio de Microbiología Objetivos Al finalizar la práctica el estudiante será capaz de: Aplicar las reglas básicas de higiene y seguridad para los laboratorios del área microbiológica.
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II
 UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
PRÁCTICA 5 FASES DE LA MITOSIS. ESTIMACIÓN DE LOS ÍNDICES MITÓTICO Y DE FASE
 PRÁCTICA 5 FASES DE LA MITOSIS. ESTIMACIÓN DE LOS ÍNDICES MITÓTICO Y DE FASE INTRODUCCIÓN La mitosis es la división nuclear asociada a las células somáticas (las células de un organismo eucariótico que
PRÁCTICA 5 FASES DE LA MITOSIS. ESTIMACIÓN DE LOS ÍNDICES MITÓTICO Y DE FASE INTRODUCCIÓN La mitosis es la división nuclear asociada a las células somáticas (las células de un organismo eucariótico que
Mitosis en meristemos de cebolla
 I. Introducción Mitosis en meristemos de cebolla La división celular es un aspecto biológico que está presente y caracteriza a los seres vivos, desde cianobacterias (fisión binaria) hasta animales y vegetales
I. Introducción Mitosis en meristemos de cebolla La división celular es un aspecto biológico que está presente y caracteriza a los seres vivos, desde cianobacterias (fisión binaria) hasta animales y vegetales
MANUAL DE PREPARACIÓN DE REACTIVOS
 MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 5 Hoja: de MANUAL DE PREPARACIÓN DE REACTIVOS Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma F0-SGC-0 Rev.2 MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN
MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 5 Hoja: de MANUAL DE PREPARACIÓN DE REACTIVOS Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma F0-SGC-0 Rev.2 MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN
UNIDAD VII. PARED CELULAR
 UNIDAD VII. PARED CELULAR - Presentes en bacterias, algas, hongos y plantas superiores. - Formada por arreglos insolubles de moléculas secretadas. - Son una parte integral de la célula. PARED CELULAR BACTERIANA
UNIDAD VII. PARED CELULAR - Presentes en bacterias, algas, hongos y plantas superiores. - Formada por arreglos insolubles de moléculas secretadas. - Son una parte integral de la célula. PARED CELULAR BACTERIANA
TEORÍA CELULAR. Matias Schleiden (1838) y Theodore Schwann (1839) LA CÉLULA ES LA UNIDAD FUNDAMENTAL DE TODOS LOS ORGANISMOS.
 TEORÍA CELULAR BIOLOGÍA CELULAR Matias Schleiden (1838) y Theodore Schwann (1839) LA CÉLULA ES LA UNIDAD FUNDAMENTAL DE TODOS LOS ORGANISMOS. En 1855 Rudolph Virchow: 1) Cada organismo vivo está formado
TEORÍA CELULAR BIOLOGÍA CELULAR Matias Schleiden (1838) y Theodore Schwann (1839) LA CÉLULA ES LA UNIDAD FUNDAMENTAL DE TODOS LOS ORGANISMOS. En 1855 Rudolph Virchow: 1) Cada organismo vivo está formado
INSTITUTO TECNOLOGICO Y DE ESTUDIOS DE MONTERREY. Ingeniería Industrial y de Sistemas. Laboratorio de Química
 INSTITUTO TECNOLOGICO Y DE ESTUDIOS DE MONTERREY CAMPUS HIDALGO María Guadalupe Hidal, 8/2/2015 23:26 Comentario [1]: 58/100 Ingeniería Industrial y de Sistemas Laboratorio de Química Practica #2 María
INSTITUTO TECNOLOGICO Y DE ESTUDIOS DE MONTERREY CAMPUS HIDALGO María Guadalupe Hidal, 8/2/2015 23:26 Comentario [1]: 58/100 Ingeniería Industrial y de Sistemas Laboratorio de Química Practica #2 María
MANUAL DE MICROBIOLOGÍA
 INSTITUTO POLITÉCNICO NACIONAL UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGÍA DEPARTAMENTO DE CIENCIAS BÁSICAS ACADEMIA DE BIOLOGÍA MANUAL DE MICROBIOLOGÍA ELABORADO POR: Martha Morales Martínez
INSTITUTO POLITÉCNICO NACIONAL UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGÍA DEPARTAMENTO DE CIENCIAS BÁSICAS ACADEMIA DE BIOLOGÍA MANUAL DE MICROBIOLOGÍA ELABORADO POR: Martha Morales Martínez
Guía teórico - Práctica
 UNIVERSIDAD NACIONAL DE ENTRE RÍOS FACULTAD DE CIENCIAS AGROPECUARIAS Guía teórico - Práctica BOTÁNICA MORFOLÓGICA 2017 UNIVERSIDAD NACIONAL DE ENTRE RÍOS FACULTAD DE CIENCIAS AGROPECUARIAS Prof. María
UNIVERSIDAD NACIONAL DE ENTRE RÍOS FACULTAD DE CIENCIAS AGROPECUARIAS Guía teórico - Práctica BOTÁNICA MORFOLÓGICA 2017 UNIVERSIDAD NACIONAL DE ENTRE RÍOS FACULTAD DE CIENCIAS AGROPECUARIAS Prof. María
TALLER No 1 MAPA CONCEPTUAL DE LA CÉLULA
 TALLER No 1 MAPA CONCEPTUAL DE LA CÉLULA 1. COMPLETE EL MAPA CONCEPTUAL. FUNCIONES: NUCLEO CROMOSOMAS NUCLEOLOS ESTRUCTURA LA CELULA MEMBRANA CELULAR FUNCIONES: FUNCIONES MITOCONDRIAS: RIBOSOMAS: CITOPLASMA
TALLER No 1 MAPA CONCEPTUAL DE LA CÉLULA 1. COMPLETE EL MAPA CONCEPTUAL. FUNCIONES: NUCLEO CROMOSOMAS NUCLEOLOS ESTRUCTURA LA CELULA MEMBRANA CELULAR FUNCIONES: FUNCIONES MITOCONDRIAS: RIBOSOMAS: CITOPLASMA
Universidad Autónoma Metropolitana- Iztapalapa. Academia de Microbiología, Departamento de Biotecnología
 Universidad Autónoma Metropolitana- Iztapalapa MANUAL DE PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGIA GENERAL Academia de Microbiología, Departamento de Biotecnología Participantes: Dra. María de los Angeles
Universidad Autónoma Metropolitana- Iztapalapa MANUAL DE PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGIA GENERAL Academia de Microbiología, Departamento de Biotecnología Participantes: Dra. María de los Angeles
UNIVERSIDAD DE CIENCIAS Y ARTES DE CHIAPAS
 FACULTAD DE CIENCIAS DE LA NUTRICIÓN Y ALIMENTOS LICENCIATURA EN NUTRIOLOGÍA MANUAL DE PRÁCTICAS PARA LA EXPERIENCIA ACADÉMICA MICROBIOLOGÍA Y PARASITOLOGÍA ELABORO: Q.F.B. MARÍA DOLORES TOLEDO MEZA ACTUALIZÓ:
FACULTAD DE CIENCIAS DE LA NUTRICIÓN Y ALIMENTOS LICENCIATURA EN NUTRIOLOGÍA MANUAL DE PRÁCTICAS PARA LA EXPERIENCIA ACADÉMICA MICROBIOLOGÍA Y PARASITOLOGÍA ELABORO: Q.F.B. MARÍA DOLORES TOLEDO MEZA ACTUALIZÓ:
- Que el alumno pueda utilizar el microscopio para la observación de preparados coloreados
 2017 TRABAJO PRACTICO N 2: MICROSCOPIA Y TINCIONES OBJETIVOS: - Que el alumno pueda utilizar el microscopio para la observación de preparados coloreados - Que el alumno conozca y pueda efectuar las tinciones
2017 TRABAJO PRACTICO N 2: MICROSCOPIA Y TINCIONES OBJETIVOS: - Que el alumno pueda utilizar el microscopio para la observación de preparados coloreados - Que el alumno conozca y pueda efectuar las tinciones
Tema V Bacteriología Médica
 Tema V Bacteriología Médica Generalidades de Bacteriología Colectivo de autores Microbiología y Parasitología Objetivos Enunciar la importancia de la Bacteriología Médica. Describir las principales estructuras
Tema V Bacteriología Médica Generalidades de Bacteriología Colectivo de autores Microbiología y Parasitología Objetivos Enunciar la importancia de la Bacteriología Médica. Describir las principales estructuras
UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR
 UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR 1. Datos Generales: Departamento Nombre del Programa Licenciatura Línea curricular Tecnológica Asignatura Biología
UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR 1. Datos Generales: Departamento Nombre del Programa Licenciatura Línea curricular Tecnológica Asignatura Biología
TRANSPORTE A TRAVÉS DE LA MEMBRANA PRÁCTICA UNIDAD TEMÁTICA 9
 TRANSPORTE A TRAVÉS DE LA MEMBRANA PRÁCTICA UNIDAD TEMÁTICA 9 PERMEABILIDAD DIFERENCIAL DE LA MEMBRANA I. INTRODUCCIÓN. Las membranas que rodean a las células y organelos, poseen permeabilidad diferencial,
TRANSPORTE A TRAVÉS DE LA MEMBRANA PRÁCTICA UNIDAD TEMÁTICA 9 PERMEABILIDAD DIFERENCIAL DE LA MEMBRANA I. INTRODUCCIÓN. Las membranas que rodean a las células y organelos, poseen permeabilidad diferencial,
Sin embargo, la detección de microorganismos patógenos es poco práctica por las siguientes razones:
 Unidad 7. Técnicas para la enumeración de microorganismos: análisis microbiológico del agua y de otras diversas muestras Práctica 7. Técnicas para la enumeración de microorganismos: análisis microbiológico
Unidad 7. Técnicas para la enumeración de microorganismos: análisis microbiológico del agua y de otras diversas muestras Práctica 7. Técnicas para la enumeración de microorganismos: análisis microbiológico
OBSERVACION DE CROMOSOMAS y CELULAS EN MITOSIS EN MERISTEMOS TERMINALES DE RAICES DE ALIUM CEPA (L.)
 PRÁCTICA 10 OBSERVACION DE CROMOSOMAS y CELULAS EN MITOSIS EN MERISTEMOS TERMINALES DE RAICES DE ALIUM CEPA (L.) Materiales: Microscopio Portaobjetos y cubreobjetos Bisturí Vidrio de de reloj o pozillos
PRÁCTICA 10 OBSERVACION DE CROMOSOMAS y CELULAS EN MITOSIS EN MERISTEMOS TERMINALES DE RAICES DE ALIUM CEPA (L.) Materiales: Microscopio Portaobjetos y cubreobjetos Bisturí Vidrio de de reloj o pozillos
- Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio microbiológico.
 Microbiología General e Inmunología Año 2012 Trabajo Práctico Nº1 Objetivos: Que el alumno sea capaz de: - Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio
Microbiología General e Inmunología Año 2012 Trabajo Práctico Nº1 Objetivos: Que el alumno sea capaz de: - Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio
UNIVERSIDAD TECNOLOGICA NACIONAL
 UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 4 Tinción y observación de microorganismos. 2009 Jefe de Cátedra:
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 4 Tinción y observación de microorganismos. 2009 Jefe de Cátedra:
Bioseguridad en el Laboratorio de Microbiología
 Objetivos Bioseguridad en el Laboratorio de Microbiología Al finalizar la práctica el estudiante será capaz de: Analizar la importancia que tienen las reglas básicas de higiene y seguridad, tanto en las
Objetivos Bioseguridad en el Laboratorio de Microbiología Al finalizar la práctica el estudiante será capaz de: Analizar la importancia que tienen las reglas básicas de higiene y seguridad, tanto en las
