Reacciones de Sustitución 26/06/2012
|
|
|
- Gustavo Olivera Rico
- hace 6 años
- Vistas:
Transcripción
1 Básicas ITESM, campus qro. 1
2 En las reacciones de sustitución dos Reactivos intercambian átomos o grupos de átomos y originan dos productos nuevos Estudiar el mecanismo de dos reacciones de sustitución de importancia: 1. Sustitución nucleofílica alifática. 2. Sustitución electrofílica aromática. Distinguir el tipo de mecanismo que sigue una reacción de sustitución nucleofílica alifática, la Sustitución Nucleofílica Bimolecular (S N 2) y la Sustitución Nucleofílica Unimolecular (S N 1), mediante la observación del tipo de sustrato, el nucleófilo, el gpo. saliente y el solvente. Predecir el producto o productos de una reacción de sustitución nucleofílica alifática y de una electrofílica aromática Básicas ITESM, campus qro. 2
3 Las reacciones de sustitución nucleofílica alifática son de las reacciones más empleadas y versátiles de la Química Orgánica En el sustrato debe existir un carbono ligado a un gpo. saliente el cual será reemplazado por un nucleófilo. La mayor electronegatividad del grupo saliente con respecto al carbono, polariza el enlace, confiriéndole al carbono una carga parcial positiva (electrófilo) haciéndolo el centro del ataque nucleofílico. Algunos tipos de compuestos que se pueden formar por desplazamiento nucleofílico de los halogenuros de alquilo Los halogenuros de alquilo (R-X), son los grupos salientes comunes, es por ello que sus reacciones características son las sustituciones nucleofílicas. Básicas ITESM, campus qro. 3
4 El CH 3 Br, se ha usado como fumigante de termitas y agente esterilizante del suelo, por su elevada toxicidad. Esta, es debida a su capacidad de transferir ó sustituir un gpo. alquilo a un amino o un sulfhidrilo nucleofílicos de ciertas enzimas, alterando así su desempeño biológico normal. Produce un alcohol Cinética de segundo orden, n=2, bimolecular. La velocidad de la reacción depende tanto del nucléofilo como del sustrato. Si la concentración del nucléofilo ó del sustrato se duplica, también la velocidad. Produce un alcohol Cinética de primer orden n= 1, Unimolecular. La velocidad de la reacción depende sólo del sustrato. Si la conc. del sustrato se duplica, también la velocidad, pero no cambia al aumentar la del nucleófilo. Transcurre por un mecanismo S N 2 Transcurre por un mecanismo S N 1 Básicas ITESM, campus qro. 4
5 Inicia con el ataque nucleofílico al carbono electrofílico, por la parte opuesta al gpo. saliente. El estado de transición inestable, debe desprenderse del gpo. saliente tan pronto se forme el enlace con el Nu -. El ataque posterior, deforma el tetraedro del carbono electrofílico, desde dentro hacia fuera (similar a un paraguas con el viento), en el producto el Nu - tiene una estereoquímica inversa a la del gpo. saliente, inversión de la configuración (inversión de Walden). Especialmente importante si el carbono electrofílico es quiral. Estereoespecifica Reacción concertada, un solo paso, donde la ruptura del enlace con el gpo. saliente y la formación del enlace con el Nu - ocurren simultáneamente. Ocurre en sus tratos 1 y 2 Básicas ITESM, campus qro. 5
6 Algunas reacciones S N 2 ocurren muy rápidamente, mientras que otras muy lentamente. A mayor gpos. alquilo ligados al carbono electrofílico, la velocidad de reacción es más lenta. Factores que influyen en la velocidad de reacción: 1. Tipo de sustrato 2. Nucleófilo 3. Gpo. saliente 4. Solvente Básicas ITESM, campus qro. 6
7 Los factores estéricos son los responsables más importantes de la reactividad del sustrato. El ataque de un haluro de alquilo 1 y 2 no está impedido, ya que están accesibles y en un 3 es prácticamente IMPOSIBLE dado la poca accesibilidad del carbono electrofílico. Reactividad Relativa CH3 X > 1 > 2 Básicas ITESM, campus qro. 7
8 El Nu es neutro o con carga negativa. En la reacción el Nu neutro adquieren carga negativa y el Nu - que es anión se vuelve neutro. Los más básicos son más reactivos. Especies negativas son más reactivas que las especies neutras similares. OH - > H2O La nucleofilia decrece de izq. a derecha y de abajo hacia arriba en la tabla periódica, al contrario que la electronegatividad. OH - > F -. Los mejores Nu - son los que están más abajo en una columna de la tabla periódica. I > Br >Cl > F Su reactividad también está influida por las condiciones de reacción Algunos nucleófilos comunes por orden decreciente en agua y alcoholes Básicas ITESM, campus qro. 8
9 Un buen gpo. saliente debe ser: Aceptor de e - Estable (base débil) una vez que ha salido. Polarizable para estabilizar el estado de transición. Los sulfonatos, sulfatos y fostafos son muy buenos grupos salientes porque deslocalizan la carga entre los átomos de O. Las moléculas neutras son buenos gpos. salientes cuando el medio es ácido. Bases débiles que son grupos salientes comunes Un gpo. muy básico o muy pequeño impide la reacción Básicas ITESM, campus qro. 9
10 Los solventes polares apróticos (no forman puentes de H) forman interacciones débiles con el Nu y aceleran la velocidad de reacción. Los próticos (H 2 O, alcoholes, mezclas agua-alcohol) desaceleran la reacción al solvatar al nucleófilo, lo hacen menos nucleofílico. Básicas ITESM, campus qro. 10
11 Reacción concertada Depende tanto de la concentración de sustrato y de nucleófilo. Los sustratos terciarios no experimentan estas reacciones. Reactividad Relativa:CH3 X > 1 > 2 Debe haber un Nu fuerte. Debe presentar muy buen gpo. saliente. Los R-F, R-OH, R- O-R y R-NH 2, no experimentan este tipo de reacciones. Los solventes polares apróticos aceleran la velocidad de una reacción S N 2 El producto tiene configuración invertida (reacción estereoespecífica) Básicas ITESM, campus qro. 11
12 1. Indicar el orden de reactividad creciente para los siguientes sustratos a. 2-cloro propano b. cloruro de etilo c. cloruro de terbutilo d. cloruro de isobutilo 2. Qué sustancia del par debe ser más reactiva como nucleófilo? a. (CH3)2N - y (CH3)2NH a. H2O y H2Se 3. Indicar el orden de reactividad creciente a. 2-bromo-propano b. 2-cloro-propano c. Yoduro de terbutilo d. 2-yodo-propano qué efecto tendrían el éter dietílico y el benceno (no polares) en la SN2? a. Acelerar b. Desacelerar c. Ninguno Pronosticar si es probable o no que las siguientes reacciones transcurran por S N 2, si es así dar el producto con su configuración (si aplica) Etanol a. Cloruro de terbutilo + KOH DMF b. (R)-2-yodo-butano + HCl CH 3 CN c. Bromuro de metilo + NaI Básicas ITESM, campus qro. 12
13 Reacción concertada Depende tanto de la concentración de sustrato y de nucleófilo. Los sustratos terciarios no experimentan estas reacciones. Reactividad Relativa:CH3 X > 1 > 2 Debe haber un Nu fuerte. Debe presentar muy buen gpo. saliente. Los R-F, R-OH, R- O-R y R-NH 2, no experimentan este tipo de reacciones. Los solventes polares apróticos aceleran la velocidad de una reacción S N 2 El producto tiene configuración invertida (reacción estereoespecífica) Básicas ITESM, campus qro. 13
14 Una de las reacciones biológicas más importantes es la transferencia de un metilo de un donante electrofílico a un nucleofílico. En el laboratorio se escogería CH 3 I, pero los organismos usan S- adenosilmetionina, molécula compleja, donante biológico del gpo. Metilo. El azufre de esta molécula (sustrato) es excelente gpo. saliente para S N 2 en el carbono del metilo. Un ejemplo de esta metilación es la síntesis biológica de adrenalina (droga del pelear o huir) a partir de la norepinefrina en la médula adrenal. Básicas ITESM, campus qro. 14
15 Reacción en dos pasos elementales. El primer paso inicia con la salida del gpo. saliente por una ruptura heterolítica, produciendo lentamente un carbocatión. Este paso es limitante de la velocidad, explica la ley de velocidad. El segundo paso (más rápido) consiste en la ataque del Nu al carbocatión. Formando dos productos, uno con configuración invertida y el otro con retención. Mezcla racémica si el carbono es quiral. Puede ser que los dos productos sean transpuestos. Básicas ITESM, campus qro. 15
16 Como el carbocatión es planar, el nucleófilo puede atacar ya sea por arriba o debajo del plano, originando una mezcla de dos enantiómeros (racemización). Si el ataque es del mismo lado del gpo. saliente retrendrá la configuración y del lado contrario tendrá configuración invertida. Si el carbocatión formado en el paso lento no es el más estable, experimentará un rearreglo mediante el desplazamiento 1,2 de hidruros o de metilos para formar un carbocatión más estable (transposición). Básicas ITESM, campus qro. 16
17 Algunas reacciones S N 1 ocurren muy rápidamente, mientras que otras muy lentamente. De manera análoga a la S N 2, los factores que influyen son: 1. Tipo de sustrato: Los sustratos 3 son los más reactivos debido a que el paso limitante es la formación del carbocatión. Cuanto más estable es un carbocatión, más rápida es su formación... Un sustrato sufre S N 1 más rápido que otro porque forma el carbocatión más rápido Nucleófilo: Debido a que no participa en el paso limitante, su concentración ni su naturaleza influye en la velocidad. 3. Gpo. Saliente: Similar a la S N 2 4. Solvente: Los solventes polares próticos son los mejores porque estabilizan al carbocatión y aceleran la velocidad. No así los apróticos. Reactividad Relativa 2 <3 Básicas ITESM, campus qro. 17
18 Básicas ITESM, campus qro. 18
19 Básicas ITESM, campus qro. 19
20 La sustitución electrofílica aromática, es el mecanismo más importante implicado en las reacciones de los compuestos aromáticos (los cuales representan aprox. el 50% de todos los compuestos orgánicos) Los compuestos aromáticos incluyen al benceno y sus derivados, así como otros compuestos, con anillos de 5,6, 7 ó más carbonos, con electrones pi que son números de Hückel (4n+2) y que resisten las reacciones de adición (debido a la estabilidad del sistema aromático) y experimentan reacciones de sustitución. Pese a que los electrones pi del anillo aromático (como en el benceno) se encuentran en un sistema estable aromático, únicamente están disponibles durante el ataque de un Electrófilo (E), fuerte que sustituye a un átomo de H. Nunca se pierde el núcleo aromático Benceno De esta forma se obtienen numerosos derivados aromáticos como los que se muestran en la figura. Básicas ITESM, campus qro. 20
21 La reacción transcurre en dos pasos elementales. El primer paso consiste en el ataque del Electrófilo para formar un carbocatión en equilbirio donde se encuentra estabilizado por el sistema aromático (complejo sigma). El segundo paso consiste en la pérdida de un protón para formar el producto de la sustitución aromática. Básicas ITESM, campus qro. 21
22 El bromo molecular no es suficientemente electrofílico para reaccionar con el benceno, sin embargo un ácido de Lewis, como el FeBr3 cataliza la reacción. Observar que el primer paso ahora es la formación del electrófilo fuerte. El ataque del benceno por el electrófilo y la salida del protón produce principalmente bromobenceno como producto de la sustitución. Las reacciones globalmente son exotérmicas Básicas ITESM, campus qro. 22
23 El mecanismo es similar a otras deshidrataciones catalizadas por ácidos. El ácido sulfúrico protona el gpo. Hidroxilo del ácido nítrico, formando el ión nitronio (electrófilo fuerte). La pérdida del protón del complejo sigma produce el nitrobenceno. Los compuestos aromáticos nitroderivados son componentes de muchos medicamentos, como el antibiótico cloranfenicol Básicas ITESM, campus qro. 23
24 Básicas ITESM, campus qro. 24
Reacciones de Eliminación 26/06/2012
 Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
DERIVADOS HALOGENADOS. Estructura
 TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES
 GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
Reacciones de Sustitución Electrofílica Aromática (S E Ar) Halogenación: Bromación y Cloración. Alquilación de Friedel-Crafts
 TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
Tema 11. CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Reacciones de adición
 erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
REACTIVIDAD DE LOS COMPUESTOS ORGÁNICOS
 REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN INTRODUCCIÓN
 Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
F FA AC C U ULTAD LTAD D D E
 FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre Fase específica OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
los compuestos orgánicos.
 2ª Parte: Estructura y reactividad de los compuestos orgánicos. 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos aromáticos. -
2ª Parte: Estructura y reactividad de los compuestos orgánicos. 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos aromáticos. -
Estructura del grupo carbonilo
 TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
QUÍMICA. 2º Bachilerrato orgánica Estereoisomería:
 TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
Ecuación de Hammett 1
 Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
11. FUERZAS INTERMOLECULARES
 Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
Las fuerzas intermoleculares son las responsables de las uniones entre las diferentes moléculas. Química 2º bachillerato Enlace químico 1 Las fuerzas de Van der Waals son interacciones entre átomos y moléculas
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD
 TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
OTRAS REACCIONES DE LOS ALCOHOLES
 OTRAS REACCIONES DE LOS ALCOHOLES Reacciones Típicas de los Alcoholes La figura muestra cuatro modos típicos de reaccionar de los alcoholes. En cada uno de ellos, se rompe uno ómásde los cuatro enlaces
OTRAS REACCIONES DE LOS ALCOHOLES Reacciones Típicas de los Alcoholes La figura muestra cuatro modos típicos de reaccionar de los alcoholes. En cada uno de ellos, se rompe uno ómásde los cuatro enlaces
Desconexión del cloruro de t-butilo
 Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres
Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II
 SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
C Cl 2sp 3 3p. C Br 2sp 3 4p C X = C X
 Química Orgánica Tema 2. aluros de alquilo 1 Tema 2. aluros de alquilo. Estructura. Nomenclatura. Reacciones de los compuestos orgánicos halogenados. oncepto de electrófilo y nucleófilo. Reacciones de
Química Orgánica Tema 2. aluros de alquilo 1 Tema 2. aluros de alquilo. Estructura. Nomenclatura. Reacciones de los compuestos orgánicos halogenados. oncepto de electrófilo y nucleófilo. Reacciones de
Ácido carboxílico Halogenuro de ácido Anhídrido de ácido Ester Amida O O R SR' O - R O O -
 X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
UNIDAD 2. CINÉTICA QUÍMICA
 UNIDAD 2. CINÉTICA QUÍMICA Introducción. Velocidad de reacción Cómo se producen las reacciones químicas Ecuación de la velocidad de reacción Factores que afectan a la velocidad de reacción Mecanismo de
UNIDAD 2. CINÉTICA QUÍMICA Introducción. Velocidad de reacción Cómo se producen las reacciones químicas Ecuación de la velocidad de reacción Factores que afectan a la velocidad de reacción Mecanismo de
ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN
 PRACTICAS DE LABORATORIO QUIMICA 2010 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN I. INTRODUCCIÓN Los compuestos orgánicos que se presentan en la
PRACTICAS DE LABORATORIO QUIMICA 2010 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN I. INTRODUCCIÓN Los compuestos orgánicos que se presentan en la
Quimica orgánica básica
 Quimica orgánica básica Química orgánica básica La química orgánica es el estudio de los compuestos de carbono. Los átomos de carbono son únicos en su habilidad de formar cadenas muy estables y anillos,
Quimica orgánica básica Química orgánica básica La química orgánica es el estudio de los compuestos de carbono. Los átomos de carbono son únicos en su habilidad de formar cadenas muy estables y anillos,
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS
 TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
Clase 17: Reactividad de los Haluros de Alquilo y algo de estereoquímica en Reacciones
 Clase 17: Reactividad de los Haluros de Alquilo y algo de estereoquímica en Reacciones Mario Manuel Rodas Morán Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de
Clase 17: Reactividad de los Haluros de Alquilo y algo de estereoquímica en Reacciones Mario Manuel Rodas Morán Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
ESTRUCTURA DE COMPUESTOS ORGÁNICOS
 ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
SUSTITUCIÓN NUCLEOFÍLICA. Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de San Carlos de Guatemala
 SUSTITUCIÓN NUCLEOFÍLICA Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de San Carlos de Guatemala Polaridades de algunos grupos Observe la polaridad de los grupos
SUSTITUCIÓN NUCLEOFÍLICA Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de San Carlos de Guatemala Polaridades de algunos grupos Observe la polaridad de los grupos
RESPUESTA Guía de ejercicios #5 Enlace químico
 Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
Liceo Bicentenario Teresa Prats Subsector: Química Nivel: 1 Medio J.C.B. / M.Q.de la F RESPUESTA Guía de ejercicios #5 Enlace químico Estimadas alumnas: Les envío las respuestas de algunas (aquellas con
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA. 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué?
 REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
REACCIONES DE TRANSFERENCIA DE ELECTRONES, AJUSTE Y ESTEQUIOMETRÍA 1-Nombra tres sustancias que sean oxidantes enérgicos Por qué? 2- Nombra tres cuerpos que sean fuertes reductores por qué? 3- Qué se entiende
CUÁLES SON LAS REACCIONES PRINCIPALES Y LOS MÉTODOS DE OBTENCIÓN MÁS COMUNES DE LOS COMPUESTOS ORGÁNICOS?
 CUÁLES SON LAS REACCIONES PRINCIPALES Y LOS MÉTODOS DE OBTENCIÓN MÁS COMUNES DE LOS COMPUESTOS ORGÁNICOS? Desempeño Esperado: El estudiante reconoce, identifica y completa algunos métodos de obtención
CUÁLES SON LAS REACCIONES PRINCIPALES Y LOS MÉTODOS DE OBTENCIÓN MÁS COMUNES DE LOS COMPUESTOS ORGÁNICOS? Desempeño Esperado: El estudiante reconoce, identifica y completa algunos métodos de obtención
Ejercicios y respuestas del apartado: Propiedades de los períodos y de los grupos. Electronegatividad
 Ejercicios y respuestas del apartado: Propiedades de los períodos y de los grupos. Electronegatividad Propiedades periódicas (1) La electronegatividad en la tabla periódica disminuye cuanto más a la (1)
Ejercicios y respuestas del apartado: Propiedades de los períodos y de los grupos. Electronegatividad Propiedades periódicas (1) La electronegatividad en la tabla periódica disminuye cuanto más a la (1)
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
PRUEBA ESPECÍFICA PRUEBA 201
 PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 201 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada ejercicio
PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 201 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada ejercicio
Química Orgánica General
 Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
Química Orgánica General Dra. Maribel Plascencia Jatomea Departamento de Investigación y Posgrado en Alimentos, DIPA Laboratorio de Microbiología y Micotoxinas 3 er piso, Edificio 5P Dr. Manuel Sánchez
EJERCICIOS PARA EL PRIMER EXAMEN PARCIAL
 UNIVERSIDAD SIMÓN BLÍVAR Departamento de Química Química rgánica II (QM-2422) EJERCICIS PARA EL PRIMER EXAMEN PARCIAL 1.- Considerando las estructuras del fenol y del ciclohexanol, responda las siguientes
UNIVERSIDAD SIMÓN BLÍVAR Departamento de Química Química rgánica II (QM-2422) EJERCICIS PARA EL PRIMER EXAMEN PARCIAL 1.- Considerando las estructuras del fenol y del ciclohexanol, responda las siguientes
EL CONTROL DE LAS ACTIVIDADES CELULARES
 EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Adición. Eliminación. Sustitución
 Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL
 Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL Nomenclatura de los alcoholes En el sistema de la IUPAC,los alcoholes se nombran añadiendo la terminación ol al hidrocarburo de referencia e, indicando
Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL Nomenclatura de los alcoholes En el sistema de la IUPAC,los alcoholes se nombran añadiendo la terminación ol al hidrocarburo de referencia e, indicando
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
TEMA 6. LAS REACCIONES EN EL ENLACE COVALENTE
 TEMA 6. LAS REAIONES EN EL ENLAE OVALENTE 1. Tipos de reacciones orgánicas. 1.1. Reacciones de adición. 1.2. Reacciones de sustitución. 1.3. Reacciones de eliminación. 1.4. Reacciones de transposición.
TEMA 6. LAS REAIONES EN EL ENLAE OVALENTE 1. Tipos de reacciones orgánicas. 1.1. Reacciones de adición. 1.2. Reacciones de sustitución. 1.3. Reacciones de eliminación. 1.4. Reacciones de transposición.
MÓDULO A: ácido-base y espectroscópicas de los compuestos orgánicos
 MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos orgánicos MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos
MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos orgánicos MÓDULO A: Estructura t y propiedades d físicas, ácido-base y espectroscópicas de los compuestos
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno
 Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno Química orgánica I Químicos Escuela de vacaciones junio 2016 Licda. Jaqueline Carrera. Propiedades de los éteres
Unidad III 3.3.Enlaces simples carbonooxigeno, 3.4.carbono -azufre, 3.5. carbono- nitrógeno Química orgánica I Químicos Escuela de vacaciones junio 2016 Licda. Jaqueline Carrera. Propiedades de los éteres
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
18 Reacciones orgánicas
 Facultad de Farmacia. Universidad de Alcalá 181 18 Reacciones orgánicas 18.1 Reacciones de adición 18.2 Reacciones de eliminación 18.3 Reacciones de sustitución 18.4 Reacciones entre ácidos y bases 18.1
Facultad de Farmacia. Universidad de Alcalá 181 18 Reacciones orgánicas 18.1 Reacciones de adición 18.2 Reacciones de eliminación 18.3 Reacciones de sustitución 18.4 Reacciones entre ácidos y bases 18.1
SGUICEL009QM11-A16V1. Ácido base I: conceptos y teorías
 SGUICEL009QM11-A16V1 Ácido base I: conceptos y teorías Ítem Alternativa Habilidad 1 B Reconocimiento 2 A Comprensión 3 E Reconocimiento 4 E Comprensión 5 E ASE 6 E Comprensión 7 D Comprensión 8 E Comprensión
SGUICEL009QM11-A16V1 Ácido base I: conceptos y teorías Ítem Alternativa Habilidad 1 B Reconocimiento 2 A Comprensión 3 E Reconocimiento 4 E Comprensión 5 E ASE 6 E Comprensión 7 D Comprensión 8 E Comprensión
Clasificación de los alquenos. Nomenclatura de los alquenos. Nomenclatura de los alquenos, continuacion
 ALQUENOS Los alquenos son hidrocarburos insaturados que contienen uno o más dobles enlaces C = C. El nombre de los hidrocarburos insaturados se debe a que los carbonos que sostienen el doble enlace todavía
ALQUENOS Los alquenos son hidrocarburos insaturados que contienen uno o más dobles enlaces C = C. El nombre de los hidrocarburos insaturados se debe a que los carbonos que sostienen el doble enlace todavía
Conceptos basicos (III)
 erramientas de la Química rgánica erramientas de la Química rgánica ompuestos carbonílicos onceptos basicos (III) δ δ plano 120 º = polar sp 2 Z Z Z Z = ó Ar Z = ó Ar aldehídos cetonas María Font. Dpto.
erramientas de la Química rgánica erramientas de la Química rgánica ompuestos carbonílicos onceptos basicos (III) δ δ plano 120 º = polar sp 2 Z Z Z Z = ó Ar Z = ó Ar aldehídos cetonas María Font. Dpto.
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
ORGÁNICA I. 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua.
 ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
ACADEMIA DE QUÍMICA TURNO VESPERTINO
 INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
INSTITUTO POLITÉCNICO NACIONAL CENTRO DE ESTUDIOS CIENTÍFICOS Y TECNOLÓGICOS No. 3 ESTANISLAO RAMÍREZ RUIZ ACADEMIA DE QUÍMICA TURNO VESPERTINO GUIA PARA EL SEGUNDO EXAMEN DEPARTAMENTALDE QUÍMICA I UNIDAD
Reacciones de reducción
 idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
Lección 1: GENERALIDADES
 Lección 1: GENERALIDADES 1.Concepto de Química Orgánica. Introducción histórica. 2. Estructuras de Lewis. Estructuras resonantes. 3. Geometría de las moléculas. 4. Representaciones de las moléculas orgánicas
Lección 1: GENERALIDADES 1.Concepto de Química Orgánica. Introducción histórica. 2. Estructuras de Lewis. Estructuras resonantes. 3. Geometría de las moléculas. 4. Representaciones de las moléculas orgánicas
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto.
 OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
OBJETIVO.- Diferenciar los distintos tipos de enlace químico para establecer las propiedades de cada compuesto. 1. Generalidades de los enlaces químicos Los enlaces químicos, son las fuerzas que mantienen
Tema 12. PREPARACIÓN DE ALQUENOS
 Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
Química del Carbono, Curso /05/2014. Tema 9. Química del Carbono. El carbono: Z=6 A=12. C =1s 2 2s 2 p 2
 Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
SOLUCIONARIO Guía Estándar Anual Polaridad de las moléculas y fuerzas intermoleculares. SGUICES034CB33-A16V1 Ítem Alternativa Habilidad 1 A ASE 2 E Reconocimiento 3 D ASE 4 B ASE 5 C ASE 6 D Reconocimiento
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
Los elementos químicos
 Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
Los elementos químicos Física y Química Las primeras clasificaciones de los elementos Oxford University Press España, S. A. Física y Química 3º ESO 2 Un elemento químico es un tipo de materia constituido
o 0.96A o 1.43A 0.96A O O H CH 3 H
 Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
Capítulo 4. Reacciones orgánicas.
 apítulo 4. Reacciones orgánicas. Una reacción química se puede definir como un proceso de interacción entre especies químicas en el que, como consecuencia de la ruptura y formación de enlaces, se origina
apítulo 4. Reacciones orgánicas. Una reacción química se puede definir como un proceso de interacción entre especies químicas en el que, como consecuencia de la ruptura y formación de enlaces, se origina
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López.
 Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
Unidad 3 Curso: Química General 1 Mtra. Norma Mónica López. Interacciones eléctricas De atracción +, - De repulsión +, + ó -,- Entre Átomos de una misma molécula Moléculas vecinas 2 ENLACE QUÍMICO Siempre
3.- Cuál de las siguientes formulaciones es la correcta para la sal trioxoclorato (V) de litio (clorato de litio)?
 UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
GUIA DE ESTUDIO Nº 7: Equilibrio Químico
 Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
Página26 GUIA DE ESTUDIO Nº 7: Equilibrio Químico I.- Conceptos básicos: Equilibrio químico y constante de equilibrio. Concentraciones en el equilibrio y evolución de un sistema hacia el equilibrio. Principio
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
Unidad I: Propiedades Periódicas: Masa y Enlace
 Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
Unidad I: Propiedades Periódicas: Masa y Enlace 1. Nociones de teoría atómica moderna 2. Propiedades periódicas de los elementos 3. Enlace iónico y covalente 4. Masas atómicas y moleculares 1. Nociones
LA TABLA PERIÓDICA. 1
 LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
LA TABLA PERIÓDICA. 1 Clasificación de Mendeleiev Clasificó lo 63 elementos conocidos utilizando el criterio de masa atómica creciente, ya que no se conocía el concepto de número atómico puesto que no
ANDALUCÍA / JUNIO 2000 LOGSE / QUÍMICA / OPCIÓN A /EXAMEN COMPLETO OPCIÓN A
 OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
REACTIVIDAD DE LOS COMPUESTOS DE CARBONO
 12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1. Explica el efecto inductivo de los siguientes compuestos: a) propil litio; b) etanol. a) Propil litio:
12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1. Explica el efecto inductivo de los siguientes compuestos: a) propil litio; b) etanol. a) Propil litio:
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. LA TABLA PERIÓDICA.
 PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. LA TABLA PERIÓDICA. A partir de la posición de los elementos en la tabla periódica formando grupos y períodos podemos deducir la evolución de algunas propiedades
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS. LA TABLA PERIÓDICA. A partir de la posición de los elementos en la tabla periódica formando grupos y períodos podemos deducir la evolución de algunas propiedades
REACCIONES DE OXIDACIÓN-REDUCCIÓN
 10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
10 REACCINES DE XIDACIÓN-REDUCCIÓN SLUCINES A LAS ACTIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1 Por qué en los procesos redox no puede existir una única semirreacción de oxidación o de reducción?
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
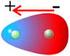 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
2x = x = M. 100 = α = % NOCl eq K C =
 1 Universidad de Castilla la Mancha Selectividad Septiembre.013 Opción A SEPTIEMBRE 013 1.- El cloruro de nitrosilo es un gas utilizado en la síntesis de productos farmacéuticos. Se descompone a altas
1 Universidad de Castilla la Mancha Selectividad Septiembre.013 Opción A SEPTIEMBRE 013 1.- El cloruro de nitrosilo es un gas utilizado en la síntesis de productos farmacéuticos. Se descompone a altas
GUÍA N 1: Enlace Químico y Grupos Funcionales
 UIVERSIDAD MAYR PRIMERA PARTE: Ejercicios de desarrollo. GUÍA : Enlace Químico y Grupos Funcionales.- Defina enlace químico y señale los tipos de enlaces químicos que se pueden presentar en una molécula
UIVERSIDAD MAYR PRIMERA PARTE: Ejercicios de desarrollo. GUÍA : Enlace Químico y Grupos Funcionales.- Defina enlace químico y señale los tipos de enlaces químicos que se pueden presentar en una molécula
Características de electrones protones y neutrones
 Características de electrones protones y neutrones Carga eléctrica Masa Espín SI (C) Atómica SI(g) Atómica (uma) Protón +1,6021 10-19 +1 1,6725 10-24 1,0073 1/2 neutrón 0 0 1,6748 10-24 1,0087 1/2 electrón
Características de electrones protones y neutrones Carga eléctrica Masa Espín SI (C) Atómica SI(g) Atómica (uma) Protón +1,6021 10-19 +1 1,6725 10-24 1,0073 1/2 neutrón 0 0 1,6748 10-24 1,0087 1/2 electrón
ALCOHOLES. Estructura: grupo
 TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
Biopolímero s (4831)
 Biopolímero s (4831) 4.3. Conceptos de catálisis química. 4.3.3. Ejemplos de tipos de catálisis. Aplicación a la catálisis enzimática Los iones metálicos como catalizadores Como se dijo anteriormente los
Biopolímero s (4831) 4.3. Conceptos de catálisis química. 4.3.3. Ejemplos de tipos de catálisis. Aplicación a la catálisis enzimática Los iones metálicos como catalizadores Como se dijo anteriormente los
1. Los elementos químicos
 RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
RESUMEN de la UNIDAD 3. ELEMENTOS Y COMPUESTOS 1. Los elementos químicos La materia está formada por partículas denominadas átomos que, a su vez, están formados por otras partículas más pequeñas: protones,
Especialista en Química Orgánica para Ciencias de la Salud
 Especialista en Química Orgánica para Ciencias de la Salud Titulación certificada por EUROINNOVA BUSINESS SCHOOL Especialista en Química Orgánica para Ciencias de la Salud Especialista en Química Orgánica
Especialista en Química Orgánica para Ciencias de la Salud Titulación certificada por EUROINNOVA BUSINESS SCHOOL Especialista en Química Orgánica para Ciencias de la Salud Especialista en Química Orgánica
PROBLEMAS DE QUIMICA GENERAL III (QM-1123) PRIMERA GUIA
 PROBLEMAS DE QUIMICA GENERAL III (QM-1123) PRIMERA GUIA 1.- Indique el número máximo de electrones que pueden ocupar cada una de las siguientes subcapas: (a) 3d, (b) 4s, (c) 2p, (d) 5f 2.- Determine el
PROBLEMAS DE QUIMICA GENERAL III (QM-1123) PRIMERA GUIA 1.- Indique el número máximo de electrones que pueden ocupar cada una de las siguientes subcapas: (a) 3d, (b) 4s, (c) 2p, (d) 5f 2.- Determine el
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA TANIA POZO CARRERA DE QUIMICA FARMACEUTICA ACIDEZ DE LOS ACIDOS CARBOXILICOS Los ácidos carboxílicos contienen el grupo carboxilo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUIMICA ORGANICA TANIA POZO CARRERA DE QUIMICA FARMACEUTICA ACIDEZ DE LOS ACIDOS CARBOXILICOS Los ácidos carboxílicos contienen el grupo carboxilo
Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES
 Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES OBJETIVOS: 1. Identificar las propiedades físicas y químicas que presentan los alcoholes. 2. Aprender a reconocer entre los alcoholes primarios, secundarios
Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES OBJETIVOS: 1. Identificar las propiedades físicas y químicas que presentan los alcoholes. 2. Aprender a reconocer entre los alcoholes primarios, secundarios
COLEGIO SAN JOSÉ - Hijas de María Auxiliadora C/ Emilio Ferrari, 87 - Madrid Departamento de Ciencias Naturales
 TEMA 1. ELEMENTOS Y COMPUESTOS EJERCICIOS Y SOLUCIONES 4. El sistema periódico 1. Escribe la configuración electrónica de los 3 primeros elementos alcalinotérreos y explica razonadamente si estos elementos
TEMA 1. ELEMENTOS Y COMPUESTOS EJERCICIOS Y SOLUCIONES 4. El sistema periódico 1. Escribe la configuración electrónica de los 3 primeros elementos alcalinotérreos y explica razonadamente si estos elementos
UNIDAD IV ALCOHOLES. Alcoholes: Usos, propiedades y aplicaciones. Pte. M. en C.Q. Macaria Hernández Chávez
 UNIDAD IV ALCOHOLES Alcoholes: Usos, propiedades y aplicaciones Pte. M. en C.Q. Macaria Hernández Chávez ALCOHOLES Introducción. La mayor parte de los alcoholes comunes, hasta con 11 ó 12 átomos de carbono,
UNIDAD IV ALCOHOLES Alcoholes: Usos, propiedades y aplicaciones Pte. M. en C.Q. Macaria Hernández Chávez ALCOHOLES Introducción. La mayor parte de los alcoholes comunes, hasta con 11 ó 12 átomos de carbono,
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs.
 Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
Explicación de las propiedades y los estados de agregación en los compuestos químicos en función de los tipos de enlace. vs. Usar las propiedades y los estados de agregación en los compuestos químicos
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
Tema 9. Química Orgánica
 Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
Lección 11: HALUROS DE ALQUILO III
 Lección 11: HALUROS DE ALQUILO III 1. Reacciones de eliminación. 1.1. Mecanismos E2 y E1. 1.2. Regioselectividad y estereoquímica de las reacciones de eliminación. 2. Competencia entre sustituciones y
Lección 11: HALUROS DE ALQUILO III 1. Reacciones de eliminación. 1.1. Mecanismos E2 y E1. 1.2. Regioselectividad y estereoquímica de las reacciones de eliminación. 2. Competencia entre sustituciones y
