EPAMIN* (fenitoína) Epamin (Fenitoína suspensión oral) (Solo para administración oral; no para uso parenteral.) DESCRIPCIÓN
|
|
|
- Miguel Sánchez Parra
- hace 6 años
- Vistas:
Transcripción
1 EPAMIN* (fenitoína) Epamin (Fenitoína suspensión oral) (Solo para administración oral; no para uso parenteral.) DESCRIPCIÓN Cada 5 ml de suspensión contienen 125 mg de fenitoína. INDICACIONES Y USO Epamin (fenitoína) está indicado para el control de convulsiones tónico clónicas (gran mal) y psicomotoras (lóbulo temporal). Pueden requerirse determinaciones del nivel sérico de fenitoína para hacer ajustes óptimos de la posología CONTRAINDICACIONES Epamin está contraindicado en pacientes con antecedentes de hipersensibilidad a la fenitoína, sus ingredientes inactivos u otras hidantoínas. Está contraindicada la coadministración de Epamin con delavirdina debido al potencial de pérdida de respuesta virológica y la posible resistencia a la delavirdina o a la clase de inhibidores de la transcriptasa inversa no nucleósidos. ADVERTENCIAS Efectos del retiro abrupto La interrupción abrupta de la fenitoína en los pacientes epilépticos puede precipitar el estado epiléptico. Cuando a criterio del clínico surja la necesidad de reducir la posología, de interrumpirla o de sustituir un medicamento anticonvulsivo alternativo, debe llevarse a cabo gradualmente. En el caso de una reacción alérgica o de hipersensibilidad, puede requerirse una sustitución más rápida de una terapia alternativa. En esa circunstancia, la terapia alternativa debe ser un anticonvulsivo que no pertenezca a la clase química hidantoína. Conductas e ideas suicidas Los fármacos antiepilépticos (AED), incluido Epamin, aumentan el riesgo de pensamientos o conductas suicidas en los pacientes que toman estos fármacos por cualquier indicación. Los 1
2 pacientes tratados con algún AED por cualquier indicación deben ser monitoreados para detectar la aparición o el empeoramiento de depresión, pensamientos o conductas suicidas y/o cualquier cambio inusual del estado de ánimo o la conducta. Análisis combinados de 199 ensayos clínicos controlados con placebo (monoterapia y terapia adyuvante) de 11 AED diferentes mostraron que los pacientes asignados aleatoriamente a uno de los AED tenía aproximadamente el doble de riesgo (riesgo relativo ajustado: 1.8, CI del 95%:1.2, 2.7) de pensamientos o conductas suicidas en comparación con los pacientes asignados aleatoriamente al placebo. En estos ensayos, que tuvieron una media de duración del tratamiento de 12 semanas, el índice de incidencia estimado de conducta o ideas suicidas entre 27,863 pacientes tratados con AED fue del 0.43%, en comparación con el 0.24% entre 16,029 pacientes tratados con placebo, lo que representa un aumento de aproximadamente un caso de pensamientos o conductas suicidas por cada 530 pacientes tratados. Hubo cuatro suicidios en pacientes tratados con fármacos en los ensayos, y ninguno en los pacientes tratados con placebo, pero el número es demasiado bajo para permitir alguna conclusión sobre el efecto del fármaco sobre el suicidio. El aumento del riesgo de pensamientos o conductas suicidas con AED se observó a partir de la primera semana después de comenzar el tratamiento farmacológico con AED y persistió mientras duró el tratamiento evaluado. Como la mayoría de los ensayos incluidos en el análisis no se prolongó más de 24 semanas, el riesgo de pensamientos o conductas suicidas después de las 24 semanas no pudo evaluarse. El riesgo de pensamientos o conductas suicidas en general fue uniforme entre los fármacos en los datos analizados. El dato del aumento de riesgo con los AED de diversos mecanismos de acción y a lo largo de diversas indicaciones sugiere que el riesgo se aplica a todos los AED utilizados para cualquier indicación. El riesgo no varió sustancialmente por la edad (5 a 100 años) en los ensayos clínicos analizados. 2
3 La Tabla 1 muestra el riesgo absoluto y relativo por indicación para todos los AED evaluados. Tabla 1. Riesgo por indicación para los fármacos antiepilépticos en el análisis combinado Indicación Pacientes con placebo con eventos cada 1000 pacientes Pacientes con fármacos con eventos cada 1000 pacientes Riesgo relativo: Incidencia de eventos en pacientes con fármacos/ Incidencia en pacientes con placebo Diferencia en el riesgo: pacientes con fármacos adicionales con eventos cada 1000 pacientes Epilepsia Psiquiátrica Otros Total El riesgo relativo de pensamientos o conductas suicidas fue mayor en ensayos clínicos de epilepsia que en ensayos clínicos para afecciones psiquiátricas o de otro tipo, pero las diferencias entre riesgos absolutos fueron similares para las indicaciones de epilepsia y psiquiátricas. Al considerarse la prescripción de Epamin o cualquier otro AED, se debe sopesar el riesgo de pensamientos o conductas suicidas con el riesgo de la enfermedad sin tratamiento. La epilepsia y muchas otras enfermedades para las cuales se prescriben AED están en sí asociadas con morbilidad y mortalidad y con el aumento del riesgo de pensamientos y conductas suicidas. En caso de que surjan pensamientos y conductas suicidas durante el tratamiento, el profesional que prescribe debe considerar si el surgimiento de esos síntomas en cada paciente en particular puede estar relacionado con la enfermedad que se está tratando. Los pacientes, sus cuidadores y sus familiares deben estar informados de que los AED aumentan el riesgo de pensamientos y conductas suicidas y deben estar informados sobre la necesidad de estar alerta para detectar el surgimiento o el empeoramiento de los signos y los síntomas de depresión, cualquier cambio inusual en el estado de ánimo o la conducta o el surgimiento de pensamientos y conductas suicidas o pensamientos de autoagresión. Las conductas preocupantes deben informarse de inmediato a los profesionales médicos. Reacciones dermatológicas graves Se han informado reacciones dermatológicas graves y a veces mortales, incluida necrólisis epidérmica tóxica (TEN) y síndrome de Stevens-Johnson (SJS) con el tratamiento con fenitoína. La aparición de los síntomas se produce habitualmente dentro de los 28 días, pero puede presentarse más tarde. Debe interrumpirse el Epamin ante el primer signo de erupción, excepto que claramente no se relacione con el fármaco. Si los signos y los síntomas sugieren SJS/TEN, el uso de este 3
4 fármaco no debe reanudarse y debe considerarse una terapia alternativa. Si se presenta una erupción, se deben evaluar en el paciente signos y síntomas de reacción farmacológica con eosinofilia y síntomas sistémicos (ver DRESS/hipersensibilidad multiorgánica a continuación). Los estudios en pacientes con descendencia china han detectado una fuerte asociación entre el riesgo de desarrollar SJS/TEN y la presencia de HLA-B*1502, una variante alélica heredada del gen HLA B, en pacientes que recibían carbamazepina. Evidencias limitadas sugieren que HLA- B*1502 puede ser un factor de riesgo para el desarrollo de SJS/TEN en pacientes con ascendencia asiática que reciben otros fármacos antiepilépticos asociados con SJS/TEN, incluida la fenitoína. Debe considerarse evitar la fenitoína como una alternativa para la carbamazepina en pacientes positivos para HLA-B*1502. El uso de la determinación del genotipo de HLA-B*1502 tiene limitaciones importantes y nunca debe sustituir una vigilancia clínica y un tratamiento del paciente adecuados. No se ha estudiado la función de otros posibles factores en el desarrollo de SJS/TEN y la morbilidad que implican, como la dosis de fármacos antiepilépticos (AED), el cumplimiento, los medicamentos concomitantes, las comorbilidades y el nivel de monitoreo dermatológico. Reacción farmacológica con eosinofilia y síntomas sistémicos (DRESS)/hipersensibilidad multiorgánica Se ha informado reacción farmacológica con eosinofilia y síntomas sistémicos (DRESS), también conocida como hipersensibilidad multiorgánica, en pacientes que toman fármacos antiepilépticos, incluido Epamin. Algunos de estos eventos han sido mortales o potencialmente mortales. La DRESS habitualmente (aunque no exclusivamente) se presenta con fiebre, erupción y/o linfadenopatía, asociadas con el compromiso de otros sistemas orgánicos, como hepatitis, nefritis, anomalías hematológicas, miocarditis o miositis, a veces con semejanza con una infección viral aguda. Suele haber eosinofilia presente. Como este trastorno es de expresión variable, puede haber compromiso de otros sistemas orgánicos que no se mencionan aquí. Es importante tener en cuenta que pueden presentarse manifestaciones tempranas de hipersensibilidad, como fiebre o linfadenopatía, aunque la erupción no sea evidente. Si se presentan esos signos o síntomas, el paciente debe evaluarse de inmediato. Epamin debe suspenderse si no se puede establecer una etiología alternativa para los signos o los síntomas. Hipersensibilidad Epamin y otras hidantoínas están contraindicados en pacientes con antecedentes de hipersensibilidad a la fenitoína. Además, deben considerarse alternativas para fármacos estructuralmente similares como las carboxamidas (por ej., carbamazepina), barbitúricos, succinimidas y oxazolidinedionas (por ej., trimetadiona) en estos mismos pacientes. De manera similar, si hay antecedentes de reacciones de hipersensibilidad a estos fármacos estructuralmente semejantes en el paciente o en miembros de la familia directa, deben considerarse alternativas para Epamin. 4
5 Lesión hepática Se han informado casos de hepatotoxicidad aguda, incluidos casos infrecuentes de insuficiencia hepática aguda, con Epamin. Estos eventos pueden ser parte del espectro de DRESS o pueden presentarse aislados. Otras manifestaciones frecuentes incluyen ictericia, hepatomegalia, aumento de los niveles séricos de transaminasas, leucocitosis y eosinofilia. El curso clínico de la hepatotoxicidad aguda de la fenitoína oscila entre una recuperación inmediata y resultados mortales. En estos pacientes con hepatotoxicidad aguda, Epamin debe interrumpirse de inmediato y no volverse a administrar. Sistema hematopoyético Se han informado complicaciones hematopoyéticas, algunas mortales, en asociación con la administración de Epamin. Estas complicaciones han incluido trombocitopenia, leucopenia, granulocitopenia, agranulocitosis y pancitopenia con o sin supresión de médula ósea. Hay varios informes que sugieren una relación entre la fenitoína y el desarrollo de linfadenopatía (local o generalizada) incluidas hiperplasia de ganglios linfáticos benigna, pseudolinfoma, linfoma y enfermedad de Hodgkin. Aunque no se ha establecido una relación de causa y efecto, los casos de linfadenopatía indican la necesidad de diferenciar ese tipo de afección de otros tipos de patología de los ganglios linfáticos. Puede presentarse compromiso de los ganglios linfáticos con o sin síntomas y signos de DRESS. En todos los casos de linfadenopatía, se indica observación de seguimiento durante un periodo prolongado y debe hacerse el máximo esfuerzo por lograr el control de las convulsiones con fármacos antiepilépticos alternativos. Efectos sobre la vitamina D y el hueso El uso crónico de fenitoína en pacientes con epilepsia se ha asociado con la disminución de la densidad mineral ósea (osteopenia, osteoporosis y osteomalacia) y fracturas óseas. La fenitoína induce las enzimas metabolizadoras hepáticas. Esto puede aumentar el metabolismo de la vitamina D y disminuir los niveles de vitamina D, lo cual puede producir deficiencia de vitamina D, hipocalcemia e hipofosfatemia. Debe considerarse la realización de un examen con pruebas de laboratorio y radiológicas relacionadas con los huesos según sea adecuado y el inicio de planes de tratamiento de acuerdo con pautas establecidas. Efectos del uso de alcohol sobre los niveles séricos de fenitoína La ingesta alcohólica aguda puede aumentar los niveles séricos de fenitoína, mientras que el uso crónico de alcohol puede disminuirlos. Exacerbación de la porfiria En vista de informes aislados que asocian la fenitoína con la exacerbación de la porfiria, debe actuarse con precaución al utilizar este medicamento en pacientes que sufren esta enfermedad. 5
6 Uso en el embarazo Datos clínicos: Riesgos para la madre. Puede haber un aumento en la frecuencia de las convulsiones durante el embarazo debido a la alteración de la farmacocinética de la fenitoína. La medición periódica de las concentraciones plasmáticas de fenitoína puede ser valiosa en el tratamiento de las mujeres embarazadas como orientación para el ajuste adecuado de la posología. Sin embargo, probablemente se indique el restablecimiento de la posología original después del parto. Riesgos para el feto. Si el fármaco se usa durante el embarazo, o si la paciente queda embarazada mientras está recibiendo el fármaco, se debe informar a la paciente sobre el riesgo potencial para el feto. La exposición prenatal a la fenitoína puede aumentar los riesgos de malformaciones congénitas y otros resultados adversos en el desarrollo. Se ha informado aumento de la frecuencia de malformaciones importantes (como hendidura orofacial y defectos cardiacos), anomalías menores (características faciales dismórficas, hipoplasia de uñas y dedos), anomalías del crecimiento (incluida microcefalia) y deficiencia mental entre niños nacidos de mujeres epilépticas que tomaron fenitoína sola o en combinación con otros fármacos antiepilépticos durante el embarazo. También se han informado varios casos de tumores malignos, incluido neuroblastoma, en niños cuyas madres recibieron fenitoína durante el embarazo. La incidencia general de malformaciones en hijos de mujeres epilépticas que recibieron fármacos antiepilépticos durante el embarazo (fenitoína y/u otras) es de aproximadamente el 10%, o de dos a tres veces la que se presenta en la población general. Sin embargo, no hay certeza sobre las contribuciones relativas de los fármacos antiepilépticos y otros factores asociados con la epilepsia a este aumento del riesgo y, en la mayoría de los casos, no se ha podido atribuir anomalías del desarrollo específicas a fármacos antiepilépticos específicos. Las pacientes deben consultar al médico para sopesar los riesgos y los beneficios de la fenitoína durante el embarazo. Periodo posterior al parto. Puede presentarse un trastorno de sangrado potencialmente mortal relacionado con la disminución de los niveles de factores de coagulación dependientes de la vitamina K en recién nacidos expuestos a la fenitoína in utero. Esta afección inducida por el fármaco puede prevenirse con la administración de vitamina K a la madre antes del parto y al neonato después del nacimiento. Datos no clínicos. La administración de fenitoína en animales preñados dio como resultado una teratogenicidad (mayores incidencias en las malformaciones fetales) y otro tipo de toxicidad del desarrollo (incluidas muerte embriofetal, alteración del crecimiento y anomalías del comportamiento) en varias especies de animales en dosis de relevancia clínica. 6
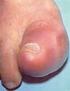
7 PRECAUCIONES Generalidades: El hígado es el sitio principal de biotransformación de la fenitoína; los pacientes con deterioro de la función hepática, los pacientes de edad avanzada o aquellos gravemente enfermos pueden presentar signos de toxicidad prematuros. Un bajo porcentaje de personas tratadas con fenitoína ha mostrado un metabolismo lento del fármaco. El metabolismo lento puede obedecer a la disponibilidad enzimática limitada y a la falta de inducción; parece estar determinado genéticamente. Si se desarrollan signos tempranos de toxicidad del SNC relacionada con la dosis, deben revisarse de inmediato los niveles plasmáticos. Se ha informado hiperglucemia, como resultado de los efectos inhibidores de la liberación de insulina del fármaco. La fenitoína también puede aumentar el nivel de glucosa sérica en los pacientes diabéticos. La fenitoína no está indicada para convulsiones debidas a causas hipoglucémicas u otras causas metabólicas. Deben realizarse procedimientos diagnósticos adecuados como se indique. La fenitoína no es efectiva para las convulsiones de ausencia (petit mal). Si hay convulsiones tónico clónicas (gran mal) y de ausencia (petit mal) presentes, se necesita una terapia farmacológica combinada. Los niveles séricos de fenitoína sostenidos por encima del intervalo óptimo pueden producir estados de confusión que se describen como delirio, psicosis o encefalopatía o raramente disfunción cerebelosa irreversible y/o atrofia cerebelosa. De manera acorde, se recomienda medir los niveles plasmáticos ante el primer signo de toxicidad aguda. Se indica la reducción de la dosis de la terapia con fenitoína si los niveles plasmáticos son excesivos; si los síntomas persisten, se recomienda suspenderla. Información para pacientes: Debe indicarse a los pacientes que tomen Epamin solo como está prescrito. Los pacientes que toman fenitoína deben ser informados sobre la importancia de respetar estrictamente la pauta posológica y sobre informar al médico con respecto a cualquier condición clínica en la cual no se pueda tomar el fármaco por vía oral como se prescribe (por ej. una cirugía, etc.). Los pacientes deben recibir instrucciones para usar un dispositivo de medición calibrado con exactitud cuando usen este medicamento para asegurar la exactitud de la dosis. Los pacientes deben estar informados sobre los signos y síntomas tóxicos tempranos de potenciales reacciones hematológicas, dermatológicas, de hipersensibilidad o hepáticas. Estos síntomas pueden incluir, entre otras cosas, fiebre, dolor de garganta, erupción, úlceras en la boca, fácil formación de hematomas, linfadenopatía y hemorragia petequial o purpúrica y, en el caso de reacciones hepáticas, anorexia, náuseas/vómitos o ictericia. El paciente debe ser advertido de que, como estos signos y síntomas pueden indicar una reacción grave, deben informar cualquier caso de inmediato al médico. Además, el paciente debe ser advertido de que, como estos signos y síntomas deben ser informados aunque sean leves o aunque se presenten después del uso prolongado. 7
8 Se debe advertir a los pacientes que eviten usar otros fármacos o bebidas alcohólicas sin consultar al médico. Debe acentuarse la importancia de una buena higiene dental para minimizar el desarrollo de hiperplasia gingival y sus complicaciones. Los pacientes, sus cuidadores y sus familiares deben estar informados de que los AED, incluido Epamin, pueden aumentar el riesgo de pensamientos y conductas suicidas y deben estar informados sobre la necesidad de estar alerta para detectar el surgimiento o el empeoramiento de los síntomas de depresión, cualquier cambio inusual en el estado de ánimo o la conducta o el surgimiento de pensamientos y conductas suicidas o pensamientos de autoagresión. Las conductas preocupantes deben informarse de inmediato a los profesionales médicos. Pruebas de laboratorio: Pueden requerirse determinaciones del nivel sérico de fenitoína para lograr ajustes óptimos de la posología. Las dosis de fenitoína habitualmente se seleccionan para alcanzar concentraciones plasmáticas totales terapéuticas de fenitoína de 10 a 20 mcg/ml (concentraciones de fenitoína libre de 1 a 2 mcg/ml). Interacciones farmacológicas: La fenitoína está muy unida a las proteínas plasmáticas y tiende al desplazamiento competitivo. La fenitoína se metaboliza mediante las enzimas del citocromo P450 hepático CYP2C9 y CYP2C19, y es particularmente susceptible a interacciones farmacológicas inhibidoras porque es objeto de metabolismo saturable. La inhibición del metabolismo puede producir aumentos significativos de las concentraciones de fenitoína circulante y aumentar el riesgo de toxicidad farmacológica. La fenitoína es un potente inductor de las enzimas hepáticas metabolizadoras de fármacos. Las determinaciones de niveles séricos de fenitoína son especialmente útiles cuando se sospechan posibles interacciones farmacológicas. Las interacciones farmacológicas más frecuentes se enumeran a continuación: Nota: La lista no es completa o integral. Deben consultarse los prospectos del envase de los fármacos individuales. Fármacos que afectan las concentraciones de fenitoína: Los fármacos que pueden aumentar los niveles séricos de fenitoína incluyen: ingesta aguda de alcohol, amiodarona, agentes antiepilépticos (etosuximida, felbamato, oxcarbazepina, mesuximida, topiramato), azoles (fluconazol, ketoconazol, itraconazol, miconazol, voriconazol), capecitabina, cloramfenicol, clordiazepóxido, disulfiram, estrógenos, fluorouracilo, fluoxetina, fluvastatina, fluvoxamina, antagonistas de H 2 (por ej. cimetidina), halotano, isoniazida, metilfenidato, omeprazol, fenotiazinas, salicilatos, sertralina, succinimidas, sulfonamidas (por ej., sulfametizol, sulfafenazol, sulfadiazina, sulfametoxazol-trimetoprima), ticlopidina, tolbutamida, trazodona y warfarina. Los fármacos que pueden disminuir los niveles de fenitoína incluyen: fármacos anticancerígenos, generalmente combinados (por ej., bleomicina, carboplatino, cisplatino, doxorubicina, metotrexato), carbamazepina, abuso crónico del alcohol, diazepam, diazoxida, ácido fólico, fosamprenavir, nelfinavir, reserpina, rifampina, ritonavir, hierba de San Juan, sucralfato, teofilina y vigabatrina. La administración de fenitoína con preparados que elevan el ph gástrico (por ej. suplementos o antiácidos con carbonato de calcio, hidróxido de aluminio e hidróxido de 8
9 magnesio) puede afectar la absorción de la fenitoína. En la mayoría de los casos en los cuales se vieron interacciones, el efecto fue la disminución de los niveles de fenitoína cuando los fármacos se tomaban simultáneamente. De ser posible, la fenitoína y estos productos no deben tomarse a la misma hora del día. Los fármacos que pueden aumentar o disminuir los niveles séricos de fenitoína incluyen: fenobarbital, valproato sódico y ácido valproico. De manera similar, el efecto de la fenitoína sobre los niveles séricos de fenobarbital, ácido valproico y valproato sódico es impredecible. El agregado o la interrupción de estos agentes en los pacientes que reciben terapia con fenitoína puede requerir un ajuste de la dosis de fenitoína para lograr resultados clínicos óptimos. Fármacos afectados por la fenitoína: Fármacos que no se deben coadministrar con fenitoína: Delavirdina Los fármacos cuya eficacia es perjudicada por la fenitoína incluyen: azoles (fluconazol, ketoconazol, itraconazol, voriconazol, posaconazol), corticoesteroides, doxiciclina, estrógenos, furosemida, irinotecan, anticonceptivos orales, paclitaxel, paroxetina, quinidina, rifampina, sertralina, tenipósido, teofilina y vitamina D. Se han informado aumentos y disminuciones en las respuestas de PT/INR con la coadministración de fenitoína y warfarina. La fenitoína disminuye las concentraciones plasmáticas de los metabolitos activos del albendazol, ciertos antivirales anti VIH (efavirenz, lopinavir/ritonavir, indinavir, nelfinavir, ritonavir, saquinavir), agentes antiepilépticos (carbamazepina, felbamato, lamotrigina, topiramato, oxcarbazepina, quetiapina), atorvastatina, clorpropamida, clozapina, ciclosporina, digoxina, fluvastatina, ácido fólico, metadona, mexiletina, nifedipina, nimodipina, nisoldipina, praziquantel, simvastatina, y verapamilo. La fenitoína administrada con fosamprenavir solo puede disminuir la concentración de amprenavir, el metabolito activo. La fenitoína administrada con la combinación de fosamprenavir y ritonavir puede aumentar la concentración de amprenavir. Se ha observado resistencia a la acción bloqueadora neuromuscular de los agentes bloqueadores neuromuscular no despolarizantes pancuronio, vecuronio, rocuronio y cisatracurio en pacientes con administración crónica de fenitoína. Se desconoce si la fenitoína tiene o no el mismo efecto sobre otros agentes no despolarizantes. Los pacientes deben ser monitoreados atentamente para detectar una recuperación más rápida que lo previsto de un bloqueo neuromuscular y los requisitos de velocidad de infusión pueden ser mayores. El agregado o la interrupción de la fenitoína durante la terapia concomitante con estos agentes puede requerir un ajuste de la dosis de los agentes para lograr resultados clínicos óptimos. Interacción del fármaco con preparados nutricionales/para alimentación enteral: Los informes en la literatura sugieren que los pacientes que recibían preparados para alimentación enteral y/o suplementos nutricionales relacionados tenían niveles plasmáticos de fenitoína inferiores a lo previsto. Por lo tanto, se sugiere no administrar fenitoína de manera concomitante con un preparado para alimentación enteral. Puede requerirse un monitoreo más frecuente del nivel sérico de fenitoína en estos pacientes. 9
10 Interacciones con pruebas de laboratorio/fármacos: La fenitoína puede disminuir las concentraciones séricas de T4: También puede producir niveles inferiores a los normales para las pruebas de dexametasona o metirapona. La fenitoína puede causar aumento de los niveles séricos de glucosa, fosfatasa alcalina y gamaglutamiltranspeptidasa (GGT). Se recomienda precaución al usar métodos inmunoanalíticos para medir concentraciones plasmáticas de fenitoína. Carcinogénesis, mutagénesis, deterioro de la fertilidad: Carcinogénesis: Ver la sección de ADVERTENCIAS (Sistema hematopoyético). En estudios de carcinogenicidad, se administró fenitoína en la alimentación de ratones (10, 25 o 45 mg/kg/día) y ratas (25, 50 o 100 mg/kg/día) durante 2 años. Las incidencias de los tumores hepatocelulares aumentaron en ratones machos y hembras en la dosis más alta. No se observaron aumentos en la incidencia de tumores en ratas. Las dosis más altas analizadas en estos estudios se asociaron con los niveles de fenitoína pico en plasma por debajo de las concentraciones terapéuticas humanas. En los estudios de carcinogenicidad informados en la bibliografía, se administró fenitoína en la alimentación durante 2 años en dosis de hasta 600 ppm (aproximadamente 90 mg/kg/día) en ratones y en dosis de hasta 2400 ppm (aproximadamente 120 mg/kg/día) en ratas. Las incidencias de tumores hepatocelulares aumentaron en ratones hembra en todas las dosis analizadas, excepto en la más baja. No se observaron aumentos en la incidencia de tumores en ratas. Mutagénesis La fenitoína arrojó resultados negativos en la prueba de Ames y en el ensayo de clastogenicidad in vitro en células ováricas de hámster chino (CHO). En los estudios informados en la bibliografía, la fenitoína arrojó resultados negativos en el ensayo in vitro de linfoma de ratón y en el ensayo de micronúcleos in vivo en ratones. La fenitoína fue clastogénica en el ensayo de intercambio de cromátides hermanas in vitro en células CHO. Fertilidad No se han evaluado de forma adecuada los efectos de la fenitoína en la fertilidad de hembras y machos. Embarazo: Ver la sección de ADVERTENCIAS. Lactancia: No se recomienda que las mujeres que toman este fármaco amamanten bebés, ya que la fenitoína parece secretarse en concentraciones bajas en la leche materna. Uso pediátrico: Ver la sección DOSIS Y ADMINISTRACIÓN. Uso geriátrico: La depuración de fenitoína tiende a disminuir con el aumento de la edad 10
11 REACCIONES ADVERSAS Cuerpo como un todo: Se han observado reacciones alérgicas en la forma de erupciones y, rara vez, formas más graves (ver el párrafo Piel y extremidades a continuación) y DRESS. También se ha informado anafilaxia. También ha habido informes sobreengrosamiento de los rasgos faciales, lupus eritematoso sistémico, periarteritis nodosa y anomalías de la inmunoglobulina. Sistema nervioso: Las reacciones adversas más comunes que se presentan a causa del tratamiento con fenitoína son reacciones del sistema nervioso y suelen estar relacionadas con la dosis. Las reacciones incluyen nistagmo, ataxia, balbuceo, disminución de la coordinación, somnolencia y confusión mental. También se observaron mareos, vértigo, insomnio, nerviosismo transitorio, espasmos motores, parestesia y dolor de cabeza. Además, ha habido informes raros de discinesias inducidas por la fenitoína, incluida corea, distonía, temblor y asterixis, similares a las inducidas por la fenotiazina y otros fármacos neurolépticos. Se han informado casos de atrofia cerebelosa, que parece producirse más probablemente en entornos con niveles elevados de fenitoína y/o uso de fenitoína a largo plazo. Se ha observado polineuropatía periférica predominantemente sensorial en pacientes con terapia a largo plazo. Sistema digestivo: Insuficiencia hepática aguda, hepatitis tóxica, daño hepático, náuseas, vómitos, estreñimiento, agrandamiento de los labios e hiperplasia gingival. Piel y extremidades: Las manifestaciones dermatológicas a veces acompañadas por fiebre han incluido erupciones escarlatiniformes o morbiliformes. Una erupción morbiliforme (tipo sarampión) es la más común; otros tipos de dermatitis son más raros. Otras formas más graves que pueden ser mortales han incluido dermatitis bullosa, exfoliativa o purpúrica, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica (ver la sección ADVERTENCIAS). También ha habido informes de hipertricosis. Sistema hematológico y linfático: Se han informado ocasionales complicaciones hematopoyéticas, algunas mortales, en asociación con la administración de fenitoína. Estas complicaciones han incluido trombocitopenia, leucopenia, granulocitopenia, agranulocitosis y pancitopenia con o sin supresión de médula ósea. Aunque se han presentado macrocitosis y anemia megaloblástica, estas afecciones suelen responder a la terapia con ácido fólico. Ha habido informes de linfadenopatía, incluidas hiperplasia de ganglios linfáticos benigna, pseudolinfoma, linfoma y enfermedad de Hodgkin (ver la sección ADVERTENCIAS). Sentidos especiales: Alteración de la sensación del gusto, incluido gusto metálico. Urogenital: Enfermedad de Peyronie SOBREDOSIS Se desconoce la dosis mortal en pacientes pediátricos. La dosis mortal en adultos se estima entre 2 y 5 gramos. Los síntomas iniciales son nistagmo, ataxia y disartria. Otros signos son temblor, 11
12 hiperreflexia, letargo, dificultad al hablar, visión borrosa, náuseas, y vómitos. El paciente puede volverse comatoso e hipotenso. La muerte se debe a depresión respiratoria y circulatoria. Hay variaciones marcadas entre las personas con respecto a los niveles plasmáticos de fenitoína en los que se puede presentar toxicidad. El nistagmo, en mirada lateral, suele aparecer con 20 mcg/ml, la ataxia con 30 mcg/ml, la disartria y el letargo aparecen cuando la concentración plasmática supera 40 mcg/ml, pero se ha informado una concentración de hasta 50 mcg/ml sin que se presentara toxicidad. La dosis terapéutica se ha llegado a tomar 25 veces con un resultado de concentración sérica de más de 100 mcg/ml con recuperación completa. Se han informado casos de disfunción y atrofia cerebelosa irreversible. Tratamiento: El tratamiento no es específico, ya que no hay antídoto conocido. Se debe observar atentamente la adecuación de los sistemas respiratorio y circulatorio y deben emplearse medidas de respaldo adecuadas. Puede considerarse la hemodiálisis, ya que la fenitoína no tiene unión completa a las proteínas plasmáticas. Se ha utilizado la transfusión de intercambio total en el tratamiento de intoxicación severa en pacientes pediátricos. En la sobredosis aguda, debe tenerse en cuenta la posibilidad de otros depresores del SNC, incluido el alcohol. DOSIS Y ADMINISTRACIÓN SOLO PARA ADMINISTRACIÓN ORAL; NO PARA USO PARENTERAL Deben monitorearse las concentraciones séricas y debe tenerse cuidado al cambiar al paciente de la forma sal sódica a la ácida libre. Dilantin Kapseals está formulado con la sal sódica de fenitoína. La forma ácida libre de fenitoína se utiliza en Epamin suspensión y Dilantin Infatabs. Como hay un aumento aproximado del 8% en el contenido de fármaco con la forma ácida libre con respecto a la sal sódica, pueden requerirse ajustes de la posología y monitoreo del nivel sérico cuando se cambia de un producto formulado con el ácido libre a uno formulado con la sal sódica y viceversa. Generalidades: La posología debe individualizarse para obtener el máximo beneficio. En algunos casos, pueden requerirse determinaciones del nivel sérico sanguíneo para hacer ajustes óptimos de la posología; el nivel sérico clínicamente efectivo suele ser de 10 a 20 mcg/ml. Con la posología recomendada, puede requerirse un periodo de siete a diez días para alcanzar niveles sanguíneos de estado estable con fenitoína y no deben realizarse cambios en la posología (aumento o disminución) a intervalos menores de siete a diez días. Dosis para adultos: Los pacientes que no han recibido tratamiento previo pueden comenzar con una cuchara de té (5 ml) de Epamin suspensión tres veces al día y, después, la dosis se ajusta para adecuarla a los requisitos individuales. Puede hacerse un aumento a cinco cucharas de té diarias, de ser necesario. Posología en poblaciones especiales Pacientes con enfermedad renal o hepática: Debido a un aumento de la fracción de fenitoína libre en pacientes con enfermedad renal o hepática o en los que tienen hipoalbuminemia, la interpretación de las concentraciones plasmáticas totales de fenitoína debe realizarse con 12
13 precaución. Las concentraciones de fenitoína libre pueden ser más útiles en estas poblaciones de pacientes. Pacientes de edad avanzada: La depuración de fenitoína disminuye ligeramente en los pacientes de edad avanzada y puede requerirse una administración menor o menos frecuente. Pediatría: Inicialmente, 5 mg/kg/día en dos o tres dosis divididas por igual, con una posología posterior individualizada, hasta un máximo de 300 mg diarios. Una posología de mantenimiento diaria recomendada habitualmente es de 4 a 8 mg/kg. Los niños de más de 6 años de edad y los adolescentes pueden requerir la dosis de adultos mínima (300 mg/día). Almacenar a temperatura inferior a 30 C. Proteger del congelamiento y la luz. Presentaciones comerciales Frasco con 120 ml de Suspensión oral de 125mg/5ml. No todas las presentaciones comerciales se encuentran disponibles en cada país. Para mayor información contactar al departamento de información médica de Pfizer a: info.medica@pfizer.com Fecha de Revisión: Diciembre de 2015 Documento de referencia: USPI LAB Para la región de Centroamérica y Caribe ver información referente a titular, fabricante y empacador en el empaque secundario. 13
EPAMIN XR 100 mg (Fenitoína sódica) Cápsulas de Liberación Prolongada
 EPAMIN XR 100 mg (Fenitoína sódica) Cápsulas de Liberación Prolongada 1. NOMBRE DEL PRODUCTO FARMACÉUTICO EPAMIN XR 100 mg Cápsulas de Liberación Prolongada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
EPAMIN XR 100 mg (Fenitoína sódica) Cápsulas de Liberación Prolongada 1. NOMBRE DEL PRODUCTO FARMACÉUTICO EPAMIN XR 100 mg Cápsulas de Liberación Prolongada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Farmacología del Sistema Nervioso. FARMACOS ANTIEPILEPTICOS. Dr. Pedro Guerra López
 Farmacología del Sistema Nervioso. FARMACOS ANTIEPILEPTICOS. Dr. Pedro Guerra López Fárm acos Antiepilépticos. Desarrollo 1912-Fenobarbital. (Hauptmann) 1938- Fenitoina (Merrit y Putnam) 1965- Fármacos
Farmacología del Sistema Nervioso. FARMACOS ANTIEPILEPTICOS. Dr. Pedro Guerra López Fárm acos Antiepilépticos. Desarrollo 1912-Fenobarbital. (Hauptmann) 1938- Fenitoina (Merrit y Putnam) 1965- Fármacos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
EPAMIN 100 mg (Fenitoína sódica) Cápsulas. Cada cápsula de EPAMIN 100 mg contiene: 100 mg de fenitoína sódica
 EPAMIN 100 mg (Fenitoína sódica) Cápsulas 1. NOMBRE DEL PRODUCTO FARMACÉUTICO EPAMIN 100 mg Cápsulas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula de EPAMIN 100 mg contiene: 100 mg de fenitoína
EPAMIN 100 mg (Fenitoína sódica) Cápsulas 1. NOMBRE DEL PRODUCTO FARMACÉUTICO EPAMIN 100 mg Cápsulas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula de EPAMIN 100 mg contiene: 100 mg de fenitoína
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp
 Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Lección 22. Farmacos Antiepilepticos y anticonvulsivantes UNIDAD VI: ALTERACIONES NEUROLÓGICAS
 Ricardo Brage e Isabel Trapero - Lección 22 UNIDAD VI: ALTERACIONES NEUROLÓGICAS Lección 22 Farmacos Antiepilepticos y anticonvulsivantes Guión Ricardo Brage e Isabel Trapero - Lección 22 1. FUNDAMENTOS.
Ricardo Brage e Isabel Trapero - Lección 22 UNIDAD VI: ALTERACIONES NEUROLÓGICAS Lección 22 Farmacos Antiepilepticos y anticonvulsivantes Guión Ricardo Brage e Isabel Trapero - Lección 22 1. FUNDAMENTOS.
FICHA TÉCNICA. Cada ml de solución contiene 50 mg de fenitoína (D.O.E) (sódica): Para excipientes ver 6.1
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FENITOÍNA COMBINO PHARM 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 50 mg de fenitoína (D.O.E) (sódica):
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO FENITOÍNA COMBINO PHARM 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de solución contiene 50 mg de fenitoína (D.O.E) (sódica):
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
Fármacos. anticonvulsivantes
 Fármacos anticonvulsivantes Epilepsia: Generalidades Enfermedad neurológica frecuente Utilización n de grupos de fármacos f con acciones farmacológicas similares Objetivo principal: Evitar la propagación
Fármacos anticonvulsivantes Epilepsia: Generalidades Enfermedad neurológica frecuente Utilización n de grupos de fármacos f con acciones farmacológicas similares Objetivo principal: Evitar la propagación
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
Documento Local del Producto
 1 Documento Local del Producto Título del Documento de Producto: Alprazolam Fecha de CDS que reemplaza: 14 de octubre de 2013 Fecha Efectiva: 12 de diciembre de 2013 Versión CDS: 8.0 1. NOMBRE DEL MEDICAMENTO
1 Documento Local del Producto Título del Documento de Producto: Alprazolam Fecha de CDS que reemplaza: 14 de octubre de 2013 Fecha Efectiva: 12 de diciembre de 2013 Versión CDS: 8.0 1. NOMBRE DEL MEDICAMENTO
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
Documento Local de Producto 1
 Documento Local de Producto 1 Título del Documento de Producto: Fenitoína Suspensión Oral, Fenitoína Cápsulas Fecha de CDS que reemplaza: 27 de Febrero de 2013 Fecha Efectiva: 23 de Abril de 2014 Versión
Documento Local de Producto 1 Título del Documento de Producto: Fenitoína Suspensión Oral, Fenitoína Cápsulas Fecha de CDS que reemplaza: 27 de Febrero de 2013 Fecha Efectiva: 23 de Abril de 2014 Versión
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
Farmacología a de la epilepsia
 Introducción Farmacología a de la epilepsia Enfermedad crónica, con presencia de episodios críticos recurrentes (crisis epilépticas) muchas veces convulsivos, de duración variable Afecta al 0,4-0,8% de
Introducción Farmacología a de la epilepsia Enfermedad crónica, con presencia de episodios críticos recurrentes (crisis epilépticas) muchas veces convulsivos, de duración variable Afecta al 0,4-0,8% de
No. el alcohol no altera el mecanismo de acción o los efectos del Andanza.
 GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
TECNOLOGÍA EN SALUD DE INTERÉS. Oxcarbazepina, lacosamida, vigabatrina, topiramato o levetiracetam. 1. RESUMEN
 TECNOLOGÍA EN SALUD DE INTERÉS Oxcarbazepina, lacosamida, vigabatrina, topiramato y levetiracetam 1. RESUMEN Título del reporte: Efectividad y seguridad de oxcarbazepina, lacosamida, vigabatrina, topiramato
TECNOLOGÍA EN SALUD DE INTERÉS Oxcarbazepina, lacosamida, vigabatrina, topiramato y levetiracetam 1. RESUMEN Título del reporte: Efectividad y seguridad de oxcarbazepina, lacosamida, vigabatrina, topiramato
LEXATUSSIN Dextrometorfano Bromhidrato 15 mg / 5 ml Jarabe
 LEXATUSSIN Dextrometorfano Bromhidrato 15 mg / 5 ml Jarabe LEXATUSSIN (Dextrometorfano Bromhidrato 15 mg/5 ml) Jarabe COMPOSICIÓN: Cada 100 ml de Jarabe contiene: Dextrometorfano Bromhidrato monohidrato...
LEXATUSSIN Dextrometorfano Bromhidrato 15 mg / 5 ml Jarabe LEXATUSSIN (Dextrometorfano Bromhidrato 15 mg/5 ml) Jarabe COMPOSICIÓN: Cada 100 ml de Jarabe contiene: Dextrometorfano Bromhidrato monohidrato...
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
Diplomado de Farmacología Clínica Aplicada a la Práctica Odontológica
 Medicamentos adyuvantes en el manejo d Diplomado de Farmacología Clínica Aplicada a la Práctica Odontológica Dra. Margarita Araujo Navarrete Neuroquímica Del dolor Neurotransmisor excitatorio: Glutamato
Medicamentos adyuvantes en el manejo d Diplomado de Farmacología Clínica Aplicada a la Práctica Odontológica Dra. Margarita Araujo Navarrete Neuroquímica Del dolor Neurotransmisor excitatorio: Glutamato
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FARMACOLOGIA DE LA EPILEPSIA
 FARMACOLOGIA DE LA EPILEPSIA OBJETIVOS Y COMPETENCIAS: Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Clasificar de forma básica los diferentes tipos de crisis epilepticas. 2.-
FARMACOLOGIA DE LA EPILEPSIA OBJETIVOS Y COMPETENCIAS: Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Clasificar de forma básica los diferentes tipos de crisis epilepticas. 2.-
PROSPECTO : INFORMACIÓN PARA EL USUARIO. Fenitoína Rubió 50 mg/ml solución inyectable
 PROSPECTO : INFORMACIÓN PARA EL USUARIO Fenitoína Rubió 50 mg/ml solución inyectable Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para
PROSPECTO : INFORMACIÓN PARA EL USUARIO Fenitoína Rubió 50 mg/ml solución inyectable Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información importante para
Clasificación crisis epilépticas
 Clasificación crisis epilépticas Parciales o focales: descarga en una zona concreta de la corteza cerebral Parcial simple: sin pérdida de conocimiento, motora, sensitiva, sensorial Parcial compleja: con
Clasificación crisis epilépticas Parciales o focales: descarga en una zona concreta de la corteza cerebral Parcial simple: sin pérdida de conocimiento, motora, sensitiva, sensorial Parcial compleja: con
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
Principios activos Eficacia Seguridad Conveniencia Niveles 1 Haloperidol Lorazepam Litio carbonato
 TRASTORNO AFECTIVO BIPOLAR (enfermedad maníaco depresiva) Codificación CIE10 F30 episodio maníaco F31.9 trastorno afectivo bipolar Problema: Trastorno afectivo mayor, marcado por una severa distorsión
TRASTORNO AFECTIVO BIPOLAR (enfermedad maníaco depresiva) Codificación CIE10 F30 episodio maníaco F31.9 trastorno afectivo bipolar Problema: Trastorno afectivo mayor, marcado por una severa distorsión
Pacientes de edad avanzada: debe considerarse la conveniencia de ampliar el intervalo de dosificación (Ver Propiedades Famacocinéticas).
 FT290191-B+2 1. NOMBRE DEL MEDICAMENTO DARVON 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextropropoxifeno (D.C.I.) napsilato 100 mg. 3. FORMA FARMACÉUTICA Cápsulas para administración por vía oral. 4.
FT290191-B+2 1. NOMBRE DEL MEDICAMENTO DARVON 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextropropoxifeno (D.C.I.) napsilato 100 mg. 3. FORMA FARMACÉUTICA Cápsulas para administración por vía oral. 4.
Paracetamol DC 90 equivalente a mg de Paracetamol
 INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre comercial: TAFIROL 2. Nombre genérico PARACETAMOL 3. Forma farmacéutica y formulación: Cada tableta contiene: Paracetamol DC 90 equivalente a. 1000 mg de Paracetamol
INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre comercial: TAFIROL 2. Nombre genérico PARACETAMOL 3. Forma farmacéutica y formulación: Cada tableta contiene: Paracetamol DC 90 equivalente a. 1000 mg de Paracetamol
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
TEMA XVI: FÁRMACOS ANTIEPILÉPTICOS PTICOS Ó ANTICONVULSIVANTES
 TEMA XVI: FÁRMACOS ANTIEPILÉPTICOS PTICOS Ó ANTICONVULSIVANTES 1 EPILEPSIA Caracterizada por descargas neuronales excesivas e incontroladas en el cerebro, aumento en el flujo de cationes al interior celular
TEMA XVI: FÁRMACOS ANTIEPILÉPTICOS PTICOS Ó ANTICONVULSIVANTES 1 EPILEPSIA Caracterizada por descargas neuronales excesivas e incontroladas en el cerebro, aumento en el flujo de cationes al interior celular
PROSPECTO. Antiepiléptico, hipnótico y sedante. Barbitúrico de acción prolongada y lento comienzo de acción.
 PROSPECTO LUMINAL 0,1 Comprimidos Fenobarbital (D.C.I.) COMPOSICIÓN 1 comprimido contiene fenobarbital (D.C.I.) 100 mg. Excipientes: Almidón de maíz, talco, carboximetilalmidón de sodio y estearato de
PROSPECTO LUMINAL 0,1 Comprimidos Fenobarbital (D.C.I.) COMPOSICIÓN 1 comprimido contiene fenobarbital (D.C.I.) 100 mg. Excipientes: Almidón de maíz, talco, carboximetilalmidón de sodio y estearato de
TEMA XXI ANTICONVULSIVANTES
 TEMA XXI ANTICONVULSIVANTES Farmacología de la epilepsia (epilambaneim) Introducción Enfermedad crónica, con presencia de episodios críticos recurrentes (crisis epilépticas) muchas veces convulsivos, de
TEMA XXI ANTICONVULSIVANTES Farmacología de la epilepsia (epilambaneim) Introducción Enfermedad crónica, con presencia de episodios críticos recurrentes (crisis epilépticas) muchas veces convulsivos, de
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
Psicofàrmacos. Escuela de parteras 2013
 Psicofàrmacos Escuela de parteras 2013 Psicofàrmacos Fàrmacos que actùan sobre las funciones cerebrales como sedantes o estimulantes, lo que produce cambios en la percepciòn, estado de ànimo, conciencia
Psicofàrmacos Escuela de parteras 2013 Psicofàrmacos Fàrmacos que actùan sobre las funciones cerebrales como sedantes o estimulantes, lo que produce cambios en la percepciòn, estado de ànimo, conciencia
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg
 PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
Nuevos y novísimos fármacos antiepilépticos
 Nuevos y novísimos fármacos antiepilépticos Cuál es el escenario en la epilepsia? 50% Control con monoterapia 30% Control con politerapia 20% Farmacorresistencia 5% están libres de crisis con un nuevo
Nuevos y novísimos fármacos antiepilépticos Cuál es el escenario en la epilepsia? 50% Control con monoterapia 30% Control con politerapia 20% Farmacorresistencia 5% están libres de crisis con un nuevo
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
Sección 9: Antiparkinsonianos
 201 Sección 9: Antiparkinsonianos 9.1 Fármacos utilizados en el parkinsonismo...202 9.2 Fármacos utilizados en el temblor esencial y trastornos relacionados...204 202 9.1 Fármacos utilizados en el parkinsonismo
201 Sección 9: Antiparkinsonianos 9.1 Fármacos utilizados en el parkinsonismo...202 9.2 Fármacos utilizados en el temblor esencial y trastornos relacionados...204 202 9.1 Fármacos utilizados en el parkinsonismo
1. NOMBRE DEL MEDICAMENTO. VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
Repafet. Rupatadina Tabletas. Rupatadina II.- DENOMINACIÓN GENÉRICA: III.- FORMA FARMACÉUTICA Y FORMULACIÓN:
 Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Usos de fármacos durante el embarazo y la lactancia
 Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
Acido valproico y valproato sódico; Oxazolidinedionas; Benzodiazepinas.
 Acido valproico y valproato sódico; Oxazolidinedionas; Benzodiazepinas. Fármaco Ácido valproico y Valproato sódico Oxazolidinediona s - Trimetadiona - parametadiona Mecanismo de acción Bloquea las descargas
Acido valproico y valproato sódico; Oxazolidinedionas; Benzodiazepinas. Fármaco Ácido valproico y Valproato sódico Oxazolidinediona s - Trimetadiona - parametadiona Mecanismo de acción Bloquea las descargas
CONTROVERSIAS HIPERTENSION PULMONAR
 CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
FENOBARBITAL 100mg Tabletas
 FENOBARBITAL 100mg Tabletas ANTIEPILÉPTICO COMPOSICIÓN: Cada comprimido contiene: Fenobarbital.100 mg Excipientes: Almidón de maíz, Lactosa Monohidratada, Polivinil Pirrolidona k-30, Estearato de Magnesio,
FENOBARBITAL 100mg Tabletas ANTIEPILÉPTICO COMPOSICIÓN: Cada comprimido contiene: Fenobarbital.100 mg Excipientes: Almidón de maíz, Lactosa Monohidratada, Polivinil Pirrolidona k-30, Estearato de Magnesio,
FICHA DE INFORMACIÓN AL PACIENTE: DIAZEPAM
 FICHA DE INFORMACIÓN AL PACIENTE: DIAZEPAM 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Ansiolítico con actividad hipnótica, anticonvulsivante, sedante, relajante muscular y amnésica. 1.2 Cómo actúa este
FICHA DE INFORMACIÓN AL PACIENTE: DIAZEPAM 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Ansiolítico con actividad hipnótica, anticonvulsivante, sedante, relajante muscular y amnésica. 1.2 Cómo actúa este
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CLORANFENICOL 250 mg/5 ml SUSPENSION ANTIINFECCIOSO Página 1 CLORANFENICOL 250 mg/5 ml Suspensión Principio Activo
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CLORANFENICOL 250 mg/5 ml SUSPENSION ANTIINFECCIOSO Página 1 CLORANFENICOL 250 mg/5 ml Suspensión Principio Activo
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
2012 GUIA DE USO DE MEDICAMENTOS EN EMBARAZO Y LACTANCIA. Sin riesgos aparentes No hay evidencia de riesgo fetal.pueden EMPLEARSE
 GUIA DE USO DE MEDICAMENTOS EN EMBARAZO Y CLASIFI FDA SEGÚN RIESGO EMBARAZO A Sin riesgos aparentes No hay evidencia de riesgo fetal.pueden EMPLEARSE B C D Sin riesgos aparentes No existen pruebas de riesgo
GUIA DE USO DE MEDICAMENTOS EN EMBARAZO Y CLASIFI FDA SEGÚN RIESGO EMBARAZO A Sin riesgos aparentes No hay evidencia de riesgo fetal.pueden EMPLEARSE B C D Sin riesgos aparentes No existen pruebas de riesgo
FICHA DE INFORMACIÓN AL PACIENTE: ALPRAZOLAM
 FICHA DE INFORMACIÓN AL PACIENTE: ALPRAZOLAM 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Ansiolítico con actividad hipnótica, anticonvulsivante, sedante, relajante muscular y amnésica. 1.2 Cómo actúa
FICHA DE INFORMACIÓN AL PACIENTE: ALPRAZOLAM 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Ansiolítico con actividad hipnótica, anticonvulsivante, sedante, relajante muscular y amnésica. 1.2 Cómo actúa
Es frecuente la infección crónica por el virus de hepatitis B (VHB)?
 HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
FICHA DE INFORMACIÓN AL PACIENTE: Ranitidina
 FICHA DE INFORMACIÓN AL PACIENTE: Ranitidina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antiúlcera péptica, antisecretor gástrico, antagonista de los receptores H2 de la histamina. 1.2 Cómo actúa este
FICHA DE INFORMACIÓN AL PACIENTE: Ranitidina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antiúlcera péptica, antisecretor gástrico, antagonista de los receptores H2 de la histamina. 1.2 Cómo actúa este
ENFOQUE DEL TRATAMIENTO CON ANTIEPILEPTICOS EN EL NIÑO
 ENFOQUE DEL TRATAMIENTO CON ANTIEPILEPTICOS EN EL NIÑO DRA. ALBIA J. POZO ALONSO Hospital Pediátrico Universitario William Soler ANTIEPILEPTICOS CLASICOS Fenobarbital 1912 Fenitoína 1938 Trimetadiona 1945
ENFOQUE DEL TRATAMIENTO CON ANTIEPILEPTICOS EN EL NIÑO DRA. ALBIA J. POZO ALONSO Hospital Pediátrico Universitario William Soler ANTIEPILEPTICOS CLASICOS Fenobarbital 1912 Fenitoína 1938 Trimetadiona 1945
TRAMADOL NORMON 100 mg/2 ml SOLUCION INYECTABLE EFG
 Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lección 36. Fármacos para el control de la secreción ácida gástrica UNIDAD IX: ALTERACIONES DIGESTIVAS
 Ricardo Brage e Isabel Trapero - Lección 36 UNIDAD IX: ALTERACIONES DIGESTIVAS Lección 36 Fármacos para el control de la secreción ácida gástrica Guión Ricardo Brage e Isabel Trapero - Lección 36 1. PRINCIPIOS
Ricardo Brage e Isabel Trapero - Lección 36 UNIDAD IX: ALTERACIONES DIGESTIVAS Lección 36 Fármacos para el control de la secreción ácida gástrica Guión Ricardo Brage e Isabel Trapero - Lección 36 1. PRINCIPIOS
Patricia Bravo José. Servicio de farmacia RMPD Burriana
 Patricia Bravo José Farmacéutica FH Farmacéutica FH Servicio de farmacia RMPD Burriana Los antipsicóticos se utilizan frecuentemente para tratar las alteraciones conductuales asociadas a la demencia.
Patricia Bravo José Farmacéutica FH Farmacéutica FH Servicio de farmacia RMPD Burriana Los antipsicóticos se utilizan frecuentemente para tratar las alteraciones conductuales asociadas a la demencia.
Principio activo / Dósis: Metoclopramida 0,2 % Linea de Desarrollo: Aparato Digestivo
 Principio activo / Dósis: Metoclopramida 0,2 % Linea de Desarrollo: Aparato Digestivo FÓRMULA: Metoclopramida (como clorhidrato) 100ml x 0,20 g. Amarillo de tartrazina como colorante c.s. 1 / 22 Metoclopramida
Principio activo / Dósis: Metoclopramida 0,2 % Linea de Desarrollo: Aparato Digestivo FÓRMULA: Metoclopramida (como clorhidrato) 100ml x 0,20 g. Amarillo de tartrazina como colorante c.s. 1 / 22 Metoclopramida
EPAMIN* (Fenitoina Sódica)
 EPAMIN* (Fenitoina Sódica) NOMBRE(S) COMERCIAL(ES) DEL PRODUCTO MEDICINAL Epamin Inyección COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La fenitoína sódica es un medicamento anticonvulsivante, relacionado con
EPAMIN* (Fenitoina Sódica) NOMBRE(S) COMERCIAL(ES) DEL PRODUCTO MEDICINAL Epamin Inyección COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La fenitoína sódica es un medicamento anticonvulsivante, relacionado con
TETRACICLINAS Y FENICOLES CLASIFICACION Y ESPECTRO
 CLASIFICACION Y ESPECTRO TETRACICLINAS: - DE ACCION CORTA: + CLORTETRACICLINA (AUREOMICINA): * FUE LA PRIMERA (1948). + OXITETRACICLINA. + TETRACICLINA. - DE ACCION LARGA: + MINOCICLINA. + DOXICICLINA.
CLASIFICACION Y ESPECTRO TETRACICLINAS: - DE ACCION CORTA: + CLORTETRACICLINA (AUREOMICINA): * FUE LA PRIMERA (1948). + OXITETRACICLINA. + TETRACICLINA. - DE ACCION LARGA: + MINOCICLINA. + DOXICICLINA.
INFORMACION PARA PRESCRIBIR REDUCIDA
 INFORMACION PARA PRESCRIBIR REDUCIDA 1. Nombre Comercial: NABRATIN 2. Nombre Genérico: CLOPIDOGREL 3. Forma Farmacéutica y Formulación: Tabletas. Cada tableta contiene: Bisulfato de Clopidogrel equivalente
INFORMACION PARA PRESCRIBIR REDUCIDA 1. Nombre Comercial: NABRATIN 2. Nombre Genérico: CLOPIDOGREL 3. Forma Farmacéutica y Formulación: Tabletas. Cada tableta contiene: Bisulfato de Clopidogrel equivalente
INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 3
 INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 3 En este tercer ejemplar del Boletín de Interferencias por Fármacos en pruebas clínicas, detallaremos
INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 3 En este tercer ejemplar del Boletín de Interferencias por Fármacos en pruebas clínicas, detallaremos
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
LLD Abreviado de XANAX
 LLD Abreviado de XANAX Versión: 8.0 Fecha: 12 Diciembre de 2013 Aprobación ARCSA: 3 de Mayo de 2014 1. Presentación: Cada tableta de liberación inmediata contiene XANAX 0.25 mg tabletas: Reg.San. 29637-02-11
LLD Abreviado de XANAX Versión: 8.0 Fecha: 12 Diciembre de 2013 Aprobación ARCSA: 3 de Mayo de 2014 1. Presentación: Cada tableta de liberación inmediata contiene XANAX 0.25 mg tabletas: Reg.San. 29637-02-11
6. Defunciones y tasas de la mortalidad perinatal según causa y sexo, por área de salud. Casos y tasas por nacidos vivos y muertos.
 6. Defunciones y tasas de la mortalidad perinatal según causa y sexo, por área de salud. Casos y tasas por 1.000 s 01-93. Todas las causas 47 3,7 20 3,0 27 4,3 XVI. 01-49. Afecciones originadas en el periodo
6. Defunciones y tasas de la mortalidad perinatal según causa y sexo, por área de salud. Casos y tasas por 1.000 s 01-93. Todas las causas 47 3,7 20 3,0 27 4,3 XVI. 01-49. Afecciones originadas en el periodo
EVALUACIÓN DEL TIEMPO DE MUESTREO DE LAS CONCENTRACIONES PLASMÁTICAS DE 2 FARMACOS ANTICONVULSIVANTES EN PACIENTES DE UN HOSPITAL PEDIATRICO.
 EVALUACIÓN DEL TIEMPO DE MUESTREO DE LAS CONCENTRACIONES PLASMÁTICAS DE 2 FARMACOS ANTICONVULSIVANTES EN PACIENTES DE UN HOSPITAL PEDIATRICO. Márquez Cruz Maribel 1, Robles Piedras Ana Luisa 1, Ruiz Anaya
EVALUACIÓN DEL TIEMPO DE MUESTREO DE LAS CONCENTRACIONES PLASMÁTICAS DE 2 FARMACOS ANTICONVULSIVANTES EN PACIENTES DE UN HOSPITAL PEDIATRICO. Márquez Cruz Maribel 1, Robles Piedras Ana Luisa 1, Ruiz Anaya
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.)
 Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.) Las dosis recomendadas son para pacientes adultos. Estas recomendaciones no deberían
Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.) Las dosis recomendadas son para pacientes adultos. Estas recomendaciones no deberían
PARACETAMOL 300 mg + CLORZOXAZONA 250 mg Tabletas
 PARACETAMOL 300 mg + CLORZOXAZONA 250 mg Tabletas PARACETAMOL 300 mg + CLORZOXAZONA 250 mg Tabletas Analgésico Relajante muscular COMPOSICION: Cada tableta contiene: Paracetamol...300.00 mg. Clorzoxazona...250.00
PARACETAMOL 300 mg + CLORZOXAZONA 250 mg Tabletas PARACETAMOL 300 mg + CLORZOXAZONA 250 mg Tabletas Analgésico Relajante muscular COMPOSICION: Cada tableta contiene: Paracetamol...300.00 mg. Clorzoxazona...250.00
7. Defunciones y tasas de la mortalidad fetal tardía según causa y sexo, por área de salud. Casos y tasas por nacidos vivos y muertos.
 s vivos y muertos. 01-93. Todas las causas 119 4,2 66 4,5 53 3,8 XVI. 01-49. Afecciones originadas en el periodo perinatal 112 3,9 64 4,4 48 3,4 01. Feto y recién afectados por condiciones de la madre
s vivos y muertos. 01-93. Todas las causas 119 4,2 66 4,5 53 3,8 XVI. 01-49. Afecciones originadas en el periodo perinatal 112 3,9 64 4,4 48 3,4 01. Feto y recién afectados por condiciones de la madre
N H S-CCDS-MK4117-MTL
 DESALEX 5 mg Tabletas Recubiertas DESALEX 5 mg Tabletas Orodispersables DESALEX 0,5 mg/ml Jarabe DESALEX 0,25 mg/ 0,5 ml Solución Gotas 1 DESCRIPCIÓN DEL PRODUCTO Desalex 5 mg tabletas recubiertas, Desalex
DESALEX 5 mg Tabletas Recubiertas DESALEX 5 mg Tabletas Orodispersables DESALEX 0,5 mg/ml Jarabe DESALEX 0,25 mg/ 0,5 ml Solución Gotas 1 DESCRIPCIÓN DEL PRODUCTO Desalex 5 mg tabletas recubiertas, Desalex
Antihiperkalémico - Antihipermagnesémico. Composición. Cada 10 ml de solución contiene: Gluconato de Calcio 1.0 g. Excipientes:
 Antihiperkalémico - Antihipermagnesémico. Composición Cada 10 ml de solución contiene: Gluconato de Calcio 1.0 g Excipientes: 1 / 21 Sacarato de calcio agua para inyectables c.s. Proporciona: Calcio 0.465
Antihiperkalémico - Antihipermagnesémico. Composición Cada 10 ml de solución contiene: Gluconato de Calcio 1.0 g Excipientes: 1 / 21 Sacarato de calcio agua para inyectables c.s. Proporciona: Calcio 0.465
Los comprimidos de Lamotrigina Normon 25 mg, 50 mg, 100 mg y 200 mg son de color blanco o casi blanco y de forma redonda.
 1. NOMBRE DEL MEDICAMENTO Lamotrigina Normon 25 mg comprimidos dispersables/masticables EFG Lamotrigina Normon 50 mg comprimidos dispersables/masticables EFG Lamotrigina Normon 100 mg comprimidos dispersables/masticables
1. NOMBRE DEL MEDICAMENTO Lamotrigina Normon 25 mg comprimidos dispersables/masticables EFG Lamotrigina Normon 50 mg comprimidos dispersables/masticables EFG Lamotrigina Normon 100 mg comprimidos dispersables/masticables
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TECNICA. (1) Equivalente a 185,2 mg de hidróxido de magnesio.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION Por 5 ml: Principios activos: Gel de hidróxido alumínico... 350 mg Hidróxido magnésico... 20 mg Por comprimido: Principio activo: Hidróxido alumínico...
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION Por 5 ml: Principios activos: Gel de hidróxido alumínico... 350 mg Hidróxido magnésico... 20 mg Por comprimido: Principio activo: Hidróxido alumínico...
NUTRICION PARENTERAL DEL RECIEN NACIDO. Dra. Reina Valdés Armenteros Hospital América Arias
 NUTRICION PARENTERAL DEL RECIEN Dra. Reina Valdés Armenteros Hospital América Arias PRINCIPIOS EN LA NUTRICIÓN DEL RECIÉN No debe suprimirse el aporte de nutrientes al nacimiento. Proteínas y energía son
NUTRICION PARENTERAL DEL RECIEN Dra. Reina Valdés Armenteros Hospital América Arias PRINCIPIOS EN LA NUTRICIÓN DEL RECIÉN No debe suprimirse el aporte de nutrientes al nacimiento. Proteínas y energía son
FOLLETO DE INFORMACIÓN AL PACIENTE
 FOLLETO DE INFORMACIÓN AL PACIENTE NIMESULIDA Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
FOLLETO DE INFORMACIÓN AL PACIENTE NIMESULIDA Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier
GELOCATIL 650 mg Comprimidos Paracetamol
 GELOCATIL 650 mg Comprimidos Paracetamol Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante, para obtener los
GELOCATIL 650 mg Comprimidos Paracetamol Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante, para obtener los
SULFAMIDAS CONCEPTO Y CLASIFICACION
 SULFAMIDAS CONCEPTO Y CLASIFICACION CONCEPTO: NH2 SO2 NH2 PARA-AMINO-BENCENO-SULFONAMIDA SULFANILAMIDA CLASIFICACION: + PARA INFECCIONES SISTEMICAS: - SULFAMETIZOL (SOLO INF. URINARIAS) - SULFAMETOXAZOL
SULFAMIDAS CONCEPTO Y CLASIFICACION CONCEPTO: NH2 SO2 NH2 PARA-AMINO-BENCENO-SULFONAMIDA SULFANILAMIDA CLASIFICACION: + PARA INFECCIONES SISTEMICAS: - SULFAMETIZOL (SOLO INF. URINARIAS) - SULFAMETOXAZOL
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
Prospecto: información para el usuario. Termalgin 500 mg comprimidos Paracetamol
 Prospecto: información para el usuario Termalgin 500 mg comprimidos Paracetamol Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
Prospecto: información para el usuario Termalgin 500 mg comprimidos Paracetamol Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
LABORATORIOS NORMON, S.A.
 1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
FOLLETO DE INFORMACIÓN AL PACIENTE
 FOLLETO DE INFORMACIÓN AL PACIENTE NISULID Nimesulida Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene
FOLLETO DE INFORMACIÓN AL PACIENTE NISULID Nimesulida Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
MUJER MADUREZ Y ENVEJECIMIENTO USO Y ABUSO DE MEDICAMENTOS. Dra. Verónica Acevedo Pastora. Médico Toxicóloga. Nicaragua.
 MUJER MADUREZ Y ENVEJECIMIENTO USO Y ABUSO DE MEDICAMENTOS Dra. Verónica Acevedo Pastora. Médico Toxicóloga. Nicaragua. USO DE MEDICAMENTOS AINES Acetaminofén IECA Enalapril Captopril Analgésicos HTA BLOQUEADORES
MUJER MADUREZ Y ENVEJECIMIENTO USO Y ABUSO DE MEDICAMENTOS Dra. Verónica Acevedo Pastora. Médico Toxicóloga. Nicaragua. USO DE MEDICAMENTOS AINES Acetaminofén IECA Enalapril Captopril Analgésicos HTA BLOQUEADORES
REHABILITACIÓN EN NEONATOLOGÍA ALTO RIESGO NEUROLÓGICO. Angélica Duque Villalobos Medico Fisiatra Fundación Clínica Valle Del Lili
 REHABILITACIÓN EN NEONATOLOGÍA ALTO RIESGO NEUROLÓGICO Angélica Duque Villalobos Medico Fisiatra Fundación Clínica Valle Del Lili NEURODESARROLLO Serie de mecanismos que involucran los procesos biológicos
REHABILITACIÓN EN NEONATOLOGÍA ALTO RIESGO NEUROLÓGICO Angélica Duque Villalobos Medico Fisiatra Fundación Clínica Valle Del Lili NEURODESARROLLO Serie de mecanismos que involucran los procesos biológicos
Cuando tratar la epilepsia: (a) Manejo de la primera crisis (b) Uso racional de la monoterapia y politerapia
 Página1 Cuando tratar la epilepsia: (a) Manejo de la primera crisis (b) Uso racional de la monoterapia y politerapia Profesor: Dr. Sebastián Espinosa Neurólogo Revisión: Dr. Jorge Pesantes Presidente de
Página1 Cuando tratar la epilepsia: (a) Manejo de la primera crisis (b) Uso racional de la monoterapia y politerapia Profesor: Dr. Sebastián Espinosa Neurólogo Revisión: Dr. Jorge Pesantes Presidente de
Reacciones Adversas de los Fármacos
 Reacciones Adversas de los Fármacos -Talidomida se administró a embarazadas, con el fin de disminuir los efectos propios del embarazo(náuseas, vómitos). Primero se probó en animales y cuando se usó en
Reacciones Adversas de los Fármacos -Talidomida se administró a embarazadas, con el fin de disminuir los efectos propios del embarazo(náuseas, vómitos). Primero se probó en animales y cuando se usó en
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
THIPENTHAL. TIOPENTAL SÓDICO 1 g INYECTABLE. VENTA BAJO RECETA ARCHIVADA (Lista III) FÓRMULA CUALI Y CUANTITATIVA. Cada frasco ampolla contiene:
 THIPENTHAL TIOPENTALSÓDICO1g INYECTABLE VENTABAJORECETAARCHIVADA(ListaIII) FÓRMULACUALIYCUANTITATIVA Cadafrascoampollacontiene: Tiopentalsódicoestéril 1g ACCIÓNTERAPÉUTICA: Anestésicogeneral,barbitúrico.CódigoATC:N01AF03.
THIPENTHAL TIOPENTALSÓDICO1g INYECTABLE VENTABAJORECETAARCHIVADA(ListaIII) FÓRMULACUALIYCUANTITATIVA Cadafrascoampollacontiene: Tiopentalsódicoestéril 1g ACCIÓNTERAPÉUTICA: Anestésicogeneral,barbitúrico.CódigoATC:N01AF03.
