Trabajo Fin de Máster
|
|
|
- Virginia Macías Méndez
- hace 6 años
- Vistas:
Transcripción
1 MÁSTER EN CIENCIAS ANALíTICAS Y BIOANALíTICAS Trabajo Fin de Máster El uso de distintas matrices de MALDI-MS para el análisis de proteínas intactas y su comparación con ESI-MS Francisco Javier Alonso García Mayo 214, Oviedo 1
2 Departamento de Química Física y Analítica JÖRG BETTMER, Profesor Contratado Doctor del Departamento de Química Física y Analítica de la Facultad de Química de la Universidad de Oviedo, CERTIFICA: Que el presente trabajo titulado El uso de distintas matrices de MALDI-MS para el análisis de proteínas intactas y su comparación con ESI-MS ha sido realizado por el Licenciado Francisco Javier Alonso García en el Departamento de Química Física y Analítica de la Universidad de Oviedo bajo su dirección, constituyendo el Trabajo de Fin de Máster del interesado, cuya presentación autorizo. Oviedo, Mayo 214 Fdo. Jörg Bettmer 2
3 1. Índice. 3
4 [Índice] 1. Índice Introducción Introducción a las proteínas La espectrometría de masas para el análisis de proteínas MALDI-MS ESI-MS Proteínas empleadas Objetivos Experimental Instrumentación MALDI-TOF ESI-q-TOF Materiales y reactivos Preparación de las muestras Parámetros de los equipos Resultados y discusión Detección de proteínas con espectrometría de masas molecular Superóxido Dismutasa SOD con MALDI
5 [Índice] SOD con ESI Insulina Insulina con MALDI Insulina con ESI Citocromo C Citocromo C con MALDI Citocromo C con ESI Hemoglobina Hemoglobina con MALDI Hemoglobina con ESI Conclusiones Bibliografía
6 2. Introducción 6
7 [Introducción] 2.1) Introducción a las proteínas. Las proteínas son sustancias orgánicas nitrogenadas complejas que se hallan en las células de animales y vegetales. Son compuestos poliméricos en los que las unidades monoméricas se denominan aminoácidos. En el código genético existen 22 aminoácidos que forman codones que forman parte de las proteínas. De estos 22 aminoácidos, 7 son aminoácidos esenciales (Valina, Leucina, Treonina, Lisina, Triptófano, Histidina, Fenilalanina, Isoleucina, Arginina y Metionina). Que un aminoácido sea esencial quiere decir que han de ser captados por los seres vivos a través de la dieta. La carencia de estos aminoácidos en la dieta limita el desarrollo de los organismos. Las proteínas se pliegan en una notable diversidad de formas tridimensionales, que proporcionan las diferentes funciones que pueden tener. Algunas proteínas se unen al DNA y regulan la expresión de los genes; otras participan en procesos de replicación, de transcripción y traducción de la información genética; otras están relacionadas con el sistema inmunitario; con la contracción muscular; con el transporte de sustancias en el torrente sanguíneo y la respiración celular. Las proteínas son las moléculas orgánicas más abundantes en las células (comprenden más del 5% del peso seco de la célula. Además de los elementos comunes a todas ellas (C, H, O, N) pueden contener otros elementos químicos como S, P, Fe, Zn o Cu. [1] Las proteínas son componentes esenciales de todas las células vivas. Su misión en el organismo se puede clasificar en dos grandes grupos: - Tipo estructural: formando parte del propio organismo. - Tipo funcional. Las características generales para todas las proteínas son: - El peso molecular de casi todas las proteínas varía entre 5 Da y varios millones de Da. - Los aminoácidos que constituyen las proteínas son 2, que se unen entre sí por medio de enlaces peptídicos. En la figura 1, se observa una representación esquemática de la reacción de formación de un enlace peptídico entre dos aminoácidos. 7
8 [Introducción] Aminoácido (1) Aminoácido (2). ENLACE PEPTÍDICO Dipéptido Agua Agua Figura 1. Reacción de formación del enlace peptídico. - La conformación de las proteínas se mantiene por fuerzas débiles (tipo puentes disulfuro, enlaces por puentes de hidrógeno ); por ello, se altera fácilmente por ligeros cambios de ph, de temperatura o por diferentes disolventes. - La hidrólisis parcial de una proteína, realizada mediante ácidos, bases o enzimas conduce a la obtención de moléculas más pequeñas (péptidos). En caso de que se produzca la hidrólisis total se obtienen los aminoácidos que la componen.[3] Las proteínas presentan, en su gran mayoría, cuatro niveles diferentes de organización tridimensional. - Estructura primaria: es la consecuencia de la secuencia y ordenamiento de los aminoácidos. - Estructura secundaria: se refiere a la estructura que adopta espacialmente una parte de la proteína. Es consecuencia de las interacciones por puentes de hidrógeno. Esta estructura hace que las proteínas adquieran estabilidad. Los dos tipos de estructuras más frecuentes son: 1) Hélice α: la cadena adopta una conformación helicoidal con los grupos R de los aminoácidos orientados hacia afuera. En la formación de esta estructura se une el grupo 8
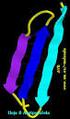
9 [Introducción] carboxilo del aminoácido n con el grupo amino del aminoácido n+4. Se produce un número máximo de interacciones lo que hace que sea una estructura muy estable. 2) Hojas plegadas β: en este caso, la cadena queda estirada y la estructura se dispone en zig - zag espacialmente, formando las láminas. Puede darse esta conformación de forma paralela o antiparalela. Los grupos R se disponen hacia adentro o hacia afuera de forma alternada. Esta conformación se estabiliza por puentes de hidrógeno entre el grupo carboxilo del aminoácido n y el grupo amino del aminoácido n+3. Las regiones de las proteínas que tienen una estructura secundaria definida se llaman dominios. - Estructura terciaria: es la forma en que la cadena polipeptídica se curva o se pliega para formar la estructura estrechamente plegada y compacta de las proteínas globulares. La estructura terciaria define las interacciones entre los diferentes dominios que forman la proteína. La estructura terciaria es específica de cada proteína y determina su función. En función de su estructura terciaria, las proteínas se pueden clasificar como: Proteínas fibrosas: las proteínas fibrosas se hallan constituidas por cadenas polipeptídicas ordenadas de modo paralelo a lo largo de un eje, formando fibras o láminas largas. Algunos ejemplos de este tipo son colágeno, α-queratina o la elastina. Proteínas globulares: están constituidas por cadenas polipéptidicas plegadas estrechamente de modo que adoptan formas esféricas o globulares compactas. Algunos ejemplos son: ferritina o albúmina. [4] Es importante tener en cuenta que la pérdida de la estructura terciaria implica la pérdida de la función de la proteína. Este proceso se denomina desnaturalización [5]. - Estructura cuaternaria: la estructura cuaternaria solo la tienen las proteínas que poseen más de una cadena polipeptídica, es decir, las proteínas oligoméricas. La estructura cuaternaria debe considerar: 9
10 [Introducción] 1) El número y la naturaleza de las distintas subunidades y monómeros que integran el oligómero. 2) La forman en que se asocian los monómeros en el espacio. Un ejemplo de proteína con estructura cuaternaria es la hemoglobina [6]. Figura 2. Hemoglobina. En la figura 2 se puede observra la estructura cuaternaria de la hemoglobina. En ella se distinguen las dos cadenas α (amarillo) y las dos cadenas β (azul), así como los grupos hemo asociados a cada cadena donde se encuentran los átomos de Fe que tiene dicha proteína. En párrafos anteriores se dijo que la estructura terciaria es la que determina la función de las proteínas. Las funciones más importantes que llevan a cabo éstas en los organismos vivos son: - Función defensiva: son las encargadas de crear los anticuerpos y regulan factores contra agentes extraños e infecciones. - Función reguladora: algunas proteínas sirven para regular la división celular y otras regulan la expresión de ciertos genes. - Función enzimática: actúan como biocatalizadores acelerando las reacciones químicas del metabolismo. - Función amortiguadora: mantienen el ph y el equilibrio osmótico en diversos medios. Se conoce también como función homeostática de las proteínas. - Función contráctil: es la responsable de la contracción de los músculos. 1
11 [Introducción] - Función estructural: es de gran importancia. Las proteínas forman tejidos de sostén y relleno que confieren elasticidad y resistencia a órganos y tejidos. Son las proteínas que forman la estructura del organismo. - Función energética: algunas proteínas tienen una función de reserva energética. - Función de transporte: Normalmente, suelen transportar oxígeno, electrones o lipoproteínas [7]. 2.2) La espectrometría de masas para el análisis de proteínas. La multitud de funciones que desarrollan y en las que participan las proteínas hacen que sean unas biomoléculas muy importantes para la vida. Por lo tanto, son unos compuestos ampliamente estudiados en el mundo científico. Tanto para la química analítica como para la bioquímica y la biología son muy importantes las técnicas de espectrometría de masas molecular. Las dos técnicas más importantes de espectrometría de masas molecular en el estudio de las proteínas son MALDI-MS y ESI-MS: 2.2.1) MALDI-MS. Las espectrometría de masas MALDI (Matrix-Assisted Laser Desorption and Ionization) es una técnica ampliamente empleada para transferir moléculas grandes o no volátiles a fase gas como iones observables en espectrometría de masas. Esta fuente de ionización suave puede usarse acoplada a analizadores de iones como el TOF (tiempo de vuelo) o analizadores de trampa de iones. La técnica es muy empleada en la caracterización de biomoléculas, polímeros, productos naturales y moléculas orgánicas e inorgánicas [8]. En las medidas por MALDI, la muestra se debe mezclar con una matriz adecuada y, conjuntamente, la mezcla se dejará secar y cristalizar antes de comenzar con las medidas. Las funciones principales de las matrices del MALDI son la de absorber parte de la radiación que proviene de la fuente láser y ayudar al analito a adquirir la carga correspondiente para poder ser 11
12 [Introducción] medido en el analizador de masas. Las características más generales que tiene que cumplir cualquier matriz de MALDI son: 1. Las matrices de MALDI deben ser capaces de absorber radiación a las longitudes de onda de la fuente láser con la que se trabaja. 2. Debe de ser soluble en las condiciones en las que se trabaja. 3. Debería de producir pocas reacciones secundarias con la muestra y, si las produce, que sean conocidas (formación de aductos). 4. Tienen que ser sustancias que no sublimen cuando están sometidas al alto vacío de la cámara láser. 5. Deben tener las propiedades químicas adecuadas para ayudar al analito a ionizarse correctamente, es muy importante que sean sustancias con grupos ácidos para cargar los analitos positivamente. 6. Debe de ser una sustancia que se fragmente poco en contacto con la radiación del láser. Esto es necesario para evitar reacciones secundarias o formación de aductos con el analito [9]. Una vez hecha la mezcla entre el analito y la matriz en las proporciones adecuadas y, sobre todo, en los disolventes adecuados, se coloca la cantidad necesaria de la mezcla sobre el soporte adecuado y se deja cocristalizar. Esta mezcla es sometida a pulsos cortos de radiación láser a alto vacío produciéndose la volatilización de la misma al producirse la absorción de la energía. Esta energía que ha sido absorbida por la mezcla se convierte en energía de excitación y facilita la transferencia de protones desde la matriz al analito produciéndose la ionización: MH + + A M + AH + Esta área que irradia el láser se calienta haciendo que se produzca la desorción y la sublimación de los iones. Los iones en fase gas se transfieren al analizador de masas, donde son separados en función de su relación m/z antes de llegar al detector. El analizador de masas que más se utiliza junto con la ionización por MALDI es el TOF (analizador de masas por tiempo de vuelo) [9]. Esto se debe a que la fuente de iones (el láser) es una fuente pulsada por lo que, es necesario acoplar como analizador de masas una que sea capaz de 12
13 [Introducción] detectar los pulsos correctamente y que los iones entre un pulso y otro no se mezclen entre sí produciendo errores en la medida. Las características más importantes que tienen los equipos de ionización por MALDI son: 1. Es una técnica de medida muy robusta. 2. Son equipos con una sencillez de manejo muy importante. 3. Permiten hacer medidas en un amplio rango de masas. 4. Tienen capacidad de automatización del trabajo. 5. Se pueden acoplar a otros analizadores de masas con el objetivo de aumentar la sensibilidad y la resolución de las medidas (IT, FTICR, instrumentación MS/MS) [1], [11]. Muestra co-cristalizada con matriz en placa Láser de luz pulsado (UV o IR) Iones del analito Hacia el analizador de masas Iones de la matriz Rejilla de extracción Lentes de enfoque Figura 3. Esquema de la desorción e ionización por MALDI. El mecanismo de ionización del MALDI es una de las mayores incógnitas que presenta la técnica ya que no se conoce el mecanismo por completo pero, si que se sabe que, la matriz tiene tres funciones muy importantes: 1) El exceso de matriz sirve para aislar el analito con el objetivo de que las interacciones intramoleculares sean mínimas. 2) La absorción de la radiación procedente del láser genera el transporte del analito y la matriz a la fase gaseosa. 13
14 [Introducción] 3) La matriz es esencial para que se produzca la ionización de las moléculas de analito. La formación de iones es un proceso altamente exotérmico. En las medidas en modo positivo, las cargas positivas de los analitos provienen de cationes que son cedidos por la matriz en el momento de formación de la pluma donde se mezcla matriz y analitos. A pesar de no estar muy claro el mecanismo de ionización, este es el más aceptado [12] y [13] ) ESI-MS La espectrometría de masas por ionización por electrospray (ESI-MS) es una técnica que es capaz de analizar moléculas de amplio rango de masas moleculares con una sensibilidad por debajo de los picomoles y con una buena exactitud de masas (en el rango del.1 -.2%). Esta técnica es muy utilizada para analizar péptidos, proteínas, carbohidratos, oligonucleótidos, biopolímeros y muestras de origen biológico. ESI es una técnica de ionización a presión atmosférica: la muestra debería estar disuelta en un disolvente adecuado para introducirla al equipo mediante una bomba de cromatografía de líquidos o la de jeringa mediante un tubo capilar de acero inoxidable. Muestra en solución,5-5, µl min -1 Jeringa o LC Capilar metálico (1µm i.d.) Gotas de disolvente/analito (aerosol) Conos de extracción skimmer Hacia el analizador de masas Flujo de N 2 PRESIÓN ATMOSFÉRICA Cono BOMBA DE VACÍO INCREMENTO DE LA DENSIDAD DE CARGA Cono (contraelectrodo) Aguja del capilar Gota múltiplemente cargada Evaporación del disolvente Explosión de Coulomb Moléculas de analito Gota múltiplemente cargada Iones de analito + Ve Suministro - Ve eléctrico Figura 4. Esquema de la ionización por ESI. 14
15 [Introducción] La punta de este capilar se somete a un alto potencial (2-6 kv) con respecto a un contraelectrodo cilíndrico que rodea la entrada al analizador de masas justo antes del primer cono de extracción de iones (skimmer). Debido a esta diferencia de potencial se produce un fino aerosol en forma de cono a presión atmosférica que se compone de pequeñas gotas del analito fuertemente cargado, esto es lo que se denomina cono de Taylor [14]. Para ayudar a la nebulización del analito y a la evaporación del disolvente se suele usar un gas inerte (típicamente N 2 ). Durante el transporte desde la región a presión atmosférica hacia el analizador de masas a alto vacío las gotas del aerosol van disminuyendo de tamaño debido a la alta tensión electrostática que se genera en el interior de la gota. Este proceso se denomina explosión de Coulomb. Dicho proceso se repite hasta que las gotas adquieren un tamaño en el rango de los micrómetros y estén ausentes de disolvente. En el siguiente paso, los iones completamente desolvatados y cargados con una o múltiples cargas se aceleran por campos eléctricos hasta que entran al analizador de masas. Existen dos teorías para la formación de los iones en el electrospray pero el mecanismo real es aún desconocido [15]-[18]. En los análisis por ESI, las muestras se diluyen en una proporción 1:1 en un disolvente orgánico (típicamente, acetonitrilo o metanol) con una proporción menor del 1% de un ácido (ácido fórmico o ácido trifluoroacético) en el caso de querer hacer medidas en modo positivo o en una base diluida en el caso de trabajar en modo negativo (Hidróxido de amonio). Es muy importante tener en cuenta que altas concentraciones de sales, de reactivos que formen pares iónicos, disoluciones reguladoras, agentes reductores o detergentes pueden hacer que la detección de los analitos se suprima. Por lo tanto, es muy importante que a las muestras que se desean analizar mediante esta técnica se les haga un pretratamiento de limpieza que asegure que todos estos agentes se eliminen en una proporción importante [19]. Los equipos de ESI trabajan a unos flujos entre 2-2 µl/min, tanto en infusión directa como acoplados a equipos de cromatografía de líquidos. Según la teoría de las multicargas descrita por Fenn [15], las moléculas orgánicas pueden adquirir tantas cargas como hidrógenos ácidos posea. Por este motivo, las proteínas con pesos moleculares entre 1-1 kda pueden generar iones con valores de m/z por debajo 15
16 [Introducción] de 4 Da y, por ello, se puede utilizar el ESI con un cuadrupolo (rango de masas por debajo de m/z 4 Da) como herramienta para el estudio de este tipo de compuestos. Al igual que en el caso de la técnica descrita con anterioridad, el ESI puede acoplarse a diferentes analizadores de masas como la trampa iónica (IT), el tiempo de vuelo (TOF) o como un espectrómetro ciclotrónico de iones con transformada de Fourier (FTICR). Se ha dicho antes que el ESI es una fuente de ionización suave y a presión atmosférica por lo que permite analizar y caracterizar complejos biomoleculares con interacciones débiles sin carácter covalente [2]. 2.3) Proteínas empleadas. En este trabajo Fin de Máster se trabajó con 4 compuestos diferentes: i. Superóxido dismutasa: es una enzima con un peso molecular en torno a 32 kda que está implicada en la defensa de los organismos frente a la toxicidad potencial de O 2. La reacción que cataliza es: - - O 2 + O H + 2 H 2 O 2 + O 2 [17] ii. Insulina: es una enzima de 51 aminoácidos con dos cadenas con un peso molecular de ~ 6 kda que actúa como una hormona encargada de la regulación de la captación y el almacenamiento de la glucosa [17]. Las dos cadenas de la insulina se denominan cadena α y cadena β y se unen entre sí por puentes disulfuro [21], [22]. iii. iv. Citocromo C: es una proteína de pequeño tamaño (~ 12.5 kda) involucrada en el transporte electrónico mitocondrial. Es una proteína monomérica que tiene como grupo prostético un grupo hemo C con un átomo de hierro coordinado [23]. Hemoglobina: es una hemoproteína de los glóbulos rojos de mamíferos y otros animales que es responsable del transporte y almacenamiento de oxígeno. Es una proteína tetramérica con dos cadenas α y dos cadenas β que tiene una masa molecular aproximada de 63 kda y un peso en cada cadena de 15 kda. 16
17 3. Objetivos. 17
18 [Objetivos] Por todo lo expuesto anteriormente es muy importante que las técnicas de detección y/o cuantificación de proteínas estén muy optimizadas. En este trabajo Fin de Máster se trabajó con las dos técnicas de espectrometría de masas más empleadas en el análisis de proteínas (MALDI y ESI). El trabajo llevado a cabo se dividió, a su vez, en dos objetivos parciales principales: 1) Evaluación de la novedosa matriz de MALDI, 2- nitrophluoroglucinol (NPG) y comparación de los resultados obtenidos con esta nueva matriz y las matrices más típicamente utilizadas en espectrometría de MALDI. 2) Comparativa de los resultados obtenidos con las dos técnicas de espectrometría de masas molecular más empleadas en proteómica (MALDI y ESI). 18
19 4. Experimental. 19
20 [Experimental] 4.1 Instrumentación MALDI - TOF. El equipo de espectrometría de masas que se utilizó fue el modelo Voyager - DE TM STR Biospectrometry TM Workstation de Applied Biosystems (Langen, Alemania). Figura 5. Representación esquemática del equipo MALDI - TOF. Este equipo de MALDI viene provisto de un láser pulsado de N 2 (337 nm). Una característica muy importante que presenta es el sistema de extracción retardada de los iones. Esto hace que los iones se concentren todos a la entrada del TOF y en el momento en que se aplique el potencial de aceleración todos los iones lo reciban en el mismo momento y adquieran la misma energía cinética. Con esto se consiguen unos espectros de masas con señales más estrechas y una mejor resolución de masas. Como se observa en la figura 5, el equipo tiene como analizador de masas un tubo de vuelo. Este equipo puede trabajar en modo lineal o en modo reflectrón ya que dispone de dos detectores diferentes ESI - q - TOF. El equipo de electrospray utilizado en este trabajo Fin de Máster es el modelo QStar XL de Applied Biosystems (Langen, Alemania). Este instrumento utiliza N 2 como gas de nebulización y tiene una celda de 2
21 [Experimental] colisión de alta presión. En la figura 6 se muestra un esquema del equipo de ESI utilizado: Figura 6. Representación esquemática del equipo ESI - q - TOF. En este trabajo Fin de Máster se introdujo la muestra en el modo de infusión directa. Por ello, se introdujeron flujos muy bajos de muestra (entre.5-1 µl/min) empleando el dispositivo con bomba de jeringa que tiene el equipo. Posteriormente, se aplica un flujo elevado de gas de nebulización (N 2 ) y una diferencia de potencial que va entre kv. Los iones después de ser generados pasan a la interfase de vacío que es la encargada de separar la fuente de electrospray (a presión atmosférica) de la cámara de alto vacío. Su función es que se produzca una transferencia de iones al espectrómetro de masas de manera que se evite la entrada del resto de la muestra, del disolvente y de moléculas de aire. Con este motivo, se utiliza una cortina de gas N 2. La cámara de vacío se divide en dos zonas diferentes, la primera de ellas a una presión de 1x1-2 torr que es donde está el primer cuadrupolo (Q ) que actúa como guía de iones. La segunda zona de alto vacío (1x1-6 torr) contiene el segundo cuadrupolo que funciona como lente de iones o como filtro de masas cuadrupolar (Q 1 ) y por último tiene un tercer cuadrupolo (Q 2 ) que actúa como celda de colisión de alta presión. Después de esta zona, se encuentra el TOF (tiempo de vuelo) con una presión de 7x1-7 torr. La última parte del equipo es un detector de iones tipo Channel Electron Multiplier (CEM). 21
22 4.2 Materiales y reactivos. [Experimental] - Disoluciones patrón de los compuestos utilizados en el trabajo Fin de Máster (insulina humana, superóxido dismutasa de eritrocitos humanos, Citocromo C y hemoglobina humana) de Sigma. Todas los analitos de este trabajo Fin de Máster están en una concentración de 1 mg/ml (1 ppm). - ZipTip Pipette tips for simple preparation C 18 (Millipore, Bredford, MA, USA), utilizados para la limpieza de las sales de las disoluciones de patrones de proteínas. - Ácido nítrico ultrapuro obtenido mediante destilación lenta sub-boiling de ácido nítrico concentrado al 65 % (p/v) de calidad pro-análisis de Merck (Darmstadt, Alemania). Este ácido se utilizó en la limpieza del material de plástico y de vidrio. - Acetonitrilo de calidad HPLC de Fisher Scientific (Hampton, New Hampshire, USA). - Ácido fórmico (grado analítico 98%) de Merck (Darmstadt, Alemania). - Disolución de renina de Applied Biosystems (Langen, Alemania) con una concentración de 1 pmol/µl para la calibración externa del analizador de tiempo de vuelo del ESI - q - TOF - MS nitrophloroglucinol, 98% de Alpha Aesar (Karlsruhe, Germany) como matriz de MALDI novedosa. - Ácido sinapínico Ultra Pure, matrix substance for MALDI - MS, >99.5% de Sigma (St Louis, USA) para las moléculas con un peso molecular superior a 1 kda. - Ácido α-ciano-4-hidroxicinámico adecuado para MALDI-TOF MS de Sigma (St Louis, USA), para los compuestos de menos de 1 kda. - Ácido trifluoroacético de pureza 99% de Sigma (St Louis, USA) para acidificar las disoluciones de matrices de MALDI. 22
23 [Experimental] 4.3 Preparación de las muestras. En la primera parte se habla de las medidas que se realizaron con el equipo de espectrometría de masas MALDI - TOF. Lo primero que hay que tener en cuenta al empezar con el trabajo es que en la preparación de muestras para el MALDI, la mezcla de la disolución de analito con las matrices ha de cumplir la siguiente relación: Las disoluciones de patrones de proteínas tienen que estar en una concentración entre.1-1 pmol/µl. En el caso de todas las proteínas que se utilizaron para las medidas con el MALDI-TOF, se disolvieron en una concentración de 1 mg/ml. Para ello, se pesó 1 mg dentro de un tubo de microcentrífuga de 1.5 ml y se les añadió 1 ml de agua ultrapura. Con esta concentración inicial, una vez realizada la mezcla con la disolución de matriz en una proporción 1:1, se cumple la relación mostrada con anterioridad. Para facilitar la disolución homogénea del patrón de proteína se introduce durante 5 min en el baño de ultrasonidos. En el caso de las matrices, cada una de ellas lleva un tratamiento diferente ya que la solubilidad no es igual en los tres casos: - Ácido sinapínico (SA). El ácido sinapínico (Figura 7) o ácido 3,5-dimetoxi-4-hidroxicinámico es el compuesto más utilizado como matriz para las medidas con proteínas con un peso molecular superior a los 1 kda. Es un compuesto orgánico con un peso molecular de g/mol. Figura 7. Estructura del ácido sinapínico. El ácido sinapínico es una molécula orgánica con un carácter ácido debido al grupo carboxilo terminal. La presencia de grupos que puedan 23
24 [Experimental] ser cargados positivamente es una de las características principales y común a todas ellas de las matrices utilizadas en el MALDI. La disolución saturada de la matriz de ácido sinapínico se preparó pesando 5 mg de ácido sinapínico y disolviéndolo en 1 ml de una mezcla de ACN:H 2 O en una proporción 3:7 con un.1% de ácido trifluoroacético (TFA). - Ácido α-ciano-4-hidroxicinámico (CHCA). Este compuesto tiene un peso molecular de g/mol (Figura 8) y que se utiliza como la matriz adecuada para el análisis de compuestos con un peso molecular por debajo de 1 kda. Figura 8. Estructura del CHCA Para la preparación de esta matriz se pesó 5 mg de la matriz en un tubo de microcentrifuga y se añadió una mezcla ACN:H 2 O en una proporción 5:5 con un.1 % de TFA. - 2-nitrophloroglucinol (NPG). El NPG es la matriz novedosa que se estudió en este trabajo Fin de Máster. Tiene un peso molecular de g/mol. A diferencia de las matrices típicas, esta es capaz de producir iones con más de una o de dos cargas [24]. Figura 9. Estructura del NPG. 24
25 [Experimental] Se puede observar en la figura 9 que, a diferencia de las otras dos matrices utilizadas y representadas, el NPG no tiene un ácido carboxílico en su estructura y sí tres grupos hidroxilo. Esta es una de las características que lo diferencia del resto de matrices comunes utilizadas en MALDI. Para la preparación de esta matriz, se pesan en un tubo de microcentrifuga 5 mg de la matriz y se le añade una mezcla ACN:H 2 O en una proporción 5:5 con un.1% de TFA. Una vez realizadas las dos disoluciones necesarias para las medidas del MALDI, se mezclan ambas en la proporción adecuada (1:1). La mezcla de la disolución de proteína y de la matriz se homogeneíza bien con ayuda del vortex y se coloca en el soporte adecuado para el equipo MALDI-TOF. Figura 1. Placa portamuestras de MALDI. En cada uno de los pocillos para colocar las muestras se puede poner entre 1-2 µl de la mezcla de matriz:proteína. Cada vez que se preparó la placa con muestras se puso cada una de las mezclas en tres pocillos diferentes ya que, el depositado de la gota y las condiciones de cristalización son parámetros básicos que influyen en la obtención de buenos resultados. Para colocar las muestras en los pocillos de la placa se utiliza una micropipeta con un rango de volúmenes entre.5 y 1 µl. Es muy importante que no se toque con la punta de la micropipeta en la placa ya que dejarían un rastro y la cristalización no sería homogénea. Es importante que antes de comenzar las medidas, la mezcla esté perfectamente cristalizada sobre la superficie de la placa portamuestras. Si no es así, se podría contaminar y ensuciar la cámara del láser del MALDI provocando un peor funcionamiento del equipo. En la preparación de los analitos para el ESI, siempre se trabajó del mismo modo para todos ellos. Se hacen disoluciones de 1 mg/ml de las 25
26 [Experimental] proteínas en ACN:H 2 O en una proporción 5:5 con un.1% de ácido fórmico. Debido a las complicaciones que presenta el ESI con la formación de sales en los capilares, estas muestras antes de ser llevadas al equipo para realizarles las medidas se les hace un tratamiento con ZipTip para eliminarles la mayor cantidad de las sales que tengan. El protocolo de trabajo con los ZipTip es el siguiente: i. Se homogeneíza el tip con una disolución 1% de ACN previamente filtrada con filtros de.22 µm. ii. Se pasa por el tip unas gotas de una disolución de agua con un.1% de TFA. Con esto se consigue equilibrar el cartucho de C 18. iii. A la muestra se le añade la cantidad necesaria de TFA para tener un.1%. iv. Se aspira el volumen de muestra 1 veces con una micropipeta. v. Se limpia el C 18 con una mezcla que tenga un 5% de metanol y un.1% TFA en agua. Con esto se eliminan de forma más eficiente las sales. vi. Se aspira 5 veces 1 µl de ACN con.1% FA y se recoge lo que se deja salir del tip en un tubo de microcentrifuga. Debido al cuadrupolo que presenta el equipo, el rango de masas con el que se puede trabajar está entre 1-4 Da. Por ello, para obtener los espectros de masas de las proteínas completas se realiza una deconvolución matemática con el propio software del equipo. En todas las medidas con electrospray se realizó la calibración de masas del TOF con renina. 4.4 Parámetros de los equipos. En el caso de las medidas del MALDI, los parámetros están puestos delante de cada una de las medidas ya que son factores muy importantes que hay que variar dependiendo de la matriz con la que estemos trabajando o de la proteína. A diferencia del MALDI, en ESI los parámetros permanecen más fijados por los que los más importantes se recogen en la tabla 1: 26
27 [Experimental] Tabla 1. Condiciones generales del ESI. Rango de Masas Modo de trabajo Polaridad Gas nebulización Gas cortina Voltaje 1-2 Da TOF-MS Positiva 2 l/min 1 l/min 4 V 27
28 5. Resultados y discusión. 28
29 Intensidad [Resultados y discusión] 5.1 Detección de proteínas con espectrometría de masas molecular ) Superóxido Dismutasa (SOD) ) SOD con MALDI. Como se ha comentado en el apartado introducción, la superóxido dismutasa es una enzima que está involucrada en mecanismos de estrés oxidativo de las células. En este trabajo Fin de Máster se utilizó superóxido dismutasa procedente de eritrocitos humanos (P441) que tiene un peso molecular de Da. Debido al peso molecular superior a 1 kda, la SOD se estudió con SA y con NPG. Las condiciones de trabajo en el equipo de MALDI para la SOD con SA se recogen en la tabla 2: Tabla 2. Condiciones de medida del MALDI para SOD con SA. Tipo de escaneo Positivo Modo Lineal LASER 25 V Disparos 15 Rango de escaneo 4-35 Da Voltaje de aceleración 25 V En la figura 11 se puede ver el espectro obtenido de la SOD con SA como matriz. 7 [M+H] [M+2H] m/z Figura 11. Espectro de MALDI para SOD con SA 29
30 Intensidad Intensidad [Resultados y discusión] La superóxido dismutasa es una proteína con dos subunidades idénticas. Por eso, a una m/z de Da se observa señal correspondiente a la molécula de proteína intacta [M+H] +. En este caso, en los estudios de MALDI de la SOD el pico de mayor intensidad se corresponde con los monómeros con una carga +1. En general, y como se dijo con anterioridad, en MALDI lo más común es que se produzcan únicamente iones [M+H] + o que éstos sean los más intensos en el espectro de masas. Se observa también un pico con una buena intensidad para la especie [M+2H] 2+ pero, a partir de ahí, ya no se observan mas cargas para esta especie. Si se amplían las dos zonas de interés correspondientes a las especies [M+H] + (figura 12) y [M+2H] 2+ (figura 13), se observa lo siguiente: (2) (2) (1) (1) (3) 2 (3) m/z m/z Figura 12. [M+H] + de SOD con SA Figura 13. [M+2H] 2+ de SOD con SA Los resultados obtenidos en forma de m/z se representan en la tabla 3: Tabla 3. Resultados de las medidas de MALDI para SOD con SA. SOD (SA) Pico m/z [Da](z=1) m/z [Da] (z=2) La SOD humana tiene asociados dos metales diferentes que hacen que la proteína tenga actividad de enzima. En este caso, los metales que tienen asociados son Cu y Zn. En los espectros de masas se puede ver que en cada rango de carga diferente se pueden ver tres picos diferentes para la proteína. En el caso del primer pico se trata de la proteína entera en la que están asociados tanto Cu como Zn. En el caso del segundo pico se corresponde con la proteína solo asociada al 3
31 Intensidad [Resultados y discusión] Cu. Esto se sabe haciendo cálculos de diferencias entre ambos picos (Δm = 66.3 Da corresponde a la pérdida de Zn). El último pico de los tres se corresponde con la proteína en su forma apo (sin metales asociados, Δm = Da corresponde a la pérdida de Cu). Además, se pueden observar dos picos a m/z = Da y Da, que corresponden a aductos de la proteína con la matriz. Se observa como en el caso de [M+2H] 2+, la resolución de los picos es mayor. Esto es debido a que en el analizador de masas tipo TOF, la resolución de masas es mejor cuanto menor sea la relación m/z. Las diferencias observadas entre los tres picos de la especie [M+2H] 2+ afirman las observaciones del ion [M+H] +. Posteriormente se hicieron las medidas de esta misma proteína con la matriz de interés de este trabajo Fin de Máster, el NPG. Las condiciones que se aplicaron al equipo de espectrometría de masas son las que se muestran en la tabla 4: Tabla 4. Condiciones de medida del MALDI para SOD con NPG. Tipo de escaneo Positivo Modo Lineal LASER 23 V Disparos 15 Rango de escaneo Da Voltaje de aceleración 25 V Se puede observar como las condiciones del láser son más suaves en este caso por lo que los analitos no sufren tanto el proceso de desorción e ionización. Los resultados obtenidos en las medidas de la SOD con la matriz NPG se observan en la figura 14: 25 [M+2H] [M+4H] 4+ [M+3H] 3+ [M+H] + 1 [M+5H] 5+ 5 [M+6H] m/z Figura 14. Espectro de MALDI para SOD con NPG 31
32 Intensidad Intensidad Intensidad Intensidad [Resultados y discusión] A simple vista en el espectro de masas podemos encontrar dos diferencias fundamentales entre los dos espectros de masas que se están comparando y es que, en el caso de la NPG, la señal correspondiente a la especie [M+2H] 2+ es más intensa que la señal correspondiente a la especie [M+H] +. Esto es importante ya que, como se explicó con anterioridad en este trabajo, la resolución de los analizadores de masas de tipo tiempo de vuelo aumenta según se disminuye la relación m/z. Si hacemos un zoom a cada una de las señales que se obtienen en el espectro de masas podemos ver lo siguiente: [M+H] + (1) (2) 2 [M+2H] 2+ (1)(2) 1 (3) (3) m/z m/z Figura 15. Ampliación de [M+H] + Figura 16. Ampliación de [M+2H] 2+ [M+3H] 3+ (1) (2) 4 [M+4H] 4+ (1) (2) 5 (3) 2 (3) m/z m/z Figura 17. Ampliación de [M+3H] 3+ Figura 18. Ampliación de [M+4H] 4+ 32
33 Intensidad Intensidad [Resultados y discusión] [M+5H] 5+ [M+6H] 6+ (1) (3) 1 (2) (3) 1 (2) (1) m/z m/z Figura 19. Ampliación de [M+5H] 5+ Figura 2. Ampliación de [M+6H] 6+ En la tabla 5 se observan los valores de m/z en cada uno de las señales obtenidas: Tabla 5. Resultados de las medidas de MALDI para SOD con NPG. SOD (NPG) Pico m/z [Da] m/z [Da] m/z [Da] m/z [Da] m/z [Da] m/z [Da] z=1 z=2 z=3 z=4 z=5 z= R En la tabla 5, también se observa la resolución en cada carga. Para calcular esto, lo que se hizo fue calcular R con la siguiente fórmula: R = m/ m donde, m es la masa del pico y, m es la anchura del pico a la semialtura. Se puede observar el elevado número de cargas que toma el analito con esta matriz. Esto tiene tres ventajas principales: 1. Mayor información analítica en un solo espectro de masas. 2. Mayor facilidad para la realización de experimentos MS/MS, debido a que, las especies con múltiples cargas tienen mayor facilidad de producir fragmentos en las medidas de MS/MS. 33
34 Intensidad [Resultados y discusión] 3. La señal es más intensa para la especie [M+2H] 2+ por lo que, como se dijo anteriormente, el TOF tiene mayor resolución. Esto nos facilita el estudio de la pérdida de metales en las metaloproteínas y también facilita la observación de aductos de las proteínas con iones Na + y K +, que son bastante frecuentes en ambas técnicas de espectrometría de masas molecular ) Superóxido Dismutasa con ESI El espectro de masas obtenido para la SOD se observa en la figura 21: m/z Figura 21. Espectro de masas de ESI para la SOD. En este caso, no se indican las cargas de las señales del espectro de masas ya que no queda del todo claro si las señales proceden de la proteína intacta o de sus monómeros. Se realizó la deconvolución de perfiles isotópicos para intentar teorizar el pico de la proteína completa y también la proteína en las dos subunidades que la forman. En las figuras 22 y 23 se observan los resultados obtenidos de las deconvoluciones: Figura 22. Deconvolución de la proteína intacta. 34
35 [Resultados y discusión] Figura 23. Deconvolución de la proteína en sus dos monómeros ) Insulina ) Insulina con MALDI. En el apartado introducción se ha descrito la insulina como una enzima hormonal que está implicada en la regulación de la glucosa en los seres vivos. En este trabajo fin de máster se trabajó con insulina humana (P138). La insulina humana tiene un peso molecular de 588 Da. La cadena α tiene un peso molecular de Da y una cadena β con un peso molecular de Da. Como se ha descrito con anterioridad, en las medidas de compuestos con un peso molecular por debajo de 1 kda, típicamente se utiliza como matriz de MALDI el ácido α-ciano-4-hidroxicinámico (CHCA). Por lo tanto, en este caso la comparación se realiza entre el CHCA y la matriz de interés NPG. Las condiciones de trabajo de la insulina con CHCA como matriz se recogen en la tabla 6: Tabla 6. Condiciones de medida del MALDI para insulina con CHCA Tipo de escaneo Modo LASER Positivo Reflectrón 24 V Disparos 15 Rango de escaneo Voltaje de aceleración 7-6 Da 2 V 35
36 Intensidad [Resultados y discusión] Los resultados obtenidos para la insulina con CHCA se observan en la figura 24: [M +2H] 2+ 1 [M +H] m/z Figura 24. Espectro de MALDI para insulina con CHCA. Una de las primeras curiosidades que se observan es que a la masa correspondiente al ion [M+H] + no se ve ninguna señal. Esto es debido a que en el proceso de desorción e ionización, el analito se rompe en las dos cadenas diferentes que tiene. Tampoco se observa señal en torno a 3 Da que sería la zona en que se vería el ion [M+2H] 2+. Esto confirma la observación de que la insulina con CHCA como matriz rompe en sus dos cadenas siempre que se mide con MALDI. Lo que si se observa con muy buena intensidad es la cadena β que tiene esta hormona. También se observa la cadena β en forma de doble cargado. El resto de señales no destacadas, se llegó a la conclusión de que son contaminaciones que aparecen en el espectro. Cabe reseñar que no aparece la señal correspondiente a la cadena α. Las medidas de la insulina con NPG como matriz requirieron de las siguientes condiciones de trabajo, representadas en la tabla 7: Tabla 7. Condiciones de MALDI para la medida de insulina con NPG Tipo de escaneo Modo LASER Positivo Reflectrón 21 V Disparos 15 Rango de escaneo Voltaje de aceleración 1-7 Da 2 V 36
37 Intensidad [Resultados y discusión] Los resultados obtenidos se representan en la figura 25: 4 [M+H] [M+2H] Figura 25. Espectro de MALDI para insulina con NPG A diferencia del caso del NPG como matriz, se puede ver con claridad la señal de la proteína intacta, tanto como de [M+H] + como de [M+2H] 2+. Esto es debido a que, con la matriz NPG, las condiciones del láser son mucho menos energéticas por lo que en el proceso de desorción e ionización no se rompen los enlaces por puentes disulfuro con los que se unen ambas cadenas entre sí. Debido a esto, el espectro de masas de insulina con NPG es mucho más limpio, con menos interferentes por lo que, la identificación de esta proteína con NPG se hace mucho más fácilmente. m/z ) Insulina con ESI. El espectro de masas para la insulina se observa en la figura 26: Figura 26. Espectro de masas de ESI para insulina 37
38 [Resultados y discusión] En todos los casos, la deconvolución se hace con el pico del espectro de masas con más señal. En este caso, la mayor señal se trata del ión [M+5H] 5+ de la insulina. Tras la deconvolución se obtuvieron los resultados que se observan en la figura 27: Figura 27. Deconvolución para la insulina ) Citocromo C ) Citocromo C con MALDI El citocromo C (P99999) es una proteína pequeña con un peso molecular de Da. Por esta característica de proteína pequeña y cercana al límite que se explicó con anterioridad para utilizar CHCA o SA se decidió trabajar con ambas matrices además de utilizar la matriz de interés en este trabajo. Las condiciones de trabajo con la matriz CHCA en estas medidas están recogidas en la tabla 8: Tabla 8. Condiciones del MALDI para citocromo C con CHCA. Tipo de escaneo Positivo Modo Lineal LASER 24 V Disparos 15 Rango de escaneo Da Voltaje de aceleración 25 V 38
39 Intensidad [Resultados y discusión] En la figura 28 se exponen los resultados de las medidas hechas con CHCA en las siguientes condiciones: [M+H] + 5 [M+2H] m/z Figura 28. Espectro de MALDI para citocromo C con CHCA. Cabe destacar que los resultados obtenidos con CHCA para la proteína citocromo C no son nada satisfactorios. Se observa señal para la especie [M+H] + y la especie [M+2H] +2, pero con una señal muy pequeña así como mucho ruido en el espectro de masas. Debido a esto, se utilizó también la matriz SA para la misma proteína. Para el SA se utilizaron condiciones de medida recogidas en la tabla 9: Tabla 9. Condiciones del MALDI para citocromo C con SA. Tipo de escaneo Positivo Modo Lineal LASER 26 V Disparos 15 Rango de escaneo 4-15 Da Voltaje de aceleración 25 V Los resultados de las medidas del MALDI del citocromo C con SA se representan la figura 29: 39
40 Intensidad [Resultados y discusión] 3 [M+H] [M+2H] m/z Figura 29. Espectro de MALDI para citocromo C con SA Cabe destacar de este espectro de masas como se observan los picos correspondientes a [M+H] + y a [M+2H] +2. Las señales y el espectro son más limpios y con una mejor resolución que en el caso del CHCA, por lo que es correcto que esta matriz sea la adecuada en las medidas de MALDI del citocromo C. El siguiente paso con la proteína citocromo C es el estudio de esta con la matriz de interés en este trabajo, NPG. Las condiciones de medida se recogen en la tabla 1: Tabla 1. Condiciones del MALDI para citocromo C con NPG. Tipo de escaneo Positivo Modo Lineal LASER 21 V Disparos 15 Rango de escaneo Da Voltaje de aceleración 25 V En las condiciones de medida se puede observar, al igual que con el resto de proteínas como las medidas con NPG se realizan en condiciones más suaves, lo que facilita las medidas de proteínas intactas. Los resultados que se obtuvieron para el citocromo C con NPG están representados en la figura 3: 4
41 Intensidad Intensidad Intensidad [Resultados y discusión] 12 [M+H] + 1 [M+2H] [M+3H] m/z Figura 3. Espectro de masas de citocromo C con NPG. Como en todos los ejemplos estudiados anteriormente, en este caso, la señal de [M+2H] +2 también aumenta mucho. En general, el espectro de masas es mucho más limpio que en los casos anteriores. La interacción del NPG con la proteína es mucho menor que en el caso de las medidas con SA por lo que, se podría decir que el NPG es una matriz más adecuada para las medidas de esta proteína. En las figuras 31, 32 y 33 se observa la ampliación de las señales para las tres cargas que se detectaron en el espectro de masas: m/z m/z Figura 31. Ampliación de [M+H] + Figura 32. Ampliación de [M+2H] 2+ 41
42 Intensidad [Resultados y discusión] m/z Figura 33. Ampliación de [M+3H] 3+ En estas ampliaciones de las zonas de interés se puede ver con claridad como la interacción entre matriz y proteína en el caso del NPG es mucho menor que en el estudio con el SA. Es muy destacable, el poco ruido de fondo que se obtiene con el NPG en todos los casos. En el estudio del citocromo C es mucho más importante que en el resto de proteínas esta disminución del ruido de fondo ) Citocromo C con ESI. El espectro de masas para el citocromo C es el que se observa en la figura 34: Figura 34. Espectro de masas de citocromo C con ESI +7 42
43 [Resultados y discusión] Este es un buen ejemplo en el que se puede observar una de las mayores características de los equipos de electrospray, la gran cantidad de cargas que se producen en los analitos. Como en otros casos, se utiliza el ión de mayor señal para hacer la deconvolución. En este caso es el de carga +15 con una m/z= Da. Los resultados de la deconvolución se observan en la figura 35: Figura 35. Deconvolución para el citocromo C ) Hemoglobina ) Hemoglobina con MALDI Como se ha descrito en la introducción, la hemoglobina es una proteína multimérica. Tiene dos cadenas α (P6995) con un peso molecular de cada una de Da y dos cadenas β (P68871) con un peso molecular de cada una de Da. Su peso molecular total es de Da. Esta es la proteína mayor que se utilizó en todo este trabajo. Por ello, solo se emplearon SA y NPG como matrices. Como viene siendo habitual en la organización de este trabajo, primero se muestran los resultados con la matriz SA. Las condiciones de trabajo fueron las recogidas en la tabla 11: 43
44 Intensidad [Resultados y discusión] Tabla 11. Condiciones del MALDI para hemoglobina con SA. Tipo de escaneo Positivo Modo Lineal LASER 27 V Disparos 15 Rango de escaneo 5-2 Da Voltaje de aceleración 25 V Los resultados se observan en la figura 36: 4 35 [M 2H] 2+ [M +H] [M 2H] 2+ [M H] m/z Figura 36. Espectro de MALDI de hemoglobina con SA. La hemoglobina es una proteína que en MALDI nunca se puede ver entera. Siempre que se hacen estudios de ella, se observan las señales correspondientes a las cadenas [25]. En este caso, la energía de láser es la más alta utilizada en todo el trabajo realizado. La cadena β es la de mayor peso molecular mientras que, la cadena α es la más pequeña. Posteriormente, se exponen los resultados obtenidos en el trabajo realizado con la hemoglobina utilizando NPG como matriz. Las condiciones de trabajo se encuentran recogidas en la tabla 12: 44
45 Intensidad [Resultados y discusión] Tabla 12. Condiciones del MALDI para hemoglobina con NPG Tipo de escaneo Positivo Modo Lineal LASER 21 V Disparos 15 Rango de escaneo 5-2 Da Voltaje de aceleración 25 V De la tabla 12, cabe destacar como la diferencia de energía de láser empleada entre el SA y el NPG es muy grande. Es la mayor diferencia de laser de todas las medidas hechas en este trabajo. Los resultados obtenidos con el NPG se observan en la figura 37: 5 [M H] 2+ [M +H] [M H] 2+ [M +H] m/z Figura 37. Espectro de MALDI de hemoglobina con NPG. Es de destacar que, a diferencia del resto de ejemplos, en el caso de la hemoglobina, los resultados no son tan satisfactorios. La única mejora que se puede destacar en este caso es que, la intensidad del láser es mucho menor por lo que, las condiciones de medidas son mucho más suaves. La hemoglobina es una proteína que no presenta buenos resultados, en general, en las medidas por MALDI-TOF-MS ) Hemoglobina con ESI. En la figura 38, se observa el espectro de masas de la hemoglobina en medidas por ESI: 45
46 [Resultados y discusión] Figura 38. Espectro de masas de hemoglobina con ESI En este caso, para realizar la deconvolución se utiliza la carga +17 que es la de mayor intensidad. Los resultados se observan en la figura 39: Da Da Figura 39. Deconvolución de hemoglobina. A diferencia del MALDI, con ESI se observan las dos cadenas de la hemoglobina. La hemoglobina intacta no produce ninguna solución al intentar hacer la deconvolución en ese rango de masa. En este apartado de resultados se trabajaron los resultados obtenidos en las medidas con las dos técnicas de análisis molecular de mayor potencial en el campo de la proteómica. Se utilizó una novedosa matriz de MALDI, observándose buenos resultados con ella, mejorando en muchas ocasiones los resultados que se obtienen con las matrices típicas de 46
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
Niveles de organización biológica. La composición de los seres vivos
 Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Biomoléculas orgánicas: Proteínas y Ácidos nucleicos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
EL CONTROL DE LAS ACTIVIDADES CELULARES
 EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS.
 REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
Biología General y Metodología de las Ciencias 2016 BIOMOLÉCULAS
 BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
ESI-MALDI-TOF. El análisis por espectrometría de masas se realiza en cuatro etapas básicas:
 ESI-MALDI-TOF Introducción Espectrometría de masas La espectrometría de masas es una técnica analítica en la que los átomos o moléculas de una muestra son ionizados, con mayor frecuencia positivamente,
ESI-MALDI-TOF Introducción Espectrometría de masas La espectrometría de masas es una técnica analítica en la que los átomos o moléculas de una muestra son ionizados, con mayor frecuencia positivamente,
Clasificación de las proteinas según su conformación
 lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
Física y Química 3º ESO
 1. Física y Química. Ciencias de la medida forman parte de las necesitan Ciencias de la naturaleza medir las propiedades de los cuerpos que se dividen en para lo cual se emplean lo que siempre conlleva
1. Física y Química. Ciencias de la medida forman parte de las necesitan Ciencias de la naturaleza medir las propiedades de los cuerpos que se dividen en para lo cual se emplean lo que siempre conlleva
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA
 BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Estructura tridimensional de las proteínas
 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
BIOMOLÉCULAS. Son moléculas fundamentales para la constitución y funcionamiento de todo ser vivo. Se clasifican en dos grupos:
 FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
Requisitos de las muestras y condiciones de análisis
 Requisitos de las muestras y condiciones de análisis Página 1 INTRODUCCION A continuación se indican los requisitos generales que han de cumplir las muestras para poder ser analizadas en el Servicio de
Requisitos de las muestras y condiciones de análisis Página 1 INTRODUCCION A continuación se indican los requisitos generales que han de cumplir las muestras para poder ser analizadas en el Servicio de
Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua
 Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua Técnico Professor: Verónica en masoterapia Pantoja. Lic. MSP. Objetivos Reconocer los bioelementos en los seres vivos Reconocer el agua como biomolécula
Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua Técnico Professor: Verónica en masoterapia Pantoja. Lic. MSP. Objetivos Reconocer los bioelementos en los seres vivos Reconocer el agua como biomolécula
Tema I: Biomoléculas
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
Universidad Nacional de la Patagonia San Juan Bosco Facultad de Ciencias Naturales Química Biológica Introducción
 Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
Biomoléculas orgánicas: Carbohidratos y Lípidos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
CLASIFICACIÓN DE LA MATERIA
 1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
Ácidos nucléicos. Los ácidos nucleicos fueron descubiertos por Freidrich Miescher en Mirel Nervenis
 Ácidos nucléicos Los ácidos nucleicos fueron descubiertos por Freidrich Miescher en 1869 La información genética o genoma, está contenida en unas moléculas llamadas ácidos nucleicos. Existen dos tipos
Ácidos nucléicos Los ácidos nucleicos fueron descubiertos por Freidrich Miescher en 1869 La información genética o genoma, está contenida en unas moléculas llamadas ácidos nucleicos. Existen dos tipos
O Un elemento químico es una sustancia que no puede dividirse en otras sustancias por medios químicos comunes. Actualmente los químicos reconocen 92
 BIOELEMENTOS BIOELEMENTOS O La vida se compone de materia, que es todo lo que ocupa espacio y tiene masa. La materia, en forma tan diversas como una roca, madera, metal y aire, se compone de elementos
BIOELEMENTOS BIOELEMENTOS O La vida se compone de materia, que es todo lo que ocupa espacio y tiene masa. La materia, en forma tan diversas como una roca, madera, metal y aire, se compone de elementos
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Tema 7: Medidas de contaminación atmosférica I
 Tema 7: Medidas de contaminación atmosférica I 7.1 Muestreo y análisis 7.2 Muestreo y análisis de partículas 7.3 Análisis de metales en partículas 7.4 Análisis de materia orgánica en partículas 7.1 Muestreo
Tema 7: Medidas de contaminación atmosférica I 7.1 Muestreo y análisis 7.2 Muestreo y análisis de partículas 7.3 Análisis de metales en partículas 7.4 Análisis de materia orgánica en partículas 7.1 Muestreo
Bioquímica Tema 2: Soluciones. Unidades Año: 2013
 TEMA 2: SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos.
TEMA 2: SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos.
PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS. Es un ácido capaz de formar sales con iones cargados
 Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
Organización básica del cuerpo humano
 Organización básica del cuerpo humano I. Niveles de organización del cuerpo humano El ser humano es un organismo extremadamente complejo. Existen diferentes niveles de complejidad o de organización en
Organización básica del cuerpo humano I. Niveles de organización del cuerpo humano El ser humano es un organismo extremadamente complejo. Existen diferentes niveles de complejidad o de organización en
Componentes químicos de
 Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
PROGRAMA DE ESTUDIO. 2. CICLO O AREA: División de Ciencias e Ingeniería/Ingeniería Ambiental.
 PROGRAMA DE ESTUDIO 1. NOMBRE DE LA ASIGNATURA: BIOQUÍMICA. 2. CICLO O AREA: División de Ciencias e Ingeniería/Ingeniería Ambiental. 3. CLAVE: 4. SERIACION: Química Orgánica. 5. H.T.S. H.P.S. T.H.S. C.
PROGRAMA DE ESTUDIO 1. NOMBRE DE LA ASIGNATURA: BIOQUÍMICA. 2. CICLO O AREA: División de Ciencias e Ingeniería/Ingeniería Ambiental. 3. CLAVE: 4. SERIACION: Química Orgánica. 5. H.T.S. H.P.S. T.H.S. C.
Figura 1: Esquema de polímero
 Eje temático: Química: Fenómenos nucleares Polímeros Procesos químicos industriales Contenido: Tipos de polímeros y polimerización Nivel: Cuarto medio Polímeros. Polímeros sintéticos y naturales Polímeros
Eje temático: Química: Fenómenos nucleares Polímeros Procesos químicos industriales Contenido: Tipos de polímeros y polimerización Nivel: Cuarto medio Polímeros. Polímeros sintéticos y naturales Polímeros
TEMA 8 SISTEMA PERIÓDICO Y ENLACES
 TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
TEMA 8 SISTEMA PERIÓDICO Y ENLACES 1. LA TABLA PERIÓDICA Elementos químicos son el conjunto de átomos que tienen en común su número atómico, Z. Hoy conocemos 111 elementos diferentes. Los elementos que
Introducción al estudio de las proteínas
 Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
TEORIA CELULAR. En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS
 TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
II.- Espectrometría de masas
 II.- Espectrometría de masas Generalidades de espectrometría de masas La espectrometría de masas en una técnica analítica que nos permite identificar y determinar estructuras, así como analizar trazas
II.- Espectrometría de masas Generalidades de espectrometría de masas La espectrometría de masas en una técnica analítica que nos permite identificar y determinar estructuras, así como analizar trazas
Técnicas de Estudio de las células
 Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Repaso Opción múltiple Macromoléculas Biológicas
 Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Determinación de constantes de ionización
 Capítulo 5. Determinación de constantes de ionización Se determinaron las constantes de ionización de diversos compuestos mediante curvas de titulación ácido-base empleando métodos espectrofotométricos
Capítulo 5. Determinación de constantes de ionización Se determinaron las constantes de ionización de diversos compuestos mediante curvas de titulación ácido-base empleando métodos espectrofotométricos
ENLACE QUÍMICO 2º BACH EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. H-CHO H C = O : CH 3 OH H C O H H H H C O C H H H CH 3 OCH 3
 EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
Las funciones de los seres vivos. Fisiología celular
 Las funciones de los seres vivos Fisiología celular La célula, como unidad funcional de los seres vivos, está capacitada para llevar a cabo las funciones características de éstos: nutrición, reproducción
Las funciones de los seres vivos Fisiología celular La célula, como unidad funcional de los seres vivos, está capacitada para llevar a cabo las funciones características de éstos: nutrición, reproducción
SOLUCIONARIO Guía Estándar Anual
 SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
SOLUCIONARIO Guía Estándar Anual El enlace químico SGUICES004CB33-A16V1 Ítem Alternativa Habilidad 1 E Reconocimiento 2 B Aplicación 3 C Comprensión 4 D Comprensión 5 D Aplicación 6 D Aplicación 7 D Comprensión
5.2. NITRÓGENO Y AZUFRE.
 5.2. NITRÓGENO Y AZUFRE. 5.2.1. PROTEÍNAS. Si hidratos de carbono y lípidos están formados únicamente por átomos de carbono, oxígeno e hidrógeno, las proteínas tienen en su composición, además, nitrógeno
5.2. NITRÓGENO Y AZUFRE. 5.2.1. PROTEÍNAS. Si hidratos de carbono y lípidos están formados únicamente por átomos de carbono, oxígeno e hidrógeno, las proteínas tienen en su composición, además, nitrógeno
Actividad introductoria: Aplicación en la industria de las fuerzas intermoleculares.
 Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Repaso: Química celular (biomoléculas)
 Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
Energía y metabolismo
 Energía y metabolismo Sesión 17 Introducción a la Biología Prof. Nelson A. Lagos Los sistemas vivos son abiertos y requieren energía para mantenerse La energía es la capacidad de hacer trabajo. Cinético
Energía y metabolismo Sesión 17 Introducción a la Biología Prof. Nelson A. Lagos Los sistemas vivos son abiertos y requieren energía para mantenerse La energía es la capacidad de hacer trabajo. Cinético
Polímero corto Monómero. síntesis. degradación
 Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Plataforma para la monitorización de la Gripe en España
 Plataforma para la monitorización de la Gripe en España La gripe es una de las enfermedades más contagiosas que existen y cada año es responsable de la muerte de cientos de miles de personas en todo el
Plataforma para la monitorización de la Gripe en España La gripe es una de las enfermedades más contagiosas que existen y cada año es responsable de la muerte de cientos de miles de personas en todo el
Unidad 2. La materia
 Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
ESPECTROMETRIA DE MASAS
 ESPECTROMETRIA DE MASAS Se puede sub-dividir en dos áreas de aplicación: Espectrometría de masas atómica EMA: determinar cuali y cuantitativamente los elementos presentes en una muestra. Espectrometría
ESPECTROMETRIA DE MASAS Se puede sub-dividir en dos áreas de aplicación: Espectrometría de masas atómica EMA: determinar cuali y cuantitativamente los elementos presentes en una muestra. Espectrometría
CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO
 Alianza para el Aprendizaje de Ciencias y Matemáticas CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO GUÍA DEL MAESTRO ESTÁNDARES ATENDIDOS: 1. LA NATURALEZA
Alianza para el Aprendizaje de Ciencias y Matemáticas CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO GUÍA DEL MAESTRO ESTÁNDARES ATENDIDOS: 1. LA NATURALEZA
PROTEÍNAS. Las proteínas están constituidas por la unión de numerosas moléculas sencillas (monómeros) denominados aminoácidos.
 PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
Protocolo de Análisis por Espectrometría de Masas de Alta Resolución. Código LEM-PR-01 Fecha 15/Octubre/2015 Versión 1
 OBJETIVO. Establecer los mecanismos y requisitos necesarios para realizar análisis de muestras tanto externas como internas en el laboratorio de espectrometría de masas. ALCANCE. Aplica al Laboratorio
OBJETIVO. Establecer los mecanismos y requisitos necesarios para realizar análisis de muestras tanto externas como internas en el laboratorio de espectrometría de masas. ALCANCE. Aplica al Laboratorio
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
Sistema Integrado de Gestión RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS PROGRAMAS DE DEPORTE Y FISIOTERAPIA GUIA PRÁCTICA N 6
 Sistema Integrado de Gestión RECONOCIMIENTO Y PROGRAMAS DE DEPORTE Y Versión 3 Proceso: Investigación - IV Octubre de 2013 Página 2 de 10 1. OBJETIVOS Reconocer algunas propiedades de las proteínas Determinar
Sistema Integrado de Gestión RECONOCIMIENTO Y PROGRAMAS DE DEPORTE Y Versión 3 Proceso: Investigación - IV Octubre de 2013 Página 2 de 10 1. OBJETIVOS Reconocer algunas propiedades de las proteínas Determinar
Espectrometría de masas Instrumentación y aplicaciones
 Clase 02 Espectroscopía de Compuestos Orgánicos MALDI-MS ESI-MS Espectrometría de masas Instrumentación y aplicaciones Espectrometría de Masa Fluid (no salt) + _ cyano-hydroxy cinnamic acid Gold tip needle
Clase 02 Espectroscopía de Compuestos Orgánicos MALDI-MS ESI-MS Espectrometría de masas Instrumentación y aplicaciones Espectrometría de Masa Fluid (no salt) + _ cyano-hydroxy cinnamic acid Gold tip needle
OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo.
 1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
CENTRO UNIVERSITARIO MONTEJO A.C. Temario Ciencias 3 Énfasis en química. Bloque I. Las características de los materiales
 Bloque I. Las características de los materiales La ciencia y la tecnología en el mundo actual Identifica las aportaciones del conocimiento químico y tecnológico en la satisfacción de necesidades básicas,
Bloque I. Las características de los materiales La ciencia y la tecnología en el mundo actual Identifica las aportaciones del conocimiento químico y tecnológico en la satisfacción de necesidades básicas,
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
SESIÓN 3 LA QUÍMICA DE LA VIDA
 Biología SESIÓN 3 LA QUÍMICA DE LA VIDA 1. Las Bases Químicas De La Vida Los organismos vivos y el mundo en el que viven están sometidos a las leyes de la física y de la química. En los organismos vivos
Biología SESIÓN 3 LA QUÍMICA DE LA VIDA 1. Las Bases Químicas De La Vida Los organismos vivos y el mundo en el que viven están sometidos a las leyes de la física y de la química. En los organismos vivos
Colegio El Valle Departamento de Biología y Geología 6H 2 O + 6CO 2 + ATP
 TEMA 4: NUTRICIÓN CELULAR Implica los procesos por los que la célula obtiene materia y energía procedentes del exterior, necesarios para su supervivencia, así como la expulsión de sustancias de desecho.
TEMA 4: NUTRICIÓN CELULAR Implica los procesos por los que la célula obtiene materia y energía procedentes del exterior, necesarios para su supervivencia, así como la expulsión de sustancias de desecho.
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
Titulaciones en Química Analítica. Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D.
 Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
Bloque II: Las moléculas forman estructuras: Célula
 Bloque II: Las moléculas forman estructuras: Célula 1. a. Indique dos tipos de moléculas presentes en todas las membranas celulares. Indique una diferencia entre la membrana plasmática y otras membranas
Bloque II: Las moléculas forman estructuras: Célula 1. a. Indique dos tipos de moléculas presentes en todas las membranas celulares. Indique una diferencia entre la membrana plasmática y otras membranas
LA LA ESTRUCTURA DE LA MATERIA. 1.-Desarrollo histórico del concepto de átomo. Teoría de Demócrito. Teoría de Dalton. Componentes del átomo
 ANEXO AL TEMA 4 LA LA ESTRUCTURA DE LA MATERIA 1.-Desarrollo histórico del concepto de átomo Teoría de Demócrito Teoría de Dalton Modelo actual Componentes del átomo Concepto de ión 2.-Elememtos y compuestos
ANEXO AL TEMA 4 LA LA ESTRUCTURA DE LA MATERIA 1.-Desarrollo histórico del concepto de átomo Teoría de Demócrito Teoría de Dalton Modelo actual Componentes del átomo Concepto de ión 2.-Elememtos y compuestos
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
Actividad: Cómo ocurren las reacciones químicas?
 Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS
 A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
SUMARIO Ácidos nucleicos. Estructura general. Tipos principales: ADN y ARN. ADN. Estructura primaria. Estructura secundaria o modelo de Watson y Crick
 COFERENCIA 5 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. ÁCIDOS NUCLEICOS Autor: Dr. Daniel Sánchez Serrano SUMARIO Ácidos nucleicos. Estructura general. Tipos principales: ADN y ARN. ADN. Estructura
COFERENCIA 5 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. ÁCIDOS NUCLEICOS Autor: Dr. Daniel Sánchez Serrano SUMARIO Ácidos nucleicos. Estructura general. Tipos principales: ADN y ARN. ADN. Estructura
CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN
 CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN Curso: Química Analítica II Loreto Ascar 2012 Esquema de las bases de la separación en cromatografía de: (a)absorción, (b) partición, (c) Intercambio iónico y (d)
CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN Curso: Química Analítica II Loreto Ascar 2012 Esquema de las bases de la separación en cromatografía de: (a)absorción, (b) partición, (c) Intercambio iónico y (d)
1. MATERIA Y SU ASPECTO
 1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Tema 1. Introducción. Bioelementos y Biomoléculas Inorgánicas
 Tema 1. Introducción. Bioelementos y Biomoléculas Inorgánicas 1. Concepto de Biología: Es la ciencia que estudia todos los fenómenos y procesos relacionados con los seres vivos. 2. Características de los
Tema 1. Introducción. Bioelementos y Biomoléculas Inorgánicas 1. Concepto de Biología: Es la ciencia que estudia todos los fenómenos y procesos relacionados con los seres vivos. 2. Características de los
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
UNIDAD 1 La materia y sus cambios
 UNIDAD 1 La materia y sus cambios Tema 1.2 Composición de la materia. Sustancias y mezclas. Mezclas homogéneas, heterogéneas y coloides. Introducción a las disoluciones: no saturadas, saturadas y sobresaturadas.
UNIDAD 1 La materia y sus cambios Tema 1.2 Composición de la materia. Sustancias y mezclas. Mezclas homogéneas, heterogéneas y coloides. Introducción a las disoluciones: no saturadas, saturadas y sobresaturadas.
Unidad 7: Respiración Celular
 1 La energía lumínica es capturada por las plantas verdes y otros organismos fotosintéticos, que la transforman en energía química fijada en moléculas como la glucosa. Estas moléculas son luego degradadas
1 La energía lumínica es capturada por las plantas verdes y otros organismos fotosintéticos, que la transforman en energía química fijada en moléculas como la glucosa. Estas moléculas son luego degradadas
CAPÍTULO 2 FLUJO DE LA INFORMACIÓN BIOLÓGICA FACULTAD DE AGRONOMÍA CURSO DE BIOQUÍMICA
 CAPÍTULO 2 FLUJO DE LA INFORMACIÓN BIOLÓGICA FACULTAD DE AGRONOMÍA CURSO DE BIOQUÍMICA Contenido 2.1 Información biológica e interacciones no covalentes. 2.2 Almacenamiento de la información biológica
CAPÍTULO 2 FLUJO DE LA INFORMACIÓN BIOLÓGICA FACULTAD DE AGRONOMÍA CURSO DE BIOQUÍMICA Contenido 2.1 Información biológica e interacciones no covalentes. 2.2 Almacenamiento de la información biológica
DISOLUCIONES UNIDAD IV. Licda. Miriam Marroquín Leiva
 DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
DISOLUCIONES UNIDAD IV 1 DISOLUCIÓN Es una mezcla homogénea de dos o más sustancias; el soluto y el disolvente. Es un término utilizado para describir un sistema en el cual una o más sustancias están mezcladas
Theory Espanol (Colombia) El Gran Colisionador de Hadrones (Large Hadron Collider) (10 puntos)
 Q3-1 El Gran Colisionador de Hadrones (Large Hadron Collider) (10 puntos) Por favor asegúrese de leer las instrucciones generales dentro del sobre adjunto antes de comenzar a resolver este problema. En
Q3-1 El Gran Colisionador de Hadrones (Large Hadron Collider) (10 puntos) Por favor asegúrese de leer las instrucciones generales dentro del sobre adjunto antes de comenzar a resolver este problema. En
4. El esquema adjunto representa la estructura de una molécula denominada lisozima.
 BLOQUE I : La base físico-química de la materia 1. a. Nombre y formule un monosacárido que contenga seis átomos de carbono. b. Indica esquemáticamente una diferencia estructural existente entre el almidón
BLOQUE I : La base físico-química de la materia 1. a. Nombre y formule un monosacárido que contenga seis átomos de carbono. b. Indica esquemáticamente una diferencia estructural existente entre el almidón
Unidad 6: ELECTROQUIMICA
 Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
Las que tienen relación con el de tamaño: LAS PROPIEDADES PERIÓDICAS. Se pueden separar en dos grupos: PERIODICIDAD
 LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
LAS PROPIEDADES PERIÓDICAS Se pueden separar en dos grupos: 1- Las que tienen relación con el de tamaño: Los radios atómicos y los radios iónicos o cristalinos. La densidad. (ρ) El punto de fusión y ebullición.
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD
 TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
