AMINOACIDOS, PEPTIDOS Y PROTEINAS. SEMANAS 29 y 30 Licda. Lilian Judith Guzmán Melgar
|
|
|
- Julián Fuentes Serrano
- hace 6 años
- Vistas:
Transcripción
1 AMINOACIDOS, PEPTIDOS Y PROTEINAS SEMANAS 29 y 30 Licda. Lilian Judith Guzmán Melgar
2 2 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos, porque son los monómeros a partir de los cuales se constituyen las proteínas. CADENA LATERAL VARIABLE R NH 2 C COOH GRUPO AMINO H GRUPO CARBOXILICO
3 CLASIFICACIÓN 3 POR LA CADENA LATERAL: Alifatitico Hidroxilados Azufrados Ácidos Amidas de aa ácidos Básicos Aromáticos Heterocíclicos POR SU REQUERIMIENTO: Esenciales No esenciales POR SU POLARIDAD: No polares Polares y neutros Acidos Básicos
4 4 Según su cadena lateral CADENA LATERAL CON GRUPO ALIFATICO HIDROXILO CARBOXILICO AMIDA AMINA AZUFRE ANILLO AROMATICO AMINOACIDO Glicina, Alanina,Valina, Leucina, Isoleucina, Prolina Serina, Treonina,Tirosina Acido Aspartico, Acido Glutamico Asparagina, Glutamina Lisina,Arginina, Histidina Cisteina, Metionina Fenilalanina, Triptofano, Tirosina
5 5 Clasificación según su polaridad NO POLARES GLICINA ALANINA VALINA LEUCINA ISOLEUCINA FENILALANINA METIONINA PROLINA TRIPTOFANO POLARES Y NEUTROS SERINA TREONINA CISTEINA TIROSINA ASPARAGINA GLUTAMINA ACIDOS AC. ASPARTICO AC. GLUTAMICO BASICOS LISINA ARGININA HISTIDINA
6 6 AMINOACIDOS NO POLARES NOMBRE ABREVIA TURA ESTRUCTURA Glicina Gli Gly Alanina Ala Ala Valina Val Val
7 7 AMINOACIDOS NO POLARES NOMBRE ABREVIA TURA ESTRUCTURA Leucina Leu Leu Isoleucina Ile Ile Fenilalanina Fen Phe
8 8 AMINOACIDOS NO POLARES NOMBRE ABREVIA TURA ESTRUCTURA Metionina Met Met Prolina Pro Pro Triptofano Trp Trp
9 9 AMINOACIDOS POLARES NEUTROS NOMBRE ABREVIA TURA ESTRUCTURA Serina Ser Ser Treonina Tre Thr Tirosina Tir Tyr
10 10 AMINOACIDOS POLARES NEUTROS NOMBRE ABREVIA TURA ESTRUCTURA Cisteina Cis Cys Asparagina Asn Asn Glutamina Gln Gln
11 11 AMINOACIDOS ACIDOS NOMBRE ABREVI- TURA ESTRUCTURA Acido Glutámico Glu Glu Acido Aspartico Asp Asp
12 12 AMINOACIDOS BÁSICOS NOMBRE ABREVIA TURA ESTRUCTURA Histidina His His Lisina Lis Lys Arginina Arg Arg
13 13 Aminoácidos Esenciales Los aminoácidos esenciales (son 10) el cuerpo humano no los sintetiza y por lo tanto deben ser parte esencial de nuestra alimentación cotidiana. La ausencia de uno de estos aminoácidos esenciales impide la formación de la proteína que lo contiene. VALINA LEUCINA METIONINA ISOLEUCINA ADULTOS FENILALANINA LISINA TREONINA TRIPTOFANO SOLO NIÑOS ARGININA HISTIDINA Va Le Me Iso Fe Lis Tre Tri
14 14 Aminoácidos no esenciales Son aquellos que nuestro organismo puede sintetizar o formar y por lo tanto no es imprescindible obtenerlos de los alimentos.
15 15 Deficiencia de aminoácidos algunos alimentos FUENTE DE ALIMENTO Huevos, leche, carne, pescado, pollo Trigo, arroz, avena Maíz Frijoles Arvejas Almendras y nueces Soya AMINOACIDOS FALTANTE Ninguno Lisina Lisina y Triptófano Metionina, triptófano metionina Lisina y triptófano Baja en metionina
16 16 ISOMERIA OPTICA: Formas D y L Todos los aminoácidos son ópticamente activos (a excepción de la glicina) y pueden existir en formas enantiomerismo D o L. El compuesto de referencia para asignar la configuración es el gliceraldehido. El grupo amino del aminoácido toma el lugar del grupo hidroxilo del gliceraldehido. Los azucares naturales pertenecen a la serie D en tanto todas las proteínas animales y vegetales que se conocen se componen completamente de aminoácidos L.
17 17 CONFIGURACION D Y L L- D- L-GLICERALDEHIDO D-GLICERALDEHIDO L- AMINOACIDO D- AMINOACIDO
18 18 PROPIEDADES FISICAS Los aminoácidos son sólidos cristalinos, incoloros, no volátiles, que se funden con descomposición a temperaturas superiores a 200 C. Son solubles en agua e insolubles en disolventes orgánicos no polares.
19 19 COMPORTAMIENTO ANFOLITO Ionización de aminoácidos A los aminoácidos en estado sólido o en solución neutra se les asigna una estructura iónica dipolar (denominada sal interna o zwitterion). Como los aminoácidos contienen grupos ácidos (-COOH) y básicos (-NH 2 ) en la misma molécula, ocurre una reacción de neutralización intramolecular, la cual conduce a la formación de una sal.
20 20 Ionización de aminoácidos ph MENOR pi (ph ACIDO para el a.a.) ph IGUAL a pi (ph NEUTRO para el a.a.) ph MAYOR pi (ph BASICO para el a.a.) Cambio en la [H + ] [H + ] aumenta Sin cambio [H + ] disminuye GRUPO CARBOXILICO -COOH -COO - -COO - GRUPO AMINO -NH 3 + -NH 3 + -NH 2 CARGA GLOBAL
21 21 ph Isoeléctrico (pi) Es ph al cual el aminoácido existe como como sal interna o zwitterión con una carga neta de cero y no muestra tendencia a migrar a algún electrodo. Cada aminoácido posee su propio ph isoeléctrico característico. AMINOACIDOS ph isoeléctrico NEUTROS ACIDOS BASICOS
22 Comportamiento acido base de los aminoácidos FORMA CATIONICA A valores de ph inferiores al ph isoeléctrico FORMA DE SAL interna en el ph isoeléctrico FORMA ANIONICA A valores de ph superiores al ph isoeléctrico SE MOVERA AL ELECTRODO NEGATIVO CATODO NO SE MOVERA SE MOVERA AL ELECTRODO POSITIVO ANODO
23 Ejercicio A. B. C. El ph isoeléctrico de la alanina es 6. Cuál de las estructuras corresponde a la Alanina? 1. En su ph Isoeléctrico 2. A un ph menor su ph isoeléctrico 3. A un ph mayor a su ph isoeléctrico
24 2. La Cisteína tiene un pi de 5.1,. Cuál de las estructuras corresponde a la Cisteína? A. B. C. 1. En su ph Isoeléctrico 2. A un ph menor su ph isoeléctrico 3. A un ph mayor a su ph isoeléctrico
25 25 FORMACION DE ENLACES PEPTIDICOS En 1902 Emil Fischer propuso que las proteínas son largas cadenas de aminoácidos unidas entre si por enlaces amida entre el α-carboxilo de un aminoácido y el grupo α amino de otro. Fischer propuso el nombre de enlace peptidico, para estos enlaces. No. de aminoácidos NOMBRE 2 DIPEPTIDO 3 TRIPEPTIDO 4 TRETAPEPTIDO 5 a 35 POLIPEPTIDO
26 FORMACION DEL ENLACE PEPTIDICO Aminoácido 1 H 2 O Aminoácido 2 Dipeptido
27 En un péptido el primer aminoácido se le llama aminoácido N-terminal y al ultimo aminoácido se le llaman aminoácido C-terminal En la formación de este tetrapeptido se liberaron 3 moléculas de agua, y posee 3 enlaces peptídicos El grupo N-terminal es la Alanina y el grupo C terminal es la Metionina
28 28 EJEMPLO Cuantos aminoácidos forman este péptido?: Cuántas moléculas de H 2 O se liberaron?: Qué aminoácido es el N-terminal? Qué aminoácido es el C-terminal?:
29 29 PEPTIDOS DE IMPORTANCIA BIOLOGICA (GLUTATION, VASOPRESINA Y OXITOCINA GLUTATION El glutatión (GSH) es un tripéptido que esta formado de los aminoácidos: Ácido glutámico, cisteína, y glicina PEPTIDO GLUTATION SECUENCIA H 2 N-Glu-Cis-Gli-COOH Contiene un enlace péptidico inusual entre el grupo amino de la cisteína y el grupo carboxilo de la cadena lateral del acido glutámico
30 30 Acido glutamico Cisteina Glicina El glutatión, un antioxidante, ayuda a proteger las células de especies reactivas de oxígeno como los radicales libres y los peróxidos. Es utilizado por las células para deshacerse de sustancias toxicas, regular las funciones del sistema inmunológico, inhibe la replicación de virus.
31 31 Alimentos que contiene glutatión Espárragos, Espinacas, Brócoli, Ajo, Repollo, Cebollas, Berros Coles de Bruselas. Algunas especias como el comino y la canela En menos cantidad: Melón, Aguacate, Toronja, Duraznos, Naranjas, Nueces, Granola, Pavo Pollo.
32 VASOPRESINA Y OXITOCINA 32 PEPTIDO VASOPRESINA OXITOCINA SECUENCIA H 2 N-Cis-Tir-Fen-Gln-Asn-Cis-Pro-Arg-Gli- COOH S-S H 2 N-Cis-Tir-Ile-Gln-Asn-Cis-Pro-Leu-Gli- COOH S-S VASOPRESINA OXITOCINA
33 33 VASOPRESINA También llamada hormona antidiurética La excreta de agua desde los riñones es gracias a la vasopresina, que recibe se nombre de esta importante función como regulador homeostático de los fluidos. Niveles altos de vasopresina provocan mayor retención renal de agua, elimina solo la suficiente para eliminar los productos de desecho.
34 34 OXITOCINA Fue la primera hormona sintetizada en el laboratorio La hormona responsable del amor (de ser:felices, amables, compasivos) Es una hormona relacionada con los patrones sexuales y con la conducta maternal y paternal que actúa también como neurotransmisor en el cerebro. Estimula la contracción del útero durante el parto y la liberación de leche. Controla el crecimiento y actividad reproductiva de los ovarios y testículos. El nivel de oxitócina en la mujer aumenta al final del parto y durante la lactancia.
35 PROTEINAS SEMANA 30
36 PROTEÍNAS Las proteínas son macromoléculas biológicas, formadas de polímeros lineales de aminoácidos, de dimensión variable. Además de Carbono, Hidrógeno, Oxígeno todas las proteínas contienen Nitrógeno. Y pueden estar constituidas por Azufre, Fosforo y trazas de otros elementos.
37 CLASIFICACION Las proteínas se pueden clasificar por su : SIMPLES COMPOSICION CONJUGADAS FUNCION BIOLOGICA
38 COMPOSICION S I M P L E S ALBUMINAS GLOBULINAS HISTONAS ESCLERO- PROTEINAS El grupo mas común e importante de las proteínas simples. Como la albumina y la seroalbumina. Son solubles en agua, soluciones salinas diluidas. Anticuerpos en el suero sanguíneo y como fibrinógeno sanguíneo. Son proteínas básicas, ya que contienen aminoácidos básicos (lisina y/o arginina). Se hallan asociadas con los ácidos nucleídos en las nucleoproteínas de la célula. Tienen funciones estructurales y de protección. La queratina (pelo, piel y uñas), el colágeno (huesos, tendones, y cartílagos) y la elastina (fibras elásticas y tejido conectivo) son algunos ejemplos.
39 CONJUGADAS Formadas por aminoácidos y por un compuesto no péptico. La porción polipeptídica se denomina apoproteina y la parte no proteica se denomina grupo prostético. C O N J U G A D A S GLUCOPROTEINAS CROMOPROTEINAS LIPOPROTEINAS METALOPROTEINAS NUCLEOPROTEINAS FOSFOPROTEINAS Proteínas con unidades de azúcar, ( ejemplogamaglobulina). Con una unidad hemo como la hemoglobina y mioglobina Proteínas que llevan moléculas de lípidos, incluyendo el colesterol. Proteínas que incorporan un ion metalico, como el caso de muchas enzimas. Proteínas unidas a acidos nucleicos como los ribosomas Proteínas con un esterfosfato, la caseína es un ejemplo
40 F U N C I O N B I O L O G I C A ENZIMAS CONTRACTIL HORMONAL PROTECTORAS ALMACENAMIENTO TRANSPORTE ESTRUCTURAL Catalizan las reacciones bioquímicas en las células. Ejemplos: TRIPSINA cataliza la hidrólisis de las proteinas y la SACARASA la hidrólisis de la sacarosa MIOSINA y la ACTINA. Responsables de la contracción muscular Regulan el metabolismo corporal. Como la HORMONA DEL CRECIMIENTO, que regula el crecimiento y la INSULINA regula el nivel de glucosa en la sangre Ayudan al cuerpo a defenderse, como las INMUNOGLOBULINAS y el FIBRINÓGENO. Almacenan los nutrientes que se necesitara posteriormente. La CASEÍNA almacena las proteínas de la leche y la FERRITINA almacena hierro en el hígado y bazo Transportan sustancias de un lugar a otro como la HEMOGLOBINA transporta oxigeno y las LIPOPROTEINAS transportan lipidos Mantienen unida una estructura del cuerpo, como el COLÁGENO forma tendones y cartilagos. QUERATINA que forma cabello, piel, uñas y lana.
41 NIVELES ESTRUCTURALES DE LAS PROTEINAS Las proteínas presentan estructuras: Primaria Secundaria Terciaria Cuaternaria
42 ESTRUCTURA PRIMARIA Se refiere al número y secuencia lineal de aminoácidos en una cadena polipeptidica de la terminal N a la terminal C.
43 ESTRUCTURA SECUNDARIA Se origina cuando los aminoácidos que la forman se unen entre si mediante enlaces de hidrógeno o con otra cadena polipeptidica. Los tres tipos de estructura secundaria son: a-hélice hoja plegada b, triple hélice.
44 HELICE ALFA (Helice a) La cadena polipeptídica adquiere una estructura helicoidal, como un cabe enrollado en espiral. La espiral se estabiliza mediante enlaces de hidrógeno formados entre los grupos N-H y los átomos de oxigeno de los grupos C=O de aminoácidos bastante alejados entre si que se halla en la siguiente vuelta de la hélice. Cada vuelta de la espiral se compone de aproximadamente de 4 unidades de aminoácidos y las cadenas laterales de estas unidades se proyectan hacia el exterior del esqueleto.
45
46 Hoja plegada beta (Hoja plegada b) Estructura secundaria en capas de la proteína estabilizadas por puentes de hidrógeno de lado a lado entre enlaces peptidico ubicados en diferentes cadenas o partes de una cadena. Laminas con plegado β.
47 Triple Hélice Estructura constituida por tres cadenas polipeptídica que se enrollan entre si que se mantienen unidas mediante puentes de hidrógeno. Esta estructura es típica del colágeno.
48 ESTRUCTURA TERCIARIA La estructura terciaria comprende atracciones y repulsiones entre los grupos R de los aminoácidos en la cadena polipeptídica. A medida que se producen interacciones entre diferentes parte de la cadena estos segmentos se doblan adquiriendo una forma tridimensional especifica. La estructura terciaria se estabiliza por fuerzas covalentes y no covalente. El enlace covalente común de cadena lateral capaz de mantener unidas entre si regiones remotas de las proteínas es el enlace disulfuro, que se forma entre 2 residuos de cisteína..
49 Los grupos SH de dos cisteínas se oxidan para formar un enlace covalente o puente de disulfuro También encontramos: TIPOS DE INTERACCIONES Interacciones hidrofóbicas Interacciones hidrofílicas Puentes salinos Enlaces de hidrógeno o puente de hidrógeno Puentes disulfuro NATURALEZA DEL ENLACE Atracciones entre grupos no polares Atracciones entre grupos polares o ionizados y el agua en la superficie de la estructura terciaria. Interacciones iónicas entre aminoácidos ácidos y básicos ionizados Interacciones entre H y O o H y N Enlaces covalentes fuertes entre los átomos de azufre de 2 cisteínas
50
51 ESTRUCTURA CUATERNARIA La estructura cuaternaria se da cuando varias cadena polipeptídicas llamadas subunidades se enlazan para formar un complejo mas grande. En la estructura cuaternaria las subunidades se mantienen unidas mediante las mismas interacciones que estabilizan sus estructuras. terciarias.
52 NIVELES ESTRUCTURALES Las proteínas se componen en niveles estructurales a)primario, b) SECUNDARIO, c) TERCIARIO, d) CUATERNARIO
53 DESNATURALIZACION Es todo cambio que altere la configuración de las estructuras secundaria, terciaria y cuaternaria de una proteínas, sin causar una ruptura de los enlaces peptídicos. Produciendo cambios drásticos en la naturaleza física y bioquímica de las moléculas.
54 La desnaturalización puede ser causada por: CALOR: Rompe los enlaces de hidrógeno y las interacciones hidrofóbicas entre grupos R no polares. Provoca la coagulación de la proteína. Ejemplo: ebullición de un huevo, freír un huevo. Las proteínas desnaturalizadas son digeridas con mas facilidad por las enzimas.
55 SOLVENTES (Alcohol etílico e isopropilico) Estos solventes pueden destruir los enlaces de hidrógeno intermoleculares de la molécula. Altera las interacciones hidrofóbicas Al formar sus propios enlaces por puente de hidrógeno con una proteína y alterar el enlace por puente de hidrógeno intramolecular de la cadena lateral. Ejemplo : una solución de alcohol al 70% para limpiar la superficie de la piel antes de una inyección. El alcohol desnaturaliza las proteínas de toda bacteria presente en el área de la inyección.
56 Cambios de ph Los reactivos ácidos y básicos cambian el ph rompiendo los enlaces por puente de hidrógeno entre grupos R polare y altera los enlaces iónicos (puentes salinos). Alteran el estado de ionización de los grupos carboxílicos y amino provocando la coagulación de la proteína.
57 Metales Pesados Ag +,Hg +2, Pb +2 Desnaturalizan proteínas al formar enlaces con grupos R iónicos o reaccionar con enlaces por puente disulfuro ( S - S ) mediante la formación de enlaces ionicos. Los cationes de estos metales pesados forman enlaces muy fuertes con los aniones carboxilato de los aminoácidos ácidos y con los grupos sulfhidrilo de los aminoácidos que contienen azufre. La proteína precipita de la solución insoluble metal-proteína. como sal
58 Agitación La acción de batir estira las cadenas polipeptídica hasta que se interrumpen las interacciones estabilizadoras. Son alterados los puentes de hidrógeno e interacciones hidrofóbicas.
59 Desnaturalización del cabello La queratina es la proteína del cabello y esta posee una gran proporción de aminoácidos que contienen azufre y la forma del cabello debe en gran parte a los enlaces disulfuro.
60 COLAGENO Proteína mas abundante en el cuerpo humano. Formado 3 polipéptidos y cada uno contiene los aminoacidos: glicina (33%), alanina (12%), prolina (22%) y cantidades menores de hidroxiprolina e hidroxilisina estos últimos 2 contiene grupos OH que forman enlaces de hidrógeno entre las cadenas laterales y fortalecen la estructura de triple hélice del colágeno. Los 3 polipeptídos se entretejen como una trenza, cuando muchas hélices triples se enredan, forman las fibrillas que constituyen los tejidos conectivos y tendones.
61 En sus variantes, el colágeno contribuye a la piel, huesos, dientes, ligamentos, cartílago y tendones que cubren soportan y mantienen unidos. En una persona joven el colágeno es elástico. Conforme la persona envejece, entre las fibrillas se forman entrecruzamientos adicionales, lo que hace al colágeno menos elástico. Los tendones se hacen quebradizos y en la piel se ven arrugas.
62 La gelatina se obtiene al convertir el colágeno de huesos, ligamentos, cartílago y tendones en un proceso de seis etapas de lavado y depuración que culminan en la obtención de un producto deshidratado de color amarillo pálido,
63 INSULINA 63 Es una hormona polipeptídica producida y secretada por las células beta de los islotes de Langerhans del páncreas formada de 51 aminoácidos, divididos en dos cadenas. La cadena "A" tiene 21 aminoácidos, y la cadena "B" tiene 30. CADEN A A B SECUENCIA Gli-Ile-Val-Gln-Gli-Cis-Cis-Ala-Ser-Val-Cis-Ser-Leu-Tir- Gli-Leu-Gln-Asn-Tir-Cis-Asn Fen-Val-Asn-Gli-His-Leu-Cis-Gli-Ser-His-Leu-Val-Gln-Ala- Leu-Tir-Leu-Val-Cis-Gli-Gln-Arg-Gli-Fen-Fen-Tir-Tre-Pro- Lis-Ala
64 64 Las dos cadenas están unidas por un puente disulfuro entre los aminoácidos número 20 de la "A" (cisteína) con el 19 de la "B" también cisteína, y otro puente disulfuro entre los aminoácidos cisteína y cisteína del número 7 de ambas cadenas ( 7 con 7). Un puente disulfuro independiente, une al aminoácido 6 (cisteína) con el 11 (cisteína) de la cadena "A".
65 MIOGLOBINA La mioglobina es una hemoproteina muscular, estructuralmente y funcionalmente muy parecida a la hemoglobina, es una proteína relativamente pequeña constituida por una cadena polipeptidica de 153 aminoácidos que contiene un grupo hemo con un átomo de hierro, y cuya función es la de almacenar oxígeno en el musculo. También se denomina miohemoglobina o hemoglobina muscular.
66 La mioglobina es el principal pigmento de la carne, y el color de este producto depende fundamentalmente del estado en el que se encuentra la mioglobina.
67 HEMOGLOBINA La hemoglobina se encuentra exclusivamente en las células rojas de la sangre, en donde su principal función es transportar al oxígeno desde los pulmones hasta los capilares en los tejidos, así como puede transportar CO 2 desde los tejidos hasta los pulmones. La hemoglobina A, la principal en los adultos, está compuesta de cuatro cadenas polipeptídica (dos cadenas alfa y dos beta) que se mantienen unidas por medio de interacciones no covalentes
68 ENZIMAS Las enzimas son proteínas que catalizan reacciones biológicas. Una reacción catalizada por enzimas tiene muchas ventajas respecto a una reacción no catalizada o una con un catalizador no enzimático. El nombre de una enzima termina con el sufijo asa. Pero muchas enzimas conservaron sus nombres comunes, como la enzima estomacal pepsina, y las enzimas intestinales tripsina y quimotripsina.
69 SITIO ACTIVO: Porción funcional de una enzima. Donde los sustratos se unen con la enzima y se produce la reacción. SUSTRATO O REACTIVO: Moléculas o iones sobre los que trabaja una enzima
70 Algunas enzimas con nombres comunes ENZIMA RENINA BROMELINA PEPSINA ESTREPTOCINASA PAPAINA USO TIPICO Coagulación de la leche para hacer queso Ablandamiento de carnes Inicia la digestión de proteínas en el estomago Disuelve coágulos sanguíneos Ablandamiento de carnes y evita la sedimentación en las cervezas
71 Enzimas Séricas usadas en el Dx de daño a tejido ENZIMA Alanina transaminasas (ALT) Creatina-quinasa (CK) Lactato Deshidrogenasa (LDH) Aspartato transaminasa (AST) Fosfatasa alcalina (ALP) Fosfatasa acida (ACP) Antígeno prostático especifico (PSA) Amilasa pancreática, (PA) Colinesterasa (CE) Lipasa (LPS) ELEVADAS EN Hepatitis Infarto al corazón Infarto cardiaco Enfermedad hepática (cirrosis, hepatitis) Carcinoma hepático o enfermedad ósea (raquitismo) Cáncer de próstata Enfermedad pancreática
72 CLASIFICACION Comisión Internacional de Bioquímica CLASE REACCION CATALIZADA EJEMPLOS OXIDO-REDUCTASAS TRANSFERASAS HIDROLASAS Reacciones de oxidación-reducción Transferencia de un grupo entre 2 compuestos Reacciones de hidrólisis Las oxidasas oxida, las reductasas reducen, las deshidrogenasas eliminan a 2 H para formar un doble enlace Las transaminasas transfiere grupos amino, las quinasas transfieren grupos fosfato Las proteasas hidrolizan enlaces peptidicos Las lipasas hidroliza los enlaces de tipo ester en los lípidos Las carbohidrasas enlaces glucosídico de los carbohidratos. Las fosfatasas hidrolizan los enlaces tipo ester fofórico Las nucleasas hidroliza ácidos nucléicos
73 LIASAS CLASE ISOMERASAS REACCION CATALIZADA Adición o eliminación de grupos a un doble enlace sin hidrolisis Reorganización de los átomos de una molécula formar un isómero EJEMPLOS Las carboxilasas añaden CO 2 Las desaminasas eliminan NH 3 Las isomerasas convierten las formas cis en trans o a la inversa, Las epimerasas convierten isómeros D en L y viceversa LIGASAS Forman enlaces entre las moléculas empleando la energía del ATP Las sintetasas enlazan 2 moléculas
74 ANEMIA FALCIFORME o Drepanocitica Es una enfermedad genética en donde en lugar de un acido glutámico de la subunidad β-heglobina aparece una valina. Los glóbulos rojos cambian su forma normal por una forma aplastada como de una hoz.
75 Fin
AMINOACIDOS Y PEPTIDOS. SEMANA 29 Licda. Lilian Judith Guzmán Melgar
 AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
CLASIFICACIÓN SEGÚN SU POLARIDAD NO POLARES POLARES NEUTROS ACIDOS BASICOS
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
28 A 32. HOJA DE TRABAJO 5o. BLOQUE. Licda. Lilian Judith Guzmán Melgar
 HOJA DE TRABAJO 5o. BLOQUE Licda. Lilian Judith Guzmán Melgar 2016 28 A 32 1. En La siguiente estructura señale lo que se le solicita: a) Colina b) Glicerol c) Acido graso d) Enlace esterfosfato 2. Cuales
HOJA DE TRABAJO 5o. BLOQUE Licda. Lilian Judith Guzmán Melgar 2016 28 A 32 1. En La siguiente estructura señale lo que se le solicita: a) Colina b) Glicerol c) Acido graso d) Enlace esterfosfato 2. Cuales
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS
 TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA
 BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Metabolismo de AMINOÁCIDOS
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Metabolismo de AMINOÁCIDOS Dr. Mynor A. Leiva Enríquez Fuente:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Metabolismo de AMINOÁCIDOS Dr. Mynor A. Leiva Enríquez Fuente:
Tema 3. Tema 3. Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos. Péptidos
 Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Holoproteínas (sólo contienen aa)
 TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
AMINOÁCIDOS, PÉPTIDOS Y PROTEINAS. M.Sc. GABY MÓNICA FELIPE BRAVO
 AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS.
 REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
Tema 5: aminoácidos y proteínas
 1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
Tema I: Biomoléculas
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
Lehninger Principles of Biochemistry Fourth Edition
 David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Aminoácidos. Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas
 Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo.
 1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
Proteínas. Tabla 1: Funciones de las proteínas
 Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
Estructura tridimensional de las proteínas
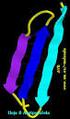 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS COMPOSICIÓN ALIMENTO VOLATIL POR SECADO (AGUA o HUMEDAD) MATERIA SECA ORGANICA INORGANICA (CENIZAS) SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO
QUÍMICA DE PROTEÍNAS COMPOSICIÓN ALIMENTO VOLATIL POR SECADO (AGUA o HUMEDAD) MATERIA SECA ORGANICA INORGANICA (CENIZAS) SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO
Introducción al estudio de las proteínas
 Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Metabolismo y uso de Proteínas. Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica
 Metabolismo y uso de Proteínas Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica Metabolismo de las Proteínas Funciones en el organismo 1. Constituyen
Metabolismo y uso de Proteínas Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica Metabolismo de las Proteínas Funciones en el organismo 1. Constituyen
Clasificación de las proteinas según su conformación
 lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
I) Biomoléculas 5) Proteínas I-5 PROTEÍNAS
 I-5 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-5 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas.
 Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas. Los aminoácidos se clasifican en unas pocas categorías diferenciadas, basadas sobre todo en su solubilidad
Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas. Los aminoácidos se clasifican en unas pocas categorías diferenciadas, basadas sobre todo en su solubilidad
PROTEÍNAS. Las proteínas están constituidas por la unión de numerosas moléculas sencillas (monómeros) denominados aminoácidos.
 PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
FISIOLOGÍA GENERAL Jesús Merino Pérez y María José Noriega Borge
 BIOMOLÉCULAS. PROTEÍNAS BIOMOLÉCULAS Los bioelementos se unen para formar biomoléculas, también denominadas principios inmediatos. En los seres vivos las moléculas se caracterizan por presentar una gran
BIOMOLÉCULAS. PROTEÍNAS BIOMOLÉCULAS Los bioelementos se unen para formar biomoléculas, también denominadas principios inmediatos. En los seres vivos las moléculas se caracterizan por presentar una gran
Biomoléculas orgánicas: Proteínas y Ácidos nucleicos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Proteínas. Fabrizio Marcillo Morla MBA. (593-9)
 Proteínas Fabrizio Marcillo Morla MBA barcillo@gmail.com (593-9) 4194239 Otras Publicaciones del mismo autor en Repositorio ESPOL Fabrizio Marcillo Morla Guayaquil, 1966. BSc. Acuicultura. (ESPOL 1991).
Proteínas Fabrizio Marcillo Morla MBA barcillo@gmail.com (593-9) 4194239 Otras Publicaciones del mismo autor en Repositorio ESPOL Fabrizio Marcillo Morla Guayaquil, 1966. BSc. Acuicultura. (ESPOL 1991).
BIOQUIMICA Y FISIOLOGÍA MICROBIANA. Dra. Yenizey Merit Alvarez Cisneros
 BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA
 Rol de los Aminoácidos en el Cultivo de Vid XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA 2011 La Molina, 06 y 07 de Julio, 2011 Ing. M.Sc. Federico Ramírez D. Gerente Técnico Aminoácidos Las plantas
Rol de los Aminoácidos en el Cultivo de Vid XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA 2011 La Molina, 06 y 07 de Julio, 2011 Ing. M.Sc. Federico Ramírez D. Gerente Técnico Aminoácidos Las plantas
Universidad Nacional de la Patagonia San Juan Bosco Facultad de Ciencias Naturales Química Biológica Introducción
 Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
AMINOÁCIDOS Y PÉPTIDOS
 TEMA 4 AMINOÁCIDOS Y PÉPTIDOS 1. Estructura y clasificación de los aminoácidos. 2. Propiedades ácido-base de los aminoácidos y péptidos 3. El enlace peptídico 4. Péptidos: hidrólisis y secuenciación 1.
TEMA 4 AMINOÁCIDOS Y PÉPTIDOS 1. Estructura y clasificación de los aminoácidos. 2. Propiedades ácido-base de los aminoácidos y péptidos 3. El enlace peptídico 4. Péptidos: hidrólisis y secuenciación 1.
Agua, carbohidratos y Lípidos
 Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Las proteínas de la dieta tras ser digeridas proporcionan los aminoácidos que utilizaremos para la síntesis de proteínas endógenas, para:
 1 CONCEPTO Las proteínas son moléculas orgánicas formadas por largas cadenas lineales, no ramificadas, de más de 70 aminoácidos (monómeros o unidades que conforman las proteínas) unidos por enlaces peptídicos.
1 CONCEPTO Las proteínas son moléculas orgánicas formadas por largas cadenas lineales, no ramificadas, de más de 70 aminoácidos (monómeros o unidades que conforman las proteínas) unidos por enlaces peptídicos.
TEORIA CELULAR. En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS
 TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares.
 Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
3. AMINOACIDOS. PROPIEDADES ACIDO-BASE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 3. AMINOACIDOS. PROPIEDADES ACIDO-BASE ESQUEMA - Aminoácidos. Definición, funciones y clasificación - Tipos de aminoácidos: aminoácidos
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 3. AMINOACIDOS. PROPIEDADES ACIDO-BASE ESQUEMA - Aminoácidos. Definición, funciones y clasificación - Tipos de aminoácidos: aminoácidos
Composición química de la materia viva. Componentes orgánicos. Proteínas
 Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
Proteínas fibrosas. Alfa Queratinas Beta-Queratinas Fibroína Colágeno Elastina
 Proteínas Fibrosas La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje Las proteínas fibrosas son generalmente fuertes mecánicamente Son generalmente insolubles Generalmente
Proteínas Fibrosas La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje Las proteínas fibrosas son generalmente fuertes mecánicamente Son generalmente insolubles Generalmente
Digestión y absorción de PROTEÍNAS. Marijose Artolozaga Sustacha, MSc
 Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
BIOMOLÉCULAS. Son moléculas fundamentales para la constitución y funcionamiento de todo ser vivo. Se clasifican en dos grupos:
 FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
GUIA DE ESTUDIO Nº 9: Aminoácidos, Proteínas y Enzimas
 GUIA DE ESTUDIO Nº 9: Aminoácidos, Proteínas y Enzimas I.- Conceptos básicos: Aminoácidos: Estructura y propiedades ácido base de los aminoácidos. Clasificación según su polaridad. Capacidad buffer. El
GUIA DE ESTUDIO Nº 9: Aminoácidos, Proteínas y Enzimas I.- Conceptos básicos: Aminoácidos: Estructura y propiedades ácido base de los aminoácidos. Clasificación según su polaridad. Capacidad buffer. El
AMINOACIDOS Y PROTEÍNAS
 AMINOACIDOS Y PROTEÍNAS I. OBJETIVO. Reconocer aminoácidos y proteínas a nivel de laboratorio. Analizar el tipo de estructura de los aminoácidos. II. FUNDAMENTO TEORICO. AMINOACIDOS: Cualquiera de los
AMINOACIDOS Y PROTEÍNAS I. OBJETIVO. Reconocer aminoácidos y proteínas a nivel de laboratorio. Analizar el tipo de estructura de los aminoácidos. II. FUNDAMENTO TEORICO. AMINOACIDOS: Cualquiera de los
Pagina casos de estudios:
 Libros para consulta de alumnos en el Área de Biología La Célula. De Coopers Biología Celular y Molecular G. Karp Becker.El mundo de la Célula 6Ed. Editorial Pearson Education. Alberts/Bray/Hopkin/Johnson/Lewis/Raff/Roberts/Walter.
Libros para consulta de alumnos en el Área de Biología La Célula. De Coopers Biología Celular y Molecular G. Karp Becker.El mundo de la Célula 6Ed. Editorial Pearson Education. Alberts/Bray/Hopkin/Johnson/Lewis/Raff/Roberts/Walter.
Bases Químicas de la Vida II
 Bases Químicas de la Vida II Macromoléculas Moléculas de gran tamaño formadas de unidades variadas de compuestos hechos a base de esqueletos del elemento carbono. A estos compuestos con esqueletos a base
Bases Químicas de la Vida II Macromoléculas Moléculas de gran tamaño formadas de unidades variadas de compuestos hechos a base de esqueletos del elemento carbono. A estos compuestos con esqueletos a base
1.- CONCEPTO DE ENZIMA
 ENZIMAS 1.- CONCEPTO DE ENZIMA Los enzimas son catalizadores muy potentes y eficaces, Químicamente son proteínas Actúan en pequeña cantidad y se recuperan indefinidamente No llevan a cabo reacciones energéticamente
ENZIMAS 1.- CONCEPTO DE ENZIMA Los enzimas son catalizadores muy potentes y eficaces, Químicamente son proteínas Actúan en pequeña cantidad y se recuperan indefinidamente No llevan a cabo reacciones energéticamente
Biología General y Metodología de las Ciencias 2016 BIOMOLÉCULAS
 BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
Proteínas. Cual es la gracia? KEVLAR. polímeros biológicos es su versatilidad para formar una gran variedad estructuras con funciones especializadas.
 Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Digestión y absorción de PROTEÍNAS. Marijose Artolozaga Sustacha, MSc
 Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
PROTEÍNAS 1. PROTEÍNAS 2. ENZIMAS 1. PROTEÍNAS
 PROTEÍNAS 1. PROTEÍNAS Introducción Aminoácidos Estructura tridimensional de las proteínas Proteínas conjugadas Propiedades Funciones 2. ENZIMAS Introducción Estructura Clasificación Mecanismo de acción
PROTEÍNAS 1. PROTEÍNAS Introducción Aminoácidos Estructura tridimensional de las proteínas Proteínas conjugadas Propiedades Funciones 2. ENZIMAS Introducción Estructura Clasificación Mecanismo de acción
5.1. CONCEPTO E IMPORTANCIA BIOLÓGICA DE LAS PROTEÍNAS
 5. PROTEINAS 5.1. CONCEPTO E IMPORTANCIA BIOLÓGICA DE LAS PROTEÍNAS Una proteína es un polipéptido formado por más de 50 aminoácidos. Los polipéptidos son polímeros de aminoácidos, unidos mediante enlaces
5. PROTEINAS 5.1. CONCEPTO E IMPORTANCIA BIOLÓGICA DE LAS PROTEÍNAS Una proteína es un polipéptido formado por más de 50 aminoácidos. Los polipéptidos son polímeros de aminoácidos, unidos mediante enlaces
Biomoléculas orgánicas: Carbohidratos y Lípidos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Metodologías básicas del procesamiento de Proteinas
 Metodologías básicas del procesamiento de Proteinas Alejandra Kun Departamento de Proteínas y Ácidos Nucleicos-IIBCE Unidad Asociada Sección Bioquímica Facultad de Ciencias 13 de octubre 2014 Curso Introducción
Metodologías básicas del procesamiento de Proteinas Alejandra Kun Departamento de Proteínas y Ácidos Nucleicos-IIBCE Unidad Asociada Sección Bioquímica Facultad de Ciencias 13 de octubre 2014 Curso Introducción
I) Biomoléculas 6) Proteínas I-6 PROTEÍNAS
 I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Polímero corto Monómero. síntesis. degradación
 Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
NUTRICION QUÉ SON LOS NUTRIENTES O NUTRIMENTOS?
 NUTRICION QUÉ SON LOS NUTRIENTES O NUTRIMENTOS? NUTRICION Los nutrientes son cualquier elemento o compuesto químico necesario para el metabolismo de un ser vivo. Es decir, los nutrientes son algunas de
NUTRICION QUÉ SON LOS NUTRIENTES O NUTRIMENTOS? NUTRICION Los nutrientes son cualquier elemento o compuesto químico necesario para el metabolismo de un ser vivo. Es decir, los nutrientes son algunas de
EL CONTROL DE LAS ACTIVIDADES CELULARES
 EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
EL CONTROL DE LAS ACTIVIDADES CELULARES LAS REACCIONES CELULARES BÁSICAS Todas las células llevan a cabo funciones vitales: Ingestión de nutrientes Eliminación de desperdicios Crecimiento Reproducción
- Las proteínas son esenciales para la formación y el mantenimiento de los tejidos corporales.
 TEMA 6. PROTEÍNAS - Las proteínas son esenciales para la formación y el mantenimiento de los tejidos corporales. - Los aa son los elementos estructurales de las proteínas. Las proteínas de plantas y animales
TEMA 6. PROTEÍNAS - Las proteínas son esenciales para la formación y el mantenimiento de los tejidos corporales. - Los aa son los elementos estructurales de las proteínas. Las proteínas de plantas y animales
Repaso Opción múltiple Macromoléculas Biológicas
 Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Estructura tridimensional de proteínas
 Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS AMINOÁCIDOS
 ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS Fabián Rodríguez Julio 2011 AMINOÁCIDOS Un aminoácido es una molécula orgánica que en su estructura contiene un grupo amino (NH 2 ) y un grupo carboxilo
ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS Fabián Rodríguez Julio 2011 AMINOÁCIDOS Un aminoácido es una molécula orgánica que en su estructura contiene un grupo amino (NH 2 ) y un grupo carboxilo
Síntesis de aminoácidos
 Síntesis de aminoácidos 2. Aminoácidos esenciales y no esenciales Los 20 aminoácidos son biológicamente imprescindibles o esenciales! Se llaman aá esenciales los que deben ser suministrados en la dieta
Síntesis de aminoácidos 2. Aminoácidos esenciales y no esenciales Los 20 aminoácidos son biológicamente imprescindibles o esenciales! Se llaman aá esenciales los que deben ser suministrados en la dieta
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS COMPOSICIÓN ALIMENTO VOLATIL POR SECADO (AGUA o HUMEDAD) MATERIA SECA ORGANICA INORGANICA (CENIZAS) SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO
QUÍMICA DE PROTEÍNAS COMPOSICIÓN ALIMENTO VOLATIL POR SECADO (AGUA o HUMEDAD) MATERIA SECA ORGANICA INORGANICA (CENIZAS) SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO
METABOLISMO DE AMINOACIDOS. Kinesiología 2011
 METABOLISMO DE AMINOACIDOS Kinesiología 2011 BALANCE NITROGENADO BN=Nitrógeno total ingerido Nitrógeno total excretado BN=0 existe equilibrio nitrogenado BN es negativo, cuando hay condiciones de síntesis
METABOLISMO DE AMINOACIDOS Kinesiología 2011 BALANCE NITROGENADO BN=Nitrógeno total ingerido Nitrógeno total excretado BN=0 existe equilibrio nitrogenado BN es negativo, cuando hay condiciones de síntesis
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Repaso: Química celular (biomoléculas)
 Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Generalidades de ENZIMAS
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 Generalidades de ENZIMAS Dr. Mynor Leiva 1 ENZIMAS Proteínas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 Generalidades de ENZIMAS Dr. Mynor Leiva 1 ENZIMAS Proteínas
CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO
 Alianza para el Aprendizaje de Ciencias y Matemáticas CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO GUÍA DEL MAESTRO ESTÁNDARES ATENDIDOS: 1. LA NATURALEZA
Alianza para el Aprendizaje de Ciencias y Matemáticas CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO GUÍA DEL MAESTRO ESTÁNDARES ATENDIDOS: 1. LA NATURALEZA
Componentes químicos de
 Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
QUÍMICA DE ALIMENTOS I Tarea 10: Las Proteínas en los alimentos. Agua (o humedad, si se conoce)*
 QUÍMICA DE ALIMENTOS I Tarea 10: Las Proteínas en los alimentos. Entregar el 21 de Mayo. Selecciona un alimento, de preferencia de los que consumes con regularidad, que contenga proteínas. 1. De acuerdo
QUÍMICA DE ALIMENTOS I Tarea 10: Las Proteínas en los alimentos. Entregar el 21 de Mayo. Selecciona un alimento, de preferencia de los que consumes con regularidad, que contenga proteínas. 1. De acuerdo
Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas
 Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas por miles, o millones de átomos. MACROMOLÉCULAS Son
Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas por miles, o millones de átomos. MACROMOLÉCULAS Son
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
METABOLISMO DE LIPIDOS
 METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
Aminoácidos y Proteínas
 Aminoácidos y Proteínas Un aminoácido es una pequeña molécula orgánica que contiene, al menos, un grupo amino (-NH 2), de naturaleza básica, y un grupo carboxilo (-COOH), de carácter ácido. Aunque los
Aminoácidos y Proteínas Un aminoácido es una pequeña molécula orgánica que contiene, al menos, un grupo amino (-NH 2), de naturaleza básica, y un grupo carboxilo (-COOH), de carácter ácido. Aunque los
METABOLISMO DEL NITRÓGENO
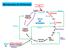 METABLISM DEL NITRÓGEN Descomposición por microorganismos Compuesto rgánicos Nitrogenados ANIMALES Desechos orgánicos Amonificación CICL DEL NITRÓGEN N 3 Nitrificación Nitrosomonas Nitrosación N 2 Nitratación
METABLISM DEL NITRÓGEN Descomposición por microorganismos Compuesto rgánicos Nitrogenados ANIMALES Desechos orgánicos Amonificación CICL DEL NITRÓGEN N 3 Nitrificación Nitrosomonas Nitrosación N 2 Nitratación
POR QUE ES TAN IMPORTANTE LA SUPLEMENTACIÓN?
 POR QUE ES TAN IMPORTANTE LA SUPLEMENTACIÓN? A continuación vamos hablar de uno de los principales suplementos a la hora de definir, como lo son Las Proteínas sus beneficios, y los diferentes tipos de
POR QUE ES TAN IMPORTANTE LA SUPLEMENTACIÓN? A continuación vamos hablar de uno de los principales suplementos a la hora de definir, como lo son Las Proteínas sus beneficios, y los diferentes tipos de
Cadena ramificada O CH3 CH2
 UIDAD Libro guía páginas 41 49 1LEIÓ 5 : De qué está hecha la célula? Biomoléculas orgánicas oncepto clave: Las moléculas a base de carbono son fundamentales para la vida. Los átomos de carbono tienen
UIDAD Libro guía páginas 41 49 1LEIÓ 5 : De qué está hecha la célula? Biomoléculas orgánicas oncepto clave: Las moléculas a base de carbono son fundamentales para la vida. Los átomos de carbono tienen
