III. Propiedades de las sustancias puras y simples compresibles. Unidad. PdV. La
|
|
|
- Inés Peralta Ponce
- hace 7 años
- Vistas:
Transcripción
1 Unidad III ropiedades de las sstanias pras y simples ompresibles El estado de n sistema errado en eqilibro se desriba a traés de los alores de las propiedades termodinámias. De la obseraión de mos sistemas termodinámios onoemos qe no todas las propiedades termodinámias son independientes na de otra, y el estado pede ser determinado úniamente por los alores de propiedades independientes. Los alores de todas las otras propiedades están determinados por los alores de este onjnto de propiedades independientes. Una regla general onoida omo prinipio de estado (postlado de estado) a sido desarrollada omo na gía para determinar la antidad de propiedades independientes neesarias para espeifiar el estado de n sistema. ara esta nidad, onsideraremos sistemas on masa y omposiión determinadas y qe no se en infleniados por moimiento algno ni ampos graitatorios. Basado en obseraiones empírias, se onlye qe ay na propiedad independiente por ada forma independiente qe el sistema tiene para ambiar s energía. Hemos menionado anteriormente qe la energía de n sistema errado pede ser alterada independientemente por alor y trabajo. Una propiedad independiente pede ser asoiada on la transferenia de alor y otra propiedad independiente pede ser añadida por ada forma releante de ambiar la energía por medio de trabajo. El término sistema simple es apliado a sistemas qe solamente tienen na forma de alterar signifiatiamente s energía por trabajo ando el sistema sfre n proeso en asieqilibrio. Esto india qe n sistema simple reqiere dos propiedades independientes para determinar s estado. El más importante de estos sistemas, y al qe le dediaremos gran parte de los análisis, son los sistemas simples ompresibles. ara estos sistemas, los ambios del olmen prooan ambios signifiatios en la energía del sistema. La únia forma de transferenia de energía por trabajo qe pede experimentar n sistema simple ompresible qe sfre n proeso en asieqilibrio está asoiado al ambio de olmen y está dado por dv. La inflenia del ampo graitatorio de la tierra se onsidera despreiable, y la presión niforme en todo el sistema. El modelo de sistema simple ompresible pede pareer my restritio, pero la prátia mestra qe pede emplearse en n amplio rango de
2 apliaiones de ingeniería anqe efetos elétrios, magnétios, de tensión sperfiial y otros estén presentes en algún grado. Si la temperatra, y otra propiedad intensia, omo el olmen espeífio,, son seleionadas omo ariables independientes, el prinipio de estado asegra qe la presión, la energía interna espeífia y todas las otras propiedades intensias peden ser determinadas omo fnión de y : (, ), (, ), y así on las otras. Dio de otra forma, el postlado de estado pede tilizarse omo la base para relaiones entre propiedades qe son difíiles de medir y propiedades qe son más fáiles de medir. fnional. Una sstania pra, simple ompresible, qe se ontrae al pasar de líqido a sólido, tiene na sperfiie omo mestra la figra (ay sstanias qe se expanden al pasar de líqido a sólido, Una sstania pra es aqella qe tiene solamente na omposiión qímia y esta es inariable. - Diagramas de fase. El prinipio de estado die qe para n sistema simple solamente se neesitan dos propiedades independientes para definir n estado, entones, al onoer los alores de estas dos propiedades qedan fijos los alores de todas las otras propiedades independientes. Así, podemos onsiderar a la temperatra,, y el olmen espeífio omo independientes, y la presión o alqier otra propiedad qedan definidas, (, ). Al grafiar esta relaión fnional entre estas tres propiedades obtenemos na sperfiie qe me india ál es el omportamiento de la sstania. Anqe ada sstania pra tiene n omportamiento similar, difieren en anto a los alores de las propiedades, así qe ada sstania tendrá s propia relaión estas tendrán n omportamiento distinto en la región de mezla líqido sólido). Se peden obserar tres regiones orrespondientes a las tres fases qe nos interesan, sólido, líqido y apor, y otras regiones orrespondientes a mezlas de estas tres fases, na araterístia de estas regiones de mezla es qe la presión y la temperatra no son independientes entre sí, por tanto el par presión y temperatra no definen n estado en estas regiones, pero si otro par omo la presión y el olmen espeífio, o la temperatra y la energía interna, esta araterístia ae qe las sperfiies de mezla de fases sean perpendilares al plano presión temperatra. ara omprender este diagrama imaginémonos n dispositio ilindro émbolo, el al ontiene iniialmente na sstania en fase
3 líqida (i), el émbolo pede moerse libremente sin ningna oposiión, de algna manera se le proporiona energía a la sstania (sistema), de forma qe ésta ambia de estado; omo el émbolo tiene libertad de moimiento la presión permanee onstante. El sistema, en ierto instante, llega a la frontera on la región de satraión (A) el proeso sige dentro de esta región donde el proeso a presión onstante también es a temperatra onstante. Llega lego a la otra ara simplifiar los análisis, es oneniente aostmbrarse a las diferentes istas del diagrama. Una de las proyeiones más tilizadas es la ista, la al mostramos a ontinaión, donde se an trazado el pnto rítio y la isoterma rítia, además del proeso frontera on la región de apor (B), ontinando la presión onstante y abandonando la tendenia a temperatra onstante, asta qe termina el proeso (f). odos los pntos de este proeso (desde i asta f), tienen la misma presión. Es este proeso desrito, la sstania ando está entre los pntos (i) y (A) es líqido omprimido (líqido sbenfriado), en el pnto (A) es líqido satrado, entre los pntos (A) y (B) es mezla líqido satrado apor satrado, en el pnto (B) es apor satrado, y entre los pntos (B) y (f) es apor sobrealentado.
4 desrito anteriormente. restemos atenión a la línea qe diide la regiones de mezla líqido apor y sólido apor, esta sesión de pntos son estados en los ales peden oexistir en eqilibrio las tres fases líqida sólida apor, y se le onoe omo línea triple. Otra ista es la, neamente se a trazado el pnto rítio, el proeso desrito anteriormente, además de la isobara rítia. La terera ista es la, donde las regiones de mezla las obseramos fsión, sblimaión y aporizaión, se en omo líneas y en las otras istas omo sperfiies. La informaión del omportamiento de las sstanias se da en diferentes formas, omo tablas, gráfios y eaiones, ada na de estas, tiene ss pros y ss ontras, por ejemplo, las tablas peden ser bastante preisas pero bastante extensas también, y por tanto difíiles de manejar, los gráfios son más ompatos qe las tablas pero on ma menos preisión, y las eaiones my apropiadas para programas de omptaión, pero ada región es desrita on eaiones distintas. O sea, qe forma de la informaión tilizar depende de ada aso, ál es la preisión qe se reqiere, qe tan repetitias son las búsqedas,.qe tan rápido ay qe dar el resltado, solo se reqiere na estimaión, et. omo líneas, la línea triple aqí se obsera omo n pnto qe se le llama pnto triple. El proeso a presión onstante qe emos desrito anteriormente se obsera omo na línea reta, donde los pntos (A) y (B) oiniden. Hay qe obserar qe se pede pasar de líqido a apor o ieersa sin pasar por la región de mezla, sino qe on n proeso qe pasa por enima del pnto rítio, en este tipo de proeso, el ambio sede palatinamente en todo el sistema a la ez y no se tiene apor y líqido en n mismo instante. Las regiones de - Uso de las tablas termodinámias. Hay tablas termodinámias ompletas para mas sstanias en todas ss fases, la estrtra de estas es similar a las presentadas en los libros de texto, on la únia diferenia de qe estas son n resmen de las tablas ompletas; para nestros propósitos de enseñanza aprendizaje es sfiiente la informaión presentada en los libros de texto. La organizaión de las tablas difiere dependiendo del libro qe se onslte, por ejemplo, en el libro ermodinámia (Wark iards), apareen las tablas para el aga, ropiedades del aga en satraión: tabla de temperatra, ropiedades del aga en satraión: tabla de presión, la informaión presentada en estas
5 tablas es la misma pero ordenadas, na de aerdo a la temperatra, otra en base a presión, la informaión presentada es las propiedades termodinámias de la línea de satraión emp., C res., bar ropiedades del aga en satraión: tabla de temperatra Volmen espeífio m /kg Energía interna Entalpía Líqido Vapor Líqido Vapor Líqido Eap. Sat. Sat Sat. Sat Sat. f x 10 fg g f g f Vapor Sat g Entropía kj/(kg K) Líqido Sat. s f Vapor Sat s g ropiedades del aga en satraión: tabla de presión emp., Volmen espeífio m /kg Energía interna Entalpía Entropía kj/(kg K) C Líqido Vapor Líqido Vapor Líqido Vapor Líqido Eap. Sat. Sat Sat. Sat Sat. Sat Sat. f x 10 g f g fg f g s f res., bar La informaión mostrada el la tabla de temperatras orresponde a los pntos de interepión entre algnas isotermas (100 C, 110 C,..., C) on las líneas de satraión, y en la tabla de presión orresponde a los pntos de interepión entre algnas isóbaras y las líneas de satraión. Los dos pntos de interepión de na isoterma on las líneas de satraión tienen también la misma presión, pero difieren en las otras propiedades. La presentaión de las propiedades en tablas, no es ontina, si no qe disreta, si obseramos la tabla ejemplo emos qe las temperatras an de 10 en 10 C, en otra porión de la tabla o en otras tablas el paso pede ser distinto, para alores de temperatra qe no apareen en la tabla, por ejemplo 1 C, se peden enontrar Vapor Sat s g los alores aproximados de las otras propiedades a traés de la interpolaión lineal. ara esto tomamos los pntos inmediato sperior e inmediato inferior y sponemos qe el omportamiento de las propiedades en ese tramo es lineal, spongamos qe la propiedad qe qeremos onoer es la energía interna del líqido satrado a 1 C, gráfiamente lo planteamos omo se mestra
6 En la eaión de la línea reta qe pasa por los pntos extremos sstitimos el alor de la temperatra a la qe deseamos la propiedad y despejamos la energía interna f1 (qe es la deseada) kJ / kg f C 1 C kJ / kg 546.0kJ / kg 140 C 10 C despejando obtenemos n alor para f1 de emp., C res., bar ropiedades del aga en satraión: tabla de temperatra Volmen espeífio m /kg Energía interna Entalpía Líqido Vapor Líqido Vapor Líqido Eap. Sat. Sat Sat. Sat Sat. f x 10 fg g f g f Vapor Sat g Entropía kj/(kg K) Líqido Sat. s f Vapor Sat s g De la misma forma se peden enontrar las otras propiedades, así qe omplementamos la tabla on alores qe iniialmente no apareen en ella. ara enontrar las propiedades de los estados intermedios entre los pntos de interepión, o sea pntos adentro de la ampana, se define na nea propiedad llamada alidad qe es igal a la relaión entre la masa de apor y la masa total del sistema x m m apor apor + m líqido esta propiedad sólo se define para la región de mezla exlyendo al pnto rítio, de forma qe los estados sobre la línea de líqido satrado tienen na alidad de ero (0) y los estados qe están sobre la línea de apor satrado tienen na alidad de no (1), todos los demás pntos dentro de la ampana tiene na alidad entre ero y no, y para estados fera de la ampana la alidad no está definida. artiendo de qe el olmen total del sistema es igal al olmen opado por el líqido más el olmen opado por el apor y on la definiión de olmen espeífio enontramos na eaión qe relaiona al olmen espeífio on la alidad, tomando en enta los alores de olúmenes espeífios del líqido y apor orrespondientes. V V líqido + V apor V/m total ( V líqido + V apor )/ m total ( f m líqido + g m apor )/ m total f m líqido / m total + g m apor / m total f (1 x) + g x Una relaión similar se mple para las otras propiedades f (1 x) + g x f (1 x) + g x s s f (1 x) +s g x or ejemplo, enontrar la energía interna para el estado (, ) (10 C, 000 )
7 Enontramos primero la alidad orrespondiente a ese estado, de la tabla obseramos qe los alores de entalpía de líqido y apor satrado para 10 C son f y g 706., y obseramos qe el alor de entalpía del estado qe nos interesa está entre los alores f y g leídos de la tabla (50.71 < 000 < 706. ), esto nos onfirma qe el estado es na mezla de líqido y apor satrados; sstitimos estos alores en la relaión orrespondiente [ f (1 x) + g x] y obtenemos la alidad ropiedades del aga en satraión: tabla de temperatra emp., res., Volmen espeífio m /kg Energía interna Entalpía Entropía kj/(kg K) C bar Líqido Vapor Líqido Vapor Líqido Vapor Líqido Vapor Eap. Sat. Sat Sat. Sat Sat. Sat Sat. Sat f x 10 g f g fg f g s f s g (1 x) x Otra tabla presentada en el libro ermodinámia (Wark iards) es ropiedades del aga: tabla de apor sobrealentado, x on este alor, los datos de la energía interna de líqido y apor satrado para 10 C y la relaión orrespondiente de la energía interna [ f (1 x) + g x] enontramos s alor (10 C, 000 ) ( ) (10 C, 000 ) De esta forma enontramos las otras propiedades para este estado.
8 estas están ordenadas en sbtablas, donde ada na de estas representan a na isobara. or ejemplo, enontremos el olmen espeífio del estado (,) (40 bar, 575 C) La primera olmna de las tablas es de temperatras, así qe la informaión ontenida en estas tablas es de los estados donde se intereptan na isobara on distintas isotermas, omo se mestra en la figra. Se mestran a ontinaión dos sbtablas orrespondientes a las isóbaras de 00 y 40 bar. La primera temperatra qe aparee es la temperatra de satraión de la presión orrespondiente, así qe para la presión de 00 bar la primera temperatra es de C, y para la presión de 40 bar la primera temperatra es de qe aparee es de 400 C y no la de satraión porqe esta isobara no entra a la región de mezla y por tanto no le orresponde ningna temperatra de satraión. Lo primero es biar la tabla qe orresponde a la presión de 40 bar, lo segndo es biar la temperatra de 575 C, obseramos qe este alor no está en la tabla, por lo qe proedemos a interpolar linealmente. omamos los estados inmediatos sperior e inferior y sponemos qe la relaión entre ellos es lineal, enontramos la eaión de la línea reta entre estos dos pntos y en ella sstitimos el alor de temperatra orrespondiente (en nestro ejemplo 575 C), y obtenemos el olmen espeífio orrespondiente. emp., C m /kg 00 bar (0.0 Mpa) ( sat C) 40 bar (4.0 Mpa) s kj/(kg K) m /kg s kj/(kg K) emp., C m /kg 00 bar (0.0 Mpa) ( sat C) 40 bar (4.0 Mpa) s kj/(kg K) m /kg s kj/(kg K) Sat m kg 560 C 575 C m m 560 C 600 C kg kg al despejar el olmen espeífio deseado obtenemos el alor (40 bar, 575 C) m /kg, así podemos enontrar el alor de las otras propiedades para este estado. Neamente obseramos qe esta informaión es disreta, así qe la informaión es solo de algnos pntos; entones si neesitamos la informaión de n estado qe no aparee diretamente en tablas, rerrimos de neo a la interpolaión. Otro ejemplo, enontremos la energía interna del estado (,) (1 bar, 600 C).
9 Al bsar la tabla orrespondiente a 1 bar, emos qe esta no está, pero obseramos qe sí está la temperatra de 600 C en las tablas orrespondientes a las presiones inmediata sperior (40 bar) e inmediata inferior (00 bar). Entones, rerrimos a la interpolaión lineal entre las dos tablas; por failidad se an simplifiado las tablas eliminando las olmnas orrespondientes al olmen espeífio, la entalpía y la entropía, y dejando las orrespondientes a las energías internas. emp., C 00 bar (0.0 Mpa) 0 bar (.0 Mpa) 40 bar (4.0 Mpa) rimero, aemos las interpolaiones para ada presión para la temperatra de 717 C y on los datos enontrados, aemos na nea interpolaión entre las presiones par enontrar la entalpía reqerida emp., C 00 bar (0.0 Mpa) 1 bar (1. Mpa) 40 bar (4.0 Mpa) lanteamos la interpolaión y despejamos la energía interna qe nos interesa 174.0kJ / kg 00bar 1bar 174.0kJ / kg 145.kJ / kg 00bar 40bar (1 bar, 600 C) Otro ejemplo, enontremos la entalpía del estado (,) (0 bar, 715 C). La tabla orrespondiente a 0 bar no se enentra y la temperatra de 715 C no aparee en las tablas inmediata sperior (40 bar) e inmediata inferior (00 bar), por tanto neesitamos aer na doble interpolaión 809.0kJ / kg 700bar 715bar 809.0kJ / kg 914.1kJ / kg 700bar 740bar (00 bar, 715 C) kJ / kg 700bar 715bar 78.8kJ / kg 89.1kJ / kg 700bar 740bar (40 bar, 715 C) kJ / kg 00bar 0bar 848.4kJ / kg 84.4kJ / kg 00bar 40bar (0 bar, 715 C) 80.4 La otra tabla qe aparee en el libro ermodinámia (Wark iards), es ropiedades del aga: tabla del líqido omprimido. La organizaión de esta tabla es similar a la de apor sobrealentado,
10 está ordenada por presiones y la primera olmna se refiera a las temperatras, entones la informaión qe presentan es de los estados loalizados en la interepión de la isobara orrespondiente on distintas isotermas Calores espeífios. Dos propiedades espeífias importantes se definen para sstanias simples y pras ompresibles y son los alores espeífios a presión y a olmen onstante, qe se definen omo las deriadas pariales de (, ) y (, ) y a estas propiedades se les llama alores espeífios porqe bajo iertas ondiiones nos indian el ambio de temperatra de n sistema dependiendo de la antidad de energía, en forma de transferenia de alor, qe se le añada o se le sstraiga a este. En mos asos aparee la relaión entre estos alores espeífios /, así qe es oneniente definir la relaión de alores espeífios k /. A ontinaión mostramos los alores de del apor de aga para arias temperatras, enontrados a traés de las tablas de las propiedades del aga para las presiones de 80, 00 y 40 bar. C 80 bar 00 bar 40 bar () Δ/ Δ () Δ/ Δ (kj/(kg - C) (kj/(kg - C) La gráfia mestra el omportamiento del en fnión de la temperatra para los asos mostrados en la tabla anterior. ápidamente podemos onlir qe para estas presiones y para este rango de temperatras el disminye ando la temperatra amenta y para na misma temperatra, amenta ando amenta la presión, esto podría no ser ierto para otras presiones p ( K) del apor de aga en fnión de la presión y la temperatra emperatra ( C) 0 Ma 4 Ma 8 Ma
11 - propiedades de los líqidos y los sólidos. Al obserar detenidamente las tablas de líqido omprimido y ompararlas on la tabla de satraión nos damos enta qe las ariaiones de las propiedades se deben más qe todo a los ambios de temperatra, mas qe a los ambios de presión. emp., C m /kg 00 bar (0.0 Mpa) ( sat C) 40 bar (4.0 Mpa) s kj/(kg K) m /kg s kj/(kg K) Sat gráfiamente esto lo obseramos en el sigiente esqema, donde emos qe apreiables ambios en la presión manteniendo la misma temperatra nos de ómo resltado peqeños ambios en el olmen espeífio, algo similar orre on otras propiedades, esto nos india qe omo na aproximaión podemos tilizar datos de líqido satrado para estados de líqido omprimido tomando omo base la misma temperatra. (, ) ( ) (, ) ( ) ara la entalpía, la ontribión de la presión pede ser importante, por lo qe la aproximaión se plantea en base a la definiión de esta (, ) ( ) ( ) f f f + alternatiamente se pede expresar omo f (, ) ( ) + ( )[ ( )] f f sat si la ontribión de la presión al alor de entalpía no es importante, esta expresión pede redirse a (, ) ( ) f Como emos isto, ay regiones donde el olmen espeífio aría poo y la energía interna aría prinipalmente on la temperatra, este omportamiento se obsera prinipalmente en la fase líqida y
12 en sólidos, por tanto es oneniente tratar este aso omo partilar. Se plantea el modelo de las sstanias inompresibles, la al tiene las propiedades de qe la densidad o olmen espeífio no ambia y qe la energía interna solo aria on la temperatra. ara este tipo de sstanias, si la energía interna solo depende de la temperatra, entones, el también solo depende de la temperatra y qeda omo n deriada simple 1 1 ( ) d ( p ) p1 1 1 ( ) d + ( p p ) 1 la entalpía qeda expresada omo d ( ) (inompresible) d ( ) ( ) +, (inompresible) Si el alor espeífio se onsidera onstante, entones ( ) 1 1 ( ) + ( ) obseramos en las dos eaiones anteriores qe se mple lo sigiente por tanto, d d para sstanias inompresibles. El alor del alor espeífio, pede en ierto interalo de temperatra onsiderarse onstante. ambién es álido - Diagrama del fator de ompresibilidad generalizado. Experimentalmente se a obserado el omportamiento de las sstanias, no de estos experimentos es onfinar n gas en n arreglo ilindro pistón, y er s omportamiento. A n gas bajo estas ondiiones se le somete a n proeso manteniendo la temperatra onstante y se e omo ambia la relaión / ando ambia la presión, obiamente en los laboratorios no se peden alanzar presiones my bajas, así qe ay na presión mínima qe se pede obtener. Si se ae esto para arias temperatras, se obtiene n gráfio omo el qe se mestra
13 Los gases se apartan del omportamiento de gas ideal y la diferenia se mide a traés de lo qe se llama fator de ompresibilidad, Z / o / el al es adimensional, si Z 1 se trata de n gas qe se omporta omo gas ideal, si Z 1 se trata de n gas no ideal. De las tablas de apor de aga se a obtenido el fator de ompresibilidad qe se mestra en la tabla y gráfia qe se mestran, ay qe obserar qe se mple la tendenia del fator de ompresibilidad a aia no (1.0) a medida qe la presión disminye. Sin embargo, si se extrapolan los datos obtenidos asta la presión ero, lim 0, se obsera na tendenia de las isotermas aia el mismo pnto, siendo esto álido para todas las isotermas de todos los gases, o sea qe el pnto de onergenia es el mismo para todo gas, por esto al alor de onergenia en el eje / se le llama onstante niersal de los gases, y ale 8.14 kj/(kmol K). La relaión / solo es álida para ando la presión tiende a ero, y omo na aproximaión para presiones bajas. A n gas qe tiene n omportamiento definido por /, para alqier ondiión de presión, se le llama gas ideal, obiamente no ay ningún gas qe en general tenga este omportamiento. (bar) 80 C 60 C 440 C 500 (m /kg) Z (m /kg) Z (m /kg) Z (m /kg) Z El gráfio anterior esta eo para el aga, de esta misma forma se peden tener gráfios de diferentes sstanias, la informaión qe estos proporionan es la misma de las tablas, solo qe en forma gráfia, además de presentar isalmente de ómo se apartan las
14 1. 1 Fator de ompresibilidad en fnión de la presión y la temperatra del apor de aga, olmen espeífio redido 0.8 Z (adimensional) resión (bar) donde, y son la presión rítia, la temperatra rítia y el olmen espeífio rítio respetiamente, de ada sstania en partilar, las presiones y temperatras sstitidas aqí deben de ser absoltas, on esto definido enniamos el prinipio de los estados orrespondientes, sstanias del omportamiento de gas ideal dependiendo de la presión y la temperatra. Como emos menionado anteriormente, este omportamiento es alitatiamente similar para todas las sstanias, entones se define el prinipio de los estados orrespondientes, el al die qe ada estado de na sstania tiene s estado orrespondiente en las otras sstanias; así qe es oneniente tener n solo gráfio, qe me permita omparar los estados orrespondientes entre sstanias, para todas las sstanias en ez de no para ada sstania, para esto se definen las propiedades redidas. 80 C 60 C 440 C 500 C, presión redida, temperatra redida si dos gases están en estados qe tienen igales la presión y la temperatra redidas, también son igales, en esos estados, los olúmenes espeífios redidos de los respetios gases, también se define el olmen psedo redido, ya qe se enentra qe las relaiones se ajstan mejor qe on el olmen redido, olmen psedoredido así qe presentamos la misma tabla y gráfio anteriores solo qe en fnión de las propiedades redidas, a este gráfio se le llama diagrama de ompresibilidad generalizado.
15 Fator de ompresibilidad en fnión de la presión y la temperatra redida (basado en el apor de aga) ermodinámia (Wark iards) apareen gráfios de este tipo para diferentes rangos de presión redida. - Eaiones de estado. Otra forma de relaionar las propiedades de na sstania es a traés de las eaiones de estado, el prinipio de estado apliado a nestro aso die qe ay na relaión entre la presión, el olmen y la temperatra qe mple on f(,, ) 0. Lo anterior signifia qe ay na eaión de estado qe relaiona la presión, el olmen espeífio y la temperatra para alqier flido omogéneo pro en estado de eqilibrio. El problema srge ando no ay na sola eaión para desribir todos los estados posibles de todas las sstanias, si no qe se desarrollan eaiones de estado limitadas a iertas regiones y a iertas sstanias Fator de ompresibilidad resión redida En base al prinipio de los estados orrespondientes este gráfio es álido para todas las sstanias anqe se a obtenido de los datos del aga, lo únio qe ay qe onoer de ada sstania son ss propiedades rítias. En las tablas A-7, A-8 y A-9, del libro Hay eaiones de estado de diferentes tipos, obtenidas analítiamente, obtenidas experimentalmente o na ombinaión de ambas, por ejemplo, desarrollemos na eaión de estado para el aso de n flido inompresible. La relaión pede resolerse para alqiera de las tres propiedades, o, omo na fnión de las otras dos, (, ), entones podemos poner el ambio infinitesimal del olmen espeífio omo d d + d
16 qe básiamente die qe el ambio en el olmen espeífio se debe a los ambios de temperatra y presión on s respetia ponderaión. Las deriadas pariales qe apareen en esta expresión tienen s signifiado físio bien definidos β 1 κ 1, oefiiente de expansión olmétria, ompresibilidad isotérmia el primero sería el ambio de olmen debido a los ambios de temperatra, manteniendo la presión onstante, por nidad de olmen; el segndo sería omo ambia el olmen debido a los ambios de presión si se mantiene la temperatra onstante, por nidad de olmen. ara estos oefiientes, solo neesitamos onoer los alores de presión, olmen espeífio y temperatra, todos ellos medibles. Sstityendo estos oefiientes obtenemos d d βd κd β d κd asta este momento la relaión qe emos obtenido es álida para alqier sstania pra y simple, aora obseremos el omportamiento de na isoterma en la región líqida de n diagrama y a na isobara en la región líqida de n diagrama, se e qe tienen na pendiente bastante grande, por tanto ( y ) ( son peqeños y de poa ariaión, al igal qe β y κ, o ) sea qe para líqidos reales, β y κ son fniones débiles de la temperatra y la presión, por tanto pede obtenerse para estos asos la sigiente relaión ln 1 d β d κ d ( ) ( ) β κ La expresión anterior es na aproximaión álida para n flido inompresible (líqido lejos del pnto rítio) y por tanto es na eaión de estado qe relaiona las propiedades, y para n flido inompresible. Este es n ejemplo rápido de ómo obtener na eaión de estado, obiamente ay eaiones más ompliadas qe esta y más preisas. El riterio de seleión de na eaión de estado depende básiamente de la preisión qe se reqiera, y del tipo de sstania qe se trate, por ejemplo, na misma eaión pede darnos na bena preisión para na sstania determinada, 1 1
17 pero pede no serir para otra qe tenga na isosidad distinta, o na eaión nos sire para na fase pero no para otra fase. Obserando el diagrama de ompresibilidad generalizado sponemos qe es posible plasmar esa informaión en na eaión, esta eaión debe de mplir qe ando la presión tiende a ero el fator de ompresibilidad tienda a no. Entones, se expresa na eaión de estado en forma de na serie infinita expandida en presión o en forma similar expandida en 1/. Z 1+ Bˆ( ) + Cˆ( ) + Dˆ ( ) + determina la preisión de la eaión, la eaión resltante solo será álida en las eindades de donde se tomaron los datos tilizados para obtener el alor de los oefiientes. Como ejemplo, obtengamos na eaión basada en la eaión del irial para el apor sobrealentado del refrigerante 14ª, las tablas de datos de esta sstania la peden enontrar en la tabla A.18 del libro ermodinámia (Wark iards), presentamos aqí na porión de ellas para nestro ejemplo, se mestran las presiones de 8.0 y 9.0 bar, on arias temperatras, temperatra de satraión, asta 140 C. Z B( ) C( ) D( ) estas eaiones son onoidas omo eaiones de estado del irial y ss oefiientes omo oefiientes del irial. Cada no de los oefiientes del irial representan omo interatúan entre sí las molélas del gas al qe se le apliqe, para obtenerlos es neesario rerrir a la teoría molelar de la meánia estadístia, para lo al abrá qe esperar qe se obtengan más aanes en este ampo. Otra forma de obtener estos oefiientes es en forma empíria, o sea trnar asta ierto término la eaión del irial y sstitir datos experimentales en la eaión trnada, así neesitaremos tantos pntos experimentales omo oefiientes tengamos en la eaión resltante, la antidad de términos me emp., C Sat m /kg 8.0 bar (0.80 Mpa) ( sat 1. C) 9.0 bar (0.90 Mpa) ( sat 5.5 C) s kj/(kg K) m /kg s kj/(kg K) omemos la eaión trnada asta el arto término, o sea qe neesitamos tres pntos para obtener los tres oefiientes B(), C() y D(), B( ) C( ) D( ) Z
18 seleionamos los pntos (9.0 bar, 140 C), (9.0 bar, 80 C) y (8.0 bar, 110 C), los olúmenes espeífios orrespondientes a ada no de estos estados los tomamos de la tabla anterior Z x , on[] m /kg estado Volmen espeífio, m /kg Z (9.0 bar, 140 C) (9.0 bar, 80 C) (8.0 bar, 110 C) Al sstitir estos alores obtenemos tres eaiones on tres inógnitas qe ay qe resoler B( ) m B( ) m B( ) m + kg + kg + kg C( ) + D( ) ( 0.059m kg) ( 0.059m kg) C( ) + D( ) ( m kg) ( m kg) C( ) al resolerlas obtenemos la sigiente tabla + D( ) ( m kg) ( m kg) B() m /kg C() m 6 /kg D() x10-5 m 9 /kg Sstityendo obtenemos la eaión sigiente Con la sigiente tabla erifiamos los resltados Estado rimer Segndo erer Carto Z Z (m /kg) término término término término e tab % ar (8.0 bar, 10 C) (9.0 bar, 10 C) (10.0 bar, 100 C) (16.0 bar, 80 C) (4.0 bar, 100 C) (5.0 bar, 70 C) (.0 bar, 90 C) (1.0 bar, 10 C) (9.0 bar, 140 C) el estado qe aparee on porentaje de ariaión igal a ero, es no de los estados qe se tilizó para obtener la eaión, los estados on % de ariaión peqeño son estados eranos a los qe se tilizaron para obtener la eaión, y los estados on % de ariaión grande son estados lejanos a estos; omo se dijo antes, esta eaión solo es álida en las regiones eranas a los pntos tilizados para obtener la eaión, si se qiere obtener na eaión más general, se deberán tomar más pntos y por tanto na eaión on más términos, y estos pntos se deberán seleionar de forma qe qeden dispersos en la región de interés. A traés de los años se an realizado esferzos por obtener eaiones de estado qe sean lo más general posibles, también se an reado eaiones de estado para sitaiones my espeífias, por ejemplo, eaiones para refrigerantes, eaiones para aeites, et.
19 Las eaiones de estado peden atalogarse de aerdo al número de onstantes qe tengan, la eaión desarrollada en el ejemplo anterior es de tres onstantes, y omo ya se meniono no de los riterios para obtener mayor preisión es el número de onstantes qe tenga la eaión, ya qe estas permiten ajstarla a las distintas regiones. Entre las eaiones de estado de dos onstantes (tres onstantes si inlimos a Ř) podemos menionar a: Eaión de estado de Dieterii a Los alores de las onstantes dependen de la sstania a la al se apliqen, estas apareen en los distintos libros qe tratan sobre el tema, estas onstantes también peden ponerse en fnión de pntos de referenia, n pnto omúnmente tilizado es el pnto rítio. e Eaión de estado de an der Waals b a En n diagrama se obsera qe la isoterma rítia al pasar por el pnto rítio tiene dos araterístias, na es qe la pendiente es ese Eaión de estado de edli Kwong b a 1 ( + b) eaión de estado de Bertelot a ( b) pnto es ero y además es n pnto de inflexión o de ambio de ratra, entones, las eaiones de estado también tienen qe tener esas araterístias, dio matemátiamente
20 0, para el pnto rítio a b apliqemos estas ondiiones a algna de las eaiones anteriores, por ejemplo an der Waals Con estas tres eaiones resolemos para las onstantes a, b y el olmen espeífio,. a + ( b) a a 4 ( b) b 8 Al ealar estas expresiones en el pnto rítio podemos igalarlas a ero, debido a las dos araterístias qe menionamos anteriormente de pendiente igal a ero y de ser n pnto de inflexión ( b) ( b) a + 6a 4 on estas tenemos tres eaiones ealadas en el pnto rítio, la eaión de an der Waals, s primera y segnda deriadas respeto al olmen Con estas expresiones podemos enontrar el alor de las onstantes para ada na de las sstanias si onoemos las propiedades rítias de estas. Esto mismo pede apliarse a las otras eaiones. Esta eaión también pede oloarse en forma generalizada b a
21 Z a b, esta eaión es álida, omo emos menionado anteriormente, para presiones bajas, esto es así porqe mirosópiamente podemos deir qe las molélas del gas están bastante separadas y no se afetan entre si signifiatiamente. Otra forma de expresar esto es Z Z Z Z 51 0 si onsideramos qe la presión se debe a las olisiones de estas molélas on las paredes del reipiente qe lo ontienen, entones las olisiones de na moléla no se en afetadas por la presenia de otras molélas, si las molélas están más era entre sí, entones, na moléla qe se dirige a olisionar ontra na pared, se e frenada por la interaión on las otras molélas disminyendo la magnitd del impato, esto ae qe el alor de la presión sea menor a lo qe indiaría la eaión de gases ideales. Al ealar las ondiiones rítias en esta expresión obtenemos Z para n gas de an der Waals Z 0.75 En la tabla A. del libro ermodinámia (Wark iards), se mestran alores de Z de arias sstanias on las ales podemos omparar el resltado qe emos obtenido. Cada na de las onstantes qe apareen en las eaiones de estado, tienen n signifiado físio, por ejemplo, el signifiado de las onstantes de an der Waals lo podemos omprender si omparamos esta expresión on la eaión de los gases ideales En base a esta análisis se orrige la eaión on n término qe onsidere la interaión entre molélas, este término tiene qe tomar en enta el tipo de moléla qe forma al gas, debido a qe ay molélas qe se ejeren ferzas relatiamente grandes y molélas qe se ejeren ferzas peqeñas. Además ay qe onsiderar la antidad de molélas qe afetarían a la moléla qe a a olisionar, obiamente a más molélas presentes, más se afeta el moimiento de estas. a +, a, depende del tipo de moléla, y 1, toma en enta la densidad de molélas.
22 El gas ideal se onsidera qe está formado por molélas pntales (partílas) o sea qe no opan n olmen, en la realidad las molélas tienen n tamaño determinado qe depende del tipo de moléla, entones si definimos al olmen qe aparee en la eaión de estado del gas ideal, omo el espaio qe podría estar opando na de las molélas, entones en n gas real este olmen sería menor qe el olmen del reipiente qe ontenga al gas, ya qe na de las molélas no podría estar donde ya están otras molélas, entones el olmen real sería menor. Esto ae posible introdir otra orreión a la eaión ( + a )( b) b, depende del tipo de moléla entones, el signifiado físio de estas onstantes, en el aso de a, india la ferza qe se ejeren entre molélas, y en el aso de b, india el tamaño de las molélas, en ambos asos son propiedad de la moléla, o dio de otra forma son propiedad de la sstania. La eaión de an der Waals se pede poner en forma del irial b Z 1 1 b Z ( 1 b ) 1 a a a b b b Z ( b a ) b b Z a entones, para n gas de an der Waals los oefiientes del irial son b m /kg C() b m 6 /kg D() b m 9 /kg B() ( a ) Lo mismo pede aerse para las otras eaiones de estado menionadas. ara edli Kwong qedaría Z 5 a , b , ( ) Z 0. Si omparamos este resltado de Z para edli Kwong on los datos de la tabla A. del libro ermodinámia (Wark iards), obseramos qe se ajsta mejor qe el Z obtenido on la eaión de an der Waals.
23 En el gráfio se mestra el omportamiento de n gas de Van der Waals en la zona de mezla líqido apor satrado, lo al no orresponde al omportamiento real de las sstanias, sin embargo, da indiios de qe a esa región ay qe prestarle atenión. Un omportamiento similar presenta la eaión de edli Kwong. Eaión de estado de Beattie Bridgeman A a b + 1, A A 1, B B 1 + B Esta eaión es my tilizada para el állo de las propiedades termodinámias del apor era de la fase líqida y por debajo de la temperatra rítia. Eaión de estado de Benedit Webb bin C + B A ( b a) aα γ 1 γ 1 + e esta eaión tiene oo onstantes y es tilizada para predeir el omportamiento de idroarbros ligeros. Estas eaiones de dos onstantes dan na prediión razonable para mas apliaiones, pero ay qe ajstar el alor de las onstantes on datos reales, para mejorar la exatitd, estando siempre limitada a ser sadas en los alrededores de donde se tomaron los datos de ajste. Hay eaiones de estado on más de dos onstantes, entre las ales podemos menionar
24 ara esoger la eaión de estado apropiada, ay qe aerse iniialmente dos pregntas, las ales están en el esqema sigiente, Una forma my prátia de presentar la informaión termodinámia es a traés de gráfios, omo el diagrama de ompresibilidad Criterios para seleionar na eaión de estado apor La región de interes es apor o gas? gas satrado Es apor satrado o apor sobrealentado sobrealentado si Se está lejos del pnto rítio o no no?? Gas ideal, Van der Waals? Beattie - Bridgeman, Van der Waals? este esqema es solo na mestra del tipo de pregntas qe ay qe aerse para seleionar na eaión de estado:
25 generalizado mostrado anteriormente, dos gráfios my omnes, son los diagramas s (temperatra - entropía) y s (entalpía entropía) qe se mestran a ontinaión, ay qe obserar qe no mestran ma definiión en la parte de líqido, por lo qe se ae neesaria na ampliaión de esta región, si se desean tilizarlos; on los gráfios se gana rapidez en la letra de datos, pero se pierde preisión. Otra entaja de los gráfios es qe nos permite obserar rápidamente el omportamiento de ada propiedad en fnión de las otras, por ejemplo es interesante obserar qe existe na zona donde la entalpía y la temperatra prátiamente son dependientes na de la otra (zona de alidez de gas ideal?), también reslta interesante obserar esta tendenia entre la temperatra y la presión en la zona de mezla. ápidamente podemos obserar también, la tendenia de las pendientes de ada na de las líneas, lo al es my importante, debido a qe están relaionadas on propiedades físias de las sstanias omo ya emos isto. ara n gas ideal se mple qe en forma similar ( ) d d d ( ) d ) ( ) ( 1 1 ( ) d d ( ) ( 1 ) de la definiión de entalpía saamos qe 1 ( ) d ( ) d - Gas ideal. Hemos obserado la tendenia del fator de ompresibilidad, Z, de n gas real ando la presión tiende a ero, entones Z tiende a no (1.0), si amentamos la presión, Z se aparta de no (1.0). Un gas al al al amentársele la presión sige manteniendo el fator de ompresibilidad igal a Uno (1.0), y además mple on qe la energía interna y por tanto la entalpía solo son fnión de la temperatra, se die qe es n gas ideal. d d d d + + o + La relaión de alores espeífios qedaría omo k + 1 ( )
26 ara tilizar estas expresiones, neesitamos onoer los alores espeífios en fnión de la temperatra, en el libro ermodinámia (Wark iards), esta informaión aparee en forma de tablas, gráfios y asta en forma de eaión a + b + + d + e 4 las onstantes dependen son fnión del gas y el libro texto presenta na lista en la tabla A.. Hay qe tomar en enta las limitantes de los datos mostrados. En oasiones es oneniente tilizar alores espeífios onstantes, estos alores peden enontrarse de la sigiente forma: 1 ( ) d 1 y 1 ( ) d 1 entones el ambio de energía interna y el ambio de entropía qedan así: ( ) ( 1 ) ( 1 ) ( ) ( 1 ) ( 1 )
TEMA 3. PROPIEDADES DE UNA SUSTANCIA PURA, SIMPLE Y COMPRESIBLE
 EMA 3. PROPIEDADES DE UNA SUSANCIA PURA, SIMPLE Y COMPRESIBLE CONENIDOS:. El riniio de estado. La relaión -- 3. Valores de roiedades termodinámias 4. La relaión -- ara gases 5. El modelo de gas ideal OBJEIVOS
EMA 3. PROPIEDADES DE UNA SUSANCIA PURA, SIMPLE Y COMPRESIBLE CONENIDOS:. El riniio de estado. La relaión -- 3. Valores de roiedades termodinámias 4. La relaión -- ara gases 5. El modelo de gas ideal OBJEIVOS
EJERCICIO DE CALCULO DE INCERTIDUMBRE APLICADO A LA LEY DE OHM
 EJECCO DE CALCULO DE NCETDUMBE APLCADO A LA LEY DE OHM O. Gtiérrez CENAM, Laboratorio Mltifniones km 4, Carretera a los Cés El Marqés Qro Tel. 0 4 0 00, Fax 0 4 3, ogtierr@enam.mx esmen: En los laboratorios
EJECCO DE CALCULO DE NCETDUMBE APLCADO A LA LEY DE OHM O. Gtiérrez CENAM, Laboratorio Mltifniones km 4, Carretera a los Cés El Marqés Qro Tel. 0 4 0 00, Fax 0 4 3, ogtierr@enam.mx esmen: En los laboratorios
de operación la línea fallada ( Pelec
 do Examen Parial de Sistemas de Potenia -7 Problema # [ Pts]. Las eaiones de osilaión de dos maqinas sinrónias interonetadas son esritas omo: H d H d P me P ele P me P ele Denote el ánglo de potenia relativo
do Examen Parial de Sistemas de Potenia -7 Problema # [ Pts]. Las eaiones de osilaión de dos maqinas sinrónias interonetadas son esritas omo: H d H d P me P ele P me P ele Denote el ánglo de potenia relativo
Matriz de rigidez de una barra articulada en sus extremos
 Matriz de rigidez de na barra artilada en ss etremos Consideremos la barra de la igra, qe posee na longitd n área de s seión transversal de valor A, qe ha sido fabriada on n material o módlo de elastiidad
Matriz de rigidez de na barra artilada en ss etremos Consideremos la barra de la igra, qe posee na longitd n área de s seión transversal de valor A, qe ha sido fabriada on n material o módlo de elastiidad
MÁQUINAS HIDRÁULICAS Y TÉRMICAS TURBOMÁQUINAS TÉRMICAS 6. ECUACIÓN FUNDAMENTAL DE LAS TURBOMÁQUINAS-ECUACIÓN DE EULER
 6. ECUACIÓN FUNDAMENTAL DE LAS TURBOMÁQUINAS-ECUACIÓN DE EULER Spongamos n ondto perteneiente al rotor de na trbomáqina por el qe irla n flido, y qe gira respeto del eje de la máqina on na veloidad anglar
6. ECUACIÓN FUNDAMENTAL DE LAS TURBOMÁQUINAS-ECUACIÓN DE EULER Spongamos n ondto perteneiente al rotor de na trbomáqina por el qe irla n flido, y qe gira respeto del eje de la máqina on na veloidad anglar
y = y ' Esta es la relatividad de Galileo.
 Transformaión de Galileo Supongamos dos sistemas de referenia: uno fijo on origen en y otro móil on respeto al primero que tiene su origen en. Para simplifiar, amos a suponer que el móil sólo se muee en
Transformaión de Galileo Supongamos dos sistemas de referenia: uno fijo on origen en y otro móil on respeto al primero que tiene su origen en. Para simplifiar, amos a suponer que el móil sólo se muee en
m = masa inercial del móvil medida en su sistema inercial (es decir, medida por un observador que se mueve con la misma velocidad que el móvil)
 Inexatitd del prinipio de inertidbre 1. El prinipio de inertidbre (o de indeterinaión) de Heisenberg apliado a la posiión y al iplso. Este prinipio die qe, siendo: error en la posiión obserada de n óil
Inexatitd del prinipio de inertidbre 1. El prinipio de inertidbre (o de indeterinaión) de Heisenberg apliado a la posiión y al iplso. Este prinipio die qe, siendo: error en la posiión obserada de n óil
12 EL BUCLE DE CONTROL
 2 EL BUCLE DE CONTROL El operador de un proeso normalmente monitorea iertas ariables y atúa sobre otras de modo de tener ontrolado el proeso. Resulta sumamente prátio realizar eso de manera automátia,
2 EL BUCLE DE CONTROL El operador de un proeso normalmente monitorea iertas ariables y atúa sobre otras de modo de tener ontrolado el proeso. Resulta sumamente prátio realizar eso de manera automátia,
AMPLIFICADOR DE CARGA. Figura 1.- Componentes principales del sistema de calibración.
 ÁLISIS DE L SE SIBILIDD DE LOS MPLIFIDORES DE R PR ELERÓMETROS M. en. illermo Silva Pineda, M. en. Sergio R. Rojas Ramírez, Ing. rtro Riz Reda División de Vibraiones y ústia, E M Resmen Los amplifiadores
ÁLISIS DE L SE SIBILIDD DE LOS MPLIFIDORES DE R PR ELERÓMETROS M. en. illermo Silva Pineda, M. en. Sergio R. Rojas Ramírez, Ing. rtro Riz Reda División de Vibraiones y ústia, E M Resmen Los amplifiadores
Recursión y Relaciones de Recurrencia. UCR ECCI CI-0111 Estructuras Discretas Prof. Kryscia Daviana Ramírez Benavides
 Reursión y Relaiones de Reurrenia UCR ECCI CI-0 Estruturas Disretas Prof. Krysia Daviana Ramírez Benavides Algoritmos Reursivos Un algoritmo es reursivo si se soluiona un problema reduiéndolo a una instania
Reursión y Relaiones de Reurrenia UCR ECCI CI-0 Estruturas Disretas Prof. Krysia Daviana Ramírez Benavides Algoritmos Reursivos Un algoritmo es reursivo si se soluiona un problema reduiéndolo a una instania
Recursión y Relaciones de Recurrencia. UCR ECCI CI-1204 Matemáticas Discretas M.Sc. Kryscia Daviana Ramírez Benavides
 Reursión y Relaiones de Reurrenia UCR ECCI CI-04 Matemátias Disretas M.S. Krysia Daviana Ramírez Benavides Algoritmos Reursivos Un algoritmo es reursivo si se soluiona un problema reduiéndolo a una instania
Reursión y Relaiones de Reurrenia UCR ECCI CI-04 Matemátias Disretas M.S. Krysia Daviana Ramírez Benavides Algoritmos Reursivos Un algoritmo es reursivo si se soluiona un problema reduiéndolo a una instania
Serie 11. Sistemas de control más elaborados
 Serie Sistemas de ontrol más elaborados Sistemas de ontrol más elaborados Se utilizan uando los lazos de ontrol onvenionales no son sufiientemente apropiados, debido a difiultades omo proesos on grandes
Serie Sistemas de ontrol más elaborados Sistemas de ontrol más elaborados Se utilizan uando los lazos de ontrol onvenionales no son sufiientemente apropiados, debido a difiultades omo proesos on grandes
y ' a x a y a z a t z' a x a y a z a t t' = a x + a y + a z + a t
 Transformaión de Galileo Supongamos dos sistemas de referenia: uno fijo (XYZ) on origen en O y otro móil (X Y Z ) on respeto al primero que tiene su origen en O. Para simplifiar las osas, amos a suponer
Transformaión de Galileo Supongamos dos sistemas de referenia: uno fijo (XYZ) on origen en O y otro móil (X Y Z ) on respeto al primero que tiene su origen en O. Para simplifiar las osas, amos a suponer
Esta es la relatividad de Galileo.
 FJC 009 Transformaión de Galileo Supongamos dos sistemas de referenia: uno fijo on origen en y otro móil on respeto al primero que tiene su origen en. Para simplifiar, amos a suponer que el móil sólo se
FJC 009 Transformaión de Galileo Supongamos dos sistemas de referenia: uno fijo on origen en y otro móil on respeto al primero que tiene su origen en. Para simplifiar, amos a suponer que el móil sólo se
ANÁLISIS DE LOS INTERCAMBIADORES DE CALOR. Mg. Amancio R. Rojas Flores
 ANÁLISIS DE LOS INERAMBIADORES DE ALOR Mg. Amanio R. Rojas Flores En la prátia los interambiadores de alor son de uso omún y un ingeniero se enuentra a menudo en la posiión de: seleionar un interambiador
ANÁLISIS DE LOS INERAMBIADORES DE ALOR Mg. Amanio R. Rojas Flores En la prátia los interambiadores de alor son de uso omún y un ingeniero se enuentra a menudo en la posiión de: seleionar un interambiador
Integración IV. Relaciones PVT de gases y líquidos puros (Repaso) 2017
 Integraión IV Relaiones PVT de gases y líquidos puros (Repaso) 017 Profesor: Dr. Niolás J. Senna JTP: Dr. Néstor H. Rodríguez Aux. 1ra: Dr. Juan I. Manassaldi Introduión Introduión Si se onoe la relaión
Integraión IV Relaiones PVT de gases y líquidos puros (Repaso) 017 Profesor: Dr. Niolás J. Senna JTP: Dr. Néstor H. Rodríguez Aux. 1ra: Dr. Juan I. Manassaldi Introduión Introduión Si se onoe la relaión
Tema 1 Equilibrio general y fallos de mercado
 Ejeriios reseltos de Miroeonomía. Eilibrio general eonomía de la informaión Fernando Perera Tallo Olga María Rodrígez Rodrígez Tema Eilibrio general fallos de merado htt://bit.l/ldd Ejeriio : Considere
Ejeriios reseltos de Miroeonomía. Eilibrio general eonomía de la informaión Fernando Perera Tallo Olga María Rodrígez Rodrígez Tema Eilibrio general fallos de merado htt://bit.l/ldd Ejeriio : Considere
11.1. Ecuaciones de la dinámica de sólidos
 Capítulo 11 Dinámia de sólidos Todos los modelos estudiados hasta ahora suponían que los sólidos deformables se enuentran, en todo instante, en equilibrio uasi-estátio. Esto quiere deir que, aunque éstos
Capítulo 11 Dinámia de sólidos Todos los modelos estudiados hasta ahora suponían que los sólidos deformables se enuentran, en todo instante, en equilibrio uasi-estátio. Esto quiere deir que, aunque éstos
Lección 1: Tensiones verticales en los suelos.
 Lección : Tensiones verticales en los selos. Tensión vertical en n pnto del terreno. La tensión vertical en n pnto calqiera de n selo a na profndidad es el peso de la colmna de terreno existente por encima
Lección : Tensiones verticales en los selos. Tensión vertical en n pnto del terreno. La tensión vertical en n pnto calqiera de n selo a na profndidad es el peso de la colmna de terreno existente por encima
Regla de la cadena. Regla de la cadena y. son diferenciables, entonces: w w u w v y u y v y. y g. donde F, w w u w v x u x v x
 Regla de la cadena Una de las reglas qe en el cálclo de na variable reslta my útil es la regla de la cadena. Dicho grosso modo, esta regla sirve para derivar na composición de fnciones, esto es, na fnción
Regla de la cadena Una de las reglas qe en el cálclo de na variable reslta my útil es la regla de la cadena. Dicho grosso modo, esta regla sirve para derivar na composición de fnciones, esto es, na fnción
TRANSFERENCIA DE CALOR POR CONVECCIÓN Departamento de Ingeniería Mecánica Universidad de Santiago de Chile. Diego Vasco C.
 TRANSFERENCIA DE CALOR POR CONVECCIÓN Departamento de Ingeniería Meánia Universidad de Santiago de Chile 2015 Diego Vaso C. INTRODUCCIÓN El meanismo de transferenia de alor por onveión surge por el movimiento
TRANSFERENCIA DE CALOR POR CONVECCIÓN Departamento de Ingeniería Meánia Universidad de Santiago de Chile 2015 Diego Vaso C. INTRODUCCIÓN El meanismo de transferenia de alor por onveión surge por el movimiento
CAMPO Y POTENCIAL ELECTROSTÁTICOS
 1 Un eletrón de arga e y masa m se lanza orizontalmente en el punto O on una veloidad v a lo largo de la direión equidistante de las plaas de un ondensador plano entre las que existe el vaío. La longitud
1 Un eletrón de arga e y masa m se lanza orizontalmente en el punto O on una veloidad v a lo largo de la direión equidistante de las plaas de un ondensador plano entre las que existe el vaío. La longitud
Segundo Principio de la Termodinámica
 ermodinámia. ema 4 Segundo Prinipio de la ermodinámia. Segundo Prinipio de la ermodinámia Enuniado de Kelvin-Plank en 85: No es posible onstruir una máuina térmia de funionamiento ílio ue permita extraer
ermodinámia. ema 4 Segundo Prinipio de la ermodinámia. Segundo Prinipio de la ermodinámia Enuniado de Kelvin-Plank en 85: No es posible onstruir una máuina térmia de funionamiento ílio ue permita extraer
Para aprender Termodinámica resolviendo problemas
 GASES REAES. Fator de ompresibilidad. El fator de ompresibilidad se define omo ( ) ( ) ( ) z = real = real y es funión de la presión, la temperatura y la naturaleza de ada gas. Euaión de van der Waals.
GASES REAES. Fator de ompresibilidad. El fator de ompresibilidad se define omo ( ) ( ) ( ) z = real = real y es funión de la presión, la temperatura y la naturaleza de ada gas. Euaión de van der Waals.
4. Espacios Vectoriales
 4. Espacios Vectoriales 4.. Definición de espacio, sbespacio ectorial y ss propiedades n ector es na magnitd qe consta de módlo, dirección y sentido. Algnos sin embargo; más teóricos, explicarían qe n
4. Espacios Vectoriales 4.. Definición de espacio, sbespacio ectorial y ss propiedades n ector es na magnitd qe consta de módlo, dirección y sentido. Algnos sin embargo; más teóricos, explicarían qe n
4. RELACIONES CONSTITUTIVAS. LEY DE HOOKE GENERALIZADA
 4. RLACIONS CONSTITUTIVAS. LY D HOOK GNRALIZADA 4. Ley de Hooke. Robert Hooke planteó en 678 que existe proporionalidad entre las fuerzas apliadas a un uerpo elástio y las deformaiones produidas por dihas
4. RLACIONS CONSTITUTIVAS. LY D HOOK GNRALIZADA 4. Ley de Hooke. Robert Hooke planteó en 678 que existe proporionalidad entre las fuerzas apliadas a un uerpo elástio y las deformaiones produidas por dihas
Introducción a la Química Computacional
 Introduión a la Químia Computaional MÉTODO D LA VARIACION PARA ROLVR APROXIMADAMNT LA CUACIÓN D CRÖDINGR Reservados todos los derehos de reproduión. Luis A. Montero Cabrera y Rahel Crespo Otero, Universidad
Introduión a la Químia Computaional MÉTODO D LA VARIACION PARA ROLVR APROXIMADAMNT LA CUACIÓN D CRÖDINGR Reservados todos los derehos de reproduión. Luis A. Montero Cabrera y Rahel Crespo Otero, Universidad
LÍMITES, CONTINUIDAD Y DERIVADAS
 LÍMITES, CONTINUIDAD Y DERIVADAS ÍNDICE. Concepto de límite. Propiedades de los límites 3. Definición de continidad 4. Tipos de continidad 5. Concepto de derivada 6. Tabla de derivadas 7. Crecimiento y
LÍMITES, CONTINUIDAD Y DERIVADAS ÍNDICE. Concepto de límite. Propiedades de los límites 3. Definición de continidad 4. Tipos de continidad 5. Concepto de derivada 6. Tabla de derivadas 7. Crecimiento y
ANÁLISIS PARAMÉTRICO DE COLECTORES SOLARES PLANOS OPERANDO EN SERIE
 195 TCSD 03-05 ANÁLISIS PARAMÉTRICO DE COLECTORES SOLARES PLANOS OPERANDO EN SERIE Ignaio R. Martín Domínguez y Ma. Teresa Alarón Herrera Centro de Investigaión en Materiales Avanzados, S.C. Miguel de
195 TCSD 03-05 ANÁLISIS PARAMÉTRICO DE COLECTORES SOLARES PLANOS OPERANDO EN SERIE Ignaio R. Martín Domínguez y Ma. Teresa Alarón Herrera Centro de Investigaión en Materiales Avanzados, S.C. Miguel de
21 Tabiques ACTUALIZACIÓN PARA EL CÓDIGO CAMPO DE VALIDEZ 14.2 REQUISITOS GENERALES
 1 Tabiqes ACTUALIZACIÓN PARA EL CÓDIGO 00 A fin de eliminar la onfsión entre el fator de resistenia φ y el fator de rigidez, en las Eaiones (14-5) y (14-6) el fator de rigidez (φ) se reemplazó por s valor
1 Tabiqes ACTUALIZACIÓN PARA EL CÓDIGO 00 A fin de eliminar la onfsión entre el fator de resistenia φ y el fator de rigidez, en las Eaiones (14-5) y (14-6) el fator de rigidez (φ) se reemplazó por s valor
Sistemas homogéneos multicomponentes 24 de marzo de 2009 Cuestiones y problemas: C: 7.3, 5
 Índie 5 CELINA GONZÁLEZ ÁNGEL JIMÉNEZ IGNACIO LÓPEZ RAFAEL NIETO Sistemas homogéneos multiomponentes 24 de marzo de 2009 Cuestiones y problemas: C: 7.3, 5 subrayados y en negrita para voluntarios punto
Índie 5 CELINA GONZÁLEZ ÁNGEL JIMÉNEZ IGNACIO LÓPEZ RAFAEL NIETO Sistemas homogéneos multiomponentes 24 de marzo de 2009 Cuestiones y problemas: C: 7.3, 5 subrayados y en negrita para voluntarios punto
12 Corte ACTUALIZACIÓN PARA EL CÓDIGO 2002 CONSIDERACIONES GENERALES. Los cambios introducidos en la edición 2002 del código incluyen los siguientes:
 1 Corte CTULIZCIÓN PR EL CÓDIGO 00 Los ambios introdidos en la ediión 00 del ódigo inlen los sigientes: 1. En el artílo 11.11.1 se hae referenia al péndie, Modelos de Bielas Tirantes. Esto permite el so
1 Corte CTULIZCIÓN PR EL CÓDIGO 00 Los ambios introdidos en la ediión 00 del ódigo inlen los sigientes: 1. En el artílo 11.11.1 se hae referenia al péndie, Modelos de Bielas Tirantes. Esto permite el so
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA. Ingeniería Química
 UNIVERSIDAD NACIONAL EXERIMENTAL OLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEARTAMENTO DE INGENIERÍA QUÍMICA Ingeniería Químia Unidad III. Balane de materia Sistemas Monofásios Clase
UNIVERSIDAD NACIONAL EXERIMENTAL OLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEARTAMENTO DE INGENIERÍA QUÍMICA Ingeniería Químia Unidad III. Balane de materia Sistemas Monofásios Clase
Capítulo II. Propiedades mecánicas.
 Capítlo II Propiedades mecánicas. 1 Cra esferzo - deformación ingenieril El Ensayo de tracción se realiza bajo la norma STM E-8, o bien la norma chilena NCH 2, entre otras. S importancia radica en qe es
Capítlo II Propiedades mecánicas. 1 Cra esferzo - deformación ingenieril El Ensayo de tracción se realiza bajo la norma STM E-8, o bien la norma chilena NCH 2, entre otras. S importancia radica en qe es
Hidráulica de canales
 Laboratorio de Hidráulia In. David Hernández Huéramo Manual de prátias Hidráulia de anales 5o semestre Autores: Guillermo enjamín Pérez Morales Jesús Alberto Rodríuez Castro Jesús Martín Caballero Ulaje
Laboratorio de Hidráulia In. David Hernández Huéramo Manual de prátias Hidráulia de anales 5o semestre Autores: Guillermo enjamín Pérez Morales Jesús Alberto Rodríuez Castro Jesús Martín Caballero Ulaje
VELOCIDAD INSTANTANEA
 VELOCIDAD INSTANTANEA OBJETIVOS DE APRENDIZAJE Determinar experimentalmente la veloidad instantánea de un móvil en un punto fijo de su trayetoria a través de un gráfio de veloidad media versus tiempo en
VELOCIDAD INSTANTANEA OBJETIVOS DE APRENDIZAJE Determinar experimentalmente la veloidad instantánea de un móvil en un punto fijo de su trayetoria a través de un gráfio de veloidad media versus tiempo en
Estructura y Evolución de Objetos del Cinturón de Kuiper y Planetas Enanos
 Estrtra y Evolión de Objetos del Cintrón de Kiper y Planetas Enanos W. MKinnon, D. Prialnik, A. Stern, A. Coradini The Solar System Beyond Neptne, 2008 Seminario El Espaio Transneptniano 2015 Introdión
Estrtra y Evolión de Objetos del Cintrón de Kiper y Planetas Enanos W. MKinnon, D. Prialnik, A. Stern, A. Coradini The Solar System Beyond Neptne, 2008 Seminario El Espaio Transneptniano 2015 Introdión
Programación y Métodos Numéricos Ejercicios Enero Junio 2018
 Programaión y Métodos Numérios Ejeriios Enero Junio 18 EJERCICIO 1 En ada aso, evaluar la expresión dada, realizando las operaiones paso a paso de auerdo al orden de preedenia de los operadores aritmétios.
Programaión y Métodos Numérios Ejeriios Enero Junio 18 EJERCICIO 1 En ada aso, evaluar la expresión dada, realizando las operaiones paso a paso de auerdo al orden de preedenia de los operadores aritmétios.
DETERMINACIÓN DE LAS CORRIENTES DE INSERCIÓN EN SISTEMAS DE DISTRIBUCIÓN DE n TRANSFORMADORES.
 ng. Horaio Salvañá HS ngeniería - www.hsingenieria.om.ar DETERMNACÓN DE LAS CORRENTES DE NSERCÓN EN SSTEMAS DE DSTRBUCÓN DE n TRANSFORMADORES. Autor: ng. Horaio Salvañá Objetivo: El objeto de este trabajo
ng. Horaio Salvañá HS ngeniería - www.hsingenieria.om.ar DETERMNACÓN DE LAS CORRENTES DE NSERCÓN EN SSTEMAS DE DSTRBUCÓN DE n TRANSFORMADORES. Autor: ng. Horaio Salvañá Objetivo: El objeto de este trabajo
DETERMINACIÓN SEMI-EMPÍRICA DEL CENTRO AERODINÁMICO DE UN PERFIL DE ALA
 DEL 19 al 1 DE SEPTIEMBRE, 01. SALAMANCA, GUANAJUATO, MÉXICO DETERMINACIÓN SEMI-EMPÍRICA DEL CENTRO AERODINÁMICO DE UN PERFIL DE ALA 1 Fernández Roque Tiburio, 1 Correa Arredondo José Arturo, 1 Mejía Carmona
DEL 19 al 1 DE SEPTIEMBRE, 01. SALAMANCA, GUANAJUATO, MÉXICO DETERMINACIÓN SEMI-EMPÍRICA DEL CENTRO AERODINÁMICO DE UN PERFIL DE ALA 1 Fernández Roque Tiburio, 1 Correa Arredondo José Arturo, 1 Mejía Carmona
ESTRUCTURA FINA DEL ÁTOMO DE HIDRÓGENO.
 ESTRUCTURA FINA DEL ÁTOMO DE HIDRÓGENO. Ciertas líneas del hidrógeno y de los alalinos mostraban perfiles on varias omponentes muy próximas entre sí, indiando un desdoblamiento de los niveles de energía
ESTRUCTURA FINA DEL ÁTOMO DE HIDRÓGENO. Ciertas líneas del hidrógeno y de los alalinos mostraban perfiles on varias omponentes muy próximas entre sí, indiando un desdoblamiento de los niveles de energía
ICNC: Longitudes de pandeo de columnas: Método riguroso
 CC: ongitudes de pandeo de olumnas: método riguroso S008a-S-U CC: ongitudes de pandeo de olumnas: Método riguroso sta CC proporiona informaión respeto al álulo de la longitud de pandeo de olumnas, para
CC: ongitudes de pandeo de olumnas: método riguroso S008a-S-U CC: ongitudes de pandeo de olumnas: Método riguroso sta CC proporiona informaión respeto al álulo de la longitud de pandeo de olumnas, para
Física Térmica - Práctico 7
 Física érmica - ráctico 7 Instituto de Física, Facultad de Ingeniería, Universidad de la República La numeración entre paréntesis de cada problema, corresponde a la numeración del libro Fundamentos de
Física érmica - ráctico 7 Instituto de Física, Facultad de Ingeniería, Universidad de la República La numeración entre paréntesis de cada problema, corresponde a la numeración del libro Fundamentos de
VECTORES EN EL PLANO.
 VECTORES EN EL PLNO. Introdcción: Magnitdes escalares ectoriales. Ha ciertas magnitdes físicas, tales como la masa, la presión, el olmen, la energía, la temperatra, etc., qe qedan completamente definidas
VECTORES EN EL PLNO. Introdcción: Magnitdes escalares ectoriales. Ha ciertas magnitdes físicas, tales como la masa, la presión, el olmen, la energía, la temperatra, etc., qe qedan completamente definidas
SECCIÓN 2: CÁLCULO DEL GOLPE DE ARIETE
 SECCIÓN : CÁCUO DE GOPE DE ARIETE CÁCUO DE GOPE DE ARIETE SEGÚN AIEVI El impato de la masa líquida ante una válvula no es igual si el ierre es instantáneo o gradual. a onda originada no tendrá el mismo
SECCIÓN : CÁCUO DE GOPE DE ARIETE CÁCUO DE GOPE DE ARIETE SEGÚN AIEVI El impato de la masa líquida ante una válvula no es igual si el ierre es instantáneo o gradual. a onda originada no tendrá el mismo
VECTORES EN EL PLANO. el punto B el extremo. Mientras no preste confusión el vector v podemos expresarlo simplemente por v.
 COLEGIO NUESTRO SEÑOR DE LA BUENA ESPERANZA Asignatra: FÍSICA 10º Profesor: Lic. EDUARDO DUARTE SUESCÚN TALLER DE VECTORES VECTORES EN EL PLANO Vector fijo. Es n segmento orientado. Lo representamos por
COLEGIO NUESTRO SEÑOR DE LA BUENA ESPERANZA Asignatra: FÍSICA 10º Profesor: Lic. EDUARDO DUARTE SUESCÚN TALLER DE VECTORES VECTORES EN EL PLANO Vector fijo. Es n segmento orientado. Lo representamos por
IDENTIFICAR LOS ELEMENTOS DE UN VECTOR
 8 REPSO POO OJETIVO IDENTIFICR LOS ELEMENTOS DE UN VECTOR Nombre: Crso: Fecha: Vector: segmento orientado determinado por dos pntos: (a, a ), origen del ector, y (b, b ), extremo del ector. Coordenadas
8 REPSO POO OJETIVO IDENTIFICR LOS ELEMENTOS DE UN VECTOR Nombre: Crso: Fecha: Vector: segmento orientado determinado por dos pntos: (a, a ), origen del ector, y (b, b ), extremo del ector. Coordenadas
Proceso selectivo profesores secundaria Madrid 2012, Física y Química 2 de julio de 2012 Revisado 21 junio 2018
 Proeso seletivo profesores seundaria Madrid 212, Físia y Químia 2 de julio de 212 3. Consideremos el esquema representado en la figura. En él una fuente láser F emite un haz (que supondremos, por senillez,
Proeso seletivo profesores seundaria Madrid 212, Físia y Químia 2 de julio de 212 3. Consideremos el esquema representado en la figura. En él una fuente láser F emite un haz (que supondremos, por senillez,
SEGUNDO PRINCIPIO DE LA TERMODINÁMICA
 SEGUNDO PRINCIPIO DE L ERMODINÁMIC UNIDD 3: 2 PRINCIPIO Muas osas ourren espontáneamente y otras no. De la observaión de los suesos otidianos puede deduirse ue los proesos espontáneos ourren en la direión
SEGUNDO PRINCIPIO DE L ERMODINÁMIC UNIDD 3: 2 PRINCIPIO Muas osas ourren espontáneamente y otras no. De la observaión de los suesos otidianos puede deduirse ue los proesos espontáneos ourren en la direión
SESIÓN DE APRENDIZAJE
 INSTITUCIÓN EDUCATIVA INMACULADA DE LA MERCED SESIÓN DE APRENDIZAJE APRENDIZAJE ESPERADO Determina la regla de orrespondenia de una funión Representa e Identifia funiones Resuelve operaiones on funiones
INSTITUCIÓN EDUCATIVA INMACULADA DE LA MERCED SESIÓN DE APRENDIZAJE APRENDIZAJE ESPERADO Determina la regla de orrespondenia de una funión Representa e Identifia funiones Resuelve operaiones on funiones
FUNDAMENTOS DEL ANÁLISIS MATRICIAL DE ESTRUCTURAS ARTICULADAS
 UNDAMENTO DEL ANÁLII MATICIAL DE ETUCTUA ATICULADA Prof. Carlo Navarro Departamento de Meánia de Medio Contino y Teoría de Etrtra MATIZ DE IGIDEZ DE UNA BAA BIATICULADA itema de referenia qe vamo a tilizar:
UNDAMENTO DEL ANÁLII MATICIAL DE ETUCTUA ATICULADA Prof. Carlo Navarro Departamento de Meánia de Medio Contino y Teoría de Etrtra MATIZ DE IGIDEZ DE UNA BAA BIATICULADA itema de referenia qe vamo a tilizar:
SIMULACIÓN MODULAR INTRODUCCIÓN A CHEMCAD 6.1
 INSIUO ECNOÓGICO DEPARAMENO DE INGENIERÍAS SEMESRE ENERO JUNIO 2009 SIMUACIÓN MODUAR INRODUCCIÓN A 6.1 (pronuniado /kemkad/) es un paquete de simulaión de proesos ampliamente usado. Dado el diseño oneptual
INSIUO ECNOÓGICO DEPARAMENO DE INGENIERÍAS SEMESRE ENERO JUNIO 2009 SIMUACIÓN MODUAR INRODUCCIÓN A 6.1 (pronuniado /kemkad/) es un paquete de simulaión de proesos ampliamente usado. Dado el diseño oneptual
-14 - ENTALPÍA DE FUSIÓN DEL HIELO
 -4 - ENTALPÍA DE FUSIÓN DEL HIELO OBJETIVO Determinar la entalpía de usión del hielo utilizando el método de las mezlas. Previamente, ha de determinarse el equivalente en agua del alorímetro, K, para uantiiar
-4 - ENTALPÍA DE FUSIÓN DEL HIELO OBJETIVO Determinar la entalpía de usión del hielo utilizando el método de las mezlas. Previamente, ha de determinarse el equivalente en agua del alorímetro, K, para uantiiar
TURBINAS DE VAPOR. José Agüera Soriano
 TURBINAS DE VAPOR Joé Agüera Soriano 0 Introdión En la trbina, el vapor tranforma primero entalpía en energía inétia y, lego, éta e edida al rodete obteniéndoe el trabajo ténio orrepondiente. entrada vapor
TURBINAS DE VAPOR Joé Agüera Soriano 0 Introdión En la trbina, el vapor tranforma primero entalpía en energía inétia y, lego, éta e edida al rodete obteniéndoe el trabajo ténio orrepondiente. entrada vapor
2. CARGA Y DESCARGA DE UN CONDENSADOR
 2. ARGA Y DESARGA DE UN ONDENSADOR a. PROESO DE ARGA La manera más senilla de argar un ondensador de apaidad es apliar una diferenia de potenial V entre sus terminales mediante una fuente de.. on ello,
2. ARGA Y DESARGA DE UN ONDENSADOR a. PROESO DE ARGA La manera más senilla de argar un ondensador de apaidad es apliar una diferenia de potenial V entre sus terminales mediante una fuente de.. on ello,
UN ANÁLISIS ELEMENTAL BENEFICIO-COSTO SOBRE LA OPTIMIZACIÓN DE LA UTILIDAD EN UN SISTEMA AGROFORESTAL
 UN ANÁLISIS ELEMENAL BENEFICIO-COSO SOBRE LA OPIMIZACIÓN DE LA UILIDAD EN UN SISEMA AGROFORESAL F.J. Zamdio-Sánhez División de Cienias Forestales de la Universidad Atónoma Chapingo. Chapingo, Méxio. C.P.
UN ANÁLISIS ELEMENAL BENEFICIO-COSO SOBRE LA OPIMIZACIÓN DE LA UILIDAD EN UN SISEMA AGROFORESAL F.J. Zamdio-Sánhez División de Cienias Forestales de la Universidad Atónoma Chapingo. Chapingo, Méxio. C.P.
Esquematizar experimentos de equilibrio térmico: agua-fe y agua-pb
 ermodinámia eoría (1212) Calor, trabajo y ambios de fase Esquematizar experimentos de uilibrio térmio: agua-fe y agua-pb CALOR () es la energía transferida entre un sistema termodinámio y sus alrededores,
ermodinámia eoría (1212) Calor, trabajo y ambios de fase Esquematizar experimentos de uilibrio térmio: agua-fe y agua-pb CALOR () es la energía transferida entre un sistema termodinámio y sus alrededores,
Realzado de Imágenes. Capitulo Introducción MN =
 Capitlo 4 Realzado de Imágenes 4. Introdcción En este capítlo amos a estdiar n conjnto de técnicas qe tratan de consegir na imagen mejorada y más nítida tanto para el obserador mano como para el ordenador.
Capitlo 4 Realzado de Imágenes 4. Introdcción En este capítlo amos a estdiar n conjnto de técnicas qe tratan de consegir na imagen mejorada y más nítida tanto para el obserador mano como para el ordenador.
NOTAS DEL CURSO TERMODINÁMICA QUÍMICA
 NOTAS DE CURSO TERODINÁICA QUÍICA Capítulo. Planteamiento de problemas de equilibrio de fases Dr. Enrique Bazúa Rueda Dr. Fernando Barragán Arohe Faultad de Químia UNA Febrero de 007 09/0/07, :55 . PANTEAIENTO
NOTAS DE CURSO TERODINÁICA QUÍICA Capítulo. Planteamiento de problemas de equilibrio de fases Dr. Enrique Bazúa Rueda Dr. Fernando Barragán Arohe Faultad de Químia UNA Febrero de 007 09/0/07, :55 . PANTEAIENTO
2. Teoría BCS. Física de los pares de Cooper
 . eoría CS. Físia de los pares de Cooper La primera teoría mirosópia de la superondutividad fue planteada en 957 por John ardeen, Leon Neil Cooper y Robert Shrieffer. La idea fundamental es tratar el problema
. eoría CS. Físia de los pares de Cooper La primera teoría mirosópia de la superondutividad fue planteada en 957 por John ardeen, Leon Neil Cooper y Robert Shrieffer. La idea fundamental es tratar el problema
Calor específico Calorimetría
 Calor espeíio Calorimetría Físia II Lieniatura en Físia 2003 Autores: Andrea Fourty María de los Angeles Bertinetti Adriana Foussats Calor espeíio y alorimetría Cátedra Físia II (Lieniatura en Físia) 1.-
Calor espeíio Calorimetría Físia II Lieniatura en Físia 2003 Autores: Andrea Fourty María de los Angeles Bertinetti Adriana Foussats Calor espeíio y alorimetría Cátedra Físia II (Lieniatura en Físia) 1.-
PROBLEMAS RESUELTOS. a. La potencia útil. b. El par motor. W t d. P útil P F
 ROBLEMAS RESUELTOS El moor de n aomóvil sminisra na poenia de 90 C a 5000 r.p.m. El vehílo se enenra sbiendo na pendiene, por lo qe iene qe vener na ferza de 1744,5 N en la direión del movimieno. La ransmisión
ROBLEMAS RESUELTOS El moor de n aomóvil sminisra na poenia de 90 C a 5000 r.p.m. El vehílo se enenra sbiendo na pendiene, por lo qe iene qe vener na ferza de 1744,5 N en la direión del movimieno. La ransmisión
VALIDACIÓN Y CÁLCULO DE INCERTIDUMBRES DEL MÉTODO DE DETERMINACIÓN DE CREATININA EN ORINA EN DOSIMETRÍA INTERNA
 VALIDACIÓN Y CÁLCULO DE INCERTIDUMBRES DEL MÉTODO DE DETERMINACIÓN DE CREATININA EN ORINA EN DOSIMETRÍA INTERNA I. Sierra, C. Hernández, P. Benito, C. López Laboratorio de Bioeliminaión. SDR. CIEMAT 1.
VALIDACIÓN Y CÁLCULO DE INCERTIDUMBRES DEL MÉTODO DE DETERMINACIÓN DE CREATININA EN ORINA EN DOSIMETRÍA INTERNA I. Sierra, C. Hernández, P. Benito, C. López Laboratorio de Bioeliminaión. SDR. CIEMAT 1.
ANÁLISIS DE LA EXTENSIÓN DE LA GRÁFICA DE UNA FUNCIÓN
 ANÁLISIS DE LA EXTENSIÓN DE LA GRÁFICA DE UNA FUNCIÓN Sugerenias al Profesor: Trabajar úniamente on funiones polinomiales y raionales, alarando que generalmente al bosquejar sus gráfias solo se muestra
ANÁLISIS DE LA EXTENSIÓN DE LA GRÁFICA DE UNA FUNCIÓN Sugerenias al Profesor: Trabajar úniamente on funiones polinomiales y raionales, alarando que generalmente al bosquejar sus gráfias solo se muestra
ECUACIONES BASICAS DE LA MAGNETOHIDRODINAMICA IDEAL. Sebastián Ramírez Ramírez pcm-ca.github.io/people/seramirezra/
 ECUACIONES BASICAS DE LA MAGNETOHIDRODINAMICA IDEAL Sebastián Ramírez Ramírez seramirezra@unal.edu.o pm-a.github.io/people/seramirezra/ La magnetohidrodinámia es la teoría que desribe la dinámia de un
ECUACIONES BASICAS DE LA MAGNETOHIDRODINAMICA IDEAL Sebastián Ramírez Ramírez seramirezra@unal.edu.o pm-a.github.io/people/seramirezra/ La magnetohidrodinámia es la teoría que desribe la dinámia de un
RELATIVIDAD. Conceptos previos:
 Coneptos muy básios de Relatiidad Espeial RELATIVIDAD Coneptos preios: Sistema de referenia inerial: Se trata de un sistema que se muee on eloidad onstante. En él se umple el prinipio de la ineria. Sistema
Coneptos muy básios de Relatiidad Espeial RELATIVIDAD Coneptos preios: Sistema de referenia inerial: Se trata de un sistema que se muee on eloidad onstante. En él se umple el prinipio de la ineria. Sistema
Singularidades. Una serie de Laurent es una serie de potencias que pueden ser positivas y/o negativas: a n (z z 0 ) n =
 Singularidades Hay muhas funiones que son analítias en una región on exepión de algunos puntos aislados donde no están definidas. Por ejemplo, /z es analítia en C {0} y os(z) es analítia en C {0, ±π, ±π,
Singularidades Hay muhas funiones que son analítias en una región on exepión de algunos puntos aislados donde no están definidas. Por ejemplo, /z es analítia en C {0} y os(z) es analítia en C {0, ±π, ±π,
TEMA 7: VECTORES. También un vector queda determinado por su módulo, dirección y sentido. Dado el vector u. = AB, se define: Módulo del vector u
 DPTO DE MATEMÁTICAS T5: VECTORES - 1 1.- VECTORES EN EL PLANO TEMA 7: VECTORES Hay magnitdes como ferza, desplazamiento, elocidad, qe no qedan completamente definidas por n número. Por ejemplo, no es sficiente
DPTO DE MATEMÁTICAS T5: VECTORES - 1 1.- VECTORES EN EL PLANO TEMA 7: VECTORES Hay magnitdes como ferza, desplazamiento, elocidad, qe no qedan completamente definidas por n número. Por ejemplo, no es sficiente
Elementos de Estadística Primer Examen Parcial (25%)
 UNIVERSIDAD CENTRAL DE VENEZUELA Cilo Básio Departamento de Matemátia Apliada Elementos de Estadístia (0260) Martes 10 de Mayo de 2011 Profesor: José Luis Quintero FACULTAD DE INGENIERÍA Elementos de Estadístia
UNIVERSIDAD CENTRAL DE VENEZUELA Cilo Básio Departamento de Matemátia Apliada Elementos de Estadístia (0260) Martes 10 de Mayo de 2011 Profesor: José Luis Quintero FACULTAD DE INGENIERÍA Elementos de Estadístia
DISEÑO Y ANÁLISIS DE DATOS EN PSICOLOGÍA II
 DISEÑO Y ANÁLISIS DE DATOS EN PSICOLOGÍA II PRÁCTICA 9 Problema.- En una determinada investigaión se estudia en diferentes estados amerianos la relaión entre varias variables soiodemográfias y el índie
DISEÑO Y ANÁLISIS DE DATOS EN PSICOLOGÍA II PRÁCTICA 9 Problema.- En una determinada investigaión se estudia en diferentes estados amerianos la relaión entre varias variables soiodemográfias y el índie
EXAMEN DE MECÁNICA SUELO Y CIMENT. (3º curso, P-98, MAYO 2007) 2º EJERCICIO. tiempo 1 hora y cuarto (6 puntos)
 EXAMEN DE MECÁNICA SUELO Y ENT. (º urso, P-98, MAYO 007) º EJERCICIO. tiempo 1 hora y uarto (6 puntos) Apellidos y Nombre En el emplazamiento de la figura, se quiere imentar un edifiio mediante losa (sin
EXAMEN DE MECÁNICA SUELO Y ENT. (º urso, P-98, MAYO 007) º EJERCICIO. tiempo 1 hora y uarto (6 puntos) Apellidos y Nombre En el emplazamiento de la figura, se quiere imentar un edifiio mediante losa (sin
Cálculo de la temperatura en el interior de la cámara de combustión en motores de combustión interna.
 Ingeniería eánia, 2 (2002) 7-15 7 Cállo de la temperatra en el interior de la ámara de omstión en motores de omstión interna. F. Soto Pa*, J. A. Silva**, A.. dos Santos***. Institto Sperior Politénio José
Ingeniería eánia, 2 (2002) 7-15 7 Cállo de la temperatra en el interior de la ámara de omstión en motores de omstión interna. F. Soto Pa*, J. A. Silva**, A.. dos Santos***. Institto Sperior Politénio José
A'' D'' C'' B'' A' C' Figura 1. Verdadera Magnitud de ángulos de rectas.
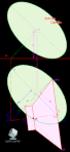 Tema 5: Ángulos entre retas y planos. Triedros Angulo de dos retas. El ángulo de dos retas es una de las magnitudes de las formas planas, y para obtener su verdadera magnitud se aplia el ambio de plano,
Tema 5: Ángulos entre retas y planos. Triedros Angulo de dos retas. El ángulo de dos retas es una de las magnitudes de las formas planas, y para obtener su verdadera magnitud se aplia el ambio de plano,
(3.1) MANUAL DE PRÁCTICAS DE LABORATORIO DE HIDRÁULICA
 MANUAL D PRÁCTICAS D LABORATORIO D HIDRÁULICA 49 NRGÍA SPCÍFICA Y FLUJO CRÍTICO OBJTIVOS Comprobar la teoría relaionada on el onepto de energía espeífia, analizando el flujo sobre un esalón o resalto en
MANUAL D PRÁCTICAS D LABORATORIO D HIDRÁULICA 49 NRGÍA SPCÍFICA Y FLUJO CRÍTICO OBJTIVOS Comprobar la teoría relaionada on el onepto de energía espeífia, analizando el flujo sobre un esalón o resalto en
Estudio del flujo de fluidos en canales abiertos
 PRÁTI 1 Estudio del flujo de fluidos en anales abiertos Área Meánia de Fluidos. Departamento Tenología. Uniersitat Jaume I Manual de Prátias de Hidráulia pliada 3 Objetio: lo largo de la prátia se pretende
PRÁTI 1 Estudio del flujo de fluidos en anales abiertos Área Meánia de Fluidos. Departamento Tenología. Uniersitat Jaume I Manual de Prátias de Hidráulia pliada 3 Objetio: lo largo de la prátia se pretende
CÁLCULO DE CALDERÍN. Autores: Pedro Gea José M. Navalón
 CÁLCULO DE CALDERÍN Autores: Pedro Gea José M. Navalón 1. INTRODUCCIÓN Para determinar el golpe de ariete produido en una instalaión protegida on alderín, en realidad, el problema en su ontexto real se
CÁLCULO DE CALDERÍN Autores: Pedro Gea José M. Navalón 1. INTRODUCCIÓN Para determinar el golpe de ariete produido en una instalaión protegida on alderín, en realidad, el problema en su ontexto real se
ANALISIS TEORICO DE LAS FUERZAS ACTUANTES SOBRE UN MOLINO DE EJE VERTICAL CON GEOMETRIA VARIABLE Y LEVA CONDUCTORA
 NLISIS TEORIO DE LS UERZS TUNTES SOBRE UN MOLINO DE EJE VERTIL ON GEOMETRI VRIBLE Y LEV ONDUTOR Vítor Rodrigo, Lis R. Merri, Las Rodrigo 3, Omar Masini 4, Rafael Rodrigo 5, Jaier arletto 6, Mario Bergoglio
NLISIS TEORIO DE LS UERZS TUNTES SOBRE UN MOLINO DE EJE VERTIL ON GEOMETRI VRIBLE Y LEV ONDUTOR Vítor Rodrigo, Lis R. Merri, Las Rodrigo 3, Omar Masini 4, Rafael Rodrigo 5, Jaier arletto 6, Mario Bergoglio
Hidráulica de pozo 6.1. PRUEBAS DE INYECCIÓN. de Hvorslev. de Cooper Bredehoeft. Bredehoeft Papadopulos
 idráulia de pozo 6.1. PRUEBAS DE INYECCIÓN 6.1.1. Método M de vorslev 6.1.. Método M de Cooper Bredehoeft Bredehoeft Papadopulos En el apítulo 4 se desarrollaron euaiones que desriben el flujo subterráneo.
idráulia de pozo 6.1. PRUEBAS DE INYECCIÓN 6.1.1. Método M de vorslev 6.1.. Método M de Cooper Bredehoeft Bredehoeft Papadopulos En el apítulo 4 se desarrollaron euaiones que desriben el flujo subterráneo.
Instituto de Física Facultad de Ingeniería Universidad de la República PROBLEMA 1
 EXEN - Física General 30 de jlio de 004 VERSIÓN Considere: g = 9,8 m/s R = 8,345 J / mol K PROBLE Una mestra de n mol de gas ideal encerrado en na cámara experimenta el ciclo mostrado en la figra, donde
EXEN - Física General 30 de jlio de 004 VERSIÓN Considere: g = 9,8 m/s R = 8,345 J / mol K PROBLE Una mestra de n mol de gas ideal encerrado en na cámara experimenta el ciclo mostrado en la figra, donde
UNIDAD II. INTEGRAL DEFINIDA Y LOS MÉTODOS DE INTEGRACIÓN. Tema: DENOMINADORES CON FACTORES LINEALES CUADRÁTICOS
 UNIDAD II. INTEGRAL DEFINIDA Y LOS MÉTODOS DE INTEGRACIÓN Tema: DENOMINADORES CON FACTORES LINEALES CUADRÁTICOS DENOMINADORES CON FACTORES LINEALES CUADRÁTICOS Cando al smar dos fracciones algebraicas
UNIDAD II. INTEGRAL DEFINIDA Y LOS MÉTODOS DE INTEGRACIÓN Tema: DENOMINADORES CON FACTORES LINEALES CUADRÁTICOS DENOMINADORES CON FACTORES LINEALES CUADRÁTICOS Cando al smar dos fracciones algebraicas
COORDINACION ACADEMICA UNIDAD QUERETARO. Problemas representativos para el examen de ingreso a doctorado. Termodinámica
 UNIDAD QUEREARO roblemas representativos para el examen de ingreso a doctorado ermodinámica Equilibrio térmico, ecuaciones de estado y trabajo 1.- Los sistemas 1 y son sales paramagnéticas con coordenadas
UNIDAD QUEREARO roblemas representativos para el examen de ingreso a doctorado ermodinámica Equilibrio térmico, ecuaciones de estado y trabajo 1.- Los sistemas 1 y son sales paramagnéticas con coordenadas
SOLUCIONES FÍSICA JUNIO 10 OPCIÓN A
 SOLUCIONES FÍSIC JUNIO 10 OCIÓN 1.- a) Veloidad de esape es la mínima que debe omuniarse a un uerpo, situado en la superfiie de un planeta de masa m p y radio r p, para que salga del ampo gravitatorio.
SOLUCIONES FÍSIC JUNIO 10 OCIÓN 1.- a) Veloidad de esape es la mínima que debe omuniarse a un uerpo, situado en la superfiie de un planeta de masa m p y radio r p, para que salga del ampo gravitatorio.
R. Alzate Universidad Industrial de Santander Bucaramanga, marzo de 2012
 Resumen de las Reglas de Diseño de Compensadores R. Alzate Universidad Industrial de Santander Buaramanga, marzo de 202 Sistemas de Control - 23358 Esuela de Ingenierías Elétria, Eletrónia y Teleomuniaiones
Resumen de las Reglas de Diseño de Compensadores R. Alzate Universidad Industrial de Santander Buaramanga, marzo de 202 Sistemas de Control - 23358 Esuela de Ingenierías Elétria, Eletrónia y Teleomuniaiones
12º CONGRESO IBEROAMERICANO DE INGENIERÍA MECÁNICA Guayaquil, 10 a 13 de Noviembre de 2015
 º CONGRESO IBEROAMERICANO DE INGENIERÍA MECÁNICA Gayaqil, a 3 de Noviembre de 5 ANÁLISIS PARAMÉTRICO DEL RENDIMIENTO PERIFÉRICO DE UNA TURBINA AXIAL CON ÁLABES SIMÉTRICOS Torres González E. V. *, Lgo Leyte
º CONGRESO IBEROAMERICANO DE INGENIERÍA MECÁNICA Gayaqil, a 3 de Noviembre de 5 ANÁLISIS PARAMÉTRICO DEL RENDIMIENTO PERIFÉRICO DE UNA TURBINA AXIAL CON ÁLABES SIMÉTRICOS Torres González E. V. *, Lgo Leyte
16 Corte en losas ACTUALIZACIÓN PARA EL CÓDIGO REQUISITOS ESPECIALES PARA LOSAS Y ZAPATAS Sección crítica para el corte
 16 Corte en losas ACTUALIZACIÓN PARA EL CÓDIGO 00 La atalizaión onsiste fndamentalmente en la revisión de los reqisitos para la armadra de orte y los onetores de orte en losas. Espeífiamente, los reqisitos
16 Corte en losas ACTUALIZACIÓN PARA EL CÓDIGO 00 La atalizaión onsiste fndamentalmente en la revisión de los reqisitos para la armadra de orte y los onetores de orte en losas. Espeífiamente, los reqisitos
VECTORES EN EL PLANO
 VECTORES EN EL PLANO.- PRIMERO DE BACHILLERATO.- TEORÍA Y EJERCICIOS. Pág. 1 VECTORES EN EL PLANO Vector fijo. Es n segmento orientado. Lo representamos por AB o por. El pnto A es el origen y el pnto B
VECTORES EN EL PLANO.- PRIMERO DE BACHILLERATO.- TEORÍA Y EJERCICIOS. Pág. 1 VECTORES EN EL PLANO Vector fijo. Es n segmento orientado. Lo representamos por AB o por. El pnto A es el origen y el pnto B
Teoria y Cuestiones. [a n cos (nx)+b n sin (nx)]
![Teoria y Cuestiones. [a n cos (nx)+b n sin (nx)] Teoria y Cuestiones. [a n cos (nx)+b n sin (nx)]](/thumbs/80/81469262.jpg) Ingeniero Industrial Asignatura: Transformadas Integrales y Euaiones en Derivadas Pariales Convoatoria de Febrero del 2004 Teoria y Cuestiones 1. Consideremos la funión ½ 0 si
Ingeniero Industrial Asignatura: Transformadas Integrales y Euaiones en Derivadas Pariales Convoatoria de Febrero del 2004 Teoria y Cuestiones 1. Consideremos la funión ½ 0 si
Examen final de Cálculo Integral
 xamen final de Cálulo Integral 6 de septiembre de 1 (Soluiones) Cuestiones C 1 Apliando el teorema 1.15 y definiión 1. de los apuntes se onluye inmediatamente que el valor de la integral oinide on la longitud
xamen final de Cálulo Integral 6 de septiembre de 1 (Soluiones) Cuestiones C 1 Apliando el teorema 1.15 y definiión 1. de los apuntes se onluye inmediatamente que el valor de la integral oinide on la longitud
(g) XeF 4. Se mezclan 0,4 moles de xenón con 0,8 moles de flúor en un recipiente de 2,0 L. En el equilibrio, el 60 % del Xe se ha convertido en XeF 4
 A 00º C de temeratura, se rodue la reaión: Xe g + F g XeF 4 g Se mezlan 0,4 moles de xenón on 0,8 moles de flúor en un reiiente de,0 L. En el equilibrio, el 60 % del Xe se ha onvertido en XeF 4. Determina:
A 00º C de temeratura, se rodue la reaión: Xe g + F g XeF 4 g Se mezlan 0,4 moles de xenón on 0,8 moles de flúor en un reiiente de,0 L. En el equilibrio, el 60 % del Xe se ha onvertido en XeF 4. Determina:
independiente de la cantidad de masa y es propio de cada sustancia c =.
 Tema 7 Termodinámia 7.. Calorimetría y ambios de fase. 7... Capaidad alorífia y alor espeífio. La temperatura de un uerpo aumenta uando se añade alor o disminuye uando el uerpo desprende alor. (Por el
Tema 7 Termodinámia 7.. Calorimetría y ambios de fase. 7... Capaidad alorífia y alor espeífio. La temperatura de un uerpo aumenta uando se añade alor o disminuye uando el uerpo desprende alor. (Por el
Lección 4. Ecuaciones diferenciales. 4. Propiedades algebraicas de las soluciones. Fórmulas de Abel y Liouville.
 GRADO DE INGENIERÍA AEROESPACIAL. CURSO 0. 4. Proiedades algebraias de las soluiones. Fórmulas de Abel y Liouville. A lo largo de esta seión suondremos que P, Q y R son funiones ontinuas en un intervalo
GRADO DE INGENIERÍA AEROESPACIAL. CURSO 0. 4. Proiedades algebraias de las soluiones. Fórmulas de Abel y Liouville. A lo largo de esta seión suondremos que P, Q y R son funiones ontinuas en un intervalo
UNIDAD 1 Ecuaciones Diferenciales de Primer Orden
 UNIDAD UNIDAD Ecaciones Diferenciales de Primer Orden Definición Clasificación de las Ecaciones Diferenciales Una ecación diferencial es aqélla qe contiene las derivadas o diferenciales de na o más variables
UNIDAD UNIDAD Ecaciones Diferenciales de Primer Orden Definición Clasificación de las Ecaciones Diferenciales Una ecación diferencial es aqélla qe contiene las derivadas o diferenciales de na o más variables
Controles de Calidad en la Fabricación de un Rodete Pelton. Murray Garcia, Harry Ernesto CAPITULO II MARCO TEORICO
 CAPITULO II MARCO TEORICO Reordemos que las Turbinas Pelton son Turbinas de Aión, y son apropiadas para grandes saltos y pequeños audales; por lo ual sus números espeífios son bajos. Referente a las partes
CAPITULO II MARCO TEORICO Reordemos que las Turbinas Pelton son Turbinas de Aión, y son apropiadas para grandes saltos y pequeños audales; por lo ual sus números espeífios son bajos. Referente a las partes
NOTAS CONTROL II. Hector A. Botero Castro Lina María Gómez Echavarría Universidad Nacional de Colombia-Sede Medellín Facultad de Minas 01/2008
 NOTAS CONTROL II Hetor A. Botero Castro Lina María Gómez Ehavarría Universidad Naional de Colombia-Sede Medellín Faultad de Minas 0/2008 FRT050: en google. www. Control.lth.se/~kursar/ INTRODUCCIÓN. Anteedentes..
NOTAS CONTROL II Hetor A. Botero Castro Lina María Gómez Ehavarría Universidad Naional de Colombia-Sede Medellín Faultad de Minas 0/2008 FRT050: en google. www. Control.lth.se/~kursar/ INTRODUCCIÓN. Anteedentes..
Fórmula integral de Cauchy
 Fórmula integral de Cauhy Fórmula integral de Cauhy. Si una funión f es analítia en una región que ontiene a urva simple errada y a su interior, entones para ada punto z 0 enerrado por, dz = 2πi f(z 0
Fórmula integral de Cauhy Fórmula integral de Cauhy. Si una funión f es analítia en una región que ontiene a urva simple errada y a su interior, entones para ada punto z 0 enerrado por, dz = 2πi f(z 0
GUÍA PARA DIRECTORES DE PLANTELES ESCOLARES DE EDUCACIÓN BÁSICA, PARA EL PROCESO DE INSCRIPCIÓN DE FEBRERO CICLO ESCOLAR
 GUÍA PARA DIRECTORES DE PLANTELES ESCOLARES DE EDUCACIÓN BÁSICA, PARA EL PROCESO DE INSCRIPCIÓN DE FEBRERO CICLO ESCOLAR 2013-2014 INDICE 1.- Objetivo... 3 2.- Proeso de Insripión... 3 3.- Cómo Aeder al
GUÍA PARA DIRECTORES DE PLANTELES ESCOLARES DE EDUCACIÓN BÁSICA, PARA EL PROCESO DE INSCRIPCIÓN DE FEBRERO CICLO ESCOLAR 2013-2014 INDICE 1.- Objetivo... 3 2.- Proeso de Insripión... 3 3.- Cómo Aeder al
INTRODUCCIÓN A LAS MATEMÁTICAS SUPERIORES. Tema 1
 INTRODUCCIÓN A LAS MATEMÁTICAS SUPERIORES Tema 1 1.1 BREE INTRODUCCIÓN A LA LÓGICA MATEMÁTICA Bibliografía: Smith, Karl J.- Introduión a la Lógia simbólia.- Grupo Editorial Iberoaméria.- Méio, 1991. Espinosa
INTRODUCCIÓN A LAS MATEMÁTICAS SUPERIORES Tema 1 1.1 BREE INTRODUCCIÓN A LA LÓGICA MATEMÁTICA Bibliografía: Smith, Karl J.- Introduión a la Lógia simbólia.- Grupo Editorial Iberoaméria.- Méio, 1991. Espinosa
