(g) XeF 4. Se mezclan 0,4 moles de xenón con 0,8 moles de flúor en un recipiente de 2,0 L. En el equilibrio, el 60 % del Xe se ha convertido en XeF 4
|
|
|
- Felisa Montserrat Reyes Villalba
- hace 7 años
- Vistas:
Transcripción
1 A 00º C de temeratura, se rodue la reaión: Xe g + F g XeF 4 g Se mezlan 0,4 moles de xenón on 0,8 moles de flúor en un reiiente de,0 L. En el equilibrio, el 60 % del Xe se ha onvertido en XeF 4. Determina: a El valor de C y. [ XeF4 ] b La resión total. C Moles iniiales Xe g + F g XeF 4 g 0,4 0,8 0 Moles que desaareen x x 0 Moles formados 0 0 x Moles en equilibrio 0,4 - x 0,8 - x x [XeF 4 ] Moles de XeF 4 x moles L Moles de Xe 0,4 x moles [Xe] L [ Xe][ F ] [F ] Moles de F 0,8 - x moles L Cuánto vale x?
2 En el enuniado, nos dien que: A 00º C de temeratura, se rodue la reaión: Xe g + F g XeF 4 g Se mezlan 0,4 moles de xenón on 0,8 moles de flúor en un reiiente de,0 L. En el equilibrio, el 60 % del Xe se ha onvertido en XeF 4. Determina: a El valor de C y. b La resión total. Si artimos de 0,4 moles de Xe y el 60 % de esos 0,4 moles se ha onvertido en XeF 4, signifia que: El número de moles de XeF 4 es el 60 % de 0,4, es deir: x 0, ,4 moles de XeF 4 Por tanto, onoido el valor de x, se ueden alular las onentraiones de todas las sustanias. Así:
3 [XeF 4 ] Moles de XeF 4 x moles L 0,4 moles L [XeF 4 ] 0,1 mol L -1 [Xe] Moles de Xe 0,4 x moles L 0,4 0,4 moles L [Xe] 0,08 mol L -1 [F ] Moles de F 0,8 - x moles L 0,8-0,4 moles L [F ] 0,16 mol L -1 [ XeF4 ] C [ Xe][ F ] Por último, sólo resta sustituir estos valores en: C 0,1 0,080,16 58, 59mol L
4 Antes de alular, vamos a justifiar qué es y ómo está relaionada on. En nuestro equilibrio genério, suongamos que todas las sustanias son gases: aa g + bb g C g +dd g El valor de viene dado or la exresión: [ C] [ A] a [ D] [ B] d b A las sustanias en estado gaseoso, se les uede aliar la euaión de estado de los gases erfetos, es deir, Vn. Así,, ara ada sustania en estado gaseoso, se odrá esribir que: A Vn A B Vn B C Vn C D Vn D Siendo A, B, C y D las resiones que ejeren or searado ada sustania gaseosa, y que se onoen omo resiones ariales. n A, n B, n C y n D son los moles de ada eseie químia. Por último V es el volumen del reiiente donde se realiza el equilibrio, R es la onstante de los gases erfetos y T es la temeratura a la que se lleva a abo el equilibrio, exresada en grados kelvin.
5 Como, or definiión, la onentraión molar [ ], es el oiente entre el número de moles y el volumen en donde se enuentran dihos moles, se tiene que: [A] n A V [B] n B V [C] n C V [D] n D V Por otro lado, las resiones ariales y las onentraiones están relaionadas: A Vn A A n A V [A] A B Vn B B n B V [B] B C Vn C C n C V [C] C D Vn D D n D V [D] D Ahora, vamos a sustituir estos valores en
6 b a d B A D C ] [ ] [ ] [ ] [ b B a A d D C Obsérvese que el fator está inluido en todos los términos, y se uede aliar la roiedad de oiente de otenias de misma base, on lo que resulta: 1 b a d b B a A d D C + +
7 1 b a d b B a A d D C + + Al rimer gran aréntesis se le denomina P b B a A d D C P n Δ 1 Al exonente +d a+b se denomina Δn, y exresa la diferenia entre el número de moles gaseosos de los rodutos y el número de moles gaseosos de los reativos n P Δ Obsérvese que si Δn 0, P C
8 Por tanto, ara hallar P bastará on sustituir los valores de C, R, T y Δn en la exresión deduida: P Δ n 1 1 0,08atm L mol 473 [1 1+ ] P 58,59mol L P 58,59 0, mol L atm L mol P 9,40atm
9 Por último, ara alular la resión total en el reiiente una vez alanzado el equilibrio, se uede utilizar la exresión: V n total total total n total V Para alular el número total de moles gaseosos, volvamos al balane de moles de la rimera diaositiva Xe g + F g XeF 4 g Moles en equilibrio 0,4 - x 0,8 - x x Número total de moles : 0,4 x + 0,8 x + x 1, x Como x 0,4 El número total de moles, es: 0,7 moles 0,7 0, total atm total 13, 96atm También se uede alular omo suma de las resiones ariales de ada sustania
10 Se introduen 0, moles de Br g en un reiiente de 0,5 litros a 600 C, siendo el grado de disoiaión en esas ondiiones 0,8. Calula y C del equilibrio [ Br] C [ Br ] Moles iniiales Br g Br g Br g 0, 0 Moles que desaareen x 0 Moles formados 0 x Moles en equilibrio 0, - x x Br g [Br ] Moles de Br x moles 0,5 L [Br ] Moles de Br 0, - x moles 0,5 L Cuánto vale x?
11 En el enuniado, nos dien que: Se introduen 0, moles de Br g en un reiiente de 0,5 litros a 600 C, siendo el grado de disoiaión en esas ondiiones 0,8. Calula y C del equilibrio Br g Br g Como el grado de disoiaión es 0,8, signifia que or ada mol de Br, 0,8 se onvierten en Br, o bien que de ada 100 moles de Br 80 se onvierten en Br. El número de moles de Br es el 80 % de 0,, es deir: x 0, ,16 moles de Br Por tanto, onoido el valor de x, se ueden alular las onentraiones de todas las sustanias. Así:
12 [Br ] Moles de Br x moles 0,5 L 0,16 moles 0,5 L [Br] 0,64 mol L -1 [Br ] Moles de Br 0, - x moles 0,5 L 0,-0,16 moles 0,5 L [Br ] 0,08 mol L -1 Por último, sólo resta sustituir estos valores en: [ Br] C [ Br ] C 0,64 1 5,1mol L 0,08
13 Para hallar P bastará on sustituir los valores de C, R, T y Δn en la exresión: P Δ n 1 1 0,08atm L mol 873 P 1 1 5,1mol L 1 P 1 1 5,1 0, mol L atm L mol 366, 5atm P
14 Para la reaión: H g + I g HI g, 54,4 a 355 C a Calula qué orentaje de I se onvierte en HI si mezlamos 0, moles de I y 0, moles de H. El equilibrio se establee a 355º C y la resión total es 0,5 atm. b India ómo influye en la obtenión de HI: un aumento del volumen del reiiente; la adiión de un gas inerte a volumen onstante. Moles iniiales H g + I g HI g 0, 0, 0 Moles que desaareen x x 0 Moles formados 0 0 x HI H I Moles en equilibrio 0, - x 0, - x x Cuánto vale x? En el equilibrio, ara ada sustania en estado gaseoso, se odrá esribir que: HI Vn HI HI n HI x V H Vn H H n V H 0, x V V I Vn I I n I 0, x V V
15 Sustituyendo en : HI H I x V 0, x 0, x V V 4x 0, x 54,4 Se uede extraer raíz uadrada en ambos miembros, y resulta: 4x 0, x 54,4 x 7, 38 0, x x 0, 157 Como los moles en equilibrio de HI son x, resulta que hay 0,314 moles de HI. Como hemos artido de 0, moles de I, si hubiera reaionado el 100 % se habrían obtenido 0,4 moles de HI. Por tanto: % de I se onvierte en HI 0, ,4 78,5 %
16 b India ómo influye en la obtenión de HI: un aumento del volumen del reiiente; la adiión de un gas inerte a volumen onstante. Tanto la adiión de un gas inerte omo el aumento del volumen del reiiente afetan a la resión de la mezla que reaiona. Pero no se afeta al equilibrio, uesto que no hay variaión del número global de moles gaseosos al asar de los reativos a los rodutos durante la reaión. Si así fuera, el equilibrio se deslazaría haia donde hubiera un menor número de moles al aumentar la resión, y en sentido ontrario al disminuirla.
17 Se añade un mol de gas NOCl a un reiiente de 4 litros a 5 C. El NOCl se desomone y forma NO y Cl gaseosos. A 5 C, C, M ara NOCl g NO g+ Cl g. a Cuáles son las onentraiones de las eseies en equilibrio? el NOCl se desomone oo dado el valor de C. b Calula a la misma temeratura. Moles iniiales NOCl g NO g + Cl g Moles que desaareen x 0 0 Moles formados 0 x x [ NO] [ Cl C [ NOCl] ] Moles en equilibrio 1 - x x x En el equilibrio, ara ada sustania, la onentraión es: Moles de NO x moles [NO ] 4 L [Cl ] Moles de Cl x moles 4 L [NOCl ] Moles de NOCl 1 - x moles 4 L Cuánto vale x?
18 Sustituyendo en C : C x 3 [ NO] [ Cl 3 ] x 10,0 10 [ NOCl] x x 1 x 4 x 1 x 4 1 x Efetuando la exresión resulta la euaión de terer grado: x x x Cuya soluión real es x 5,
19 En el equilibrio, ara ada sustania la onentraión es: [NO ] [Cl ] Moles de NO Moles de Cl x moles 4 L x moles 4 L 5, moles 4 L 5, moles 4 L [NOCl ] Moles de NOCl 1 - x moles 4 L 1-5, moles 4 L [NO ], M [Cl ] 1, M [NOCl ] 0,49 M b Para hallar P bastará on sustituir los valores de C, R, T y Δn en la exresión P P Δ n 1 1 0,08atm L mol ,0 10 mol L 3 4, P atm
20 Alternativa al álulo de x En la exresión : C La euaión x 3 [ NO] [ Cl 3 ] x 10,0 10 [ NOCl] x x 1 x 4 x 1 x 4 1 x 3 x 1 x, Puede aroximarse rátiamente a: x 3, La razón es que el NOCl se desomone muy oo dado el valor de C y, el valor de x será muy equeño, tan equeño que el resultado de 1- x, es rátiamente 1 Esta aroximaión, no siemre es osible realizarla sin ometer un gran error. Para valores de del orden de 10-5 y menores, se uede ontemlar esta osibilidad, omo veremos, en los equilibrios de roduto de solubilidad y en los equilibrios áido-base. x, ,
21 En un deósito de 10 L se introduen 0,61 moles de CO y 0,39 moles de H, a 150 C. Una vez la reaión H g + CO g CO g + H O g ha alanzado el equilibrio, se enuentra que hay 0,35 moles de CO. Calula: a La onentraión de las eseies y el valor de la onstante de equilibrio a diha temeratura. b La omosiión de la mezla al añadir 0, moles de H, manteniendo onstante la temeratura. H g + CO g CO g + H O g Moles iniiales 0,39 0, Moles que desaareen x x 0 0 Moles formados Moles en equilibrio 0 0 x x 0,39 - x 0,61 - x x x En el equilibrio, ara ada sustania, la onentraión es: [CO ] Moles de CO [H ] [CO ] Moles de H x moles 10 L Moles de CO [H O ] Moles de H O 0,39 - x moles 10 L 0,61 - x moles Cuánto vale x? 10 L x moles 10 L
22 Como, nos die el enuniado, hay 0,35 moles de CO y del balane de materia sabemos que hay 0,61 x moles de CO : 0,61 x 0,35 x 0,6 moles Sustituyendo este valor en las exresiones anteriores, se obtiene: [CO ] 0,06 M [H O ] 0,06 M [H ] 0,013 M [CO ] 0,035 M Y on estos datos se alula, sin difiultad, el valor de : C [ CO][ H O] [ H ][ CO ] 0,06 0,06 0,013 0,035 1,486
23 b La omosiión de la mezla al añadir 0, moles de H, manteniendo onstante la temeratura. Si onsideramos la situaión : H g + CO g CO g + H O g Moles en equilibrio 0,13 0,35 0,6 0,6 Si añadimos 0, moles de H se rome el equilibrio. 0,13 + 0, 0,35 0,6 0,6 Según el riniio de Le Châtelier, al añadir 0, de la H, el equilibrio se deslazará haia la dereha ara disminuir la onentraión de H, ero no variará. El nuevo balane de materia resulta: H g + CO g CO g + H O g Moles iniiales 0,13 + 0, 0,35 0,6 0,6 Moles que desaareen Moles formados y y y y Moles en equilibrio 0,35 - y 0,35 - y 0,6 + y 0,6 + y En el nuevo equilibrio, ara ada sustania, la onentraión es: [CO ] Moles de CO [H ] [CO ] Moles de H Moles de CO 0,6 + y moles 10 L [H O ] Moles de H O 0,35 - y moles 10 L 0,35 - y moles 10 L Cuánto vale y? 0,6 + y 10 L
24 Sustituyendo en C : C [ CO][ H O] [ H ][ CO ] 0, ,35 10 y 0,6 + y 10 y 0,35 y 10 0,6 + y 0,35 y Se uede extraer raíz uadrada en ambos miembros, y resulta: 1,486 0,6 0,35 + y y 1,486 0,6 + y 1, 19 0,35 y y 0, 075moles Sustituyendo este valor en las exresiones anteriores, se obtiene: [CO ] 0,00335 M [H O ] 0,00335 M [H ] 0,0075 M [CO ] 0,0075 M Siendo esta la nueva omosiión del equilibrio
25 Este aartado, también se uede resolver aliando el balane de materia a una situaión en la que la antidad de sustania iniial de H fuera la suma de los 0,39 moles del iniio más los 0, moles que se añaden on osterioridad. Esto es así dado que el equilibrio se alanzará en la misma medida, orque no se ha variado la temeratura a la que transurre el roeso y, or tanto, no ambia. El balane de materia así lanteado sería: H g + CO g CO g + H O g Moles iniiales 0,61 0, Moles que desaareen z z 0 0 Moles formados 0 0 z z Moles en equilibrio 0,61 - z 0,61 - z z z Sustituyendo en, se halla el valor de z, y se uede omrobar que se obtienen las mismas onentraiones en el nuevo equilibrio.
26 Para la reaión: ICl s I s + Cl g, la onstante vale 0,4, a 5 C uando la resión se exresa en atmósferas. En un reiiente de dos litros donde se ha heho el vaío, se introduen moles de ICl s. a Cuál será la onentraión del Cl g al alanzar el equilibrio? b Cuántos gramos de ICl s quedarán? Datos: m I 16,9; m Cl 35,5. ICl s I s + Cl g Moles iniiales 0 0 Moles que desaareen Moles formados Moles en equilibrio x x x - x x x El valor de x se uede alular, aliando la onstante de equilibrio. Como Cl es la únia sustania gaseosa que interviene en la reaión: P Cl
27 Como V n n V xmoles 0,08atm L mol L Cl Cl 0, 4 atm 4,436x 0,48 x 0, 0196moles En el equilibrio, ara el Cl, la onentraión es: [Cl ] Moles de Cl x moles L 0,0196 moles L 0,0098 moles L -1 b Cuántos gramos de ICl s quedarán? En el equilibrio hay - x moles de ICl, es deir: 0,0196 1,961 moles de ICl Lo que transformado en gramos son: m ICl 1,961moles 16,4g / mol 318, 3gICl
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 6, Oión A Reserva 1, Ejeriio, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio 6, Oión A Reserva, Ejeriio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 6, Oión A Reserva 1, Ejeriio, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio 6, Oión A Reserva, Ejeriio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2013 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 013 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio 3, Oión A Reserva 3, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 013 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio 3, Oión A Reserva 3, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 008 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Reserva 1, Ejeriio 6, Oión A Reserva, Ejeriio 3, Oión A Reserva, Ejeriio 6, Oión B Reserva 3, Ejeriio 3, Oión A Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 008 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Reserva 1, Ejeriio 6, Oión A Reserva, Ejeriio 3, Oión A Reserva, Ejeriio 6, Oión B Reserva 3, Ejeriio 3, Oión A Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 6, Oión A Reserva, Ejeriio 3, Oión A Reserva, Ejeriio 5, Oión B Reserva 3, Ejeriio 3, Oión A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 6, Oión A Reserva, Ejeriio 3, Oión A Reserva, Ejeriio 5, Oión B Reserva 3, Ejeriio 3, Oión A Reserva 3,
EQUILIBRIO QUÍMICO QCA 07
 1.- Dado el equilibrio: N (g) + 3 H (g) NH 3 (g) Justifique la influenia sobre el mismo de: a) Un aumento de la resión total. b) Una disminuión de la onentraión de N. ) Una disminuión de la temeratura.
1.- Dado el equilibrio: N (g) + 3 H (g) NH 3 (g) Justifique la influenia sobre el mismo de: a) Un aumento de la resión total. b) Una disminuión de la onentraión de N. ) Una disminuión de la temeratura.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Opión A Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión B Reserva 1, Ejeriio 6, Opión B Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Opión A Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión B Reserva 1, Ejeriio 6, Opión B Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
Equilibrio en las reacciones químicas: equilibrio dinámico. Energía de Gibbs y constante de equilibrio
 Equilibrio en las reaiones químias: equilibrio dinámio Constante t de equilibrio: i eq,, Control inétio y ontrol termodinámio Coiente de reaión Priniio de Le Châtelier Energía de Gibbs y onstante de equilibrio
Equilibrio en las reaiones químias: equilibrio dinámio Constante t de equilibrio: i eq,, Control inétio y ontrol termodinámio Coiente de reaión Priniio de Le Châtelier Energía de Gibbs y onstante de equilibrio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 05 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 5, Opión B Reserva, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión B Reserva, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 05 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 5, Opión B Reserva, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión B Reserva, Ejeriio
EJERCICIOS DE EQUILIBRIO QUÍMICO. R// a)0,8 moles, 2,4 moles, 0,4 moles, 2,22 atm, 6,66 atm, 1,11 atm. b)kp= 1,
 EJERCICIS DE EQUILIBRI QUÍMIC 1-.- A 70ºC se mezlan 1 mol de N y moles de H, al llegar al equilibrio, se han formado 0, moles de NH, y la resión es de 10 atm. Hallar: a) los moles de ada gas y la resión
EJERCICIS DE EQUILIBRI QUÍMIC 1-.- A 70ºC se mezlan 1 mol de N y moles de H, al llegar al equilibrio, se han formado 0, moles de NH, y la resión es de 10 atm. Hallar: a) los moles de ada gas y la resión
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 5, Opión B Reserva 1, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión B Reserva, Ejeriio 6, Opión B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 5, Opión B Reserva 1, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión B Reserva, Ejeriio 6, Opión B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2001 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 001 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 3, Opión B Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión A Reserva 1, Ejeriio
PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 001 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 3, Opión B Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión A Reserva 1, Ejeriio
EQUILIBRIO QUÍMICO QCA 04 ANDALUCÍA
 1.- Considérese el siguiente sistema en equilibrio: SO 3 (g) SO (g) + 1/ O (g) H > 0 Justifique la veraidad o falsedad de las siguientes afirmaiones: a) Al aumentar la onentraión de oxígeno, el equilibrio
1.- Considérese el siguiente sistema en equilibrio: SO 3 (g) SO (g) + 1/ O (g) H > 0 Justifique la veraidad o falsedad de las siguientes afirmaiones: a) Al aumentar la onentraión de oxígeno, el equilibrio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
EQUILIBRIO QUÍMICO QCA 01
 1.- En un reiiente de 1L, a 000, se introduen 6 1 10-3 moles de CO y una ierta antidad de H, roduiéndose la reaión: H (g) + CO (g) H O(g) + CO(g) Si uando se alanza el equilibrio, la resión total es de
1.- En un reiiente de 1L, a 000, se introduen 6 1 10-3 moles de CO y una ierta antidad de H, roduiéndose la reaión: H (g) + CO (g) H O(g) + CO(g) Si uando se alanza el equilibrio, la resión total es de
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 01 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 5, Opión B Reserva 1, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión A Reserva, Ejeriio 6, Opión B Reserva 3,
PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 01 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 5, Opión B Reserva 1, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión A Reserva, Ejeriio 6, Opión B Reserva 3,
Equilibrio Químico (I) Kc. Cociente de reacción
 K. Coiente de reaión IES La Magdalena. Avilés. Asturias Cuando se lleva a abo una reaión químia podemos enontrarnos on las siguientes situaiones: Las onentraiones iniiales de los reativos van disminuyendo
K. Coiente de reaión IES La Magdalena. Avilés. Asturias Cuando se lleva a abo una reaión químia podemos enontrarnos on las siguientes situaiones: Las onentraiones iniiales de los reativos van disminuyendo
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2001 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 001 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 3, Opión B Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión A Reserva 1, Ejeriio
PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 001 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 3, Opión B Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión A Reserva 1, Ejeriio
2.1. CONSTANTE DE EQUILIBRIO. LEY DE ACCIÓN DE MASAS. Si tenemos un proceso químico expresado de forma general como: c C (g) + d D (g)
 Las reaiones químias se pueden dividir en reversibles e irreversibles, según puedan transurrir en los dos sentidos o en uno sólo. En las reaiones reversibles tanto las sustanias reaionantes omo los produtos
Las reaiones químias se pueden dividir en reversibles e irreversibles, según puedan transurrir en los dos sentidos o en uno sólo. En las reaiones reversibles tanto las sustanias reaionantes omo los produtos
TEMA 10: EQUILIBRIO QUÍMICO
 TEMA : EQUILIBRIO QUÍMICO. Conepto de equilibrio químio: reaiones reversibles. Existen reaiones, denominadas irreversibles, que se araterizan por transurrir disminuyendo progresivamente la antidad de sustanias
TEMA : EQUILIBRIO QUÍMICO. Conepto de equilibrio químio: reaiones reversibles. Existen reaiones, denominadas irreversibles, que se araterizan por transurrir disminuyendo progresivamente la antidad de sustanias
Ley de Acción de masas. Constante de equilibrio.
 Tema 5. Equilibrio Químio Ley e Aión e masas. Constante e equilibrio. Coiente e reaión. Caraterístias el equilibrio químio. Formas e eresar las onstantes e equilibrio y relaiones entre ellas. Grao e isoiaión.
Tema 5. Equilibrio Químio Ley e Aión e masas. Constante e equilibrio. Coiente e reaión. Caraterístias el equilibrio químio. Formas e eresar las onstantes e equilibrio y relaiones entre ellas. Grao e isoiaión.
a) Aumento de la temperatura K c b) Adición de I 2 O 5 (s) Cantidad de I 2 c) Aumento de la presión Cantidad de CO
 1.- Cosidere el siguiete sistema geeral e equilibrio: a A(g) + b B(g) C(g) + d D(g) H < a) Idique razoadamete e qué aso so iguales los valores de las ostates y. b) Justifique ómo afetará al sistema la
1.- Cosidere el siguiete sistema geeral e equilibrio: a A(g) + b B(g) C(g) + d D(g) H < a) Idique razoadamete e qué aso so iguales los valores de las ostates y. b) Justifique ómo afetará al sistema la
Lección 4. Ecuaciones diferenciales. 4. Propiedades algebraicas de las soluciones. Fórmulas de Abel y Liouville.
 GRADO DE INGENIERÍA AEROESPACIAL. CURSO 0. 4. Proiedades algebraias de las soluiones. Fórmulas de Abel y Liouville. A lo largo de esta seión suondremos que P, Q y R son funiones ontinuas en un intervalo
GRADO DE INGENIERÍA AEROESPACIAL. CURSO 0. 4. Proiedades algebraias de las soluiones. Fórmulas de Abel y Liouville. A lo largo de esta seión suondremos que P, Q y R son funiones ontinuas en un intervalo
PRÁCTICA 14 DESPLAZAMIENTO DEL EQUILIBRIO QUÍMICO: EFECTO DE LA CONCENTRACIÓN Y DE LA TEMPERATURA
 PRÁCTICA 14 DESPLAZAMIENTO DEL EQUILIBRIO QUÍMICO: EFECTO DE LA CONCENTRACIÓN Y DE LA TEMPERATURA OBJETIVOS Fijar el onepto de equilibrio químio mediante el estudio experimental de distintas mezlas de
PRÁCTICA 14 DESPLAZAMIENTO DEL EQUILIBRIO QUÍMICO: EFECTO DE LA CONCENTRACIÓN Y DE LA TEMPERATURA OBJETIVOS Fijar el onepto de equilibrio químio mediante el estudio experimental de distintas mezlas de
La relación que existe entre un cambio de elevación h, en un líquido y un cambio en la presión, Δp, p h [Kg/m 2 ]
![La relación que existe entre un cambio de elevación h, en un líquido y un cambio en la presión, Δp, p h [Kg/m 2 ] La relación que existe entre un cambio de elevación h, en un líquido y un cambio en la presión, Δp, p h [Kg/m 2 ]](/thumbs/62/48298239.jpg) II.3. DESRROLLO DE L RELCION PRESION-ELEVCION es: La relaión que existe entre un ambio de elevaión h, en un líquido un ambio en la resión, Δ, h [Kg/m ].3. Donde γ es el eso eseífio del líquido, esta viene
II.3. DESRROLLO DE L RELCION PRESION-ELEVCION es: La relaión que existe entre un ambio de elevaión h, en un líquido un ambio en la resión, Δ, h [Kg/m ].3. Donde γ es el eso eseífio del líquido, esta viene
Cuestiones. Problemas EQUILIBRIO QUÍMICO
 Cuestiones y Problemas EQUILIBRIO QUÍMICO AUTOR: TOMÁS MATA GARCÍA PROBLEMAS 1. En un reipiente de 4 litros, a una ierta temperatura, se introduen las antidades de HCl, O y Cl indiadas en la tabla, estableiéndose
Cuestiones y Problemas EQUILIBRIO QUÍMICO AUTOR: TOMÁS MATA GARCÍA PROBLEMAS 1. En un reipiente de 4 litros, a una ierta temperatura, se introduen las antidades de HCl, O y Cl indiadas en la tabla, estableiéndose
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 003 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 6, Oción A Reserva 1, Ejercicio 3, Oción A Reserva 1, Ejercicio 5, Oción B Reserva, Ejercicio 6, Oción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 003 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 6, Oción A Reserva 1, Ejercicio 3, Oción A Reserva 1, Ejercicio 5, Oción B Reserva, Ejercicio 6, Oción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 ROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 00 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Oción A Junio, Ejercicio 6, Oción B Reserva 1, Ejercicio 3, Oción A Reserva 1, Ejercicio 5, Oción B Reserva,
ROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 00 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Oción A Junio, Ejercicio 6, Oción B Reserva 1, Ejercicio 3, Oción A Reserva 1, Ejercicio 5, Oción B Reserva,
ÁCIDO BASE QCA 09 ANDALUCÍA
 ÁCIDO BASE QCA 9 ANDALUCÍA.- El ph de L de disoluión auosa de hidróxido de litio es. Calule: a) Los gramos de hidróxido que se han utilizado para prepararla. b) El volumen de agua que hay que añadir a
ÁCIDO BASE QCA 9 ANDALUCÍA.- El ph de L de disoluión auosa de hidróxido de litio es. Calule: a) Los gramos de hidróxido que se han utilizado para prepararla. b) El volumen de agua que hay que añadir a
LÍMITES DE FUNCIONES. CONTINUIDAD Y RAMAS INFINITAS Tipos de Discontinuidades en un Punto 1 - Tiene ramas infinitas en un punto
 LÍMITES DE FUNCIONES. CONTINUIDAD Y RAMAS INFINITAS Tipos de Disontinuidades en un Punto - Tiene ramas infinitas en un punto y 5 La reta 5 es una asíntota vertial - Presenta un salto en un punto, si y
LÍMITES DE FUNCIONES. CONTINUIDAD Y RAMAS INFINITAS Tipos de Disontinuidades en un Punto - Tiene ramas infinitas en un punto y 5 La reta 5 es una asíntota vertial - Presenta un salto en un punto, si y
Para aprender Termodinámica resolviendo problemas
 GASES REAES. Fator de ompresibilidad. El fator de ompresibilidad se define omo ( ) ( ) ( ) z = real = real y es funión de la presión, la temperatura y la naturaleza de ada gas. Euaión de van der Waals.
GASES REAES. Fator de ompresibilidad. El fator de ompresibilidad se define omo ( ) ( ) ( ) z = real = real y es funión de la presión, la temperatura y la naturaleza de ada gas. Euaión de van der Waals.
1. Propiedades de la Presión Hidrostática.
 Tema. Hidrostátia. Proiedades de la Presión Hidrostátia.. Euaión fundamental de la Hidrostátia.. Presión Hidrostátia en los líquidos. Euaión de equilirio de los líquidos esados. ota ieométria. 4. Suerfiie
Tema. Hidrostátia. Proiedades de la Presión Hidrostátia.. Euaión fundamental de la Hidrostátia.. Presión Hidrostátia en los líquidos. Euaión de equilirio de los líquidos esados. ota ieométria. 4. Suerfiie
Equilibrio Químico (II) Kp. Principio de Le Chatelier. Mezclas de gases. Presión parcial
 . Priiio de e Chatelier IES a Magdalea. vilés. sturias Mezlas de gases. Presió arial E ua mezla de gases odemos alular la resió total de la mezla si ooemos el úmero total de moles gaseosos ( Tot ) aliado
. Priiio de e Chatelier IES a Magdalea. vilés. sturias Mezlas de gases. Presió arial E ua mezla de gases odemos alular la resió total de la mezla si ooemos el úmero total de moles gaseosos ( Tot ) aliado
I.E.S. ARQUITECTO PEDRO GUMIEL
 I.E.S. ARQUITECTO PEDRO GUMIEL Químia BA2 E1.R: Estrutura atómia. Enae. Termoquímia 1. Dados os eementos A, B y C, de números atómios 6, 11 y 17 respetivamente, india: a) La onfiguraión eetrónia de ada
I.E.S. ARQUITECTO PEDRO GUMIEL Químia BA2 E1.R: Estrutura atómia. Enae. Termoquímia 1. Dados os eementos A, B y C, de números atómios 6, 11 y 17 respetivamente, india: a) La onfiguraión eetrónia de ada
PREGUNTAS DE TEST SOBRE EQUILIBRIOS QUÍMICOS
 REGUNTAS DE TEST SOBRE EQUILIBRIOS QUÍMIS A - DEFINICIONES GENERALES: B - NSTANTES DE EQUILIBRIO: C - RINCIIO DE LE CHATELIER: A - DEFINICIONES GENERALES: A-01 - ara que una reacción química ueda llamarse
REGUNTAS DE TEST SOBRE EQUILIBRIOS QUÍMIS A - DEFINICIONES GENERALES: B - NSTANTES DE EQUILIBRIO: C - RINCIIO DE LE CHATELIER: A - DEFINICIONES GENERALES: A-01 - ara que una reacción química ueda llamarse
Recursión y Relaciones de Recurrencia. UCR ECCI CI-1204 Matemáticas Discretas M.Sc. Kryscia Daviana Ramírez Benavides
 Reursión y Relaiones de Reurrenia UCR ECCI CI-04 Matemátias Disretas M.S. Krysia Daviana Ramírez Benavides Algoritmos Reursivos Un algoritmo es reursivo si se soluiona un problema reduiéndolo a una instania
Reursión y Relaiones de Reurrenia UCR ECCI CI-04 Matemátias Disretas M.S. Krysia Daviana Ramírez Benavides Algoritmos Reursivos Un algoritmo es reursivo si se soluiona un problema reduiéndolo a una instania
Máquinas de combustión interna rotativas:
 67.2/7 UBA Ing. O. Jaimovih Caítulo 16 Máquinas de interna rotativas: Son aquellas en las uales se umlen rátiamente las mismas evoluiones que en las alternativas, es deir, admisión - omresión - igniión,
67.2/7 UBA Ing. O. Jaimovih Caítulo 16 Máquinas de interna rotativas: Son aquellas en las uales se umlen rátiamente las mismas evoluiones que en las alternativas, es deir, admisión - omresión - igniión,
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA. Ingeniería Química
 UNIVERSIDAD NACIONAL EXERIMENTAL OLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEARTAMENTO DE INGENIERÍA QUÍMICA Ingeniería Químia Unidad III. Balane de materia Sistemas Monofásios Clase
UNIVERSIDAD NACIONAL EXERIMENTAL OLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEARTAMENTO DE INGENIERÍA QUÍMICA Ingeniería Químia Unidad III. Balane de materia Sistemas Monofásios Clase
3. PRIMERA LEY DE LA TERMODINÁMICA EN SISTEMAS CERRADOS
 3. PRIMERA LEY DE LA TERMODINÁMICA EN SISTEMAS CERRADOS En todo lo que sigue no hay ambios en la masa del sistema termodinámio que estamos estudiando, o en otras alabras el número de moléulas del sistema
3. PRIMERA LEY DE LA TERMODINÁMICA EN SISTEMAS CERRADOS En todo lo que sigue no hay ambios en la masa del sistema termodinámio que estamos estudiando, o en otras alabras el número de moléulas del sistema
GRADO EN FARMACIA. Asignatura: FISICA APLICADA GUIA DE ESTUDIO UNIDAD 1. ENERGIA Y TERMODINAMICA
 GRADO EN FARMAIA Asignatura: FIIA APLIADA Año aadémio: 03-04 GIA DE EDIO. Energía. rabajo. Ley de onservaión de la energía 3. alor. Equilibrio térmio 4. Introduión a la ermodinámia 5. Primer Priniio de
GRADO EN FARMAIA Asignatura: FIIA APLIADA Año aadémio: 03-04 GIA DE EDIO. Energía. rabajo. Ley de onservaión de la energía 3. alor. Equilibrio térmio 4. Introduión a la ermodinámia 5. Primer Priniio de
EQUILIBRIO QUÍMICO SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD. para cada una de las siguientes reacciones reversibles: O (g) FNO. p p.
 8 EQUILIBRIO QUÍMICO SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Constante de equilibrio 1 Escribe la eresión de las constantes de equilibrio K y K c ara cada una de las siguientes reacciones reversibles:
8 EQUILIBRIO QUÍMICO SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Constante de equilibrio 1 Escribe la eresión de las constantes de equilibrio K y K c ara cada una de las siguientes reacciones reversibles:
REPARTIDO EQUILIBRIO
 REPARTIDO 6 007 EQUILIBRIO Bibliografía: - Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B. Bursten. Ed. Prentice-Hall, México, 1998, 7 ma Ed. Caítulo 15, ágs. 539-565 Caítulo 16, ágs. 573-605
REPARTIDO 6 007 EQUILIBRIO Bibliografía: - Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B. Bursten. Ed. Prentice-Hall, México, 1998, 7 ma Ed. Caítulo 15, ágs. 539-565 Caítulo 16, ágs. 573-605
En la tabla adjunta se recogen los valores, a distintas temperaturas, de la constante del equilibrio químico: T (º K) K
 En la tabla adjunta se recogen los valores, a distintas temeraturas, de la constante del equilibrio químico: SO (g) SO (g) + O (g) 3 (º ) 98 400 600 800 1000 '8 10 1'78 10 16 1'98 10 8 1'9 10 3 '64 10
En la tabla adjunta se recogen los valores, a distintas temeraturas, de la constante del equilibrio químico: SO (g) SO (g) + O (g) 3 (º ) 98 400 600 800 1000 '8 10 1'78 10 16 1'98 10 8 1'9 10 3 '64 10
Ecuaciones de primer grado
 Euaiones de primer grado. Resuelve las siguientes euaiones de primer grado on paréntesis. 3( + ) + ( 3 ) = 7 3( ) ( 3 ) ( + ) = 3( ) ( + ) ( + 3) = 3 + = 5 ( 7 ). Resuelve las siguientes euaiones de primer
Euaiones de primer grado. Resuelve las siguientes euaiones de primer grado on paréntesis. 3( + ) + ( 3 ) = 7 3( ) ( 3 ) ( + ) = 3( ) ( + ) ( + 3) = 3 + = 5 ( 7 ). Resuelve las siguientes euaiones de primer
Termodinámica. Problemas resueltos de Física. Universidad Tecnológica Nacional Facultad Regional Gral. Pacheco
 Universidad ecnológica Nacional ermodinámica POEM. En una transformación a resión constante (resión atmosférica) el volumen de un gas varía en 0, litros. Se le suministran,8 cal.. En una transformación
Universidad ecnológica Nacional ermodinámica POEM. En una transformación a resión constante (resión atmosférica) el volumen de un gas varía en 0, litros. Se le suministran,8 cal.. En una transformación
7.2 Equilibrio químico
 70 t 1/ ln ln. (7.19) k Aexp E ( RT ) Despejando la temperatura de la euaión (7.19), y sustituyendo los valores dados, nos queda: -1 Ea 11700 J.mol T 30. ln -1-1 0,693 Rln 8,3144 J.mol. ln 1-1 6,19 10
70 t 1/ ln ln. (7.19) k Aexp E ( RT ) Despejando la temperatura de la euaión (7.19), y sustituyendo los valores dados, nos queda: -1 Ea 11700 J.mol T 30. ln -1-1 0,693 Rln 8,3144 J.mol. ln 1-1 6,19 10
Segundo Principio de la Termodinámica
 ermodinámia. ema 4 Segundo Prinipio de la ermodinámia. Segundo Prinipio de la ermodinámia Enuniado de Kelvin-Plank en 85: No es posible onstruir una máuina térmia de funionamiento ílio ue permita extraer
ermodinámia. ema 4 Segundo Prinipio de la ermodinámia. Segundo Prinipio de la ermodinámia Enuniado de Kelvin-Plank en 85: No es posible onstruir una máuina térmia de funionamiento ílio ue permita extraer
UNIDAD 1.- PROBABILIDAD
 UNIDAD 1.- PROBABILIDAD 1. EXPERIMENTOS ALEATORIOS. ESPACIO MUESTRAL. Definiión: Un fenómeno o experienia se die aleatorio uando al repetirlo en ondiiones análogas no se puede predeir el resultado. Si
UNIDAD 1.- PROBABILIDAD 1. EXPERIMENTOS ALEATORIOS. ESPACIO MUESTRAL. Definiión: Un fenómeno o experienia se die aleatorio uando al repetirlo en ondiiones análogas no se puede predeir el resultado. Si
QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO
 QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010)
QUÍMICA de 2º de BACHILLERATO EL EQUILIBRIO QUÍMICO PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010)
CONJUNTOS. Según se ha visto en el ejercicio anterior, para que la intersección de dos conjuntos A y B sea A, se tiene que verificar que A B.
 CONJUNTOS 1. Si se umple: a) = b) = ) = (Convoatoria junio 2001. Examen tipo E ) Es laro que la opión orreta es la a). Cuando un onjunto está dentro de otro, la interseión es el onjunto pequeño y la unión
CONJUNTOS 1. Si se umple: a) = b) = ) = (Convoatoria junio 2001. Examen tipo E ) Es laro que la opión orreta es la a). Cuando un onjunto está dentro de otro, la interseión es el onjunto pequeño y la unión
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE. septiembre 2013 QUÍMICA. CÓDIGO 160
 PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE Opión A: septiembre 2013 QUÍMICA. CÓDIGO 160 1. Dadas las siguientes onfiguraiones eletrónias de dos elementos A: [Ne]3s 2 3p 1 y B:[Ne]3s
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE Opión A: septiembre 2013 QUÍMICA. CÓDIGO 160 1. Dadas las siguientes onfiguraiones eletrónias de dos elementos A: [Ne]3s 2 3p 1 y B:[Ne]3s
PAU Movimiento Vibratorio Ejercicios resueltos
 PU Moviiento Vibratorio jeriios resueltos 99-009 PU CyL S995 ley Hooke alitud y freuenia Colgado de un soorte hay un resorte de onste = 0 N/ del que uelga una asa de kg. n estas irunsias y en equilibrio,
PU Moviiento Vibratorio jeriios resueltos 99-009 PU CyL S995 ley Hooke alitud y freuenia Colgado de un soorte hay un resorte de onste = 0 N/ del que uelga una asa de kg. n estas irunsias y en equilibrio,
EQUILIBRIO QUÍMICO. Concentraciones molares, presiones y constantes K c y K p.
 EQUILIBRIO QUÍMICO Concentraciones molares, presiones y constantes K c y K p. 1.- La formación del N 2 O 4 se explica mediante las dos reacciones siguientes: 2 NO (g) + O 2 (g) 2 NO 2 (g); 2 NO 2 (g) N
EQUILIBRIO QUÍMICO Concentraciones molares, presiones y constantes K c y K p. 1.- La formación del N 2 O 4 se explica mediante las dos reacciones siguientes: 2 NO (g) + O 2 (g) 2 NO 2 (g); 2 NO 2 (g) N
TOBERAS Y DIFUSORES. José Agüera Soriano
 TOBERAS Y DIFUSORES José Agüera Soriano 0 Primer riniio ara sistemas abiertos RECORDATORIO euaión de la energía Q h h dq dh d dw t trabajo ténio W d dw W t t W r d d t dw r José Agüera Soriano 0 RECORDATORIO
TOBERAS Y DIFUSORES José Agüera Soriano 0 Primer riniio ara sistemas abiertos RECORDATORIO euaión de la energía Q h h dq dh d dw t trabajo ténio W d dw W t t W r d d t dw r José Agüera Soriano 0 RECORDATORIO
TEMA V: EQUILIBRIO QUIMICO
 EMA V: EQUILIBRIO QUIMICO 1.- El CO gaseoso se disocia a 1000K según la reacción: CO (g) CO (g) + (g) Calcule el valor de Kp cuando la presión de equilibrio es 1 atm y el grado de disociación del CO es
EMA V: EQUILIBRIO QUIMICO 1.- El CO gaseoso se disocia a 1000K según la reacción: CO (g) CO (g) + (g) Calcule el valor de Kp cuando la presión de equilibrio es 1 atm y el grado de disociación del CO es
Soluciones de Ley de las presiones parciales de Dalton
 Solucoes de Ley de las resoes arcales de Dalto La resó arcal de u gas () e ua mezcla, es la resó que ejercería este gas s ocuase todo el volume que ocua la mezcla. També se uede calcular como: 1. Ua mezcla
Solucoes de Ley de las resoes arcales de Dalto La resó arcal de u gas () e ua mezcla, es la resó que ejercería este gas s ocuase todo el volume que ocua la mezcla. També se uede calcular como: 1. Ua mezcla
1 2 +! $ = # 1$ $ Pensamiento Algebraico GUÍA DE PARA LOS ASPIRANTES A LA MME Temas que debe dominar:
 Pensamiento lgebraio Temas que debe dominar: GUÍ DE PR LOS SPIRNTES L MME-06 Definiión, operaiones y propiedades de: Números Naturales Números Enteros Números raionales Números irraionales Números omplejos
Pensamiento lgebraio Temas que debe dominar: GUÍ DE PR LOS SPIRNTES L MME-06 Definiión, operaiones y propiedades de: Números Naturales Números Enteros Números raionales Números irraionales Números omplejos
Intensimetría acústica aplicada al aislamiento sonoro
 4. TEORÍA DEL AILAMIENTO El aislamiento o índie de reduión sonora R, se define omo diez vees el logaritmo del oiente entre la otenia sonora que inide sobre el objeto de rueba que se onsidere,, y la otenia
4. TEORÍA DEL AILAMIENTO El aislamiento o índie de reduión sonora R, se define omo diez vees el logaritmo del oiente entre la otenia sonora que inide sobre el objeto de rueba que se onsidere,, y la otenia
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2000 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA : EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Oción B Reserva 1, Ejercicio, Oción A Reserva 1, Ejercicio 3, Oción B Reserva 1, Ejercicio 4, Oción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA : EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Oción B Reserva 1, Ejercicio, Oción A Reserva 1, Ejercicio 3, Oción B Reserva 1, Ejercicio 4, Oción
QUÍMICA 2º DE BACHILLERATO EQUILIBRIO QUÍMICO
 EQUILIBRIO QUÍMICO 1. En un recipiente de 4 litros, a una cierta temperatura, se introducen las cantidades de HCl, O 2 y Cl 2 indicadas en la tabla, estableciéndose el siguiente equilibrio: calcule: a)
EQUILIBRIO QUÍMICO 1. En un recipiente de 4 litros, a una cierta temperatura, se introducen las cantidades de HCl, O 2 y Cl 2 indicadas en la tabla, estableciéndose el siguiente equilibrio: calcule: a)
Ciclones. 1.- Descripción.
 Cilones 1.- Desriión. Los ilones son equios meánios estaionarios, amliamente utilizados en la industria, que ermiten la searaión de artíulas de un sólido o de un líquido que se enuentran susendidos en
Cilones 1.- Desriión. Los ilones son equios meánios estaionarios, amliamente utilizados en la industria, que ermiten la searaión de artíulas de un sólido o de un líquido que se enuentran susendidos en
SISTEMAS ABIERTOS. José Agüera Soriano
 SISTEMAS ABIERTOS José Agüera Soriano 0 José Agüera Soriano 0 SISTEMAS ABIERTOS ECUACIONES FUNDAMENTALES DE UN FLUJO VELOCIDAD DEL SONIDO EN UN GAS PROCESOS DE DERRAME ESTRANGULACIÓN DE UN FLUJO TRANSPORTE
SISTEMAS ABIERTOS José Agüera Soriano 0 José Agüera Soriano 0 SISTEMAS ABIERTOS ECUACIONES FUNDAMENTALES DE UN FLUJO VELOCIDAD DEL SONIDO EN UN GAS PROCESOS DE DERRAME ESTRANGULACIÓN DE UN FLUJO TRANSPORTE
Calor específico Calorimetría
 Calor espeíio Calorimetría Físia II Lieniatura en Físia 2003 Autores: Andrea Fourty María de los Angeles Bertinetti Adriana Foussats Calor espeíio y alorimetría Cátedra Físia II (Lieniatura en Físia) 1.-
Calor espeíio Calorimetría Físia II Lieniatura en Físia 2003 Autores: Andrea Fourty María de los Angeles Bertinetti Adriana Foussats Calor espeíio y alorimetría Cátedra Físia II (Lieniatura en Físia) 1.-
Unidad 7: Equilibrio químico
 Unidad 7: Equilibrio químico 1. INTRODUCCIÓN Una reacción reversible es aquella en la cual los productos vuelven a combinarse para generar los reactivos. En estos procesos ocurren simultáneamente dos reacciones:
Unidad 7: Equilibrio químico 1. INTRODUCCIÓN Una reacción reversible es aquella en la cual los productos vuelven a combinarse para generar los reactivos. En estos procesos ocurren simultáneamente dos reacciones:
Práctica 3 DETERMINACIÓN DE LA CONSTANTE DE EQUILIBRIO DEL ÁCIDO ACÉTICO MEDIANTE MEDIDAS DE CONDUCTIVIDAD
 Dpto. Cienias Abientales - Área de Quíia Físia Prátia 3 DETERMINACIÓN DE LA CONSTANTE DE EQUILIBRIO DEL ÁCIDO ACÉTICO MEDIANTE MEDIDAS DE CONDUCTIVIDAD 1. Objetivo Se pretende alular el grado de disoiaión
Dpto. Cienias Abientales - Área de Quíia Físia Prátia 3 DETERMINACIÓN DE LA CONSTANTE DE EQUILIBRIO DEL ÁCIDO ACÉTICO MEDIANTE MEDIDAS DE CONDUCTIVIDAD 1. Objetivo Se pretende alular el grado de disoiaión
DPTO: FÍSICA QUÍMICA IES POLITÉCNICO CARTAGENA
 DPTO: FÍSICA QUÍMICA IES POLITÉCNICO CARTAGENA PROBLEMAS Y CUESTIONES PAU DE VARIAS COMUNIDADES SOBRE EL EQUILIBRIO QUÍMICO Mª Teresa Gómez Ruiz 2010 PROBLEMAS Y CUESTIONES PAU DE VARIAS COMUNIDADES SOBRE
DPTO: FÍSICA QUÍMICA IES POLITÉCNICO CARTAGENA PROBLEMAS Y CUESTIONES PAU DE VARIAS COMUNIDADES SOBRE EL EQUILIBRIO QUÍMICO Mª Teresa Gómez Ruiz 2010 PROBLEMAS Y CUESTIONES PAU DE VARIAS COMUNIDADES SOBRE
ESCUELA SUPERIOR DE INGENIEROS INDUSTRIALES Universidad de Navarra Examen de TERMODINÁMICA I Curso Troncal - 4,5 créditos 2 de febrero de 1998
 ECUEL UEIO DE INGENIEO INDUILE Uniersidad de Naarra Exaen de EMODINÁMIC I Curso 997-98 ronal - 4,5 réditos de febrero de 998 Nobre Contestar OD las reguntas ienen el iso alor ieo áxio: hora inutos ea oniso
ECUEL UEIO DE INGENIEO INDUILE Uniersidad de Naarra Exaen de EMODINÁMIC I Curso 997-98 ronal - 4,5 réditos de febrero de 998 Nobre Contestar OD las reguntas ienen el iso alor ieo áxio: hora inutos ea oniso
EJERCICIOS RESUELTOS TEMA 5
 Fundaento Quíio 1º Ineniería énia Aríola EJECICIO EUELO EMA 5 1.- A 2 ºC la preión de vapor del éter etílio (C 4 H 1 O) e iual a 44 H. Calular la preión de vapor de una dioluión que ontiene 54 de anilina
Fundaento Quíio 1º Ineniería énia Aríola EJECICIO EUELO EMA 5 1.- A 2 ºC la preión de vapor del éter etílio (C 4 H 1 O) e iual a 44 H. Calular la preión de vapor de una dioluión que ontiene 54 de anilina
Tema 6: Semejanza en el Plano.
 Tema 6: Semejanza en el Plano. 6.1 Semejanza de Polígonos. Definiión 6..1.- Cuatro segmentos a, b, y d son proporionales si se umple la siguiente igualdad: a =. A ese oiente omún se le llama razón de proporionalidad.
Tema 6: Semejanza en el Plano. 6.1 Semejanza de Polígonos. Definiión 6..1.- Cuatro segmentos a, b, y d son proporionales si se umple la siguiente igualdad: a =. A ese oiente omún se le llama razón de proporionalidad.
Tema 2: El Modelo de Los Factores Específicos OWC T. del Comercio Internacional. Fernando Perera Tallo ttp://bit.ly/8l8ddu
 Tema : El Modelo de os atores Eseífios OWC T. del Comerio Internaional ernando Perera Tallo tt://bit.l/8l8ddu Modelo Generalizado de la ventaja omarativa: El modelo de Riardo se uede generalizar al aso
Tema : El Modelo de os atores Eseífios OWC T. del Comerio Internaional ernando Perera Tallo tt://bit.l/8l8ddu Modelo Generalizado de la ventaja omarativa: El modelo de Riardo se uede generalizar al aso
PROBLEMAS DE FLUIDOS ( )
 ROBLEMA DE FLUIDO (-) riniio de Arquímedes FLUIDO. Un sólido metálio se susende de un dinamómetro y se mide su eso, que resulta ser de.5 N. eguidamente se somete a las siguientes oeraiones:. El sólido
ROBLEMA DE FLUIDO (-) riniio de Arquímedes FLUIDO. Un sólido metálio se susende de un dinamómetro y se mide su eso, que resulta ser de.5 N. eguidamente se somete a las siguientes oeraiones:. El sólido
A'' D'' C'' B'' A' C' Figura 1. Verdadera Magnitud de ángulos de rectas.
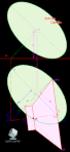 Tema 5: Ángulos entre retas y planos. Triedros Angulo de dos retas. El ángulo de dos retas es una de las magnitudes de las formas planas, y para obtener su verdadera magnitud se aplia el ambio de plano,
Tema 5: Ángulos entre retas y planos. Triedros Angulo de dos retas. El ángulo de dos retas es una de las magnitudes de las formas planas, y para obtener su verdadera magnitud se aplia el ambio de plano,
Momentos de Inercia de cuerpos sólidos: EJE. Varilla delgada. Disco. Disco. Cilíndro. Esfera. Anillo I = MR
 91 Momentos de Ineria de uerpos sólidos: EJE Varilla delgada 1 I = ML 1 Diso 1 I = M Diso 1 I = M 4 ilíndro 1 I = M Esfera I = M 5 Anillo I = M 9 Observaión: Los momentos de ineria on respeto a ejes paralelos
91 Momentos de Ineria de uerpos sólidos: EJE Varilla delgada 1 I = ML 1 Diso 1 I = M Diso 1 I = M 4 ilíndro 1 I = M Esfera I = M 5 Anillo I = M 9 Observaión: Los momentos de ineria on respeto a ejes paralelos
TOBERAS Y DIFUSORES. José Agüera Soriano
 TOBERAS Y DIFUSORES José Agüera Soriano 0 José Agüera Soriano 0 VELOCIDAD DEL SONIDO EN UN GAS κ s d d s a κ s d d s olumen eseífio κ s oefiiente de omresibilidad isoentróio d d s a K K gas erfeto a R
TOBERAS Y DIFUSORES José Agüera Soriano 0 José Agüera Soriano 0 VELOCIDAD DEL SONIDO EN UN GAS κ s d d s a κ s d d s olumen eseífio κ s oefiiente de omresibilidad isoentróio d d s a K K gas erfeto a R
3_1ª LEY: SISTEMAS CERRADOS
 3_1ª LEY: SISTEMAS CERRADOS 3.1 CALOR 3. TRABAJO 3.3 1ª LEY TERMODINAMICA 3.4 CAPACIDAD CALORÍFICA SISTEMA CERRADOS: LA MASA (NÚMERO DE MOLÉCULAS ) SE MANTIENE CONSTANTE U Q W E inétia + E otenial + U
3_1ª LEY: SISTEMAS CERRADOS 3.1 CALOR 3. TRABAJO 3.3 1ª LEY TERMODINAMICA 3.4 CAPACIDAD CALORÍFICA SISTEMA CERRADOS: LA MASA (NÚMERO DE MOLÉCULAS ) SE MANTIENE CONSTANTE U Q W E inétia + E otenial + U
se alcanza calentando 3 g de pentacloruro de fósforo hasta 400 ºC en un recipiente de medio litro, siendo la presión final de 2 atm.
 1 Problemas y cuestiones de EQUILIBRIO QUÍMICO 2º de bachillerato. Química 1. Una mezcla gaseosa constituida inicialmente por 3,5 moles de hidrógeno y 2,5 moles de yodo, se calienta a 400 ºC con lo que,
1 Problemas y cuestiones de EQUILIBRIO QUÍMICO 2º de bachillerato. Química 1. Una mezcla gaseosa constituida inicialmente por 3,5 moles de hidrógeno y 2,5 moles de yodo, se calienta a 400 ºC con lo que,
Solución: Observamos que los números de la sucesión se pueden escribir de la siguiente L de esta manera la suma de los primeros
 roblema : uánto suman los primeros 008 términos de la suesión 0,,,,, L? Soluión: Observamos que los números de la suesión se pueden esribir de la siguiente 0 manera,,,,, L de esta manera la suma de los
roblema : uánto suman los primeros 008 términos de la suesión 0,,,,, L? Soluión: Observamos que los números de la suesión se pueden esribir de la siguiente 0 manera,,,,, L de esta manera la suma de los
QUÍMICA // 2º BACHILLERATO.
 QUÍMICA // 2º BACHILLERATO. EQUÍLIBRIO QUÍMICO. TEMA 6 TEMARIO QUÍMICA.. I.E.S. FERNANDO DE LOS RÍOS (QUINTANAR DEL REY) Temario Química. Tema 6. 2 Índice de Contenido. 1. INTRODUCCIÓN.... 3 2. LEY DE
QUÍMICA // 2º BACHILLERATO. EQUÍLIBRIO QUÍMICO. TEMA 6 TEMARIO QUÍMICA.. I.E.S. FERNANDO DE LOS RÍOS (QUINTANAR DEL REY) Temario Química. Tema 6. 2 Índice de Contenido. 1. INTRODUCCIÓN.... 3 2. LEY DE
MODELOS DE PROBABILIDAD II
 MODELOS DE PROBABILIDAD II DISTRIBUCIÓN GEOMÉTRICA DISTRIBUCIÓN BINOMIAL NEGATIVA DISTRIBUCIÓN HIPERGEOMÉTRICA DISTRIBUCIÓN DE PÓLYA INTRODUCCIÓN A LA ESTIMACIÓN BAYESIANA DE PROPORCIONES DISTRIBUCIÓN
MODELOS DE PROBABILIDAD II DISTRIBUCIÓN GEOMÉTRICA DISTRIBUCIÓN BINOMIAL NEGATIVA DISTRIBUCIÓN HIPERGEOMÉTRICA DISTRIBUCIÓN DE PÓLYA INTRODUCCIÓN A LA ESTIMACIÓN BAYESIANA DE PROPORCIONES DISTRIBUCIÓN
MOTORES COHETE. Curso 5º A2 y B 2009/10. Juan Manuel Tizón Pulido
 MOTORES COHETE Clases Prátias Curso 5º A2 y B 2009/10 Juan Manuel Tizón Pulido jmtizon@aero.um.es htt://webserver.dmt.um.es/zoe/dmt/members/jmtizon/motores-ohete-1 Motores Cohete: Caítulo 2 ACTUACIONES
MOTORES COHETE Clases Prátias Curso 5º A2 y B 2009/10 Juan Manuel Tizón Pulido jmtizon@aero.um.es htt://webserver.dmt.um.es/zoe/dmt/members/jmtizon/motores-ohete-1 Motores Cohete: Caítulo 2 ACTUACIONES
TEMA 1 CONCEPTOS BÁSICOS
 Matemática Financiera Diaositiva 1 TEMA 1 CONCEPTOS BÁSICOS 1. Caital financiero. Fenómeno Financiero 2. Elección financiera. Postulado de royección financiera 3. Conceto de ley y sistema financiero. Proiedades
Matemática Financiera Diaositiva 1 TEMA 1 CONCEPTOS BÁSICOS 1. Caital financiero. Fenómeno Financiero 2. Elección financiera. Postulado de royección financiera 3. Conceto de ley y sistema financiero. Proiedades
j Sigue practicando El trabajo de extracción es: = hf = 6,62 10 J s 9,38 10 s = 6,21 10 J
 FÍSICA RELATIVISTA Y FÍSICA CUÁNTICA 99 j Sigue ratiando Un otón de luz roja de 700 nm de longitud de onda tiene una energía igual a,4 0 9 J Cuál es la energía de un otón de luz erde de 550 nm? La relaión
FÍSICA RELATIVISTA Y FÍSICA CUÁNTICA 99 j Sigue ratiando Un otón de luz roja de 700 nm de longitud de onda tiene una energía igual a,4 0 9 J Cuál es la energía de un otón de luz erde de 550 nm? La relaión
Pman = cmhg= atm
 emodinámia eoía (11) oblemas esueltos Semeste: 014-1 1. Una masa de 0 g de SO se enuenta almaenada en un tanque on un volumen de 50 dm a una tempeatua de 800 R. La pesión baométia loal es de 700 mm Hg.
emodinámia eoía (11) oblemas esueltos Semeste: 014-1 1. Una masa de 0 g de SO se enuenta almaenada en un tanque on un volumen de 50 dm a una tempeatua de 800 R. La pesión baométia loal es de 700 mm Hg.
Problemas Química Propuestos en las P.A.U. Equilibrio Químico
 Ley de Chatelier 1.- Indica, justificando brevemente la respuesta, si son ciertas o falsas las siguientes afirmaciones: a) Para la reacción N 2 (g) + 3 H 2 (g) 2 NH 3 (g) un aumento de la presión, manteniendo
Ley de Chatelier 1.- Indica, justificando brevemente la respuesta, si son ciertas o falsas las siguientes afirmaciones: a) Para la reacción N 2 (g) + 3 H 2 (g) 2 NH 3 (g) un aumento de la presión, manteniendo
Donde: M = es la molaridad (mol l -1 )
 Exresiones de Concentración en Términos de la Cantidad de Soluto or Cantidad de Disolución Vale la ena recordar aquí que un mol es la cantidad de sustancia que contiene el número de Avogadro (NA) de artículas
Exresiones de Concentración en Términos de la Cantidad de Soluto or Cantidad de Disolución Vale la ena recordar aquí que un mol es la cantidad de sustancia que contiene el número de Avogadro (NA) de artículas
Supercies Regladas. Ejemplo El cilíndro y el cono circular son ejemplos de supercies regladas
 Unidad 1. Superies Cuádrias 1.6 Superies Regladas Superies Regladas Deniión 1. Una superie on la propiedad de que para ada punto en ella hay toda una reta que está ontenida en la superie y que pasa por
Unidad 1. Superies Cuádrias 1.6 Superies Regladas Superies Regladas Deniión 1. Una superie on la propiedad de que para ada punto en ella hay toda una reta que está ontenida en la superie y que pasa por
Equilibrio químico 9/23/2010. Copyright The McGraw-Hill Companies, Inc. / Provisto por Dr. Hernández-Castillo 1. Capítulo 14
 Equilibrio es un estado en el que no hay cambios observables con el pasar del tiempo. Equilibrio químico Capítulo 14 Equilibrio químico es logrado cuando: La rapidez de la reacción en una dirección y en
Equilibrio es un estado en el que no hay cambios observables con el pasar del tiempo. Equilibrio químico Capítulo 14 Equilibrio químico es logrado cuando: La rapidez de la reacción en una dirección y en
Equilibrios químicos 2ºBACH
 1. Dada la reacción:, completa la siguiente tabla, teniendo en cuenta que en el equilibrio, el volumen es 25 litros y la presión total 8 atm. H 2 N 2 NH 3 Moles iniciales 2 1 3,2 Moles que reaccionan Moles
1. Dada la reacción:, completa la siguiente tabla, teniendo en cuenta que en el equilibrio, el volumen es 25 litros y la presión total 8 atm. H 2 N 2 NH 3 Moles iniciales 2 1 3,2 Moles que reaccionan Moles
Fórmula integral de Cauchy
 Fórmula integral de Cauhy Fórmula integral de Cauhy. Si una funión f es analítia en una región que ontiene a urva simple errada y a su interior, entones para ada punto z 0 enerrado por, dz = 2πi f(z 0
Fórmula integral de Cauhy Fórmula integral de Cauhy. Si una funión f es analítia en una región que ontiene a urva simple errada y a su interior, entones para ada punto z 0 enerrado por, dz = 2πi f(z 0
LEY DE SENOS. Ya hemos visto como resolver triángulos rectángulos ahora veremos todas las técnicas para resolver triángulos generales.
 LEY DE SENOS Ya hemos visto omo resolver triángulos retángulos ahora veremos todas las ténias para resolver triángulos generales a γ α Este es un triángulo el ángulo α se esrie en el vértie de, el ángulo
LEY DE SENOS Ya hemos visto omo resolver triángulos retángulos ahora veremos todas las ténias para resolver triángulos generales a γ α Este es un triángulo el ángulo α se esrie en el vértie de, el ángulo
TERMODINÁMICA FUNDAMENTAL. TEMA 4. Aplicaciones del primer principio
 ERMODINÁMICA FUNDAMENAL EMA 4. Alicaciones del rimer rinciio 1. Ecuación energética de estado. Proiedades energéticas 1.1. Ecuación energética La energía interna, al ser función de estado, deende de, y.
ERMODINÁMICA FUNDAMENAL EMA 4. Alicaciones del rimer rinciio 1. Ecuación energética de estado. Proiedades energéticas 1.1. Ecuación energética La energía interna, al ser función de estado, deende de, y.
2.4 Transformaciones de funciones
 8 CAPÍTULO Funiones.4 Transformaiones de funiones En esta seión se estudia ómo iertas transformaiones de una funión afetan su gráfia. Esto proporiona una mejor omprensión de ómo grafiar Las transformaiones
8 CAPÍTULO Funiones.4 Transformaiones de funiones En esta seión se estudia ómo iertas transformaiones de una funión afetan su gráfia. Esto proporiona una mejor omprensión de ómo grafiar Las transformaiones
-14 - ENTALPÍA DE FUSIÓN DEL HIELO
 -4 - ENTALPÍA DE FUSIÓN DEL HIELO OBJETIVO Determinar la entalpía de usión del hielo utilizando el método de las mezlas. Previamente, ha de determinarse el equivalente en agua del alorímetro, K, para uantiiar
-4 - ENTALPÍA DE FUSIÓN DEL HIELO OBJETIVO Determinar la entalpía de usión del hielo utilizando el método de las mezlas. Previamente, ha de determinarse el equivalente en agua del alorímetro, K, para uantiiar
MODELOS DE STOCK ESTOCÁSTICOS
 MODELO DE TOCK ETOCÁTICO DR/3 Modelos de tok Estoástios Modelizaión Cuantitativa: Modelos de eríodo únio y un solo item. Modelos de eríodos fijos y lotes variables. Modelizaión or imulaión de Montearlo:
MODELO DE TOCK ETOCÁTICO DR/3 Modelos de tok Estoástios Modelizaión Cuantitativa: Modelos de eríodo únio y un solo item. Modelos de eríodos fijos y lotes variables. Modelizaión or imulaión de Montearlo:
Tema 14. Reactores químicos
 Tema 4. Reatores químios Ingeniería Químia Dr. Rafael Camarillo Prof. yud. Reatores químios Condiiones determinantes Espeifiaiones Eleión del tipo de reator químio Diseño del reator olumen del reator Condiiones
Tema 4. Reatores químios Ingeniería Químia Dr. Rafael Camarillo Prof. yud. Reatores químios Condiiones determinantes Espeifiaiones Eleión del tipo de reator químio Diseño del reator olumen del reator Condiiones
HOJA DE PROBLEMAS 6: ENUNCIADOS
 Tema: EQUILIBRIO QUÍMICO HOJA DE PROBLEMAS 6: ENUNCIADOS 1. ( ) Se ha hallado que una mezcla en equilibrio 2 SO 2 + O 2 2 SO 3 contenida en un recipiente de 2 litros a una temperatura determinada, contiene
Tema: EQUILIBRIO QUÍMICO HOJA DE PROBLEMAS 6: ENUNCIADOS 1. ( ) Se ha hallado que una mezcla en equilibrio 2 SO 2 + O 2 2 SO 3 contenida en un recipiente de 2 litros a una temperatura determinada, contiene
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción B Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción B Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 5, Opción
Equilibrio químico. Tema 5
 Equilibrio químico Tema 5 2 1.- Concepto de equilibrio químico. Características. Aspecto dinámico de las reacciones químicas. 2.- Ley de acción de masas. K C. Cociente de reacción. 3.- K p Relación con
Equilibrio químico Tema 5 2 1.- Concepto de equilibrio químico. Características. Aspecto dinámico de las reacciones químicas. 2.- Ley de acción de masas. K C. Cociente de reacción. 3.- K p Relación con
Clase 2. Las ecuaciones de Maxwell en presencia de dieléctricos.
 Clase Las euaiones de Maxwell en presenia de dielétrios. A diferenia de los metales (ondutores elétrios) existen otro tipo de materiales (dielétrios) en los que las argas elétrias no son desplazadas por
Clase Las euaiones de Maxwell en presenia de dielétrios. A diferenia de los metales (ondutores elétrios) existen otro tipo de materiales (dielétrios) en los que las argas elétrias no son desplazadas por
