BENEMÉRITA UNIVERSIDAD AUTÓNOMA DE PUEBLA FACULTAD DE CIENCIAS QUÍMICAS LICENCIATURA: QUÍMICO FARMACOBIÓLOGO
|
|
|
- Guillermo Maestre Alcaraz
- hace 6 años
- Vistas:
Transcripción
1 BENEMÉRITA UNIVERSIDAD AUTÓNOMA DE PUEBLA FACULTAD DE CIENCIAS QUÍMICAS LICENCIATURA: QUÍMICO FARMACOBIÓLOGO ÁREA ESPECÍFICA DE: MICROBIOLOGÍA NOMBRE DE LA ASIGNATURA: CÓDIGO: FAR 335L FECHA DE ELABORACIÓN: MARZO 2002 NIVEL EN EL MAPA CURRICULAR: TIPO DE ASIGNATURA: FORMATIVO DISCIPLINARIA PROFESORES QUE PARTICIPARON EN SU ELABORACIÓN: QFB. Ana Berta Escobedo López MSP. Claudy Lorena Villagran Padilla MC. Gloria León Tello MSP. Jesús Luzuriaga Galicia MSP. Juan Manuel Álvarez López QFB. Ma. de la Cruz Meneses Sánchez HORAS DE TEORÍA: 3 HORAS PRÁCTICA: 2 CRÉDITOS: 8 1
2 INDICE Fac. Cs. Qs. Dpto. De MICROBIOLOGÍA Página Práctica 1 Seguridad en el laboratorio 6 Práctica 2 Aislamiento y siembra de hongos en placa y tubo 8 Práctica 3 Reconocimiento de las estructuras básicas de los 10 hongos Práctica 4 Estructuras de reproducción asexual en hongos 13 saprofíticos Práctica 5 Identificación macro y microscópica de los hongos 15 saprofíticos más frecuentes Práctica 6 Dermatofitos 17 Práctica 7 Identificación macro y microscópica de los 20 Dermatofitos Práctica 8 Pitiriasis versicolor 22 Práctica 9 Cromomicosis y esporotricosis 24 Práctica 10 Criptococosis 27 Práctica 11 Candidiasis 29 Práctica 12 Geotricosis 33 Práctica 13 Aspergilosis 35 Práctica 14 Blastomicosis Y Paracoccidiodomicosis 37 Práctica 15 Acción fungicidade los imidazoles empleados en el tratamiento de Micosis 40 Práctica 16 Evaluación 42 Bibliografía 43 2
3 Prólogo Fac. Cs. Qs. Dpto. De MICROBIOLOGÍA La Micología es una rama dentro de la Microbiología a la que se le presta poco interés, quizás porque para muchos microbiólogos es un área muy árida, a la cual el acceso a casos clínicos resulta en la mayoría de los casos poco accesibles, pero es algo que no debe desalentar ya que los retos hacen que los triunfos se disfruten mucho más. Los hongos son microorganismos con una gran gama de características las cuales los hacen muy interesantes, desde su gran variedad en tamaño y color de colonia considerando el punto de vista macroscópico hasta la diversidad de sus formas microscópicas los hongos presentan una importancia tanto médica como industrial. Médica en la gran diversidad de micosis que pueden causar, desde las más sencillas como lo es un Pie de atleta hasta las más complejas como lo puede ser una Criptococosis meníngea entre otras. Infecciones que no respetan ni edad ni sexo ya que pueden causar problemas tanto a hombres como mujeres, a niños y adultos. En algún momento pueden resultar fastidiosos cuando despliegan su facilidad para contaminar alimentos y medio ambiente ocasionando un deterioro en los mismos, lo cual puede causar ligeros malestares en las personas que van desde un malestar estomacal hasta una alergia. Pero no todo es nocivo en ellos ya que a nivel industrial son de gran utilidad, ayudan a darle esa calidad a la cerveza durante el proceso de fermentación, a dar el punto exacto de maduración a cierto tipo de quesos, a participar como principio activo de ciertos antibióticos y a dar ese sabor exquisito al pan. Por todo esto es importante conocerlos, saber la forma de identificarlos y esta es la finalidad que persigue este Manual el dar a conocer al alumno las características de identificación de estos microorganismos así como la forma de poder aislarlos. 3
4 REGLAMENTO DEL LABORATORIO Fac. Cs. Qs. Dpto. De MICROBIOLOGÍA 1.-Llegar puntual a práctica, se dará un tiempo de tolerancia de 10 minutos antes de pasar lista 2.-Traer bata blanca limpia, con botones y entrar con ella ya puesta 3.- Las mochilas serán colocadas en los cajones o en el lugar indicado por el profesor 4.-El lugar de trabajo dentro del laboratorio será opcional para el alumno pero a partir de la primera practica ese será su lugar de trabajo 5.-En la mesa de trabajo solo tendrá el manual de practicas y los elementos para trabajar (lápices, plumas, cerillos, maskin tape, etc.) 6.-No se debe comer ni tomar líquidos dentro del laboratorio y mucho menos durante la realización de la práctica 7.-Queda prohibido fumar 8.-En prácticas donde se requiera pipetear se prohíbe hacerlo con la boca 9.-Antes y después de utilizar el asa de trabajo se debe esterilizar 10.-En el caso de accidente informar INMEDIATAMENTE al profesor responsable. 11.-Todo material que requiera ser desechado se colocara en el lugar indicado ex profeso por el profesor 12.- En cada práctica se deberá contestar el cuestionario correspondiente, el cual será revisado únicamente a los 8 días de realizada la práctica, de lo contrario, se restará medio punto a la calificación final por cada cuestionario no presentado a tiempo El laboratorio se evaluará con un examen teórico-práctico al final del curso que corresponderá al 20% de la calificación final de la materia. 4
5 Práctica No. 1. Fac. Cs. Qs. Dpto. De MICROBIOLOGÍA Seguridad en el Laboratorio Introducción. Los laboratorios de Micología son ambientes especiales con respecto a la seguridad de aquellos que trabajan en ellos, las muestras clínicas de pacientes recibidas para su estudio significan un riesgo para el personal debido a los agentes infecciosos que pueden contener. Los cultivos de agentes infecciosos producto de muchas de las actividades del micologo clínico tambien constituyen una amenaza. La educación del personal que manipula a diario los agentes potencialmente infecciosos y la educación por medio de avisos sobre riesgos biologicos, así como instrucciones escritas y verbales de aquellos que solo tienen una exposición limitada al ambiente del laboratorio son las medidas disponibles más importantes para prevenir las infecciones adquiridas en el laboratorio, los riesgos de un laboratorio de Micología pueden extenderse a laboratorios adyacentes. Además del riesgo por infección los laboratorios de Micología también están expuestos a todos los riesgos asociados a cualquier ambiente de laboratorio como incendio, riesgos electricos, químicos, materiales radiactivos, mal funcionamiento de los equipos, peligros dependientes de desastres naturales, situaciones ambientales como pisos deslizantes, sistemas de circulación de aire deficiente. Se debe poseer un manual de seguridad que contenga información sobre la conducta a seguir en caso de una contigencia Objetivo. Dar a conocer a los alumnos a través de un seminario las reglas de seguridad a seguir durante el desarrollo de las prácticas a realizar Técnicas a emplear. Exposición oral del tema utilizando material didáctico ( acetatos, diapositivas) Material a emplear. Acetatos y diapositivas Desarrollo de la práctica. 1.- Exposición oral 2.- Ronda de preguntas 3.- Aclaración de dudas 5
6 Reporte. Resumen de lo expuesto durante el Seminario Cuestionario 1.- Defina que es seguridad 2.- En un laboratorio que factores pueden alterar la seguridad 3.- Que pasos se deben seguir para establecer la seguridad 4.- De los factores que pueden alterar la seguridad cual considera el más importante 5.- Una breve crítica acerca del tema 6
7 Introducción. Práctica No. 2 AISLAMIENTO Y SIEMBRA DE HONGOS EN PLACA Y TUBO. La mayoría de los alimentos y productos agrícolas, son invadidos por diversos microorganismos durante su desarrollo y su almacenamiento, siendo los hongos los más abundantes y la principal causa de los procesos de putrefacción de los alimentos y de los granos, ocasionando severas pérdidas económicas. Algunos hongos se encuentran como flora normal de diversas cavidades y mucosas del organismo humano, así como están presentes en el suelo y las plantas, donde se considera que tales sitios son su hábitat normal. Objetivo. El alumno se familiarizará y aprenderá a manejar las diversas técnicas de aislamiento y siembra de hongos para su posterior identificación. Técnicas a emplear. A).- Técnica de dilución y vertido en placa (sustratos sólidos o líquidos muy contaminados). 1.- Preparar de 4 a 5 tubos con 9 ml de agua destilada, o bien, solución salina isotónica, esterilizar y numerar del 1 al Se suspende en el tubo 1, un ml, o bien, un gramo de alimento ó muestra a analizar. 3.- Homogenizar perfectamente la prueba. 4.- con ayuda de una pipeta estéril, tomar 1 ml del tubo 1 y traspasarlo al tubo 2; con otra pipeta estéril, se toma una alícuota de 1 ml y se lleva al tubo 3; así sucesivamente hasta llegar al tuvo De las dos últimas, tomar 1 ml de cada una y depositarlos respectivamente en las placas de Petri estériles y vacías. 6.- Adicionar aproximadamente 20 ml del medio PDA o SDA, estéril, fundido y enfriado a 45ºC. 7.- Homogenizar por rotación de las placas sobre la mesa. 8.- Dejar solidificar e incubar a 28ºC por 4 a 5 días. 9.- Hacer observaciones cada 48 hrs. hasta la aparición de colonias características de hongos. B).- Técnica de siembra por puntos en placa o tubo (sustratos sólidos poco contaminados). 1.- Fragmentar dentro de una placa el material a estudiar. 2.- Con la ayuda de asas micológicas flameadas y estériles distribuir de 4 a 5 fragmentos de la muestra sobre la superficie de una placa de Petri con medio SDA o PDA (si utiliza tubo distribuya de 2 a 3 fragmentos de la muestra sobre la superficie del pico de flauta). 7
8 3.- Incubar a 28ºC durante 3 a 4 días observando el desarrollo alrededor de los fragmentos cada 48 hrs. C).- Técnica de exposición de placa (medio ambiente) 1.- Distribuir placas con medio SDA o PDA en los sitios donde se desee hacer el aislamiento. 2.- Destaparlas y exponerlas al ambiente de 5 a 10 minutos, taparlas. 3.- Incubar a 28ºC durante 4 a 5 días y observando cada 48 horas hasta la aparición de colonias de hongos. Material a emplear. 1.- Suelo. 2.- Refrescos embotellados. 3.- Granos (arroz, trigo, fríjol, etc.) 4.- Alimento (chocolate, yogurt, queso, etc.) 5.- Placas con medio SDA o PDA. 6.- Tubos con tapón de rosca con medio SDA o PDA. 7.- Tubos con solución salina isotónica, o bien, agua estéril. 8.- Placas de Petri y pipetas de 1 ml estériles. PDA= Papa Dextrosa Agar. SDA= Sabouraud Dextrosa Agar. Desarrollo de la práctica. 1.- Proceder al aislamiento de hongos por la técnica de dilución y vertido en placa. 2.- Proceder al aislamiento de hongos por la técnica de puntos en placa o tubo. 3.- Proceder al aislamiento de hongos por la técnica de exposición de placas. Cuestionario 1.- Defina el término aislamiento 2.- Cuáles son las técnicas de aislamiento para hongos? 3.- Cuál es la composición química de los medios de cultivo para hongos? 4.- Cómo define un hongo contaminante? 5.- Cuál es la temperatura adecuada de crecimiento de un hongo? 6.- Menciona si la muestra estaba libre de contaminación, en caso de haber estado contaminada por hongos o levaduras menciona cuantas colonias aislaste por ml de muestra. 8
9 Práctica No. 3. RECONOCIMIENTO DE LAS ESTRUCTURAS BÁSICAS DE LOS HONGOS. Introducción. La mayoría de los que deben relacionarse con la rama micológica, a menudo se sienten confundidos y desalentados en sus tentativas para estudiar los hongos debido a la gran variación en el aspecto macroscópico de las colonias, a la multiplicidad de las estructuras microscópicas y a la nomenclatura poco conocida. Sin embargo, estas dificultades son más psicológicas que reales y cuando se llegan a dominar unos cuantos conceptos básicos basados en las morfologías macroscópica y microscópica, la identificación de los hongos resulta más fácil y rápida que en otras bacterias ordinarias. Los hongos emiten una o más prolongaciones tubulares llamadas tubos germinales o también llamadas hifas, que se alargan por el crecimiento de su extremo distal. La hifa puede dividirse por formación de paredes transversales a intervalos regulares. Las hifas divididas por tabiques se denominan hifas tabicadas, sin embargo algunos hongos no desarrollan tabicaciones en las hifas y se denominan no tabicadas o cenocíticas. Finalmente, el conjunto de hifas desarrollan lo que se conoce como micelio, la diferenciación de los hongos se basa principalmente en su aspecto colonial y morfología microscópica. l.- La morfología colonial se basa en los siguientes parámetros: - Aspecto - Consistencia. - Pigmentación de la colonia. - Difusión de pigmento al medio. - Luz reflejada. - Luz transmitida. - Bordes. ll.- Morfología microscópica ( referente al micelio ) - Tabicado o septado. - Cenocítico. - Hialino. - Pigmentado ( fugilaginoso, carotenoide ) - Macrosifonado - Microsifonado. Objetivo. El alumno será capaz de diferenciar las colonias de los hongos y los diversos tipos de estructuras básicas, como por ejemplo, el micelio por medio de técnicas de observación en fresco o directa y algunas preparaciones facilitadas por el profesor, valorando estos parámetros como fundamentales en la identificación de los hongos. 9
10 Técnicas a emplear. A).- Técnica de resiembra en tubo. 1.- Con el asa micológica en ángulo de 90º tomar un pequeño fragmento de loas colonias con morfología diferente y depositarlo en un tubo con medio inclinado PDA o SDA. 2.- Incubar a 28ºC. 3.- Observar cada 40 horas el desarrollo de las colonias. B).- Técnica de observación microscópica en fresco. 1.- Sobre un porta objetos depositar una gota de colorante azul de algodón lactofenol. 2.- Con el asa micológica tomar un pequeño fragmento de la colonia y colocarlo sobre el porta objetos. 3.- Agregar una gota de alcohol al 70% (esto es necesario solo en el caso de hongos con esporulación abundante). 4.- Dilacerar el fragmento de la colonia con ayuda da agujas de disección o bien con la misma asa micológica. 5.- Colocar sobre la preparación un cubre objeto evitando formar burbujas de aire. 6.- Observar al microscopio a seco débil y seco fuerte, nunca usar aceite de inmersión. Material a emplear. 1.- Colonias de hongos aisladas en la práctica anterior. 2.- Colonias de hongos proporcionadas por el profesor. 3.- Tubos con medio PDA o SDA. 4.- Colorante azul de algodón. 5.- Preparaciones fijas proporcionadas por el profesor. 6.- Porta y cubre objetos. Desarrollo de la práctica. 1.- Observar las colonias aisladas de los sustratos (práctica # 1). 2.- Escoger diferentes tipos de colonias y resembrarlas en tubos con medio PDA o SDA. 3.-Observar comparativamente las características macroscópicas de las colonias desarrolladas. 4.- Hacer preparaciones en fresco con azul de algodón lactofenol de las colonias aisladas resultando de la práctica anterior. 5.- Observar comparativamente el micelio de las muestras aisladas con las preparaciones fijas proporcionadas por el profesor. Dibujos: a.- Hifa. b.- Micelio. c.- Micelio macrosifonado septado. d.- Micelio macrosifonado cenocítico. e.- Micelio septado fugilaginoso. f.- Micelio microsifonado. 10
11 Descripción macroscópica de las cepas tipo proporcionadas por la responsable del laboratorio. Cuestionario 1.- Defina el término hifa y micelio 2.-Mencione la clasificación del micelio según: a.- Función b.- Diámetro c.- Continuidad d.- Coloración 3.- Por la morfología macroscópica y microscópica, cómo puede ser un hongo? 4.- Cómo fue el crecimiento obtenido de la practica anterior? 5.-Mencione los parámetros utilizados en la lectura de morfología colonial de hongos 11
12 Práctica No. 4. Fac. Cs. Qs. Dpto. De MICROBIOLOGÍA ESTRUCTURAS DE REPRODUCCIÓN ASEXUAL EN HONGOS SAPRÓFITOS. Introducción. La espora se refiere a un órgano que tiene como función la multiplicación del hongo, las esporas tienen una forma definida que puede ser redonda, ovalada, más o menos larga etc. Pueden ser unicelulares o pluricelulares; su tamaño varía de 2 a varias decenas de micras, su pared es sencilla o doble. Las esporas asexuadas se forman ya sea en el interior de un saco por lo que se conoce como endosporas o en el exterior conociéndolas como exosporas, fijadas a la extremidad o sobre el trayecto de una hifa. También pueden ser producidas por órganos especiales, al ser puestas en libertas las esporas pueden multiplicarse y dar origen a una colonia. Las esporas asexuadas son el resultado de la transformación de la hifa, sin el concurso de fenómenos sexuales y se dividen en tres grupos: A).- Talosporas que a su vez se subdividen en: - Artrosporas. - Blasrtosporas. - Dictiosporas. - Clamidosporas. - Aleuriosporas. B).- Conidiosporas. C).- Esporangiosporas. Objetivo. Que el alumno se introduzca en el conocimiento básico de las diferentes estructuras de reproducción asexual, parámetro básico e importante en la identificación microscópica de los diferentes hongos filamentosos y levaduriformes. Técnicas a emplear. Preparación de placas para microcultivo. 1.- Seleccionar placas Petri de 20 x 100 mm. 2.- Colocar dentro de la placa un círculo de papel filtro. 3.- Sobre el círculo de papel colocar una varilla de vidrio de 8 mm de diámetro doblada en V. 4.- Sobre la varilla colocar un porta y un cubre objetos (22 x 22 mm). 5.- Esterilizar las placas así preparadas. 6.- Colocar glicerol al 10% estéril. 7.- Formol al 10%. 8.- Pinzas, pipetas estériles. 9.- Placa con medio de cultivo SDA o PDA (se deberá seccionar en cuadros pequeños en una zona estéril). 12
13 Material a emplear. 1.- Colonias de hongos aisladas en la práctica anterior. 2.- Colonias de hongos proporcionadas por el profesor. 3.- Cultivos de Candida albicans en medio de Agar Harina de Maíz o medio para clamidosporas. 4.- Preparaciones fijas proporcionadas por el profesor Desarrollo de la práctica. 1.- Realizar la técnica de microcultivo a partir de las colonias obtenidas en tubo. 2.- Observar y comparar al microscopio los diversos tipos de esporas asexuales en preparaciones fijas proporcionadas por el profesor. 3.- Hacer los dibujos y anotar en nombre del hongo correspondiente: a.- Artrosporas. b.- Blastosporas. c.- Clamidosporas. d.- Esporangiosporas. e.- Conidiosporas. f.- Macroconidias. g.- Dictiosporas. h.- Fialosporas Cuestionario 1.-Defina el termino espora 2.- Mencione los grupos de esporas por las cuales se reproducen los hongos 3.- Un hongo filamentoso, porque tipo de esporas se reproduce? 4.- Una levadura, porque tipo de esporas se reproduce? 5.- Que técnica se utiliza para la observación microscópica de las esporas? 13
14 Práctica No. 5. IDENTIFICACIÓN MACRO Y MICROSCÓPICA DE LOS HONGOS SAPROFITOS MÁS FRECUENTES. Introducción. La presencia de hongos en alimentos y productos alimenticios no es una novedad, se conoce desde hace mucho tiempo y de hecho estos hongos, levaduras o mohos han sido utilizados para alterar de manera deseable el sabor y olor de algún alimento (maduración de quesos y carnes, producción de vinos y cerveza). Los hongos también se conocen como descomponedores de los alimentos, actualmente existen ciencias especializadas en el estudio de los hongos, ya que éstos han demostrado gran relevancia en las áreas médica, alimenticia, agrícola, etc... En el área médica por los diversos cuadros clínicos que producen en el humano, causando hasta la muerte (esto es cuando no se lleva a cabo un buen diagnóstico de laboratorio y médico). En el área de la industria alimenticia posee gran valor como contaminantes de materia prima y producto terminado, causando en la mayoría de los casos perdidas económicas a la empresa, o bien son utilizados como elementos de gran valor en la producción de diversas enzimas, antibióticos y vitaminas. En el área agrícola, pueden producir destrucción de cosechas, o bien se asocian a otros microorganismos del suelo contribuyendo al logro de cultivos frondosos. Los diferentes tipos de hongos saprófitos pueden entonces tener efectos nocivos o bien aportar beneficios. Objetivo. Que el alumno establezca los diversos parámetros macro y microscópicos para la identificación propia y definitiva de los hongos saprófitos más frecuentes. Material a emplear. 1.- Preparaciones obtenidas a partir del microculivo. 2.- Preparaciones fijas proporcionadas por el profesor. 3.- Sepas de hongos saprófitos proporcionados por el profesor. Desarrollo de la práctica. 1.- Desmontar la preparación del microcultivo. Teñir y sellar. 2.- Hacer comparaciones microscópicas entre las preparaciones obtenidas por los equipos y las preparaciones fijas proporcionadas por el profesor. 3.- Hacer los dibujos correspondientes a: a.- Rhizopus. b.- Mucor. c.- Aspergillus. 14
15 d.- Penicillum. e.- Geotrichum. f.- Hormodendrum. Fac. Cs. Qs. Dpto. De MICROBIOLOGÍA 4.- Describir la morfología macroscópica de los hongos filamentosos. 5.- Describir la morfología macroscópica de los hongos levaduriformes. Cuestionario 1.-Que parámetros se deben considerar para hacer una identificación microscópica de los hongos 2.- Anote la ficha de identificación de los siguientes hongos a.- Rhizopus b.- Mucor c.- Aspergillus niger d.- Penicillum sp e.-ulocladium sp f.- Alternaria sp g.- Sacharomyces cereviceae h.- Rodhotorula sp 15
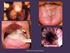
16 Práctica No. 6. DERMATOFITOS (Tiñas) Introducción. Las tiñas constituyen un grupo de micosis causadas por hongos taxonómicamente relacionados que afectan los tejidos queratinizados: piel, cabello, uñas en el humano, plumas, cuernos y piel de animales. Estos hongos pertenecen a numerosas especies agrupadas en tres géneros: Trichophyton, Microsporum, Epidermophyton. Los hongos pertenecientes a estos géneros tienen como característica común la de poseer enzimas queratinofilicas para atacar a la queratina presente en la piel y otras estructuras del hospedero, por lo que se conocen con el nombre de dermatofitos y dermatofitosis o tiñas a las enfermedades que ellos producen. Los dermatofitos manifiestan su estado parasitario a través de hifas ramificadas o bien hifas con artrosporas, esta forma la adquieren en el tejido que atacan. En el estado saprofito o vegetativo estos hongos presentan estructuras ornamentadas y variadas que se toman como base para la diferenciación entre diferentes géneros y especies a nivel microscópico. Objetivo. Familiarizar al alumno con las diversas tomas de muestras clínicas de acuerdo a la zona afectada por los dermatofitos; instruirlo en el manejo de las técnicas en fresco a través de la cual buscara el estado parasitario de los mismos en las diferentes muestras clínicas Técnicas a emplear. A).- Obtención de escamas. 1.- El laboratorista deberá de proveerse de alcohol, gasa, lancetas estériles, placas de Petri y un marcador. 2.- Se localiza la parte afectada y se analiza macroscópicamente la lesión anotando si hay o no descamación, resequedad, si hay bordes, etc. 3.- Se limpia la zona afectada con gasa y alcohol. 4.- Se hace un raspado ligero con uno de los bordes de la lanceta (de ser posible obtener fragmentos de la lesión con pinzas). NOTA: Cuando el paciente es un niño y no resiste el raspado, o si la descamación no es visible, la muestra se toma adhiriendo a la piel un trozo de cinta "SCOTCH" y retirándola de golpe, la cual se colocara en un porta objeto para su transporte y observación. 5.- El producto de la lesión se recolecta en placas de Petri. 6.- Se toman los datos del paciente escribiéndolos con marcador en la parte superior de la placa. 7.- En el laboratorio, con una parte de la muestra se realiza una preparación en fresco de la siguiente manera: a).- Sobre un porta objetos agregar una gota de NaOH o KOH del 5 al 10% (solución aclarante). 16
17 b).- Se deposita un pequeño fragmento de muestra y se deja reposar por 10 minutos. c).- Se deposita un cubre objetos sobre la preparación, tratando de no formar burbujas de aire y se deja reposar la muestra por 15 minutos. d).- La preparación se observa al microscopio con el objetivo seco débil y seco fuerte, tratando de buscar la fase parasitaria del hongo. 8.- En zona de esterilidad junto a un mechero, la muestra clínica sobrante se siembra por la técnica de punto en placa y en tubos con medios de cultivo que contengan SDA, PDA, Agar microbiótico, etc. 9.- Se encuban las placas a 28ºC durante 4 a 5 días haciendo la revisión de las siembras cada 48 horas harta la aparición de las colonias características. B).- Técnica del raspado de uñas. 1.- Se sienta al paciente en alto y se procede a limpiar la uña afectada con alcohol. 2.- El borde del dedo afectado se deposita sobre el margen de la placa de Petri. 3.- Se raspa la uña con una navaja de afeitar nueva, yendo de la parte proximal a la dixtal. 4.- La muestra se recolecta en la caja de Petri y se tapa para su transporte. NOTA: SI más de una uña está afectada, se debe usar un equipo limpio para cada uña (navajas limpias). C).- Técnica de obtención de cabellos. 1.- examinar el cuero cabelludo del paciente. 2.- Depilar con pinzas los cabellos afectados y al mismo tiempo colectar las escamas que se hallen sobre el cuero cabelludo. 3.- Depositar las muestras sobre una placa de Petri estéril y cerrarla. 4.- Cuando el paciente es un niño que no resiste la depilación los cabellos se toman con una cinta "Scotch". 5.- A partir de entonces se procede igual que en el paso # 7 de la primera técnica descrita en está práctica. Material a emplear. 1.- Diversas muestras clínicas parasitadas por dermatofitos. 2.- Tubos con medio SDA, PDA, Micobiotico. 3.- KOH o NaOH al 5-10%. 4.- Cepas de: a.- Trichophyton (T. mentagrophytes, T. rubrum, T. tonsurans, T. concentricum ). b.- Microsporum gypseum. c.- Epidermophyton floccosum. Desarrollo de la práctica. 1.- Hacer preparaciones en fresco con las muestras de pelo y/o escamas, de piel y/o uñas. 2.- Buscar artrosporas e hifas ramificadas (fase parasitaria común de los dermatofitos) 3.- Cultivar las muestras clínicas por la técnica de punto en placa o en tubo, empleando los diversos medios de cultivo. 4.- Hacer microcultivo de las cepas tipo proporcionadas por el profesor. 5.- Hacer la descripción macroscópica de las cepas tipo proporcionadas por el profesor. 17
18 Dibujos. Fac. Cs. Qs. Dpto. De MICROBIOLOGÍA Muestra positiva a fase parasitaria. Descripción macroscópica de las cepas tipo. Cuestionario 1.-Defina el termino tiña 2.- Por su topografía cómo se clasifican las tiñas? 3.- Qué técnicas se emplean en la toma de muestras para tiñas? 4.- Qué solución se emplea para realizar el en fresco de una muestra de tiña? 5.- Qué se debe observar en la preparación en fresco para determinar que se trata de una tiña? 6.- Hacer un reporte de la muestra utilizada con la siguiente información: a) Tipo de muestra b) Observaciones de la lesión c) Microorganismo aislado d) Conclusiones 18
19 Introducción. Práctica No. 7. IDENTIFICACIÓN MACRO Y MICROSCÓPICA DE LOS DERMATOFITOS. Se ha podido llegar a una clasificación simplificada de los dermatofitos mediante el cultivo de los mismos y la selección de ciertos caracteres morfológicos específicos como criterios para la diferenciación entre géneros y especies. Por este método, Emmons demostró con claridad máxima que tan solo procede considerar tres géneros: Microsporum, Trichophyton, Epidermophyton, la diferenciación de los géneros y sus respectivas especies se basa en las características macroscópicas de las colonias y en la morfología microscópica. Género Trichophtyon: Por examen macroscópico, la colonia tiene aspecto algodonoso, pulverulento o polvoriento o velloso, liso o céreo. La pigmentación varía notablemente, ya que en cultivo pueden ser blancos, rosados o rojos, purpúreos, violetas, anaranjados, amarillos o pardos. Puede presentarse pigmento difusible al medio, que se aprecia al reverso de la placa o tubo; este pigmento puede variar del color beige al café o rojo vino intenso. Por examen microscópico las macroconidias son raras o no existen en algunas especies, a menos que el hongo se desarrolle sobre un medio de cultivo apropiado y se observan como grandes estructuras fusiformes en mazo, de pared gruesa o lisa de 4 a 6 micras de ancho por 10 a 50 micras de longitud. Pueden verse también otras estructuras como micelio en raqueta, clamidosporas y cuerpos nodulares o hifas en espiral. Género Microsporum: En cultivo desarrollo un micelio aéreo, algodonoso, lanudo, pulverulento o polvoriento, cuyo color varía del ante al blanco o matices más intensos del pardo. Por examen microscópico, la pared espinosa de las macroconidias caracteriza al género, puede ser pequeña (de dos septos) o grande (de 6 a 12 septos), fusiforme u oval, de pared gruesa o delgada, se presentan microconidias, se advierten también hifas septadas similares a clamidosporas. Género Epidermophyton: Por su aspecto macroscópico, los cultivos son característicamente aterciopelados o pulverulentos, con surcos radiales ventrales y color amarillo verdoso. Por examen microscópico solo producen grandes macroconidias de pared delgada, lisas, multitabicadas y en mazo. En el micelio se ven clamidosporas e hifas en raqueta, este género solo incluye una especie (E. floccosum ) Objetivo. Familiarizar al alumno con los parámetros macro y microscópicos de los dermatofitos en base a las cepas tipo. 19
20 Material a emplear. 1.- Microcultivos sembrados en la práctica anterior. 2.- Cepas tipo proporcionadas por el profesor. 3.- Formol al 10%. 4.- Colorante azul de algodón. 5.- Barniz de uñas transparente. Desarrollar la práctica. 1.- Hacer un análisis macroscópico de los cultivos obtenidos a partir de la muestra problema y cepas tipo proporcionales por el profesor. 2.- Desmontar los microcultivos después de haber desactivado con formol al 10% por lo menos 45 minutos antes y hacer un análisis microscópico comparativo con preparaciones fijas proporcionadas por el profesor. 3.- Hacer la descripción macroscópica de las cepas tipo proporcionadas por el profesor. Dibujos. a.- Trichophyton Tonsurans. b.- Trichophyton Rubrum. c.- Trichophyton Mentagrophytes. d.- Microsporum Gypseum. E.- Epidermophyton Floccosum. Descripción macroscópica de las cepas tipo. Cuestionario 1.-De la clasificación con género y especie de Dermatofitos 2.- Qué tipo de tejido atacan los Dermatofitos? 3.- Cuál es el sustrato que degradan los Dermatofitos? 4.- Que poseen los Dermatofitos para poder degradar este sustrato? 5.- En términos generales cómo es la morfología macroscópica de un Dermatofito? 20
21 Práctica No. 8. Pitiriasis versicolor Introducción. Micosis superficial causada por Malassezia furfur, afecta sobre todo tronco y raìces de extremidades, se caracteriza por manchas lenticulares asintomáticas de color rosado, marrón o hipocromicas cubiertas de escama fina y de evolución crònica. Su distribución es cosmopolita, afecta a ambos sexos con ligero predominio en mujeres, es rara en niños y ancianos pero se ha observado desde antes de las dos semanas de edad hasta después de los 90 años, con predominio de los 20 a los 30 años de edad, se manifiesta en cualquier raza y nivel socioeconómico. Se consideran como factores predisponentes desnutrición, infeccioines crónicas, embarazo, administración de glucocorticoides, aplicación de aceites y lubricantes en la piel, uso de prendas sinteticas, no se ha demostrado contagio. Objetivo. Familiarizar al alumno con la toma de muestra clínica de lesiones características de esta micosis; instruirlo en el manejo de la técnica en fresco a través de la cual se buscara el estado parasitario del agente etiologico en la muestra clínica seleccionada Técnicas a emplear. A).- Obtención de escamas. 1.- El laboratorista deberá de proveerse de alcohol, gasa, lancetas estériles, placas de Petri y un marcador. 2.- Se localiza la parte afectada y se analiza macroscópicamente la lesión anotando si hay o no descamación, resequedad, si hay bordes, etc. 3.- Se limpia la zona afectada con gasa y alcohol. 4.- Se hace un raspado ligero con uno de los bordes de la lanceta ola muestra se toma adhiriendo a la piel un trozo de cinta "SCOTCH" y retirándola de golpe, la cual se colocara en un porta objeto para su transporte y observación. 5.- El producto de la lesión se recolecta en placas de Petri. 6.- Se toman los datos del paciente escribiéndolos con marcador en la parte superior de la placa. 7.- En el laboratorio, con una parte de la muestra se realiza una preparación en fresco de la siguiente manera: a).- Sobre un porta objetos agregar una gota de NaOH o KOH del 5 al 10% más una gota de azul de Parker b).- Se deposita un pequeño fragmento de muestra y se deja reposar por 10 minutos. c).- Se deposita un cubre objetos sobre la preparación, tratando de no formar burbujas de aire y se deja reposar la muestra por 15 minutos. d).- La preparación se observa al microscopio con el objetivo seco débil y seco fuerte, tratando de buscar la fase parasitaria del hongo. 21
22 8.- En zona de esterilidad junto a un mechero, la muestra clínica sobrante se siembra por la técnica de punto en placa y en tubos con medios de cultivo que contengan SDA, PDA, Agar Micobiótico, etc a los cuales se les agrega 5% de aceite de oliva 9.- Se encuban las placas a 37ºC durante 4 a 5 días haciendo la revisión de las siembras cada 48 horas harta la aparición de las colonias características. Material a emplear. 1.- Diversas muestras clínicas parasitadas por Malassezia furfur 2.- Tubos con medio SDA, PDA, Micobiotico más 5% de aceite de oliva 3.- KOH o NaOH al 5-10%. 4.- Azul de Parker 4.- Cepas de: a.- Malassezia furfur. Desarrollo de la práctica. 1.- Hacer preparaciones en fresco con las muestras de escamas,. 2.- Buscar acúmulos de blastosporas y filamentos cortos 3.- Cultivar las muestras clínicas por la técnica de punto en placa o en tubo, empleando los diversos medios de cultivo. 4.- Hacer microcultivo de las cepas tipo proporcionadas por el profesor. 5.- Hacer la descripción macroscópica de la cepa tipo proporcionada por el profesor. Dibujos. Muestra positiva a fase parasitaria. Descripción macroscópica de las cepa tipo. Cuestionario 1.-Defina el termino Pitiriasis 2.- En que tipo de pacientes es frecuente esta micosis? 3.- Qué técnicas se emplean en la toma de muestras para este padecimiento? 4.- Qué solución se emplea para realizar el en fresco de una muestra de Pitiriasis? 5.- Qué se debe observar en la preparación en fresco para determinar que se trata de una Pitiriasis? 6.- Hacer un reporte de la muestra utilizada con la siguiente información: a) Tipo de muestra b) Observaciones de la lesión c) Microorganismo aislado d) Conclusiones 22
23 Práctica No. 9 CROMOMICOSIS Y ESPOROTRICOSIS (MICOSIS SUBCUTÁNEAS) Introducción. Esporotricosis.- Es una micosis generalmente subcutánea y benigna, pero que en raros casos puede ser generalizada y mortal. Afecta especialmente las extremidades superiores e inferiores y excepcionalmente produce enfermedad pulmonar primaria al penetrar por vía respiratoria. La esporotricosis prevalece en campesinos, empacadores de alfarería y vendedores de diversos zacates, la vía de entrada es a través de la piel, mediante un traumatismo cutáneo con espinas u otros objetos vegetales. En su fase parasitaria, el hongo se observa como levaduras gemantes alargadas (en forma de puro) o redondeadas de 3 a 10 micras de diámetro. En la fase saprobia el hongo tiene micelio delgado (1 a 2 micras de diámetro), tabicado, ramificado, que esporula mediante conidióforos en forma de flor de margarita. El examen directo del pus no permite en general visualizar al hongo; raramente se pueden observar las formas parasitarias en frotes de pus teñidos por el método de Hotchkiss-Mac Manus. El cultivo es el mejor método diagnostico de la esporotricosis, mediante la siembra del pus en placa con SDA, las colonias al principio son pequeñas y blancas y crecen de micelio áereo; a medida que aumenta el crecimiento, la superficie de la colonia adquiere aspecto húmedo, rugoso y membranoso, el color puede variar del crema al negro. Cromomicosis.- Es una micosis verrucosa, crónica, de evolución lenta, generalmente se localiza en miembros inferiores. Se caracteriza por la formación de nódulos cutáneos verrucosos y lesiones ulcerocostrosas que a veces son pedunculadas, dando apariencia de coliflor. Es prevalente en campesinos del sexo masculino, especialmente en los que no protegen sus pies adecuadamente de los traumatismos causados por plantas, en algunas lesiones, el hongo se halla en las escamas, en el pus y los tejidos subcutáneos a través de biopsias. En el examen en fresco de estos productos biológicos, se observan unas células redondeadas de color castaño y paredes gruesas, aisladas, o en grupos, llamadas Corpúsculos de Meddlar, en ocasiones, estas llamadas células fumagoides miden de 6 a 12 micras de diámetro y aparecen divididas transversalmente. Esta micosis es producida por diversos hongos negros, todos pertenecientes al grupo de los Dematiáceos, entre los más conocidos cabe citar al género Phialophora, que posee una sola especie patógena: P. verrucosa, caracterizada por la producción de fiálides en forma de botella que producen esporas en su interior, las cuales son expulsadas por el cuello de la fiálide, aparentando un florero Cladosporium carrionil.- Única especie considerada patógena, se identifica porque sólo puede esporular en forma de cladosporio, es decir, cadenas de conidias acropétalas de longitud moderada. 23
24 El género Fonsecae comprende a las especies siguientes: F. pedrosoi, F. compacta, F, dermatitidis, especialmente F. pedrosoi esporula de tres maneras diferentes: acrotecas, cladosporios y por fiálides. Acroteca.- Se caracteriza por la producción de conidióforos semejantes a clavas, de donde nacen las conidias en la punta y a los lados. Objetivo. Familiarizar al alumno con el manejo y conocimiento macro y microscópico de las cepas como agentes etiológicos de la esporotricosis y cromomicosis. Técnicas a emplear. A).- Técnica de observación directa o en fresco. B).- Técnica de microcultivo (cepas tipo). Material a emplear. 1.- Placas para microcultivo. 2.- Placas con agar Saboraud seccionadas en cuadros. 3.- Glicerol estéril al 10%. 4.- Formol al 10%. 5.- Pipetas estériles. 6.- Colorante azul de algodón. 7.- Cepas proporcionadas por el profesor. 8.- Porta y cubre objetos. Desarrollo de la práctica. 1.- Sembrar microcultivo con las cepas tipo. 2.- Hacer preparaciones directas a partir de las cepas tipo (es recomendable no usar colorante para que se observe el tipo de micelio en el caso de los hongos dematiáceos). 3.- Hacer la descripción macroscópica de las cepas tipo. Dibujos. a.- Sporothrix schenkii. b.- Phialophora verrucosa. c.- Fonsecae pedrosoi. d.- Cladosporium carrionii. Descripción macroscópica de las cepas tipo. 24
25 Cuestionario 1.- Cuáles son las micosis subcutáneas mas frecuentes en México? 2.-Mencione los géneros que pertenecen al grupo de los Demateaceos 3.- Los Demateaceos, cómo se observan al microscopio en su fase de levadura? 4.-La morfología macroscópica de un Demateaceo en general cómo es? 5.-Mencione el tipo de esporulación de cada uno de los Demateaceos 25
26 Práctica No. 10. CRIPTOCOCOSIS (MICOSIS OPORTUNISTAS) Introducción. La criptococosis es una micosis oportunista que afecta primariamente a pulmones, produciéndose una enfermedad que generalmente cursa en forma asintomática, pudiendo diseminarse a cualquier órgano de la economía, particularmente a meninges y sistema nervioso central, donde produce meningitis subaguda o crónica. El hongo fue aislado por primera vez por Emmons del excremento y nidos de palomas; Sanfelice lo aisló del zumo de frutas. El diagnóstico de laboratorio se hace en base a los productos biológicos como esputo y líquido cefalorraquídeo, el hongo se manifiesta en el producto de la lesión como un organismo en forma de levadura con pared gruesa y en gemación, de 5 a 20 micras de diámetro, rodeado por una cápsula ancha, refráctil. Deben cultivarse todos los materiales en agar sangre a 37ºC y en agar Saboraud a temperatura ambiente, puede añadirse cloranfenicol al medio para evitar la presencia de bacterias en las muestras, pero nunca cicloheximida, dada la sensibilidad de Criptococcus neoformas a la misma. Sobre agar glucosa Saboraud a temperatura ambiente, el organismo crece con lentitud, produciendo colonias en forma de levadura que al principio pueden ser blancas, rugosas y granulosas. En las preparaciones macroscópicas se comprueba la presencia de organismos y células en gemación con tubos germinales, en la etapa de crecimiento no se advierte cápsula, la colonia se desarrolla a 37ºC sobre agar Saboraud con apariencia mucoide, viscosa, de color crema a pardo, en su morfología se observan levaduras encapsuladas al teñir con tinta china. Objetivo. Familiarizar al alumno con la búsqueda de la fase parasitaria del hongo a través de la tinción con tinta china y que a la vez conozca la morfología colonial macroscópica del agente etiológico. Técnicas a emplear. A).- Obtención de esputo. B).- Concentración de esputo. C).- Obtención de Líquido Cefalorraquídeo ( es preferible que esta muestra sea obtenida por un profesionista experto en la obtención de dicho líquido ). CONCENTRACIÓN DEL LÍQUIDO CEFALORRAQUÍDEO. 1.- Centrifugar la muestra a 2000 rpm durante 20 minutos. 26
27 2.- Con pipeta Pasteur estéril separar cuidadosamente el sobrenadante y pasarlo a un tubo estéril. 3.- Utilizar el sedimento para las pruebas diagnósticas de rutina. TINCIÓN NEGATIVA (con tinta china) 1.- En un porta objetos poner una gota de tinta china. 2.- Con una asa bacteriológica poner una o dos asadas del sedimento (ya sea esputo o LCR) 3.- Poner un cubre objetos tratando de no formar burbujas de aire. 4.- Montar la muestra y observar al microscopio a seco débil y seco fuerte, tratando de hallar la fase parasitaria del hongo. Material a emplear. 1.- Frascos de boca ancha estériles. 2.- Tinta china. 3.- Asa bacteriológica. 4.- Porta y cubre objeto. 5.- Pepsina al 1%. Desarrollo de la práctica. 1.- Obtener muestras patológicas y concentrarlas siguiendo las técnicas ya descritas. 2.- Hacer preparaciones en fresco con la tinta china. 3.- Buscar la fase parasitaria de C neoformans en las preparaciones con tinta china. 4.- Observar las características coloniales de C. neoformans en agar Saboraud. Dibujos. a.- Criptococcus neoformans. Descripción macroscópica de las cepas tipo. Cuestionario 1.- Qué estructura es característica de Criptococcus neoformans? 2.- Qué técnica de coloración se utiliza para observar al agente etiológico de la Criptococosis? 3.- Cuáles son los cuadros clínicos mas graves que puede ocasionar este hongo? 4.- Qué tipo de muestras se pueden utilizar en el diagnostico de una Criptococosis? 5.- A qué antibiótico es sensible Criptococcus neoformans? 27
28 Práctica No. 11. CANDIDIASIS (MICOSIS OPORTUNISTA) Introducción. La Candidiasis, por los diversos cuadros clínicos que presenta, puede causar desde una micosis superficial, una subcutánea, hasta una profunda o bien comportarse como oportunista. Candida albicans puede causar infección aguda o subaguda, produciendo lesiones en boca, vagina, piel, uñas, bronquios, pulmones y ocasionalmente, septicemia, endocarditis o meningitis. Como pueden aislarse cepas patógenas de Candida albicans en piel normal, mucosa oral y vaginal normales y en la materia fecal de individuos sanos, salta a la vista que la mayor parte de las infecciones tienen un origen endógeno y la determinación de la fuente de infección constituye un problema tan difícil como en el caso de infecciones de Staphylococcus aureus. La presencia de Candida en el individuo normal explica la diseminación durante las enfermedades debilitantes, padecimientos malignos del sistema hamatopoyético, diabetes, lupus eritemetoso, enfermedades granulomatosas, etc... La Candidiasis ataca a personas de todas las edades y razas y en ambos sexos, habiéndose reconocido ciertos factores predisponentes. Los antibióticos de amplio espectro y las drogas citotóxicas favorecen la infección por Candida albicans y otras especies de Candida. Actualmente, Candida albicans y Candida stellatoidea son los agentes etiológicos que se presentan con mayor frecuencias es casos de candidiasis, pero existen otras especies también capaces de producir enfermedad en el hombre: Candida krusei; Candida tropicalis; Candida guillemondii; Candida pseudotropicalis; Candida parakrusei. Objetivo. El alumno será capaz de seleccionar las tácticas de trabajo que lo lleven a la identificación de Candida albicans a partir de diversos especímenes clínicos. Técnicas a emplear. A).- Tomar de exudados faríngeos. 1.- El paciente debe presentarse si haber tomado alimentos, con aseo bucal hecho al menos 12 horas antes de tomar la muestra. 2.- Se coloca al paciente sentado en posición odontológica. Auxiliarse con una lámpara adecuada para visualizar perfectamente la cavidad oral. 3.- Mediante un abatelenguas estéril sujetar la lengua e introducir un hisopo estéril, raspando con la punta del algodón las partes más afectadas de las amígdalas, sin tocar úvula. 4.- Repetir la operación con otro hisopo estéril. 5.- Se colocan los hisopos dentro de un tubo con solución salina estéril. 28
29 B).- Toma de exudados vaginales. 1.- La paciente debe presentarse sin aseo o aplicación de medicamentos vaginales por lo menos 24 horas antes de la toma de la muestra y sin estar mestruando, a menos que sea estrictamente necesario. 2.- Se coloca a la paciente en posición ginecológica y se introduce en la vagina un espejo vaginal en posición paralela a los labios; se debe ir rotando el espejo con mucho cuidado hasta tenerlo en posición horizontal. Se localiza con cuidado el cuello y se fija el espejo (de preferencia evitar el uso de sustancias lubricantes). 3.- Se toma la muestra con dos hisopos estériles del sitio donde se localice la lesión (de preferencia del fondo del saco y cuello de la matriz). 4.- Uno de los hisopos se rota sobre un porta objetos, para tinción de Gram. 5.- Se introducen los dos hisopos en un tubo con solución salina isotónica. C).- Técnica de siembra por punto en tubo y placa. En el caso de que la muestra sea de escamas o raspado de uñas. D).- Técnica de observación en fresco con KOH o NaOH. Tinción de Gram. 1.- Fijar el frote por calor. 2.- Cubrir el porta objetos con cristal violeta por un minuto. 3.- Lavar con agua corriente. 4.- Cubrir la preparación con lugol durante un minuto. 5.- Lavar con agua corriente. 6.- Decolorar con solución alcohol-cetona. 7.- lavar con agua corriente. 8.- Contrastar con safranina por 30 segundos. 9.- Lavar con agua corriente Examinar al microscopio con aceite de inmersión. Aislamiento por estría cruzada 1.- Depositar suavemente el inóculo del hisopo rotándolo sobre la superficie del medio de cultivo, en la zona periférica de uno de los sectores de la placa. 2.- Extenderlo con el asa bacteriológica (prevenir flameada y enfriada en el medio), sin separarla de la superficie del medio: dibujar de 4 a 5 trozos en zig-zag continuo y separado. 3.- Quemar el asa y enfriar dentro del medio. 4.- Repetir la operación anterior cuidando de tocar solamente los extremos de las últimas estrías. 5.- La siguiente estría se lleva hasta el centro del medio sin tocar en ningún momento las estrías de los otros sectores. 29
30 Identificación rápida de Candida albicans. Fac. Cs. Qs. Dpto. De MICROBIOLOGÍA A).- Tubo germinativo en suero. 1.- Inocular una pequeña cantidad de células en 0.5 ml del suero (de preferencia de pacientes diabéticos). 2.- Incubar a 37ºC en agitación durante 30 a 60 minutos o en condiciones estacionarias durante 2 horas. 3.- Montar entre portada y cubre objetos una gota de la suspensión y observar al microscopio a seco débil y seco fuerte. B).- Producción de clamidosporas (Técnica de Dalmov) 1.- Marcar en dos partes iguales el reverso de las placas de Petri con medio Oxgall y Clamidosporas o bien Harina de Maíz. 2.- En uno de los sectores de cada medio, descargar el inóculo de la cepa problema, trazando un zig-zag abierto con el asa, procurando no sobrepasar la superficie de 2 cm cuadrados. 3.- Flamear el asa y repasar la estría en sentido contrario. 4.- Flamear el cubre objetos y colocarlo sobre la siembra, presionándolo ligeramente con el extremo contrario del asa. 5.- Repetir la misma operación en el sector contrario y con cepa testigo. 6.- Incubar las placas a 28ºC durante 48 a 96 horas. 7.- Destapar las placas y observar al microscopio directamente sobre el agar y cubre objetos a seco débil y seco fuerte. De la cepa problema hacer una suspensión en solución salina estéril para sembrar los medios para la fermentación y asimilación de carbohidratos. Zimograma: 1.- Utilizar una serie de tubos de hemólisis conteniendo cada uno 4 ml de medio base de Wickerham y 1 ml de los azúcares a probar al 6%. Adicionar una campana de Durham como indicador de la producción de gas. 2.- Inocularlos con dos gotas de la suspensión. 3.- Incubar a 28ºC durante 72 horas. 4.- Hacer las lecturas de producción de ácido y gas. Auxonograma. 1.- Utilizar una serie de tubos de 16 x 150 mm con tapón de rosca, conteniendo cada uno 4.5 ml del medio base y 0.5 ml de los azúcares a probar al 5%. 2.- Inocular con dos gotas de la suspensión. 3.- Incubar a 28ºC y observar el crecimiento cada 48 horas. Material a emplear. 1.- Cepa del género Candida ( Candida albicans ). 2.- Exudado faríngeo. 30
31 3.- Exudado vaginal. 4.- Suero humano. 5.- Placas Petri con: - Gelosa sangre. - Saboraud dextrosa. - Clamidospora. - Oxgall y Biggy. 6.- Tubos de medio de: - Saboraud inclinado. - Micobiotico inclinado. 7.- Medio base de Wickerham. 8.- Medio base para asimilación de carbohidratos. 9.- Solución salina estéril Abate lenguas e hisopos estériles Pipetas Pasteur estériles Equipo de tinción de Gram NaOH o KOH al 10% Preparaciónes fijas. Fac. Cs. Qs. Dpto. De MICROBIOLOGÍA Desarrollo de la práctica. 1.- Proceder a la toma del exudado faríngeo. 2.- Trabajarlo simultáneamente con las muestras proporcionadas por el profesor ( exudado vaginal y/o uñas o escamas ), siguiendo la metodología para el diagnóstico de Candida. 3.- Identificar hasta especie las levaduras aisladas de las muestras problema. 4.- Observar la morfología parasitaria de Candida albicans en preparaciones fijas proporcionadas por el profesor. Dibujos. a.- Observación en fresco de exudado faríngeo. b.- Observación en fresco de exudado vaginal. c.- Frote de exudado faríngeo. Tinción de Gram. d.- Frote exudado vaginal. Tinción de Gram. Cuestionario 1.-Aparte de Candida albicans, qué otras especies existen? 2.- Cuáles son los cuadros clínicos que con mayor frecuencia produce Candida albicans? 3.-Para la producción de Clamidosporas, en qué medio de cultivo se debe hacer crecer a Candida? 4.-En una tinción de Gram, cómo se observa a este agente etiológico? 5.- Qué pruebas de laboratorio se utilizan para determinar la especie de este hongo? 31
GUIA DE TRABAJOS PRÁCTICOS MICOLOGÍA
 GUIA DE TRABAJOS PRÁCTICOS MICOLOGÍA Departamento de Microbiología Facultad de Medicina UBA 2009 Guía de Trabajos Prácticos 2009 1 Observación de escamas con micelios y levaduras. Digestión con KOH 40%.
GUIA DE TRABAJOS PRÁCTICOS MICOLOGÍA Departamento de Microbiología Facultad de Medicina UBA 2009 Guía de Trabajos Prácticos 2009 1 Observación de escamas con micelios y levaduras. Digestión con KOH 40%.
MÓDULO III DERMATOFITOSIS
 MAESTRÍA EN MICOLOGÍA MÉDICA Universidad Nacional del Nordeste COHORTE 2012-2013 MÓDULO III DERMATOFITOSIS MAESTRÍA EN MICOLOGÍA MÉDICA Universidad Nacional del Nordeste COHORTE 2012-2013 GÉNERO EPIDERMOPHYTON
MAESTRÍA EN MICOLOGÍA MÉDICA Universidad Nacional del Nordeste COHORTE 2012-2013 MÓDULO III DERMATOFITOSIS MAESTRÍA EN MICOLOGÍA MÉDICA Universidad Nacional del Nordeste COHORTE 2012-2013 GÉNERO EPIDERMOPHYTON
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Unidad Curricular: Virología y Micología Veterinaria TRABAJO PRÁCTICO No. 6 MICOLOGÍA OBJETIVO 1. Estudiar las características morfológicas de los hongos y su crecimiento en los medios de cultivo. GENERALIDADES
1 Unidad Curricular: Virología y Micología Veterinaria TRABAJO PRÁCTICO No. 6 MICOLOGÍA OBJETIVO 1. Estudiar las características morfológicas de los hongos y su crecimiento en los medios de cultivo. GENERALIDADES
GUÍA DE TRABAJOS PRÁCTICOS MICROBIOLOGÍA FARMACIA
 1 GUÍA DE TRABAJOS PRÁCTICOS MICROBIOLOGÍA FARMACIA ÁREA MICOLOGÍA AÑO 2014 2 TRABAJO PRÁCTICO N 1 Tema: - Macromorfología de las colonias fúngicas - Micromorfología del desarrollo fúngico vegetativo -
1 GUÍA DE TRABAJOS PRÁCTICOS MICROBIOLOGÍA FARMACIA ÁREA MICOLOGÍA AÑO 2014 2 TRABAJO PRÁCTICO N 1 Tema: - Macromorfología de las colonias fúngicas - Micromorfología del desarrollo fúngico vegetativo -
PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Introducción
 PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Objetivos. Que el alumno aprenda las técnicas de cultivo y manipulación de diferentes tipos de hongos. Que el estudiante conozca las
PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Objetivos. Que el alumno aprenda las técnicas de cultivo y manipulación de diferentes tipos de hongos. Que el estudiante conozca las
MANUAL DE NORMAS Y PROCEDIMIENTOS PROCEDIMIENTO: OPERATIVOS DE ORINAS
 SERVICIO DE LABORATORIO 1 DE 5 1. OBJETIVO El objetivo del presente documento es describir el procedimiento para determinar las características físicas, química y microscópicas de muestras de orinas. 2.
SERVICIO DE LABORATORIO 1 DE 5 1. OBJETIVO El objetivo del presente documento es describir el procedimiento para determinar las características físicas, química y microscópicas de muestras de orinas. 2.
PRÁCTICO N 3. Técnicas para la observación, aislamiento y conservación de microorganismos
 PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA
 PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
LEVADURAS DE INTERÉS MÉDICO PRUEBAS DE IDENTIFICACIÓN
 LEVADURAS DE INTERÉS MÉDICO PRUEBAS DE IDENTIFICACIÓN Levaduras de Importancia Médica Levaduras del género Candida Levaduras del género Cryptococcus Levaduras del género Malassezia Levaduras del género
LEVADURAS DE INTERÉS MÉDICO PRUEBAS DE IDENTIFICACIÓN Levaduras de Importancia Médica Levaduras del género Candida Levaduras del género Cryptococcus Levaduras del género Malassezia Levaduras del género
GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS
 ESCUELA DE SALUD GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia Informática
ESCUELA DE SALUD GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia Informática
INTRODUCCIÓN AL ESTUDIO DE HONGOS
 UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN FACULTAD DE CIENCIAS QUÍMICAS INTRODUCCIÓN AL ESTUDIO DE HONGOS M.C. Francisco Javier Gómez Vega Mayo del 2005 H O N G O S No existe un acuerdo general sobre los límites
UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN FACULTAD DE CIENCIAS QUÍMICAS INTRODUCCIÓN AL ESTUDIO DE HONGOS M.C. Francisco Javier Gómez Vega Mayo del 2005 H O N G O S No existe un acuerdo general sobre los límites
PRACTICA Núm. 15 AISLAMIENTO E IDENTIFICACION DE MOHOS DEL AIRE
 I. OBJETIVO PRACTICA Núm. 15 AISLAMIENTO E IDENTIFICACION DE MOHOS DEL AIRE Aislar mohos del aire y conocer sus características morfológicas y estructurales para lograr su identificación. II. INTRODUCCION
I. OBJETIVO PRACTICA Núm. 15 AISLAMIENTO E IDENTIFICACION DE MOHOS DEL AIRE Aislar mohos del aire y conocer sus características morfológicas y estructurales para lograr su identificación. II. INTRODUCCION
Cultivo Puro. Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica
 Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II
 UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
Los Microorganismos PROFESORA LUCÍA MUÑOZ ROJAS
 Los Microorganismos PROFESORA LUCÍA MUÑOZ ROJAS Qué son? 1. Seres vivos microscópicos que sólo son visibles usando microscopios. Su tamaño se mide en nanómetros, micrómetros o micras. 2. En su mayoría
Los Microorganismos PROFESORA LUCÍA MUÑOZ ROJAS Qué son? 1. Seres vivos microscópicos que sólo son visibles usando microscopios. Su tamaño se mide en nanómetros, micrómetros o micras. 2. En su mayoría
2. Observación de hongos de interés industrial
 2. Observación de hongos de interés industrial En esta práctica se realizarán observaciones en fresco de varios hongos de interés industrial. 2.1 Preparaciones para el estudio microscópico de los aislados
2. Observación de hongos de interés industrial En esta práctica se realizarán observaciones en fresco de varios hongos de interés industrial. 2.1 Preparaciones para el estudio microscópico de los aislados
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión)
 PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para
PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para
MANUAL DE OPERACIONES. DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 15 SUBDIRECCIÓN DE INVESTIGACIÓN BIOMÉDICA MANUAL DE TINCIONES
 A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
A Hoja: de 0 MANUAL DE TINCIONES Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma Hoja: 2 de 0. Propósito Establecer las técnicas y condiciones para la realización de tinciones utilizadas en
1ª PRÁCTICA DE MICROBIOLOGÍA:
 1ª PRÁCTICA DE MICROBIOLOGÍA: INTRODUCCIÓN A LAS TÉCNICAS DE CULTIVO EN MICROBIOLOGÍA (O COMO HACER VISIBLES ORGANISMOS INVISIBLES) INTRODUCCIÓN El objetivo de esta práctica es aislar y observar algunos
1ª PRÁCTICA DE MICROBIOLOGÍA: INTRODUCCIÓN A LAS TÉCNICAS DE CULTIVO EN MICROBIOLOGÍA (O COMO HACER VISIBLES ORGANISMOS INVISIBLES) INTRODUCCIÓN El objetivo de esta práctica es aislar y observar algunos
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
Hongos. Hongos ornamentales. Psilocybes Amanita muscaria Cortinarius violaceus
 Hongos Hongos ornamentales Psilocybes Amanita muscaria Cortinarius violaceus Hongos alimenticios Ustilago maydis (zeae) Amanita cesarea Boletus edulis Agaricus campestris Rossula brevipes (stuntzii) Candida
Hongos Hongos ornamentales Psilocybes Amanita muscaria Cortinarius violaceus Hongos alimenticios Ustilago maydis (zeae) Amanita cesarea Boletus edulis Agaricus campestris Rossula brevipes (stuntzii) Candida
Tema 4.- Técnicas de siembra y aislamiento
 Tema 4.- Técnicas de siembra y aislamiento La siembra consiste en tomar con el asa de platino, previamente flameado, o con hisopo estéril una pequeña cantidad de muestra a estudiar y repartirla por toda
Tema 4.- Técnicas de siembra y aislamiento La siembra consiste en tomar con el asa de platino, previamente flameado, o con hisopo estéril una pequeña cantidad de muestra a estudiar y repartirla por toda
FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA
 FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA UNIDAD DIDÁCTICA : CÉLULAS Y TEJIDOS 01.- Células animales y vegetales Duración Estimada: 1h 40 min Capacidad Terminal Observación de células animales y
FICHAS DE PRÁCTICAS DE BIOLOGÍA 4º ESO BIOLOGÍA UNIDAD DIDÁCTICA : CÉLULAS Y TEJIDOS 01.- Células animales y vegetales Duración Estimada: 1h 40 min Capacidad Terminal Observación de células animales y
Micosis Superficiales I Dermatofitosis
 Micosis Superficiales I Dermatofitosis Micosis Superficiales Son aquellas micosis que invaden la capa superficial de piel, mucosas y fáneras (pelo y uñas). Sin atravesar la membrana basal del epitelio.
Micosis Superficiales I Dermatofitosis Micosis Superficiales Son aquellas micosis que invaden la capa superficial de piel, mucosas y fáneras (pelo y uñas). Sin atravesar la membrana basal del epitelio.
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
Trabajo Práctico N 3. Reconocimiento de sustancias ácidas, básicas y neutras. mediante el empleo de indicadores químicos.
 Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Laboratorio Nacional de Salud Pública
 1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
1. Tinción de Gram 2. Objeto y campo de aplicación La técnica de tinción de Gram se utiliza para la tinción de bacterias, levaduras y actinomicetos aerobios. Este procedimiento operativo estándar es aplicable
GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES
 ESCUELA DE SALUD GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia
ESCUELA DE SALUD GUÍA OBSERVACIÓN DE MICROORGANISMOS Y USO DE TINCIONES DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO
 RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
- Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio microbiológico.
 Microbiología General e Inmunología Año 2012 Trabajo Práctico Nº1 Objetivos: Que el alumno sea capaz de: - Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio
Microbiología General e Inmunología Año 2012 Trabajo Práctico Nº1 Objetivos: Que el alumno sea capaz de: - Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio
TRABAJO PRÁCTICO N 6 FERTILIZANTES BIOLÓGICOS: DESARROLLO Y CONTROL DE CALIDAD DE INOCULANTES
 TRABAJO PRÁCTICO N 6 FERTILIZANTES BIOLÓGICOS: DESARROLLO Y CONTROL DE CALIDAD DE INOCULANTES Objetivos Conocer los parámetros para la selección de cepas. Conocer las metodologías y procedimientos microbiológicos
TRABAJO PRÁCTICO N 6 FERTILIZANTES BIOLÓGICOS: DESARROLLO Y CONTROL DE CALIDAD DE INOCULANTES Objetivos Conocer los parámetros para la selección de cepas. Conocer las metodologías y procedimientos microbiológicos
HONGOS CONTAMINANTES COMUNES. Ruby N. Gutiérrez 5.1
 HONGOS CONTAMINANTES COMUNES. Ruby N. Gutiérrez 5.1 - Medios de Sabouraud y Mycosel - El agar Mycosel contiene cicloheximida y cloranfenicol (antibióticos) que inhiben el crecimiento de casi todas las
HONGOS CONTAMINANTES COMUNES. Ruby N. Gutiérrez 5.1 - Medios de Sabouraud y Mycosel - El agar Mycosel contiene cicloheximida y cloranfenicol (antibióticos) que inhiben el crecimiento de casi todas las
BIODETERIORO DEL PATRIMONIO FOTOGRÁFICO URUGUAYO PRODUCIDO POR HONGOS
 BIODETERIORO DEL PATRIMONIO FOTOGRÁFICO URUGUAYO PRODUCIDO POR HONGOS Silvina Soria; Belén Corallo, Dinorah Pan, Raquel Alonso y Lina Bettucci Laboratorio de Micología Facultad de Ciencias Espacio Interdisciplinario-UDELAR
BIODETERIORO DEL PATRIMONIO FOTOGRÁFICO URUGUAYO PRODUCIDO POR HONGOS Silvina Soria; Belén Corallo, Dinorah Pan, Raquel Alonso y Lina Bettucci Laboratorio de Micología Facultad de Ciencias Espacio Interdisciplinario-UDELAR
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
Micosis superficiales y oportunistas
 Universidad Nacional de Rosario - Facultad de Ciencias Médicas Micosis superficiales y oportunistas Área Injuria - 2015 HONGOS RECORDEMOS Eucariotas Inmóviles Pared celular con quitina Membrana citoplasmática
Universidad Nacional de Rosario - Facultad de Ciencias Médicas Micosis superficiales y oportunistas Área Injuria - 2015 HONGOS RECORDEMOS Eucariotas Inmóviles Pared celular con quitina Membrana citoplasmática
Micosis Profundas. Clasificación:
 MICOSIS PROFUNDAS Micosis Profundas Clasificación: Micosis Dermohipodérmicas. Micosis Profundas Sistémicas. Micosis Profundas Localizadas en un órgano, tejido o región anatómica. EPIDEMIOLOGIA Distribución
MICOSIS PROFUNDAS Micosis Profundas Clasificación: Micosis Dermohipodérmicas. Micosis Profundas Sistémicas. Micosis Profundas Localizadas en un órgano, tejido o región anatómica. EPIDEMIOLOGIA Distribución
LABORATORIO DE MICROBIOLOGÍA EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote
 Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
Toma de Muestras Microbiológicas
 Toma de Muestras Microbiológicas MICROBIOLOGÍA CLÍNICA DIAGNÓSTICO DE ENFERMEDADES INFECCIOSAS MUESTRA AISLAMIENTO IDENTIFICACIÓN SENSIBILIDAD A ANTIMICROBIANOS Detección de anticuerpos, antígenos y ácidos
Toma de Muestras Microbiológicas MICROBIOLOGÍA CLÍNICA DIAGNÓSTICO DE ENFERMEDADES INFECCIOSAS MUESTRA AISLAMIENTO IDENTIFICACIÓN SENSIBILIDAD A ANTIMICROBIANOS Detección de anticuerpos, antígenos y ácidos
NMP PARA LA DETERMINACION DE COLIFORMESY COLIFORMES FECALES EN AGUAS
 PRT-712.03-005 Página 1 de 6 1. OBJETIVO Este método es utilizado para estimar la densidad de bacterias del grupo coliformes y conocer la calidad sanitaria en aguas crudas 2. CAMPO DE APLICACIÓN Y ALCANCE
PRT-712.03-005 Página 1 de 6 1. OBJETIVO Este método es utilizado para estimar la densidad de bacterias del grupo coliformes y conocer la calidad sanitaria en aguas crudas 2. CAMPO DE APLICACIÓN Y ALCANCE
ESPORAS DE HONGOS ALERGENOS: Concentración en hogares de pacientes alérgicos y en depósitos de residuos
 ESPORAS DE HONGOS ALERGENOS: Concentración en hogares de pacientes alérgicos y en depósitos de residuos Autores: NAJAR, Laura E.; MOLINA, María G.;PRÓSPERI Ana M.; PRÓSPERI, Susana B. Colaboradores: Alcantú
ESPORAS DE HONGOS ALERGENOS: Concentración en hogares de pacientes alérgicos y en depósitos de residuos Autores: NAJAR, Laura E.; MOLINA, María G.;PRÓSPERI Ana M.; PRÓSPERI, Susana B. Colaboradores: Alcantú
CATEDRA DE MICROBIOLOGIA Y PARASITOLOGIA FOUBA. Patogenia de los Hongos
 Patogenia de los Hongos Micetismo MECANISMOS DE ACCIÓN Micotoxicosis Reacciones alérgicas Micosis PATÓGENA Parásito Hongo Micosis Hábitat Hospedero Factores del Hospedero Estado inmunológico Enfermedades
Patogenia de los Hongos Micetismo MECANISMOS DE ACCIÓN Micotoxicosis Reacciones alérgicas Micosis PATÓGENA Parásito Hongo Micosis Hábitat Hospedero Factores del Hospedero Estado inmunológico Enfermedades
BIORREACTRES. Estudios básicos y aplicados sobre procesos de fermentación
 BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
Carrera de Microbiología Clínica Módulo Micología Clínica Año Guía de trabajos prácticos
 Carrera de Microbiología Clínica Año 2013 Guía de trabajos prácticos Carrera de Microbiología Clínica DIRECTORES Dra. Liliana Guelfand Dr. Rolando Soloaga GUÍA DE TRABAJOS PRÁCTICOS 2013 DOCENTES Claudia
Carrera de Microbiología Clínica Año 2013 Guía de trabajos prácticos Carrera de Microbiología Clínica DIRECTORES Dra. Liliana Guelfand Dr. Rolando Soloaga GUÍA DE TRABAJOS PRÁCTICOS 2013 DOCENTES Claudia
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
AISLAMIENTO DE MICROORGANISMOS
 PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
GENERALIDADES DE HONGOS. Micología
 GENERALIDADES DE HONGOS 1 CARACTERÍSTICAS DE LOS HONGOS DE IMPORTANCIA MÉDICA Reino Fungi Organismos eucariotas Se nutren por absorción-heterótrofos Aerobios Desarrollo a 28ºC; 37ºC Pared celular compuesta
GENERALIDADES DE HONGOS 1 CARACTERÍSTICAS DE LOS HONGOS DE IMPORTANCIA MÉDICA Reino Fungi Organismos eucariotas Se nutren por absorción-heterótrofos Aerobios Desarrollo a 28ºC; 37ºC Pared celular compuesta
UNIVERSIDAD DE CIENCIAS Y ARTES DE CHIAPAS
 FACULTAD DE CIENCIAS DE LA NUTRICIÓN Y ALIMENTOS LICENCIATURA EN NUTRIOLOGÍA MANUAL DE PRÁCTICAS PARA LA EXPERIENCIA ACADÉMICA MICROBIOLOGÍA Y PARASITOLOGÍA ELABORO: Q.F.B. MARÍA DOLORES TOLEDO MEZA ACTUALIZÓ:
FACULTAD DE CIENCIAS DE LA NUTRICIÓN Y ALIMENTOS LICENCIATURA EN NUTRIOLOGÍA MANUAL DE PRÁCTICAS PARA LA EXPERIENCIA ACADÉMICA MICROBIOLOGÍA Y PARASITOLOGÍA ELABORO: Q.F.B. MARÍA DOLORES TOLEDO MEZA ACTUALIZÓ:
Materiales. Cultivos puros de hongos: Saccharomyces cerevisiae Rhodototula sp Penicillum sp Aspergillus niger Rhizopous sp Alternaria sp Fusarium sp
 Unidad 3. Estudio de cultivos bacterianos puros y Unidad 4. Estudio microscópico y cultivo de hongos algas y protozoarios Práctica 5. Técnicas de siembra y cultivo de bacterias y hongos Objetivos Aplicar
Unidad 3. Estudio de cultivos bacterianos puros y Unidad 4. Estudio microscópico y cultivo de hongos algas y protozoarios Práctica 5. Técnicas de siembra y cultivo de bacterias y hongos Objetivos Aplicar
ESTRATEGIAS PARA EL CONTROL HIGIENICO SANITARIO DE ALIMENTARIAS. 21 Mayo de 2015
 ESTRATEGIAS PARA EL CONTROL HIGIENICO SANITARIO DE SUPERFICIES EN INDUSTRIAS ALIMENTARIAS. METODOS DIRECTOS E INDIRECTOS 21 Mayo de 2015 CRITERIOS MICROBIOLOGICOS PARA EL CONTROL AMBIENTAL INDICADORES
ESTRATEGIAS PARA EL CONTROL HIGIENICO SANITARIO DE SUPERFICIES EN INDUSTRIAS ALIMENTARIAS. METODOS DIRECTOS E INDIRECTOS 21 Mayo de 2015 CRITERIOS MICROBIOLOGICOS PARA EL CONTROL AMBIENTAL INDICADORES
Técnicas de monitoreo para la detección de microorganismos en el medio ambiente
 Técnicas de monitoreo para la detección de microorganismos en el medio ambiente Gloria Alicia Figueroa Aguilar Condiciones Ambientales REQUISITO: El laboratorio debe asegurarse que las condiciones ambientales,
Técnicas de monitoreo para la detección de microorganismos en el medio ambiente Gloria Alicia Figueroa Aguilar Condiciones Ambientales REQUISITO: El laboratorio debe asegurarse que las condiciones ambientales,
COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM
 DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM. 2 ESTRUCTURA CELULAR (BLOLQUE III) INTRODUCCIÓN La célula es la unidad anatómica y fisiológica de los
DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM. 2 ESTRUCTURA CELULAR (BLOLQUE III) INTRODUCCIÓN La célula es la unidad anatómica y fisiológica de los
RepublicofEcuador EDICTOFGOVERNMENT±
 RepublicofEcuador EDICTOFGOVERNMENT± Inordertopromotepubliceducationandpublicsafety,equaljusticeforal, abeterinformedcitizenry,theruleoflaw,worldtradeandworldpeace, thislegaldocumentisherebymadeavailableonanoncommercialbasis,asit
RepublicofEcuador EDICTOFGOVERNMENT± Inordertopromotepubliceducationandpublicsafety,equaljusticeforal, abeterinformedcitizenry,theruleoflaw,worldtradeandworldpeace, thislegaldocumentisherebymadeavailableonanoncommercialbasis,asit
MICROBIOLOGÍA AGRÍCOLA
 MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I
 UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
Microscopio y observación de células
 I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
Hongos. Hongos ornamentales. Amanita muscaria Cortinarius violaceus
 Hongos Hongos ornamentales Psilocybes Amanita muscaria Cortinarius violaceus Hongos alimenticios Ustilago maydis (zeae) Amanita cesarea Boletus edulis Agaricus campestris Rossula brevipes (stuntzii) Candida
Hongos Hongos ornamentales Psilocybes Amanita muscaria Cortinarius violaceus Hongos alimenticios Ustilago maydis (zeae) Amanita cesarea Boletus edulis Agaricus campestris Rossula brevipes (stuntzii) Candida
ANEXO 1 Medios de cultivo y reconstitución de cepas
 conservamos 31 ANEXO 1 Medios de cultivo y reconstitución de cepas Agar tripticasa de soya (TSA) -Triptona, digestión pancreática de caseína -Peptona de soya, digestión pancreática de harina de soya -Cloruro
conservamos 31 ANEXO 1 Medios de cultivo y reconstitución de cepas Agar tripticasa de soya (TSA) -Triptona, digestión pancreática de caseína -Peptona de soya, digestión pancreática de harina de soya -Cloruro
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR. PRACTICA No. 3 TINCIONES
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR PRACTICA No. 3 TINCIONES Alumnos(as): Karla Ayde Sánchez Guillen Erika Vanessa Molina Murillo Yatzeny Gpe.
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS LABORATORIO DE BIOLOGIA CELULAR PRACTICA No. 3 TINCIONES Alumnos(as): Karla Ayde Sánchez Guillen Erika Vanessa Molina Murillo Yatzeny Gpe.
Objetivos. S Determinar la presencia de bacterias coliformes en una muestra de agua
 Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
EXAMEN EN FRESCO DE HECES Y PRESENCIA DE HUEVOS PRACTICA 3
 EXAMEN EN FRESCO DE HECES Y PRESENCIA DE HUEVOS PRACTICA 3 1. Introducción Examen macroscópico Es importante determinar la consistencia de las heces fecales y clasificarlas en líquidas, blandas o duras,
EXAMEN EN FRESCO DE HECES Y PRESENCIA DE HUEVOS PRACTICA 3 1. Introducción Examen macroscópico Es importante determinar la consistencia de las heces fecales y clasificarlas en líquidas, blandas o duras,
PROPOSICIÓN DE UN CICLO EN EL QUE SE ESTABLECEN RELACIONES ENTRE LAS DISTINTAS FORMAS DE PULLULAR1A PULLULANS
 Anal. Inst. Bot. Cavanilles 31 (2): 149-153 (1974) PROPOSICIÓN DE UN CICLO EN EL QUE SE ESTABLECEN RELACIONES ENTRE LAS DISTINTAS FORMAS DE PULLULAR1A PULLULANS por S. RAMOS e I. GARCÍA ACHA Pullularia
Anal. Inst. Bot. Cavanilles 31 (2): 149-153 (1974) PROPOSICIÓN DE UN CICLO EN EL QUE SE ESTABLECEN RELACIONES ENTRE LAS DISTINTAS FORMAS DE PULLULAR1A PULLULANS por S. RAMOS e I. GARCÍA ACHA Pullularia
PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA.
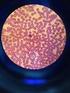 AMPLIACIÓN BIOLOGÍA 4º ESO Taller Biología 4º E.S.O. BLOQUE 2. MICROSCOPÍA Y CITOLOGÍA PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA. OBJETIVOS o Adquirir práctica
AMPLIACIÓN BIOLOGÍA 4º ESO Taller Biología 4º E.S.O. BLOQUE 2. MICROSCOPÍA Y CITOLOGÍA PRÁCTICA 2. PREPARACIONES MICROSCOPICAS 1. CÉLULA EUCARIOTA VEGETAL: EPIDERMIS DE CEBOLLA. OBJETIVOS o Adquirir práctica
Estudios microbiológicos.procedimientos. 1. Urocultivos
 Estudios microbiológicos.procedimientos 1. Urocultivos Se realizará el cultivo de orina a todas las muestras llegadas al laboratorio, que cumplan con los requisitos para la toma, conservación y transporte
Estudios microbiológicos.procedimientos 1. Urocultivos Se realizará el cultivo de orina a todas las muestras llegadas al laboratorio, que cumplan con los requisitos para la toma, conservación y transporte
TRABAJO PRÁCTICO DIVISIÓN CELULAR
 Cátedra de Biología Escuela de Medicina Veterinaria Universidad Nacional de Río Negro TRABAJO PRÁCTICO DIVISIÓN CELULAR OBJETIVOS: Identificar los mecanismos implicados en la reproducción asexual y sexual.
Cátedra de Biología Escuela de Medicina Veterinaria Universidad Nacional de Río Negro TRABAJO PRÁCTICO DIVISIÓN CELULAR OBJETIVOS: Identificar los mecanismos implicados en la reproducción asexual y sexual.
HONGOS Y PROTOCTISTAS
 HONGOS Y PROTOCTISTAS Concepción Rueda Rero GRUPO DE TRABAJO: 209 ELABORACIÓN DE MATERIALES DE CIENCIAS NATURALES, FÍSICA Y QUÍMICA Y MATEMÁTICAS PARA ALUMNOS ACNEES DE 1º ES.O. Curso 2015/2016 del CTIF
HONGOS Y PROTOCTISTAS Concepción Rueda Rero GRUPO DE TRABAJO: 209 ELABORACIÓN DE MATERIALES DE CIENCIAS NATURALES, FÍSICA Y QUÍMICA Y MATEMÁTICAS PARA ALUMNOS ACNEES DE 1º ES.O. Curso 2015/2016 del CTIF
PRACTICA 2 TINCION DE GRAM
 PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
Instructivo. Manejo de los Residuos Infecciosos
 Página 1 de 5 1. Objetivo Describir las actividades necesarias (clasificación, almacenamiento, tratamiento y eliminación), para realizar el manejo de los residuos infeciosos. 2. Alcance Se aplica a todas
Página 1 de 5 1. Objetivo Describir las actividades necesarias (clasificación, almacenamiento, tratamiento y eliminación), para realizar el manejo de los residuos infeciosos. 2. Alcance Se aplica a todas
Dermatofitosis. Tiña de la Uña Fernando Gómez Daza, Postgrado de Dermatología, Universidad de Carabobo, Sep. 2008
 Dermatofitosis. Tiña de la Uña Fernando Gómez Daza, Postgrado de Dermatología, Universidad de Carabobo, Sep. 2008 Esta dermatomicosis se define como toda infección dermatofítica en las uñas de las manos
Dermatofitosis. Tiña de la Uña Fernando Gómez Daza, Postgrado de Dermatología, Universidad de Carabobo, Sep. 2008 Esta dermatomicosis se define como toda infección dermatofítica en las uñas de las manos
TEMA 11 METODOLOGÍA PARA LA TOMA Y TRANSPORTE DE MUESTRAS DE ANAEROBIOS
 TEMA 11 METODOLOGÍA PARA LA TOMA Y TRANSPORTE DE MUESTRAS DE ANAEROBIOS TOMA DE MUESTRA DE ANAEROBIOS Y TRANSPORTE AL LABORATORIO GENERALIDADES IMPORTANCIA DE LA MICROBIOTA ANEROBIA RECOLECCIÓN DE MUESTRAS
TEMA 11 METODOLOGÍA PARA LA TOMA Y TRANSPORTE DE MUESTRAS DE ANAEROBIOS TOMA DE MUESTRA DE ANAEROBIOS Y TRANSPORTE AL LABORATORIO GENERALIDADES IMPORTANCIA DE LA MICROBIOTA ANEROBIA RECOLECCIÓN DE MUESTRAS
ONICOMICOSIS AA/CAI. Estamos en la tierra de nadie Charly García
 ONICOMICOSIS Estamos en la tierra de nadie Charly García Dra. Alicia Arechavala Jefa de la Unidad Micología Hospital Muñiz Prof. Dra. Cristina Iovannitti Centro de Micología Facultad Medicina UBA Hoja
ONICOMICOSIS Estamos en la tierra de nadie Charly García Dra. Alicia Arechavala Jefa de la Unidad Micología Hospital Muñiz Prof. Dra. Cristina Iovannitti Centro de Micología Facultad Medicina UBA Hoja
BUENAS PRÁCTICAS DE MUESTREO PARA LA RECOLECCION DE AGUA PARA EL ANALISIS MICROBIOLOGICO
 BUENAS PRÁCTICAS DE MUESTREO PARA LA RECOLECCION DE AGUA PARA EL ANALISIS MICROBIOLOGICO OBJETIVO Asegurar las condiciones de las tareas de toma de muestra de aguas a las que luego se les realizará análisis
BUENAS PRÁCTICAS DE MUESTREO PARA LA RECOLECCION DE AGUA PARA EL ANALISIS MICROBIOLOGICO OBJETIVO Asegurar las condiciones de las tareas de toma de muestra de aguas a las que luego se les realizará análisis
PROCEDIMIENTO TECNICA DE COAGULASA EN TUBO PRT
 Página 1 de 7 1. OBJETIVO Comprobar la facultad de las unidades formadoras de colonias de S. aureus presentes en una muestra de alimento, de coagular el plasma de conejo por acción de la enzima coagulasa
Página 1 de 7 1. OBJETIVO Comprobar la facultad de las unidades formadoras de colonias de S. aureus presentes en una muestra de alimento, de coagular el plasma de conejo por acción de la enzima coagulasa
PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA
 PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA I. OBJETIVO Investigar la presencia de Estreptococos fecales en una muestra de agua mediante la técnica del Número Más Probable (NMP) usando
PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA I. OBJETIVO Investigar la presencia de Estreptococos fecales en una muestra de agua mediante la técnica del Número Más Probable (NMP) usando
Petrifilm. Levaduras y Mohos. Guía de Interpretación
 3 Petrifilm Levaduras y Mohos Guía de Interpretación Hacer un recuento con placas Petrifilm Levaduras y Mohos es fácil. Contienen un indicador colorante para levaduras y mohos para proporcionar contraste
3 Petrifilm Levaduras y Mohos Guía de Interpretación Hacer un recuento con placas Petrifilm Levaduras y Mohos es fácil. Contienen un indicador colorante para levaduras y mohos para proporcionar contraste
Clostridium perfringens
 Clostridium perfringens Introducción Cuando se lanza un producto alimentario al mercado se deben tener en cuenta varios parámetros que le otorgan calidad al producto, uno de ellos es la inocuidad. Los
Clostridium perfringens Introducción Cuando se lanza un producto alimentario al mercado se deben tener en cuenta varios parámetros que le otorgan calidad al producto, uno de ellos es la inocuidad. Los
PROCEDIMIENTO RECUENTO MOHOS Y LEVADURAS EN ALIMENTOS NORMA ISO 7954
 PRT- 712.02-031 Página 1 de 9 1. OBJETIVO Conocer el número de Mohos y Levaduras que contiene un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento se aplica a todos los alimentos de consumos
PRT- 712.02-031 Página 1 de 9 1. OBJETIVO Conocer el número de Mohos y Levaduras que contiene un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento se aplica a todos los alimentos de consumos
CONTRIBUCIÓN FOTOGRÁFICA AL ESTUDIO DE MICROHONGOS FILAMENTOSOS DEL PÁRAMO DE GUASCA
 1 CONTRIBUCIÓN FOTOGRÁFICA AL ESTUDIO DE MICROHONGOS FILAMENTOSOS DEL PÁRAMO DE GUASCA Investigador principal: Rubén Darío Torrenegra G. Otros Investigadores: Ludis Samira Rueda Blanco. Grupo de Investigación:
1 CONTRIBUCIÓN FOTOGRÁFICA AL ESTUDIO DE MICROHONGOS FILAMENTOSOS DEL PÁRAMO DE GUASCA Investigador principal: Rubén Darío Torrenegra G. Otros Investigadores: Ludis Samira Rueda Blanco. Grupo de Investigación:
QUÉ CONTIENE UN MEDIO? Aquellos requerimientos nutricionales que los microorganismos necesitan para crecer. Depende del ambiente en donde viven.
 OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL
 UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
TEMA 9 MÉTODOS ÓPTICOS PARA EL DIAGNÓSTICO DE LABORATORIO DE ENFERMEDADES INFECCIOSAS
 TEMA 9 MÉTODOS ÓPTICOS PARA EL DIAGNÓSTICO DE LABORATORIO DE ENFERMEDADES INFECCIOSAS INDICE DE CONTENIDOS Introducción Tipos de microscopía óptica Microscopía de campo claro Microscopía de campo oscuro
TEMA 9 MÉTODOS ÓPTICOS PARA EL DIAGNÓSTICO DE LABORATORIO DE ENFERMEDADES INFECCIOSAS INDICE DE CONTENIDOS Introducción Tipos de microscopía óptica Microscopía de campo claro Microscopía de campo oscuro
Profesora: Ana María Gallardo Suárez. Observación de hongos MOHO DEL PAN Y DE LA FRUTA. PRACTICA Nº 3 CURSO: 3 ESO. Recursos ana.fjb.
 Observación de hongos MOHO DEL PAN Y DE LA FRUTA. PRACTICA Nº 3 CURSO: 3 ESO Recursos ana.fjb.es Objetivos de la Práctica Estudio de hongos descomponedores de alimentos: * Observación macroscópica del
Observación de hongos MOHO DEL PAN Y DE LA FRUTA. PRACTICA Nº 3 CURSO: 3 ESO Recursos ana.fjb.es Objetivos de la Práctica Estudio de hongos descomponedores de alimentos: * Observación macroscópica del
Tema 42 Hongos productores de micosis superficiales, subcutáneas y sistémicas
 Tema 42 Hongos productores de micosis superficiales, subcutáneas y sistémicas Miguel Ángel Bratos Pérez Micosis superficiales: etiología, cuadros clínicos, diagnóstico Micosis cutáneas: etiología, cuadros
Tema 42 Hongos productores de micosis superficiales, subcutáneas y sistémicas Miguel Ángel Bratos Pérez Micosis superficiales: etiología, cuadros clínicos, diagnóstico Micosis cutáneas: etiología, cuadros
Escuela de Ciencias Agrícolas, Pecuarias y del Medio Ambiente
 GUÍA: Bacteriología y Micología: Descripción Microscópica y Macroscópica MICROBIOLOGIA AMBIENTAL CÓDIGO 358010 Programa de Ingeniería Ambiental y Tecnología en Saneamiento Ambiental. ESTRATEGIA DE APRENDIZAJE:
GUÍA: Bacteriología y Micología: Descripción Microscópica y Macroscópica MICROBIOLOGIA AMBIENTAL CÓDIGO 358010 Programa de Ingeniería Ambiental y Tecnología en Saneamiento Ambiental. ESTRATEGIA DE APRENDIZAJE:
DIMORFICOS CRIPTOCOCO PNEUMOCYSTIS OTROS HONGOS OPORTUNISTAS
 HONGOS PRODUCTORES DE II DIMORFICOS CRIPTOCOCO PNEUMOCYSTIS OTROS HONGOS OPORTUNISTAS MOHOS LEVADURAS HIFAS NO SEPTADAS HIFAS SEPTADAS ZIGOMICETOS DEMATIACEOS HONGOS HIALINOS MOHOS HIALINOS DERMATOFITOS
HONGOS PRODUCTORES DE II DIMORFICOS CRIPTOCOCO PNEUMOCYSTIS OTROS HONGOS OPORTUNISTAS MOHOS LEVADURAS HIFAS NO SEPTADAS HIFAS SEPTADAS ZIGOMICETOS DEMATIACEOS HONGOS HIALINOS MOHOS HIALINOS DERMATOFITOS
V Olimpiada Española de Biología: Fase Nacional
 Código de Identificación 4 últimos dígitos- letra DNI V Olimpiada Española de Biología: Fase Nacional PRÁCTICA 3: IDENTIFICACIÓN DE POLEN Y SUS RELACIONES CON DISTINTOS TIPOS DE POLINIZACIÓN. USO DEL MICROSCOPIO
Código de Identificación 4 últimos dígitos- letra DNI V Olimpiada Española de Biología: Fase Nacional PRÁCTICA 3: IDENTIFICACIÓN DE POLEN Y SUS RELACIONES CON DISTINTOS TIPOS DE POLINIZACIÓN. USO DEL MICROSCOPIO
Explique el significado de los términos magnificación, resolución y apertura numérica. Cuál es su importancia en microscopía?
 Fecha: dd / mm / aa Datos alumno Nombre: Informe de laboratorio Prácticas 2, 3, 4 y 5 PDF para impresión 1. Preguntas Explique el significado de los términos magnificación, resolución y apertura numérica.
Fecha: dd / mm / aa Datos alumno Nombre: Informe de laboratorio Prácticas 2, 3, 4 y 5 PDF para impresión 1. Preguntas Explique el significado de los términos magnificación, resolución y apertura numérica.
PRÁCTICA 1: Funcionamiento laboratorio. Normas y material
 PRÁCTICA 1: Funcionamiento laboratorio. Normas y material OBJETIVO: 1. Familiarizarse con el uso y manejo de todo el material del laboratorio, así como con las normas para un buen funcionamiento del mismo.
PRÁCTICA 1: Funcionamiento laboratorio. Normas y material OBJETIVO: 1. Familiarizarse con el uso y manejo de todo el material del laboratorio, así como con las normas para un buen funcionamiento del mismo.
DESCRIPCION DE BIOCOUNTER
 DESCRIPCION DE BIOCOUNTER BIOCOUNTER es un Laminocultivo para Control Microbiológico Industrial utilizado ampliamente en el campo alimentario y áreas relacionadas. El análisis microbiológico realizado
DESCRIPCION DE BIOCOUNTER BIOCOUNTER es un Laminocultivo para Control Microbiológico Industrial utilizado ampliamente en el campo alimentario y áreas relacionadas. El análisis microbiológico realizado
REINO FUNGI (=MICOTA)
 REINO FUNGI (=MICOTA) Son organismos eucariotas Heterótrofos (no tienen clorofila) Nutrición por absorción (producen exoenzimas) Producen esporas (de origen asexual y sexual) Pared celular de quitina (poliscárido
REINO FUNGI (=MICOTA) Son organismos eucariotas Heterótrofos (no tienen clorofila) Nutrición por absorción (producen exoenzimas) Producen esporas (de origen asexual y sexual) Pared celular de quitina (poliscárido
PROCESAMIENTO DE MUESTRAS VAGINALES
 PROCESAMIENTO DE MUESTRAS VAGINALES Proyecto AECID 2012 Nuevos procedimientos para el diagnóstico de enfermedades olvidadas utilizando tele-microscopía de bajo coste. 1 TABLA DE CONTENIDOS TOMA DE LA MUESTRA
PROCESAMIENTO DE MUESTRAS VAGINALES Proyecto AECID 2012 Nuevos procedimientos para el diagnóstico de enfermedades olvidadas utilizando tele-microscopía de bajo coste. 1 TABLA DE CONTENIDOS TOMA DE LA MUESTRA
Clase I Generalidades de las Micosis
 Clase I Generalidades de las Micosis Estamos inmersos en un mundo micológico PARTE 1 Diapositivas: de 1 a 26 HONGOS DEFINICIÓN: : Son organismos eucariotas, aclorófilos filos,, cuya pared celular contiene
Clase I Generalidades de las Micosis Estamos inmersos en un mundo micológico PARTE 1 Diapositivas: de 1 a 26 HONGOS DEFINICIÓN: : Son organismos eucariotas, aclorófilos filos,, cuya pared celular contiene
Estos son los principales géneros de hongos que con más frecuencia son productores de micosis subcutáneas. ESPOROTRICOSIS
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA CENTRO UNIVERSITARIO METROPOLITANO FACULTAD DE CIENCIAS MÉDICAS MICROBIOLOGÍA TERCER AÑO MICOSIS SUBCUTÁNEAS Cuando hablamos de micosis subcutáneas nos referimos
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA CENTRO UNIVERSITARIO METROPOLITANO FACULTAD DE CIENCIAS MÉDICAS MICROBIOLOGÍA TERCER AÑO MICOSIS SUBCUTÁNEAS Cuando hablamos de micosis subcutáneas nos referimos
CARRERA DE MEDICINA GUÍA DE PRÁCTICA DE LABORATORIO
 ASIGNATURA: PARASITOLOGÍA Y MICOLOGÍA CICLO: TERCERO SEMESTRE: A 2014 ÁREA: CIENCIAS PATOLÓGICAS MALLA: 6 NÚMERO HORAS SEMANALES DE LA PRÁCTICA: 2 NIVEL CURRICULAR: BÁSICO (CIENCIAS BÁSICAS) LABORATORIO:
ASIGNATURA: PARASITOLOGÍA Y MICOLOGÍA CICLO: TERCERO SEMESTRE: A 2014 ÁREA: CIENCIAS PATOLÓGICAS MALLA: 6 NÚMERO HORAS SEMANALES DE LA PRÁCTICA: 2 NIVEL CURRICULAR: BÁSICO (CIENCIAS BÁSICAS) LABORATORIO:
LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS
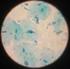 LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS INTRODUCCIÓN En el universo biológico se encuentran dos tipos de células: procariotas y eucariotas. Estas últimas a
LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS INTRODUCCIÓN En el universo biológico se encuentran dos tipos de células: procariotas y eucariotas. Estas últimas a
USO DE LEVADURAS COMO PRODUCTORES DE PROTEINAS DE INTERES FARMACEUTICO
 USO DE LEVADURAS COMO PRODUCTORES DE PROTEINAS DE INTERES FARMACEUTICO INTRODUCCION Un microoganismo de uso industrial debe producir la sustancia de interés; estar disponible en cultivo puro; debe ser
USO DE LEVADURAS COMO PRODUCTORES DE PROTEINAS DE INTERES FARMACEUTICO INTRODUCCION Un microoganismo de uso industrial debe producir la sustancia de interés; estar disponible en cultivo puro; debe ser
UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUÍMICAS. Dr. Iván Salmerón María A. Anaya Castro 4 de abril de 2011
 UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUÍMICAS Dr. Iván Salmerón María A. Anaya Castro 4 de abril de 2011 LECHE PASTEURIZADA DE VACA Leche de vaca para consumo humano, producto proveniente
UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUÍMICAS Dr. Iván Salmerón María A. Anaya Castro 4 de abril de 2011 LECHE PASTEURIZADA DE VACA Leche de vaca para consumo humano, producto proveniente
LOS MICROORGANISMOS EN EL AMBIENTE
 Introducción Objetivo Fundamento Trabajo Práctico Nº 2 LOS MICROORGANISMOS EN EL AMBIENTE Procedimiento Resultados Observaciones Conclusiones INTRODUCCIÓN La microbiología es la ciencia que estudia los
Introducción Objetivo Fundamento Trabajo Práctico Nº 2 LOS MICROORGANISMOS EN EL AMBIENTE Procedimiento Resultados Observaciones Conclusiones INTRODUCCIÓN La microbiología es la ciencia que estudia los
Flora normal del cuerpo
 Flora normal del cuerpo Objetivos Determinar la importancia de la flora normal del cuerpo. Describir algunos ejemplos de organismos que forman parte de la flora normal. Aislar microorganismos del cuello,
Flora normal del cuerpo Objetivos Determinar la importancia de la flora normal del cuerpo. Describir algunos ejemplos de organismos que forman parte de la flora normal. Aislar microorganismos del cuello,
