PRÁCTICAS DE BIOLOGÍA MOLECULAR
|
|
|
- Carlos López Plaza
- hace 8 años
- Vistas:
Transcripción
1 1 PRÁCTICAS DE BIOLOGÍA MOLECULAR Gregorio Hueros Soto Elisa Gómez Yolanda Sanz
2 2 El objetivo fundamental de esta práctica es el desarrollo de un proceso experimental que permite la identificación de secuencias concretas de DNA, tanto genes como secuencias no codificadoras, en el genoma de cualquier organismo. El procedimiento empleado se basa en la utilización de la hibridación de ácidos nucléicos y la detección de esta hibridación utilizando procedimientos no radiactivos. Los resultados obtenidos en esta práctica proporcionarán información sobre la organización en el genoma de las secuencias identificadas, atendiendo al criterio de su grado de repetición, secuencias únicas o repetidas, y en este segundo caso, si dichas secuencias se encuentran dispuestas en el genoma en tandem o dispersas. Este procedimiento experimental (parte A de la práctica) es ampliamente utilizado en todos los campos de la Biología molecular y tiene aplicaciones concretas en Genética. Por ejemplo, la identificación de polimorfismos en el DNA, la construcción de mapas genéticos, la identificación de individuos por huella de DNA o en estudios de evolución molecular. Adicionalmente (parte B de la práctica), ensayaremos un procedimiento de detección de secuencias en el genoma mediante PCR. La inclusión de esta práctica permitirá revisar, críticamente, la utilidad real de ambos métodos en el análisis genómico.
3 3 Parte A. INTRODUCCIÓN GENERAL 1. Hibridación de ácidos nucléicos La posibilidad de desnaturalizar y renaturalizar el DNA permite la hibridación de los ácidos nucléicos. Esto se consigue al desnaturalizar dos moléculas diferentes y ponerlas luego en condiciones de renaturalización, con el objeto de que si existen secuencias complementarias en ambas poblaciones de moléculas, éstas puedan encontrase y formar enlaces de hidrógeno originando segmentos duplexos. También pueden hacerse hibridaciones entre DNA y RNA, desnaturalizando el DNA y poniendo las hebras simples en contacto con el RNA; si existen secuencias complementarias se formarán heteroduplex DNA-RNA. Como es obvio, cuanto más parecidas sean las dos moléculas que se pongan a hibridar, mayores será la longitud del heteroduplex y su estabilidad. En el experimento que se va a desarrollar, se trata de identificar por hibridación aquella secuencia o grupo de secuencias que sean complementarias a una concreta. 2. Elementos que participan en la hibridación Para realizar el experimento, se parte de dos fuentes distintas de DNA. En primer lugar, el DNA blanco, en este caso el genoma de una determinada especie, que es donde se pretende identificar una secuencia o grupo de secuencias. En segundo lugar el denominado DNA sonda, en este caso un fragmento de DNA previamente aislado de un genoma y que nos define un gen o una secuencia nucleotídica concreta. Este DNA sonda está ligado a un vector, un plásmido que tiene propiedades autorreplicativas en el interior de células bacterianas. El aislamiento, purificación y cuantificación del DNA blanco y del DNA sonda, constituyen la primera parte del experimento. 3. Fraccionamiento del DNA El aislamiento de DNA de células eucarióticas da lugar a una solución de moléculas de DNA de alto peso molecular. Si el procedimiento de extracción no hubiera introducido roturas ocasionales, una molécula se correspondería con el DNA
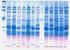
4 4 contenido en un cromosoma del complemento cromosómico de la especie. Distintas moléculas se corresponderían con distintos cromosomas, y conjuntos de ellas con un genoma completo del organismo. Como se parte de un fragmento de tejido constituido por miles de células, el resultado final de la extracción es un conjunto de moléculas, denominado DNA genómico, en el que está representado el genoma de la especie en innumerables copias. Para facilitar el análisis de secuencias concretas del DNA genómico, se procede a la digestión del mismo utilizando enzimas de restricción. Estas enzimas son endonucleasas que tienen la propiedad de reconocer secuencias cortas, de unos cuatro a seis pares de bases en el DNA de doble hebra, y cortar el DNA en todos los puntos donde se encuentre tal secuencia, llamada diana de restricción. Cada enzima de restricción tiene una diana particular. La digestión de una muestra de DNA genómico con una enzima de restricción origina una colección de fragmentos de DNA de distintos tamaños. Los distintos fragmentos de esta colección pueden ser separados en función de su tamaño mediante una técnica denominada electroforesis en gel. Los geles son soportes que constan de una matriz de moléculas largas y delgadas resultado de la polimerización de agarosa o poliacrilamida. La matriz presenta poros cuyo tamaño puede controlarse variando la concentración del gel. Al depositar en el gel el producto de la digestión de un DNA genómico, colocar el gel en un tampón adecuado y aplicar una corriente eléctrica, los fragmentos de DNA, cargados negativamente, se mueven a través del gel hacia el ánodo. Las moléculas de mayor longitud tienen mas dificultades de movimiento a través de los poros del gel por lo que se mueven más lentamente. Por el contrario, las moléculas más cortas tienen menos impedimentos y se mueven más rápidamente. Como resultado, se originará una separación por tamaños de la mezcla de fragmentos iniciales. Los fragmentos originados pueden ser visualizados si el gel se tiñe con bromuro de etidio, un colorante que se intercala entre las bases del DNA y emite una fluorescencia cuando se estimula con radiación ultavioleta. En cada electroforesis se debe cargar en un carril una mezcla de fragmentos de tamaño conocido, denominados marcadores de peso molecular, que permitirá estimar el tamaño de los
5 fragmentos de interés por interpolación. 5 Se realizarán digestiones de los DNA genómicos extraídos con diferentes enzimas de restricción y las digestiones se fraccionarán por electroforesis. Se hará los mismo con los plásmidos. Cuando se comparen ambos resultados quedará patente la muy diferente complejidad de los DNA utilizados. Los carriles de electroforesis del DNA genómico aparecerán saturados de fluorescencia, lo que indica que hay miles de fragmentos de todos los tamaños a lo largo del gel. Por el contrario, la electroforesis de los plásmidos producirá un patrón de fragmentos discreto, con una o pocas bandas según el enzima utilizado. 4. Transferencia a membranas (Southern blot) La identificación de fragmentos de interés entre los miles generados en una digestión de DNA genómico se realizará, como hemos indicado antes, por hibridación. La hibridación no funciona bien cuando se realiza directamente sobre el gel, por lo que se recurre a realizar una transferencia de los fragmentos desde el gel a un soporte sólido fácilmente manejable. Este soporte es un filtro o membrana de nitrocelulosa o nylon que es capaz de unir covalentemente moléculas de DNA. La transferencia se realiza por capilaridad haciendo pasar a través del gel un tampón apropiado que arrastra los fragmentos de DNA hasta la membrana colocada encima del gel. Puesto que la hibridación requiere que las moléculas de DNA estén en forma de hebras sencillas, previamente a la transferencia el gel será equilibrado en un tampón fuertemente alcalino que desnaturalizará al DNA. Las moléculas simplexas quedarán unidas a la membrana en las mismas posiciones relativas que ocupaban en el gel. 5. Marcaje de la sonda Para poder reconocer las moléculas heteroduplexas que se originarán en el proceso de hibridación es necesario que uno de los ácidos nucléicos este marcado. El marcaje se realiza en el DNA sonda. Existen diferentes estrategias para conseguir marcar la sonda. La mayoría de ellas se basan en la producción de copias del fragmento sonda a las que se ha incorporado un desoxirribonucleótido marcado a través de un proceso enzimático de replicación de DNA. El nucleótido marcado puede ser tanto uno al que se ha incorporado un átomo radiactivo como una mólecula que
6 6 funciona como hapteno. Se utilizará este último tipo de marcaje, incorporando en la reacción un nucleótido unido a digoxigenina. Se utilizarán dos protocolos de marcaje: el procedimiento de random-primer y la reacción en cadena de la polimerasa (PCR). Se cuantificará la incorporación del marcaje por random-primer mediante un ensayo de dot-blot. Una vez marcado el DNA sonda se desnaturalizará por calor antes de utilizarlo en la hibridación. 6. Hibridación y su detección El DNA blanco inmovilizado sobre el filtro y desnaturalizado se debe incubar un cierto tiempo con el DNA sonda marcado y desnaturalizado en condiciones que favorezcan la formación de puentes de hidrógeno entre DNA blanco y DNA sonda. Después de la hibridación es necesario eliminar los restos de DNA sonda que no hayan hibridado, lo que se consigue con una serie de lavados. La detección de la hibridación en los sistemas que utilizan marcajes no radiactivos requiere la incubación de la membrana con ciertos agentes para detectar los heteroduplex DNA blanco-dna sonda. En primer lugar se utiliza un anticuerpo contra el hapteno asociado a los nucleótidos marcados, en este caso antidigoxigenina. Se producirá una reacción antígeno-anticuerpo y por lo tanto, en los heteroduplex se formarán complejos digoxigenina-antidigoxigenina. A su vez la antidigoxigenina lleva unida una enzima, la fosfatasa alcalina, capaz de catalizar reacciones de defosforilación. La membrana es incubada con un sustrato específico de la fosfatasa alcalina y en las condiciones apropiadas para que pueda producirse la reacción enzimática. El sustrato que se añade es un compuesto, CDP*, que al ser desfosforilado da lugar a un compuesto cuya descomposición va acompañada de la emisión de luz. Esta emisión de fotones puede ser visualizada si la membrana es cubierta por una película sensible que quedará impresionada en aquellos lugares donde se ha producido hibridación. Este tipo de detección se denomina por quimioluminiscencia. Los fragmentos que han hibridado con la sonda son así identificados.
7 MATERIALES 7 Se utilizarán cuatro plásmidos recombinantes que llevan insertados distintos tipos de secuencias (ver mapas en anexo I): pta794: presenta un inserto de 400 pares de bases (pb) que corresponde a un gen de DNA ribosomal 5S de Triticum aestivum pas1: presenta un inserto de 1 Kpb que corresponde a un monómero de una familia de secuencias repetidas de Triticum tauschii pmrp-1: contiene un fragmento del cdna del gen ZmMRP-1 de maíz, clonado en el vector Bluescript. pgus: contiene un fragmento del gen delator GUS, clonado en el vector Bluescript. Como fuente de DNA genómico se utilizarán hojas jóvenes de cereales: Trigo diploide y maíz.
8 AISLAMIENTO DE DNA GENÓMICO 8 1. Introducción Los procedimientos de extracción de DNA de plantas deben incluir los siguientes pasos: Rotura de paredes celulares. Esto se consigue moliendo el tejido en un mortero en presencia de nitrógeno líquido Rotura de membranas celulares para liberar el DNA. Esto se consigue utilizando un detergente como el SDS Protección del DNA de la acción de nucleasas. Los detergentes realizan esa función junto al EDTA que es un agente quelante que une iones magnesio, necesarios como cofactor para la mayoría de las endonucleasas. La adición de proteinasa K colabora en la degradación de enzimas. Separación de proteínas y DNA. Las proteínas son emulsionadas, desnaturalizadas y separadas del DNA tras la adición de fenol/cloroformo. Utilización de un tampón de ph 8 o superior para asegurar que los ácidos nucléicos se retengan en la fase acuosa. La concentración de sal es también importante para este propósito. El DNA es recogido al final del proceso de extracción por su insolubilidad en etanol. Para conseguir mayor pureza en la preparación de DNA se debe incluir un tratamiento con RNAsa para degradar el RNA contaminante El procedimiento seguido debe reducir en lo posible el fraccionamiento ocasional del DNA. Se obtendrán moléculas de hasta 50 kpb de longitud 2. Métodos Se parte de hojas jóvenes de 15 días recién cortadas. En su defecto se pueden utilizar hojas jóvenes almacenadas a 80º C. 1. Se colocan las hojas sobre un mortero y se añade nitrógeno líquido. Se
9 procede a pulverizar las hojas 9 2. El polvo obtenido se mezcla con tampón de lisis en proporción adecuada: por 500 mg de hoja añadir 4 ml de tampón. el tampón de lisis se ha preparado previamente, en este momento sólo hay que añadir proteinasa K hasta una concentración de 100 μg/ml 3. Pasar el contenido del mortero a un tubo de 10 ml estéril. Tapar el tubo e incubar en un baño a 50º C durante 30 min. Invertir el tubo ocasionalmente y con suavidad para mezclar bien. 4. Retirar del baño. Añadir ½ volumen de fenol y ½ volumen de cloroformo. Mezclar bien. Enfriar en hielo 15 min. Equilibrar los tubos dos a dos y centrifugar 10 min a rpm 5. De las dos capas que se han formado retirar la superior (acuosa) y pasarla a otro tubo de 10 ml. Añadir un volumen de cloroformo. Mezclar bien. Enfriar en hielo 5 min. Equilibrar los tubos dos a dos y centrifugar 10 min a rpm 6. Tomar la capa superior y pasarla a un tubo Falcon de 50 ml. Añadir lentamente 2 volúmenes de etanol absoluto frío. El DNA precipita en la interfase. Se enrolla con una pipeta Pasteur y se pasa a un eppendorf 7. Añadir 1 ml de etanol al 70% para lavar y eliminar los restos de SDS. mezclar con suavidad. Eliminar el etanol de 70%. Invertir el tubo con cuidado para drenar todo el etanol y dejar en esta posición un tiempo para secar ligeramente el DNA 8. Añadir 400 μl de tampón TE y dejar disolviendo el DNA a 4 º C hasta el día siguiente 9. Añadir RNAsa a una concentración final de 100 μg/ml e incubar 20 min a 37º C 10. Añadir SDS y proteinasa K hasta una concentración final de 0,5% SDS y 100 μg/ml de proteinasa K. Incubar 1 h a 50º C 11. Añadir acetato sódico hasta una concentración final de 0,3M, ½ volumen de fenol y ½ volumen de cloroformo. Mezclar bien. Enfriar en hielo durante 10 min. Equilibrar los tubos y centrifugar 10 min a rpm
10 Pasar el sobrenadante a un nuevo tubo. Añadir 1 volumen de cloroformo. Mezclar bien. Enfriar en hielo 5 min. Equilibrar los tubos. Centrifugar 5 min a rpm 13. Pasar el sobrenadante a un nuevo tubo. Añadir 2 volúmenes de etanol absoluto frío. Mezclar y recoger el DNA centrifugando 30 seg. Lavar con etanol al 70%. Drenar el etanol y dejar secar 14. Disolver en una cantidad apropiada de TE ( μl) dependiendo de la cantidad extraída 3. Soluciones Tampón de lisis Solución de trabajo Soluciones stock Para 100 ml 100 mm Tris-HCl ph 8,5 1M 10 ml 100 mm NaCl 1M 10 ml 50 mm EDTA ph 8,5 0,5M 10 ml SDS al 2% 10% 20 ml 100 μg/ml proteinasa K 10 mg/ml 1 ml La solución sin proteinasa K se prepara y autoclava. En el momento de su utilización se añade la proteinasa K Fenol El fenol se compra equilibrado con Tris-ClH ph 8. Se le añade 0,1% 8-Hidroxiquinoleina como antioxidante. Cloroformo 24 partes de cloroformo y 1 parte de alcohol isoamílico RNAsa (concentración 10 mg/ml) Disolver la RNAsa en agua Calentar a 95ºC durante 10 min. Dejar enfriar lentamente y almacenar en alíquotas a 20ºC Acetato sódico Solución stock 3M: Para 100 ml pesar 24,6 g de acetato sódico y disolver en 100 ml de agua.
11 Ajustar a ph 5 con ácido acético. Autoclavar. 11 Tris-HCl 1M, ph 8 Para 100 ml: disolver 12,1 g de Tris base en 80 ml de agua. Añadir 4,2 ml de HCl y ajustar el ph añadiendo HCl 1N. Añadir agua hasta 100 ml. Autoclavar. EDTA 500 mm Para 100 ml: pesar 18,6 g de EDTA. Ajustar el ph con NaOH primero sólido y luego con una solución 1M. Autoclavar Tampón TE 10 mm Tris-HCl ph 8, 1 mm EDTA ph 8. Se prepara a partir de soluciones stock de 1 M Tris- HCl y 500 mm EDTA
12 AISLAMIENTO DE PLÁSMIDOS Introducción Los plásmidos se replican en el interior de bacterias. Para obtenerlos es necesario lisar las bacterias y separar el DNA bacteriano del plasmídico. El procedimiento que se utilizará es el método de lisis alcalina. Las células bacterianas son lisadas con SDS a alto ph con lo que se consigue la desnaturalización del DNA. Al neutralizar posteriormente la preparación, el DNA bacteriano renaturaliza parcialmente y precipita formando un complejo de proteínas-dna-sds. El DNA plasmídico permanece en solución. 2. Métodos 1. Inocular con el clon bacteriano de interés 5 ml de medio LB estéril al que se añaden 30 μl de ampicilina de la solución stock de 25 mg/ml. Incubar a 37ºC, h con agitación vigorosa 2. Tomar 1,5 ml y pasarlos a un eppendorf 3. Centrifugar 5 min a rpm 4. Desechar en su totalidad el sobrenadante y resuspender el precipitado en 100 μl de tampón glucosa frío 5. Añadir 200 μl de una solución recién preparada de 0,2 M NaOH y SDS al 1%. cerrar el tubo y mezclar el contenido invirtiendo el tubo suavemente dos o tres veces. Mantener en hielo durante 5 min 6. Mezclar de nuevo y añadir 150 μl de una solución fría de acetato potásico 5 M ph 4,8. Agitar el tubo e introducirlo en hielo 5 min 7. Centrifugar 10 min a 4ºC y rpm 8. Transferir el sobrenadante a otro tubo y añadir un volumen de fenol/cloroformo (1/2 volumen de fenol y1/2 de cloroformo). Mezclar vigorosamente y centrifugar 5 min. Transferir el sobrenadante a un nuevo tubo 9. Añadir un volumen de cloroformo. Mezclar bien. Centrifugar 5 min. Transferir el sobrenadante a un nuevo tubo.
13 Añadir dos volúmenes de etanol absoluto. Mezclar. Centrifugar 15 min a temperatura ambiente 11. Eliminar el sobrenadante e invertir el tubo para drenar la mayor cantidad posible de etanol 12. Añadir 1 ml de etanol al 70%. mezclar bien, separando el precipitado del fondo del tubo. Volver a centrifugar 13. Eliminar el sobrenadante y secar el precipitado en campana de vacío 14. Añadir 30 μl de TE ph 8 conteniendo 20 μg/ml de RNAsa. Almacenar a 20ºC 3. Soluciones Algunas son comunes a las empleadas en la extracción de DNA genómico. Ver apartado anterior. Medio LB Para 1l: 10 g Bacto-triptona, 5 g extracto de levadura, 10 g NaCl. Ajustar a ph 7 con 1M NaOH Tampón glucosa Solución de trabajo: 50 mm glucosa, 10 mm EDTA ph 8, 25 mm Tris-HCl ph 8. Debe utilizarse frío. Autoclavar Solución de lisis Solución de trabajo: 0,2 N NaOH, SDS al 1%. Se prepara en el momento de su utilización a partir de soluciones stock. Para 10 muestras preparar 2 ml: 40 μl de NaOH 10 M, 200 μl SDS al 10% y hasta 2 ml de agua Acetato potásico Solución de trabajo 5M acetato potásico ph 4,8. Para 100 ml: 49 g de acetato potásico, 11,5 ml de ácido ácetico glacial y hasta 100 ml de agua. Autoclavar. TE-RNAsa Preparar 10 ml de TE ph 8 y añadir 20 μl de RNAsa libre de DNAsas de 10 mg/ml.
14 CUANTIFICACIÓN Y CONTROL DE CALIDAD DEL DNA 14 Cuantificación por espectroscopía UV 1. Introducción Tanto el DNA como el RNA absorben luz ultravioleta de una longitud de onda entre 250 y 270 nm debido a los espectros característicos de sus bases nitrogenadas. A densidad óptica de 260 nm (OD 260 ) una absorbancia de 1, medida en una cubeta de 1cm de paso de luz, es indicativa de una concentración de DNA de 50 μg/ml; para el RNA 1 OD 260 corresponde a una concentración de 40 μg/ml. La proporción de absorbancias a 260 nm y 280 nm sirve para valorar la pureza de la muestra. Un valor de 1,8-2,0 indica que la absorción es fundamentalmente debida a los ácidos nucléicos. Un valor menor a 1,8 indica que puede haber contaminación de proteínas (cuyo máximo de absorción está en torno a 280 nm); en este caso es aconsejable reprecipitar el DNA. 2. Métodos 1. En una cubeta de cuarzo de 1ml de volumen, añadir 995 μl de TE y 5μl de la preparación de DNA genómico obtenida anteriormente 2. Medir la absorbancia en un espectrofotómetro. Realizar dos medidas a OD 260 y OD Calcular la proporción OD 260 /OD Calcular la concentración de DNA de la muestra, teniendo en cuenta la dilución usada (en este caso 200) y la concentración de DNA que corresponde a 1 OD 260 (50 μg/ml) OD 260 x 200 x 50 concentración de DNA en μg/μl =
15 15 Control de calidad del DNA genómico por electroforesis 1. Introducción Este paso resulta esencial para comprobar si el DNA aislado es de alto peso molecular y valorar la posible degradación de la muestra. También confirma las estimaciones de la concentración de DNA realizadas con el espectrofotómetro. Se realiza por electroforesis en geles de agarosa 2. Métodos Preparación de las muestras 1. Ajustar las preparaciones de DNA que han sido previamente cuantificadas por espectroscopía a la concentración de 0,3 μg/μl 2. Preparar una muestra con 500 ng de DNA y añadirle 2 μl de tampón de carga 6x por electroforesis en geles de agarosa. 3. Cargar en un gel de agarosa al 0,8% (ver sección Electroforesis en geles de agarosa)
16 DIGESTIÓN DE DNA GENÓMICO CON ENZIMAS DE RESTRICCIÓN Introducción Las reacciones de digestión se preparan teniendo en cuenta: a) cada μg de DNA se digiere con 3 unidades de enzima; b) el volumen de la reacción debe ser al menos 10 veces superior al del enzima al estar presente el glicerol en los tampones de almacenamiento de las enzimas; c) las reacciones se realizan en tampones específicos para cada enzima. se digerirán 10 μg de DNA con cada enzima en un volumen de 100 μl. 2. Métodos 1. En un eppendorf de 1,5 ml añadir: i. 50 μl de la preparación de DNA de concentración 0,3 μg/μl ii. 7,5 μl de tampón 10x de la enzima iii. 4,5 μl de enzima de concentración 10U/μl iv. 13 μl de agua 2. Incubar los tubos en un baño a 37ºC durante 18 h 3. Realizar una electroforesis control con un alícuota de 5 μl a la que se añade 1μl de tampón de carga 4. Precipitar el resto del DNA añadiendo 7,5 μl de acetato sódico 3M y 150 μl de etanol. Incubar a 20 ºC durante 18 h o a -80 ºC durante 30 min. 5. Eliminar el etanol. Secar las muestras. Añadir 20 μl de TE y 2 μl de tampón de carga 6. Visualizar el gel control. Si se ha producido digestión el resto de la preparación de DNA digerida será fraccionada por electroforesis en gel de agarosa al 0,8% en tampón TAE durante h.
17 DIGESTIÓN DE DNA PLASMÍDICO CON ENZIMAS DE RESTRICCIÓN 17 1 Introducción Se tendrán en cuenta las mismas consideraciones expuestas en el apartado de digestión de DNA genómico. Además hay que considerar: 1) El DNA plasmídico extraído según el protocolo descrito contiene grandes cantidades de RNA, y por lo tanto su concentración no se puede determinar por espectrofotometría. 2) El número de dianas para cualquier enzima de restricción presente en un DNA plasmídico es inferior al presente en el DNA genómico, lo cual permite tiempos de digestión más cortos. 2. Métodos 1. En un eppendorf de 1,5 ml añadir: 0,5 μg de DNA plasmídico 2 μl de tampón 10x de la enzima 0,5 μl de cada enzima empleada Hasta 20 μl de agua 2. Incubar los tubos a 37ºC durante al menos 2 h 3. Añadir 2 μl de tampón de carga 4. Analizar mediante electroforesis en gel de agarosa al 1% ELECTROFORESIS EN GEL DE AGAROSA 1 Introducción Los geles de agarosa se preparan en moldes o bandejas apropiadas de muy diferentes tamaños según el número de muestras a analizar y el tipo y cantidad de DNA a fraccionar. Los geles son de 0,3-0,5 mm de grosor y las concentraciones de agarosa que se utilizan varían del 0,3% al 2%. Cuanto mayor es la concentración de agarosa menor es el tamaño de los fragmentos de DNA que pueden ser eficazmente separados. Una concentración de 0,8% de agarosa separa productos en el rango de 9 a 0,8 kb y una concentración del 1,5% tiene un rango de separación de 2 a 0,2 kb.
18 18 A ph cercanos a la neutralidad el DNA está cargado negativamente y migra del cátodo al ánodo con una movilidad que depende de su tamaño. Normalmente, fragmentos lineares de DNA cortos migran a través del gel más rápidamente que fragmentos largos. La tasa de migración depende del tamaño de los fragmentos lineares y del gradiente de voltaje que se establece entre los electrodos. Los mejores resultados en términos de resolución y eficaz fraccionamiento por tamaños se obtienen utilizando voltajes bajos (<5V/cm). En el caso de separación de plásmidos intactos, al ser moléculas circulares y normalmente superenrolladas su movilidad no sólo depende del tamaño sino también de esa especial conformación. Las moléculas circulares migran más lentamente que las lineares del mismo tamaño. Y las superenrolladas más rápidamente que las lineares. 2. Métodos 2.1 Preparación del gel de agarosa 1. Preparar la bandeja donde se verterá la solución de agarosa sellando con cinta adhesiva los laterales. Colocar el peine dejando entre los dientes y el fondo 1 mm, aproximadamente. 2. Preparar un gel de agarosa a la concentración deseada. Pesar la agarosa y depositarla en un erlermeyer 3. Añadir el volumen apropiado de tampón TAE 4. Llevarlo al microondas y calentar hasta que hierva. La solución al hervir debe quedar transparente 5. Atemperar la solución hasta 50ºC. 6. Verter la solución sobre la bandeja y esperar a que gelifique 7. Retirar el peine y la cinta adhesiva y colocar el gel en la cubeta de electroforesis 8. Añadir tampón TAE en los reservorios de la cubeta y por encima del gel hasta que lo cubra ligeramente
19 2.2 Electroforesis Cargar las muestras en el gel utilizando una micropipeta. Evitar formar burbujas. Reservar los pocillos primero y último para cargar los marcadores de peso molecular. 2. Conectar la cubeta a la fuente de alimentación teniendo en cuenta que el DNA migra del cátodo (negro) al ánodo (rojo). 3. Correr las muestras a <5V/cm hasta que el azul de bromofenol (incluido en el tampón de carga) haya migrado ¾ de la longitud del gel. 4. Desconectar los electrodos. Tomar el gel y pasarlo a una bandeja con solución de bromuro de etidio (0,5 μg/ ml). 5. Mantener la bandeja en agitación suave durante al menos 20 min. PRECAUCIÓN!: El bromuro de etidio es un poderosos mutágeno. Utilizar guantes y manejar la solución con cuidado 6. Llevar el gel a un transiluminador de luz UV para su visualización y fotografiado. 3. Soluciones TAE Solución stock (50x): Para preparar un litro: 242 g de Tris base, 100 ml EDTA 0,5 M y 57,1 ml de ácido acético glacial Tampón de carga 6x 0,25% de azul de bromofenol, 0,25% de xilen-cyanol y 15% de ficoll 400 en agua Bromuro de etidio Solución stock de 10 mg/ml
20 TRANSFERENCIA DE DNA DIGERIDO A MEMBRANAS DE NYLON Introducción La técnica de transferencia o Southern blot permite trasladar el DNA desde el gel de agarosa a una membrana de nylon. El DNA desnaturalizado es transferido por capilaridad y fijado covalentemente a la membrana lo que permite su posterior hibridación con sondas marcadas. Para facilitar la transferencia del gel a la membrana es necesario degradar el DNA para reducir el tamaño de los fragmentos que deben transferirse. Esto se puede conseguir bien con un tratamiento de hidrólisis con HCl o exponiendo brevemente al gel a radiación UV. 2. Métodos 1. El gel de agarosa teñido con bromuro de etidio se lleva al transiluminador y se expone 4 min a la luz UV. Posteriormente se fotografía. 2. Se corta por la zona de los pocillos y se pasa a una bandeja con 250 ml de tampón de desnaturalización, durante 30 min 3. Sumergir el gel en tampón de transferencia durante 15 min. Retirar el tampón y añadir nuevo. mantener otros 15 min 4. Durante el tiempo que el gel permanece en el tampón anterior se prepara el sistema de transferencia. Sobre una cubeta colocar un cristal apropiado. Cortar dos hojas de papel Whatman de 35 cm de longitud y de anchura 1 cm superior a la del gel. Estas hojas se empapan con e tampón de transferencia y se colocan sobre el cristal a modo de puente. Por ellas ascenderá el tampón de transferencia desde la cubeta. Cortar también otras tres hojas de Whatman del tamaño del gel. Cortar la membrana de nylon del tamaño del gel. Usar guantes 5. Colocar el gel encima del puente. La parte del gel que estuvo en contacto con el fondo de la cubeta, lisa y homogénea, debe quedar ahora boca arriba. Evitar que se formen burbujas en al superficie de contacto entre las hojas de Whatman y entre estas y el gel 6. Humedecer la membrana de nylon en tampón de transferencia. Colocarla
21 cuidadosamente y sin que se formen burbujas sobre el gel Colocar encima del gel las tres hojas de Whatman previamente cortadas y humedecidas en tampón de transferencia 8. Colocar encima una torre de servilletas y sobre éstas un cristal y algo de peso 9. Añadir el tampón de transferencia a la cubeta. Cubrir el puente con plástico en la zona no ocupada por el gel 10. Dejar transfiriendo >20 h 11. Retirar las servilletas y marcar la esquina superior derecha de la membrana para usar como referencia. Retirar la membrana y lavarla brevemente en 2xSSC 12. El DNA se fija mejor a la membrana si se somete a luz UV durante un corto espacio de tiempo. Irrradiar la membran en el espectrolinker. 3. Soluciones Solución de desnaturalización Solución de trabajo: 0,5 M NaOH, 1,5 M NaCl. Solución de neutralización-transferencia Solución de trabajo: 1M acetato amónico 2xSSC Solución stock 20xSSC: 3M NaCl, 0,3M citrato sódico
22 MARCAJE DE SONDAS DE DNA UTILIZANDO PCR Introducción La reacción en cadena de la polimerasa (PCR) es una reacción de replicación de DNA que por acción de una enzima polimerasa permite obtener innumerables copias de cualquier segmento de DNA. El único requisito para ello es conocer las secuencias nucleotídicas que flanquean al segmento de DNA. El conocimiento de estas secuencias permite la construcción de cortos oligonucleótidos complementarios a ellas que servirán como cebadores para la síntesis de DNA. El procedimiento consiste en la reiteración de sucesivos ciclos de desnaturalización-anillamiento del cebador-polimerización. En esta práctica se replicarán por PCR los insertos de los plásmidos utilizados, utilizando cebadores complementarios a las regiones del vector que flanquean el inserto para los dos primeros y cebadores específicos del inserto en el caso del gen de maíz La reacción de replicación requiere lógicamente la adición de los cuatro desoxirribonucleótidos precursores. Se utilizará una enzima DNA polimerasa termoresistente (Taq polimerasa) que no sufre desnaturalización a altas temperaturas. Como lo que se pretende es tener marcados los fragmentos de DNA resultantes para utilizarlos como DNA sonda, es necesario introducir en la reacción una cierta proporción de uno de los precursores marcados. Se utilizará dutp unido a digoxigenina (Dig-dUTP). 2. Métodos El volumen final de la reacción es de 25 μl. La proporción de precursor marcado a no marcado (Dig-dUTP: dttp) es 1:3. Los componentes de cada reacción son los siguientes 1μl (1 ng) de DNA diluido 1 μl de tampon de reacción de Taq 10x 0,3 μl MgCl 2 (50 mm) 0,2 μl de una mezcla de datp, dgtp y dctp (10 mm cada uno) 0,15 μl de dttp (10 mm)
23 0,5 μl de Dig-dUTP (1mM) 23 0,5 μl de cebador 1 (10 μm) 0,5 μl de cebador 2 (10 μm) 0,2 μl de Taq polimerasa (1 unidad) 5,65 μl de agua 1. Calcular las cantidades necesarias de cada componente según las sondas a marcar. Preparar una mezcla de reacción en un eppendorf. Añadir todos los componentes excepto el DNA y añadir en último lugar la DNA polimerasa. Mezclar bien todos los componentes y centrifugar brevemente. 2. En eppendorf de 0,5 ml añadir: 1μl de DNA 9 μl de la mezcla de reacción 3. Centrifugar para eliminar las burbujas. 4. Incubar los tubos en el termociclador durante: 1ciclo de 2 min 30 seg a 95ºC 35 ciclos de 30 seg a 94ºC, 1 min a 50ºC y 1 min a 72ºC 1 ciclo de 5 min a 72ºC tiempo indefinido a 4ºC 5. Valorar la eficacia de la amplificación y estimar la concentración del inserto marcado por electroforesis de un alícuota. 6. Tomar 1 μl de la reacción y añadir 1 μl de tampón de carga y 8 μl de agua 7. Preparar un minigel de agarosa al 1%. Cargar las muestras. cargar controles de peso molecular. Realizar la electroforesis.teñir con bromuro de etidio y visualizar. 8. Purificar las sondas marcadas correctamente mediante un kit de
24 limpieza de reacciones de PCR. 24 PREHIBRIDACIÓN-HIBRIDACIÓN 1 Introducción Este método permite identificar de entre los miles de fragmentos de DNA unidos al filtro a aquellos homólogos a la sonda utilizada. La formación de puentes de hidrógeno entre los pares de bases de la sonda y el DNA homólogo implica cinéticas de asociación y disociación, Los factores que influyen en esta cinética son: temperatura, concentración de la sonda y concentración de sal en el tampón de hibridación. También influyen la divergencia entre las secuencias que deben hibridar, el porcentaje de uniones G-C frente a A-T y la cantidad de agentes desnaturalizantes que, en su caso, puedan incluirse en la solución de hibridación, como formamida. Todos estos factores se reúnen en una fórmula general que permite obtener la temperatura de fusión (Tm) a la cual el 50% de los híbridos de doble cadena están reasociados. El criterio para elegir la temperatura de hibridación es de 27º-30ºC por debajo de la Tm. Generalmente, se utilizan métodos estandarizados útiles para la mayoría de los DNA, se empleará uno de esos métodos que emplea una temperatura de hibridación de 65ºC. Antes de incubar la sonda con la membrana se realiza un paso llamado de prehibridación. Durante este proceso se van a bloquear todos los sitios del filtro a los que no se unió el DNA transferido y a los que se podría unir inespecíficamente la sonda. De este modo se asegura que en el proceso de hibridación, la sonda se una únicamente a las secuencias complementarias del DNA blanco. 2. Métodos 1. Todo el proceso se realiza en botellas de cristal o tubos de polipropileno. Las membranas deben ser introducidas cuidadosamente en las botellas utilizando pinzas. No se deben dejar secar.
25 25 2. La membrana se incuba en un volumen apropiado, según su tamaño, de solución de prehibridación, durante al menos 30 min a 65ºC. 3. Desnaturalizar la sonda calentándola a 95ºC durante 10 min. Enfriar rápidamente sumergiendo el eppendorf en hielo. 4. Desechar la solución de prehibridación y añadir 10 ml de solución de hibridación de la misma composición que la anterior y a la que se añaden ng/ml de la sonda desnaturalizada. Incubar a 65º C durante h. 3. Soluciones Solución de prehibridación e hibridación Solución de trabajo: 0,25 M Na 2 HPO 4 ph 7, 7% SDS, 100 μg/ml de DNA de esperma de arenque
26 LAVADOS POSTHIBRIDACIÓN Y DETECCIÓN DE LA HIBRIDACIÓN Introducción Una vez formados los híbridos entre el DNA blanco y la sonda, es necesario eliminar toda la sonda que no ha hibridado. Al ser la membrana absorbente, algo de sonda puede haber empapado la membrana. Si no fuera eliminada, toda la membrana quedaría marcada y los heteroduplex específicos serían indetectables. La temperatura a la que se realizan los lavados y la concentración salina de las soluciones pueden alterarse para permitir un mayor o menor número de emparejamientos incorrectos en las moléculas híbridas. A mayor temperatura y menor concentración de sal, los lavados son más estrictos y se permiten menor número de emparejamientos incorrectos. La detección de la hibridación se realiza por quimiluminiscencia, es decir, detección de una señal luminosa en los lugares donde ha ocurrido hibridación. La señal luminosa será recogida en una película de sensible requiriéndose muy cortos tiempos de exposición. La detección quimiluminiscente es un proceso en tres pasos. En el prímero, las membranas son tratadas con un agente bloqueante que impedirá la unión inespecífica del anticuerpo a la membrana. Después, la membrana es incubada con una dilución del anticuerpo anti-digoxigenina-fosfatasa alcalina. En el tercer paso, la membrana, llevando los heteroduplex DNA blanco-dna sonda unidos al anticuerpo conjugado con la enzima, es puesta en contacto con el sustrato quimiluminiscente y expuesta a una película sensible a la luz para recoger la señal luminosa. 2. Métodos 1. Preparar 200 ml de cada una de las soluciones antes de sacar las membranas del horno de hibridación 2. Sacar la membrana de la botella y ponerla en una cubeta. La solución de hibridación se almacena a 20ºC y puede rehusarse hasta 6 veces
27 3. La membrana se somete a los siguientes lavados posthibridación: 27 lavados de 5 min en HSW a temperatura ambiente lavados de 30 min en HSW a 65ºC 4. Sumergir la membrana en tampón 1 durante unos segundos para equilibrarla 5. Sumergir la membrana en tampón 2 durante al menos 30 min. En este paso se bloquean los sitios inespecíficos de unión al anticuerpo. 6. Preparar una solución del anticuerpo a dilución 1:25000 en tampón 2. Sumergir la membrana durante 30 min con agitación suave 7. La eliminación del anticuerpo no unido a DNA se realiza mediante 3 lavados en tampón 1 durante 10 min 8. Sumergir la membrana en tampón 3 durante 5 min 9. Preparar una solución del sustrato CDP* en tampón 3 diluyendo 1: Poner en contacto con la solución del sustrato CDP* durante 5 min 11. Sellar la membrana en una bolsa de plástico y colocarla en un cassette con una película sensible a la luz. Mantener de 30 min a 2 h. Revelar la película. 3. Soluciones Solución HSW 0,15xSSC, SDS al 0,1% Tampón 1 0,1 M ácido maléico ph 7,5, 0,15 M NaCl, 0,3% Tween 20 Tampón 2 1% Blocking en tampón 1 Tampón 3 0,1 M Tris-ClH ph 9,5, 0,1 M NaCl
28 AMPLIFICACIÓN DE FRAGMENTOS DE DNA Introducción Una alternativa a la técnica de Southern blot, para la detección de secuencias en un genoma, es la amplificación por PCR utilizando cebadores derivados de la secuencia que buscamos. 2. Métodos El volumen de la reacción es de 25 μl 1. Preparar la mezcla de reacción: Tampón 10x 2.5 μl MgCl μl Cebador 1 (10μM) 1 μl Cebador 2 (10μM) 1 μl Mezcla de dntps (10mM cada uno) 0.5 μl Taq polimerasa 0,1 μl (0.5 U) Agua μl 2. Calcular el volumen total de la mezcla de reacción según la cantidad de muestras y mezclar los componentes añadiendo en último lugar la enzima. Mezclar bien. Centrifugar brevemente. 3. Cada muestra de DNA (1 μl =50 ng) se coloca en un eppendorf y se añaden 24 μl de la mezcla de reacción. Centrifugar brevemente 4. Incubar las muestras en el termociclador con el programa: 2 min 30 seg a 94 ºC 30 seg a 94 ºC 35 x 30 seg a 60 ºC 1 min a 72 ºC 5 min a 72 ºC Indefinido a 10 ºC 5. Preparar un gel de agarosa al1% 6. Cargar las muestras en el gel. Efectuar la electroforesis 7. Teñir el gel con bromuro de etidio durante 30 min. Visualizar con luz UV
29 29
30 30 ANEXO I. SECUENCIAS pta794 pta794 BamH1 BamH1 BamH1 Apa LI (150) BamHI (328) 1 TTTTTAATTT TTTTCGCGCC GCTTGCAAAA CAAAACGCAC GTGCAAGTAA 51 TATATTTACC GTGTTTTATT ATTTTGCAGG AGTGCGGTAA GTTATAGCTG 101 GGTGCTCACG ATTCACGGGT CCAGCGTCGG CGTTGTGGCG CGGCAAGCGT 151 GCACTGGTGC GGTTGAGAGG GAGGGGTGGA AACCGCGTTA AACTCGTCTC 201 CGTAGTTGAG AGGGAGCGGC CAAAGCAATG TACAATCGTC TTTGTAGTGG 251 AGCTGGGAGG GGCAAGGATA AGGGACGAAG ACCGGGGTAA CATGTCGGAT 301 GCGATCATAC CCAGCACTAA AGCACCGGAT CCCATCAGAA CTCCGAAGTT 351 AAGCGTGCTT GGGCGAGAGT AGTACTAGGA TGGGTGACCT CCTGGGAAGT 401 CCTCGTGTTG CATTCCC PAs1 pas1 326 bp 1 51 ACAAAACGGA CAATCTCTTT CAAAGTATCA GGGTTTCATA CGGAAACTCG TCTGTTACAA AGGGATTTCA TTATTTTTGA ACTTATTTGA AATCCATAGT TTTTCTGTGT TCAAAATGCA CCATTCAAAG ACACATCATC TATTTACAAC CCTTTCTGAC TTCATTTGTT ATTTTTCATG CATTTACTGA TTATTTTTGA 201 GCCATAAGAC CATGAAATTG AAAAGCATTT GAAATGAACT CTGAAAAGGT 251 TCCAAGTTGG CATGGTATCA TAATTTCACC CACATAGCAT GGGCAAGAAA 301 GTAGAGAGGG CTACGGAAAA ATGGAT
31 31 pmrp-1 attb2 NcoI (5197) ApaLI (5139) coding sequence Intron site AvaI (4726) T7 reverse primer attb1 T7 transcription terminator 6xHis initiation ATG RBS T7 promoter T7 primer pdest17/zmmrp1c-ter 5430 bp HindIII (500) ClaI (507) EcoRI (531) bla promoter ApaLI (857) Amp(R) PstI (1287) AvaI (3467) ROP ApaLI (2603) pbr322 origin ApaLI (2103) Estructura del T-DNA introducido en las plantas transgénicas de maíz FAD2 intron +1 pro CsVMV 3'Nos Bar intron Actine pactin (rice) pro Actine Ds ( 3'Ac ) Ds ( 5'Ac ) 3'Nos LB GFP Actin intron attb1 MRP GR CaMV polya prozmbetl1 TATA Box EcGUS attb2 3'AtSac66 RB
32 PGUS 32 HindIII (4014) ClaI (4009) EcoRV (1) AvaI (3993) ApaLI (146) ApaLI (470) GUS C-term AvaI (1060) ApaLI (3077) Amp GUS C-term 4021 bp EcoRI (1065) PstI (1075) XmaI (1077) AvaI (1077) Sma I (1079) BamHI (1083) ApaLI (1831)
33 puc19 33 Apa LI (2367) AP r P(BLA) puc bp Apa LI (178) ALPHA EcoRI (397) AvaI (413) Xma I (413) Sma I (415) Bam HI (418) PstI (440) Hin diii (448) P(LAC) ORI Apa LI (1121) pbskii (Características similares a puc19 pero con un polylinker mayor) REV-pUC18 (100.0%) Sac I (305) Not I (318) pbspracticas1 (100.0%) XbaI (325) BamHI (337) EcoRI (355) EcoRV (363) lac operon LacZ pblu2skp comp HindIII (367) XhoI (388) ApaI (401) UNIV-pUC18 (100.0%) 2961 bp pbspracticas-b (100.0%) Ampr
34 pbr EcoRI (4360) HindIII (30) AP r BamHI (376) TC r PstI (3612) pbr bp ORI
35 35 Días Actividades Southern Sonda PCR Martes 8 Extracción de DNA I Miércoles 9 Extracción de DNA II Siembra colonias Jueves 10 Cuantificación, gel Miniprep Viernes 11 Lunes 14 Digestión Electroforesis Southern Digestión Plasmidos Electroforesis digestión Martes 15 Transferencia Marcaje Miércoles 16 Fijación Electroforesis marcaje Amplificación construcciones Jueves 17 Hibridación Electroforesis Viernes 18 Revelado, discusión de resultados Discusión
B) Añadir al medio LB, además de la ampicilina, el IPTG (conc final, 0.5 mm) y X-Gal (conc. final 80 µg/ml). Es decir, para 100 ml de LB adicionar:
 Medios utilizados en este apartado: 1.-IPTG stock solution (0.1 M) - 0.6 g IPTG. - Añadir agua estéril a un volumen final de 25 ml. Filtrar con papel secante pasando la solución a tubos eurotubos. Guardar
Medios utilizados en este apartado: 1.-IPTG stock solution (0.1 M) - 0.6 g IPTG. - Añadir agua estéril a un volumen final de 25 ml. Filtrar con papel secante pasando la solución a tubos eurotubos. Guardar
Comprobando la calidad del DNA genómico mediante electroforesis en gel
 Comprobando la calidad del DNA genómico mediante electroforesis en gel GELES 1 Y 2 Agarosa 0.8 %, electroforesis a 1 V/cm Muestras: Se ha cargado muestras de DNA genómico no digerido, antes (líneas impares)
Comprobando la calidad del DNA genómico mediante electroforesis en gel GELES 1 Y 2 Agarosa 0.8 %, electroforesis a 1 V/cm Muestras: Se ha cargado muestras de DNA genómico no digerido, antes (líneas impares)
DEPARTAMENTO DE GENÉTICA UNIVERSIDAD DE GRANADA FUNDAMENTOS DE BIOLOGÍA APLICADA I 4º CURSO DE BIOLOGÍA
 DEPARTAMENTO DE GENÉTICA UNIVERSIDAD DE GRANADA FUNDAMENTOS DE BIOLOGÍA APLICADA I 4º CURSO DE BIOLOGÍA MÓDULO DE GENÉTICA TÉCNICAS MOLECULARES DE ANÁLISIS GENÉTICO AISLAMIENTO Y CLONACIÓN DE ADN SATÉLITE
DEPARTAMENTO DE GENÉTICA UNIVERSIDAD DE GRANADA FUNDAMENTOS DE BIOLOGÍA APLICADA I 4º CURSO DE BIOLOGÍA MÓDULO DE GENÉTICA TÉCNICAS MOLECULARES DE ANÁLISIS GENÉTICO AISLAMIENTO Y CLONACIÓN DE ADN SATÉLITE
1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS
 1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS Existen diferentes métodos para la obtención de ADN bacteriano que varían en duración y complejidad del procedimiento en función de la calidad del ADN que queramos
1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS Existen diferentes métodos para la obtención de ADN bacteriano que varían en duración y complejidad del procedimiento en función de la calidad del ADN que queramos
Módulo 1 Biología Molecular Genética Molecular II 2009. Módulo 1. Amplificación de un fragmento de ADN genómico por PCR
 Módulo 1 Amplificación de un fragmento de ADN genómico por PCR En este primer módulo se amplificará por PCR, mediante el uso de oligonucleótidos específicos, un fragmento de ADN genómico de Aspergillus
Módulo 1 Amplificación de un fragmento de ADN genómico por PCR En este primer módulo se amplificará por PCR, mediante el uso de oligonucleótidos específicos, un fragmento de ADN genómico de Aspergillus
Taller Ciencia para Jóvenes CIMAT 2012 Bachillerato julio 8 14 Cinvestav Campus Guanajuato
 Introducción Taller Ciencia para Jóvenes CIMAT 2012 Bachillerato julio 8 14 Cinvestav Campus Guanajuato Visita al CINVESTAV - Irapuato. 19 julio, 2012. Las bacterias son los organismos más abundantes que
Introducción Taller Ciencia para Jóvenes CIMAT 2012 Bachillerato julio 8 14 Cinvestav Campus Guanajuato Visita al CINVESTAV - Irapuato. 19 julio, 2012. Las bacterias son los organismos más abundantes que
4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar
 4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar - Agarosa de grado molecular - Agarosa de bajo punto de fusión
4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar - Agarosa de grado molecular - Agarosa de bajo punto de fusión
Construcción de la biblioteca en cósmidos de Azospirillum brasilense CBG 497.
 Construcción de la biblioteca en cósmidos de Azospirillum brasilense CBG 497. Extracción de DNA genómico El DNA de A. brasilense CBG 497 se extrajo siguiendo el método descrito por la casa comercial distribuidora
Construcción de la biblioteca en cósmidos de Azospirillum brasilense CBG 497. Extracción de DNA genómico El DNA de A. brasilense CBG 497 se extrajo siguiendo el método descrito por la casa comercial distribuidora
EXTRACCIÓN DE ADN (Doyle & Doyle, 1987)
 EXTRACCIÓN DE ADN (Doyle & Doyle, 1987) MATERIALES Y REACTIVOS (Grado biología molecular a analítico) Cloroformo Alcohol Isoamilico Isopropanol. Etanol al 70%. Bloques de Hielo Microcentrifuga Bloque de
EXTRACCIÓN DE ADN (Doyle & Doyle, 1987) MATERIALES Y REACTIVOS (Grado biología molecular a analítico) Cloroformo Alcohol Isoamilico Isopropanol. Etanol al 70%. Bloques de Hielo Microcentrifuga Bloque de
Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular
 Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular Aislamiento, análisis y manipulación de ácidos nucleicos Generación de moléculas de DNA recombinante Ingeniería Genética AISLAMIENTO
Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular Aislamiento, análisis y manipulación de ácidos nucleicos Generación de moléculas de DNA recombinante Ingeniería Genética AISLAMIENTO
Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular
 Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular Aislamiento, análisis y manipulación de ácidos nucleicos Generación de moléculas de DNA recombinante Ingeniería Genética AISLAMIENTO
Unidad9. Principios de Ingeniería Genética Aplicaciones de Biología Molecular Aislamiento, análisis y manipulación de ácidos nucleicos Generación de moléculas de DNA recombinante Ingeniería Genética AISLAMIENTO
Práctica: Electroforesis de DNA y transferencia a membranas de celulosa o nylon.
 Biología Celular y Molecular para Medicina Jorge Contreras Pineda Práctica: Electroforesis de DNA y transferencia a membranas de celulosa o nylon. GENERALIDADES La electroforesis es una técnica de laboratorio
Biología Celular y Molecular para Medicina Jorge Contreras Pineda Práctica: Electroforesis de DNA y transferencia a membranas de celulosa o nylon. GENERALIDADES La electroforesis es una técnica de laboratorio
ANEXOS. Anexo 1 Transformación mediante electroporación
 Anexo 1 Transformación mediante electroporación ANEXOS En este método de transformación de E. coli se requieren células electrocompetentes. La preparación de estas células consta de los siguientes pasos:
Anexo 1 Transformación mediante electroporación ANEXOS En este método de transformación de E. coli se requieren células electrocompetentes. La preparación de estas células consta de los siguientes pasos:
Transferencia de material genético II. 1) Aislamiento de plásmidos Lisis alcalina
 Transferencia de material genético II 1) Aislamiento de plásmidos Lisis alcalina ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido. Verificar que hay células transformantes de acuerdo
Transferencia de material genético II 1) Aislamiento de plásmidos Lisis alcalina ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido. Verificar que hay células transformantes de acuerdo
Métodos de Biología Molecular y de Ingeniería Genética
 Métodos de Biología Molecular y de Ingeniería Genética I. Enzimas de restricción Análisis Las enzimas de restricción fueron aisladas de bacterias; su función natural es proteger contra DNA extraño II.
Métodos de Biología Molecular y de Ingeniería Genética I. Enzimas de restricción Análisis Las enzimas de restricción fueron aisladas de bacterias; su función natural es proteger contra DNA extraño II.
Módulo 2 Biología Molecular Genética Molecular II Módulo 2. Clonación y Selección de moléculas recombinantes
 Módulo 2 Clonación y Selección de moléculas recombinantes El fragmento de ADN amplificado por PCR en el módulo anterior se introdujo en un vector pgem T Easy (Ver Anexo 2) utilizando una ligasa. En la
Módulo 2 Clonación y Selección de moléculas recombinantes El fragmento de ADN amplificado por PCR en el módulo anterior se introdujo en un vector pgem T Easy (Ver Anexo 2) utilizando una ligasa. En la
5. DETECCION DE GENES DE VIRULENCIA MEDIANTE HIBRIDACIÓN CON SONDAS DE ADN
 5. DETECCION DE GENES DE VIRULENCIA MEDIANTE HIBRIDACIÓN CON SONDAS DE ADN Materiales - Eppendorf de 1,5 ml estériles - Eppendorf de pared fina para PCR - Puntas de pipeta estériles desechables - Guantes
5. DETECCION DE GENES DE VIRULENCIA MEDIANTE HIBRIDACIÓN CON SONDAS DE ADN Materiales - Eppendorf de 1,5 ml estériles - Eppendorf de pared fina para PCR - Puntas de pipeta estériles desechables - Guantes
DANAGENE PLASMID MIDI/MAXI KIT
 REF.0702.4 25 Midis REF.0702.5 10 Maxis DANAGENE PLASMID MIDI/MAXI KIT 1. INTRODUCCION DANAGENE PLASMID Midi/Maxiprep Kit proporciona un método simple para purificar ADN plasmídico a partir de cultivos
REF.0702.4 25 Midis REF.0702.5 10 Maxis DANAGENE PLASMID MIDI/MAXI KIT 1. INTRODUCCION DANAGENE PLASMID Midi/Maxiprep Kit proporciona un método simple para purificar ADN plasmídico a partir de cultivos
Transferencia de material genético II. Ensayos de restricción (digestión) del plásmido Electroforesis en geles de agarosa
 Transferencia de material genético II Ensayos de restricción (digestión) del plásmido Electroforesis en geles de agarosa ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido. Verificar
Transferencia de material genético II Ensayos de restricción (digestión) del plásmido Electroforesis en geles de agarosa ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido. Verificar
PCR SIMULADA. Ref.PCR Simulada (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO
 Ref.PCR Simulada (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO PCR SIMULADA El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
Ref.PCR Simulada (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO PCR SIMULADA El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA
 INTRODUCCIÓN PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA La electroforesis es una técnica que permite separar moléculas cargadas eléctricamente, entre las cuales se encuentran los ácidos nucleicos (DNA
INTRODUCCIÓN PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA La electroforesis es una técnica que permite separar moléculas cargadas eléctricamente, entre las cuales se encuentran los ácidos nucleicos (DNA
Ensayos de restricción
 Ensayos de restricción Vector con inserto= Vector recombinante 6500pb Objetivos de ensayos de restricción de plásmidos Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa.
Ensayos de restricción Vector con inserto= Vector recombinante 6500pb Objetivos de ensayos de restricción de plásmidos Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa.
ESTRUCTURA, PROPIEDADES Y FUNCIÓN DE ÁCIDOS NUCLÉICOS. Aislamiento de plásmido
 ESTRUCTURA, PROPIEDADES Y FUNCIÓN DE ÁCIDOS NUCLÉICOS Aislamiento de plásmido Transferencia de material genético intercelular Transformación Conjugación Transformación Transducción Existe algún mecanismo
ESTRUCTURA, PROPIEDADES Y FUNCIÓN DE ÁCIDOS NUCLÉICOS Aislamiento de plásmido Transferencia de material genético intercelular Transformación Conjugación Transformación Transducción Existe algún mecanismo
Técnicas del ADN recombinante Introducción
 Técnicas del ADN recombinante Introducción Estructura primaria del ADN Enzimas de restricción (ER) Son enzimas (endonucleasas) de origen bacteriano que reconocen y cortan secuencias específicas (4-8 pb)
Técnicas del ADN recombinante Introducción Estructura primaria del ADN Enzimas de restricción (ER) Son enzimas (endonucleasas) de origen bacteriano que reconocen y cortan secuencias específicas (4-8 pb)
CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA. Grado en Medicina
 DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR III FACULTAD DE MEDICINA UNIVERSIDAD COMPLUTENSE DE MADRID CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA Grado en Medicina CURSO ACADÉMICO 2014/2015 INDICE
DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR III FACULTAD DE MEDICINA UNIVERSIDAD COMPLUTENSE DE MADRID CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA Grado en Medicina CURSO ACADÉMICO 2014/2015 INDICE
ESTRUCTURA, PROPIEDADES Y FUNCIÓN DE ÁCIDOS NUCLÉICOS. Aislamiento de plásmido. M. en C. J. Abraham León Domínguez
 ESTRUCTURA, PROPIEDADES Y FUNCIÓN DE ÁCIDOS NUCLÉICOS Aislamiento de plásmido M. en C. J. Abraham León Domínguez La transformación bacteriana es un proceso muy útil en biología molecular. Conjugación Transformación
ESTRUCTURA, PROPIEDADES Y FUNCIÓN DE ÁCIDOS NUCLÉICOS Aislamiento de plásmido M. en C. J. Abraham León Domínguez La transformación bacteriana es un proceso muy útil en biología molecular. Conjugación Transformación
Tipos de Muestras. Técnicas de Biología Molecular. Extracción de ácidos nucleicos. Extracción de DNA genómico. Muestra de sangre en papel filtro
 Técnicas de Biología Molecular Dr. Luis Salazar N Depto. de Ciencias Básicas / UFRO 2004 Tipos de Muestras Extracción de ácidos nucleicos o DNA o RNA Sangre total (EDTA) Saliva Líquido Amniótico Bulbo
Técnicas de Biología Molecular Dr. Luis Salazar N Depto. de Ciencias Básicas / UFRO 2004 Tipos de Muestras Extracción de ácidos nucleicos o DNA o RNA Sangre total (EDTA) Saliva Líquido Amniótico Bulbo
EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS
 EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS Los hongos poseen un genoma complejo consistente en: ADN nuclear (n ADN) ADN mitocondrial (mt ADN) en algunos casos ADN plasmídico EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS
EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS Los hongos poseen un genoma complejo consistente en: ADN nuclear (n ADN) ADN mitocondrial (mt ADN) en algunos casos ADN plasmídico EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS
TÉCNICAS DE ANÁLISIS GENÉTICO: Extracción de ADN.
 Trabajo Práctico 2.2 TÉCNICAS DE ANÁLISIS GENÉTICO: Extracción de ADN. Desde el reconocimiento del ADN como "la molécula de la vida", se conoce que en ella se encuentran cifradas las instrucciones que
Trabajo Práctico 2.2 TÉCNICAS DE ANÁLISIS GENÉTICO: Extracción de ADN. Desde el reconocimiento del ADN como "la molécula de la vida", se conoce que en ella se encuentran cifradas las instrucciones que
DANAGENE SALIVA KIT. Ref Extracciones / Ref Extracciones
 DANAGENE SALIVA KIT Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones 1.INTRODUCCION Este kit provee un método para la extracción de ADN genómico de alta calidad a partir de muestras de saliva
DANAGENE SALIVA KIT Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones 1.INTRODUCCION Este kit provee un método para la extracción de ADN genómico de alta calidad a partir de muestras de saliva
PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS. Es un ácido capaz de formar sales con iones cargados
 Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
Anexo Conservar a 4 o C.
 Anexo 1 Purificación de ADN viral 1. Partir de un sobrenadante de un cultivo celular infectado y clarificado. 2. Concentrar las formas brotantes de los baculovirus por centrifugación (centrifugrar 1,5
Anexo 1 Purificación de ADN viral 1. Partir de un sobrenadante de un cultivo celular infectado y clarificado. 2. Concentrar las formas brotantes de los baculovirus por centrifugación (centrifugrar 1,5
BIOLOGIA MOLECULAR. Dra. Ma. Laura Tondo
 TÉCNICAS BASADAS EN HIBRIDACIÓN MOLECULAR BIOLOGIA MOLECULAR 2016 Dra. Ma. Laura Tondo DESNATURALIZACION Y RENATURALIZACION DEL DNA Cómo se mantienen unidas las dos hebras del DNA? - Puentes de hidrógeno
TÉCNICAS BASADAS EN HIBRIDACIÓN MOLECULAR BIOLOGIA MOLECULAR 2016 Dra. Ma. Laura Tondo DESNATURALIZACION Y RENATURALIZACION DEL DNA Cómo se mantienen unidas las dos hebras del DNA? - Puentes de hidrógeno
PRÁCTICAS AMPLIACIÓN DE MICROBIOLOGÍA
 PRÁCTICAS AMPLIACIÓN DE MICROBIOLOGÍA Día 1º.- EXPLICACIÓN GENERAL. TRANSFORMACIONES: E. coli, Streptomyces Día 2º.- INOCULAR MINIPREPS (8:45 de la mañana). OBTENCIÓN DE PLÁSMIDO ( MINIPREPS, Lisis alcalina)
PRÁCTICAS AMPLIACIÓN DE MICROBIOLOGÍA Día 1º.- EXPLICACIÓN GENERAL. TRANSFORMACIONES: E. coli, Streptomyces Día 2º.- INOCULAR MINIPREPS (8:45 de la mañana). OBTENCIÓN DE PLÁSMIDO ( MINIPREPS, Lisis alcalina)
Anexo 1: Enfermedades monogénicas diagnosticadas hasta la fecha, en España, mediante DGP (Fuente: datos propios del grupo de interés en DGP de
 Anexo 1: Enfermedades monogénicas diagnosticadas hasta la fecha, en España, mediante DGP (Fuente: datos propios del grupo de interés en DGP de ASEBIR). 1 2 3 4 Anexo2: Ejemplo de protocolo para translocaciones
Anexo 1: Enfermedades monogénicas diagnosticadas hasta la fecha, en España, mediante DGP (Fuente: datos propios del grupo de interés en DGP de ASEBIR). 1 2 3 4 Anexo2: Ejemplo de protocolo para translocaciones
A. Anexo: Extracción de dsrna por columnas de exclusión de Sephadex G-50
 A. Anexo: Extracción de dsrna por columnas de exclusión de Sephadex G-50 (Tomado de Guzmán, 1994; Rodríguez, 2006) 1. En un tubo eppendorf tapa rosca estéril colocar 100 mg de material vegetal pulverizado
A. Anexo: Extracción de dsrna por columnas de exclusión de Sephadex G-50 (Tomado de Guzmán, 1994; Rodríguez, 2006) 1. En un tubo eppendorf tapa rosca estéril colocar 100 mg de material vegetal pulverizado
Material complementario UD 5
 Material complementario UD 5 Componentes de la PCR ADN molde que es el que se quiere replicar. Oligonucleótidos iniciadores, primers o cebadores: - Son oligonucleótidos monocatenarios cuya secuencia es
Material complementario UD 5 Componentes de la PCR ADN molde que es el que se quiere replicar. Oligonucleótidos iniciadores, primers o cebadores: - Son oligonucleótidos monocatenarios cuya secuencia es
DANAGENE SPIN GENOMIC DNA KIT
 DANAGENE SPIN GENOMIC DNA KIT Ref.0605.1 50 extracciones Ref.0605.2 250 extracciones Ref.0605.3 1000 extracciones 1. INTRODUCCION Este kit está designado para una rápida extracción y purificación de ADN
DANAGENE SPIN GENOMIC DNA KIT Ref.0605.1 50 extracciones Ref.0605.2 250 extracciones Ref.0605.3 1000 extracciones 1. INTRODUCCION Este kit está designado para una rápida extracción y purificación de ADN
TEMA 14 NUEVAS TECNOLOGÍAS PARA EL ESTUDIO DE LAS ENFERMEDADES INFECCIOSAS: MÉTODOS GENÉTICOS
 TEMA 14 NUEVAS TECNOLOGÍAS PARA EL ESTUDIO DE LAS ENFERMEDADES INFECCIOSAS: MÉTODOS GENÉTICOS Tema 14. Nuevas tecnologías para el estudio de enfermedades infecciosas: métodos genéticos Métodos genéticos
TEMA 14 NUEVAS TECNOLOGÍAS PARA EL ESTUDIO DE LAS ENFERMEDADES INFECCIOSAS: MÉTODOS GENÉTICOS Tema 14. Nuevas tecnologías para el estudio de enfermedades infecciosas: métodos genéticos Métodos genéticos
Cátedra de Biotecnología Molecular. Ingeniería Química, Bioquímica y Farmacia. Trabajo Práctico N 1
 Cátedra de Biotecnología Molecular Ingeniería Química, Bioquímica y Farmacia Trabajo Práctico N 1 Preparación de muestras, extracción y análisis de ácidos nucleicos Introducción La información genética
Cátedra de Biotecnología Molecular Ingeniería Química, Bioquímica y Farmacia Trabajo Práctico N 1 Preparación de muestras, extracción y análisis de ácidos nucleicos Introducción La información genética
Conceptos y técnicas en ecología fluvial
 Conceptos y técnicas en ecología fluvial Edición a cargo de: ARTURO ELOSEGI Profesor titular de Ecología en la Universidad del País Vasco SERGI SABATER Catedrático de Ecología en la Universidad de Girona
Conceptos y técnicas en ecología fluvial Edición a cargo de: ARTURO ELOSEGI Profesor titular de Ecología en la Universidad del País Vasco SERGI SABATER Catedrático de Ecología en la Universidad de Girona
TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR
 TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DOCENTES: Andrés Ciocchini, Gabriela Niemirowicz. DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR Purificación de ácido desoxiribonucleico (ADN) por partición diferencial
TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DOCENTES: Andrés Ciocchini, Gabriela Niemirowicz. DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR Purificación de ácido desoxiribonucleico (ADN) por partición diferencial
Preparación y Caracterización de Ácidos Nucleicos
 Práctico Nº 5. Ácidos Nucleicos I Preparación y Caracterización de Ácidos Nucleicos Facultad de Ciencias Bioquímica (Licenciatura en Ciencias Biológicas) Objetivos Laboratorio Ácidos Nucleicos I: Extracción
Práctico Nº 5. Ácidos Nucleicos I Preparación y Caracterización de Ácidos Nucleicos Facultad de Ciencias Bioquímica (Licenciatura en Ciencias Biológicas) Objetivos Laboratorio Ácidos Nucleicos I: Extracción
DANAGENE DNA/RNA PURIFICATION KIT
 DANAGENE DNA/RNA PURIFICATION KIT REF.0805 50 EXTRACCIONES 1.INTRODUCIÓN 1.1 Descripción del producto DANAGENE DNA/RNA PURIFICATION Kit provee un método rápido para la extracción y purificación simultánea
DANAGENE DNA/RNA PURIFICATION KIT REF.0805 50 EXTRACCIONES 1.INTRODUCIÓN 1.1 Descripción del producto DANAGENE DNA/RNA PURIFICATION Kit provee un método rápido para la extracción y purificación simultánea
REACCIÓN EN CADENA DE LA POLIMERASA (PCR)
 REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología General Microbiología M de los Alimentos Licenciatura en Bioquímica i Ingeniería en alimentos c Microbiología r 2015 Licenciatura en Biotecnología
REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología General Microbiología M de los Alimentos Licenciatura en Bioquímica i Ingeniería en alimentos c Microbiología r 2015 Licenciatura en Biotecnología
SOUTHERN BLOT. A Fragmentos estándar de ADN. E ADN padre 2 cortado con enzimas de restricción. C ADN Hijo cortado con enzimas de restricción
 SOUTHERN BLOT 5 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de esta práctica es introducir a los estudiantes en el conocimiento de una de las técnicas de hibridación utilizadas en laboratorio,
SOUTHERN BLOT 5 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de esta práctica es introducir a los estudiantes en el conocimiento de una de las técnicas de hibridación utilizadas en laboratorio,
ELECTROFORESIS AVANZADA
 Ref. ELECAVANZADA (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Ref. ELECAVANZADA (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Práctico: Genética bacteriana 2007.
 Práctico: Genética bacteriana 2007. Actividad integrada Departamento de Genética Departamento de Bacteriología y Virología. OBJETIVOS Objetivos generales El estudiante al terminar la actividad práctica
Práctico: Genética bacteriana 2007. Actividad integrada Departamento de Genética Departamento de Bacteriología y Virología. OBJETIVOS Objetivos generales El estudiante al terminar la actividad práctica
Universidad Nacional Autónoma de México
 Universidad Nacional Autónoma de México Facultad de Química Curso Genética y Biología Molecular (1630) Licenciatura Químico Farmacéutico Biológico Dra. Herminia Loza Tavera Profesora Titular de Carrera
Universidad Nacional Autónoma de México Facultad de Química Curso Genética y Biología Molecular (1630) Licenciatura Químico Farmacéutico Biológico Dra. Herminia Loza Tavera Profesora Titular de Carrera
RT- PCR diagnóstica del Cotton leafroll dwarf virus (CLRDV) en plantas de algodón
 RT- PCR diagnóstica del Cotton leafroll dwarf virus (CLRDV) en plantas de algodón La identificación rápida y precisa de los patógenos que afectan a los cultivos de interés agronómico es crítica para predecir
RT- PCR diagnóstica del Cotton leafroll dwarf virus (CLRDV) en plantas de algodón La identificación rápida y precisa de los patógenos que afectan a los cultivos de interés agronómico es crítica para predecir
Universidad Nacional Autónoma de México
 Universidad Nacional Autónoma de México Facultad de Química Curso Genética y Biología Molecular (1630) Licenciatura Químico Farmacéutico Biológico Dra. Herminia Loza Tavera Profesora Titular de Carrera
Universidad Nacional Autónoma de México Facultad de Química Curso Genética y Biología Molecular (1630) Licenciatura Químico Farmacéutico Biológico Dra. Herminia Loza Tavera Profesora Titular de Carrera
DANAGENE BLOOD DNA KIT
 Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
SECCIÓN I - INTRODUCCIÓN
 Facultad de Medicina Genética 1 er Curso SECCIÓN I - INTRODUCCIÓN Tema 1. TÉCNICAS BÁSICAS DE GENÉTICA MOLECULAR Facultad de Medicina Genética 1 er Curso TEMA 1 TÉCNICAS BÁSICAS DE GENÉTICA MOLECULAR 1.1
Facultad de Medicina Genética 1 er Curso SECCIÓN I - INTRODUCCIÓN Tema 1. TÉCNICAS BÁSICAS DE GENÉTICA MOLECULAR Facultad de Medicina Genética 1 er Curso TEMA 1 TÉCNICAS BÁSICAS DE GENÉTICA MOLECULAR 1.1
CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA. Grado en Medicina
 DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR III FACULTAD DE MEDICINA UNIVERSIDAD COMPLUTENSE DE MADRID CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA Grado en Medicina CURSO ACADÉMICO 2017/2018 INDICE
DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR III FACULTAD DE MEDICINA UNIVERSIDAD COMPLUTENSE DE MADRID CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA Grado en Medicina CURSO ACADÉMICO 2017/2018 INDICE
EXTRACCIÓN Y PURIFICACIÓN DE ÁCIDOS NUCLEICOS
 EXTRACCIÓN Y PURIFICACIÓN DE ÁCIDOS NUCLEICOS Consideraciones iniciales - Condiciones de limpieza y esterilidad - Peligrosidad de algunos reactivos usados en la purificación Fases - Rotura-homogeneización:
EXTRACCIÓN Y PURIFICACIÓN DE ÁCIDOS NUCLEICOS Consideraciones iniciales - Condiciones de limpieza y esterilidad - Peligrosidad de algunos reactivos usados en la purificación Fases - Rotura-homogeneización:
PROPIEDADES DE LOS ACIDOS NUCLEICOS Y TECNICAS DE DETECCION
 PROPIEDADES DE LOS ACIDOS NUCLEICOS Y TECNICAS DE DETECCION 1. RNA NORTHERN BLOT CONVENCIONAL NORTHERN BLOT REVERSO (MICROARRAY) HIBRIDACION IN SITU 2. DNA SOUTHERN BLOT ANALISIS DE GENOTECAS Estructura
PROPIEDADES DE LOS ACIDOS NUCLEICOS Y TECNICAS DE DETECCION 1. RNA NORTHERN BLOT CONVENCIONAL NORTHERN BLOT REVERSO (MICROARRAY) HIBRIDACION IN SITU 2. DNA SOUTHERN BLOT ANALISIS DE GENOTECAS Estructura
REGULACIÓN DE LA EXPRESIÓN GÉNICA EN PROCARIOTAS ANÁLISIS DE LA EXPRESIÓN DE LACZ
 REGULACIÓN DE LA EXPRESIÓN GÉNICA EN PROCARIOTAS ANÁLISIS DE LA EXPRESIÓN DE LACZ Para conocer la organización del ADN se desarrollaron métodos que permitieron conocer la secuencia exacta de nucleótidos,
REGULACIÓN DE LA EXPRESIÓN GÉNICA EN PROCARIOTAS ANÁLISIS DE LA EXPRESIÓN DE LACZ Para conocer la organización del ADN se desarrollaron métodos que permitieron conocer la secuencia exacta de nucleótidos,
DANAGENE microspin DNA KIT
 Ref. 0607.1 50 extracciones Ref. 0607.2 250 extracciones 1.INTRODUCCION DANAGENE microspin DNA KIT Este kit permite una eficiente extracción de ADN genómico y mitocondrial a partir de muestras de pequeño
Ref. 0607.1 50 extracciones Ref. 0607.2 250 extracciones 1.INTRODUCCION DANAGENE microspin DNA KIT Este kit permite una eficiente extracción de ADN genómico y mitocondrial a partir de muestras de pequeño
3. Materiales y Métodos
 3. Materiales y Métodos El análisis de haplotipos se realizó mediante la caracterización de variaciones alélicas reportadas con anterioridad. En total de analizaron cinco marcadores polimórficos: tres
3. Materiales y Métodos El análisis de haplotipos se realizó mediante la caracterización de variaciones alélicas reportadas con anterioridad. En total de analizaron cinco marcadores polimórficos: tres
HIBRIDACIÓN DE ÁCIDOS NUCLEICOS: SOUTHERN BLOT
 HIBRIDACIÓN DE ÁCIDOS NUCLEICOS: SOUTHERN BLOT HIBRIDACION DE ACIDOS NUCLEICOS APAREAMIENTO COMPLEMENTARIO DE BASES ENTRE DOS ACIDOS NUCLEICOS DE HEBRA SIMPLE PRODUCTO DE HEBRA DOBLE. DNA/DNA RNA/RNA DNA/RNA
HIBRIDACIÓN DE ÁCIDOS NUCLEICOS: SOUTHERN BLOT HIBRIDACION DE ACIDOS NUCLEICOS APAREAMIENTO COMPLEMENTARIO DE BASES ENTRE DOS ACIDOS NUCLEICOS DE HEBRA SIMPLE PRODUCTO DE HEBRA DOBLE. DNA/DNA RNA/RNA DNA/RNA
REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología de los Alimentos Ingeniería en alimentos
 REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología de los Alimentos Ingeniería en alimentos 2015 Desarrollada por Kary Mullis en 1986 Técnica in vitro que permite amplificar enzimáticamente una región
REACCIÓN EN CADENA DE LA POLIMERASA (PCR) Microbiología de los Alimentos Ingeniería en alimentos 2015 Desarrollada por Kary Mullis en 1986 Técnica in vitro que permite amplificar enzimáticamente una región
CURSO DE EXTENSIÓN TEÓRICO PRÁCTICO HERRAMIENTAS EFICIENTES PARA LA IDENTIFICACIÓN DE LEVADURAS DE INTERÉS AGROINDUSTRIAL
 LIBRO DE MEMORIAS 2 CURSO DE EXTENSIÓN TEÓRICO PRÁCTICO HERRAMIENTAS EFICIENTES PARA LA IDENTIFICACIÓN DE LEVADURAS DE INTERÉS AGROINDUSTRIAL Santiago de Cali, 23 al 28 de agosto de 2010 3 Libro de memorias
LIBRO DE MEMORIAS 2 CURSO DE EXTENSIÓN TEÓRICO PRÁCTICO HERRAMIENTAS EFICIENTES PARA LA IDENTIFICACIÓN DE LEVADURAS DE INTERÉS AGROINDUSTRIAL Santiago de Cali, 23 al 28 de agosto de 2010 3 Libro de memorias
TRABAJO PRÁCTICO No. 2 EXTRACION DE ACIDO NUCLEICO VIRAL
 Unidad Curricular: Virología y Micología Veterinaria TRABAJO PRÁCTICO No. 2 EXTRACION DE ACIDO NUCLEICO VIRAL Las pruebas para el diagnostico específico de una infección viral se clasifican en dos tipos:
Unidad Curricular: Virología y Micología Veterinaria TRABAJO PRÁCTICO No. 2 EXTRACION DE ACIDO NUCLEICO VIRAL Las pruebas para el diagnostico específico de una infección viral se clasifican en dos tipos:
PRÁCTICO Nº 6. ACIDOS NUCLEICOS II Espectrofotometría, Electroforesis, Mapas de Restricción
 PRÁCTICO Nº 6. ACIDOS NUCLEICOS II Espectrofotometría, Electroforesis, Mapas de Restricción Espectrofotometría de ácidos nucleicos Los dobles enlaces conjugados de las bases nitrogenadas hacen que los
PRÁCTICO Nº 6. ACIDOS NUCLEICOS II Espectrofotometría, Electroforesis, Mapas de Restricción Espectrofotometría de ácidos nucleicos Los dobles enlaces conjugados de las bases nitrogenadas hacen que los
Caracteristicas del ADN. Se rompen con las siguientes condiciones -Temperaturas >90 - ph >10.5
 PCR Caracteristicas del ADN Se rompen con las siguientes condiciones -Temperaturas >90 C - ph >10.5 Baja astringencia tiene uniones parciales o imperfectas. Renaturalización Dependiendo de: -Contenido
PCR Caracteristicas del ADN Se rompen con las siguientes condiciones -Temperaturas >90 C - ph >10.5 Baja astringencia tiene uniones parciales o imperfectas. Renaturalización Dependiendo de: -Contenido
DANAGENE SPIN BLOOD DNA KIT
 DANAGENE SPIN BLOOD DNA KIT Ref. 0606.1 50 extracciones Ref. 0606.2 250 extracciones 1. INTRODUCCION Este kit está designado para una rápida extracción y purificación de ADN genómico de alta calidad a
DANAGENE SPIN BLOOD DNA KIT Ref. 0606.1 50 extracciones Ref. 0606.2 250 extracciones 1. INTRODUCCION Este kit está designado para una rápida extracción y purificación de ADN genómico de alta calidad a
Instrucciones de uso. BAG Cycler Check. Kit de para la validación de la uniformidad de la temperatura en los termocicladores
 Instrucciones de uso BAG Cycler Check Kit de para la validación de la uniformidad de la temperatura en los termocicladores listo para usar, prealicuotado REF 7104 (10 tests) REF 71044 (4 tests) Contenidos
Instrucciones de uso BAG Cycler Check Kit de para la validación de la uniformidad de la temperatura en los termocicladores listo para usar, prealicuotado REF 7104 (10 tests) REF 71044 (4 tests) Contenidos
K ADN PuriPrep-P kit. Extracción y purificación rápida de ADN plasmídico (miniprep)
 K 1207 ADN PuriPrep-P kit Extracción y purificación rápida de ADN plasmídico (miniprep) Indice Presentación... 6 Importante... 6 Componentes del kit... 6 Condiciones de conservación... 7 Garantía... 7
K 1207 ADN PuriPrep-P kit Extracción y purificación rápida de ADN plasmídico (miniprep) Indice Presentación... 6 Importante... 6 Componentes del kit... 6 Condiciones de conservación... 7 Garantía... 7
PROTOCOLO DE UTILIZACIÓN Hibridación para cortes de tejidos preservados en parafina
 PROTOCOLO DE UTILIZACIÓN Hibridación para cortes de tejidos preservados en parafina Materiales Provistos: ADN marcado con moléculas fluorescentes (sonda). Buffer de Hibridación Reactivos para preparar
PROTOCOLO DE UTILIZACIÓN Hibridación para cortes de tejidos preservados en parafina Materiales Provistos: ADN marcado con moléculas fluorescentes (sonda). Buffer de Hibridación Reactivos para preparar
Reacción en cadena de la polymerasa (PCR)
 Reacción en cadena de la polymerasa (PCR) 1 PCR Que es? Es una técnica in vitro diseñada para amplificar una región específica de DNA. Es extremadamente sensible, con la capacidad de amplificar millones
Reacción en cadena de la polymerasa (PCR) 1 PCR Que es? Es una técnica in vitro diseñada para amplificar una región específica de DNA. Es extremadamente sensible, con la capacidad de amplificar millones
DETERMINACIÓN DEL MAPA DE UN PLÁSMIDO CON ENZIMAS DE RESTRICCIÓN
 DETERMINACIÓN DEL MAPA DE UN PLÁSMIDO CON ENZIMAS DE RESTRICCIÓN 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es desarrollar un conocimiento del mapaje de ADN determinando
DETERMINACIÓN DEL MAPA DE UN PLÁSMIDO CON ENZIMAS DE RESTRICCIÓN 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es desarrollar un conocimiento del mapaje de ADN determinando
ELECTROFORESIS. Agarosa. Poliacrilamida
 ELECTROFORESIS DE ADN ELECTROFORESIS Agarosa Poliacrilamida Finalidad de la electroforesis Separar Identificar Purificar 1 2 3 4 5 Tinción del ADN Bromuro de etidio Absorbancia a 302 y 366 y emisión a
ELECTROFORESIS DE ADN ELECTROFORESIS Agarosa Poliacrilamida Finalidad de la electroforesis Separar Identificar Purificar 1 2 3 4 5 Tinción del ADN Bromuro de etidio Absorbancia a 302 y 366 y emisión a
GENÉTICA MOLECULAR E INGENIERÍA GENÉTICA: Conceptos, Técnicas y Aplicaciones. Blga: Wendy Morales Oviedo 2017
 GENÉTICA MOLECULAR E INGENIERÍA GENÉTICA: Conceptos, Técnicas y Aplicaciones Blga: Wendy Morales Oviedo 2017 TEMA 1. ÁCIDOS NUCLEICOS: Preparación, Purificación y análisis de ácidos nucleicos 1.1. INTRODUCCIÓN
GENÉTICA MOLECULAR E INGENIERÍA GENÉTICA: Conceptos, Técnicas y Aplicaciones Blga: Wendy Morales Oviedo 2017 TEMA 1. ÁCIDOS NUCLEICOS: Preparación, Purificación y análisis de ácidos nucleicos 1.1. INTRODUCCIÓN
PRÁCTICAS DE GENÉTICA Y BIOTECNOLOGÍA AMBIENTAL
 PRÁCTICAS DE GENÉTICA Y BIOTECNOLOGÍA AMBIENTAL Cuaderno del alumno Universidad Rey Juan Carlos. Escuela Superior de Ciencias Experimentales y Tecnología. Prácticas de Genética y BTA Prácticas de Genética
PRÁCTICAS DE GENÉTICA Y BIOTECNOLOGÍA AMBIENTAL Cuaderno del alumno Universidad Rey Juan Carlos. Escuela Superior de Ciencias Experimentales y Tecnología. Prácticas de Genética y BTA Prácticas de Genética
3. COMPONENTES. Tampón de electroforesis concentrado 2 x 50 ml 10 X (2 envases 500ml)
 PCR SIMULADA Ref.PCR Simulada (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
PCR SIMULADA Ref.PCR Simulada (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
Proyecto de Fin de Cursos
 Universidad de la República Oriental del Uruguay Proyecto de Fin de Cursos ELECTROFORESIS EN GEL DE MOLÉCULAS DE ADN Noviembre de 2006 Carolina Etchart C.I. 3.757.708-8 Marcelo Lavagna C.I. 3.508.715-8
Universidad de la República Oriental del Uruguay Proyecto de Fin de Cursos ELECTROFORESIS EN GEL DE MOLÉCULAS DE ADN Noviembre de 2006 Carolina Etchart C.I. 3.757.708-8 Marcelo Lavagna C.I. 3.508.715-8
Relator: José Ramón Vidal Juviño 1
 Práctica 4. Amplificación de ADN por PCR y electroforesis P4A: Ampliación de ADN por Reacción en Cadena de la Polimerasa Estudio de polimorfismos humanos ALU por PCR (BioTed, cod. PCR3) P4B: Separación
Práctica 4. Amplificación de ADN por PCR y electroforesis P4A: Ampliación de ADN por Reacción en Cadena de la Polimerasa Estudio de polimorfismos humanos ALU por PCR (BioTed, cod. PCR3) P4B: Separación
Purificación de ADN plasmídico, utilizando soluciones homeopatizadas
 Purificación de ADN plasmídico, utilizando soluciones homeopatizadas Dra. Niurka Meneses Moreno Universidad de Berna, Suiza niurka.meneses@unibe.dcb.ch, niurkam@gmail.com En los laboratorios de investigación
Purificación de ADN plasmídico, utilizando soluciones homeopatizadas Dra. Niurka Meneses Moreno Universidad de Berna, Suiza niurka.meneses@unibe.dcb.ch, niurkam@gmail.com En los laboratorios de investigación
1 MATERIALES Y MÉTODOS
 1 MATERIALES Y MÉTODOS 1.1 CEPAS BACTERIANAS Las cepas empleadas se describen en la tabla 1, en general las cepas se cultivaron en medio LB (Luria Bertani) a 37 o C de 12 a 18 h, al menos que se indiquen
1 MATERIALES Y MÉTODOS 1.1 CEPAS BACTERIANAS Las cepas empleadas se describen en la tabla 1, en general las cepas se cultivaron en medio LB (Luria Bertani) a 37 o C de 12 a 18 h, al menos que se indiquen
Tema 11. Herramientas de la genética molecular
 Tema 11. Herramientas de la genética molecular Genética CC. Mar 2004-05 Objetivos Técnicas de clonación Construcción de genotecas e identificación de secuencias Mapas de restricción Amplificación (PCR)
Tema 11. Herramientas de la genética molecular Genética CC. Mar 2004-05 Objetivos Técnicas de clonación Construcción de genotecas e identificación de secuencias Mapas de restricción Amplificación (PCR)
Clonación molecular. Clonar significa hacer copias idénticas
 INGENIERÍA GENÉTICA Clonación molecular Clonar significa hacer copias idénticas Este término originalmente fue aplicado al procedimiento de aislar una célula y permitirle reproducirse creando una población
INGENIERÍA GENÉTICA Clonación molecular Clonar significa hacer copias idénticas Este término originalmente fue aplicado al procedimiento de aislar una célula y permitirle reproducirse creando una población
ACIDOS NUCLEICOS A PARTIR DE GELES DE AGAROSA
 /i AISLAMIENTO DE ACIDOS NUCLEICOS A PARTIR DE GELES DE AGAROSA '/ Guadalupe Yunuén M. C. Humberto Doctora Juliette Morlon-fitgot INSTITUTO DE INVESTIGAC;JONES, t BIOMEDICAS I U. N. A. M. 1992 d ;j 3 8
/i AISLAMIENTO DE ACIDOS NUCLEICOS A PARTIR DE GELES DE AGAROSA '/ Guadalupe Yunuén M. C. Humberto Doctora Juliette Morlon-fitgot INSTITUTO DE INVESTIGAC;JONES, t BIOMEDICAS I U. N. A. M. 1992 d ;j 3 8
APLICACIÓN DE LA PCR: DIAGNÓSTICO DE PARÁSITOS
 Prácticas docentes en la COD: 10-71 APLICACIÓN DE LA PCR: DIAGNÓSTICO DE PARÁSITOS FUNDAMENTO TEÓRICO La PCR es una técnica que permite llevar a cabo la síntesis in vitro de fragmentos de ADN. Está basada
Prácticas docentes en la COD: 10-71 APLICACIÓN DE LA PCR: DIAGNÓSTICO DE PARÁSITOS FUNDAMENTO TEÓRICO La PCR es una técnica que permite llevar a cabo la síntesis in vitro de fragmentos de ADN. Está basada
figura1 : esquema PCR introducción a la PCR termocicladoresnahita
 Gracias a sus altas prestaciones e increíble precio, los termocicladores Nahita son los equipos de elección de gran cantidad de laboratorios y centros de investigación para llevar a cabo la reacción en
Gracias a sus altas prestaciones e increíble precio, los termocicladores Nahita son los equipos de elección de gran cantidad de laboratorios y centros de investigación para llevar a cabo la reacción en
Ensayos southwestern y northwestern
 Búsqueda de proteínas que se unen a DNA (secuencia conocida, promotor) Ensayo southwestern encontrar proteínas ligantes de DNA que reconozcan en éste una determinada secuencia de nucleótidos Ensayo northwestern
Búsqueda de proteínas que se unen a DNA (secuencia conocida, promotor) Ensayo southwestern encontrar proteínas ligantes de DNA que reconozcan en éste una determinada secuencia de nucleótidos Ensayo northwestern
AMPLIFICACIÓN Y DETECCIÓN POR PCR DEL LOCUS HUMANO D1S80
 AMPLIFICACIÓN Y DETECCIÓN POR PCR DEL LOCUS HUMANO D1S80 Ref. PCR1 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción
AMPLIFICACIÓN Y DETECCIÓN POR PCR DEL LOCUS HUMANO D1S80 Ref. PCR1 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción
Investigando los genes FRAUDE CANINO
 FRAUDE CANINO Ahora vamos a actuar como policías científicos. No se trata de un caso humano, sino de perros. El protocolo seguido es similar al de la Huella Genética o Huella de ADN, es decir, vamos a
FRAUDE CANINO Ahora vamos a actuar como policías científicos. No se trata de un caso humano, sino de perros. El protocolo seguido es similar al de la Huella Genética o Huella de ADN, es decir, vamos a
17.- Electroforesis de ácidos nucleicos en geles de agarosa. Aislamiento y caracterización electroforética de DNA plasmídico
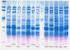 17.- Electroforesis de ácidos nucleicos en geles de agarosa. Aislamiento y caracterización electroforética de DNA plasmídico Carmen Alicia Padilla Peña, Jesús Diez Dapena, Emilia Martínez Galisteo, José
17.- Electroforesis de ácidos nucleicos en geles de agarosa. Aislamiento y caracterización electroforética de DNA plasmídico Carmen Alicia Padilla Peña, Jesús Diez Dapena, Emilia Martínez Galisteo, José
ESTUDIO DE POLIMORFISMOS ALU HUMANOS POR PCR
 ESTUDIO DE POLIMORFISMOS ALU HUMANOS POR PCR Ref. PCRALU 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena
ESTUDIO DE POLIMORFISMOS ALU HUMANOS POR PCR Ref. PCRALU 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena
PCR gen 16S ARNr bacteriano
 PCR gen 16S ARNr bacteriano Ref. PCR16S 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y la práctica de la Reacción en Cadena de la Polimerasa
PCR gen 16S ARNr bacteriano Ref. PCR16S 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y la práctica de la Reacción en Cadena de la Polimerasa
5. MATERIALES Y MÉTODOS
 5. MATERIALES Y MÉTODOS 5.1 Equipos Los siguientes termocicladores se emplearon para la amplificación por PCR: - Perkin Elmer, GeneAmp PCR System 2400. - Perkin Elmer, GeneAmp PCR System 9600. - Applied
5. MATERIALES Y MÉTODOS 5.1 Equipos Los siguientes termocicladores se emplearon para la amplificación por PCR: - Perkin Elmer, GeneAmp PCR System 2400. - Perkin Elmer, GeneAmp PCR System 9600. - Applied
- Las mezclas de amplificación se presentan en formato monotest en tubos de PCR de 0.2 ó 0.5 ml, identificadas con diferentes colores.
 ! El diagnóstico de los linfomas malignos es una de las áreas que más dificultad reviste dentro de la histopatología. Si bien muchos casos se diagnostican a través de los datos histomorfológicos e inmunohistoquímicos,
! El diagnóstico de los linfomas malignos es una de las áreas que más dificultad reviste dentro de la histopatología. Si bien muchos casos se diagnostican a través de los datos histomorfológicos e inmunohistoquímicos,
DANAGENE microrna KIT
 DANAGENE microrna KIT Ref.0804 1.INTRODUCCION Este kit provee un método rápido y eficiente para la extracción y purificación de moléculas pequeñas de ARN (
DANAGENE microrna KIT Ref.0804 1.INTRODUCCION Este kit provee un método rápido y eficiente para la extracción y purificación de moléculas pequeñas de ARN (
TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS. DOCENTES: Dr. Andrés Ciochinni, Dra. Gabriela Niemirowicz. DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR
 TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DOCENTES: Dr. Andrés Ciochinni, Dra. Gabriela Niemirowicz. DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR Purificación de ácido desoxiribonucleico (ADN). El ADN es un polímero
TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DOCENTES: Dr. Andrés Ciochinni, Dra. Gabriela Niemirowicz. DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR Purificación de ácido desoxiribonucleico (ADN). El ADN es un polímero
Técnicas de Biología Molecular. Dr. Luis Salazar N Depto. de Ciencias Básicas / UFRO
 Técnicas de Biología Molecular Dr. Luis Salazar N Depto. de Ciencias Básicas / UFRO 2004 Extracción de ácidos nucleicos o o DNA RNA Tipos de Muestras Sangre total (EDTA) Saliva Líquido Amniótico Bulbo
Técnicas de Biología Molecular Dr. Luis Salazar N Depto. de Ciencias Básicas / UFRO 2004 Extracción de ácidos nucleicos o o DNA RNA Tipos de Muestras Sangre total (EDTA) Saliva Líquido Amniótico Bulbo
GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES. Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé
 GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé Esquema de investigación en pruebas fallidas Revisar el procedimiento y determinar
GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé Esquema de investigación en pruebas fallidas Revisar el procedimiento y determinar
39. Aislamiento y purificación del DNA de un plásmido recombinante
 39. Aislamiento y purificación del DNA de un plásmido recombinante Aurora Galván Cejudo, Manuel Tejada, Antonio Camargo, José Javier Higuera, Vicente Mariscal, Emilio Fernández Reyes Departamento de Bioquímica
39. Aislamiento y purificación del DNA de un plásmido recombinante Aurora Galván Cejudo, Manuel Tejada, Antonio Camargo, José Javier Higuera, Vicente Mariscal, Emilio Fernández Reyes Departamento de Bioquímica
DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR GRADO EN QUÍMICA PRÁCTICAS DE BIOQUÍMICA. Curso... /... NOMBRE Y APELLIDOS: CURSO Y GRUPO:
 DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR GRADO EN QUÍMICA PRÁCTICAS DE BIOQUÍMICA Curso... /... NOMBRE Y APELLIDOS: CURSO Y GRUPO: Taquilla nº: . 19 de febrero de 2015 Qui-Bioq-jmpf Laboratorio
DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR GRADO EN QUÍMICA PRÁCTICAS DE BIOQUÍMICA Curso... /... NOMBRE Y APELLIDOS: CURSO Y GRUPO: Taquilla nº: . 19 de febrero de 2015 Qui-Bioq-jmpf Laboratorio
ANEXOS A: Procedimientos experimentales
 ANEXOS 1 ANEXOS A: Procedimientos experimentales SDS-TRIS-GLICINA-PAGE Procedimiento A.1. Descripción del método de preparación de geles de poliacrilamida. Se trata de un sistema vertical de electroforesis,
ANEXOS 1 ANEXOS A: Procedimientos experimentales SDS-TRIS-GLICINA-PAGE Procedimiento A.1. Descripción del método de preparación de geles de poliacrilamida. Se trata de un sistema vertical de electroforesis,
