Método para la determinación de Vibrio cholerae en alimentos, hielo y agua.
|
|
|
- Jorge Santos Rico
- hace 6 años
- Vistas:
Transcripción
1 Método para la determinación de Vibrio cholerae en alimentos, hielo y agua. OBJETIVO Realizar el análisis microbiológico para detectar Vibrio cholerae en alimentos, agua y/o hielo. Explicar el fundamento de cada etapa del análisis. GENERALIDADES Las enfermedades transmitidas por alimentos (ETA s), pueden ser de tipo infeccioso y de origen químico, como las intoxicaciones. La incidencia de estas enfermedades constituye uno de los problemas de salud pública más extendidos en el mundo contempóraneo y permanecen como una de las causas principales de morbilidad, ocupando el segundo lugar entre las enfermedades transmisibles de notificación obligatoria. Entre los alimentos involucrados en ETA s que están contaminados por V. cholerae resaltan los moluscos bivalvos, los crustáceos y los pescados frescosrefrigerados y congelados. Estos productos pueden generar enfermedades a los consumidores debido a que desde su origen están sometidos a contaminación microbiológica y química entre otras, aunado a la forma de consumo que en muchos casos es cruda. El fin principal de la Norma Oficial Mexicana que regula estos productos desde el punto de vista sanitario es el de proteger la salud del consumidor. El cólera es una enfermedad relacionada con el abastecimiento de aguas con poca higiene, o bien de los alimentos provenientes de aguas contaminadas con materia fecal y que se consumen crudos. También puede aparecer V. cholerae O1 en moluscos bivalvos, crustáceos o pescados que se obtienen de aguas no contaminadas en donde el microorganismo forma parte de la microbiota autóctona. La enfermedad del cólera fue descrita por primera ocasión por Pacini en Ésta se presenta por la ingesta de la bacteria viable, la cual se establece en el intestino delgado y libera una toxina termolábil. La producción de esta toxina provoca diarrea acuosa causando los síntomas característicos del cólera. Los síntomas del cólera asiático pueden ir desde una diarrea acuosa ligera, hasta una diarrea severa con aspecto de agua de arroz. El establecimiento de la enfermedad por lo general es repentino, con periodos de incubación que varían entre las 6 h. y los 5 días. Esta enfermedad generalmente es autolimitante. Las personas con cólera requieren de hidratación intravenosa u oral con soluciones que contengan cloruro de sodio, bicarbonato de sodio, cloruro de potasio y glucosa, ya que la muerte sobreviene debido a la deshidratación y pérdida de electrolitos esenciales.
2 Mediante estudios en personas voluntarias saludables, se ha demostrado que la dosis infectiva necesaria para provocar la enfermedad es aproximadamente de un millón de c{elulas, y se ha concluido que una vez adquirido el cólera, la administración de tetraciclina así como de antiácidos, mejora rápidamente el curso de la enfermedad. El género Vibrio incluye a los bacilos rectos o curvos Gramnegativos, oxidasa positivos (excepto la especie metschnikovii), anaerobios facultativos. Muchas especies de Vibrio spp. son patógenas para humanos y están implicadas en toxiinfecciones transmitidas por alimentos. La mayoría de los microorganismos que pertenecen a este género no crecen en medios sin cloruro de sodio a excepción de V. cholerae y V. mimicus, por lo tanto, debido a esta característica no es considerado un vibrio halofílico, aunque requieran trazas del ión sodio para su crecimiento. Las especies cholerae comprenden varios grupos antigénicos somáticos incluyendo el grupo O1, el cual se asocia con los biotipos clásico y El Tor. A su vez, este grupo O1 puede tener varios serotipos incluyendo Inaba, Ogawa e Hikojima. Las especies de V. cholerae noo1 (referidos en la literatura como vibrios no aglutinables o NAG), se encuentran en aguas estuarinas y pueden causar enfermedad gastrointestinal, aunque típicamente es menos severa que la causada por el V. cholerae O1. El serotipo O139 identificado por primera vez en 1992 como el causante de una nueva epidemia de cólera en la India y Bangladesh y el cual no se ha podido encontrar en aguas estuarinas, es una excepción de los vibrios NAG que si produce los síntomas clásicos del cólera. Otros microorganismos pertenecientes al género Vibrio que son causantes de enfermedades gastrointestinales transmitidas por alimentos son V. parahaemolyticus y V. vulnificus. V. parahaemolyticus es una bacteria halofílica encontradas normalmente con microbiota normal de aguas y animales estuarios. El microorganismo tiene una distribución mundial en ambientes estuarios y costeros, y se ha aislado de muchas especies de pescados, mariscos y crustáceos. V. vulnificus es una bacteria halofílica encontrada en ambientes estuarios y es fenotípicamente similar a V. parahaemolyticus. Esta bacteria causa enfermedades transmitidas por alimentos y en heridas, cualquiera de éstas puede progresar rápidamente hasta una septicemia mortal. Los moluscos bivalvos crudos son la principal fuente de transmisión alimentaria del V. vulnificus. Otros Vibrio spp. halofílicos, V. fluvialis, V. hollisae, V. alginolyticus, V. furnissii y V. metschnikovii, se han asociado con gastroenteritis y están presentes en ambientes estuarios junto con otras especies patógenas y no patógenas de Vibrio. FUNDAMENTO El método de detección estándar para la recuperación y la detección de Vibrio cholerae es cualitativo. Sin embargo se recomienda para las especies aisladas de V. cholerae de
3 los serotipos O1 y noo1 demostrar la producción de la toxina del cólera. Este método describe un esquema general que consiste en: Enriquecimiento a diferentes temperaturas, dependiendo del tipo de alimento que se desee analizar, donde se pretende incrementar las poblaciones de Vibrio e inhibir otros microorganismos presentes en la muestra. Aislamiento diferencial en medio sólido selectivo, el cual restringe el crecimiento de otros géneros diferentes a Vibrio, permitiendo el reconocimiento de colonias sospechosas de la especie Vibrio cholerae. Purificación: Las colonias características sospechosas de pertenecer a la especie cholerae, se purifican en medios no selectivos. Identificación bioquímica, que permite la identificación de los cultivos de V. cholerae. Pruebas serológicas, que permitan la identificación de los cultivos de V. cholerae. MEDIOS DE CULTIVO Y DILUYENTES Material necesario para preenriquecimiento de V. cholerae en agua y hielo: 1 tubo de ensayo de 22 x 175 mm con 10,0 ml de agua peptonada alcalina (1,0% P/V) (ph= ) (APA) a. Material necesario para preenriquecimiento de V. cholerae en pescados ahumados: 1 matraz Erlenmeyer de 500,0 ml con 225,0 ml de agua peptonada alcalina (1,0% P/V) alcalina (ph= ) (APA) a. 2 tubos de 16 x 150 con 9,0 ml de agua peptonada alcalina (1,0% P/V) alcalina (ph= ) (APA) a. Material necesario para preenriquecimiento de V. cholerae en moluscos bivalvos en concha o desconchados, frescos, refrigerados o congelados: 1 matraz Erlenmeyer de 1000,0 ml con 450,0 ml de agua peptonada alcalina (1,0% P/V) alcalina (ph= ) (APA) a. 1 matraz Erlenmeyer de 500,0 ml vacío y estéril a. 4 tubos de 16 x 150 con 9,0 ml de agua peptonada alcalina (1,0% P/V) (ph= ) (APA) a. Material necesario para preenriquecimiento de V. cholerae para demás productos de la pesca refrigerados o congelados (parte comestible), pasteurizados, ahumados, semipreparados (crudos o precocidos, empanizados rebozados o capeados, empanizados y congelados). 2 matraces Erlenmeyer de 500,0 ml con 225,0 ml de agua peptonada alcalina (1,0% P/V) alcalina (ph= ) (APA) a. 4 tubos de 16 x 150 con 9,0 ml de agua peptonada alcalina (1,0% P/V) alcalina (ph= ) (APA) a. Material necesario para preenriquecimiento de V. cholerae en quesos:
4 1 matraz Erlenmeyer de 500,0 ml con 250,0 ml de agua peptonada alcalina (1,0% P/V) alcalina (ph= ) (APA) a. 5 tubos de 16 x 150 con 9,0 ml de agua peptonada alcalina (1,0% P/V) alcalina (ph= ) (APA) a. Material necesario para preenriquecimiento de V. cholerae en helados y bases o mezclas para helados: 1 matraz Erlenmeyer de 500,0 ml con 225,0 ml de agua peptonada alcalina (1,0% P/V) alcalina (ph= ) (APA) a. 5 tubos de 16 x 150 con 9,0 ml de agua peptonada alcalina (1,0% P/V) alcalina (ph= ) (APA) a. NOTA El siguiente material será el mismo para el análisis de cualquier tipo de muestra: 3 cajas de Petri con 20,0 ml de agar tiosulfatocitratobilissacarosa (TCBS) b. 3 cajas de Petri con 20,0 ml de agar T1N1 (Agar triptona con 1% NaCl) y/o 3 cajas de Petri con 20,0 ml de agar soya tripticaseína con 2,0% de NaCl (P/V) c. 3 tubos de 13 x 100 con 3,0 ml de agar tripleazúcarhierro (TSI) más 2% NaCl y/o agar de hierro Kligler más 2% NaCl inclinados (KIA) d. 3 tubos de 13 x 100 con 3,0 ml de agar de hierro Kligler más 2% NaCl inclinados (KIA) d. 3 tubos de 13 x 100 con 3,0 ml de agar arginina glucosa más 2% NaCl inclinados (AAG) d. 1 caja (dividir en 3 segmentos) o 3 tubos de 13 x 100 con 3,5 ml de agar o caldo triptona sin NaCl (T1N0) d. 1 caja (dividir en 3 segmentos) o 3 tubos de 13 x 100 con 3,5 ml de agar o caldo triptona más 3,0% de NaCl (T1N3) d. 1 caja (dividir en 3 segmentos) o 3 tubos de 13 x 100 con 3,5 ml de caldo o agar triptona más 6,0% de NaCl (T1N6) d. 6 tubos de 13 x 100 con 5,0 ml de medio Hugh y Leifson más 2% NaCl más 1,0% de glucosa (P/V) d. 3 discos para prueba de oxidasa d. 3 discos para prueba de ONPG d. 3 tubos de 13 x 100 con 3,5 ml de agar hierro lisina (LIA) más 2% NaCl inclinados d. 3 tubos de 13 x 100 con 3,5 ml de caldo RM/VP más 2% NaCl d. 3 tubos de 13 x 100 con 3,5 ml de caldo rojo de fenol más 2% NaCl más 1,0% de arabinosa (P/V) d. Opcional: además del TCBS, 3 cajas de Petri con 20,0 ml de agar modificado con celobiosa, polimixina B y colistina (mcpc) b. SOLUCIONES, REACTIVOS E INDICADORES
5 1 frasco gotero con reactivo de Kovac s d. 1 frasco gotero con reactivo o discos para la prueba de la oxidasa (tetrametilpfenilendiamina; TMPD) d. Colorantes necesarios para la tinción de Gram c, d. Aceite mineral ó vaspar c. Aceite de inmersión c,d,e. Solución de desoxicolato de sodio al 0,5% en agua destilada estéril para la prueba del hilo mucoide d. MATERIAL Y EQUIPO 1 bolsa para Stomacher o vaso de licuadora estéril a. Stomacher o motor para licuadora a. Mechero Bunsen a. 1 pipeta estéril con algodón de 1,0, 5,0 y 10,0 ml a. Pipetas Pasteur estériles a,,b,c, d, e Propipeta a,b,c,d,e. 1 caja de Petri estéril a. Baño de agua a 35 ± 2 y 42 ± 1ºC a,b,c,d. Incubadora a 35 ± 2ºC a,b,c,d. Incubadora a 42 ± 2ºC a,b,c,d. Balanza granataria a. Cucharas estériles u otros instrumentos apropiados para transferir muestras de alimentos a. Asas bacteriológicas de 3 mm de diámetro b,c,d. Asa bacteriológica de platino para efectuar la prueba de oxidasa d. Tijeras y pinzas estériles a. Cubreobjetos y portaobjetos c,d,e. Microscopio c,d,e. Equipo de filtración por membrana a. (solo para análisis de agua o hielo). Filtros de membrana de 0.45 µm de poro y 47 mm de diámetro Pinzas para membranas NOTAS a b c d e Material necesario al inicio de la práctica. Material necesario a las 24 h. de iniciada la práctica. Material necesario a las 48 h. de iniciada la práctica. Material necesario a las 72 h. de iniciada la práctica. Material necesario a las 96 h. de iniciada la práctica.
6 DETERMINACIÓN DE V. CHOLERAE EN AGUA Y HIELO Filtrar 3 litros de agua o hielo fundido a través de un filtro de membrana Aislamiento de 0.45 µm. en Colocar medios la de membrana cultivo selectivos en y diferenciales un tubo con 10 ml de APA Incubar a 35 ± 2ºC/1824 h Después de la incubación y sin agitar la película, de cada matraz efectuar aislamiento en uno de los sigs. Medios de cultivo: TCBS (mcpc opcional además del TCBS). Seleccionar al menos 3 col sospechosas de cada placa. Realizar Gram, y como filtro prueba de oxidasa y si es () pbas bioq presuntiv. [Si se cuenta con tiempo, realizar aislamiento previo a las bioq para garantizar pureza de las col]. Incubar, TCBS h. a 35±2C. sacarosa () = amarillo mcpc 1824 h a 39 40ºC. celobiosa ( ) = púrpura Alternativa para purificar: Agar T 1N 1 o agar soya tripticasa 2,0% NaCl. Inc. 3537ºC/1218 h. Tinción de Gram, pba ox () y Bioquímicas presuntivas KIA, TSI y AAG Inc ºC/1824 h. Resultados característicos Confirmación serológica Resultados positivos para Vibrio cholerae Siembra de bioquímicas complementarias: pruebas de halofilia en T 1N 0, T 1N 3, T 1N 6 y O/F, ONPG, RMVP, prueba de la cadena y fermentación de sacarosa y arabinosa.
7 DETERMINACIÓN DE V. CHOLERAE EN DEMAS PRODUCTOS DE PESCA QUE NO SEAN PESCADOS AHUMADOS NI MOLUSCOS BIVALVOS Realizar 2 mezclas con aprox. 250,0 g c/u. De cada mezcla tomar 25,0 g y colocar en 225,0 ml de APA. Homogeneizar 2 min. Para cada matraz realizar 2 dil. seriadas en 9,0 ml APA Incubar una serie a 35 ±2 C y otra a 42 ±0,2 C / h. Después de la incubación y sin agitar la película, efectuar aislamiento en uno de los sigs. medios de cultivo: TCBS (mcpc opcional además del TCBS). Seleccionar al menos 3 col sospechosas de cada placa. Realizar Gram, y como filtro prueba de oxidasa y si es () pbas bioq presuntiv. [Si se cuenta con tiempo, realizar aislamiento previo a las bioq para garantizar pureza de las col]. Incubar, TCBS 18 Aislamiento en medios 24 de h. cultivo a 3537 C. selectivos y diferenciales sacarosa () = amarillo mcpc 1824 h a 39 40ºC. celobiosa ( ) = púrpura Alternativa para purificar: Agar T 1N 1 o agar soya tripticasa 2,0% NaCl. Inc. 3537ºC/1218 h. Tinción de Gram, pba ox () y Bioquímicas presuntivas KIA, TSI y AAG Inc ºC/1824 h. Resultados característicos
8 Confirmación serológica Resultados positivos para Vibrio cholerae Siembra de bioquímicas complementarias: pruebas de halofilia en T 1N 0, T 1N 3, T 1N 6, y O/F, ONPG, RM VP, prueba de la cadena y fermentación de sacarosa y arabinosa.
9 DETERMINACIÓN DE V. CHOLERAE EN QUESOS Y HELADOS Pesar 25,0 g de pescado incluyendo vísceras, queso ó helado Aislamiento en medios de cultivo selectivos y diferenciales 225,0 ml de APA y realizar 2 dil. seriadas (5 dil. para queso ó helado) en 9,0 ml APA Incubar a 35±2 C / 1824 h. Después de la incubación y sin agitar la película, efectuar aislamiento en uno de los sigs. medios de cultivo: TCBS (mcpc opcional además del TCBS). Seleccionar al menos 3 col sospechosas de cada placa. Realizar Gram, y como filtro prueba de oxidasa y si es () pbas bioq presuntiv. [Si se cuenta con tiempo, realizar aislamiento previo a las bioq para garantizar pureza de las col]. Incubar, TCBS h. a 3537 C. sacarosa () = amarillo mcpc 1824 h a 39 40ºC. celobiosa ( ) = púrpura Alternativa para purificar: Agar T 1N 1 o agar soya tripticasa 2,0% NaCl. Inc. 3537ºC/1218 h. Tinción de Gram, pba ox () y Bioquímicas presuntivas KIA, TSI y AAG Inc ºC/1824 h. Inc ºC/1824 h. Resultados característicos
10 Confirmación serológica Resultados positivos para Vibrio cholerae Siembra de bioquímicas complementarias: pruebas de halofilia en T 1N 0, T 1N 3, T 1N 6 y O/F, ONPG, RMVP, prueba de la cadena y fermentación de sacarosa y arabinosa.
11 DETERMINACIÓN DE V. CHOLERAE EN MOLUSCOS BIVALVOS EN CONCHA O DESCONCHADOS, FRESCOS, REFRIGERADOS O CONGELADOS Desconchar 1012 moluscos (aprox. 50,0 g) y colocar en 450,0 ml de APA. Homogeneizar 2 min. Dividir en 2 matraces estériles. Para cada matraz realizar 2 dil. seriadas en 9,0 ml APA Incubar una serie a 35±2 C y otra a 42±0,2 C / 1824 h. Después de la incubación y sin agitar la película, efectuar aislamiento en uno de los sigs. medios de cultivo: TCBS (mcpc opcional además del TCBS). Seleccionar al menos 3 col sospechosas de cada placa. Realizar Gram, y como filtro prueba de oxidasa y si es () pbas bioq presuntiv. [Si se cuenta con tiempo, realizar aislamiento previo a las bioq para garantizar pureza de las col]. Incubar, TCBS 18 Aislamiento 24 h. en medios a 3537 C. selectivos y diferenciales sacarosa () = amarillo mcpc 1824 h a 39 40ºC. celobiosa ( ) = púrpura Alternativa para purificar: Agar T 1N 1 o agar soya tripticasa 2,0% NaCl. Inc. 3537ºC/1218 h. Tinción de Gram, pba ox () y Bioquímicas presuntivas KIA, TSI y AAG Inc ºC/1824 h. Resultados característicos
12 Confirmación serológica Resultados positivos para V. cholerae Siembra de bioquímicas complementarias: pruebas de halofilia en T 1N 0, T 1N 3, T 1N 6 y O/F, ONPG, RMVP, prueba de la cadena y fermentación de sacarosa y arabinosa.
13 PROCEDIMIENTO 1. Enriquecimiento. TIPO DE MUESTRA Agua y Hielo Pescados ahumados Moluscos bivalvos, en concha, desconchados, frescos, refrigerados o congelados Demás productos de la pesca Quesos de suero PREPARACIÓN DE LA MUESTRA Filtrar 3 litros de agua o hielo fundido a través de un filtro de membrana de 0.45 µm. Colocar la membrana en un tubo con 10 ml de APA Tomar carne del área de las vísceras, incluyendo éstas. 25,0 g de la muestra en 225,0 ml de APA. Homogeneizar 2 min. Realizar 2 diluciones más en 9,0 ml de APA. Desconchar 1012 moluscos (carne y líquido). 50,0 g de la muestra en 450,0 ml APA. Homogeneizar 2 min. Dividir en 2 matraces estériles. Realizar 2 diluciones más en 9,0 ml de APA. Tomar carne del área de las vísceras, incluyendo éstas. 25,0 g de la muestra en 225,0 ml de APA por duplicado. Homogeneizar 2 min. Realizar 2 diluciones más en 9,0 ml de APA. Pesar 25,0 g de la muestra en 225,0 ml de APA por duplicado. Homogeneizar 2 min. Realizar 2 diluciones más en 9,0 de APA. TEMPERATURA DE INCUBACIÓN DEL PREENRIQUECIMIENTO 35±2ºC/1824 h 42±0,2 ºC ºC/1824 h X X (3 diluciones) X (3 diluciones) X (3 diluciones) X (3 diluciones) X (3 diluciones) X (3 diluciones) X (3 diluciones) Quesos frescos Helados, sorbetes y bases para helados Pesar 25,0 g de la muestra en 225,0 ml de APA. Homogeneizar 2 min. Realizar 5 diluciones más en 9,0 de APA. X (3 diluciones) Para todos los casos proseguir con el inciso Resiembra
14 Después de la incubación, y sin agitar la película transferir el inóculo a una placa de agar TCBS y optativo mcpc además del TCBS: 1. Agar con tiosulfatocitratosales biliaressacarosa (TCBS). Incubar durante a 35±2ºC durante 18 a 24 h.. 2. Agar modificado con celobiosa, polimixina B y colistina (mcpc). La polimixina inhibe al biotipo Clásico de V. cholerae. Incubar durante 18 a 24 h. de 3940ºC. 3. Morfología colonial. Examinar las placas a fin de determinar si se presentan las características coloniales que a continuación se describen: Agar TCBS. Las colonias de V. cholerae (El Tor y Clásico) son grandes, lisas, amarillas (positivas para la fermentación de la sacarosa) y ligeramente achatadas, con el centro opaco y los bordes translúcidos. NOTA Las especies de Vibrio no producen colonias pequeñas de color crema en agar TCBS, en cambio las colonias de V. mimicus, que están estrechamente relacionadas con V. cholerae, son verdes (sacarosa negativas). La mayoría de las demás especies de Vibrio crecen en agar TCBS y producen colonias amarillas y verdes. Agar mcpc. Las colonias de V. cholerae El Tor son púrpuras (negativas para la fermentación de la celobiosa). El V. vulnificus produce colonias amarillas achatadas, con el centro opaco y los bordes translúcidos. La mayoría de las demás especies de Vibrio no crecen fácilmente en agar mcpc. 4. Selección y Aislamiento Seleccionar por lo menos 3 colonias sospechosas de cada placa y realizar a cada una: tinción de Gram y prueba de oxidasa. Si se observa un cultivo puro de bacilos Gram negativo, que pueden o no ser curvos y oxidasa (), realizar las pruebas bioquimicas presuntivas de diferenciación inoculando cada colonia sospechosa, a la que previamente se le realizó tinción de Gram y oxidasa, en KIA, TSI y AAG. Como alternativa, y sólo si se cuenta con suficiente tiempo, previo a las pruebas bioquímicas presuntiva, aislarlas en: 1. Paso alternativo para purificación de colonias sospechosas a partir de TCBS y/o mcpc. Agar T1N1 o agar soya tripticasa con 2,0% de NaCl e incubar a 3537 C durante 1218 h. Es necesario hacer un cultivo en un medio no
15 selectivo a fin de garantizar la pureza de las colonias antes de las pruebas bioquímicas. 2. Otro segundo paso alternativo para purificación que se realiza posterior al paso descrito en el punto anterior no. 1, consiste en usar agar gelatina (GA) y agar gelatina con 3% de NaCl (GS) para determinar la tolerancia de los cultivos puros a la sal. Dividir las placas en tantos sectores como colonias sospechosas se desee identificar, inocular una línea recta en el centro de un sector de las placas, tanto de GA como de GS con cada cultivo puro. Incubar durante 18 a 24 horas de 3537ºC. El V. cholerae y el V. mimicus crecerán. El vibrio spp halofílico crecerá en ambas placas, porque ellos no requieren de sal. Sólo en la placa con GS. Para leer la reacción de la gelatinasa sostener la placa sobre una superficie negra, observará un halo opaco alrededor de la colonia de los microorganismos gelatinasa positivos. 3. Ya sea que se haya podido realizar por lo menos uno de los pasos de purificación o bien si se optó por tomar colonias aisladas y sospechosas directamente a partir de las placas con TCBS y/o mcpc y una vez comprobada pureza con tinción de Gram, se sugiere como filtro, realizar prueba de oxidasa y prueba del hilo mucoide. Si el cultivo puro resulta ser oxidasa positiva (presencia del citocromo oxidasa) y positivo en la prueba del hilo mucoide (todas las cepas de V. cholerae son positivas), realizar las pruebas bioquímicas presuntivas y complementarias descritas a continuación Prueba de oxidasa. 1. Colocar un círculo de papel filtro en una caja de Petri y humedecerlo con algunas gotas de reactivo de oxidasa. Alternativamente se puede utilizar un disco reactivo comercial. 2. Tomar suavemente una porción del cultivo desarrollado en agar soya tripticasa con NaCl al 2,0% o agar T1N1 y depositarlo en el papel filtro anterior. NOTA Para los microorganismos oxidasa positivos, el papel se tornará púrpura oscuro o azul en pocos segundos. Las especies patógenas de Vibrio son oxidasa positivas (excepto el V. metschnnikovii) Prueba de la cadena o cuerda. La prueba de la cadena es muy útil como prueba presuntiva para sospechar de V. cholerae, debido a que todos los biotipos dan la prueba positiva y por añadidura, para excluir las especies que no son Vibrio, particularmente las cepas de Aeromonas. que por lo general son negativas. Otras especies de Vibrio pueden dar una reacción positiva o débil a la prueba de la cuerda.
16 1. A partir de un cultivo fresco proveniente de un agar no selectivo como lo es el agar T1N1, sobre un portaobjetos emulsionar una porción del cultivo en una pequeña gota de desoxicolato de sodio al 0,5% en agua destilada estéril. Al cabo de 60 segundos las células se lisan (pérdida de la turbidez) y el DNA forma una especie de rosario cuando se levanta con un asa, preferiblemente de material plástico, ( hasta 2 o 3 cm) del portaobjetos. 5. Diferenciación. Pruebas bioquímicas presuntivas y complementarias. La fórmula para todos los medios de pruebas bioquímicas deberán contener por lo menos un 2,0% de NaCl. Se recomiendan los siguientes medios porque las reacciones permiten efectuar una diferenciación presuntiva entre la mayoría de las especies de Vibrio, Aeromonas, Plesiomonas y otras bacterias. La diferenciación de las colonias sospechosas se realiza por duplicado en: 5.1. Agar triple azúcar hierro (TSI) y Agar Kligler hierro (KIA) 1. Registrar las características del medio TSI y KIA antes de la inoculación (color del medio). 2. Tomar suavemente una porción del centro de la colonia con asa bacteriológica recta y estéril e inocular por picadura y estría en un tubo con agar triple azúcar hierro (TSI) y en agar de Kligler (KIA) inclinado. 3. Incubar el medio TSI y KIA a 35 2 C durante 18 a 24 h. 4. Las reacciones de V. cholerae en KIA que contenga glucosa y lactosa son similares a aquellas de las Enterobacteriaceae no fermentadoras de la lactosa (pico de flauta alcalina [roja], fondo ácido [amarillo], no produce gas, ni H2S). Sin embargo, en TSI las cepas de V. cholerae producen un pico de flauta ácido (amarillo), un fondo ácido (amarillo) y no producen gas, ni H2S Agar arginina y glucosa (AAG) 1. Registrar las características del medio AAG antes de la inoculación (color del medio). 2. Tomar suavemente una porción del centro de la colonia con asa bacteriológica recta y estéril e inocular por picadura y estría en un tubo con medio AAG inclinado. 3. Incubar el medio AAG a 35 2 C durante 18 a 24 h. 4. La determinación de la capacidad enzimática de un microorganismo de descarboxilar la Larginina para formar la diamina putrescina se hace evidente con la resultante alcalinidad. La descarboxilación de la Larginina se evidencia con un pico de flauta/extremo inferior color púrpura (alcalino).
17 5. La dihidrolasa positiva producirá dos moléculas de amoniaco más dióxido de carbono ATP a través del intermediario Lornitina haciéndose evidente con la resultante alcalinidad. 6. En la dihidrolasa negativa no se producirá cambio alguno en el color original del medio AAG antes de la inoculación; o es posible poder apreciar un ligero cambio del color inicial del medio de cultivo hacia el amarillo en el fondo del tubo, provocado por una ligera acidificación producida a partir de la fermentación de la glucosa Agar lisina hierro. 1. Registrar las características del medio LIA antes de la inoculación (color del medio). 2. Tomar suavemente una porción del centro de la colonia con asa bacteriológica recta y estéril, estriar el pico de flauta y punzar el fondo del medio dos veces en un tubo con medio (LIA) inclinado. 3. Incubar con las tapas flojas; 1824 h de incubación a 35±2 C. 4. La determinación de la capacidad enzimática de un microorganismo de descarboxilar la lisina para formar una amina se hace evidente con la resultante alcalinidad. La descarboxilación de la lisina se evidencia con un pico de flauta/extremo inferior color púrpura (alcalino). 5. La descaboxilación negativa se hace evidente por el pico de flauta púrpura/extremo inferior amarillo (ácido); fermentación sólo de la glucosa. 6. La desaminación de la lisina se hace evidente por un pico de flauta rojo/extremo inferior color amarillo Prueba de halofilia. 1. Tomar suavemente una porción del cultivo desarrollado en KIA o TSI o AAG con asa bacteriológica estéril y suspender el inóculo en un tubo con los siguientes medios: Caldo triptona con NaCl al 0,0% (T1N0) Caldo triptona con NaCl al 3,0% (T1N3) Caldo triptona con NaCl al 6,0% (T1N6). 2. Incubar los medios a 35 2 C durante 18 a 24 h. NOTAS El V. cholerae y el V. mimicus crecerán en T1N0 y T1N3 y no crecen en T1N6. Algunos géneros de bacterias que no son Vibrio y que presentan reacciones similares a las de V. cholerae en medios de TSI y LIA no crecen en T1N3. La mayoría
18 de las especies de Vibrio spp. que incluyen algunos V. cholerae no O1, crecen únicamente en T1N3 y no crecen en T1N6 ni en concentraciones mayores de sal Prueba de halofilia alternativa. Alternativamente se realiza la prueba de halofilia en cajas de Petri con los siguientes medios de cultivo: Agar gelatina (GA) Agar gelatina con NaCl al 3,0% (GS 3,0%) Agar gelatina con NaCl al 6,0% (GS 6,0%) 1. Dividir cada placa en tantos sectores como cultivos se deseen probar. Tomar suavemente una porción del cultivo desarrollado en KIA o TSI o AAG con asa bacteriológica estéril e inocular en el centro de cada sector una estría recta. 2. Incubar a 3537ºC durante 18 a 24 h.. NOTA V. cholerae y V. mimicus crecen al 0,0% y al 3,0% de sal y rara vez al 6,0% de cloruro de sodio. Para leer la reacción de la gelatinasa sostener la placa sobre una superficie negra, observar un halo opaco alrededor de la colonia de los microorganismos gelatinasa positivos Prueba de oxidaciónfermentación. 1. Tomar suavemente una porción del cultivo desarrollado en KIA o TSI o AAG con asa bacteriológica estéril e inocular por picadura en dos tubos con el medio HughLeifson. 2. Añadir una capa de aceite mineral estéril a uno de los tubos para incubación en anaerobiosis. 3. Incubar ambos tubos a 3537ºC durante 18 a 24 h. NOTA Las especies de Vibrio spp utilizan la glucosa tanto para la oxidación como para la fermentación. Las especies de Pseudomonas, que comúnmente se aíslan del pescado y los mariscos con métodos de enriquecimiento que se usan para las especies de Vibrio, utilizan sólo la glucosa para la oxidación Caldo RMVP (Rojo de metilovoges Proskauer)
19 1. Con asa bacteriológica recta estéril tomar crecimiento del tubo TSI, KIA o LIA e inocular el tubo con caldo RMVP Prueba de VogesProskauer (VP) 1. Para la prueba de VogesProskauer incubar a 35 2 C durante h. 2. Transferir a un tubo de 13 x 100 mm estéril un mililitro de cultivo. 3. Adicionar a este cultivo, 0,6 ml de reactivo de VP1 (alfanaftol etanólico al 5 %), agitar y agregar 0,2 ml del reactivo VP2 (hidróxido de potasio al 40%). 4. Adicionar algunos cristales de creatinina (opcional). 5. Agitar nuevamente y dejar reposar el tubo en forma inclinada, con el objeto que la reacción se lleve a cabo en presencia de oxígeno. 6. Interpretar los resultados después de 2 h. de incubación a temperatura ambiente. La prueba que indica la presencia del producto final neutro, acetilmetilcarbinol (acetoína), 23 butanodiol o el diacetil estará indicada por un color después de revelar con reactivos VP1 y VP2: Anillo rojizo Prueba de Rojo de Metilo 1. Para la prueba de rojo de metilo (RM) incubar a 35 2 C el resto del medio RM/VP durante 48 h más (96 h. de incubación en total a partir de la inoculación inicial del medio RM/VP). 2. Adicionar al medio de cultivo dos a tres gotas de solución indicadora de rojo de metilo. 3. Agitar e interpretar los resultados en forma inmediata. La prueba que indica la capacidad de un microorganismo para producir y mantener estables los productos finales ácidos a partir de la fermentación de la glucosa y vencer la capacidad buffer del sistema, estará indicado por un color distintivo rojo brillante estable en la superficie del medio Caldo arabinosa y caldo sacarosa 1. Con asa bacteriológica recta estéril, tomar crecimiento del tubo TSI o KIA o LIA e inocular en el tubo que contiene caldo rojo de fenol más 1% de arabinosa y el caldo rojo de fenol más 1% de sacarosa. 2. Incubar a 35 2 C durante 24 2 h. 3. Interpretar resultados. La determinación de la capacidad de un microorganismo para fermentar un hidrato de carbono específico incorporado al medio basal, caldo rojo de fenol y producir ácido estará indicado por un color amarillo Prueba rápida del ONPG en discos. 1. Preparar un inoculo bastante denso proveniente del TSI o KIA con agua destilada en un tubo pequeño. Mezclar perfectamente.
20 2. Colocar un disco sobre la suspensión bacteriana e incubar en baño de agua a 37 C. Examinar a intervalos de 15 min durante 1h: la mayoría de las reacciones positivas (color amarillo) aparecerá en min. Dejar los tubos con respuesta negativa hasta 24 h antes de descartar. En algunos casos se pueden observar reacciones tardías. 6. Identificación y confirmación de V.chloreae O1, V.cholerae no O1 y V. mimicus a través de pruebas bioquímicas complementarias. Leer los resultados de las prueba bioquímicas de TSI, KIA, AAG, T1N0, T1N3, T1N6 además del caldo glucosa de HughLeifson. También se sugiere realizar una tinción de Gram a un cultivo de 18 a 24 h. de incubación. La interpretación de las pruebas bioquímicas para identificación de V. cholerae y otras especies bacterianas afines figuran en los cuadros 1, 2 y Prueba serológica de aglutinación. 1. Inocular los cultivos sospechosos presuntivos en agar tripticasa soya (TSA) e incubar a 3537 C durante 16 a 24 h. 2. Colocar con una asa bacteriológica, dos gotas separadas de solución salina estéril (NaCl 0.85%) sobre un portaobjetos o en dos secciones de una placa para aglutinación. 3. Suspender en cada una de las gotas, una porción del cultivo desarrollado en TSA. 4. Agregar a una de ellas una gota del suero anti Vibrio cholerae Grupo O1 subgrupo Inaba (factor AC) y mezclar con el canto del asa o empleando aplicadores de madera. 5. Agitar inclinando la lámina hacer girar las gotas durante aproximadamente un minuto. 6. Observar bajo una buena iluminación y sobre un fondo oscuro la reacción. 7. Considerar cualquier grado de aglutinación como positiva. 8. Realizar el mismo procedimiento con el suero anti Vibrio cholerae Grupo O1 subgrupo Ogawa (factor AB). NOTAS La suspensión del cultivo en la que no se adicionó el suero anti Vibrio cholerae Grupo O1 subgrupo Inaba (factor AC) o el suero anti Vibrio cholerae Grupo O1 subgrupo Ogawa (factor AB) se considerará como el control negativo para poder interpretar el resultado. Existe la posibilidad que los antígenos anti Vibrio cholerae estén relacionados entre sí, por lo que se considera pertinente realizar pruebas bioquímicas para confirmar que el cultivo puro sea de V. cholerae O1 o no O1.
21 Es conveniente incluir cultivos positivos y negativos, además de los controles salinos para cada antisuero usado. Los cultivos que aglutinan con el suero polivalente (grupo O1) y con los sueros Inaba y Ogawa, tienen los 3 factores (A, B y C) y son del serotipo Hikojima. Los cultivos que aglutinan con el suero polivalente, pero no aglutinan con sueros Inaba y Ogawa, no se pueden tipificar con estos antisueros. Los cultivos de V. cholerae cuya identidad se haya confirmado con métodos bioquímicos y que no aglutinen con el suero del grupo O1 se deben considerar como V. cholerae no O1. CÁLCULOS Y EXPRESIÓN DE RESULTADOS Consultar los resultados obtenidos y comparar con los Cuadros 1, 2 y 3 para la identificación de los géneros y especies de la bacteria investigada. En caso de que los resultados obtenidos no correspondan a ninguna especie del género Vibrio consultar el cuadro de la Familia Enterobacteriaceae e intentar la identificación del problema. CUADRO 1. Reacciones de algunas especies de Vibrio spp. y microorganismos relacionados en medios sólidos diferenciales. Microorganismo Agar hierro Kligler (KIA) Pico de flauta Fondo de tubo V. cholerae Lac Gluc Sac V. mimicus Lac Gluc Sac Agar hierrotres azúcares (TSI) Pico de Fondo flauta de tubo Gluc ( raro) Gluc ( raro) V. parahaemolyticus Lac Gluc Sac Gluc Arg. V. alginolyticus Lac Gluc Sac Gluc Arg. V. vulnificus Lac o A. hydrophila Lac o P. shigelloides Lac o Gluc Sac ( raro) Gluc Sac o Gluc Sac o Gluc Gluc Gluc Neutro Agar arginina glucosa (AAG) Pico de Fondo flauta de tubo Arg. Gluc Dihid. lig. Arg. Gluc Dihid. Gluc Dihid. Gluc Dihid. Arg. Gluc Dihid. Arg. Gluc Dihid. Neutro Ninguna de las especies de Vibrio spp. aquí enlistadas producen ácido sulfhídrico en KIA, TSI, LIA o AAG, o gas de la glucosa en cantidades detectables en KIA, TSI ó AAG. Algunas especies de Aeromonas spp. pueden producir gas a partir de la glucosa en estos medios.
22 CUADRO 2. Características mínimas para la identificación de Vibrio cholerae Característica Vibrio cholerae Morfología Bacilo Gramnegativo (pueden ser curvos) Citocromo oxidasa TSI Sac ( raro) Gluc gas H2S KIA Lac Gluc gas H2S Dihidrolasa arginina en AAG Gluc (ligeramente ) Lisina descarboxilasa Prueba de oxidaciónfermentación Fermentación oxidación Voges Proskauer El Tor Tipo Clásico Prueba de halofilia con NaCl 0,0% 3,0% 6,0% usualmente 8,0% 10,0% Fermentación de la sacarosa ONPG (оnitrofenilβdgalactopiranósido) Fermentación de la arabinosa Crecimiento a 42ºC
23 CUADRO 3. Características diferenciales de especies y biotipos del género Vibrio V. V. V. V. V. V. V. V. cholerae alginolyticus fluvialis parahaemolyticus vulnificus mimicus hollisae furnissii A A V V V V NC A Crecimiento en TCBS Agar mcpc P NC NC NC A NC NC NC Medio AAG Ka KA KK KA KA KA Ka KK Crecimiento con: 0,0% NaCl 3,0% NaCl 8,0% NaCl 10,0% NaCl Crecimiento a: 4ºC 30ºC 35ºC 40ºC /d d d Oxidasa OF/glucosa OF OF OF OF OF OF OF OF ONPG Voges d Proskauer Rojo de Metilo NC NC NC d Indol d d Movilidad d Citrato d d Arginina dihidrolasa Descarboxilación de lisina Descarboxilación de: Ornitina Gelatinasa d Ureasa D Producción de: ND ND ND amilasa H2S (SIM) Utilización de: Dglucosa Gas a partir de glucosa DXilosa LArabinosa d DGalactosa d Sacarosa Celobiosa d Lactosa d a d Salicina DGluconato Putrescina d d SÍMBOLOS: TCBS, tiosulfatocitratosales biliaressacarosa; mcpc, agar celobiosapolimixina Bcolistina; modificado; AAG, agar argininaglucosa A, amarillo; V, verde; P púrpura; OF, metabolismo oxidativo/fermentativo; N, no crece; K, alcalino; a, ligeramente ácido; V, reacción variable dependiendo de las especies o biotipos; S, sensible; R, resistente; d, resultados diferentes; d a, generalmente los biotipos silvestres son lac pero es una característica que por mutaciones se puede adquirir, existen biotipos lac y lac y éstos últimos son cada vez más frecuentes,, la mayoría de las cepas, usualmente 90% o más;, casi ninguna cepa positiva, usualmente positivas; ND, no hay datos. ND ND ND ND ND ND ND ND d ND ND ND ND
24 EXPRESIÓN DE RESULTADOS Reportar presencia o ausencia de Vibrio cholerae o la especie identificada en 25.0 ó 50.0 g de alimento (según sea el caso) ó en 3 L de agua o hielo. BIBLIOGRAFÍA Norma Oficial Mexicana NOM031SSA Bienes y Servicios. Productos de la pesca. Moluscos Bivalvos Frescos Refrigerados y Congelados. Especificaciones sanitarias. México. Norma Oficial Mexicana NOM242SSA Bienes y Servicios. Productos de la pesca frescos, refrigerados, congelados y procesados. Especificaciones sanitarias y métodos de prueba. México. Apéndice B. Norma Oficial Mexicana NOM041SSA Bienes y Servicios. Agua purificada envasada. Especificaciones sanitarias. México. Nota: Esta norma incluía la especificación de Vibrio cholerae para agua y/o hielo pero en la actualidad está caduca. Se deja la referencia debido a que no existe norma vigente que contemple la determinación de Vibrio cholerae en agua y/o hielo. Norma oficial mexicana NOM243SSA12010, productos y servicios. Leche, producto lácteo, producto lácteo combinado, mezcla de leche con grasa vegetal y derivados lácteos. Disposiciones y especificaciones sanitarias. Métodos de prueba Food and Drug Administration (2003) Bacteriological Analytical Manual. 9 th ed. Arlington, VA: AOAC. Kaysner C. A., & DePaola A. Jr. (2001) Vibrio. In: Compendium of Methods for the Microbiological Examination of Foods. 4 th ed. Downs F.P. & Ito K. (Eds.) APHA. Washington International Commission on Microbiological. Specifications of Foods (2005) Microorganisms in Foods 6 Chapman & Hall. 2nd ed.
25 MEDIOS DE CULTIVO Agar Tiosulfato, Citrato, Sales Biliares y Sacarosa (TCBS) Peptona de caseina g Peptona de carne g Extracto de levadura Sacarosa g g Tiosulfato de sodio.5h2o g Citrato de sodio.2h2o Colato de sodio Bilis de buey Cloruro de sodio Citrato férrico Azul de bromotimol Azul de timol Agar Agua destilada 10.0 g g g g g mg mg g ml Preparar en un matraz por lo menos tres veces más grande que el volumen requerido de medio. Adicionar los ingredientes en agua destilada tibia y calentar con agitación constante hasta ebullición e inmediatamente retirar del calor. No esterilizar. ph 8.6 ± 0.2 a 25ºC. Enfriar a 50ºC y colocar en cajas de Petri. Dejar secar las placas de 3745ºC antes de usar. Modo de Acción La alta concentración del tiosulfto y citrato así como la fuerte alcalinidad de este medio, inhibe el crecimiento de la familia Enterobacteriaceae. Las sales biliares y el colato y las sales biliares suprimer primariamente a los enterococos. Cualquier bacteria coliforme que pudiera crecer, no puede metabolizar la sacarosa. Solamente unas cuantas especies de Proteus sacarosapositiva pueden crecer para formar colonias amarillas, parecidas a los vibrios. La mezcla de indicadores azul de timoazul de bromotimol cambian su color al amarillo, cuando hay liberación de ácido, aún en este medio fuertemente alcalino. Incubar de 1824 h a 35ºC aeróbicamente. Apariencia de las colonias Amarillas y planas, 23 mm de diámetro Pequeñas, centro azulverde Grandes, amarillas Azul Muy pequeñas, transparentes Microorganismos Vibrio cholerae, Vibrio cholerae var. El Tor Vibrio parahaemolyticus Vibrio alginolyticus Pseudomonas, Aeromonas y otros Enterobacteriaceae y otros
26 Agar modificado con Celobiosa, Polimixina B y Colistina (mcpc). Solución 1: Peptona g Extracto de carne g Cloruro de sodio g Solución Stock de colorante ml Agar g Agua destilada ml Ajustar el ph a 7,6. Hierva hasta que se disuelva el agar. Esterilizar por autoclave 15 minutos a 121ºC. Enfríe de 4855ºC. Solución stock de colorantes X: Azul de bromotimol g Rojo de cresol g Etanol al 95% ml Para obtener un color firme del medio usar una solución colorante stock en lugar de estar pesando repetidamente los colores en polvo. Disuelva el colorante en etanol hasta obtener una solución al 4% (peso/volumen). Agregue 1 ml de esta solución a cada litro de agar mcpc, la cual tendrá al final 40 mg de azul de bromotimol y 40 mg de rojo cresol por litro. Solución 2: Celobiosa g Colistina UI Polimixina B UI Agua destilada ml Disuelva la celobiosa por calentamiento en agua destilada. Enfríe y agregue los antibióticos. Esterilice por filtración, agregue la solución 2 a la solución 1 mezcle y distribuya en cajas Petri. Agar/Caldo T1N1 (Agar Tripticasa y Sal). Triptona o tripticasa o digerido pancreático de caseina g Cloruro de sodio g Agar g
27 Agua destilada ml Suspenda los ingredientes y hierva hasta disolución del agar, si lo desea inclinado, distribuya en tubos. Para prepaar caldo T1N1 omitir el agar. Esterilice en autoclave 15 minutos a 121ºC. ph final 7.2 ± 0.2. Deje solidificar los tubos inclinados, para placas enfríe el medio de 4550ºC y distribuya en cajas Petri estériles. Agar Gelatina (GA). Tripticasa (digerido pancreático de caseina) g Cloruro de sodio g Gelatina g Agar g Agua destilada ml Suspenda los ingredientes y hierva hasta disolución de la gelatina y el agar, ajuste el ph a 7,2 ± 0.2. Esterilice en autoclave 15 minutos a 121ºC. Enfríe de 4550ºC y distribuya en cajas Petri estériles. Agar/Caldo Gelatina con Sal (GS). Preparar agar gelatina (GA), pero adicionando 30 g de cloruro de sodio por cada litro. Suspenda los ingredientes y hierva hasta disolver la gelatina y el agar. Ajuste el ph de 7,2 ± 0,2. Esterilice en autoclave 15 minutos a 121ºC. Enfríe de 4550ºC, coloque en cajas Petri. Si es necesario para inhibir la diseminación de Vibrio spp tal como V. alginolyticus, use de 2530 g de agar por litro. Para preparar caldo GS omitir el agar. Caldo Glucosa de HughLeifson. Peptona g Extracto de levadura... 0,5 g Cloruro de sodio g Dextrosa g Púrpura de bromocresol g Agar g Agua destilada ml Suspenda los ingredientes y hierva hasta disolver el agar. Ajuste el ph a 7,4 ± 0,2. Coloque en tubos y esterilice en autoclave 15 minutos a 121ºC.
28 Modo de acción Al añadir un carbohidrato al medio de cultivo, la degradación del carbohidrato con la consecuente liberación de ácido se hace evidente por el indicador de ph azul de bromotimol el cual cambia su color a amarillo. La degradación se lleva a cabo mientras el medio está expuesto al aire (la degradación puede ser oxidativa o fermentativa) o en ausencia del aire (degradación fermentativa solamente). Para cada carbohidrato, inocular un tubo con un cultivo puro del microorganismo mediante picadura hasta el fondo de los tubos y sellar un tubo con parafina y otro no. El microorganismo utilizado para la inoculación deberá estar en fase logarítmica de desarrollo. Incubar al menos 48 h a temperatura óptima de incubación. Una coloración amarilla en ambos tubos, abierto y sellado con parafina, significa degradación fermentativa, mientras que una coloración amarilla solo del tubo abierto indica que el carbohidrato en cuestión es degradado solamente vía oxidativa. La degradación oxidativa se presenta solo o cercanamente a la superficie del medio, mientras que la degradación fermentativa se presenta en la superficie y en todo el tubo. Se comprueban finalmente el crecimiento microbiano producido mediante la observación de turbidez solamente a lo largo de la linea de la picadura (cepa no móvil) o a lo largo de todo el medio (cepa móvil). Caldo Triptona T1N0 y Caldos Triptona Sal T1N1, T1N3, T1N6, T1N8 y T1N10. Triptona o tripticasa (digerido pancreático de caseina) g Cloruro de sodio o g Agua destilada ml Disuelva los ingredientes en agua destilada, para T1N0 no agregue cloruro de sodio, para T1N1 use 10 g de cloruro de sodio (1% w/v concentración de cloruro de sodio). Para T1N3 usar 30 g de NaCl por litro (3% w/v concentración de cloruro de sodio). Así respectivamente, para T1N6, T1N8 y T1N10 usar 60, 80 y 100 g de NaCl por litro. Distribuya en tubos de tapón de rosca de 16 x 150 mm, tape los tubos. Esterilice en autoclave durante 15 minutos a 121ºC. Ajuste el ph a 7,2 ± 0,2. Caldo Soya Tripticasa (TSB). Peptona de tripticasa (Triptona) (digerido pancreático de caseina) 17.0 g Peptona de fitona (Soytona) g Cloruro de sodio g Fosfato dipotásico g Dextrosa g Agua destilada ,0 ml Suspenda los ingredientes en agua destilada y caliente hasta disolución. Distribuya 225 ml en matraces de 500 ml o tubos. Esterilice en autoclave durante 15 minutos a 121ºC. El ph final debe ser de 7,2 ± 0,2.
29 Modo de acción Las peptonas promueven la replicación aún de microorganismos fastidiosos. El cloruro de sodio proporciona el equilibrio osmótico. Agar Soya Tripticasa (TSA). Peptona tripticasa (Triptona) g Peptona de fitona (Soytona) g Cloruro de sodio g Agar g Agua destilada ml Suspenda los ingredientes en agua destilada y hierva durante un minuto hasta disolución del agar. Para Vibrio sp.p halofílicos, agregar 15 g de cloruro de sodio. Distribuya dentro de tubos o matraces. Esterilice en autoclave durante 15 minutos a 121ºC. Deje solidificar los tubos inclinados o deje enfriar de 4550ºC y distribuya en cajas Petri. El ph final debe ser de 7,3 ± 0,2. Modo de acción Las peptonas promueven la replicación aún de microorganismos fastidiosos. El cloruro de sodio proporciona el equilibrio osmótico. Agar de Hierro Kligler (KIA). Peptona polipeptona g Lactosa g Dextrosa g Cloruro de sodio g Citrato férrico amoniacal g Tiosulfato de sodio g Rojo de fenol... 0,025 g Agar... 15,0 g Agua destilada ml Se sugiere añadir 20g de NaCl/L de medio de cultivo para identificar V. cholerae.
30 Suspender los ingredientes y hervir hasta disolución del agar. Distribuir en tubos de tapón de rosca. Esterilizar en autoclave durante 15 minutos a 121ºC. Dejar solidificar los tubos inclinados. Ajustar el ph de 7,4 ± 0,2. Modo de acción El medio se solidifica en forma inclinada permitiendo tener dos cámaras de crecimiento: una aeróbica, el pico de flauta y la otra anaeróbica, el fondo del tubo. La degradación de los carbohidratos acompañada de producción de ácido se detecta mediante el indicador de ph rojo de fenol, el cual cambia su color de rojonaranja a amarillo, bajo alcalinización se torna rojo intenso. El tiosulfato es reducido por muchas especies bacterianas a ácido sulfhídrico el cual reacciona con la sal de fierro para dar un sulfuro ferroso de color negro. Fermentación de carbohidratos La fermentación de glucosa cambia el medio a amarillo, pero debido a su baja concentración (0.1%) esto sólo se observa en el fondo del tubo, mientras que la superficie cambia a rojo. Una vez consumida la glucosa, el microorganismo comienza a metabolizar aminoácidos liberando amoníaco, lo cual alcaliniza el medio, esto ocurre en la superficie. La fermentación de lactosa cambia el medio a amarillo y dado que su concentración es mayor (1%), la formación de ácido es suficiente para mantener el color amarillo tanto en el fondo como en la superficie del tubo. En caso de no haber fermentación, el medio vira a rojo. Modo de empleo La siembra se realiza por picadura en el agar y estría en la superficie inclinada. Se incuba de 18 a 24 horas a 35 2 C en condiciones aerobias. Agar Arginina Glucosa Inclinado (AAG). Peptona g Extracto de levadura g Triptona g Cloruro de sodio g Glucosa g LArginina(hidrocloruro) g Citrato férrico amónico g Tiosulfato de sodio g Púrpura de bromocresol g Agar g Agua destilada ml Suspender los ingredientes en agua destilada, hervir hasta disolución del agar, y distribuir en cantidades de 5 ml a tubos de 13 x 100 mm. Ajustar el ph de 6,8 a 7,0. Esterilizar en autoclave de 10 a 12 minutos a 121ºC. Deje solidificar el medio inclinado. Modo de acción
31 El aminoácido Larginina es catabolizado (degradado) por medio de dos sistemas que pueden ocurrir de manera simultánea o separada. Estas dos vías metabólicas son el sistema de la arginina dehidrolasa y el sistema de la arginina descarboxilasa. En el sistema descarboxilasa, la Larginina sufre una descarboxilación para producir agmatina, una posterior degradación de la agmantina ocurre por una de dos vías metabólicas; si está presente la enzima agmatina ureohidrolasa se formará putrescina más urea y a su vez si está presente la ureasa se producirán dos moléculas de amoniaco y dióxido de carbono; y en cambio, si no se encuentra la enzima agmatina ureohidrolasa sino la enzima agmatina desiminasa, se producirá putrescina por medio de un compuesto intermediario Ncarbamoilputrescina, más dióxido de carbono y dos moléculas de amoniaco. En el sistema dehidrolasa, la degradación de la Larginina ocurre en un proceso de dos pasos: primero una degradación del aminoácido a Lcitrulina, seguida por un sistema que fracciona la citrulina. La reacción global produce la formación de Lornitina, dióxido de carbono y amoniaco a partir del sustrato Larginina. Un cambio rápido e intenso del indicador de ph a la alcalinidad indica que el catabolismo de la Larginina se dibió al sistema arginina dehidrolasa. Un cambio más débil y más lento del ph sin la formación de amoniaco ocurre cuando la Larginina es degradada por el sistema de arginina descaroxilasa. Sin embargo, el factor tiempo no es una manera confiable de determinar cuál fue la vía utilizada. Agar Triple Azúcar y Hierro (TSI). Polipeptona g Cloruro de sodio g Lactosa g Sacarosa g Glucosa g Sulfato ferroso amónico g Tiosulfato de sodio g Rojo de fenol g Agar g Agua destilada ml Se sugiere añadir 20g de NaCl/L de medio de cultivo para identificar V. cholerae. Disolver los ingredientes en agua destilada. Mezclar bien y calentar a ebullición, agitando ocasionalmente hasta completa disolución. Enfriar a 60ºC y ajuste el ph de 7,3 ± 0,1. Modo de acción En este medio la concentración de glucosa es la décima parte de la concentración de la lactosa y la sacarosa, lo cual permite determinar cuándo éste es el único glúcido fermentado. La pequeña cantidad de ácido producido por la fermentación de la glucosa es
Método para la determinación de Vibrio cholerae en alimentos, hielo y agua.
 Método para la determinación de Vibrio cholerae en alimentos, hielo y agua. OBJETIVO Realizar adecuadamente el análisis microbiológico para detectar Vibrio cholerae en alimentos, agua y/o hielo. Explicar
Método para la determinación de Vibrio cholerae en alimentos, hielo y agua. OBJETIVO Realizar adecuadamente el análisis microbiológico para detectar Vibrio cholerae en alimentos, agua y/o hielo. Explicar
PROCEDIMIENTO DETECCION Vibrio cholerae EN AGUAS POR TECNICA DE MEMBRANA FILTRANTE. PRT Página 1 de 8
 PRT-712.02-062 Página 1 de 8 1. OBJETIVO Detectar la presencia de Vibrio cholerae en aguas. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a muestras de aguas claras que no contengan residuos,
PRT-712.02-062 Página 1 de 8 1. OBJETIVO Detectar la presencia de Vibrio cholerae en aguas. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a muestras de aguas claras que no contengan residuos,
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA
 PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
MANUAL DE PREPARACIÓN DE MEDIOS DE CULTIVO
 Rev. 02 Hoja: 1 de 14 MANUAL DE PREPARACIÓN DE MEDIOS DE Elaboró: Revisó: Autorizó: Puesto QUÍMICO JEFE DEL LABORATORIO SUBDIRECTOR DE INVESTIGACIÓN Firma Hoja: 2 de 14 1. Propósito Definir y describir
Rev. 02 Hoja: 1 de 14 MANUAL DE PREPARACIÓN DE MEDIOS DE Elaboró: Revisó: Autorizó: Puesto QUÍMICO JEFE DEL LABORATORIO SUBDIRECTOR DE INVESTIGACIÓN Firma Hoja: 2 de 14 1. Propósito Definir y describir
1. LEVINE EMB AGAR FOTO 6. Medios de cultivo Levine EMG Agar.
 1. LEVINE EMB AGAR. El Agar EMB Levine es un medio selectivo y diferencial, adecuado para el crecimiento de Enterobacterias. Es un medio adecuado para la búsqueda y diferenciación de bacilos entéricos,
1. LEVINE EMB AGAR. El Agar EMB Levine es un medio selectivo y diferencial, adecuado para el crecimiento de Enterobacterias. Es un medio adecuado para la búsqueda y diferenciación de bacilos entéricos,
1 MATERIALES Y MÉTODOS
 1 MATERIALES Y MÉTODOS 1.1 ESQUEMA DE TRABAJO Toma de muestras mesofílicos aerobios por cuenta en placa (UFC*). coniformes fecales mediante NMP * Vibrio cholerae O1 Salmonella Staphyloccoccus aureus *NMP,
1 MATERIALES Y MÉTODOS 1.1 ESQUEMA DE TRABAJO Toma de muestras mesofílicos aerobios por cuenta en placa (UFC*). coniformes fecales mediante NMP * Vibrio cholerae O1 Salmonella Staphyloccoccus aureus *NMP,
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-308-1992. ALIMENTOS - CUENTA DE ORGANISMOS COLIFORMES FECALES. FOODS - FECALS COLIFORM ORGANISMS COUNT. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración de está Norma participaron
NMX-F-308-1992. ALIMENTOS - CUENTA DE ORGANISMOS COLIFORMES FECALES. FOODS - FECALS COLIFORM ORGANISMS COUNT. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración de está Norma participaron
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
APÉNDICE G. Identificación bioquímica de enterobacterias por el sistema API 20E
 APÉNDICE G Identificación bioquímica de enterobacterias por el sistema API 20E OBJETIVO: - Establecer la metodología en la identificación de enterobacterias por medio de pruebas bioquímicas estandarizadas
APÉNDICE G Identificación bioquímica de enterobacterias por el sistema API 20E OBJETIVO: - Establecer la metodología en la identificación de enterobacterias por medio de pruebas bioquímicas estandarizadas
Morfología Agua peptonada. 37 C/ h. investigar: Agar Salmonella. Bacilos gran Shigella. negativos, con Agar Xilosa Lactosa selectivos
 Práctica No. 7 Nombre la práctica: Método para la terminación Salmonella en alimentos Objetivo: Intificación Salmonella en una muestra carne NOM: NOM-114-SSA1-1994 Muestra utilizada: Carne picada Características
Práctica No. 7 Nombre la práctica: Método para la terminación Salmonella en alimentos Objetivo: Intificación Salmonella en una muestra carne NOM: NOM-114-SSA1-1994 Muestra utilizada: Carne picada Características
Blga. Carmen Vargas García. Asesora en Laboratorios Ambientales
 CURSO - TALLER ACTUALIZACIÓN DE METODOLOGÍAS ANALÍTICAS BACTERIOLOGICAS PARA ANALISIS DE AGUAS Piura, 9 al 13 de Noviembre 2009 BACTERIAS PATÓGENAS: Vibrio cholerae y Salmonella Blga. Carmen Vargas García
CURSO - TALLER ACTUALIZACIÓN DE METODOLOGÍAS ANALÍTICAS BACTERIOLOGICAS PARA ANALISIS DE AGUAS Piura, 9 al 13 de Noviembre 2009 BACTERIAS PATÓGENAS: Vibrio cholerae y Salmonella Blga. Carmen Vargas García
Agar Salmonella Shigella (SS) Agar Sulfito Bismuto (SB)
 Agares utilizados Agar Salmonella Shigella (SS) Medio de siembra selectivo para aislar Salmonella y Shigella, diferencia organismos fermentadores de lactosa de los que no lo hacen e inhiben organismos
Agares utilizados Agar Salmonella Shigella (SS) Medio de siembra selectivo para aislar Salmonella y Shigella, diferencia organismos fermentadores de lactosa de los que no lo hacen e inhiben organismos
PROCEDIMIENTO TECNICA NMP STAPHYLOCOCCUS AUREUS EN ALIMENTOS. BAM ONLINE 2001
 PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TÉCNICA RECUENTO EN PLACA
 PRT-712.03-040 Página 1 de 6 1. OBJETIVO Determinar el número de Enterobactereaceae presentes en un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
PRT-712.03-040 Página 1 de 6 1. OBJETIVO Determinar el número de Enterobactereaceae presentes en un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
PROCEDIMIENTO TECNICA DE COAGULASA EN TUBO PRT
 Página 1 de 7 1. OBJETIVO Comprobar la facultad de las unidades formadoras de colonias de S. aureus presentes en una muestra de alimento, de coagular el plasma de conejo por acción de la enzima coagulasa
Página 1 de 7 1. OBJETIVO Comprobar la facultad de las unidades formadoras de colonias de S. aureus presentes en una muestra de alimento, de coagular el plasma de conejo por acción de la enzima coagulasa
NMP PARA LA DETERMINACION DE COLIFORMESY COLIFORMES FECALES EN AGUAS
 PRT-712.03-005 Página 1 de 6 1. OBJETIVO Este método es utilizado para estimar la densidad de bacterias del grupo coliformes y conocer la calidad sanitaria en aguas crudas 2. CAMPO DE APLICACIÓN Y ALCANCE
PRT-712.03-005 Página 1 de 6 1. OBJETIVO Este método es utilizado para estimar la densidad de bacterias del grupo coliformes y conocer la calidad sanitaria en aguas crudas 2. CAMPO DE APLICACIÓN Y ALCANCE
NMP PARA LA DETERMINACION DE COLIFORMES Y ESCHERICHIA COLI EN ALIMENTOS PRT
 Página 1 de 8 1. OBJETIVO Estimar la densidad de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
Página 1 de 8 1. OBJETIVO Estimar la densidad de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO
 CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO CULTIVO DE MICROORGANISMOS fuente de energía exógena nutrientes esenciales: agua, carbón, nitrógeno, minerales condiciones ambientales apropiadas: ph, temperatura,
CULTIVO DE MICROORGANISMOS MEDIOS DE CULTIVO CULTIVO DE MICROORGANISMOS fuente de energía exógena nutrientes esenciales: agua, carbón, nitrógeno, minerales condiciones ambientales apropiadas: ph, temperatura,
Clostridium perfringens
 Clostridium perfringens Introducción Cuando se lanza un producto alimentario al mercado se deben tener en cuenta varios parámetros que le otorgan calidad al producto, uno de ellos es la inocuidad. Los
Clostridium perfringens Introducción Cuando se lanza un producto alimentario al mercado se deben tener en cuenta varios parámetros que le otorgan calidad al producto, uno de ellos es la inocuidad. Los
Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias.
 Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias. Objetivos Relacionar la actividad metabólica de los microorganismos con los cambios producidos en diferentes
Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias. Objetivos Relacionar la actividad metabólica de los microorganismos con los cambios producidos en diferentes
Laboratorio de Agroindustria II. Calidad de Leche
 Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
Objetivos. S Determinar la presencia de bacterias coliformes en una muestra de agua
 Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-187-1978. DETERMINACIÓN DEL NÚMERO MÁS PROBABLE DE GÉRMENES. METHOD OF TEST FOR GERMS MOST PROBABLE NUMBER. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración de esta Norma
NMX-F-187-1978. DETERMINACIÓN DEL NÚMERO MÁS PROBABLE DE GÉRMENES. METHOD OF TEST FOR GERMS MOST PROBABLE NUMBER. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración de esta Norma
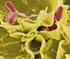
Vibrio cholerae MICROBIOLOGÍA Y PARASITOLOGÍA
 Vibrio cholerae MICROBIOLOGÍA Y PARASITOLOGÍA AREA ACADEMICA: LICENCIATURA EN ENFERMERIA TEMA: Vibrio cholerae PROFESOR: Q.F.B. CINOSURA DEL ANGEL HUERTAS PERIODO: JULIO DICIEMBRE 2017 TEMA: Vibrio cholerae
Vibrio cholerae MICROBIOLOGÍA Y PARASITOLOGÍA AREA ACADEMICA: LICENCIATURA EN ENFERMERIA TEMA: Vibrio cholerae PROFESOR: Q.F.B. CINOSURA DEL ANGEL HUERTAS PERIODO: JULIO DICIEMBRE 2017 TEMA: Vibrio cholerae
Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos.
 BIPLACA HYCHECK Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos. Son estadísticamente comparables a una Torunda
BIPLACA HYCHECK Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos. Son estadísticamente comparables a una Torunda
PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA
 PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA I. OBJETIVO Investigar la presencia de Estreptococos fecales en una muestra de agua mediante la técnica del Número Más Probable (NMP) usando
PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA I. OBJETIVO Investigar la presencia de Estreptococos fecales en una muestra de agua mediante la técnica del Número Más Probable (NMP) usando
BIORREACTRES. Estudios básicos y aplicados sobre procesos de fermentación
 BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
NMP PARA LA DETERMINACION DE COLIFORMES Y Escherichia coli EN ALIMENTOS BASADO EN BAM on line
 COLIFORMES Y Escherichia coli EN ME-712.02-004 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias del grupo coliformes, como indicador sanitario en alimentos. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar
COLIFORMES Y Escherichia coli EN ME-712.02-004 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias del grupo coliformes, como indicador sanitario en alimentos. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar
MICROBIOLOGÍA AGROINDUSTRIAL I- UNIDAD REPASO DE CLASES PRÁCTICAS. Dra. Flor Teresa García Huamán
 MICROBIOLOGÍA AGROINDUSTRIAL I- UNIDAD REPASO DE CLASES PRÁCTICAS 1 1. AISLAMIENTO DE BACTERIAS PRODUCTORAS DE AMILASAS. 2. TÉCNICAS DE SEMBRADO. 3. DETERMINACIÓN DE BACTERIAS DE UNA MUESTRA: RECUENTO
MICROBIOLOGÍA AGROINDUSTRIAL I- UNIDAD REPASO DE CLASES PRÁCTICAS 1 1. AISLAMIENTO DE BACTERIAS PRODUCTORAS DE AMILASAS. 2. TÉCNICAS DE SEMBRADO. 3. DETERMINACIÓN DE BACTERIAS DE UNA MUESTRA: RECUENTO
INSTITUTO NACIONAL DE LA PESCA UNIVERSIDAD NACIONAL AUTONOMA DE MEXICO
 03-06-95 NORMA Oficial Mexicana NOM-031-SSA1-1993, Bienes y servicios. Productos de la pesca. Moluscos bivalvos frescos-refrigerados y congelados. Especificaciones sanitarias. Al margen un sello con el
03-06-95 NORMA Oficial Mexicana NOM-031-SSA1-1993, Bienes y servicios. Productos de la pesca. Moluscos bivalvos frescos-refrigerados y congelados. Especificaciones sanitarias. Al margen un sello con el
UNIVERSIDAD DE CIENCIAS Y ARTES DE CHIAPAS
 1 FACULTAD DE CIENCIAS DE LA NUTRICIÓN Y ALIMENTOS LICENCIATURA EN NUTRIOLOGÍA MANUAL DE PRÁCTICAS PARA LA EXPERIENCIA ACADÉMICA MICROBIOLOGÍA DE ALIMENTOS ELABORO: M. EN C. GILBER VELA GUTIÉRREZ Y M.
1 FACULTAD DE CIENCIAS DE LA NUTRICIÓN Y ALIMENTOS LICENCIATURA EN NUTRIOLOGÍA MANUAL DE PRÁCTICAS PARA LA EXPERIENCIA ACADÉMICA MICROBIOLOGÍA DE ALIMENTOS ELABORO: M. EN C. GILBER VELA GUTIÉRREZ Y M.
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
QUÉ CONTIENE UN MEDIO? Aquellos requerimientos nutricionales que los microorganismos necesitan para crecer. Depende del ambiente en donde viven.
 OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 TRABAJO PRÁCTICO No. 5 METABOLISMO BACTERIANO: ACTIVIDAD SOBRE CARBOHIDRATOS Y PROTEINAS OBJETIVOS 1. Explicar el fundamento de las pruebas bioquímicas utilizadas en el estudio del metabolismo bacteriano.
1 TRABAJO PRÁCTICO No. 5 METABOLISMO BACTERIANO: ACTIVIDAD SOBRE CARBOHIDRATOS Y PROTEINAS OBJETIVOS 1. Explicar el fundamento de las pruebas bioquímicas utilizadas en el estudio del metabolismo bacteriano.
1. Medios de cultivo.
 1. Medios de cultivo. 89 1. MEDIOS DE CULTIVO. Para la investigación para un analisis especifico de las aguas del parque se han utilizado cinco medios de cultivo sólidos en formato de placas Petri. TSA
1. Medios de cultivo. 89 1. MEDIOS DE CULTIVO. Para la investigación para un analisis especifico de las aguas del parque se han utilizado cinco medios de cultivo sólidos en formato de placas Petri. TSA
PROCEDIMIENTO RECUENTO DE COLIFORMES EN MEDIO SÓLIDO
 PRT-712.03-008 Página 1 de 6 1. OBJETIVO Este método es utilizado para realizar recuento de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento
PRT-712.03-008 Página 1 de 6 1. OBJETIVO Este método es utilizado para realizar recuento de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento
Preparación de medios de cultivo. Bacteriología II. O B J E T I V O
 Preparación de medios de cultivo. Bacteriología II. O B J E T I V O El objetivo de la presente práctica es aprender a preparar correctamente los principales de medios de cultivo que se utilizan en el laboratorio
Preparación de medios de cultivo. Bacteriología II. O B J E T I V O El objetivo de la presente práctica es aprender a preparar correctamente los principales de medios de cultivo que se utilizan en el laboratorio
NORMA OFICIAL MEXICANA NOM-113-SSA1-1994, BIENES Y SERVICIOS. MÉTODO PARA LA CUENTA DE MICROORGANISMOS COLIFORMES TOTALES EN PLACA.
 NORMA OFICIAL MEXICANA NOM-113-SSA1-1994, BIENES Y SERVICIOS. MÉTODO PARA LA CUENTA DE MICROORGANISMOS COLIFORMES TOTALES EN PLACA. Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.-
NORMA OFICIAL MEXICANA NOM-113-SSA1-1994, BIENES Y SERVICIOS. MÉTODO PARA LA CUENTA DE MICROORGANISMOS COLIFORMES TOTALES EN PLACA. Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.-
PREPARACION DE MEDIOS DE CULTIVO
 PREPARACION DE MEDIOS DE CULTIVO MEDIOS DE CULTIVO Un medio de cultivo es un conjunto de nutrientes, factores de crecimiento y otros componentes que crean las condiciones necesarias para el desarrollo
PREPARACION DE MEDIOS DE CULTIVO MEDIOS DE CULTIVO Un medio de cultivo es un conjunto de nutrientes, factores de crecimiento y otros componentes que crean las condiciones necesarias para el desarrollo
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO. OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico.
 GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
NORMA Oficial Mexicana NOM-112-SSA1-1994, Bienes y servicios. Determinación de bacterias coliformes. Técnica del número más probable.
 10-19-95 NORMA Oficial Mexicana NOM-112-SSA1-1994, Bienes y servicios. Determinación de bacterias coliformes. Técnica del número más probable. Al margen un sello con el Escudo Nacional, que dice: Estados
10-19-95 NORMA Oficial Mexicana NOM-112-SSA1-1994, Bienes y servicios. Determinación de bacterias coliformes. Técnica del número más probable. Al margen un sello con el Escudo Nacional, que dice: Estados
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I
 PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I P # 1 P # 2 P # 3 P # 4 P # 5 P # 6 Uso y cuidados en el manejo del Microscopio Esterilización de materiales y medios Técnicas de Tinción
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I P # 1 P # 2 P # 3 P # 4 P # 5 P # 6 Uso y cuidados en el manejo del Microscopio Esterilización de materiales y medios Técnicas de Tinción
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
PROCEDIMIENTO RECUENTO MOHOS Y LEVADURAS EN ALIMENTOS NORMA ISO 7954
 PRT- 712.02-031 Página 1 de 9 1. OBJETIVO Conocer el número de Mohos y Levaduras que contiene un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento se aplica a todos los alimentos de consumos
PRT- 712.02-031 Página 1 de 9 1. OBJETIVO Conocer el número de Mohos y Levaduras que contiene un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento se aplica a todos los alimentos de consumos
PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO
 PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO I. OBJETIVO Aislar dos microorganismos por la técnica de siembra de dilución por estría en placa de agar y obtener un
PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO I. OBJETIVO Aislar dos microorganismos por la técnica de siembra de dilución por estría en placa de agar y obtener un
Cuenta en placa de bacterias
 Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química,. México. Cuenta en placa de bacterias OBJETIVOS Realizar adecuadamente la técnica de cuenta en placa para diversos grupos microbianos de
Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química,. México. Cuenta en placa de bacterias OBJETIVOS Realizar adecuadamente la técnica de cuenta en placa para diversos grupos microbianos de
NORMA Oficial Mexicana NOM-113-SSA1-1994, Bienes y servicios. Método para la cuenta de microorganismos coliformes totales en placa.
 08-25-95 NORMA Oficial Mexicana NOM-113-SSA1-1994, Bienes y servicios. Método para la cuenta de microorganismos coliformes totales en placa. Al margen un sello con el Escudo Nacional, que dice: Estados
08-25-95 NORMA Oficial Mexicana NOM-113-SSA1-1994, Bienes y servicios. Método para la cuenta de microorganismos coliformes totales en placa. Al margen un sello con el Escudo Nacional, que dice: Estados
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-304-1977. MÉTODO GENERAL DE INVESTIGACIÓN DE SALMONELLA EN ALIMENTOS. GENERAL RESEARCH METHOD FOR THE DETERMINATION OF SALMONELLA IN FOODS. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO.
NMX-F-304-1977. MÉTODO GENERAL DE INVESTIGACIÓN DE SALMONELLA EN ALIMENTOS. GENERAL RESEARCH METHOD FOR THE DETERMINATION OF SALMONELLA IN FOODS. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO.
Petrifilm. Placas para Recuento de E. coli y Coliformes. Guía de Interpretación. E. coli : E. coli es capaz de crecer en medios conteniendo
 Guía de Interpretación Petrifilm Placas para Recuento de E. coli y Coliformes Esta guía sirve para familiarizarse con los resultados obtenidos en las placas M Petrifilm para Recuento de E. coli y Coliformes
Guía de Interpretación Petrifilm Placas para Recuento de E. coli y Coliformes Esta guía sirve para familiarizarse con los resultados obtenidos en las placas M Petrifilm para Recuento de E. coli y Coliformes
DEGRADACIÓN DE LA LACTOSA POR LACTOBACILUS HASTA ÁCIDO LÁCTICO
 DEGRADACIÓN DE LA LACTOSA POR LACTOBACILUS HASTA ÁCIDO LÁCTICO I. INTRODUCCIÓN Los organismos aerobios así como los anaerobios rompen la molécula de glucosa para su catalización, este camino es usado,
DEGRADACIÓN DE LA LACTOSA POR LACTOBACILUS HASTA ÁCIDO LÁCTICO I. INTRODUCCIÓN Los organismos aerobios así como los anaerobios rompen la molécula de glucosa para su catalización, este camino es usado,
Trabajo Práctico Nº4: Análisis Bacteriológico del Agua. Lic Soria José
 Trabajo Práctico Nº4: Análisis Bacteriológico del Agua Lic Soria José Las fuentes del Agua Se considera agua potable de suministro público y agua potable de uso domiciliario la que es apta para la alimentación
Trabajo Práctico Nº4: Análisis Bacteriológico del Agua Lic Soria José Las fuentes del Agua Se considera agua potable de suministro público y agua potable de uso domiciliario la que es apta para la alimentación
NTE INEN Primera Revisión 2015-xx
 Quito Ecuador NORMA TÉCNICA ECUATORIANA NTE INEN 9-8 Primera Revisión -xx CONTROL MICROBIOLÓGICO DE LOS ALIMENTOS. DETECCIÓN Y RECUENTO DE ESCHERICHIA COLI PRESUNTIVA POR LA TÉCNICA DEL NÚMERO MÁS PROBABLE
Quito Ecuador NORMA TÉCNICA ECUATORIANA NTE INEN 9-8 Primera Revisión -xx CONTROL MICROBIOLÓGICO DE LOS ALIMENTOS. DETECCIÓN Y RECUENTO DE ESCHERICHIA COLI PRESUNTIVA POR LA TÉCNICA DEL NÚMERO MÁS PROBABLE
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-286-1992. ALIMENTOS. PREPARACIÓN Y DILUCIÓN DE MUESTRAS DE ALIMENTOS PARA ANÁLISIS MICROBIOLÓGICOS. FOODS. PREPARATION AND DILUTION OF FOOD SAMPLES FOR MICROBIOLOGICAL ANALYSIS. NORMAS MEXICANAS.
NMX-F-286-1992. ALIMENTOS. PREPARACIÓN Y DILUCIÓN DE MUESTRAS DE ALIMENTOS PARA ANÁLISIS MICROBIOLÓGICOS. FOODS. PREPARATION AND DILUTION OF FOOD SAMPLES FOR MICROBIOLOGICAL ANALYSIS. NORMAS MEXICANAS.
Dice Debe decir Justificación*
 COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de febrero y hasta el 31
COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de febrero y hasta el 31
Placas Petrifilm para Recuento de E. coli / Coliformes
 Guía de interpretación Placas Petrifilm para Recuento de E. coli / Coliformes Esta guía lo familiarizará con los resultados de las Placas 3M Petrifilm para Recuento de E. coli / Coliformes. Para mayor
Guía de interpretación Placas Petrifilm para Recuento de E. coli / Coliformes Esta guía lo familiarizará con los resultados de las Placas 3M Petrifilm para Recuento de E. coli / Coliformes. Para mayor
RepublicofEcuador EDICTOFGOVERNMENT±
 RepublicofEcuador EDICTOFGOVERNMENT± Inordertopromotepubliceducationandpublicsafety,equaljusticeforal, abeterinformedcitizenry,theruleoflaw,worldtradeandworldpeace, thislegaldocumentisherebymadeavailableonanoncommercialbasis,asit
RepublicofEcuador EDICTOFGOVERNMENT± Inordertopromotepubliceducationandpublicsafety,equaljusticeforal, abeterinformedcitizenry,theruleoflaw,worldtradeandworldpeace, thislegaldocumentisherebymadeavailableonanoncommercialbasis,asit
PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA
 PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA Capacidades a lograr: 1. Conoce y aplica técnicas de siembra, cultivo y cuantificación del proceso fermentativo para producción
PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA Capacidades a lograr: 1. Conoce y aplica técnicas de siembra, cultivo y cuantificación del proceso fermentativo para producción
GRUPOS MICROBIANOS BACTERIAS PROTOZOOS ALGAS
 MEDIOS DE CULTIVO GRUPOS MICROBIANOS BACTERIAS LEVADURAS MOHOS PROTOZOOS ALGAS NUTRIMENTOS Material celular Generar energía Metabolismo adecuado Elementos importantes en los sistemas biológicos APPLIED
MEDIOS DE CULTIVO GRUPOS MICROBIANOS BACTERIAS LEVADURAS MOHOS PROTOZOOS ALGAS NUTRIMENTOS Material celular Generar energía Metabolismo adecuado Elementos importantes en los sistemas biológicos APPLIED
MICROBIOLOGÍA AGRÍCOLA
 MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
3M Placas Petrifilm para Recuento de Enterobacterias
 3M Placas Petrifilm para Recuento de Enterobacterias Recomendaciones de uso Para información detallada sobre ADVERTENCIAS, PRECAUCIONES, COMPENSACIONES POR GARANTÍA / GARANTÍA LIMITADA, LIMITACIONES POR
3M Placas Petrifilm para Recuento de Enterobacterias Recomendaciones de uso Para información detallada sobre ADVERTENCIAS, PRECAUCIONES, COMPENSACIONES POR GARANTÍA / GARANTÍA LIMITADA, LIMITACIONES POR
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO F.E.S. IZTACALA METODOLOGÍA CIENTÍFICA IV Práctica 2: Determinación físico-química de suelo y agua.
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO F.E.S. IZTACALA METODOLOGÍA CIENTÍFICA IV Práctica 2: Determinación físico-química de suelo y agua. Objetivo general: Que el alumno aplique las técnicas, comúnmente
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO F.E.S. IZTACALA METODOLOGÍA CIENTÍFICA IV Práctica 2: Determinación físico-química de suelo y agua. Objetivo general: Que el alumno aplique las técnicas, comúnmente
TRABAJO PRÁCTICO N 2 MEDIOS DE CULTIVO SIEMBRA Y TRANSPLANTE. Lic.Soria Josè
 TRABAJO PRÁCTICO N 2 MEDIOS DE CULTIVO SIEMBRA Y TRANSPLANTE Lic.Soria Josè MEDIOS DE CULTIVO. Definición: es toda preparación artificial, sólida, semisólida o líquida que suministra al microorganismo
TRABAJO PRÁCTICO N 2 MEDIOS DE CULTIVO SIEMBRA Y TRANSPLANTE Lic.Soria Josè MEDIOS DE CULTIVO. Definición: es toda preparación artificial, sólida, semisólida o líquida que suministra al microorganismo
UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUÍMICAS. Dr. Iván Salmerón María A. Anaya Castro 4 de abril de 2011
 UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUÍMICAS Dr. Iván Salmerón María A. Anaya Castro 4 de abril de 2011 LECHE PASTEURIZADA DE VACA Leche de vaca para consumo humano, producto proveniente
UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUÍMICAS Dr. Iván Salmerón María A. Anaya Castro 4 de abril de 2011 LECHE PASTEURIZADA DE VACA Leche de vaca para consumo humano, producto proveniente
Logros. Crecimiento bacteriano. Crecimiento. Finalidad de las bacterias
 Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
Petrifilm Serie Placas para Recuento Rápido de Coliformes. Guía de Interpretación
 Guía de Interpretación Petrifilm Serie 2000 Placas para Recuento Rápido de Coliformes Esta guía sirve para familiarizarse con los resultados obtenidos en las placas Serie 2000 para Recuento Rápido de Coliformes
Guía de Interpretación Petrifilm Serie 2000 Placas para Recuento Rápido de Coliformes Esta guía sirve para familiarizarse con los resultados obtenidos en las placas Serie 2000 para Recuento Rápido de Coliformes
3M Placas Petrifilm para el Recuento de Coliformes
 M Placas Petrifilm para el Recuento de Coliformes Recomendaciones de uso Para información detallada sobre ADVERTENCIAS, PRECAUCIONES, COMPENSACIONES POR GARANTÍA / GARANTÍA LIMITADA, LIMITACIONES POR RESPONSABILIDAD
M Placas Petrifilm para el Recuento de Coliformes Recomendaciones de uso Para información detallada sobre ADVERTENCIAS, PRECAUCIONES, COMPENSACIONES POR GARANTÍA / GARANTÍA LIMITADA, LIMITACIONES POR RESPONSABILIDAD
Título de la gráfica: Crecimiento/ No crecimiento
 Resultados de la semana anterior (TSB) Título de la gráfica: # tubo TSB 1-24 Crecimiento/ No crecimiento Descripción del crecimiento Resultados de la semana anterior (TSA slant) Título de la gráfica: tubo
Resultados de la semana anterior (TSB) Título de la gráfica: # tubo TSB 1-24 Crecimiento/ No crecimiento Descripción del crecimiento Resultados de la semana anterior (TSA slant) Título de la gráfica: tubo
SECRETARIA DE COMERCIO FOMENTO INDUSTRIAL NORMA MEXICANA NMX-F ALIMENTOS - DETERMINACION DE NITRITOS EN PRODUCTOS CARNICOS METODO DE PRUEBA
 SECRETARIA DE COMERCIO Y FOMENTO INDUSTRIAL NORMA MEXICANA NMX-F-543-1992 ALIMENTOS - DETERMINACION DE NITRITOS EN PRODUCTOS CARNICOS METODO DE PRUEBA FOODS - TEST METHOD FOR NITRITES DETERMINATION IN
SECRETARIA DE COMERCIO Y FOMENTO INDUSTRIAL NORMA MEXICANA NMX-F-543-1992 ALIMENTOS - DETERMINACION DE NITRITOS EN PRODUCTOS CARNICOS METODO DE PRUEBA FOODS - TEST METHOD FOR NITRITES DETERMINATION IN
AISLAMIENTO DE MICROORGANISMOS
 PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-321-S-1978. DETERMINACIÓN DE FÉCULA POR HIDRÓLISIS ÁCIDA EN EMBUTIDOS. DETERMINATION OF STARCH IN SAUSAGES BY ACID HIDROLISIS. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración
NMX-F-321-S-1978. DETERMINACIÓN DE FÉCULA POR HIDRÓLISIS ÁCIDA EN EMBUTIDOS. DETERMINATION OF STARCH IN SAUSAGES BY ACID HIDROLISIS. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración
PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión)
 PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para
PRÁCTICA 5. Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para
SAPONIFICACIÓN: SÍNTESIS DE JABÓN
 SAPONIFICACIÓN: SÍNTESIS DE JABÓN Objetivos: 1. Preparar jabón a partir de aceite vegetal 2. Observar las propiedades del jabón al someterlo a distintas pruebas. Introducción: Las propiedades de las grasas
SAPONIFICACIÓN: SÍNTESIS DE JABÓN Objetivos: 1. Preparar jabón a partir de aceite vegetal 2. Observar las propiedades del jabón al someterlo a distintas pruebas. Introducción: Las propiedades de las grasas
MICROBIOLOGIA APLICADA Manual de Laboratorio APENDICE C PREPARACION DE SOLUCIONES Y REACTIVOS
 APENDICE C PREPARACION DE SOLUCIONES Y REACTIVOS 200 1. AGUA DE DILUCION CON SOLUCION BUFFER. Solución I Disolver 34 g de fosfato monobásico de potasio (KH 2 PO 4 ) en 500 ml de agua destilada. Ajustar
APENDICE C PREPARACION DE SOLUCIONES Y REACTIVOS 200 1. AGUA DE DILUCION CON SOLUCION BUFFER. Solución I Disolver 34 g de fosfato monobásico de potasio (KH 2 PO 4 ) en 500 ml de agua destilada. Ajustar
Petrifilm Recuento de Aerobios. Guía de Interpretación
 3 Petrifilm Recuento de Aerobios Guía de Interpretación 1 3M Petrifilm Recuento de Aerobios Recuento = 0 Es fácil interpretar la placa Petrifilm Recuento de Aerobios. La figura 2 nos muestra una placa
3 Petrifilm Recuento de Aerobios Guía de Interpretación 1 3M Petrifilm Recuento de Aerobios Recuento = 0 Es fácil interpretar la placa Petrifilm Recuento de Aerobios. La figura 2 nos muestra una placa
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON
 PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
MEDIOS DE CULTIVO. Microbiología Lic. en Biología Molecular FQBF-UNSL Marzo 2017
 MEDIOS DE CULTIVO Microbiología Lic. en Biología Molecular FQBF-UNSL Marzo 2017 PROCARIOTAS Bacterias Hongos y levaduras www.profesorenlinea.cl Cianobacterias EUCARIOTAS Protistas urbinavinos.blogspot.com
MEDIOS DE CULTIVO Microbiología Lic. en Biología Molecular FQBF-UNSL Marzo 2017 PROCARIOTAS Bacterias Hongos y levaduras www.profesorenlinea.cl Cianobacterias EUCARIOTAS Protistas urbinavinos.blogspot.com
MANUAL DE PREPARACIÓN DE REACTIVOS
 MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 5 Hoja: de MANUAL DE PREPARACIÓN DE REACTIVOS Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma F0-SGC-0 Rev.2 MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN
MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN Fecha: JUN 5 Hoja: de MANUAL DE PREPARACIÓN DE REACTIVOS Elaboró: Autorizó: Puesto QUÍMICO JEFE DE LABORATORIO Firma F0-SGC-0 Rev.2 MOP-SIB-3 DIRECCIÓN DE INVESTIGACIÓN
Géneros: Vibrio, Aeromonas y Plesiomonas
 Tema 20 Géneros: Vibrio, Aeromonas y Plesiomonas Microbiología. Nutrición y Dietética Dra Ana I. Dueñas Marzo 2009 Géneros: Vibrio, Aeromonas y Plesiomonas Características: Antes agrupados en familia Vibrionaceae
Tema 20 Géneros: Vibrio, Aeromonas y Plesiomonas Microbiología. Nutrición y Dietética Dra Ana I. Dueñas Marzo 2009 Géneros: Vibrio, Aeromonas y Plesiomonas Características: Antes agrupados en familia Vibrionaceae
DETERMINACION DE BACTERIAS COLIFORMES: COLIMETRIA
 DETERMINACION DE BACTERIAS COLIFORMES: COLIMETRIA En esta práctica, vamos a centrarnos en determinar las bacterias coliformes presentes en un agua mediante el Método de los tubos múltiples ó colimetria
DETERMINACION DE BACTERIAS COLIFORMES: COLIMETRIA En esta práctica, vamos a centrarnos en determinar las bacterias coliformes presentes en un agua mediante el Método de los tubos múltiples ó colimetria
Placas Petrifilm. para Recuento de Enterobacterias. Guía de interpretación
 Placas Petrifilm para Recuento de Enterobacterias Guía de interpretación Esta guía lo familiarizará con los resultados de las Placas Petrifilm de 3M para Recuento de Enterobacterias (Familia Enterobacteriaceae).
Placas Petrifilm para Recuento de Enterobacterias Guía de interpretación Esta guía lo familiarizará con los resultados de las Placas Petrifilm de 3M para Recuento de Enterobacterias (Familia Enterobacteriaceae).
PROCEDIMIENTO PARA DETERMINAR NMP DE E. coli EN MOLUSCOS BIVALVOS ENFRIADOS Y CONGELADOS. METODO LST-MUG
 PRT-712.02-011 Página 1 de 7 1. OBJETIVO Determinar presuntivamente E coli dentro de 24 h en caldo. 2. CAMPO DE APLICACIÓN Y ALCANCE Se aplica a muestras de moluscos bivalvos enfriados y congelados. 3.
PRT-712.02-011 Página 1 de 7 1. OBJETIVO Determinar presuntivamente E coli dentro de 24 h en caldo. 2. CAMPO DE APLICACIÓN Y ALCANCE Se aplica a muestras de moluscos bivalvos enfriados y congelados. 3.
Cepas bacterianas: cepas de bactérias bacilares Gram negativas
 IDENTIFICACION DE ENTEROBACTERIAS Martha Murcia Aranguren INTRODUCCIÓN Las pruebas bioquímicas se basan en la determinación de la presencia o ausencia de diferentes enzimas codificadas por el material
IDENTIFICACION DE ENTEROBACTERIAS Martha Murcia Aranguren INTRODUCCIÓN Las pruebas bioquímicas se basan en la determinación de la presencia o ausencia de diferentes enzimas codificadas por el material
LABORATORIO DE MICROBIOLOGÍA EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote
 Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
RepublicofEcuador EDICTOFGOVERNMENT±
 RepublicofEcuador EDICTOFGOVERNMENT± Inordertopromotepubliceducationandpublicsafety,equaljusticeforal, abeterinformedcitizenry,theruleoflaw,worldtradeandworldpeace, thislegaldocumentisherebymadeavailableonanoncommercialbasis,asit
RepublicofEcuador EDICTOFGOVERNMENT± Inordertopromotepubliceducationandpublicsafety,equaljusticeforal, abeterinformedcitizenry,theruleoflaw,worldtradeandworldpeace, thislegaldocumentisherebymadeavailableonanoncommercialbasis,asit
Laboratorio de Introducción a la Microbiología. Practico N 5
 Laboratorio de Introducción a la Microbiología Practico N 5 PRUEBAS BIOQUIMICAS y AISLAMIENTO Los microorganismos pueden ser separados e identificados de acuerdo a una gran variedad de razones, tales como:
Laboratorio de Introducción a la Microbiología Practico N 5 PRUEBAS BIOQUIMICAS y AISLAMIENTO Los microorganismos pueden ser separados e identificados de acuerdo a una gran variedad de razones, tales como:
Pruebas Bioquímicas E + S ES E + P
 Pruebas Bioquímicas Determinan la actividad metabólica de una cepa pura. Son empleadas principalmente la identificación y clasificación de bacterias y hongos. Pruebas Bioquímicas E + S ES E + P Se pueden
Pruebas Bioquímicas Determinan la actividad metabólica de una cepa pura. Son empleadas principalmente la identificación y clasificación de bacterias y hongos. Pruebas Bioquímicas E + S ES E + P Se pueden
Placas Petrifilm de Alta Sensibilidad para Recuento de Coliformes
 Guía de interpretación Placas Petrifilm de Alta Sensibilidad para Recuento de Coliformes Esta guía lo familiarizará con los resultados de las Placas Petrifilm de 3M de Alta Sensibilidad para Recuento de
Guía de interpretación Placas Petrifilm de Alta Sensibilidad para Recuento de Coliformes Esta guía lo familiarizará con los resultados de las Placas Petrifilm de 3M de Alta Sensibilidad para Recuento de
Análisis microbiológico de una muestra de orina
 Análisis microbiológico de una muestra de orina El propósito del análisis microbiológico de una muestra de orina es en primer lugar determinar si existe una infección y, si existe, identificar el microorganismo
Análisis microbiológico de una muestra de orina El propósito del análisis microbiológico de una muestra de orina es en primer lugar determinar si existe una infección y, si existe, identificar el microorganismo
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-219-1972. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE LACTOSA EN LECHE. TEST METHOD FOR DETERMINATION OF LACTOSE IN MILK. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. 1. ALCANCE RECOPILADO POR: EL
NMX-F-219-1972. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE LACTOSA EN LECHE. TEST METHOD FOR DETERMINATION OF LACTOSE IN MILK. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. 1. ALCANCE RECOPILADO POR: EL
1. OBJETIVO Detectar enterotoxina A de C. perfringens por método de aglutinación pasiva en látex en cepas aisladas de alimentos
 PRT-712.04-080 Página 1 de 9 1. OBJETIVO Detectar enterotoxina A de C. perfringens por método de aglutinación pasiva en látex en cepas aisladas de alimentos 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este
PRT-712.04-080 Página 1 de 9 1. OBJETIVO Detectar enterotoxina A de C. perfringens por método de aglutinación pasiva en látex en cepas aisladas de alimentos 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este
Universidad Nacional de Ingeniería UNI Norte. Métodos de detección de contaminación microbiana
 Universidad Nacional de Ingeniería UNI Norte Curso: Un enfoque práctico para la inocuidad de los alimentos Métodos de detección de contaminación microbiana iciar el explorador Internet Explorer.lnk Facilitadoras
Universidad Nacional de Ingeniería UNI Norte Curso: Un enfoque práctico para la inocuidad de los alimentos Métodos de detección de contaminación microbiana iciar el explorador Internet Explorer.lnk Facilitadoras
Guía de laboratorio: Reconocimiento de moléculas orgánicas.
 Departamento de Ciencias / Biología Primeros medios Prof. Daniela Gutiérrez G. Instrucciones generales: Guía de laboratorio: Reconocimiento de moléculas orgánicas. - Lean con detención cada una de las
Departamento de Ciencias / Biología Primeros medios Prof. Daniela Gutiérrez G. Instrucciones generales: Guía de laboratorio: Reconocimiento de moléculas orgánicas. - Lean con detención cada una de las
Recuento de bacterias heterótrofas totales (PCA)
 Recuento de bacterias heterótrofas totales (PCA) a. Medios de cultivo Agar recuento en placa (PCA) Triptosa Glucosa Extracto de levadura Agar-Agar H2O destilada 5 g 1 g 2.5 g 15 g 1 l b. Preparacion del
Recuento de bacterias heterótrofas totales (PCA) a. Medios de cultivo Agar recuento en placa (PCA) Triptosa Glucosa Extracto de levadura Agar-Agar H2O destilada 5 g 1 g 2.5 g 15 g 1 l b. Preparacion del
Objetivo 1 Comprender las propiedades fisiológicas de las bacterias que explican su capacidad de producir daño en el hospedero
 Facultad de Medicina Universidad de Chile Fisiología Bases del diagnóstico Dra. M.Angélica Martínez Tagle Programa de Microbiología, ICBM Objetivo 1 Comprender las propiedades fisiológicas de las bacterias
Facultad de Medicina Universidad de Chile Fisiología Bases del diagnóstico Dra. M.Angélica Martínez Tagle Programa de Microbiología, ICBM Objetivo 1 Comprender las propiedades fisiológicas de las bacterias
Trabajo Práctico Nº 5
 Introducción Objetivo Procedimiento Resultados Trabajo Práctico Nº 5 INFLUENCIA DE LAS CONDICIONES AM- BIENTALES EN EL CRECIMIENTO MICRO- BIANO Conclusiones Bibliografía INTRODUCCIÓN Las diferentes especies
Introducción Objetivo Procedimiento Resultados Trabajo Práctico Nº 5 INFLUENCIA DE LAS CONDICIONES AM- BIENTALES EN EL CRECIMIENTO MICRO- BIANO Conclusiones Bibliografía INTRODUCCIÓN Las diferentes especies
USO: MEDIO ENRIQUECIDO QUE PERMITE EL CRECIMIENTO DE MICROORGANISMOS EXIGENTES COMO HAEMOPHILUS, NEISSERIA Y LISTERIA.
 AGAR CHOCOLATE SUPLEMENTADO USO: MEDIO ENRIQUECIDO QUE PERMITE EL CRECIMIENTO DE MICROORGANISMOS EXIGENTES COMO HAEMOPHILUS, NEISSERIA Y LISTERIA. AGAR 10.0 g FOSFATO DIPOTASICO ALMIDON DE 1.0 g FOSFATO
AGAR CHOCOLATE SUPLEMENTADO USO: MEDIO ENRIQUECIDO QUE PERMITE EL CRECIMIENTO DE MICROORGANISMOS EXIGENTES COMO HAEMOPHILUS, NEISSERIA Y LISTERIA. AGAR 10.0 g FOSFATO DIPOTASICO ALMIDON DE 1.0 g FOSFATO
PROCEDIMIENTO DE METODO CUALITATIVO DE DETECCION DE SHIGELLA SPP EN MATRIZ AGUA
 PRT-712.02-065 Página 1 de 5 1. OBJETIVO Detectar en forma cualitativa la presencia de Shigella spp en muestras de aguas. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento es aplicable a las muestras
PRT-712.02-065 Página 1 de 5 1. OBJETIVO Detectar en forma cualitativa la presencia de Shigella spp en muestras de aguas. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento es aplicable a las muestras
LABORATORIO GRUPO 16
 Química Inorgánica Laboratorio Grupo 16 1 LABORATORIO GRUPO 16 A) DESCOMPOSICIÓN DEL AGUA OXIGENADA Materiales: balanza granataria, tubos de ensayos,... Reactivos: agua oxigenada de 10 vol, dióxido de
Química Inorgánica Laboratorio Grupo 16 1 LABORATORIO GRUPO 16 A) DESCOMPOSICIÓN DEL AGUA OXIGENADA Materiales: balanza granataria, tubos de ensayos,... Reactivos: agua oxigenada de 10 vol, dióxido de
Lab # 7: Respiración. Biol 3013 Dra. Gladys M. Varela Modificado por: Dra. O. Hernández-Vale
 Lab # 7: Respiración Biol 3013 Dra. Gladys M. Varela Modificado por: Dra. O. Hernández-Vale Objetivos Describir los procesos de respiración aeróbica y anaeróbica Describir acción de levadura sobre diferentes
Lab # 7: Respiración Biol 3013 Dra. Gladys M. Varela Modificado por: Dra. O. Hernández-Vale Objetivos Describir los procesos de respiración aeróbica y anaeróbica Describir acción de levadura sobre diferentes
4B Reacciones de Sustitución Electrofílica Aromática. Yodación de la Vainillina.
 PRÁCTICA 4B Reacciones de Sustitución Electrofílica Aromática. Yodación de la Vainillina. I. OBJETIVOS. a) Llevar a cabo la yodación de la vainillina para ejemplificar una reacción de sustitución electrofílica
PRÁCTICA 4B Reacciones de Sustitución Electrofílica Aromática. Yodación de la Vainillina. I. OBJETIVOS. a) Llevar a cabo la yodación de la vainillina para ejemplificar una reacción de sustitución electrofílica
