TEMA:HIBRIDACIÓN in situ
|
|
|
- Miguel Sevilla Prado
- hace 8 años
- Vistas:
Transcripción
1 UNIVERSIDAD NACINAL AUTÓNMA DE MÉXIC INSTITUT DE BITECNLGÍA PRGRAMA DE PSGRAD EN CIENCIAS BIQUÍMICAS EVALUACIÓN FINAL CURS DE MÉTDS CRDINADR DEL CURS: DR. RBERT STCK ALUMNA: BLANCA RAMS CERRILL TEMA:HIBRIDACIÓN in situ 1
2 ÍNDICE I. Introducción 1 II. Breve historia 1 III. Pasos y consideraciones de la hibridación in situ 2 IV. Preparación de la sonda 4 a) Diseño de sondas 5 b) Tipo de sonda y método de síntesis 5 c) Elección de la sonda 6 d) Tamaño de la sonda 6 e) Estabilidad de la sonda 7 f) Sondas de doble cadena contra las de cadena sencilla 7 V. Marcaje 7 a) ( 3 H) Tritio 7 b) 35 S 8 c) 32 P 8 d) 33 P 8 e) Marcaje con digoxigenina 8 f) Marcaje con biotina 9 g) Marcaje fluorescente de ácidos nucléicos 11 h) Métodos de marcaje para: i) DNA 12 ii) RNA 13 iii) ligonucleótidos 13 VI. Preparación de tejidos 14 a) Fijación 14 b) Tejido embebido y su seccionamiento 15 VII. Tratamiento de la laminilla 15 VIII. Pretratamiento del tejido 16 a) Tratamiento con solventes orgánicos 16 b) Tratamiento con proteasas para facilitar 16 la accesibilidad al RNA de interés c) Inactivación endógena enzimática 17 d) Tratamiento con RNasas 17 e) Tratamiento con HCL 17 f) Tratamiento con detergentes 17 2
3 g) Impedimento de enlaces 17 h) Pre-hibridación 17 i) Blancos del DNA 17 IX. Pre-hibridación y desnaturalización de la sonda y su blanco 18 X. Hibridación 18 a) Largo de la sonda 20 b) Composición de la sonda 20 c) Identidad 20 d) Composición de la solución de lavados de la hibridación 20 e) Desnaturalización del DNA 21 f) ph 21 g) Temperatura 21 XI. Lavados post-hibridación 23 XII. Detección 23 a) Sondas radioactivas 23 i) Grados de la emulsión 24 ii) Espesor de la emulsión 24 iii) Almacenamiento y vida media de la emulsión 24 iv) Condiciones de exposición 24 v) Tiempo de exposición 24 vi) Condiciones para revelarla 24 b) Sondas marcadas con haptenos 24 XIII. Técnicas de doble tinción 25 XIV. Controles 26 a) Hibridación cruzada con secuencias de 26 ácidos nucléicos inespecíficos b) Enlaces inespecíficos 26 c) Generación inespecífica de la señal 27 d) Ruido de fondo sobre tejidos específicos 27 e) Ruido de fondo de sondas marcadas con haptenos 27 XV. Fotografía 28 XVI. Microscopía 28 a) De campo claro 28 b) De campo oscuro 29 c) De contraste de fases 29 d) Microscopía de contraste de reflexión 29 e) De fluorescencia 29 3
4 f) Imágenes digitales 29 g) Microscopía electrónica 29 h) Flujo citométrico 29 XVII. Algunas otra técnicas: PRINS 30 a) Principios y métodos de in situ PCR 30 b) Amplificación in situ 30 c) Detección de productos de PCR en la célula 30 d) Eficiencia de PCR in situ 31 e) PCR in situ tiene una gran número de aplicaciones en diagnóstico 31 f) Controles para PCR in situ 32 XIX. Comparación de las técnicas de hibridación in situ 34 4
5 Abreviaturas A AP BCIP Bio BrdU C cdna DAB DAPI DEPC DIG DMS DNasa dsdna DTT EDTA FISH FITC FLU G mrna NTB PBS PCR PFA RNasa snrna snorna ssdna STS T TBE TBS TE TEMED TESPA T m T r trna U UV Adenina Fosfatasa alcalina 5-bromo-4cloro-3-indolil fosfato biotina 5-bromo-4-cloro-3-indolid fosfato citosina DNA complementario diaminobenzidina 4,6-diamino-2-fenilindole dietilpirocarbonato digoxigenina dimetilsufóxido deoxiribonucleasa doble cadena de DNA ditiotreitol ácido etilenoadiaminotretacético fluorescence in situ hybridization Fluorescencia in situ Fluoresceína Guanina mrna 4-nitroblue-tretrazolium chloride buffer fosfato salino reacción en cadena de la polimerasa paraformaldheído ribonucleasa small nuclear RNA small nucleolar RNA cadena sencilla de DNA sitio de pegado de la secuencia timina tris-borato-edta tris buffer salino tris-edta tetrametilenediamina 3-aminopropiltrietoxisilina Temperatura de fusión Temperatura de reasociaión RNA de transferencia uracilo luz ultravioleta 5
6 Índice de tablas y figuras Pág. Figura 1. Principios de la hibridación in situ 1 Figura 2. Diagrama de flujo de la hibridación in situ 3 Figura 3. Estructura química de la digoxigenina 8 Figura 4. Estructura química de la biotina 9 Tabla 1. Ventajas y desventajas de sistemas de marcaje 11 Figura 5. Estructura química de la fluoresceína 12 Tabla 2. Ventajas y desventajas entre la sondas de hibridación 20 Tabla 3. Aplicaciones de la hibridación in situ 32 Tabla 4. Controles requeridos para experimentos de hibridación 33 I. Introducción. Hibridación in situ es una técnica que detecta secuencias de ácidos nucleicos en células, cromosomas o tejidos preservados. La detección in situ provee una visualización directa de la localización espacial de secuencias específicas que es crucial para dilucidar la organización y función génica, por lo que el método de hibridación in situ se ha convertido en una técnica importante en diversos campos, incluyendo diagnóstico de rearreglos cromosomales, detección de infecciones virales y análisis de la función génica durante el desarrollo embrionario. La hibridación in situ toma como fundamento la complementaridad de los ácidos nucléicos, la cual puede ser DNA y/o RNA, a través de puentes de hidrógeno formados entre las bases: adenina timina (DNA) o uracilo (RNA) y citosina-guanina (DNA y RNA). Este apareamiento da lugar a una doble cadena en la cual una cadena, tiene la orientación opuesta a la otra con respecto al esqueleto azúcar-fosfato. La secuencia es leída de 5' a 3'. Secuencia DNA RNA 5' TGATCCGTTA 3' 5' UGAUCCGUUA 3' 3' ACTAGGCAAT 5' Transcripción 6
7 Figura 1. Principios de la hibridación in situ. La relación entre la doble cadena de DNA y su transcrito a RNA. El DNA genómico consiste de dos cadenas complementarias, A aparea con T y G con C en orientación opuesta (5' a 3' y 3' a 5'). La transcripción usa la cadena líder como templado y genera una secuencia idéntica de RNA. II. Breve historia La técnica fue desarrollada en 1969 por Gall y Pardue e independientemente por Jonh et al., en el mismo año. Gall y colaboradores describieron una técnica que formaba híbridos moleculares entre RNA y DNA. La técnica se llevó a cabo en ovocitos de Xenopus laevis, hibridando rrna con rdna extracromosomal. Detectaron la localización diferencial en las células, de los híbridos de ácidos nucléicos ha distintos estadíos. En ese momento la única forma de marcaje eran los radioisótopos, por lo que se usó tritio para el experimento y la forma de detección fue por autoradiografía. Demostraron que en ciertas partes como tejido conectivo, la técnica no era suficientemente sensible para mostrar las cantidades pequeñas de rdna en un genoma. Esto lo llevaron a cabo exponiendo las preparaciones por periodos más allá de dos meses. Evaluaron variables de la técnica que afectan el rendimiento de la hibridación, haciéndo hincapié en un paso fundamental que se debe llevar a cabo para realizar la técnica: la desnaturalización. Plantearon que el híbrido puede reabsorberse en el soporte que utilizaron (agar) y esto puede fungir como impedimento para que se lleve a cabo la reacción. Finalmente propusieron mejorar la técnica, pese a las limitaciones de ese momento, incrementando el rendimiento con el uso de RNA sintetizado in vitro, es decir preparándolo enzimáticamente, usando como templado el rdna satélite de Xenopus. Además el clonaje molecular no era posible en ese tiempo y la hibridación in situ se restringió a aquellas secuencias que pudieran ser purificadas y aisladas por métodos bioquímicos y resolver problemas como localización citológica del DNA. Vale la pena resaltar que estos experimentos arrojaron información valiosa que contribuyó a perfeccionar la técnica y poderla aplicar en varios campos. El clonaje molecular de ácidos nucleicos y el mejoramiento de las técnicas de marcaje radioactivo han cambiado el panorama dramáticamente. Por ejemplo Harper et al., en 1981 detectó en cromosomas metafásicos el gen de la insulina. El método de detección fue la autorradiografía. En 1985 Coghlan sintetizó oligonucleótidos marcados radioactivamente para detección. Este mismo investigador en 1986 detectó citológicamente un bajo número de copias de mrnas. La alta sensibilidad que provee la prueba (de 20 a 50 copias de secuencias blanco/célula), así como el rango tan grande de aplicaciones dió pie a que muchos laboratorios adoptaran la técnica; aunque uno de los principales 2
8 problemas que enfrentaba la hibridación in situ era el tipo de marcaje (radioactivo) y el tiempo requerido para la detección (autorradiografía). Con el tiempo ésto fue cambiando, desarrollando otro tipo de marcaje de los ácidos nucleicos dejando de lado al mayor impedimento para la aplicación general de la hibridación in situ, lo cual abrió nuevas oportunidades para emplear distintos marcajes en un experimento. La estrategia actual es utilizar un sistema de detección con anticuerpos aumentando la accesibilidad de la prueba. III. Pasos y consideraciones para la hibridación in situ. La técnica involucra: a) Generación de ácidos nucleicos marcados para una detección subsecuente. b) Fijación de tejidos (seccionados), preparación de cromosomas. c) Preparación del tejido para incrementar el acceso del ácido nucleico marcado. d) Hibridación de la sonda marcada en cromosomas o tejidos. e) Lavados selectivos que remuevan las sondas que no hibridan. 3
9 f) Detección de la sonda marcada, revelando la localización celular de los ácidos nucleicos. Preparación de laminillas - tratamiento con gelatina o poli-l-lisina -siliconización Fijación del material en la laminilla - por precipitación (etanol) Por entrecruzamiento (formaldheído) Pretratamiento del tejido (opcional) a) tratamientos que previenen el ruido Inactivación endógena de la enzima Tratamiento con RNasas b) Permeabilización Ácidos diluídos Detergente/alcohol Proteasas Prehibridación (opcional) Incubación de la muestra con una solución pre-hibridación, a la misma temperatura que la hibridación Desnaturalización de la sonda y su Blanco ph o calor Desnaturalizqación simultánea o separada de la sonda y su blanco (si es doble cadena) Sonda a) Elección de la sonda ds: DNA, cdna ss: RNA, oligonucleótidos ss-dna b) Preparación de la sonda Aislamiento de fragmentos de DNA (opcional) cdna: clonaje RNA: clonaje y transcripción en vectores ligonucleótidos: síntesis química c) Marcaje de la sonda Ds DNA: random primed, nick translation, PCR RNA: transcripción in vitro, RT-PCR ligonucleótidos marcados Hibridación Componentes de la solución Ácidos nucléicos heterólogos Fosfato de sodio, EDTA, SDS, sales Formamida Dextrán sulfato Pasos post-hibridación Tratamiento con nucleasas (opcional) Lavados astringentes Determinación de las condiciones de hibridación Determinación de la temperatura de hibridación, ph, uso de formamida, concentración de sales Composición de la solución de hibridación Concentración de la sonda Microscopía de fluorescencia por sondas directamente marcadas con un fluorocromo Detección inmunológica Bloqueo Incubación con anticuerpos Micrsocopía de fluorescencia o sustratos colorimétricos Montaje Micrsocopía, análisis de resultados Evaluación Determinación de la especificidad en la hibridación (controles) Tratamiento con nucleasas Uso de sondas múltiples Uso de vectores o ácidos nulceicos heterólogos Figura 2. Diagrama de flujo de la hibridación in situ. Este método puede ser combinado con PCR para amplificar las secuencias de pegado y aumentar la detección de la señal. Un aspecto crítico en éste método es que los ácidos nucleicos que están retenidos in situ no deben de ser degradados por nucleasas, para que sea posible la hibridación de la sonda. Actualmente existen varias alternativas para elegir el tipo de sonda y los métodos de marcaje y detección. 4
10 Las alternativas mayormente usadas son: a) Sondas de RNA, sondas de DNA (cadena doble o sencillo) u oligonucleótidos b) Marcas radioactivas o haptenos c) Marcajes directos e indirectos La detección del método depende de lo que se requiera: a) Sensibilidad. Depende del fácil acceso que tenga la sonda marcada, la cantidad y tipo de marca incluída en la sonda y el método de detección. b) Resolución. La resolución de la señal puede variar de sitios específicos en una célula, lo cual depende de la sonda marcada y del método de detección. c) Especificidad. La especificidad de la señal depende de la selectividad del lavado y de secuencias similares que interfieran en el pegado de la sonda. d) Análisis de secciones celulares o de tejidos montados en laminillas o secciones de tejidos que se encuentren en solución, tejidos enteros o embriones. e) Detección múltiple de genes o productos génicos. La relación física entre genes o regiones cromosomales pueden ser visualizadas por el uso de distintas marcas fluorescentes para la detección simultánea de distintos productos génicos en una célula o tejido. f) Programas computacionales. Estos pueden ayudar a la visualización de modelos espaciales de transcritos en un tejido o embrión. Se pueden llevar a cabo modelos tridimensionales. g) Conveniencia y seguridad. Las marcas no radioactivas son más estables, seguras y rápidas. IV. Preparación de la sonda. Para sondas de cadena sencilla, se debe usar la secuencia reversa complementaria. Cuando las sondas son sintetizadas por transcripción, involucra generar mrna del gen endógeno. Cuando se diseñan los oligos marcados, es importante recordar que la secuencia antisentido es la hebra complementaria reversa de la cadena líder y debe ser leída de 5 a 3. En general es preferible usar sondas específicas, ya que esto garantiza una buena hibridación. Existen situaciones en las cuales esto no puede llevarse a cabo, por ejemplo, si los genes todavía no están clonados de las especies 5
11 usadas para la hibridación o si la secuenica génica es muy similar entre especies. Esto puede favorecer una hibridación entrecruzada. Para evitar ésto, se requiere una alta selectividad que reduzca la presencia de bases mal apareadas, aumentando de esta manera la especificidad. Si los modelos de expresión son los mismos, como se pueden ver con una sonda homóloga, es un experimento alentador, aunque no prueba la especificidad. Ésto puede ser probado por un Northern o un Southern-blot. La hibridación entrecruzada provee información preliminar muy valiosa. a) El diseño de sondas se resume en los siguientes puntos: i) La hibridación entrecruzada utiliza sondas largas (>100 pb) usadas bajo condiciones selectivas especialmente después de la digestión con nucleasas, ya que una sonda además de homóloga, debe ser lo suficientemente amplia para llevar a cabo la hibridación. ii) Para sondas pequeñas (oligonucleótidos de pb) es muy probable que algún gen distinto al de interés tenga una secuencia idéntica. Alternativamente se puede hacer un screening y éste puede ser realizado por búsqueda de secuencias en bases de datos. iii) Los mrna poseen las secuencias poli(t) y poli(u), al transcribirse a cdna se evita que la sonda no incluya esta cola, porque secuencias largas, ricas en GC dan una gran estabilidad a la sonda por los triples enlaces que se forman entre estas bases. Se necesitan dos elecciones más para la preparación de la sonda: el tipo de ácidos nucleicos y la marca que se incorpora en la sonda. Algunos métodos alternativos están disponibles para la síntesis de la sonda. b) Tipo de sonda y método de síntesis. Distintos tipos de sondas de ácidos nucleicos pueden ser utilizadas para la hibridación in situ: i) Sondas de DNA doble cadena. Pueden ser preparadas utilizando técnicas como nick translation, random priming o PCR, en las cuales el nucleótido marcado es incorporado. PCR y random priming proporcionan una buena actividad específica. Estas sondas pueden ser desnaturalizadas antes de usar. Cuando se usan para detectar una cadena simple como mrna, estas son menos sensibles debido a que la concentración de la sonda marcada es reducida. ii) Sondas de DNA de cadena simple (largas). Pueden ser preparadas utilizando primer extension en templados de cadena simple o por PCR con un nucleótido marcado. Éste último es el más usado porque es más fácil de llevar a cabo y las marcas pueden sintetizarse con poca cantidad de material. El PCR permite una gran flexibilidad en la elección de las secuencias marcadas por el uso de primers. Estas marcas han sido ampliamente usadas. iii) ligonucleótidos (entre 20 y 40 bases). Son marcados incorporando oligonucleótidos modificados durante la síntesis química o adicionando una cola marcada. Una de las desventajas es que algunos oligonucleótidos marcados no se incorporan y por tanto la sensibilidad disminuye. 6
12 iv) Sondas de RNA de cadena sencilla. Pueden ser sintetizadas por el uso de una RNA polimerasa (SP6, T7 o T3 RNA polimerasa). La secuencia de la sonda es clonada en un vector que flanqueará dos sitios distintos de iniciación. La cadena de RNA antisentido (sonda) es sintetizada en dirección opuesta al gen endógeno. Se recomienda linearizar la sonda de RNA con enzimas que dejen el extremo 5 cohesivo, por que se ha reportado, que el extremo 3 romo promueve la síntesis de transcritos anormales. c) Elección de la sonda. Las sondas largas de cadena simple (RNA o DNA) proporcionan una alta sensibilidad en la detección de cadena sencilla. Los oligonucleótidos son muy sensibles y la señal puede ser incrementada por el uso de un cocktail de sondas que flanquearán en regiones distintas. Para estudios de mrnas estrechamente relacionados, las sondas específicas, pueden ser obtenidas por síntesis de oligonucleótidos. Se diseñan primers que serán usados para la amplificación del fragmento deseado de DNA en el PCR. Estos fragmentos pueden ser clonados y usados para sintetizar cadenas dobles o sencillas de DNA o RNA. Alternativamente, para el caso de sondas de RNA, pueden ser marcadas directamente sin clonación incluyendo el primer marcado en el sitio de iniciación de la RNA polimerasa. Finalmente las sondas de DNA de doble cadena son recomendadas para blancos de doble cadena y esto puede ser suficientemente sensible para detectar abundancia de cadena sencilla. d) Tamaño de la sonda. Las sondas largas pueden emitir una señal más fuerte debido a que incorporan mayor número de nucleótidos marcados dentro de ella. Sin embargo, las sondas que son tan largas dan señales débiles, debido a que la sonda penetra menos eficientemente en el tejido. La mejor estrategia es usar una secuencia larga como templado para la síntesis de la sonda pero asegurar que la sonda generada es lo suficientemente pequeña para poder penetrar. Muchos procedimientos están basados en que la sonda de bases porque emiten señales óptimas para la hibridación en secciones de ciertos tejidos (Cox, 1984.). Se ha encontrado que las sondas de RNA que miden por arriba de 1 kb proveen señales óptimas para la hibridación in situ, en embriones fijados en paraformaldheído. La penetración está influenciada por el tamaño de la sonda aunque también depende de la naturaleza del tejido, de la forma de fijación y si el pretratamiento ha sido realizado para remover las proteínas celulares. El tamaño de la sonda puede ser controlado durante la reacción de síntesis: i) Sondas de DNA, sintetizadas por nick translation, el largo está determinado por la cantidad de DNasa en la reacción. ii) Sondas marcadas por random priming el tamaño está determinado por la concentración del primer. 7
13 iii) Primers que puedan ser elegidos para deteminar el tamaño de la sonda sintetizada por PCR. iv) Sondas largas de DNA pueden ser cortadas parcialmente por incubación a altas temperaturas. v) Sondas largas de RNA son parcialmente cortadas por hidrólisis alcalina limitada. Si el tamaño de la sonda es cortada por hidrólisis hay que revisar el tamaño de la sonda, porque si ésta es muy pequeña, ésta no hibridará bajo condiciones selectivas standard, dando una baja señal. e) Estabilidad de la sonda y la interacción con su blanco. En experimentos de hibridación los puentes entra la sonda y la secuencia blanco juega un rol importante. El largo decrementa la estabilidad en el siguiente orden RNA-RNA, DNA-RNA, DNA-DNA (Wetmur et al., 1986). La estabilidad de los híbridos está influenciada por las condiciones de hibridación, por la concentración de formamida, sales y la temperatura. f) Sondas de doble cadena contra cadena sencilla. Un número de reacciones competentes ocurren durante la hibridación in situ con sondas de doble cadena. Las sondas de cadena sencilla proveen las siguientes ventajas: i) La sonda no se agota porque no se autoliga. ii) No son cadenas largas porque deben penetrar en la sección de tejido o en los cromosomas. Con DNA-DNA la renaturalización in situ de secuencias blanco se lleva a cabo eficientemente porque los híbridos tienen una estabilidad térmica similar. La renaturalización in situ de DNA puede ser impedida por el uso de sondas de RNA de cadena sencilla. Los híbridos DNA-RNA son más estables térmicamente que los híbridos DNA-DNA. Las condiciones de hibridación pueden ser diseñadas de tal manera que la formación del híbrido DNA-DNA no sea favorecido, pero el híbrido DNA-RNA sí. V. MARCAJE Existen dos alternativas para que el marcaje sea incorporado dentro de la sonda: el marcaje radioactivo que es detectado por autorradiografía, o por haptenos (no radioactivo) el cual es detectado directa o indirectamente por inmunocitoquímica. Sistemas Isotópicos No isotópicos radioactividad no radioactivos directos Indirectos Los sistemas isotópicos ofrecen una alta sensibilidad, particularmente con tritio, así como alta resolución. Por otro lado el empleo de radiosiótopos 8
14 requieren licencia especial. El método de detección (autorradiografía) requiere un tiempo de exposición de semanas. Algunos isótopos han sido usado para marcajes radiocativos en la hibridación in situ, que difieren en cuanto a la resolución de la señal, la velocidad en obtención de resultados y la estabilidad de la sonda. a) 3 H - proporciona una señal a nivel subcelular pero requiere largas exposiciones autorradiográficas. b) 35 S proporciona resolución de un diámetro celular, con tiempos de exposición de una semana. Agentes reductores como el ditiotreitol (DTT) pueden ser incluídos en la solución que contenga 35 S para proteger al azufre de la oxidación. La vida media de este isótopo es de 87 días y la marca debe ser usada en un mes aproximadamente. c) 32 P da una resolución menor que el 35 S y además proporciona una baja eficiencia en la autorradiografía, ofrece una pequeña ventaja en cuanto a la velocidad de obtención de resultados. Posee una vida media de 14 días. d) 33 P da una resolución similar a 35 S, pero éste tiene una vida media más corta (25 días) y el costo es mayor. Con el uso de sondas radioactivas es posible hacer un método cuantitativo. Existen dos tipos de sistemas no isotópicos para la prueba de hibridación: directo e indirecto. En el primero, la molécula detectable (reportera) es enlazada directamente al ácido nucléico y este híbrido puede ser visualizado en el microscópio inmediatamente después de la reacción de hibridación. El paso limitante en éste método es que el híbrido subsista a las condiciones de lavado. Lo más importante, además, es que la molécula reportera no interfiera con la hibridación. El marcaje con un fluorocromo en pruebas de RNA desarrollada por Bauman et al., 1980, 1984, y el marcaje directo de ácidos nucleicos con enzimas, descrito por Renz y Kurz, 1984, siguen este criterio. Los métodos indirectos requieren una marca que contenga la molécula reportera, introducida química o enzimáticamente, que pueda ser detectada por afinidad citoquímica. En este método al igual que el anterior, el marcaje no debe interferir con la hibridación, ya que la molécula reportera debe estar accesible a los anticuerpos que la detecten. Se han descrito un sin número de modificaciones a haptenos (Langer et al., 1981) y uno de los sistemas más populares es el sistema DIG (digoxigenina) el cual será descrito posteriormente. Tiempo atrás se decribió la síntesis química de oligonucleótidos conteniendo grupos funcionales (grupos sulfhidrilos, aminas primarias alifáticas). Con esto se pudo hacer reaccionar haptenos, fluorocromos o enzimas que producen un marcaje estable, el cual se utilizó para la hibridación in situ (Agrawal et al., 1986). 9
15 e) Marcaje con digoxigenina (DIG) El método de marcaje con DIG está basado en un esteroide aislado de las plantas Digitalis purpurea y Digitalis lanata. Las hojas y flores de estas plantas son la única fuente natural de digoxigenina. H CH3 CH3 H P P P HN N N H H N H H R2 R1 Figura 3. Digoxigenina-UTP/dUTP/DDUTP, alcali-estable. Digoxigenina-UTP (R1=H, R2=H). Digoxigenina-dUTP (R1=H, R2=H) y Digoxigenina-ddUTP (R1=H, R2=H). La digoxigenina se enlaza en la posición C5 de la uridina mediante un brazo que contiene 11 átomos de carbono. Los nucleótidos marcados con DIG pueden ser incorporados a las sondas de ácidos nucleicos por DNA polimerasas (E. coli DNA polimerasa I, T4 DNA polimerasa, T7 DNA polimerasa, reverso transcritptasa y Taq DNA polimerasa), al igual que RNA polimerasas (SP6, T3 T7 RNA polimerasa) y transferencia terminal. Los ácidos nucleicos pueden ser marcados químicamente con DIG-NHS ester o con DIG Chem-Link. Las sondas DIG-marcadas pueden ser detectadas con una alta especificidad por anticuerpos anti-digoxigenina (Anti-DIG) que son conjugados a fosfatasa alcalina, peroxidasa, fluoresceína, rodamina u oro coloidal. Alternativamente, anticuerpos anti-digoxigenina primarios y secundarios pueden ser usados. La sensibilidad de la detección depende del método usado para visualizar los anticuerpos anti-dig conjugados. Cuando un anti-dig conjugado a fosfatasa alcalina es visualizado por colorimetría (NTB y BCIP o 5 bromo, 4 cloro, 3- indolidfosfato nitro azul) o sustraros fluorescentes (HNPP), la sensibilidad de la detección es aproximadamente de 0.1 pg. Las mezclas marcada contenidas en los kits de marcaje con DIG relacionan a la uridina marcada con DIG a dttp la cual produce una marca de hibridación altamente sensible. Esta relación produce una incorporación de 20 a 25 nucleótidos marcados con DIG al DNA. f) Marcaje con biotina El marcaje de ácidos nucleicos con biotina-dutp (Figura 4) fue desarrollado por David Ward y colaboradores en la Universidad de Yale (Langer et al., 1981). Recientemente se han sintetizado otros nucleótidos biotinilados como adenosina biotinilado y citosín-trifosfatos (Gebeyehu et al., 1987). También se han implementado procedimientos fotoquímicos al igual que un número de 10
16 métodos de biotinilación química han sido descritos (Gillam and Tener, 1986; Reisfeld et al., 1987; Viscidi et al., 1986). HN NH H S H NH NH NH NH P P P N Figura 4. Estructura química de la biotina-dutp. H En principio la biotina puede ser detectada en la misma longitud de onda que la digoxigenina, dependiendo del fluoróforo acoplado a estreptavidina. La estreptavidina o avidina es más frecuentemente usada porque éstas moléculas tienen una alta capacidad de enlace con la biotina. La avidina (proveniente de la clara de huevo) es una glicoproteína de 68 kda con una constante de asociación de M a 25 C. Las sondas marcadas con haptenos tienen varias ventajas, incluyendo seguridad, alta estabilidad, obtención rápida de resultados y resolución. Además la hibridación in situ puede ser realizada en un soporte. Los métodos más sensibles involucran incorporación de nucleótidos modificados que tienen un grupo hapteno que es detectado por un anticuerpo específico. Siguiendo la hibridación, el tejido es incubado con haptenos enlazando anticuerpos acoplados a una enzima y entonces la señal es producida por colorimetría. El rango de haptenos tiene un uso limitado por la disponibilidad comercial. El marcaje fluorescente de la sonda o de anticuerpos anti-haptenos, ofrece la ventaja de usar etiquetas fluorescentes distintas simultáneamente, detectando diferentes secuencias. Esta estrategia es usada generalmente para la hibridación en cromosomas y es menos recurrente para la detección de mrna por la baja sensibilidad. Una nueva alternativa que se ofrece es el uso de anticuepos acoplados a oro coloidal usados para la detección por microscopia electrónica. La elección de la marca depende de los requerimientos para la sensibilidad y resolución de la señal. Las sondas marcadas con 35 S son más sensibles que las sondas marcadas con haptenos, y pueden ser elegidas para la detección de transcritos no abundantes. Si la resolución a nivel celular y/o visualización tridimensional de la expresión génica es requerida, entonces el método ideal 11
17 es el marcaje con haptenos. La seguridad es una consideración importante para la elección del método. En la tabla 1 se muestran las ventajas y desventajas que tiene cada uno de los sistemas: Tabla 1. Ventajas y desventajas de sistemas isótipicos y no isotípicos Isotópicos (Marcaje con 35 S, 3 H, 33 P y 32 P) VENTAJAS Alta sensibilidad, fácil detección, eficiencia en el marcaje de la sonda que puede ser estimado rápidamente. Puede ser usada para cuantificación por conteo de granos de plata ( 35 S). DESVENTAJAS Equipo para uso de radioactividad, tiempo de exposición variable y la resolución es dependiente de marcaje. Los radioisotopos tienen una vida media relativamente corta. Se deben de tener estrictos controles dentro de la prueba. Con frecuencia variabilidad en la eficiencia de la prueba. No isotópicas (Biotina, digoxigenina, FITC, dinitrofenil, marcaje con fosfatasa alcalina o peroxidasa) Buena sensibilidad, exposición no radiocativa, larga vida media de la sonda, reproducibilidad, buena resolucón celular y morfología. Protocolos accesibles. Permanente retención del color. Dificultad en detección de secuencias no repetitivas. Problemas con ruido de fondo en tejidos ricos de la molécula marcada (ej. biotina). Pasos adicionales para la detección. Dificultades en la cuantificación exacta de la molécula marcada. 12
18 g) Marcaje Fluorescente de ácidos nucleicos Los nucleótidos marcados con fluoresceína (Figura 5) son una alternativa de los marcajes radioactivos. Los análogos de nucleótidos marcados con fluoresceína pueden ser usados como sistemas directos e indirectos de la hibridación (Dirk et al., 1991; Wiegant et al., 1991). La fluoresceína dutp/utp/ddutp pueden ser incorporados enzimáticamente a los ácidos nucleicos de acuerdo a técnicas standard. El marcaje con fluoresceína es un marcaje directo que no requiere detección inmunocitoquímica por lo que es necesario que haya un mínimo ruido de fondo. En general las desventajas de los métodos directos es que son menos sensibles que los métodos indirectos descritos anteriormente. Alternativamente, los nucleótidos marcados con fluoresceína pueden ser detectados con un anticuerpo conjugado anti-fluoresceína o con un anticuerpo no conjugado o con un anticuerpo secundario contra fluoresceína. tros nucleótidos marcados con fluorocromos, como tetrametil-rodamina-5- dutp que emite en rojo están disponibles actualmente. P P P HN N N H H N C X 4 Li + R2 R1 H H Figura 5. Estructura química de la fluoresceína dutp h) Métodos de marcaje para: i) DNA. Las sondas preparadas por marcaje random primed son preferenciales para aplicaciones de blot por la alta tasa de incorporación de nucleótidos y la alta tasa de producción de sondas marcadas. En la reacción de marcaje por random primed, el templado de DNA es linearizado, desnaturalizado y un primer es incorporado. Inicia en el extremo 3 -H del primer, por síntesis de Klenow. Se sintetiza una molécula de DNA a lo largo del sustrato de cadena sencilla. El tamaño de la sonda es cerca de pb con la ayuda de reactivos premezclados y marcados (como DIG, biotina o fluoresceína) la reacción de random primed puede producir de ng (por 10 ng de templado y una hora de incubación) de µg (por 3 µg de templado y 20 horas de incubación) de una sonda de DNA no radioactiva. En la reacción de nick translation, el templado de DNA puede ser superenrrollado o linearizado. Después el DNA es cortado con DNasa I, 13
19 comienza la actividad de la exonucleasa de DNA-polimerasa I que va de 5 a 3 y se extiende desde la muesca hasta la siguiente muesca (nick-gap); entonces la polimerasa reemplaza los nucleótidos escindidos con nucleótidos marcados. La reacción produce óptimos marcajes después de 60 a 90 minutos. El tamaño de la sonda después de la reacción debe ser cerca de 200 a 500 pb. Las sondas pueden ser preparadas por PCR. En éste, dos primers hibridan en los extremos del DNA y flanquean secuencias específicas, entonces una polimerasa termoestable (como la Taq polimerasa) elonga a los dos primers. Una serie repetitiva de ciclos (desnaturalización, anclaje y extensión del primer) resulta en una acumulación exponencial de copias de la secuencia (cerca de millones de copias en 20 ciclos). La incorporación de nucleótidos marcados durante el PCR puede producir grandes cantidades de sonda marcada.eel largo de la sonda amplificada está definida por el extremo 5 de los primers para el PCR. El PCR permite una fácil producción de sondas con tamaño óptimo. Los tres métodos de marcaje de DNA permiten una gran flexibilidad considerando el largo de los fragmentos marcados. En las reacciones de nick translation el cambio en la concentración de DNasa altera la longitud del fragmento, en cambio la reacción de random primed es afectada por la concentración del primer y para el caso de PCR la secuencia de los primers controlan el tamaño del fragmento. En los tres casos se produce una buena cantidad de sondas marcadas, muchas de las cuales tienen regiones complementarias sobrelapadas. ii) RNA. Las sondas de RNA son generadas por transcripción in vitro de un templado linearizado. En este caso un promotor para la RNA polimerasa puede estar en el vector de DNA, SP6, T3 o T7 RNA polimerasa y son comúnmente usadas para la síntesis de la complementaria de RNA al DNA sustrato. El transcrito sintetizado es una copia exacta de la secuencia del promotor al sitio de restricción. El tamaño de la sonda puede ser ajustado mediante los sitios de restricción y de esta manera tener un control en el tamaño de todas las sonda de RNA. La cantidad de RNA marcado es cerca de 10 µg por 1µg de DNA. iii) ligonucleótidos. ligonucleótidos sintéticos tienen algunas ventajas. Son sintetizados automáticamente, son pequeños y de cadena sencilla. Por su pequeño tamaño poseen una gran capacidad de penetración, la cual es considerada como uno de los factores más importantes de la hibridación in situ. Por otro lado el tamaño del oligo puede ser una desventaja, porque usualmente flanquean menos blancos que las sondas de cdna convencional. Recientes estudios han sugerido que la propiedad de penetración de la sonda compensa el número de blancos que quedan sin flanquear. Una de las 14
20 mayores ventajas que tiene este tipo de marcaje es que la cadena sencilla excluye la posibilidad de renaturalización. Los oligonucleótidos pueden ser marcados directamente con un fluorocromo, con enzimas o con haptenos como biotina, o DIG, las cuales son visualizadas por afinidad citoquímica después de la hibridación. Algunas marcas pueden ser seguidas química o enzimáticamente. El primer enfoque fue químico utilizando oligos sintéticos los cuales tenían aminas reactivas o grupos tioles, adicionados en el paso final de la síntesis automática. Después de la purificación, el oligonucleótido reactivo es modificado con un hapteno. Ejemplo: DIG-NHS o con moléculas reporteras. La segunda aproximación química fue probar DIG o biotina y ver que no formaba una unión de tipo covalente coordinado. Los protocolos enzimáticos utilizan deoxinucleotidil transferasa terminal, marcando enzimáticamente oligos sintéticos en el extremo 3. Algunos métodos son ventajosos en cuanto a la producción de sondas a pequeña escala porque no requiere la síntesis y derivatización de oligos. VI. PREPARACIÓN DEL TEJID El procedimiento para preparar tejidos está determinado por la naturaleza del mismo y los requerimientos específicos del experimento. Las células en cultivo de tejidos pueden ser crecidas directamente en soportes, en los cuales serán fijadas para posteriormente seccionarlos. Los puntos importantes para llevar a cabo la fijación del tejido son: el método de incrustación y evaluar el material de la superficie de pegado. a) Fijación. Para preservar morfológicamente el material biológico debe ser fijado. La fijación es un paso crítico para obtener buenos resultados. Desde el punto de vista químico existen limitaciones en el tipo de fijación: i) Los grupos funcionales involucrados en el aparemiento de las bases están protegidos por la estructura de DNA. ii) El RNA es poco reactivo con agentes entrecruzantes iii) La reacción es reversible con formaldheído Para fijar cromosomas metafásicos, ésta se hace con metanol/ácido acético. Para tejidos embebidos en parafina se usa la fijación con formalina. Para secciones de tejido congelado (criostato) son fijadas con formaldheído 4% por 30 minutos o con solución Bovin Fix que ha dado resultados satisfactorios, al igual que la fijación por vapor de paraformaldheído. Las fijaciones entrecruzadas, como por aldheídos, proporcionan facilidad en el acceso y retención de RNA que precipita en el fijado. Las condiciones para la fijación son un fuerte compromiso. Fijaciones fuertes permiten una buena preservación de la morfología celular, pero el incremento en el entrecruzamiento baja la accesibilidad al blanco. Lo comúnmente usado es 15
CUESTIONES. 1. Por qué la PCR convencional no es cuantitativa?
 2º BIOQUÍMICA CUESTIONES 1. Por qué la PCR convencional no es cuantitativa? En la PCR convencional, la cuantificación del ADN de la muestra es complicada debido a que la eficacia de amplificación va disminuyendo
2º BIOQUÍMICA CUESTIONES 1. Por qué la PCR convencional no es cuantitativa? En la PCR convencional, la cuantificación del ADN de la muestra es complicada debido a que la eficacia de amplificación va disminuyendo
Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz
 IDEXX VetLab Suite IDEXX SNAP Tests Laboratorio de Referencia IDEXX Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz Obtenga respuestas definitivas con la IDEXX RealPCR
IDEXX VetLab Suite IDEXX SNAP Tests Laboratorio de Referencia IDEXX Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz Obtenga respuestas definitivas con la IDEXX RealPCR
Identificación varietal en vid por técnicas de Biología Molecular. Lic. Luciana Garcia Lic. Carolina Chiconofri
 Identificación varietal en vid por técnicas de Biología Molecular. Lic. Luciana Garcia Lic. Carolina Chiconofri OBJETIVO Desarrollar un banco de datos a partir de plantas de origen indudable y del uso
Identificación varietal en vid por técnicas de Biología Molecular. Lic. Luciana Garcia Lic. Carolina Chiconofri OBJETIVO Desarrollar un banco de datos a partir de plantas de origen indudable y del uso
El Banco Nacional de ADN oferta un control de calidad de muestras de ADN y ARN.
 PROGRAMA CONTROL DE CALIDAD DE MUESTRAS El Banco Nacional de ADN oferta un control de calidad de muestras de ADN y ARN. El programa completo de control de calidad de muestras de ADN y ARN engloba diferentes
PROGRAMA CONTROL DE CALIDAD DE MUESTRAS El Banco Nacional de ADN oferta un control de calidad de muestras de ADN y ARN. El programa completo de control de calidad de muestras de ADN y ARN engloba diferentes
3/22/2010. Iván Ferrer Rodríguez, PhD Catedrático. En el 1983, Kary Mullis dio a conocer la Técnica de reacción en cadena de la Polimerasa o PCR.
 Iván Ferrer Rodríguez, PhD Catedrático En el 1983, Kary Mullis dio a conocer la Técnica de reacción en cadena de la Polimerasa o PCR. Síntesis "in vitro" de secuencias específicas de ADN son amplificadas.
Iván Ferrer Rodríguez, PhD Catedrático En el 1983, Kary Mullis dio a conocer la Técnica de reacción en cadena de la Polimerasa o PCR. Síntesis "in vitro" de secuencias específicas de ADN son amplificadas.
PCR. Técnica inventada por Kary Mullis :1987. Premio Nobel 1993. Amplifica una ÚNICA secuencia a partir de una mezcla compleja de ADN
 PCR PCR Técnica inventada por Kary Mullis :1987 Premio Nobel 1993 Amplifica una ÚNICA secuencia a partir de una mezcla compleja de ADN Aprovecha los requerimientos de la replicación Templete ADN Nucleótidos
PCR PCR Técnica inventada por Kary Mullis :1987 Premio Nobel 1993 Amplifica una ÚNICA secuencia a partir de una mezcla compleja de ADN Aprovecha los requerimientos de la replicación Templete ADN Nucleótidos
PCR. Componentes del PCR. PCR Polymerase Chain Reaction (Reacción en Cadena de la Polimerasa)
 PCR PCR Polymerase Chain Reaction (Reacción en Cadena de la Polimerasa) Es una técnica de biología molecular descrita en 1986 por Kary Mullis. (Nobel de química en 1993) Necesidad de pruebas de diagnóstico
PCR PCR Polymerase Chain Reaction (Reacción en Cadena de la Polimerasa) Es una técnica de biología molecular descrita en 1986 por Kary Mullis. (Nobel de química en 1993) Necesidad de pruebas de diagnóstico
Reacción en cadena de la polymerasa (PCR)
 Reacción en cadena de la polymerasa (PCR) 1 PCR Que es? Es una técnica in vitro diseñada para amplificar una región específica de DNA. Es extremadamente sensible, con la capacidad de amplificar millones
Reacción en cadena de la polymerasa (PCR) 1 PCR Que es? Es una técnica in vitro diseñada para amplificar una región específica de DNA. Es extremadamente sensible, con la capacidad de amplificar millones
PROBLEMAS MAS FRECUENTES DURANTE LA SECUENCIACIÓN NO SE PRODUCE REACCION O ESTA DECAE POCO DESPUÉS DE COMENZAR
 PROBLEMAS MAS FRECUENTES DURANTE LA SECUENCIACIÓN NO SE PRODUCE REACCION O ESTA DECAE POCO DESPUÉS DE COMENZAR Las causas pueden ser las siguientes: No hay ADN o se encuentra en muy baja concentración.
PROBLEMAS MAS FRECUENTES DURANTE LA SECUENCIACIÓN NO SE PRODUCE REACCION O ESTA DECAE POCO DESPUÉS DE COMENZAR Las causas pueden ser las siguientes: No hay ADN o se encuentra en muy baja concentración.
Técnicas moleculares.
 Técnicas moleculares. DMTV Carolina Acevedo Curso de Microbiología 2015 SÍNTESIS IN VITRO DE UNA GRAN CANTIDAD DE COPIAS DE UN SEGMENTO DE ADN EXISTENTE EN UNA MUESTRA. O sea. Amplificamos en forma exponencial
Técnicas moleculares. DMTV Carolina Acevedo Curso de Microbiología 2015 SÍNTESIS IN VITRO DE UNA GRAN CANTIDAD DE COPIAS DE UN SEGMENTO DE ADN EXISTENTE EN UNA MUESTRA. O sea. Amplificamos en forma exponencial
DNA RECONBINANTE Depende de enzimas capaces de: Cortar Unir Replicar Transcribir inversamente el RNA Otra herramienta es el uso de Sondas específicas
 DNA RECONBINANTE Depende de enzimas capaces de: Cortar Unir Replicar Transcribir inversamente el RNA Otra herramienta es el uso de Sondas específicas ELEMENTOS BÁSICOS DE LA INVESTIGACIÓN EN GENES Análisis
DNA RECONBINANTE Depende de enzimas capaces de: Cortar Unir Replicar Transcribir inversamente el RNA Otra herramienta es el uso de Sondas específicas ELEMENTOS BÁSICOS DE LA INVESTIGACIÓN EN GENES Análisis
CÓDIGO GENÉTICO Y SÍNTESIS DE PROTEÍNAS
 CÓDIGO GENÉTICO Y SÍNTESIS DE PROTEÍNAS Sumario Mitosis y meiosis Código genético y síntesis de proteínas: 1. Concepto de gen 2. Estructura del ADN 3. La replicación del ADN 4. La transcripción 5. La traducción
CÓDIGO GENÉTICO Y SÍNTESIS DE PROTEÍNAS Sumario Mitosis y meiosis Código genético y síntesis de proteínas: 1. Concepto de gen 2. Estructura del ADN 3. La replicación del ADN 4. La transcripción 5. La traducción
PROBLEMAS MÁS FRECUENTES Y POSIBLES SOLUCIONES
 PROBLEMAS MÁS FRECUENTES Y POSIBLES SOLUCIONES NO SE PRODUCE REACCIÓN O ÉSTA DECAE POCO DESPUÉS DE COMENZAR No hay ADN o hay menos del necesario No hay cebador o la concentración es inferior a la necesaria.
PROBLEMAS MÁS FRECUENTES Y POSIBLES SOLUCIONES NO SE PRODUCE REACCIÓN O ÉSTA DECAE POCO DESPUÉS DE COMENZAR No hay ADN o hay menos del necesario No hay cebador o la concentración es inferior a la necesaria.
Técnicas de Biología Molecular
 Técnicas de Biología Molecular DNA I. Enzimas de restricción Análisis Las enzimas de restricción fueron aisladas de bacterias; su función natural es proteger contra DNA extraño II. Separación electroforética
Técnicas de Biología Molecular DNA I. Enzimas de restricción Análisis Las enzimas de restricción fueron aisladas de bacterias; su función natural es proteger contra DNA extraño II. Separación electroforética
Practica la genética Ficha didáctica del profesorado Bachillerato
 Ficha didáctica del profesorado Bachillerato www.eurekamuseoa.es Extracción de ADN Cuál es la función de cada uno de los ingredientes utilizados para realizar la disolución tampón para la visualización
Ficha didáctica del profesorado Bachillerato www.eurekamuseoa.es Extracción de ADN Cuál es la función de cada uno de los ingredientes utilizados para realizar la disolución tampón para la visualización
TÉCNICAS GENÓMICAS. 2) Cuantificación del número de virus presentes en muestras de sangre o suero: carga vírica
 TÉCNICAS GENÓMICAS Utilidad/Objetivos: 1) Detección de microorganismos directamente en muestras clínicas identificando un fragmento específico del genoma del microorganismo concreto 2) Cuantificación del
TÉCNICAS GENÓMICAS Utilidad/Objetivos: 1) Detección de microorganismos directamente en muestras clínicas identificando un fragmento específico del genoma del microorganismo concreto 2) Cuantificación del
1. Cuáles son las diferencias en los componentes químicos del ADN y ARN?
 ACTIVIDADES TEMA 4 - BIOTECNOLOGÍA 1. Cuáles son las diferencias en los componentes químicos del ADN y ARN? Las cadenas de ADN están formadas por fosfato y desoxirribosa y la del ARN por fosfato y ribosa.
ACTIVIDADES TEMA 4 - BIOTECNOLOGÍA 1. Cuáles son las diferencias en los componentes químicos del ADN y ARN? Las cadenas de ADN están formadas por fosfato y desoxirribosa y la del ARN por fosfato y ribosa.
Detección de patógenos en alimentos, utilizando la técnica de PCR, reacción en cadena de la polimerasa.
 Detección de patógenos en alimentos, utilizando la técnica de PCR, reacción en cadena de la polimerasa. Lic. Esp. Mariano Diego Massari 1er Congreso Bioquímico Córdoba 2011 8ª Jornada de Actualización
Detección de patógenos en alimentos, utilizando la técnica de PCR, reacción en cadena de la polimerasa. Lic. Esp. Mariano Diego Massari 1er Congreso Bioquímico Córdoba 2011 8ª Jornada de Actualización
Instituto de Biomedicina y Biotecnología de Cantabria (IBBTEC) SERVICIO DE SECUENCIACIÓN MASIVA
 1. DESCRIPCIÓN DEL SERVICIO El servicio de Secuenciación Masiva tiene como finalidad el proporcionar asesoramiento y soporte técnico a los grupos de investigación interesados en realizar proyectos de ultrasecuenciación.
1. DESCRIPCIÓN DEL SERVICIO El servicio de Secuenciación Masiva tiene como finalidad el proporcionar asesoramiento y soporte técnico a los grupos de investigación interesados en realizar proyectos de ultrasecuenciación.
Programa donde se inscribe la beca y/o la tesis: Interacciones biológicas: de las
 Titulo: Potencial uso simultáneo de micopatógenos biocontroladores de hormigas cortadoras de hojas. Autores: Natalia G. Armando, Jorge A. Marfetán, Patricia J. Folgarait Correo: ng.armando14@gmail.com
Titulo: Potencial uso simultáneo de micopatógenos biocontroladores de hormigas cortadoras de hojas. Autores: Natalia G. Armando, Jorge A. Marfetán, Patricia J. Folgarait Correo: ng.armando14@gmail.com
PCR en Tiempo Real. Introducción
 Introducción Página 1 de 6 Introducción general La reacción en cadena de la polimerasa, cuyas iniciales en inglés son PCR ("polymerase chain reaction"), es una técnica que fue desarrollada por Kary Mullis
Introducción Página 1 de 6 Introducción general La reacción en cadena de la polimerasa, cuyas iniciales en inglés son PCR ("polymerase chain reaction"), es una técnica que fue desarrollada por Kary Mullis
ELABORACIÓN N DE MEZCLA PARA PCR. Raquel Asunción Lima Cordón
 ELABORACIÓN N DE MEZCLA PARA PCR Raquel Asunción Lima Cordón PCR Polymerase Chain reaction (reacción en cadena de la polimerasa) Sintetizar muchas veces un fragmento de ADN PCR: simulación de lo que sucede
ELABORACIÓN N DE MEZCLA PARA PCR Raquel Asunción Lima Cordón PCR Polymerase Chain reaction (reacción en cadena de la polimerasa) Sintetizar muchas veces un fragmento de ADN PCR: simulación de lo que sucede
Preguntas de selectividad en Andalucía. Ácidos nucleicos. Análisis e interpretación de imágenes, esquemas, figuras...
 Año 2001 Describa las funciones más relevantes de los nucleótidos. Cite un ejemplo de nucleótido que participe en cada una de ellas [1,5]. Explique las funciones de los distintos tipos de RNA que participan
Año 2001 Describa las funciones más relevantes de los nucleótidos. Cite un ejemplo de nucleótido que participe en cada una de ellas [1,5]. Explique las funciones de los distintos tipos de RNA que participan
P.C.R. "Técnica de amplificación enzimática de secuencias específicas de DNA"
 P.C.R. "Técnica de amplificación enzimática de secuencias específicas de DNA" Paso 1: Desnaturalización del DNA Paso 2: Hibridación de los "Primers" Paso 3: Extensión Paso 1: Desnaturalización del DNA
P.C.R. "Técnica de amplificación enzimática de secuencias específicas de DNA" Paso 1: Desnaturalización del DNA Paso 2: Hibridación de los "Primers" Paso 3: Extensión Paso 1: Desnaturalización del DNA
III. Material genético. b. Composición y estructura del RNA.
 III. Material genético b. Composición y estructura del RNA. RNA (ácido ribonucléico) Polímero de nucleótidos La pentosa de los nucleótidos es la Ribosa: en la posición 2' del anillo del azúcar hay un grupo
III. Material genético b. Composición y estructura del RNA. RNA (ácido ribonucléico) Polímero de nucleótidos La pentosa de los nucleótidos es la Ribosa: en la posición 2' del anillo del azúcar hay un grupo
PCR gen 18S ARNr humano
 PCR gen 18S ARNr humano Ref.PCR18S 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa (PCR)
PCR gen 18S ARNr humano Ref.PCR18S 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa (PCR)
Cuál es tu temperatura favorita? Cuán brillante es el Sol? Educación en el cambio global Cambios en la atmósfera - Sección CA3-1
 Educación en el cambio global Cambios en la atmósfera - Sección CA3-1 CA3 Actividades Cuál es tu temperatura favorita? Si alguien te preguntase a qué temperatura te gustaría vivir, seguramente elegirías
Educación en el cambio global Cambios en la atmósfera - Sección CA3-1 CA3 Actividades Cuál es tu temperatura favorita? Si alguien te preguntase a qué temperatura te gustaría vivir, seguramente elegirías
PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN DE LAS COMPETENCIAS PROFESIONALES CUESTIONARIO DE AUTOEVALUACIÓN PARA LAS TRABAJADORAS Y TRABAJADORES
 MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
DANAGENE RNA PURIFICATION KIT
 DANAGENE RNA PURIFICATION KIT REF.0801.1 100 EXTRACCIONES REF.0801.2 500 EXTRACCIONES 1.INTRODUCCION Este kit permite la permite la obtención de ARN total a partir de cultivos celulares, tejidos animales,
DANAGENE RNA PURIFICATION KIT REF.0801.1 100 EXTRACCIONES REF.0801.2 500 EXTRACCIONES 1.INTRODUCCION Este kit permite la permite la obtención de ARN total a partir de cultivos celulares, tejidos animales,
Traducción del. Our ref:
 Traducción del Documento: Our ref: Secretaría del ISO/TC 176/SC 2 Fecha: 15 de octubre de 2008 A los Miembros del ISO/TC 176/SC 2 - Gestión de la Calidad y Aseguramiento de la Calidad/ Sistemas de la Calidad
Traducción del Documento: Our ref: Secretaría del ISO/TC 176/SC 2 Fecha: 15 de octubre de 2008 A los Miembros del ISO/TC 176/SC 2 - Gestión de la Calidad y Aseguramiento de la Calidad/ Sistemas de la Calidad
Técnicas de ADN recombinante: la manipulación genética
 Técnicas de ADN recombinante: la manipulación genética A partir de los años 70 se desarrollaron las herramientas de la biología molecular o la ingeniería genética o lo que se ha llamado técnicas del ADN
Técnicas de ADN recombinante: la manipulación genética A partir de los años 70 se desarrollaron las herramientas de la biología molecular o la ingeniería genética o lo que se ha llamado técnicas del ADN
ELECTROFORESIS. Agarosa. Poliacrilamida
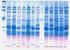 ELECTROFORESIS DE ADN ELECTROFORESIS Agarosa Poliacrilamida Finalidad de la electroforesis Separar Identificar Purificar 1 2 3 4 5 Tinción del ADN Bromuro de etidio Absorbancia a 302 y 366 y emisión a
ELECTROFORESIS DE ADN ELECTROFORESIS Agarosa Poliacrilamida Finalidad de la electroforesis Separar Identificar Purificar 1 2 3 4 5 Tinción del ADN Bromuro de etidio Absorbancia a 302 y 366 y emisión a
Parámetros con la ventana de selección de usuario, reglas, texto y descomposición (IVE)
 QUÉ SON CONCEPTOS PARAMÉTRICOS? Los conceptos paramétricos de Presto permiten definir de una sola vez una colección de conceptos similares a partir de los cuales se generan variantes o conceptos derivados
QUÉ SON CONCEPTOS PARAMÉTRICOS? Los conceptos paramétricos de Presto permiten definir de una sola vez una colección de conceptos similares a partir de los cuales se generan variantes o conceptos derivados
Orientación acerca de los requisitos de documentación de la Norma ISO 9001:2000
 Orientación acerca de los requisitos de documentación de la Norma ISO 9001:2000 Documento: ISO/TC 176/SC 2/N 525R Marzo 2001 ISO Traducción aprobada el 2001-05-31 Prólogo de la versión en español Este
Orientación acerca de los requisitos de documentación de la Norma ISO 9001:2000 Documento: ISO/TC 176/SC 2/N 525R Marzo 2001 ISO Traducción aprobada el 2001-05-31 Prólogo de la versión en español Este
RESUMEN La industria alimentaria, en respuesta a la demanda por parte de los consumidores de alimentos naturales, frescos y libres de conservantes
 RESUMEN La industria alimentaria, en respuesta a la demanda por parte de los consumidores de alimentos naturales, frescos y libres de conservantes químicos, ha desarrollado tecnologías de conservación
RESUMEN La industria alimentaria, en respuesta a la demanda por parte de los consumidores de alimentos naturales, frescos y libres de conservantes químicos, ha desarrollado tecnologías de conservación
1) a) En la figura señale, englobando con un trazo continuo, lo siguiente:
 CÁTEDRA: BIOQUÍMICA Carreras: Farmacia Profesorado en Química Licenciatura en Química Licenciatura en Alimentos ÁCIDOS NUCLEICOS 1) a) En la figura señale, englobando con un trazo continuo, lo siguiente:
CÁTEDRA: BIOQUÍMICA Carreras: Farmacia Profesorado en Química Licenciatura en Química Licenciatura en Alimentos ÁCIDOS NUCLEICOS 1) a) En la figura señale, englobando con un trazo continuo, lo siguiente:
(Estudios in vivo y estudios in vitro)
 (Estudios in vivo y estudios in vitro) IN VIVO: es la experimentación con un todo, que viven organismos en comparación. Ensayos con animales y ensayos clínicos son dos formas de investigación in vivo.
(Estudios in vivo y estudios in vitro) IN VIVO: es la experimentación con un todo, que viven organismos en comparación. Ensayos con animales y ensayos clínicos son dos formas de investigación in vivo.
Ficha Técnica del LightCycler Selección de las Secuencias de las Sondas de Hibridización para ser utilizadas en el LightCycler
 Ficha Técnica del LightCycler Selección de las Secuencias de las Sondas de Hibridización para ser utilizadas en el LightCycler Por Olfert Landt y Andreas Nitsche, TIB MOLBIOL, Berlín Traducción: Adriana
Ficha Técnica del LightCycler Selección de las Secuencias de las Sondas de Hibridización para ser utilizadas en el LightCycler Por Olfert Landt y Andreas Nitsche, TIB MOLBIOL, Berlín Traducción: Adriana
La Absorción del Agua
 La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
CLASE DE RESOLUCIÓN DE PROBLEMAS DE PCR LIC. BIOTECNOLOGÍA 2015
 CLASE DE RESOLUCIÓN DE PROBLEMAS DE PCR LIC. BIOTECNOLOGÍA 2015 DEFINICIÓN PCR: Constituye la técnica más importante para amplificar ácidos nucleicos in vitro. Ambas hebras del DNA de interés son replicadas
CLASE DE RESOLUCIÓN DE PROBLEMAS DE PCR LIC. BIOTECNOLOGÍA 2015 DEFINICIÓN PCR: Constituye la técnica más importante para amplificar ácidos nucleicos in vitro. Ambas hebras del DNA de interés son replicadas
METODOLOGÍAS UTILIZADAS EN INVESTIGACIÓN BÁSICA Y APLICADA REACCION EN CADENA DE LA POLIMERASA (PCR)
 METODOLOGÍAS UTILIZADAS EN INVESTIGACIÓN BÁSICA Y APLICADA REACCION EN CADENA DE LA POLIMERASA (PCR) Centro de de Microscopía Electrónica Facultad de de Ciencias Médicas Universidad Nacional de de Córdoba
METODOLOGÍAS UTILIZADAS EN INVESTIGACIÓN BÁSICA Y APLICADA REACCION EN CADENA DE LA POLIMERASA (PCR) Centro de de Microscopía Electrónica Facultad de de Ciencias Médicas Universidad Nacional de de Córdoba
GUIA DE LABORATORIO PRACTICA 8 EXTRACCIÓN ADN PROGRAMA DE ENFERMERIA CURSO INTEGRADO DE PROCESOS BIOLOGICOS
 GUIA DE LABORATORIO PRACTICA 8 EXTRACCIÓN ADN PROGRAMA DE ENFERMERIA CURSO INTEGRADO DE PROCESOS BIOLOGICOS Leidy Diana Ardila Leal Docente. INTRODUCCIÓN En esta práctica se va a realizar la extracción
GUIA DE LABORATORIO PRACTICA 8 EXTRACCIÓN ADN PROGRAMA DE ENFERMERIA CURSO INTEGRADO DE PROCESOS BIOLOGICOS Leidy Diana Ardila Leal Docente. INTRODUCCIÓN En esta práctica se va a realizar la extracción
TRANSDUCTORES CAPACITIVOS
 CLASE 10 -- TRANSDUCTORES CAPACITIVOS Un capacitor o condensador consiste en dos superficies conductivas separadas por un material dieléctrico, el cual puede ser un sólido, líquido, gas o vacío. La capacitancia
CLASE 10 -- TRANSDUCTORES CAPACITIVOS Un capacitor o condensador consiste en dos superficies conductivas separadas por un material dieléctrico, el cual puede ser un sólido, líquido, gas o vacío. La capacitancia
MÉTODOS CROMATOGRÁFICOS: 1. Exclusión molecular 2. Intercambio iónico 3. Afinidad SSN
 MÉTODOS CROMATOGRÁFICOS: 1. Exclusión molecular 2. Intercambio iónico 3. Afinidad SSN Propiedades de una proteína que son útiles para su purificación por cromatografía Peso molecular Carga iónica Hidrofobicidad
MÉTODOS CROMATOGRÁFICOS: 1. Exclusión molecular 2. Intercambio iónico 3. Afinidad SSN Propiedades de una proteína que son útiles para su purificación por cromatografía Peso molecular Carga iónica Hidrofobicidad
BIOTECNOLOGÍA. 1.- Ingeniería Genética, ADN recombinante
 BIOTECNOLOGÍA 1.- Ingeniería Genética, ADN recombinante Técnica del ADN recombinante: es la más usada en ingeniería genética, esta basada en el uso de las enzimas de restricción o endonucleasas de restricción
BIOTECNOLOGÍA 1.- Ingeniería Genética, ADN recombinante Técnica del ADN recombinante: es la más usada en ingeniería genética, esta basada en el uso de las enzimas de restricción o endonucleasas de restricción
CAPÍTULO 20 ESPECTROMETRÍA DE MASAS. Rosamil Rey, Ph.D. CHEM 4160
 CAPÍTULO 20 ESPECTROMETRÍA DE MASAS Rosamil Rey, Ph.D. CHEM 4160 INTRODUCCIÓN La espectrometría de masas no es una espectroscopia de absorción como IR, RMN y UV. Es el registro gráfico que sufre una molécula
CAPÍTULO 20 ESPECTROMETRÍA DE MASAS Rosamil Rey, Ph.D. CHEM 4160 INTRODUCCIÓN La espectrometría de masas no es una espectroscopia de absorción como IR, RMN y UV. Es el registro gráfico que sufre una molécula
CONTABILIZACIÓN DE INVERSIONES EN ASOCIADAS. NEC 20 Norma Ecuatoriana de Contabilidad 20
 CONTABILIZACIÓN DE INVERSIONES EN ASOCIADAS CONTENIDO NEC 20 Norma Ecuatoriana de Contabilidad 20 Contabilización de Inversiones en Asociadas Alcance Definiciones Influencia significativa Métodos de contabilidad
CONTABILIZACIÓN DE INVERSIONES EN ASOCIADAS CONTENIDO NEC 20 Norma Ecuatoriana de Contabilidad 20 Contabilización de Inversiones en Asociadas Alcance Definiciones Influencia significativa Métodos de contabilidad
ALI: 004 Fecha: 08 Julio 2011 AREA DE NEGOCIO ALIMENTO DEL CAMPO A LA MESA
 ALI: 004 Fecha: 08 Julio 2011 AREA DE NEGOCIO ALIMENTO DEL CAMPO A LA MESA El uso de gases y las tendencias en las tecnologías para la producción de alimentos Cada día las personas esperan consumir alimentos
ALI: 004 Fecha: 08 Julio 2011 AREA DE NEGOCIO ALIMENTO DEL CAMPO A LA MESA El uso de gases y las tendencias en las tecnologías para la producción de alimentos Cada día las personas esperan consumir alimentos
EXPEDIENTE DE MEDICAMENTO EN INVESTIGACIÓN (IMPD) PARA MEDICAMENTOS DE TERAPIA CELULAR: MÓDULO DE CALIDAD
 EXPEDIENTE DE MEDICAMENTO EN INVESTIGACIÓN (IMPD) PARA MEDICAMENTOS DE TERAPIA CELULAR: MÓDULO DE CALIDAD Susana Rojo División de Productos Biológicos y Biotecnología AEMPS La solicitud se hará preferentemente
EXPEDIENTE DE MEDICAMENTO EN INVESTIGACIÓN (IMPD) PARA MEDICAMENTOS DE TERAPIA CELULAR: MÓDULO DE CALIDAD Susana Rojo División de Productos Biológicos y Biotecnología AEMPS La solicitud se hará preferentemente
Potenciales de optimización de reacciones de laboratorio -
 Potenciales de optimización de reacciones de laboratorio - Reglas básicas para síntesis sostenibles En el curso de la investigación sobre algunas reaccione incluidas en NOP se han podido identificar algunos
Potenciales de optimización de reacciones de laboratorio - Reglas básicas para síntesis sostenibles En el curso de la investigación sobre algunas reaccione incluidas en NOP se han podido identificar algunos
Reacción en cadena de la polimerasa (PCR)
 Dr. Alejandro Leal Reacción en cadena de la polimerasa (PCR) La reacción en cadena de la polimerasa (PCR, por sus siglas en inglés de "polymerase chain reaction") es un método de amplificación in vitro
Dr. Alejandro Leal Reacción en cadena de la polimerasa (PCR) La reacción en cadena de la polimerasa (PCR, por sus siglas en inglés de "polymerase chain reaction") es un método de amplificación in vitro
Guía de Preparación de Muestras para PLASTICOS para el Software de Formulación de Datacolor
 Guía de Preparación de Muestras para PLASTICOS para el Software de Formulación de Datacolor 1. Generalidades 2. Qué se necesita para comenzar? 3. Qué hacer para sistemas opacos y translúcidos? 4. Qué hacer
Guía de Preparación de Muestras para PLASTICOS para el Software de Formulación de Datacolor 1. Generalidades 2. Qué se necesita para comenzar? 3. Qué hacer para sistemas opacos y translúcidos? 4. Qué hacer
Instituto de Biomedicina y Biotecnología de Cantabria (IBBTEC) SERVICIO DE SECUENCIACIÓN MASIVA
 1. DESCRIPCIÓN DEL SERVICIO El servicio de Secuenciación Masiva tiene como finalidad el proporcionar asesoramiento y soporte técnico a los grupos de investigación interesados en realizar proyectos de ultrasecuenciación.
1. DESCRIPCIÓN DEL SERVICIO El servicio de Secuenciación Masiva tiene como finalidad el proporcionar asesoramiento y soporte técnico a los grupos de investigación interesados en realizar proyectos de ultrasecuenciación.
Entender el funcionamiento de los relojes permitiría lidiar con ciertas patologías en humanos. 28 ACTUALIDAD EN I+D RIA / Vol. 41 / N.
 28 ACTUALIDAD EN I+D RIA / Vol. 41 / N.º 1 Entender el funcionamiento de los relojes permitiría lidiar con ciertas patologías en humanos Abril 2015, Argentina 29 Relojes biológicos en plantas Ajustar el
28 ACTUALIDAD EN I+D RIA / Vol. 41 / N.º 1 Entender el funcionamiento de los relojes permitiría lidiar con ciertas patologías en humanos Abril 2015, Argentina 29 Relojes biológicos en plantas Ajustar el
Rentabilidad, viabilidad y financiamiento de la prevención del cáncer de cuello uterino
 Rentabilidad, viabilidad y financiamiento de la prevención del cáncer de cuello uterino Dra. Carol Levin PATH La transcripción del video está debajo de cada diapositiva. Rentabilidad Compara los costos
Rentabilidad, viabilidad y financiamiento de la prevención del cáncer de cuello uterino Dra. Carol Levin PATH La transcripción del video está debajo de cada diapositiva. Rentabilidad Compara los costos
Capítulo IV. Manejo de Problemas
 Manejo de Problemas Manejo de problemas Tabla de contenido 1.- En qué consiste el manejo de problemas?...57 1.1.- Ventajas...58 1.2.- Barreras...59 2.- Actividades...59 2.1.- Control de problemas...60
Manejo de Problemas Manejo de problemas Tabla de contenido 1.- En qué consiste el manejo de problemas?...57 1.1.- Ventajas...58 1.2.- Barreras...59 2.- Actividades...59 2.1.- Control de problemas...60
Código: IDX-016 Ver: 1 TOXO. Sistema para la detección de la presencia de ADN de Toxoplasma gondii. Reg. MSP 21205
 Sistema para la detección de la presencia de ADN de Toxoplasma gondii Reg. MSP 21205 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. info@atgen.com.uy www.atgen.com.uy
Sistema para la detección de la presencia de ADN de Toxoplasma gondii Reg. MSP 21205 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. info@atgen.com.uy www.atgen.com.uy
HOJA INFORMATIVA DE HORTICULTURA
 HOJA INFORMATIVA DE HORTICULTURA COSECHA Y POST-COSECHA: Importancia y fundamentos Alejandro R. Puerta Ing. Agr. Agosto 2002 La cosecha y post - cosecha es una etapa de fundamental importancia en el proceso
HOJA INFORMATIVA DE HORTICULTURA COSECHA Y POST-COSECHA: Importancia y fundamentos Alejandro R. Puerta Ing. Agr. Agosto 2002 La cosecha y post - cosecha es una etapa de fundamental importancia en el proceso
OLIMPÍADA ARGENTINA DE BIOLOGÍA APEB ÁREA DE ACTUALIZACIÓN Y PERFECCIONAMIENTO EN LA ENSEÑANZA DE LA BIOLOGÍA CONTINUIDAD Y CAMBIO DE LAS ESPECIES I:
 MINISTERIO DE EDUCACIÓN, CIENCIA Y TECNOLOGIA UNIVERSIDAD NACIONAL DE RIO CUARTO FACULTAD DE CIENCIAS EXACTAS, FÍSICO - QUÍMICAS Y NATURALES DEPARTAMENTO DE CIENCIAS NATURALES OLIMPÍADA ARGENTINA DE BIOLOGÍA
MINISTERIO DE EDUCACIÓN, CIENCIA Y TECNOLOGIA UNIVERSIDAD NACIONAL DE RIO CUARTO FACULTAD DE CIENCIAS EXACTAS, FÍSICO - QUÍMICAS Y NATURALES DEPARTAMENTO DE CIENCIAS NATURALES OLIMPÍADA ARGENTINA DE BIOLOGÍA
11.2-DISCUSIÓN Prueba rápida
 11.2-DISCUSIÓN Prueba rápida Como se observa en la tabla 9 del total de las embarazadas (62,214) a las que se les realizo la prueba rápida un 99.3%(61,808) de ellas dio como resultado no reactivo, tan
11.2-DISCUSIÓN Prueba rápida Como se observa en la tabla 9 del total de las embarazadas (62,214) a las que se les realizo la prueba rápida un 99.3%(61,808) de ellas dio como resultado no reactivo, tan
CAPITULO 5. PROCESO DE SECADO. El secado se describe como un proceso de eliminación de substancias volátiles (humedad)
 CAPITULO 5. PROCESO DE SECADO. 5.1 Descripción general del proceso de secado. El secado se describe como un proceso de eliminación de substancias volátiles (humedad) para producir un producto sólido y
CAPITULO 5. PROCESO DE SECADO. 5.1 Descripción general del proceso de secado. El secado se describe como un proceso de eliminación de substancias volátiles (humedad) para producir un producto sólido y
Base de datos en Excel
 Base de datos en Excel Una base datos es un conjunto de información que ha sido organizado bajo un mismo contexto y se encuentra almacenada y lista para ser utilizada en cualquier momento. Las bases de
Base de datos en Excel Una base datos es un conjunto de información que ha sido organizado bajo un mismo contexto y se encuentra almacenada y lista para ser utilizada en cualquier momento. Las bases de
PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN DE LAS COMPETENCIAS PROFESIONALES CUESTIONARIO DE AUTOEVALUACIÓN PARA LAS TRABAJADORAS Y TRABAJADORES
 MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
CROMOSOMA 21. Pintado Cromosómico Total 21
 CROMOSOMA 21 Pintado Cromosómico Total 21 21q21.3 Early onset Alzheimer region probe EN 21 Break Apart 21q22 [AML1(RUNX1)] Doble Fusión t(12;21)(p13;q22)[etv6/aml1(runx1)] Doble Fusión t(8;21)(q21;q22)
CROMOSOMA 21 Pintado Cromosómico Total 21 21q21.3 Early onset Alzheimer region probe EN 21 Break Apart 21q22 [AML1(RUNX1)] Doble Fusión t(12;21)(p13;q22)[etv6/aml1(runx1)] Doble Fusión t(8;21)(q21;q22)
C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O. Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua
 C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno,
C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno,
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 Unidad Curricular: Virología y Micología Veterinaria 1 TRABAJO PRÁCTICO No. 3 AMPLIFICACIÓN DE GENES VIRALES Reacción en Cadena de la Polimerasa, conocida como PCR (por sus siglas en inglés: Polimerase
Unidad Curricular: Virología y Micología Veterinaria 1 TRABAJO PRÁCTICO No. 3 AMPLIFICACIÓN DE GENES VIRALES Reacción en Cadena de la Polimerasa, conocida como PCR (por sus siglas en inglés: Polimerase
PRUEBA RAPIDA EN EMBARAZADAS (n=62,214 2009-Junio 2010) NO REACTIVO n=218 REACTIVO INDETERMINADO. Tabla 9: Resultados Prueba rápida
 11-RESULTADOS 11.1-Interpretación y análisis de resultados Un total de de 62,214 mujeres embarazadas se realizaron la prueba rápida de VIH durante años 2009 hasta junio 2010 (Tabla 9). De ellas, 61,808
11-RESULTADOS 11.1-Interpretación y análisis de resultados Un total de de 62,214 mujeres embarazadas se realizaron la prueba rápida de VIH durante años 2009 hasta junio 2010 (Tabla 9). De ellas, 61,808
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA
 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA PROGRAMA DE INGENIERIA DE ALIMENTOS 211612 TRANSFERENCIA DE MASA ACTIVIDAD 11 RECONOCIMIENTO UNIDAD 3 BOGOTA D.C. Extracción líquido - líquido La extracción líquido-líquido,
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA PROGRAMA DE INGENIERIA DE ALIMENTOS 211612 TRANSFERENCIA DE MASA ACTIVIDAD 11 RECONOCIMIENTO UNIDAD 3 BOGOTA D.C. Extracción líquido - líquido La extracción líquido-líquido,
MÓDULO: GESTIÓN DE RESIDUOS TEMA: DESMINERALIZACIÓN
 MÓDULO: GESTIÓN DE RESIDUOS TEMA: DESMINERALIZACIÓN DOCUMENTACIÓN ELABORADA POR: NIEVES CIFUENTES MASTER EN INGENIERIÁ MEDIOAMBIENTAL Y GESTIÓN DEL AGUA ÍNDICE 1. INTRODUCCIÓN 2. INTERCAMBIO IÓNICO 3.
MÓDULO: GESTIÓN DE RESIDUOS TEMA: DESMINERALIZACIÓN DOCUMENTACIÓN ELABORADA POR: NIEVES CIFUENTES MASTER EN INGENIERIÁ MEDIOAMBIENTAL Y GESTIÓN DEL AGUA ÍNDICE 1. INTRODUCCIÓN 2. INTERCAMBIO IÓNICO 3.
PCR. Qué es la PCR? T a de fusión de oligonucleótidos (t m )
 % a de fusión de oligonucleótidos (t m ) Qué es la PCR? La reacción en cadena de la polimerasa (PCR: polymerase chain reaction) es una técnica de amplificación de secuencias de DNA in vitro t m = 2 (A
% a de fusión de oligonucleótidos (t m ) Qué es la PCR? La reacción en cadena de la polimerasa (PCR: polymerase chain reaction) es una técnica de amplificación de secuencias de DNA in vitro t m = 2 (A
GUIA SOBRE LOS REQUISITOS DE LA DOCUMENTACION DE ISO 9000:2000
 1 INTRODUCCIÓN Dos de los objetivos más importantes en la revisión de la serie de normas ISO 9000 han sido: desarrollar un grupo simple de normas que sean igualmente aplicables a las pequeñas, a las medianas
1 INTRODUCCIÓN Dos de los objetivos más importantes en la revisión de la serie de normas ISO 9000 han sido: desarrollar un grupo simple de normas que sean igualmente aplicables a las pequeñas, a las medianas
Técnicas descritas en el curso 7.28
 Técnicas descritas en el curso 7.28 Técnica: Clase 1 Experimento de incorporación de dntps Ensayo de extensión del cebador Ensayo de unión en filtro Electroforesis en gel Análisis de ADN Helicasa Polaridad
Técnicas descritas en el curso 7.28 Técnica: Clase 1 Experimento de incorporación de dntps Ensayo de extensión del cebador Ensayo de unión en filtro Electroforesis en gel Análisis de ADN Helicasa Polaridad
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Preguntas que se hacen con frecuencia sobre los estudios clínicos
 Preguntas que se hacen con frecuencia sobre los estudios clínicos Son seguros? Todos los ensayos clínicos deben ser aprobados por el gobierno federal y deben cumplir con una reglamentación estricta que
Preguntas que se hacen con frecuencia sobre los estudios clínicos Son seguros? Todos los ensayos clínicos deben ser aprobados por el gobierno federal y deben cumplir con una reglamentación estricta que
Actividades para mejoras. Actividades donde se evalúa constantemente todo el proceso del proyecto para evitar errores y eficientar los procesos.
 Apéndice C. Glosario A Actividades de coordinación entre grupos. Son dinámicas y canales de comunicación cuyo objetivo es facilitar el trabajo entre los distintos equipos del proyecto. Actividades integradas
Apéndice C. Glosario A Actividades de coordinación entre grupos. Son dinámicas y canales de comunicación cuyo objetivo es facilitar el trabajo entre los distintos equipos del proyecto. Actividades integradas
Pruebas rápidas r. Estrategias preventivas. Propuesta de nuevas estrategias preventivas
 XV ENCUENTRO ESTATAL PARA ONG s Madrid, 1-3 de Octubre 2009 Diagnóstico tardío o. Pruebas rápidas r Dra Carmen Rodríguez Centro Sanitario Sandoval Madrid Estrategias preventivas La prevención de nuevas
XV ENCUENTRO ESTATAL PARA ONG s Madrid, 1-3 de Octubre 2009 Diagnóstico tardío o. Pruebas rápidas r Dra Carmen Rodríguez Centro Sanitario Sandoval Madrid Estrategias preventivas La prevención de nuevas
IES Pando Departamento de Biología y Geología 1
 IES Pando Departamento de Biología y Geología 1 2 Células en diversos estadios del ciclo celular en la raíz de ajo. 3 Diversos aspectos del núcleo durante el ciclo celular Ciclo celular 4 Repartición del
IES Pando Departamento de Biología y Geología 1 2 Células en diversos estadios del ciclo celular en la raíz de ajo. 3 Diversos aspectos del núcleo durante el ciclo celular Ciclo celular 4 Repartición del
MEDICIÓN Y ANÁLISIS DE CONTAMINANTES DEL AIRE
 CAPÍTULO 8 MEDICIÓN Y ANÁLISIS DE CONTAMINANTES DEL AIRE Fuente: National Geographic - Noviembre 2000 INTRODUCCIÓN La medición de los contaminantes sirve para varias funciones tales como: Provee un criterio
CAPÍTULO 8 MEDICIÓN Y ANÁLISIS DE CONTAMINANTES DEL AIRE Fuente: National Geographic - Noviembre 2000 INTRODUCCIÓN La medición de los contaminantes sirve para varias funciones tales como: Provee un criterio
LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503. GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN
 LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503 GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN I. EL PROBLEMA Dos líquidos completamente miscibles se pueden separar por métodos físicos llamados
LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503 GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN I. EL PROBLEMA Dos líquidos completamente miscibles se pueden separar por métodos físicos llamados
Análisis de la Proliferación y Apoptosis. Lic. En Bioquímica Carolina Leimgruber
 Análisis de la Proliferación y Apoptosis Lic. En Bioquímica Carolina Leimgruber El funcionamiento adecuado de cualquier organismo depende de su capacidad para producir nuevas células y de eliminar aquellas
Análisis de la Proliferación y Apoptosis Lic. En Bioquímica Carolina Leimgruber El funcionamiento adecuado de cualquier organismo depende de su capacidad para producir nuevas células y de eliminar aquellas
ASEGURAMIENTO DE LA CALIDAD EN LABORATORIO
 FUNDACION NEXUS ASEGURAMIENTO DE LA CALIDAD EN LABORATORIO Marzo de 2012 CALIDAD, CONTROL DE LA CALIDAD Y ASEGURAMIENTO DE LA CALIDAD El laboratorio de análisis ofrece a sus clientes un servicio que se
FUNDACION NEXUS ASEGURAMIENTO DE LA CALIDAD EN LABORATORIO Marzo de 2012 CALIDAD, CONTROL DE LA CALIDAD Y ASEGURAMIENTO DE LA CALIDAD El laboratorio de análisis ofrece a sus clientes un servicio que se
1.2 SISTEMAS DE PRODUCCIÓN
 19 1.2 SISTEMAS DE PRODUCCIÓN Para operar en forma efectiva, una empresa manufacturera debe tener sistemas que le permitan lograr eficientemente el tipo de producción que realiza. Los sistemas de producción
19 1.2 SISTEMAS DE PRODUCCIÓN Para operar en forma efectiva, una empresa manufacturera debe tener sistemas que le permitan lograr eficientemente el tipo de producción que realiza. Los sistemas de producción
Introducción. Ciclo de vida de los Sistemas de Información. Diseño Conceptual
 Introducción Algunas de las personas que trabajan con SGBD relacionales parecen preguntarse porqué deberían preocuparse del diseño de las bases de datos que utilizan. Después de todo, la mayoría de los
Introducción Algunas de las personas que trabajan con SGBD relacionales parecen preguntarse porqué deberían preocuparse del diseño de las bases de datos que utilizan. Después de todo, la mayoría de los
Unidad VI: Supervisión y Revisión del proyecto
 Unidad VI: Supervisión y Revisión del proyecto 61. Administración de recursos La administración de recursos es el intento por determinar cuánto, dinero, esfuerzo, recursos y tiempo que tomará construir
Unidad VI: Supervisión y Revisión del proyecto 61. Administración de recursos La administración de recursos es el intento por determinar cuánto, dinero, esfuerzo, recursos y tiempo que tomará construir
Requisitos del semillero
 Requisitos del semillero La tarea de la cama de siembra es proporcionar a la semilla las condiciones idóneas para una germinación rápida y uniforme. Esto requiere agua, aire, calor y un ambiente libre
Requisitos del semillero La tarea de la cama de siembra es proporcionar a la semilla las condiciones idóneas para una germinación rápida y uniforme. Esto requiere agua, aire, calor y un ambiente libre
BENTLEY BactoCount IBC
 BENTLEY BactoCount IBC Características del equipo El BactoCount IBC es un equipo automático para contar rápido e individualmente las bacterias de la leche cruda. Capacidad: de 50 hasta 150 muestras / hora.
BENTLEY BactoCount IBC Características del equipo El BactoCount IBC es un equipo automático para contar rápido e individualmente las bacterias de la leche cruda. Capacidad: de 50 hasta 150 muestras / hora.
Tratamiento del Riesgo
 Tratamiento del Riesgo 1 En que consiste el tratamiento de los riesgos? 2. Cuando debemos enfrentarnos a los riesgos? 3. Estrategias de tratamiento de riesgos 4. Modelo de Análisis de Riesgos 5. Qué pasos
Tratamiento del Riesgo 1 En que consiste el tratamiento de los riesgos? 2. Cuando debemos enfrentarnos a los riesgos? 3. Estrategias de tratamiento de riesgos 4. Modelo de Análisis de Riesgos 5. Qué pasos
Leica Application Suite
 Leica Application Suite Macro Editor y Macro Runner Personalizado y automatizado 2 Las instrucciones se pueden pausar opcionalmente cuando la rutina se ejecuta para interactuar con las imágenes. Las instrucciones
Leica Application Suite Macro Editor y Macro Runner Personalizado y automatizado 2 Las instrucciones se pueden pausar opcionalmente cuando la rutina se ejecuta para interactuar con las imágenes. Las instrucciones
CONTROL DE PROCESO EN BIODIGESTORES
 !!!! Grupo AquaLimpia CONTROL DE PROCESO EN BIODIGESTORES Preparado por AquaLimpia Engineering e.k. Uelzen - Alemania Julio 2013 2 Derechos reservados Propiedad intelectual Aqualimpia Engineering e.k Prohibida
!!!! Grupo AquaLimpia CONTROL DE PROCESO EN BIODIGESTORES Preparado por AquaLimpia Engineering e.k. Uelzen - Alemania Julio 2013 2 Derechos reservados Propiedad intelectual Aqualimpia Engineering e.k Prohibida
CAPITULO I. Introducción. En la actualidad, las empresas están tomando un papel activo en cuanto al uso de sistemas y
 CAPITULO I Introducción 1.1 Introducción En la actualidad, las empresas están tomando un papel activo en cuanto al uso de sistemas y redes computacionales. La tecnología ha ido evolucionando constantemente
CAPITULO I Introducción 1.1 Introducción En la actualidad, las empresas están tomando un papel activo en cuanto al uso de sistemas y redes computacionales. La tecnología ha ido evolucionando constantemente
AQUAGESTION. ISAv: Un acercamiento actualizado en la detección de sus variantes en la región. Departamento de Desarrollo y Laboratorio Diagnóstico.
 AQUAGESTION ISAv: Un acercamiento actualizado en la detección de sus variantes en la región. Departamento de Desarrollo y Laboratorio Diagnóstico. Noviembre 2011 ACTUALIDAD Este año Sernapesca confirma
AQUAGESTION ISAv: Un acercamiento actualizado en la detección de sus variantes en la región. Departamento de Desarrollo y Laboratorio Diagnóstico. Noviembre 2011 ACTUALIDAD Este año Sernapesca confirma
Empresa Financiera Herramientas de SW Servicios
 Empresa Financiera Herramientas de SW Servicios Resulta importante mencionar que ésta es una empresa cuya actividad principal está enfocada a satisfacer las necesidades financieras de los clientes, a través
Empresa Financiera Herramientas de SW Servicios Resulta importante mencionar que ésta es una empresa cuya actividad principal está enfocada a satisfacer las necesidades financieras de los clientes, a través
DURABILIDAD DE LAS ESTRUCTURAS: CORROSIÓN POR CARBONATACIÓN. INFLUENCIA DEL ESPESOR Y CALIDAD DEL RECUBRIMIENTO
 DURABILIDAD DE LAS ESTRUCTURAS: CORROSIÓN POR CARBONATACIÓN. INFLUENCIA DEL ESPESOR Y CALIDAD DEL RECUBRIMIENTO Revista Cemento Año 6, Nº 25 Con frecuencia se comenta que el acero y el hormigón pueden
DURABILIDAD DE LAS ESTRUCTURAS: CORROSIÓN POR CARBONATACIÓN. INFLUENCIA DEL ESPESOR Y CALIDAD DEL RECUBRIMIENTO Revista Cemento Año 6, Nº 25 Con frecuencia se comenta que el acero y el hormigón pueden
Activos Intangibles Costos de Sitios Web
 SIC-32 Documentos publicados para acompañar a la Interpretación SIC-32 Activos Intangibles Costos de Sitios Web Esta versión incluye las modificaciones resultantes de las NIIF emitidas hasta el 31 de diciembre
SIC-32 Documentos publicados para acompañar a la Interpretación SIC-32 Activos Intangibles Costos de Sitios Web Esta versión incluye las modificaciones resultantes de las NIIF emitidas hasta el 31 de diciembre
Este documento enumera los diferentes tipos de Diagramas Matriciales y su proceso de construcción. www.fundibeq.org
 DIAGRAMA MATRICIAL 1.- INTRODUCCIÓN Este documento enumera los diferentes tipos de Diagramas Matriciales y su proceso de construcción. Muestra su potencial, como herramienta indispensable para la planificación
DIAGRAMA MATRICIAL 1.- INTRODUCCIÓN Este documento enumera los diferentes tipos de Diagramas Matriciales y su proceso de construcción. Muestra su potencial, como herramienta indispensable para la planificación
Implementando un ERP La Gestión del Cambio
 Artículos> Implementando un ERP - La Gestión del Cambio Artículo Implementando un ERP La Gestión del Cambio 1 Contenido Sumario Ejecutivo 3 Los sistemas ERP flexibilizan la gestión de la empresa y su cadena
Artículos> Implementando un ERP - La Gestión del Cambio Artículo Implementando un ERP La Gestión del Cambio 1 Contenido Sumario Ejecutivo 3 Los sistemas ERP flexibilizan la gestión de la empresa y su cadena
Ventajas y desventajas. Entre las cámaras analogas y las cámaras digitales
 Ventajas y desventajas Entre las cámaras analogas y las cámaras digitales Cámaras análogas (desventajas) Los rollos de película tienen un número determinado de exposiciones: 12, 24 o 36. Sin rollo disponible,
Ventajas y desventajas Entre las cámaras analogas y las cámaras digitales Cámaras análogas (desventajas) Los rollos de película tienen un número determinado de exposiciones: 12, 24 o 36. Sin rollo disponible,
LIMPIEZA Y DESINFECCIÓN EN LA INDUSTRIA LÁCTEA
 LIMPIEZA Y EN LA INDUSTRIA LÁCTEA LD EN LAS INDUSTRIAS DE ALIMENTOS La sanitización/higienización es un concepto general que comprende la creación y mantenimiento de las condiciones óptimas de higiene
LIMPIEZA Y EN LA INDUSTRIA LÁCTEA LD EN LAS INDUSTRIAS DE ALIMENTOS La sanitización/higienización es un concepto general que comprende la creación y mantenimiento de las condiciones óptimas de higiene
PRODUCCIÓN + LIMPIA. Generalidades de su metodología
 PRODUCCIÓN + LIMPIA Generalidades de su metodología PRODUCCIÓN + LIMPIA Una opción para el desarrollo Sustentable La Producción más Limpia tiende a la obtención de bienes y servicios con el mínimo impacto
PRODUCCIÓN + LIMPIA Generalidades de su metodología PRODUCCIÓN + LIMPIA Una opción para el desarrollo Sustentable La Producción más Limpia tiende a la obtención de bienes y servicios con el mínimo impacto
SECUENCIACIÓN SANGER DE ADN: GUÍA DE SOLUCIONES TÉCNICAS
 SECUENCIACIÓN SANGER DE ADN: GUÍA DE SOLUCIONES TÉCNICAS Secugen recomienda que para la visualización de las secuencias se usen programas que permitan ver el dato crudo, ya que a partir de ese dato se
SECUENCIACIÓN SANGER DE ADN: GUÍA DE SOLUCIONES TÉCNICAS Secugen recomienda que para la visualización de las secuencias se usen programas que permitan ver el dato crudo, ya que a partir de ese dato se
