COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE USO HOSPITALARIO
|
|
|
- Concepción Bustos Guzmán
- hace 7 años
- Vistas:
Transcripción
1 COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE USO HOSPITALARIO INFORME DE EVALUACIÓN Principio activo: Nombre comercial y presentaciones: ANIDULAFUNGINA ECALTA (Pfizer S.A.) 100 mg vial (PVL: IVA 4%= 416 ) Condiciones de dispensación: Uso Hospitalario Procedimiento de autorización: Centralizado EMEA Fecha de autorización: Septiembre 2007 Código ATC / DDD 1 : J02AX06: Otros antimicóticos, uso sistémico / 0,1 g Excipientes de declaración obligatoria: Etanol (6 g/vial) y fructosa. INTRODUCCIÓN 2-5 La candidiasis invasiva es una infección oportunista predominantemente nosocomial que se produce cuando especies de Candida, habitualmente localizadas en el tracto digestivo, alcanzan el torrente sanguíneo. La candidemia es la forma más simple y más frecuente de candidiasis invasiva; es aquella situación en la que Candida spp. ha entrado en la corriente sanguínea, pero no ha infectado todavía a órganos. En los últimos años se han observado algunas novedades en las micosis sistémicas que complican su tratamiento, particularmente el incremento de las infecciones por especies no-albicans de Candida que suponen un 30-50% de los casos. La candidiasis invasiva es una causa importante de complicaciones y mortalidad en los pacientes hospitalizados. Los fármacos disponibles para su tratamiento son: - Azoles: principalmente fluconazol y voriconazol. - Polienos: entre ellos las distintas formulaciones de anfotericina B. - Equinocandinas: son los antifúngicos más recientes, entre ellos anidulafungina y caspofungina. INDICACIONES APROBADAS 6 EMEA: Tratamiento de la candidiasis invasiva en pacientes adultos no neutropénicos. Anidulafungina se ha estudiado principalmente en pacientes con candidemia, y sólo en un número limitado de pacientes con infecciones de tejido profundo por Candida o enfermedades que cursan con formación de abscesos. FDA: Candidemia, candidiasis esofágica y otras formas de infección por Candida (candidiasis diseminada, intraabdominal y peritonitis). MECANISMO DE ACCIÓN 6 Anidulafungina es una equinocandina semisintética, obtenida a partir de Aspergillus nidulans. Inhibe selectivamente la 1,3-beta-D-glucanosintetasa, enzima presente en hongos, pero no en células humanas. El resultado es la inhibición de la formación del 1,3-beta-D-glucano, un componente esencial de la pared celular fúngica. Anidulafungina ha demostrado actividad fungicida in vitro frente a especies de Candida, incluyendo C. albicans, C. glabrata, C. parapsilosis, C. tropicalis y C. krusei. 1
2 FARMACOCINÉTICA 2,6 Anidulafungina muestra una farmacocinética lineal en un amplio rango de dosis ( mg/día). En los estudios farmacocinéticos realizados en voluntarios sanos, pacientes y poblaciones especiales (peso, sexo, raza, niños, ancianos, patología renal y/o hepática, VIH) se observó una baja variabilidad interindividual. Distribución: anidulafungina se caracteriza por una rápida semivida de distribución (0,5-1 h) y un volumen de distribución de l, que es similar al volumen total de fluido corporal. Se alcanzó el estado estacionario al día siguiente de administrar la dosis de carga (el doble de la dosis diaria de mantenimiento). El fármaco se une extensamente (> 99%) a las proteínas plasmáticas humanas. No se han realizado ensayos específicos de distribución tisular en humanos, por lo que no se conoce si anidulafungina penetra en el líquido cefalorraquídeo y/o a través de la barrera hematoencefálica. Metabolismo: anidulafungina no se metaboliza a nivel hepático. Tampoco es inductor o inhibidor clínicamente relevante del sistema enzimático CYP450. El fármaco experimenta una lenta degradación química, dando lugar a un péptido de anillo abierto, carente de actividad antifúngica. Eliminación: este péptido es posteriormente transformado a nuevos péptidos de degradación, siendo eliminado principalmente por excreción biliar. El aclaramiento es de, aproximadamente, 1 litro/hora y su semivida de eliminación en torno a 24 horas. El aclaramiento renal de anidulafungina ha demostrado ser insignificante. Por tanto, anidulafungina es una equinocandina que presenta un perfil farmacocinético diferente a caspofungina, pues no se metaboliza en el hígado ni se excreta por vía renal. POSOLOGÍA Y FORMA DE ADMINISTRACIÓN 6 Anidulafungina se administra por vía I.V. intermitente (no administrar ni en bolus ni en perfusión continua). La dosis recomendada es de 200 mg el primer día (dosis de carga), pasando desde el segundo día a 100 mg/día durante un mínimo de 14 días tras el último cultivo positivo. No existen datos suficientes que avalen el uso de anidulafungina durante más de 35 días. No se requiere ajuste de dosis en insuficiencia hepática o renal de cualquier grado. Reconstitución: Se reconstituye cada vial con su disolvente (30 ml de etanol anhidro 20% p/p en agua), resultando una concentración de 3,33 mg/ml. El tiempo de reconstitución puede ser de hasta 5 min. Dilución: Dentro del intervalo de 1 h tras su reconstitución, la dosis requerida (1-2 viales) deberá ser diluida en Cloruro Sódico 0,9% o Glucosa 5%, hasta una concentración de 0,36 mg/ml*. No se ha establecido la compatibilidad de anidulafungina con otros aditivos (sueros, fármacos). Administración: La mezcla así preparada deberá administrarse en un plazo de 24 h, sin superar una velocidad de perfusión de 1,1 mg/min, equivalente a 3 ml/min. Desechar la solución si se observan partículas sólidas o un cambio de coloración. * Requisitos de dilución, según la dosis diaria: Dosis Volumen total reconstituido Volumen de suero necesario Volumen total Concentración final de la mezcla Velocidad de perfusión 100 mg 30 ml 250 ml 280 ml 0,36 mg/ml 3 ml/min 200 mg 60 ml 500 ml 560 ml 0,36 mg/ml 3 ml/min EFICACIA CLÍNICA 7,8 La evidencia de la eficacia de anidulafungina está basada en los resultados de un único estudio pivotal (Reboli AC et al) 7. Las características y resultados de dicho ensayo se exponen en la tabla del Anexo 1. No existe ningún estudio comparativo de anidulafungina con otras equinocandinas. Un 89 % de los pacientes del estudio pivotal tenían sólo candidemia (definida como, al menos, un hemocultivo positivo) u otras formas de candidiasis invasiva (definida como un cultivo positivo obtenido de un sitio estéril) dentro de las 96 horas anteriores a su inclusión en el estudio. En todos los pacientes con candidemia se recomendó la retirada del catéter venoso central. Sólo unos pocos pacientes presentaban neutropenia (definida como un recuento de neutrófilos < 500 / mm 3 ) en el momento de su inclusión en el estudio, 5 de ellos en el grupo de anidulafungina y 4 en el de fluconazol; asimismo un número limitado de pacientes presentaban infecciones de tejido profundo o enfermedades que cursaban con formación de abscesos producidas por Candida. 2
3 Fluconazol fue elegido como comparador en el estudio por consideraciones de eficacia y seguridad. La elección del valor de 20% para el IC 95% de la diferencia como criterio de no inferioridad deriva de otros estudios previos con equinocandinas, aunque parece un criterio poco exigente teniendo en cuenta la gravedad de los pacientes. Algunos aspectos a destacar en este estudio son 8 : Para la variable primaria de eficacia se obtiene un resultado satisfactorio en el 75,6% de los pacientes con anidulafungina frente al 60,2% con fluconazol. La diferencia de 15,4 % (IC 95%: 3,9 a 27) permite ver que anidulafungina cumple el criterio de no inferioridad frente a fluconazol, pero como además el límite inferior del IC 95% es superior a cero la respuesta obtenida es mayor y con significación estadística (p = 0,01). Por tanto, anidulafungina muestra en este estudio pivotal un perfil favorable con respecto a fluconazol en el tratamiento de pacientes con candidiasis invasiva que eran, principalmente, no neutropénicos y con candidemia. Ya que la variable principal incluye la respuesta microbiológica y clínica, y esta última engloba no solo a pacientes curados sino también a los que habían mejorado; la EMEA requirió al laboratorio solicitante de la autorización un análisis que incluyera solo a los curados. Los resultados, utilizando esa definición revisada de éxito del tratamiento, continuaron siendo consistentes con la conclusión inicial de no inferioridad de anidulafungina frente a fluconazol, no así en cuanto al criterio de superioridad. En todas las variables secundarias anidulafungina era, al menos, tan eficaz como fluconazol, aunque las tasas de respuesta disminuían a las 2 y 6 semanas como en el caso de fluconazol. A las 2 semanas post-tratamiento anidulafungina mostraba superioridad pero a las 6 semanas solo no inferioridad. De los 47 centros participantes, 1 centro incluyó 25 pacientes (aproximadamente el 10% de la población del ensayo). De estos tenían respuesta global satisfactoria 14/15 pacientes (93,3%) en el grupo de anidulafungina y 5/10 (50%) en el de fluconazol. Los análisis realizados no mostraron ninguna evidencia de la existencia de un efecto centro sobre los resultados del análisis primario. Sin embargo, si los datos de esos 25 pacientes eran retirados las tasas de éxito del estudio cambiaban, pasando a ser los resultados de la variable primaria de un 73,2% para anidulafungina frente a 61,1% con fluconazol (diferencia: 12,1%; IC 95%: 1,1 a 23) con lo que anidulafungina mostraba no inferioridad frente a fluconazol, pero no superioridad. La población de pacientes con candidiasis invasiva distinta de candidemia era pequeña en ambos grupos, pero la respuesta era mayor en el de anidulafungina, 8 de 11 pacientes (72,7%), que en el de fluconazol, 8 de 15 pacientes (53,3%). En el subgrupo de pacientes con APACHE II < 20 las respuestas satisfactorias al final del tratamiento I.V. eran 81,2% con anidulafungina frente a 61,2% con fluconazol. Si APACHE II > 20 (pacientes más graves) la proporción de respuestas satisfactorias era similar en ambos grupos (53,8% vs 55% con anidulafungina y fluconazol, respectivamente). La mayoría de los pacientes de este estudio (81,2%) tenían una puntuación de APACHE II < 20. Cuando se valoraba la respuesta microbiológica del tratamiento sobre todas las especies de Candida, en conjunto, se obtenía una respuesta del 88,1% para el grupo de anidulafungina frente a 76,2% con fluconazol (p = 0,02). Cuando se analizaba dicha respuesta por separado (frente a cada especie de Candida) también se obtenía diferencia estadísticamente significativa (p = 0,01) en el caso de C. albicans con anidulafungina (95,1%) frente a fluconazol (81,4%); no así en el caso de especies no albicans (C. glabrata, C. parapsilosis, C. tropicalis y otras) en las que las diferencias no eran significativas. En el caso de C. parapsilosis, la respuesta era del 69 % con anidulafungina frente a un 88 % con fluconazol (p = 0,36). Si se compara con fluconazol, los pacientes que recibían anidulafungina tenían una respuesta global satisfactoria frente al conjunto de especies de Candida (aunque solo estadísticamente significativa en el caso de C. albicans y C. tropicalis) con excepción de C. parapsilosis en cuyo caso la respuesta era menor con anidulafungina (64%) que con fluconazol (83%), aunque la diferencia no era significativa (p = 0,37). 3
4 Al final del tratamiento I.V. la persistencia de la infección por Candida se producía en el 6,3% de los pacientes con anidulafungina y el 14,4% con fluconazol (p = 0,06). Las tasas de mortalidad en ambos grupos durante el estudio eran: 29/127 (22,8%) con anidulafungina frente a 37/118 (31,4%) con fluconazol; la diferencia no era significativa (p = 0,151). La mayoría de las muertes no eran atribuibles a la infección por Candida spp. Tan solo lo era en el 1,6% de los pacientes con anidulafungina y el 4,2% con fluconazol. Las limitaciones de este estudio incluyen: o Baja proporción de pacientes con neutropenia o Pequeña proporción de pacientes con candidiasis invasiva no candidémica o Escasa proporción de pacientes muy graves (APACHE II > 20) o Exclusión de pacientes pediátricos o Posibilidad de que exista un efecto centro Guías de Práctica Clínica 3,5,9 Guías de prestigio reconocido como la de la Sociedad Americana de Enfermedades Infecciosas (2008 IDSA Guidelines for Invasive Candidiasis), recomendaciones de expertos en enfermedades infecciosas de las Sociedades Españolas de Medicina Interna (SEMI), Quimioterapia (SEQ), Neumología y Cirugía Torácica (SEPAR), y las Guías de Práctica Clínica en Oncología del National Comprehensive Cancer Network (NCCN) hacen recomendaciones sobre tratamiento antifúngico, y consideran a las equinocandinas como tratamiento de 1ª línea, tanto empírico como dirigido, de la candidiasis invasiva en diversas situaciones. No obstante, consideran a todas ellas (anidulafungina, caspofungina y micafungina) como equivalentes en términos de eficacia y con un perfil de seguridad satisfactorio. Dichas guías hacen recomendaciones similares entre si, que se resumen en los siguientes puntos: A) Si la especie de Candida es desconocida (tratamiento empírico) - Se recomienda FLUCONAZOL en pacientes menos graves o en los que no han recibido tratamiento previo con azoles. - Se recomienda EQUINOCANDINA en pacientes graves o clínicamente inestables, y en aquellos que habían recibido recientemente fluconazol como profilaxis o tratamiento. - Si se sospecha o existe un riesgo elevado de que la especie sea Candida glabrata o Candida krusei se recomienda EQUINOCANDINA pues C. glabrata se asocia con resistencia variable a fluconazol y C. krusei es siempre resistente a éste. B) Si la especie de Candida es conocida (tratamiento dirigido) - Si se trata de C. albicans o C. tropicalis se recomienda FLUCONAZOL o EQUINOCANDINA. - Si la especie es C.parapsilosis se recomienda FLUCONAZOL pues su CMI puede ser muy elevada para las equinocandinas. - En caso de C. glabrata o C. krusei se recomienda EQUINOCANDINA. Anfotericina B, en sus diferentes formulaciones, es considerada una alternativa aceptable a fluconazol o equinocandina para terapia empírica en casos de sospecha de candidiasis invasiva en adultos no neutropénicos, pero su uso debería limitarse a casos en que existe intolerancia o contraindicación a otros antifúngicos. Voriconazol no se recomienda como tratamiento de primera elección en ese mismo tipo de pacientes, sino limitado a la transición a tratamiento oral en casos seleccionados de candidiasis invasiva (p. ej: por C. krusei). SEGURIDAD 6-8,10 Las reacciones adversas (RAM) con anidulafungina fueron generalmente de leves a moderadas, y rara vez motivaron la interrupción del tratamiento. En el ensayo pivotal el número de RAM relacionadas con el tratamiento fue similar en ambos grupos: 24,4% (anidulafungina) vs 26,4% (fluconazol). La elevación de las enzimas hepáticas fue más frecuente en el grupo de fluconazol; por el contrario, distress respiratorio y disnea fueron más frecuentes con 4
5 anidulafungina que con fluconazol. Las RAM graves ocurrieron en dos pacientes de cada grupo: fibrilación atrial y convulsiones (anidulafungina); trombosis venosa profunda y elevación de enzimas hepáticas (fluconazol). Las RAM que llevaron a la suspensión del tratamiento aparecieron en 15 pacientes con anidulafungina y 27 pacientes con fluconazol (p = 0,02). Murieron menos pacientes en el grupo de anidulafungina (22,8%) que en el de fluconazol (31,4%), siendo esta diferencia estadísticamente no significativa. El tiempo medio hasta el fallecimiento fue de 21 días en el grupo de anidulafungina frente a 14 días en el de fluconazol. Las RAM más frecuentes, de cualquier gravedad y consideradas como posiblemente relacionadas con anidulafungina, fueron: aquellas relacionadas con la perfusión [incluyeron rubor / sofocos (2,3%); prurito (2,3%); erupción (1,5%) y urticaria (0,8%)] o bien otras RAM relacionadas con el tratamiento que ocurrieron en 1% de los pacientes durante el ensayo pivotal e incluyeron: hipopotasemia (3,1%), diarrea (3,1%), elevación de la GPT (2,3%), fosfatasa alcalina sérica elevada (1,5%) y bilirrubina sérica elevada (1,5%). Precauciones de empleo 6,8 Uso pediátrico: anidulafungina no está recomendada para uso en menores de 18 años debido a la ausencia de datos sobre seguridad y eficacia. Embarazo y lactancia: no se recomienda el uso de anidulafungina en el embarazo (categoría C de la FDA en todos los trimestres); se desconoce si anidulafungina se excreta en la leche humana, por tanto se valorará en cada caso la relación beneficio/riesgo para el niño lactante y la madre. Efectos hepáticos: se han observado niveles aumentados de enzimas hepáticos en pacientes tratados con anidulafungina. También se observaron alteraciones hepáticas clínicamente significativas en pacientes con patologías subyacentes graves en tratamiento concomitante con múltiples medicamentos, así como casos aislados de hepatitis o agravamiento de la insuficiencia hepática. Por tanto, en los pacientes con niveles aumentados de enzimas hepáticas durante el tratamiento con anidulafungina, debe monitorizarse la función hepática para, en caso de agravamiento, valorar la relación beneficio/riesgo de continuarlo. Contenido en alcohol: cada vial contiene 6 g de etanol, que puede ser perjudicial para pacientes con problemas de alcoholismo, así como en mujeres lactantes y en grupos de alto riesgo (enfermos hepáticos, epilepsia). El etanol también puede alterar el efecto de otros medicamentos. Contraindicaciones: hipersensibilidad a la anidulafungina, a alguno de los excipientes o a otras equinocandinas; pacientes con intolerancia hereditaria a la fructosa (es uno de los excipientes). Interacciones 6,8,10 Anidulafungina no actúa como sustrato, inductor ni inhibidor de las enzimas del citocromo P450 (CYP450). Por consiguiente, es improbable que con este fármaco se produzcan interacciones medicamentosas mediadas por CYP450. Se han realizado estudios específicos de interacción de anidulafungina con otros medicamentos susceptibles de ser administrados de forma concomitante, ciclosporina, tacrolimus, voriconazol, anfotericina B o rifampicina, y en ningún caso se recomienda ajuste de dosis de anidulafungina, ni de los otros medicamentos. Sin embargo, no puede excluirse el riesgo de interacciones farmacodinámicas con los medicamentos que producen hipopotasemia o con aquellos que interaccionen con el etanol. 5
6 COSTE DEL TRATAMIENTO 11 El coste del tratamiento completo es muy variable pues depende de la respuesta clínica y microbiológica del paciente. Coste del tratamiento / paciente de las diversas alternativas Anidulafungina Caspofungina Fluconazol Voriconazol (vial 100 mg) (viales 70 y 50 mg) (vial 400 mg) (vial 200 mg) a, b, c Anfoter. B liposom. (vial 50 mg) Precio unitario (PVL + IVA) mg: 593,6 50 mg: 466,7 15,6 138,6 135,2 Posología D o : 200 mg día 1 D m : 100 mg/día D o : 70 mg día 1 D m : 50 mg/día D o : 800 mg día 1 D m : 400 mg/día D o : 6 mg/kg c/12 h día 1 D m : 4mg/Kg c/12 h 3 5 mg/kg/día Coste / día d ,7 15,6 415,8 540,8 811,2 Coste / tto (14 días) Coste incremental respecto al tto de referencia Referencia a: se elige 14 días de tratamiento, porque es la duración mínima que aparece en las fichas técnicas de anidulafungina y caspofungina, así como en IDSA Guidelines 2004 (Infectious Diseases Society of America) y en el estudio pivotal (Reboli AC et al). b: la dosis de fluconazol es la utilizada en el estudio pivotal. c: cálculos de dosis para un paciente de 60 Kg (voriconazol y anfotericina B liposomal). d: calculado según la dosis de mantenimiento (D m ). D o : dosis de carga. No se conocen estudios farmacoeconómicos publicados hasta la fecha. En el informe de evaluación de la anidulafungina del Scottish Medicines Consortium, se presentan datos de un análisis farmacoeconómico de minimización de costes presentado por el laboratorio; los resultados de dicho análisis mostrarían las ventajas económicas de la anidulafungina respecto a caspofungina y anfotericina B liposomal, no así frente a fluconazol, voriconazol y anfotericina B convencional. El Servicio Escocés de Salud (NHS Scotland) acepta el uso restringido de anidulafungina en pacientes que no toleren fluconazol o que tengan candidiasis invasiva resistente a fluconazol 11. 6
7 CONCLUSIONES 2,3,5,10,12,13 Con los datos actuales, no existe justificación para abandonar fluconazol como tratamiento de 1ª línea en la mayoría de los pacientes con candidiasis invasiva, dada su eficacia, seguridad y coste. No existen ensayos clínicos comparativos de anidulafungina frente a caspofungina aunque, por comparación indirecta, su eficacia y seguridad parecen muy similares en pacientes no neutropénicos con candidiasis invasiva 13. Son ventajas de caspofungina el hecho de estar indicada también en pacientes neutropénicos así como en aspergilosis invasiva, a diferencia de anidulafungina. Entre las principales diferencias a favor de anidulafungina (con respecto a caspofungina) está su teórico mejor perfil de interacciones (particularmente con ciclosporina y tacrolimus), y el no precisar ajustes de dosis en insuficiencia hepática grave. El coste del tratamiento con anidulafungina es muy parecido al de caspofungina, y muy superior al de fluconazol. El uso de anidulafungina debería ser restringido al tratamiento de pacientes adultos, no neutropénicos, con candidiasis invasiva, y con alto riesgo de resistencia a fluconazol que además: presenten insuficiencia hepática grave y/o reciban tratamiento con inmunosupresores (ciclosporina, tacrolimus). La evaluación de novedades terapéuticas en el momento de su comercialización se apoya en información cuya validez puede verse limitada con el paso del tiempo, por lo que debe ser empleada con precaución. Esta evaluación ha sido realizada de acuerdo con el Procedimiento Normalizado de Trabajo del Comité de Evaluación de Nuevos Medicamentos de Uso Hospitalario. Queda totalmente prohibido el uso de este documento con fines promocionales. MIEMBROS DEL COMITÉ DE EVALUACIÓN DE NUEVOS MEDICAMENTOS DE USO HOSPITALARIO - José Manuel Agud Aparicio. - Iñigo Aizpurua Imaz. - Pedro Aranegi Lasuen. - Mª José Arrizabalaga Arrizabalo. - Mª Victoria Egurbide Arberas. - Julia Fernández Uría. - Francisco Javier González Mielgo. - Olatz Ibarra Barrueta. - Rafael Ilardia Lorentzen. - Carlos Martínez Martínez. - Isabel Porras Arregui. - Mª Luisa Vilella Ciriza. Miembros consultores: - José Miguel Montejo Baranda - Mikel Aldamiz-Echebarria San Sebastián 7
8 BIBLIOGRAFÍA Anidulafungina: Actualización microbiológica y clínica. Drugs of Today. 2008; 44 (supl 2). 3.- Barberán J, Mensa J, Fariñas C, llenares P, Serrano R, Menéndez R, et al. Recomendaciones de tratamiento antifúngico en pacientes con bajo grado de inmunosupresión. Rev Esp Quimioter. 2008; 21(2): Anidulafungin for invasive candidiasis and candidaemia. National Horizon Scanning Centre 2006 (December): American Society of Infectious Diseases (IDSA) Guidelines for invasive candidiasis. 6.- Ficha técnica ECALTA Reboli AC, Rotstein C, Pappas PG, Chapman SW, Kett DH, Kumar D et al. (Anidulafungin Study Group). Anidulafungin versus fluconazole for invasive candidiasis. N Engl J Med. 2007; 356 (24): European Medicines Agency (EMEA). European public assessment report (EPAR) for anidulafungin NCCN Clinical Practice Guidelines in Oncology. Prevention and treatment of cancer-related infections. (Version ): Anidulafungine. Rev Prescrire. 2008; 28(299): Anidulafungin 100 mg powder and solvent for concentrate for solution (Ecalta). Scottish Medicines Consortium 10 October 2008 (465/08): 1-7. Published 10 November Antifungal drugs: Treatment guidelines. Med Lett Ther. 2008; 6(65): Mora-Duarte J, Betts R, Rotstein C, Lopes Colombo A, Thompson-Moya L, et al. Comparison of caspofungin and amphotericin B for invasive candidiasis. N Engl J Med. 2002; 347(25): Otra bibliografía de interés: - Krause DS, Reinhardt J, Vázquez JA, Reboli A, Goldstein BP, Wible M, Henkel T. Phase 2, randomized, dose-ranging study evaluating the safety and efficacy of anidulafungin in invasive candidiasis and candidemia. Antimicrob Agents Chemother. 2004; 48(6): Pfaller MA, Diekema DJ, Boyken L, Messer SA, Tendolkar S, Hollis RJ, Goldstein BP. Effectiveness of anidulafungin in eradicating Candida species in invasive candidiasis. Antimicrob Agents Chemother. 2005; 49(11): Anidulafungin (Eraxis) for Candida infections. Med Lett Ther. 2006; 48(1235):
9 ANEXO 1.- ENSAYOS CLÍNICOS Referenci a Tipo de estudio y objetivo Población (N, características) Pauta de tratamiento / seguimiento Variables de medida Tamaño del efecto / Intervalos de confianza / Valores p (grupo estudio vs grupo control) Calidad del estudio (Escala Jadad) Reboli AC et al (N Engl J Med 2007; 356: ). Período de realización: de marzo 2003 a octubre 2004 Financiado por Vicuron (adquirido por Pfizer en 2005) EC fase III, doble ciego, multinacional, multicéntrico (47 centros), aleatorizado, comparativo de ANI vs FLU. Estratificado según APACHE II (< 20 ó > 20) y recuento de neutrófilos < 500 ó > 500 / mm 3. Aleatorización 1:1 dentro de cada bloque. Estudio de no inferioridad (aunque con un análisis estadístico de 2 pasos preespecificado: no inferioridad seguida de superioridad). Objetivo: Determinar la eficacia y seguridad de ANI vs FLU en el tto de pacientes con candidemia y/o candidiasis invasiva. 261 pac. incluidos; de ellos, 256 pac. en la población por intención de tratar (ITT); de ellos, 245 pac. (N) en la población por intención de tratar modificada (MITT). Edad: años. Criterios de inclusión Pacientes con candidemia y/o candidiasis invasiva en las 96 horas previas a la inclusión. Criterios de exclusión - Tto antifúngico sistémico previo de más de 48 h. - Profilaxis con azoles de más de 7 días en los 30 días previos a la inclusión. - Infección refractaria por Candida spp o por C. krusei - Endocarditis, meningitis, osteomielitis, por Candida. - Elevación de los enzimas hepáticos. ANI (n=127): 200 mg IV día 1 seguido de 100 mg/día. FLU (n=118): 800 mg IV día 1 seguido de 400 mg/día. Todos los pacientes podían recibir FLU oral (400 mg/día) tras un mínimo de 10 días de tto IV si: no fiebre en las últimas 24 h; tolerabilidad oral; cultivos (-) para Candida spp. y si había mejoría clínica. La duración media del tto IV era de 13,5 días (ANI) y 12,1 (FLU). El 26% (33/127) del grupo de ANI y el 28% (33/118) de FLU continuaron tto con fluconazol oral. La exposición media a medicamentos del estudio fue de 15 días para ANI y 14 en el grupo de FLU (rango: 14 a 42 días) y al menos durante 14 días tras cultivos (-) y mejoría clínica. Seguimiento: al inicio del tto, durante este, y tras finalizar el tto IV los pacientes eran valorados (signos, síntomas y valores de laboratorio) y también al finalizar el tto oral y a las 2 y 6 semanas de finalizar la terapia antifúngica. Pérdidas: por violaciones del protocolo, retirada del estudio o por suspensión del tto fueron 28/127 (22%) en grupo de ANI vs 34/118 (29%) en grupo de FLU los pacientes que eran excluidos del análisis de eficacia al final del tto IV. El % de pacientes que abandonaron el estudio antes de la 6ª semana post-tto fue del 28% en el grupo de ANI y el 36% en el de FLU. Variable principal Respuesta global favorable (clínica y microbiológica) al final del tto IV. Variables secundarias Respuesta global al final de todo el tto (IV + Oral). Respuesta global a las 2 semanas posttto. Respuesta global a las 6 semanas posttto. Límite de no inferioridad: - 20 % (límite inferior del IC 95 % de la diferencia entre ANI y FLU > 20 %) Criterio de superioridad: 0 % (límite inferior del IC 95 % de la diferencia entre ANI y FLU > 0) 75,6% con ANI vs 60,2% con FLU. RAR % (IC 95%): 15,4 (3,9 a 27) (*). 74% con ANI vs 56,8% con FLU. RAR% (IC 95%): 17,2 (5,5 a 29). 64,6% con ANI vs 49,2% con FLU. RAR% (IC 95%): 15,4 (3,1 a 27,7). 55,9% con ANI vs 44,1% con FLU. RAR% (IC 95%): 11,8 (-0,6 a 24,3). (*) En un análisis posterior sobre la población, en la que se evaluó la eficacia primaria si se retiraba del análisis a pacientes cuya respuesta global era indeterminada, los resultados para la respuesta global al final del tto IV fueron: 96/109 (88,1 %) para ANI vs 71/95 (74,7 %) para FLU RAR%: 13,4 % (IC 95 %: 2,6 a 23,9). En un análisis separado hecho por Pfizer a requerimiento de la EMEA, y usando una definición revisada de éxito del tto (los pacientes que cumplían la definición de mejoría eran considerados como fallos de tto), los resultados fueron consistentes con la conclusión inicial de no inferioridad de ANI vs FLU: 67,7 % vs 57,6 % RAR%: 10,09 (IC 95 %: -1,98 a 22,1). Aleatorización: 1 Doble ciego: 1 Pérdidas: 1 Aleatorización apropiada: 1 Ciego apropiado: 0 TOTAL: 4 puntos ANI: anidulafungina; FLU: fluconazol; ITT (población por intención de tratar): todos los pacientes que recibieron al menos una dosis de ANI o FLU. MITT (población por intención de tratar modificada): todos los pacientes que recibieron al menos una dosis de ANI o FLU, y tenían un cultivo positivo para alguna especie de Candida en las 96 h. previas al estudio. RAR: reducción absoluta de riesgo. Respuesta global: respuesta clínica + respuesta microbiológica; Respuesta clínica: resolución de signos y síntomas de candidiasis invasiva + no necesidad de tto adicional antifúngico sistémico. Respuesta microbiológica: erradicación de las especies de Candida presentes al inicio del tto (se pudo hacer cultivo) o erradicación presumible (no cultivo en paciente con respuesta clínica positiva). 9
HOSPITAL UNIVERSITARIO REINA SOFÍA Informe de la Comisión de Farmacia y Terapéutica Anidulafungina
 HOSPITAL UNIVERSITARIO REINA SOFÍA Informe de la Comisión de Farmacia y Terapéutica Anidulafungina Informe preliminar del Servicio de Farmacia 1.- Identificación del fármaco: Nombre Comercial: Ecalta Presentaciones:
HOSPITAL UNIVERSITARIO REINA SOFÍA Informe de la Comisión de Farmacia y Terapéutica Anidulafungina Informe preliminar del Servicio de Farmacia 1.- Identificación del fármaco: Nombre Comercial: Ecalta Presentaciones:
INFORME TECNICO DE EVALUACIÓN ANIDULAFUNGINA
 INFORME TECNICO DE EVALUACIÓN ANIDULAFUNGINA Candidiasis invasiva Noviembre 2008 Servicio de Farmacia 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: anidulafungina. Indicaciones clínicas
INFORME TECNICO DE EVALUACIÓN ANIDULAFUNGINA Candidiasis invasiva Noviembre 2008 Servicio de Farmacia 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: anidulafungina. Indicaciones clínicas
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
FLUCONAZOL. Solución para infusión IV. 200 mg. ALFARMA S.A., PANAMÁ, REPÚBLICA DE PANAMÁ. Fabricante, país:
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: FLUCONAZOL Solución para infusión IV 200 mg Estuche por un frasco de PEBD con 100 ml. Titular
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: FLUCONAZOL Solución para infusión IV 200 mg Estuche por un frasco de PEBD con 100 ml. Titular
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
Guía de Referencia Rápida. Diagnóstico y Tratamiento de Candidiasis Invasiva en el Adulto
 Guía de Referencia Rápida Diagnóstico y de Candidiasis Invasiva en el Adulto Guía de Práctica Clínica GPC Catálogo maestro de guías de práctica clínica: IMSS-562-12 Diagnóstico y de Candidiasis Invasiva
Guía de Referencia Rápida Diagnóstico y de Candidiasis Invasiva en el Adulto Guía de Práctica Clínica GPC Catálogo maestro de guías de práctica clínica: IMSS-562-12 Diagnóstico y de Candidiasis Invasiva
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
!"#$%"&"'!% La incidencia, evolución y pronóstico de la infección fúngica invasiva ha variado
 !"#$%"&"'!% ()%&"$ % *+,-,."/"&!"$"+,-0 1 La incidencia, evolución y pronóstico de la infección fúngica invasiva ha variado notablemente en las últimas décadas y actualmente podemos decir que estamos ante
!"#$%"&"'!% ()%&"$ % *+,-,."/"&!"$"+,-0 1 La incidencia, evolución y pronóstico de la infección fúngica invasiva ha variado notablemente en las últimas décadas y actualmente podemos decir que estamos ante
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
PROTOCOLO PARA EL TRATAMIENTO DE CANDIDEMIA Y CANDIDIASIS DISEMINADA EN PACIENTES NO NEUTROPENICOS (PNN)
 PROTOCOLO PARA EL TRATAMIENTO DE CANDIDEMIA Y CANDIDIASIS DISEMINADA EN PACIENTES NO NEUTROPENICOS (PNN) 1. INTRODUCCION Una de las principales dificultades para establecer que estamos ante una infección
PROTOCOLO PARA EL TRATAMIENTO DE CANDIDEMIA Y CANDIDIASIS DISEMINADA EN PACIENTES NO NEUTROPENICOS (PNN) 1. INTRODUCCION Una de las principales dificultades para establecer que estamos ante una infección
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
Profilaxis de las Infecciones Fúngicas Invasoras en el Paciente Hematológico
 Profilaxis de las Infecciones Fúngicas Invasoras en el Paciente Hematológico Isidro Jarque Servicio de Hematología H.U. La Fe, Valencia IFI en Pacientes Onco-hematológicos Diagnóstico antemortem Diagnóstico
Profilaxis de las Infecciones Fúngicas Invasoras en el Paciente Hematológico Isidro Jarque Servicio de Hematología H.U. La Fe, Valencia IFI en Pacientes Onco-hematológicos Diagnóstico antemortem Diagnóstico
Técnicas de sensibilidad in vitro a los antifúngicos
 Técnicas de sensibilidad in vitro a los antifúngicos Javier Pemán Unidad de Micología Servicio de Microbiología Hospital Universitario La Fe Valencia Palma de Mallorca, 11 febrero 2010 Detección de resistencias
Técnicas de sensibilidad in vitro a los antifúngicos Javier Pemán Unidad de Micología Servicio de Microbiología Hospital Universitario La Fe Valencia Palma de Mallorca, 11 febrero 2010 Detección de resistencias
INFECCIÓN INVASIVA POR CÁNDIDA
 UNIDAD DE PATOLOGÍA INFECCIOSA DE PEDIATRÍA (C.FIGUERAS) AMI. HUVH. BARCELONA. OCTUBRE 2005. REVISADO JUNIO 2008 INFECCIÓN INVASIVA POR CÁNDIDA CANDIDEMIA Y CANDIDIASIS AGUDA DISEMINADA Cándida sp es la
UNIDAD DE PATOLOGÍA INFECCIOSA DE PEDIATRÍA (C.FIGUERAS) AMI. HUVH. BARCELONA. OCTUBRE 2005. REVISADO JUNIO 2008 INFECCIÓN INVASIVA POR CÁNDIDA CANDIDEMIA Y CANDIDIASIS AGUDA DISEMINADA Cándida sp es la
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
Nuevos Antifúngicos.
 Jornadas Nacionales del Centenario de la Sociedad Argentina de Pediatría-Infectología Pediátrica. Buenos Aires. 14 a 16 de abril de 2011. Mesa Redonda: nuevos antifúngicos para infecciones fúngicas invasivas.
Jornadas Nacionales del Centenario de la Sociedad Argentina de Pediatría-Infectología Pediátrica. Buenos Aires. 14 a 16 de abril de 2011. Mesa Redonda: nuevos antifúngicos para infecciones fúngicas invasivas.
Eni* Tabletas e Inyectable. Ciprofloxacino
 Tabletas e Inyectable Ciprofloxacino Descripción Es ciprofloxacino, la fluoroquinolona bactericida potente, con amplio espectro antibacteriano que incluye grampositivos y gramnegativos. Tiene alta eficacia
Tabletas e Inyectable Ciprofloxacino Descripción Es ciprofloxacino, la fluoroquinolona bactericida potente, con amplio espectro antibacteriano que incluye grampositivos y gramnegativos. Tiene alta eficacia
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
FICHA TÉCNICA. KETOISDIN 400 mg óvulos está indicado en adultos para el tratamiento local de
 1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
MICOSIS OPORTUNISTAS I CANDIDA Y ASPERGILLUS
 MICOSIS OPORTUNISTAS I CANDIDA Y ASPERGILLUS Ana Arribi Unidad de Microbiología Clínica Hospital Clínico San Carlos CANDIDIASIS C. albicans C. glabrata C. parapsilosis C. tropicalis C. Krusei C. guilliermondii
MICOSIS OPORTUNISTAS I CANDIDA Y ASPERGILLUS Ana Arribi Unidad de Microbiología Clínica Hospital Clínico San Carlos CANDIDIASIS C. albicans C. glabrata C. parapsilosis C. tropicalis C. Krusei C. guilliermondii
Índice PATOGENIA Y PREVENCIÓN DE LA INFECCIÓN QUIRÚRGICA. Capítulo 1 Conceptos de microbiología aplicada
 Índice SECCIÓN I: PATOGENIA Y PREVENCIÓN DE LA INFECCIÓN QUIRÚRGICA Capítulo 1 Conceptos de microbiología aplicada Introducción.............................................. 28 Factores predisponentes
Índice SECCIÓN I: PATOGENIA Y PREVENCIÓN DE LA INFECCIÓN QUIRÚRGICA Capítulo 1 Conceptos de microbiología aplicada Introducción.............................................. 28 Factores predisponentes
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Nuevos y novísimos fármacos antiepilépticos
 Nuevos y novísimos fármacos antiepilépticos Cuál es el escenario en la epilepsia? 50% Control con monoterapia 30% Control con politerapia 20% Farmacorresistencia 5% están libres de crisis con un nuevo
Nuevos y novísimos fármacos antiepilépticos Cuál es el escenario en la epilepsia? 50% Control con monoterapia 30% Control con politerapia 20% Farmacorresistencia 5% están libres de crisis con un nuevo
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
Usos de fármacos durante el embarazo y la lactancia
 Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
Modificaciones respecto a la anterior edición. Elaborado: Revisado Aprobado: Dirección Médica Dirección Enfermería
 Protocolo de nueva elaboración Modificaciones respecto a la anterior edición Elaborado: Revisado Aprobado: Comisión Infección, profilaxis y política antibiótica Dirección Médica Dirección Enfermería Dirección
Protocolo de nueva elaboración Modificaciones respecto a la anterior edición Elaborado: Revisado Aprobado: Comisión Infección, profilaxis y política antibiótica Dirección Médica Dirección Enfermería Dirección
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
CANCIDAS debe administrarse en adultos ( 18 años) por infusión intravenosa lenta durante aproximadamente 1 hora.
 CANCIDAS 50 mg POLVO LIOFILIZADO PARA SOLUCIÓN INYECTABLE I.V. (Caspofungina) CANCIDAS 70 mg POLVO LIOFILIZADO PARA SOLUCIÓN INYECTABLE I.V. (Caspofungina) I. CLASE TERAPÉUTICA CANCIDAS es un producto
CANCIDAS 50 mg POLVO LIOFILIZADO PARA SOLUCIÓN INYECTABLE I.V. (Caspofungina) CANCIDAS 70 mg POLVO LIOFILIZADO PARA SOLUCIÓN INYECTABLE I.V. (Caspofungina) I. CLASE TERAPÉUTICA CANCIDAS es un producto
Cefalosporinas Indicaciones y Contraindicaciones
 Cefalosporinas Indicaciones y Contraindicaciones Dra. Ma. Consuelo Rojas Cefalosporinas Sustancias químicas producidas por una especie de hongo cephalosporium acremonium. Son betalactámicos Químicamente
Cefalosporinas Indicaciones y Contraindicaciones Dra. Ma. Consuelo Rojas Cefalosporinas Sustancias químicas producidas por una especie de hongo cephalosporium acremonium. Son betalactámicos Químicamente
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
Monitorización de niveles de vancomicina en Pediatría
 Monitorización de niveles de vancomicina en Pediatría Chevorn Suzette Adams (R3 Pediatría) María Luz Boquera Ferrer (R4 Farmacia Hospitalaria) Tutor: Dr. Luis Moral 3 febrero, 2016, HGUA. Objetivo Repasar
Monitorización de niveles de vancomicina en Pediatría Chevorn Suzette Adams (R3 Pediatría) María Luz Boquera Ferrer (R4 Farmacia Hospitalaria) Tutor: Dr. Luis Moral 3 febrero, 2016, HGUA. Objetivo Repasar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
SIM EXPRESS Información dirigida a los profesionales de la salud Teriflunomida
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
PROTOCOLO PARA LA PROFILAXIS Y EL TRATAMIENTO ANTIFUNGICO DE LAS MICOSIS MAS FRECUENTES.
 PROTOCOLO PARA LA PROFILAXIS Y EL TRATAMIENTO ANTIFUNGICO DE LAS MICOSIS MAS FRECUENTES. ESQUEMA: 1) PROFILAXIS ANTIFUNGICA EN PACIENTES VIH. 2) PROFILAXIS ANTIFUNGICA EN PACIENTES NEUTROPENICOS. 3) TTO
PROTOCOLO PARA LA PROFILAXIS Y EL TRATAMIENTO ANTIFUNGICO DE LAS MICOSIS MAS FRECUENTES. ESQUEMA: 1) PROFILAXIS ANTIFUNGICA EN PACIENTES VIH. 2) PROFILAXIS ANTIFUNGICA EN PACIENTES NEUTROPENICOS. 3) TTO
Patricia Novas Vidal R4 oncología médica H.U. Marqués de Valdecilla, Santander
 Neutropenia Febril Patricia Novas Vidal R4 oncología médica H.U. Marqués de Valdecilla, Santander 1. Introducción 2. Definición 3. Epidemiología 4. Evaluación inicial Índice 5. Paciente con bajo riesgo
Neutropenia Febril Patricia Novas Vidal R4 oncología médica H.U. Marqués de Valdecilla, Santander 1. Introducción 2. Definición 3. Epidemiología 4. Evaluación inicial Índice 5. Paciente con bajo riesgo
ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO
 Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
POLÍTICA DE PRECIOS Y FINANCIACIÓN DE MEDICAMENTOS. Piedad Ferré DG Cartera Básica de Servicios del SNS y Farmacia 27-oct-2016
 POLÍTICA DE PRECIOS Y FINANCIACIÓN DE MEDICAMENTOS Piedad Ferré DG Cartera Básica de Servicios del SNS y Farmacia 27-oct-2016 Bases legales Real Decreto legislativo I/2015 por el que se aprueba el texto
POLÍTICA DE PRECIOS Y FINANCIACIÓN DE MEDICAMENTOS Piedad Ferré DG Cartera Básica de Servicios del SNS y Farmacia 27-oct-2016 Bases legales Real Decreto legislativo I/2015 por el que se aprueba el texto
Cuaderno de Recogida de Datos
 Cuaderno de Recogida de Datos ESTUDIO EPEMIOLÓGICO SOBRE LA INCENCIA DE CANDIASIS OROFARÍNGEA EN PACIENTES CON CÁNCER DE CABEZA Y CUELLO ATENDOS EN HOSPITALES ESPAÑOLES ESTUDIO Código: GIC-EPI-2009-01
Cuaderno de Recogida de Datos ESTUDIO EPEMIOLÓGICO SOBRE LA INCENCIA DE CANDIASIS OROFARÍNGEA EN PACIENTES CON CÁNCER DE CABEZA Y CUELLO ATENDOS EN HOSPITALES ESPAÑOLES ESTUDIO Código: GIC-EPI-2009-01
Adecuación de tratamiento con nuevos anticoagulantes orales
 Adecuación de tratamiento con nuevos anticoagulantes orales Prevención primaria de episodios tromboembólicos venosos en pacientes adultos sometidos a cirugía de reemplazo total de CADERA O RODILLA. Dabigatrán
Adecuación de tratamiento con nuevos anticoagulantes orales Prevención primaria de episodios tromboembólicos venosos en pacientes adultos sometidos a cirugía de reemplazo total de CADERA O RODILLA. Dabigatrán
INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) INSULINAS
 Centro de Información de Medicamentos. Servicio de Farmacia. INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) Datos del solicitante INSULINAS Dr. Pedro José Pines Corrales, FEA del servicio
Centro de Información de Medicamentos. Servicio de Farmacia. INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) Datos del solicitante INSULINAS Dr. Pedro José Pines Corrales, FEA del servicio
MONITORIZACIÓN TERAPÉUTICA DE VORICONAZOL EN EL TRATAMIENTO DE
 MONITORIZACIÓN TERAPÉUTICA DE VORICONAZOL EN EL TRATAMIENTO DE LA IFI EN NIÑOS C. Figueras Unitat de Patologia Infecciosa i Immunodeficiències de Pediatria Hospital Vall d Hebron. Barcelona CEPAS. Cádiz
MONITORIZACIÓN TERAPÉUTICA DE VORICONAZOL EN EL TRATAMIENTO DE LA IFI EN NIÑOS C. Figueras Unitat de Patologia Infecciosa i Immunodeficiències de Pediatria Hospital Vall d Hebron. Barcelona CEPAS. Cádiz
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
AZITROMICINA PHARMAGENUS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 AZITROMICINA PHARMAGENUS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Azitromicina Pharmagenus EFG se ha realizado siguiendo las Directrices que la Agencia Europea
AZITROMICINA PHARMAGENUS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Azitromicina Pharmagenus EFG se ha realizado siguiendo las Directrices que la Agencia Europea
Candidiasis sistémica en niños: a quién, cómo y hasta cuándo tratar? Sarah Parker, MD Assistant Professor The Children s Hospital, Denver
 Candidiasis sistémica en niños: a quién, cómo y hasta cuándo tratar? Sarah Parker, MD Assistant Professor The Children s Hospital, Denver 1 Cándida-- un problema? Una de las más comunes infecciones nosocomiales
Candidiasis sistémica en niños: a quién, cómo y hasta cuándo tratar? Sarah Parker, MD Assistant Professor The Children s Hospital, Denver 1 Cándida-- un problema? Una de las más comunes infecciones nosocomiales
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
ETOPOSIDO 100mg/5mL. 1. Identificación del Medicamento. Nombre Comercial. Etoposido 100mg/5mL Solución Inyectable. Nombre Genérico.
 ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
Manejo de las Infecciones Micóticas
 Manejo de las Infecciones Micóticas Abraham Alí Munive, M.D. Al abordar el tema de la infecciones micóticas en los pacientes hospitalizados, debemos entender que es uno de los campos complejos en la medicina,
Manejo de las Infecciones Micóticas Abraham Alí Munive, M.D. Al abordar el tema de la infecciones micóticas en los pacientes hospitalizados, debemos entender que es uno de los campos complejos en la medicina,
Presentaciones y precio Forma farmacéutica y dosis Unidades por envase Código Coste por unidad PVL + IVA. 1 VIAL ,86 euros
 MICAFUNGINA Candidiasis invasiva,candidiasis esofágica Profilaxis de infección por Candida Informe para la Guía Farmacoterapéutica de Hospitales de Andalucía (BORRADOR PÚBLICO) 6/5/2009 Plazo para presentación
MICAFUNGINA Candidiasis invasiva,candidiasis esofágica Profilaxis de infección por Candida Informe para la Guía Farmacoterapéutica de Hospitales de Andalucía (BORRADOR PÚBLICO) 6/5/2009 Plazo para presentación
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
600 U.I. 480 mg 95% Ig. 67,5 mg 9,0 mg 3 ml. Solución inyectable con inmunoglobulinas, principalmente inmunoglobulina G (IgG).
 1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
1. NOMBRE DEL MEDICAMENTO GAMMA ANTI-HEPATITIS B GRIFOLS 600 U.I. GAMMA ANTI-HEPATITIS B GRIFOLS 1000 U.I. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 600 U.I. 1000 U.I. Inmunoglobulina
LO ÚLTIMO EN PATOLOGÍA RESPIRATORIA MARÍA LIZARITURRRY R3 MEDICINA INTERNA HOSPITAL UNIVERSITARIO LA PAZ
 LO ÚLTIMO EN PATOLOGÍA RESPIRATORIA MARÍA LIZARITURRRY R3 MEDICINA INTERNA HOSPITAL UNIVERSITARIO LA PAZ 13.12.2013 VARÓN, 62 AÑOS. Fumador 30 cigarrillos/día desde hace 40 años Asintomático PRUEBA DE
LO ÚLTIMO EN PATOLOGÍA RESPIRATORIA MARÍA LIZARITURRRY R3 MEDICINA INTERNA HOSPITAL UNIVERSITARIO LA PAZ 13.12.2013 VARÓN, 62 AÑOS. Fumador 30 cigarrillos/día desde hace 40 años Asintomático PRUEBA DE
Influencia de la evaluación de los efectos de residuos en flora intestinal sobre el IDA de una droga
 Influencia de la evaluación de los efectos de residuos en flora intestinal sobre el IDA de una droga A. Haydée Fernández, DVM, MS, DABT 25 de Septiembre de 2010 Cartagena de Indias, Colombia Como se calcula
Influencia de la evaluación de los efectos de residuos en flora intestinal sobre el IDA de una droga A. Haydée Fernández, DVM, MS, DABT 25 de Septiembre de 2010 Cartagena de Indias, Colombia Como se calcula
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 1 mg comprimidos masticables para perros Metacam 2,5 mg comprimidos masticables para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 1 mg comprimidos masticables para perros Metacam 2,5 mg comprimidos masticables para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
NOMBRE DEL MEDICAMENTO COMPOSICIÓN CUALITATIVA Y CUANTITATIVA FORMA FARMACÉUTICA DATOS CLÍNICOS. Edad Peso corporal (aprox.) Posología (cada 6 horas)
 NOMBRE DEL MEDICAMENTO APIRETAL 100 mg/ml solución oral COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Fórmula por ml: Paracetamol... 100 mg Azorrubina (E-122)... 50 μg También contiene AGUA FORMA FARMACÉUTICA
NOMBRE DEL MEDICAMENTO APIRETAL 100 mg/ml solución oral COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Fórmula por ml: Paracetamol... 100 mg Azorrubina (E-122)... 50 μg También contiene AGUA FORMA FARMACÉUTICA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO DICLOVET 50 mg/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
No. el alcohol no altera el mecanismo de acción o los efectos del Andanza.
 GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
Ceccato F, Gontero R, Negri M, Rolla I, Crabbe E, Ortiz A, Paira S. Sección Reumatología, Hospital Cullen. Santa Fe, Argentina.
 Elevación de las enzimas hepáticas y leucopenia en pacientes con Artritis Reumatoidea y Artropatía Psoriática tratados con metotrexate y/o leflunomida. Ceccato F, Gontero R, Negri M, Rolla I, Crabbe E,
Elevación de las enzimas hepáticas y leucopenia en pacientes con Artritis Reumatoidea y Artropatía Psoriática tratados con metotrexate y/o leflunomida. Ceccato F, Gontero R, Negri M, Rolla I, Crabbe E,
Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina.
 1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
Los Ensayos Clínicos (EC) son estudios epidemiológicos caracterizados por ser:
 (678',26(3,'(0,2/Ï*,&26(;3(5,0(17$/(6 Contenido: 1. Ensayos Clínicos Características Diseño de estudio de cohortes y ensayos clínicos Selección de la muestra de estudio Grupos de estudio. Aleatorización.
(678',26(3,'(0,2/Ï*,&26(;3(5,0(17$/(6 Contenido: 1. Ensayos Clínicos Características Diseño de estudio de cohortes y ensayos clínicos Selección de la muestra de estudio Grupos de estudio. Aleatorización.
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
NUEVO ESQUEMA DE ASIGNACIÓN DE PAUTAS DE TRATAMIENTO Enero-2009 (Ver Diagrama Básico de asignación de protocolo de asignación de IS)
 NUEVO ESQUEMA DE ASIGNACIÓN DE PAUTAS DE TRATAMIENTO Enero-2009 (Ver Diagrama Básico de asignación de protocolo de asignación de IS) A) BASE: TRIPLE con PREDNISONA+ + MICOFENOLATO Pacientes sin características
NUEVO ESQUEMA DE ASIGNACIÓN DE PAUTAS DE TRATAMIENTO Enero-2009 (Ver Diagrama Básico de asignación de protocolo de asignación de IS) A) BASE: TRIPLE con PREDNISONA+ + MICOFENOLATO Pacientes sin características
1. NOMBRE DEL MEDICAMENTO. VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
1. NOMBRE DEL MEDICAMENTO VALSEDAN 150 mg, Comprimidos recubiertos Extracto de Valeriana officinalis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Principio activo: Extracto seco
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Terapia antifúngica combinada para la Criptococosis Meníngea. Dra. Jimena Prieto
 ANÁLISIS Terapia antifúngica combinada para la Criptococosis Meníngea Dra. Jimena Prieto 11 de abril de 2013 Objetivo Determinar si la terapia combinada (anfotericina B y flucitosina o anfotericina B
ANÁLISIS Terapia antifúngica combinada para la Criptococosis Meníngea Dra. Jimena Prieto 11 de abril de 2013 Objetivo Determinar si la terapia combinada (anfotericina B y flucitosina o anfotericina B
Para la lista completa de excipientes, véase la sección Indicaciones de uso, especificando las especies de destino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MucoActiol 50 mg/ml Solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada mililitro contiene 50 mg de carbocisteína. Para consultar la lista completa de excipientes,
Implicaciones de la co-infección
 TB/VIH Carlos Andrés Agudelo. MD, MSc Infectólogo Clínica Universitaria Bolivariana y Escuela de Ciencias de la Salud U.P.B. Corporación para Investigaciones Biológicas Implicaciones de la co-infección
TB/VIH Carlos Andrés Agudelo. MD, MSc Infectólogo Clínica Universitaria Bolivariana y Escuela de Ciencias de la Salud U.P.B. Corporación para Investigaciones Biológicas Implicaciones de la co-infección
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA. La duración estimada del tratamiento será de dos semanas.
 FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
La osmolaridad calculada de la solución es de 154 mosm/l y el ph de 4,5-7,0. El contenido teórico en sodio y en cloruro es de 77 mmol/l.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de Sodio Grifols 0,45% solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio, 0,45 g La osmolaridad
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de Sodio Grifols 0,45% solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio, 0,45 g La osmolaridad
PROFILAXIS ANTIFÚNGICA CON ITRACONAZOL INTRAVENOSO EN TRASPLANTE DE SANGRE DE CORDÓN UMBILICAL (TSCU). ANÁLISIS DE 20 PACIENTES ADULTOS
 PROFILAXIS ANTIFÚNGICA CON ITRACONAZOL INTRAVENOSO EN TRASPLANTE DE SANGRE DE CORDÓN UMBILICAL (TSCU). ANÁLISIS DE 20 PACIENTES ADULTOS. IMPLICACIÓN DE ENFERMERÍA Araceli Aineto García 1 ; Jose Antonio
PROFILAXIS ANTIFÚNGICA CON ITRACONAZOL INTRAVENOSO EN TRASPLANTE DE SANGRE DE CORDÓN UMBILICAL (TSCU). ANÁLISIS DE 20 PACIENTES ADULTOS. IMPLICACIÓN DE ENFERMERÍA Araceli Aineto García 1 ; Jose Antonio
Se recomiendan las siguientes modificaciones en caso de disfunción renal.
 1. NOMBRE DEL MEDICAMENTO ACICLOVIR TEDEC 25 mg/ml solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla contiene: Aciclovir (D.O.E.) 250 mg Para excipientes, ver 6.1. 3. FORMA
1. NOMBRE DEL MEDICAMENTO ACICLOVIR TEDEC 25 mg/ml solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla contiene: Aciclovir (D.O.E.) 250 mg Para excipientes, ver 6.1. 3. FORMA
Es frecuente la infección crónica por el virus de hepatitis B (VHB)?
 HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
Clínica de Enfermedades Infecciosas Hospital Roosevelt Febrero 2016
 Clínica de Enfermedades Infecciosas Hospital Roosevelt Febrero 2016 Requiere de evaluación: Clínica: Signos y Síntomas (la mayoría asintomáticos) Bioquímica Serológica Histológica Virológica Determinar
Clínica de Enfermedades Infecciosas Hospital Roosevelt Febrero 2016 Requiere de evaluación: Clínica: Signos y Síntomas (la mayoría asintomáticos) Bioquímica Serológica Histológica Virológica Determinar
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
DEL HEMANGIOMA INFANTIL
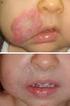 COMUNICACIÓN CIENTÍFICA PROPRANOLOL ORAL EN EL TRATAMIENTO DEL HEMANGIOMA INFANTIL Martínez Roca C 1, Yáñez Gómez P 1, Gómez Tellado M 2, Vilaboa Pedrosa C 1, Calleja Chuclá T 1, Martín Herranz MI 1. 1
COMUNICACIÓN CIENTÍFICA PROPRANOLOL ORAL EN EL TRATAMIENTO DEL HEMANGIOMA INFANTIL Martínez Roca C 1, Yáñez Gómez P 1, Gómez Tellado M 2, Vilaboa Pedrosa C 1, Calleja Chuclá T 1, Martín Herranz MI 1. 1
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
LEVETIRACETAM SOLUCION INTRAVENOSA EN EPILEPSIA (Informe para la Comisión de Farmacia y Terapéutica del Hospital Son LLátzer) Fecha Abril 2008
 LEVETIRACETAM SOLUCION INTRAVENOSA EN EPILEPSIA (Informe para la Comisión de Farmacia y Terapéutica del Hospital Son LLátzer) Fecha Abril 2008 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco:
LEVETIRACETAM SOLUCION INTRAVENOSA EN EPILEPSIA (Informe para la Comisión de Farmacia y Terapéutica del Hospital Son LLátzer) Fecha Abril 2008 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco:
Significado y tratamiento de la candidemia. Dra Dolors Rodríguez IV jornada de Enfermedades Infecciosas de la SEMI Barcelona, Junio 2008
 Significado y tratamiento de la candidemia Dra Dolors Rodríguez IV jornada de Enfermedades Infecciosas de la SEMI Barcelona, Junio 2008 Caso clínico, antecedentes Paciente mujer de 32 a Estreñimiento pertinaz
Significado y tratamiento de la candidemia Dra Dolors Rodríguez IV jornada de Enfermedades Infecciosas de la SEMI Barcelona, Junio 2008 Caso clínico, antecedentes Paciente mujer de 32 a Estreñimiento pertinaz
Peritonitis fúngica en el Hospital Nacional Cayetano Heredia: Reporte de 7 casos
 Peritonitis fúngica en el Hospital Nacional Cayetano Heredia: Reporte de 7 casos Pablo Angeles Resumen: Introducción: La infección fúngica es infrecuente, pero se asocia con una alta morbilidad, con la
Peritonitis fúngica en el Hospital Nacional Cayetano Heredia: Reporte de 7 casos Pablo Angeles Resumen: Introducción: La infección fúngica es infrecuente, pero se asocia con una alta morbilidad, con la
PROPUESTA DE FICHA TÉCNICA
 PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
ESTATINAS EN PERSONAS MAYORES
 ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
Elección de Antiagregantes Plaquetarios en SCA sin SDST tratados con ACP
 Elección de Antiagregantes Plaquetarios en SCA sin SDST tratados con ACP Deberíamos cambiar nuestra práctica? Dr Alejandro Martínez S Universidad Católica de Chile Interacción Plaquetas y Coagulación
Elección de Antiagregantes Plaquetarios en SCA sin SDST tratados con ACP Deberíamos cambiar nuestra práctica? Dr Alejandro Martínez S Universidad Católica de Chile Interacción Plaquetas y Coagulación
BASES FARMACOCINÉTICAS PARA EL DISEÑO O DE UNA PAUTA TERAPÉUTICA. Dr. Pedro Guerra López
 BASES FARMACOCINÉTICAS PARA EL DISEÑO O DE UNA PAUTA TERAPÉUTICA Dr. Pedro Guerra López Pautas terapeuticas Objetivos de esta lección. - Conocer el interés clínico de la farmacocinética en general en cuanto
BASES FARMACOCINÉTICAS PARA EL DISEÑO O DE UNA PAUTA TERAPÉUTICA Dr. Pedro Guerra López Pautas terapeuticas Objetivos de esta lección. - Conocer el interés clínico de la farmacocinética en general en cuanto
Preguntas para responder
 Preguntas para responder TRATAMIENTO DE LA EPOC EN FASE ESTABLE 1. Existe evidencia para aconsejar un tipo concreto de broncodilatador de acción mantenida en monoterapia cuando se inicia el tratamiento
Preguntas para responder TRATAMIENTO DE LA EPOC EN FASE ESTABLE 1. Existe evidencia para aconsejar un tipo concreto de broncodilatador de acción mantenida en monoterapia cuando se inicia el tratamiento
DATOS BÁSICOS DE LA ASIGNATURA. CÓDIGO: AÑO DEL PLAN DE ESTUDIO: 1996 TIPO: TRONCAL Créditos LRU/ECTS Totales: 4/3,1 PROFESOR RESPONSABLE
 EXPERIENCIA PILOTO DE CRÉDITOS EUROPEOS UNIVERSIDAD DE CÓRDOBA FACULTAD DE MEDICINA GUÍA DOCENTE DE LICENCIADO EN MEDICINA CURSO 2008-2009 FICHA DE ASIGNATURA NOMBRE: MICROBIOLOGÍA MÉDICA CLÍNICA DATOS
EXPERIENCIA PILOTO DE CRÉDITOS EUROPEOS UNIVERSIDAD DE CÓRDOBA FACULTAD DE MEDICINA GUÍA DOCENTE DE LICENCIADO EN MEDICINA CURSO 2008-2009 FICHA DE ASIGNATURA NOMBRE: MICROBIOLOGÍA MÉDICA CLÍNICA DATOS
ARTICULOS PUBLICADOS 4. ARTÍCULOS PUBLICADOS
 4. ARTÍCULOS PUBLICADOS 53 4.1. Clinical study and follow-up of 100 patients with the antiphospholipid syndrome. Semin Arthritis Rheum 1999; 29: 182-190. 54 55 56 57 58 59 60 61 62 63 RESUMEN Objetivo:
4. ARTÍCULOS PUBLICADOS 53 4.1. Clinical study and follow-up of 100 patients with the antiphospholipid syndrome. Semin Arthritis Rheum 1999; 29: 182-190. 54 55 56 57 58 59 60 61 62 63 RESUMEN Objetivo:
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
