Genscreen HIV-1 Ag Confirmatory Assay 25 pruebas 71121
|
|
|
- Eduardo Sevilla Ortíz
- hace 8 años
- Vistas:
Transcripción
1 Genscreen HIV-1 Ag Confirmatory Assay 25 pruebas PARA LA CONFIRMACIÓN POR NEUTRALIZACIÓN DE LAS MUESTRAS REACTIVAS CON LA PRUEBA Genscreen HIV-1 ANTIGEN ASSAY IVD Control de calidad del fabricante Todos los productos fabricados y comercializados por la sociedad Bio-Rad se hallan bajo un sistema de garantía de calidad desde la recepción de las materias primas hasta la comercialización de los productos finales. Cada lote de producto final se somete a un control de calidad y sólo se comercializa si está en conformidad con los criterios de aceptación. El fabricante conserva la documentación referente a la producción y al control de cada lote.
2 ÍNDICE DE MATERIAS 1. INTERÉS CLÍNICO 2. PRINCIPIO DEL KIT Genscreen HIV-1 Ag Confirmatory Assay 3. COMPOSICIÓN DEL KIT Genscreen HIV-1 Ag Confirmatory Assay 4. MATERIAL NECESARIO PERO NO SUMINISTRADO 5. RECOMENDACIONES DE HIGIENE Y SEGURIDAD 6. PRECAUCIONES 7. MUESTRAS 8. RECONSTITUCIÓN DE LOS REACTIVOS - VALIDEZ - CONSERVACIÓN 9. PROCEDIMIENTO 10. CÁLCULO E INTERPRETACIÓN DE LOS RESULTADOS 11. COMPROBACIÓN ESPECTROFOTOMÉTRICA DE LA DISTRIBUCIÓN DE LAS MUESTRAS Y DE LOS REACTIVOS 12. ESPECIFICACIONES 13. LÍMITES DE LA PRUEBA 14. REFERENCIAS BIBLIOGRÁFICAS 14
3 1 - INTERÉS CLÍNICO Las muestras reactivas repetibles con la prueba Genscreen HIV-1 Ag Assay deben estar neutralizadas para confirmar la presencia del antígeno p24 del VIH-1. La neutralización del antígeno viral con un anticuerpo anti VIH es un método de confirmación reconocido (1-4). La presencia del antígeno p24 en la muestra se comprueba con la pérdida de reactividad del antígeno VIH-1 en comparación con una muestra no neutralizada procedente del mismo especimen. La prueba Genscreen HIV-1 Ag Confirmatory Assay está destinada a la confirmación de la presencia del antígeno p24 del VIH-1 en las muestras de suero, plasma o sobrenadante de cultivos celulares que sean reactivas repetibles según la prueba Genscreen HIV-1 Ag Assay. 3 - PRINCIPIO DEL KIT Genscreen HIV-1 Ag Confirmatory Assay La muestra reactiva repetible según la prueba Genscreen HIV-1 Ag Assay se incuba con el reactivo de confirmación [anticuerpo anti VIH (humano)]. Si la muestra contiene el antígeno VIH-1, este antígeno se neutralizará por los anticuerpos anti-vih-1 presentes en el reactivo de confirmación. La muestra en cuestión se vuelve a ensayar con la prueba Genscreen HIV-1 Ag Assay. El antígeno VIH-1 neutralizado no puede fijarse a los pocillos sensibilizados con los anticuerpos anti VIH-1 y, por tanto, se produce una reducción de la densidad óptica. Para comparar las señales obtenidas, junto a la muestra neutralizada se ensaya en paralelo un control no-neutralizado de la muestra [tratada con un control negativo antígeno VIH-1 (humano) en sustitución del reactivo de confirmación]. La positividad de las muestras reactivas repetibles con la prueba Genscreen HIV-1 Ag Assay se confirma si la disminución de la densidad óptica en la muestra neutralizada es superior o igual al 50% de la señal de la muestra no neutralizada, y si la señal de la muestra no neutralizada es superior al valor umbral de la prueba. 3 - COMPOSICIÓN DEL KIT Genscreen HIV-1 Ag Confirmatory Assay ETIQUETADO NATURALEZA DE LOS REACTIVOS PRESENTACIÓN RA C0 HIV-1 Ag Confirmatory Reagent Negative Control Reactivo de Confirmación HIV-1 Ag Suero humano que contiene anticuerpos anti-vih-1 Sulfato de Gentamicina 0,005% Conservante : ProClin 300 (0,5%) Control Negativo Suero humano normal no reactivo para el Ag VIH-1, el Ag HBs, los anticuerpos anti-vih-1, anti-vih-2, anti-vhc y anti-htlv-i Sulfato de Gentamicina 0,005% Conservante : ProClin 300 (0,5%) 1 frasco 1.3 ml 1 frasco 12 ml 4 - MATERIAL NECESARIO PERO NO SUMINISTRADO Ver el prospecto de la prueba Genscreen HIV-1 Ag Assay (referencia 71120) Bio-Rad 15
4 5 - RECOMENDACIONES DE HIGIENE Y SEGURIDAD Todos los reactivos del kit están destinados para uso de diagnóstico «in vitro». El reactivo de confirmación VIH-1 ha sido probado y encontrado negativo en las pruebas de despistaje del antígeno de superficie de la hepatitis B (AgHBs), de los anticuerpos dirigidos contra el virus de la hepatitis C (Ac anti-vhc) y contra el virus HTLV (Ac anti-htlv-i). El reactivo de confirmación VIH-1 se ha inactivado por calor. El material de origen humano utilizado en la preparación del control negativo ha sido probado y encontrado negativo en anticuerpos anti-vih1 y VIH2, en antígeno HBs, en anticuerpos anti-vhc y en anticuerpos anti HTLV1/HTLV2. Ningún método puede garantizar de forma absoluta la ausencia de virus VIH, Hepatitis B o C u otros agentes infecciosos. Por tanto, los reactivos, al igual que las muestras de los pacientes, deben ser considerados y manipulados como productos potencialmente infecciosos y respetando las precauciones de uso. La ficha de datos de seguridad está disponible bajo petición. Ciertos reactivos contienen ProClin 300. ProClin % : Irritante. R43 : puede provocar una sensibilización por contacto con la piel. S28-37: después del contacto con la piel, se procederá inmediatamente a un lavado con agua abundante y jabón. Es preciso utilizar guantes apropiados. Xi-Irritante Las muestras y los reactivos de origen humano, así como el material y los productos contaminados se deben desechar después de la descontaminación: - Ya sea mediante inmersión en lejía a una concentración final del 5% de hipoclorito sódico (1 volumen de lejía por cada 10 volúmenes de fluido contaminado o agua) durante 30 minutos, - O mediante autoclave a 121 C durante un mínimo de 2 horas. El autoclave es el major método para inactivar losa virus VIH y VHB. - NO INTRODUZCA SOLUCIONES QUE CONTENGAN HIPOCLORITO SÓDICO EN EL AUTOCLAVE. Ver el prospecto de la prueba Genscreen HIV-1 Ag Assay (referencia 71120) para las demás recomendaciones de higiene y seguridad. 6 - PRECAUCIONES La calidad de los resultados depende del respecto de las buenas prácticas de laboratorio siguientes: No utilizar reactivos después de la fecha de caducidad. No modificar el procedimiento. Antes de la utilización, esperar 30 minutos para que los reactivos se equilibren a la temperatura ambiente (18-30 C). Ver el prospecto de la prueba "Genscreen HIV-1 Ag Assay" (referencia 71120) para las demás precauciones. 16
5 7 - MUESTRAS Obtenga una muestra de sangre de acuerdo con la práctica actual. Se pueden utilizar muestras de suero, plasma, o cultivo celular. Los siguientes anticoagulantes han sido evaluados y encontrados aceptables : EDTA, heparina, citrato sódico. Véase el apartado correspondiente de Genscreen HIV-1 Ag Assay (referencia 71120) para otras instrucciones. 8 - RECONSTITUCIÓN DE LOS REACTIVOS - VALIDEZ CONSERVACIÓN Los reactivos del kit Genscreen HIV-1 Ag Confirmatory Assay están listos para usar. El kit debe conservarse a +2-8 C. Equilibrar todos los reactivos a temperatura ambiente (18-30 C) antes de su utilización. Cada elemento del kit Genscreen HIV-1 Ag Confirmatory Assay conservado a +2-8 C puede utilizarse una vez abierto hasta la fecha de caducidad indicada en la caja. 9 - PROCEDIMIENTO La duración aproximada de este ensayo es de unas 4 horas. Una vez iniciado cada ciclo del procedimiento de la prueba, debe efectuarse íntegramente y sin interrupción. ATENCIÓN! las muestras reactivas repetibles con la prueba Genscreen HIV-1 Ag Assay según el procedimiento a 37 C deben confirmarse con el Genscreen HIV-1 Ag Confirmatory Assay según el procedimiento a 37 C. Así mismo, las muestras reactivas repetibles con la prueba Genscreen HIV-1 Ag Assay según el procedimiento a 40 C deberán confirmarse con la prueba Genscreen HIV-1 Ag Confirmatory Assay según el procedimiento a 40 C. Seguir estrictamente el protocolo propuesto. Utilizar los sueros de control negativo y positivo en cada preparación de la prueba para validar la calidad de ésta última. Aplicar las buenas prácticas de laboratorio : 1. Establecer cuidadosamente el plan de distribución y de identificación de las muestras. 2. Preparar la solución de lavado diluida. 3. Sacar el marco soporte y las tiras (R1) de su embalaje protector. 4. Procedimiento de neutralización: a. Para cada muestra, etiquetar 1 tubo de ensayo de plástico con la letra A (muestra neutralizada) y 1 tubo de ensayo de plástico con la letra B (muestra control no neutralizada). Pipetear 150 μl de la muestra reactiva repetible en cada tubo. b. Para el control positivo antígeno VIH-1, etiquetar dos tubos de ensayo de plástico con la letra A (control neutralizado) y dos tubos de ensayo de plástico con la letra B (control no neutralizado). Pipetear 150 μl de control positivo antígeno VIH-1 (C1) en cada tubo. c. Para el control negativo antígeno VIH-1, etiquetar tres tubos de ensayo de plástico con la letra B (no neutralizado). Pipetear 150 μl de control negativo antígeno VIH-1 (C0) en cada tubo. d. Añadir 25 μl de reactivo de confirmación antígeno VIH-1 (RA) en cada tubo etiquetado A (neutralizado). e. Añadir 25 μl de control negativo antígeno VIH-1 (C0) en cada tubo etiquetado B (no neutralizado). f. Agitar cada tubo suavemente con el vortex o con pequeños golpecitos. Evitar la formación excesiva de espuma Bio-Rad 17
6 18 g. Incubar los tubos durante 15 a 30 minutos a temperatura ambiente (18-30 C) para que se produzca la reacción de neutralización. 5. Depositar directamente, sin prelavar la placa, y de forma sucesiva (recomendación para la distribución de la placa) : μl de diluyente de muestra en cada pocillo μl de control negativo (C0) en A1, B1, C1 150 μl de control positivo (C1) neutralizado en D1, E1 150 μl de control positivo (C1) no neutralizado en F1, G1 150 μl de muestra tratada en H1, etc En cada microplaca (utilizada total o parcialmente) deben ensayarse cuatro muestras de control positivas, dos neutralizadas y dos no neutralizadas, y tres muestras de control negativas. Comprobar que el diluyente de muestra está bien mezclado con la muestra (o con el control). Cuando las soluciones contenidas en cada pocillo están bien mezcladas, deben presentar un color uniforme. NOTA : En esta etapa se puede comprobar visualmente la distribución de las muestras puesto que tras su adición, el diluyente que inicialmente era verde vira a azul (ver capítulo 11 para la comprobación automática COMPROBACIÓN ESPECTROFOTOMÉTRICA DE LA DISTRIBUCIÓN DE LAS MUESTRAS Y DE LOS REACTIVOS) 6. Cuando sea posible, cubrir con una película autoadhesiva apretando bien toda la superficie para garantizar la estanqueidad. 7. Incubar la placa durante 60 ± 5 minutos a 37 ± 1 C o a 40 ± 1 C en una incubadora estática de calor seco. 8. Retirar la película adhesiva. Aspirar el contenido de todos los pocillos en un contenedor para residuos contaminados (que contenga hipoclorito de sodio) y añadir inmediatamente en cada uno de ellos una cantidad mínima de 0,370 ml de solución de lavado. Respetar un tiempo de remojo (tiempo de espera) de 20 a 60 segundos. Aspirar de nuevo y repetir el lavado 4 veces (en total, un mínimo de 5 lavados). El volumen residual debe ser inferior a 10 μl (si fuera necesario, secar la placa dándole la vuelta sobre una hoja de papel absorbente). Si se dispone de un lavador automático, respetar el mismo ciclo operativo. 9. Distribuir rápidamente 100 μl de la solución de trabajo conjugada 1 en todos los pocillos. Agitar el conjugado antes de usar. NOTA : La distribución de la solución de trabajo del conjugado 1, que tiene un color amarillo, puede comprobarse visualmente en esta etapa de la manipulación. 10. Si es posible, cubrir la microplaca con una película nueva. Incubar 30 ± 5 minutos a 37 ± 1 C o a 40 ± 1 C en una incubadora estática de calor seco. 11. Retirar la película adhesiva. Aspirar el contenido de todos los pocillos en un contenedor para residuos contaminados (que contenga hipoclorito de sodio) y lavar al menos 5 veces como se indicó anteriormente. Si se dispone de un lavador automático, respetar el mismo ciclo operativo. 12. Distribuir rápidamente 100 μl de la solución de trabajo conjugada 2 en todos los pocillos. Agitar el conjugado antes de usar. Nota : La distribución de la solución de trabajo del conjugado 2, que tiene un color verde, puede comprobarse visualmente en esta etapa de la manipulación.
7 13. Si es posible, cubrir la microplaca con una película nueva. Incubar 30 ± 5 minutos a 37 ± 1 C o a 40 ± 1 C en una incubadora estática de calor seco. 14. Retirar la película adhesiva, aspirar el contenido de todos los pocillos y lavar al menos 5 veces como se indicó anteriormente. El volumen residual debe ser inferior a 10 μl (si fuera necesario, secar las tiras dándoles la vuelta sobre una hoja de papel). 15. Distribuir rápidamente en todos los pocillos 100 μl de la solución de revelado de la actividad enzimática (R8 + R9) previamente preparada. Dejar que la reacción se desarrolle en la oscuridad durante 30 ± 5 minutos a temperatura ambiente (18 a 30 C). Durante esta incubación, no utilizar película adhesiva. NOTA : La distribución de la solución de revelado, que presenta un color rosa, puede controlarse visualmente en esta etapa de la manipulación: hay una diferencia de coloración significativa entre un pocillo vacío y un pocillo que contiene la solución de revelado rosada (ver apartado 11 para la comprobación automática COMPROBACIÓN ESPECTROFOTOMÉTRICA DE LA DISTRIBUCIÓN DE LAS MUESTRAS Y DE LOS REACTIVOS) 16. Añadir 100 μl de solución de parada (R10) manteniendo la misma secuencia y el mismo ritmo de distribución que para la solución de revelado. Homogeneizar la mezcla de reacción. Nota.: La distribución de la solución de parada, que es incolora, puede controlarse visualmente en esta etapa de la manipulación. La coloración del sustrato, rosa (en caso de muestras negativas) o azul (en caso de muestras positivas), desaparece de los pocillos que se vuelven incoloros (si las muestras son negativas) o amarillos (si las muestras son positivas) tras la adición de la solución de parada. 17. Limpiar cuidadosamente la parte inferior de las placas. Esperar un mínimo de 4 minutos tras la distribución de la solución de parada y, en los 30 minutos siguientes a la parada de la reacción, leer la densidad óptica a 450/ nm con un lector de placas. 18. Antes de transcribir los resultados, comprobar la concordancia entre la lectura y el plan de distribución y de identificación de las placas y de las muestras CÁLCULO E INTERPRETACIÓN DE LOS RESULTADOS La presencia de antígeno VIH-1 en una muestra se confirma por comparación del valor de la absorbencia (abs) de las muestras neutralizadas con el valor de la absorbencia (abs) de las muestras no neutralizadas. Esta comparación se expresa en porcentaje de reducción. 1) Validación de los controles positivos y negativos Comprobar que los valores individuales de los controles negativos y positivos se localizan dentro de los límites definidos en el apartado "Validación del ensayo" del prospecto de la prueba "Genscreen HIV-1 Ag Assay". Se puede descartar uno de los valores del control negativo si se encuentra fuera de las normas de validación indicadas en el prospecto del producto Genscreen HIV-1 Ag Assay. Todos los controles positivos deben tenerse en cuenta. 2) Cálculo de la media de las absorbencias (Xabs) Determinar la absorbencia media de los controles negativos y positivos (neutralizados y no neutralizados) dividiendo la suma de sus valores de absorbencia entre el número de controles aceptados. Seguir los criterios del apartado Cálculo de la media de las absorbencias del prospecto de la prueba Genscreen HIV-1 Ag Assay para calcular los valores de absorbencia medios Bio-Rad 19
8 3) Cálculo del porcentaje de reducción El porcentaje de reducción de todos los controles y de todas las muestras se determina aplicando la siguiente ecuación : abs muestra no neutralizada - abs muestra neutralizada % reducción = 100 x abs muestra no neutralizada - Xabs control negativo Ejemplo Muestra Absorbencia media Control Negativo antígeno VIH, no neutralizado Control Positivo antígeno VIH, no neutralizado Control Positivo antígeno VIH, neutralizado % de reducción de la absorbencia del control positivo HIV Ag Xabs (XCP) = x = = 100.5% reducción ) Validación del ensayo Los valores de absorbencia de cada control negativo (y control de medio de cultivo celular si fuera el caso) son superiores a 0,000 UA e inferiores o iguales a 0,100 UA. El valor de un control negativo puede descartarse. Si dos controles negativos no cumplen estos criterios, se repetirá nuevamente la valoración. El valor de absorbencia media de los controles positivos (XCP) debe ser superior o igual a 0,500 UA y los valores de absorbencia individuales deben encontrarse en una zona de reproducibilidad de 0,65 a 1,35 veces la XCP. Todos los valores de los controles positivos deben tenerse en cuenta. El porcentaje de reducción de cada control positivo neutralizado antígeno VIH debe ser, como mínimo, del 50%. 5) Interpretación de los resultados Una muestra se considera positive al antígeno VIH-1 si se alcanzan los siguientes criterios : La muestra es reactiva de forma repetida con el Genscreen HIV-1 Ag Assay. El valor de absorbencia de la muestra no neutralizada es mayor o igual al valor discriminatorio calculado. El% de reducción abs de la muestra es 50%. ADVERTENCIA : Si el valor de absorbencia de una muestra de paciente es mayor que el límite superior de linealidad del lector, utilizar el umbral superior como valor de absorbencia para los siguientes cálculos. 1. Calcular el valor umbral añadiendo un factor constante (0,050) a la media de los controles negativos. 2. Determinar el porcentaje de reducción de cada abs de muestra utilizando la ecuación incluida en el apartado Cálculo del porcentaje de reducción. 20
9 A continuación se presenta un ejemplo de valores obtenidos durante un ensayo y su correspondiente interpretación : Muestra Valores de absorbencia Media Control Negativo No neutralizado Control Positivo No neutralizado Control Positivo neutralizado Muestra No neutralizada Muestra neutralizada Ejemplo de umbral : = % reducción de CPX antígeno VIH = 100 x = = 100.5% reducción % reducción de la abs de las muestras = 100 x = = 100.5% reducción ADVERTENCIA : En ciertos casos, las muestras con un título elevado de antígeno VIH no presentarán una disminución de la señal del 50% tras añadir el reactivo de confirmación antígeno VIH-1. Por tanto, las muestras fuertemente reactivas (absorbencia 2,000) deben diluirse (por ejemplo a 1:4 o a 1:8) en control negativo antígeno VIH y ensayarse de nuevo con la prueba de confirmación Genscreen HIV-1 Ag Confirmatory Assay. Si a pesar de todo, el porcentaje de reducción no es al menos 50% con la muestra diluida y si dicha muestra sigue siendo muy reactiva, volver a diluir la primera dilución a 1:16 o más utilizando control negativo antígeno VIH-1 y ensayarla de nuevo con la prueba de confirmación Genscreen HIV-1 Ag Confirmatory Assay COMPROBACIÓN ESPECTROFOTOMÉTRICA DE LA DISTRIBUCIÓN DE LAS MUESTRAS Y DE LOS REACTIVOS Ver el prospecto de la prueba "Genscreen HIV-1 Ag Assay" (referencia 71120) Bio-Rad 21
10 12 - ESPECIFICACIONES Especificidad Un total de 2063 muestras recientes de sueros (941) y plasmas (1122) obtenidas de una población de donantes de sangre se ensayaron con la prueba Genscreen HIV-1 Ag Assay. Todas las muestras eran negativas según los resultados obtenidos previamente con las pruebas de despistaje Ac anti-vih1 y de detección del Ag HIV. Este estudio de especificidad se realizó a las 2 temperaturas de incubación que se indican en el protocolo operativo. Las dos muestras que resultaron falsos positivos repetibles no fueron neutralizadas en la prueba de confirmación. Sensibilidad Panel SFTS 96 y muestras positivas. Se realizó un estudio de sensibilidad con 78 muestras (panel SFTS positivos y pacientes seropositivos en diferentes estadios de la infección por el VIH1) que resultaron reactivas repetibles con la prueba Genscreen HIV-1 Ag Assay. De las 76 muestras reactivas repetibles con la prueba Genscreen HIV- 1 Ag Assay, todas se confirmaron con la prueba Genscreen HIV-1 Ag Confirmatory Assay. Dos muestras de pacientes, no reactivas con otro EIA, no se confirmaron con la prueba de neutralización. Se neutralizaron 55 sobrenadantes de cultivos celulares que representaban los diferentes grupos y subtipos del Ag VIH-1 (A, B, C, D, E, F, G, H, J, N y O). Se ensayaron 17 paneles de seroconversión. Todas las muestras encontradas positivas con la prueba Genscreen HIV-1 Ag Assay se confirmaron con la prueba Genscreen HIV-1 Ag Confirmatory Assay. Estudio del efecto gancho Se ensayaron concentraciones altas en antígeno HIV-1 para verificar la ausencia de efecto gancho con la prueba "Genscreen HIV-1 Ag Assay". Se diluyó un lisado viral de HIV-1 en el diluyente de control positivo para obtener concentraciones de 2 μg/ml a 0,2 pg/ml. Se neutralizan todas las muestras con concentraciones < 20 ng/ml. A partir de este valor, las muestras deben diluirse para que la neutralización sea eficaz LÍMITES DE LA PRUEBA Cuando se ensayan muestras de suero, plasma o cultivos celulares para confirmar la presencia del antígeno VIH-1, deben respetarse las recomendaciones de los prospectos de uso de las pruebas Genscreen HIV-1 Ag Assay y de la prueba de confirmación Genscreen HIV-1 Ag Confirmatory Assay. Se recomienda a los usuarios de este kit que lean el presente prospecto con atención antes de efectuar el ensayo. Los procedimientos de utilización de la prueba deben respetarse escrupulosamente en lo referente al pipeteo de las muestras y de los reactivos, al lavado de las microplacas y a los tiempos de las etapas de incubación. Pueden obtenerse resultados negativos en muestras cuyos niveles de antígeno VIH sean demasiados bajos en comparación con los límites de detección de la prueba; así mismo, pueden observarse resultados negativos si el marcador estudiado no se encuentra presente en el estadio de la enfermedad en la que se ha obtenido la muestra. Si la adición de muestra o de reactivo no se realiza según las instrucciones, se puede obtener un resultado falso negativo. En caso de sospecha clínica de infección o de error durante el procedimiento se debería efectuar una nueva valoración. Un valor de absorbencia inferior a 0,000 UA para una muestra indica un error durante el proceso o un problema con el material; en estos casos, debe repetirse el ensayo de la muestra. Ver el prospecto de la prueba "Genscreen HIV-1 Ag Assay" para otros límites de utilización. 22
11 14 - REFERENCIAS BIBLIOGRÁFICAS 1. Casey JM, Kim Y, Andersen PR, et al: Human T-cell lymphotropic virus type III: immunologic characterization and primary structure analysis of the major internal protein, p24. J Virology 55: , Ritter J, Escaich S, Trepo C, et al: HIV antigen detection in antibody negative sera. Abstract 1627, IV International Conference on AIDS, Veronese FD, Sarngadharan MG, Rahman R, et al: Monoclonal antibodies specific for p24, the major core protein of human T-cell Leukemia virus type III. Natl Acad Sci USA, 82: , Schaeffler B, Flesher A, Shriver K, Tam MR: Monoclonal antibody detection of p25 HIV antigen in the serum and CSF of patients within the AIDS spectrum. Abstract 7759, IV International Conference on AIDS, Resnick L, Veren K, Salahuddin SZ, et al: Stability and inactivation of HTLV-III/LAV under clinical laboratory environments. JAMA 255: , Sarngadharan MG, Markham PD: The role of human T-Lymphotropic retroviruses in leukemia and AIDS, in Wormser GP (ed.): AIDS and Other Manifestations of HlV Infection. New Jersey, Noyes Publications 1987, pp Bond WW, Favero MS, Petersen NJ, et al: Inactivation of Hepatitis B virus by intermediate-to-high level disinfectant chemicals. J Clin Micro 18: , Bio-Rad 23
12 (GB) - CE marking (European directive 98/79/CE on in vitro diagnostic medical devices) - Marquage CE (Directive européenne 98/79/CE relative aux dispositifs médicaux de diagnostic in vitro) - Marcado CE (Directiva europea 98/79/CE sobre productos sanitarios para diagnóstico in vitro) - Marchiatura CE (Direttiva europea 98/79/CE relativa ai dispositivi medico-diagnostici in vitro) - CE Konformitätskennzeichnung (Europäische Richtlinie 98/79/EG über In-vitro-Diagnostika) - Marcação CE (Directiva europeia 98/79/CE relativa aos dispositivos médicos de diagnóstico in vitro) - CE-märkning (Europeiskt direktiv 98/79/EG om medicintekniska produkter för in vitro-diagnostik) - CE-mærkningen (Europa direktiv 98/79/EF om medicinsk udstyr til in vitro-diagnostik) - CE ( 98/79/CE in vitro ) - CE oznaczenie (Dyrektywa unijna 98/79/CE dotycząca produktów medycznych do badań in vitro) - CE ženklas (Europos sąjungos direktyva 98/79/CE dėl in vitro diagnostikos medicinos prietaisų) - CE jelzés (98/79/CE Európai Irányelv az in vitro orvosi diagnosztikai eszközökről) - CE märgistus (Euroopa direktiiv 98/79/CE in vitro diagnostikameditsiiniseadmete kohta) - CE označenie o zhode (Európska direktíva 98/79/CE pre in vitro diagnostické zdravotnícke postupy) - CE značka (Evropská direktiva 98/79/CE o diagnostických zdravotnických prostředcích in vitro) - CE-merking (EU-direktiv 98/79/CE om medisinsk utstyr til in vitro-diagnostikk) - Marca CE (Directiva europeana 98/79/CE pentru dispozitive medicale de diagnostic in vitro) - СЕ маркировка (Европейска директива 98/79/CE за ин витро диагностичните медицински изделия) IVD (GB) - For in vitro diagnostic use - Pour diagnostic in vitro - Para diagnóstico in vitro - Per uso diagnostico in vitro - In-vitro-Diagnostikum - Para uso em diagnóstico in vitro - In vitro-diagnostik - In vitro diagnose - in vitro - Do stosowania in vitro - in vitro diagnostikai - Csak in vitro diagnosztikai alkalmazásra - In vitro diagnostiliseks kasutamiseks - Na diagnostiku in vitro - Pro diagnostiku in vitro - Til in vitro-diagnostikk - Pentru diagnostic in vitro - За ин витро диагностика (GB) - Catalogue number - Référence catalogue - Número de catálogo - Numero di catalogo - Bestellnummer - Número de catálogo - Katalognummer - Katalognummer - - Numer katalogu - Katalogo numeris - Cikkszám - Katalooginumber - Katalógové číslo - Katalogové číslo - Katalognummer - Număr de catalog - Каталожен номер (GB) - Manufacturer - Fabricant - Fabricante - Produttore - Hersteller - Fabricante - Tillverkad av - Fremstillet af - - Producent - Gamintojas - Gyártó - Tootja - Výrobca - Výrobce - Produsent - Producător - Производител (GB) - Authorised Representative - Représentant agréé - Representante autorizado - Distributore autorizzato - Bevollmächtigter - Representante Autorizado - Auktoriserad representant - Autoriseret repræsentant - - Upoważniony Przedstawiciel - Įgaliotasis atstovas - Meghatalmazott Képviselő - Volitatud esindaja - Autorizovaný zástupca - Zplnomocněný zástupce - Autorisert representant - Reprezentant autorizat - Упълномощен представител
13 (GB) - Batch code - Code du lot - Código de lote - Codice del lotto - Chargen-Bezeichnung - Código do lote - Batchnr - Batchkoden - - Numer serii - Serijos numeris - Gyártási szám - Partii kood - Číslo šarže - Číslo šarže - Partikode - Număr de lot - Партиден номер (GB) - Expiry date YYYY/MM/DD - Date de peremption AAAA/MM/JJ - Estable hasta AAAA/MM/DD - Da utilizzare prima del AAAA/MM/GG - Verwendbar bis JJJJ/MM/TT - Data de expiração AAAA/MM/DD - Utgångsdatum ÅÅÅÅ/MM/DD - Anvendes før ÅÅÅÅ/MM/DD - YYYY/MM/DD - Data ważności YYYY/MM/DD - Galioja iki YYYY/MM/DD - Szavatossági idő ÉÉÉÉ/HH/NN - Aegumistähtaeg AAAA/KK/PP - Použiteľné do RRRR/MM/DD - Datum exspirace RRRR/MM/DD - Utløpsdato ÅÅÅÅ/MM/DD - Data expirarii AAAA/LL/ZZ - Срок на годност година/месец/ден (GB) - Storage temperature limitation - Limites de températures de stockage - Temperatura límite - Limiti di temperatura di conservazione - Lagertemperatur - Limites de temperatura de armazenamento - Temperaturbegränsning - Temperaturbegrænsning - - Temperatura przechowywania - Saugojimo temperatūriniai apribojimai - Tárolási hőmérsékleti határok - Piirangud säilitustemperatuurile - Skladovacia teplota od do - Teplotní rozmezí od do - Oppbevaringstemperatur - Limitele de temperatură la stocare - Температурни граници на съхранение (GB) - Consult Instruction for use - Consulter le mode d'emploi - Consulte las instrucciones de uso - Consultare le istruzioni per uso - Siehe Gebrauchsanweisung - Consulte o folheto informativo - Se bruksanvisningen - Se instruktion før brug - - Sprawdź instrukcję - Ieškokite informacijos vartojimo instrukcijoje - Olvassa el a használati utasítást - Kasutamisel vaata instruktsiooni - Katalógové číslo - Viz návod k použití - Se bruksanvisninger - Consultati prospectul de utilizare - Виж инструкцията за употреба
14 Bio-Rad 3, bd Raymond Poincaré Marnes-la-Coquette - France Tél.: /2009 Fax.: Code:
Monolisa HBs Ag ULTRA 72408
 Monolisa HBs Ag ULTRA 72408 Confirmatory 25 tests PRUEBA PARA LA CONFIRMACIÓN DE LA PRESENCIA DEL ANTÍGENO DE SUPERFICIE DEL VIRUS DE LA HEPATITIS B EN EL SUERO O EL PLASMA HUMANO IVD Control de calidad
Monolisa HBs Ag ULTRA 72408 Confirmatory 25 tests PRUEBA PARA LA CONFIRMACIÓN DE LA PRESENCIA DEL ANTÍGENO DE SUPERFICIE DEL VIRUS DE LA HEPATITIS B EN EL SUERO O EL PLASMA HUMANO IVD Control de calidad
Genscreen HIV-1 Ag Assay 192 Tests 71120
 Genscreen HIV-1 Ag Assay 192 Tests 71120 TEST IMMUNOENZIMÁTICO (EIA, ENZYME IMMUNOASSAY) PARA LA DETECCIÓN DEL ANTÍGENO P24 DEL VIRUS DE LA IMMUNODEFICIENCIA ADQUIRIDA HUMANA DE TIPO 1 (VIH-1) EN EL SUERO
Genscreen HIV-1 Ag Assay 192 Tests 71120 TEST IMMUNOENZIMÁTICO (EIA, ENZYME IMMUNOASSAY) PARA LA DETECCIÓN DEL ANTÍGENO P24 DEL VIRUS DE LA IMMUNODEFICIENCIA ADQUIRIDA HUMANA DE TIPO 1 (VIH-1) EN EL SUERO
18 determinaciones 72251 EQUIPO DE CONFIRMACIÓN PARA LA DETECCIÓN DE ANTICUERPOS ANTI-HIV-1 EN SUERO/PLASMA MEDIANTE INMUNOTRANSFERENCIA
 NEW LAV BLOT I 18 determinaciones 72251 EQUIPO DE CONFIRMACIÓN PARA LA DETECCIÓN DE ANTICUERPOS ANTI-HIV-1 EN SUERO/PLASMA MEDIANTE INMUNOTRANSFERENCIA IVD Control de calidad del fabricante Todos los productos
NEW LAV BLOT I 18 determinaciones 72251 EQUIPO DE CONFIRMACIÓN PARA LA DETECCIÓN DE ANTICUERPOS ANTI-HIV-1 EN SUERO/PLASMA MEDIANTE INMUNOTRANSFERENCIA IVD Control de calidad del fabricante Todos los productos
GARANTÍAS MÍNIMAS DE CALIDAD EN LA PRODUCCIÓN DE PLASMA RICO EN PLAQUETAS (PRP)
 GARANTÍAS MÍNIMAS DE CALIDAD EN LA PRODUCCIÓN DE PLASMA RICO EN PLAQUETAS (PRP) Existen diferentes modalidades de producción de PRP y es necesario establecer las garantías mínimas de calidad en la producción,
GARANTÍAS MÍNIMAS DE CALIDAD EN LA PRODUCCIÓN DE PLASMA RICO EN PLAQUETAS (PRP) Existen diferentes modalidades de producción de PRP y es necesario establecer las garantías mínimas de calidad en la producción,
Genscreen HIV-1/2 Version 2
 Genscreen HIV-1/2 Version 2 1 placa - 96 tests 72278 5 placas - 480 tests 72279 PARA LA DETECCIÓN DE ANTICUERPOS ANTI VIH-1 Y ANTI VIH-2 EN EL SUERO/PLASMA MEDIANTE TÉCNICA INMUNOENZIMÁTICA IVD Control
Genscreen HIV-1/2 Version 2 1 placa - 96 tests 72278 5 placas - 480 tests 72279 PARA LA DETECCIÓN DE ANTICUERPOS ANTI VIH-1 Y ANTI VIH-2 EN EL SUERO/PLASMA MEDIANTE TÉCNICA INMUNOENZIMÁTICA IVD Control
ScanGel NEUTRAL 86429 48 Tarjetas 86430 1080 Tarjetas
 ScanGel NEUTRAL 86429 48 Tarjetas 86430 1080 Tarjetas GEL NEUTRO Grupo sérico, screening de Ac irregulares, pruebas cruzadas IVD Todos los productos fabricados y comercializados por la sociedad Bio-Rad
ScanGel NEUTRAL 86429 48 Tarjetas 86430 1080 Tarjetas GEL NEUTRO Grupo sérico, screening de Ac irregulares, pruebas cruzadas IVD Todos los productos fabricados y comercializados por la sociedad Bio-Rad
PROSPECTO. Para uso diagnóstico in vitro. Para uso en la preparación y aislamiento de linfocitos purificados directamente de sangre entera.
 Para uso en la preparación y aislamiento de linfocitos purificados directamente de sangre entera. PROSPECTO Para uso diagnóstico in vitro PI-TT.610-ES-V5 Información e instrucciones Uso previsto El reactivo
Para uso en la preparación y aislamiento de linfocitos purificados directamente de sangre entera. PROSPECTO Para uso diagnóstico in vitro PI-TT.610-ES-V5 Información e instrucciones Uso previsto El reactivo
Monolisa HBc IgM PLUS 96 tests 72382
 Monolisa HBc IgM PLUS 96 tests 72382 KIT DE DETECCIÓN DE LAS IgM ESPÉCÍFICAS DIRIGIDAS CONTRA EL ANTÍGENO DEL CORE DEL VIRUS DE LA HEPATITIS B POR EL MÉTODO INMUNOENZIMÁTICO IVD Control de calidad del
Monolisa HBc IgM PLUS 96 tests 72382 KIT DE DETECCIÓN DE LAS IgM ESPÉCÍFICAS DIRIGIDAS CONTRA EL ANTÍGENO DEL CORE DEL VIRUS DE LA HEPATITIS B POR EL MÉTODO INMUNOENZIMÁTICO IVD Control de calidad del
PLASMA DE CONEJO 56352
 PLASMA DE CONEJO 56352 PARA PRUEBA DE COAGULASA IVD 1- USO PREVISTO El plasma de conejo liofilizado se usa para la detección de coagulasa libre producida por Staphylococcus aureus. 2- PRINCIPIO La producción
PLASMA DE CONEJO 56352 PARA PRUEBA DE COAGULASA IVD 1- USO PREVISTO El plasma de conejo liofilizado se usa para la detección de coagulasa libre producida por Staphylococcus aureus. 2- PRINCIPIO La producción
Pruebas rápidas r. Estrategias preventivas. Propuesta de nuevas estrategias preventivas
 XV ENCUENTRO ESTATAL PARA ONG s Madrid, 1-3 de Octubre 2009 Diagnóstico tardío o. Pruebas rápidas r Dra Carmen Rodríguez Centro Sanitario Sandoval Madrid Estrategias preventivas La prevención de nuevas
XV ENCUENTRO ESTATAL PARA ONG s Madrid, 1-3 de Octubre 2009 Diagnóstico tardío o. Pruebas rápidas r Dra Carmen Rodríguez Centro Sanitario Sandoval Madrid Estrategias preventivas La prevención de nuevas
Monolisa HBsAgULTRA 1 placa - 96 pruebas placas pruebas 72348
 Monolisa HBsAgULTRA 1 placa - 96 pruebas 72346 5 placas - 480 pruebas 72348 KIT PARA LA DETECCIÓN DEL ANTÍGENO DE SUPERFICIE DEL VIRUS DE LA HEPATITIS B POR EL MÉTODO INMUNOENZIMÁTICO EN EL SUERO O EL
Monolisa HBsAgULTRA 1 placa - 96 pruebas 72346 5 placas - 480 pruebas 72348 KIT PARA LA DETECCIÓN DEL ANTÍGENO DE SUPERFICIE DEL VIRUS DE LA HEPATITIS B POR EL MÉTODO INMUNOENZIMÁTICO EN EL SUERO O EL
Pruebas serológicas para dengue
 Pruebas serológicas para dengue El 40% de la población mundial corre riesgo de infección por dengue Durante más de 25 años, Focus Diagnostics ha sido un líder en el desarrollo de ensayos inmunológicos
Pruebas serológicas para dengue El 40% de la población mundial corre riesgo de infección por dengue Durante más de 25 años, Focus Diagnostics ha sido un líder en el desarrollo de ensayos inmunológicos
Guía de Preparación de Muestras para PLASTICOS para el Software de Formulación de Datacolor
 Guía de Preparación de Muestras para PLASTICOS para el Software de Formulación de Datacolor 1. Generalidades 2. Qué se necesita para comenzar? 3. Qué hacer para sistemas opacos y translúcidos? 4. Qué hacer
Guía de Preparación de Muestras para PLASTICOS para el Software de Formulación de Datacolor 1. Generalidades 2. Qué se necesita para comenzar? 3. Qué hacer para sistemas opacos y translúcidos? 4. Qué hacer
Monolisa Total Anti-HAV PLUS plaques tests
 Monolisa Total Anti-HAV PLUS 72481 2 plaques - 192 tests EQUIPO REACTIVO PARA LA DETECCIÓN Y LA CUANTIFICACIÓN DE LOS ANTICUERPOS TOTALES ANTI VHA POR UNA TÉCNICA INMUNOENZIMÁTICA EN EL SUERO Y EL PLASMA
Monolisa Total Anti-HAV PLUS 72481 2 plaques - 192 tests EQUIPO REACTIVO PARA LA DETECCIÓN Y LA CUANTIFICACIÓN DE LOS ANTICUERPOS TOTALES ANTI VHA POR UNA TÉCNICA INMUNOENZIMÁTICA EN EL SUERO Y EL PLASMA
Monolisa Anti-HBs PLUS 192 tests 72566
 Monolisa Anti-HBs PLUS 192 tests 72566 EQUIPO REACTIVO DE DETECCIÓN Y CUANTIFICACIÓN DE LOS ANTICUERPOS ANTI-HBs EN EL SUERO/PLASMA HUMANO POR EL MÉTODO INMUNOENZIMÁTICO IVD Control de calidad del fabricante
Monolisa Anti-HBs PLUS 192 tests 72566 EQUIPO REACTIVO DE DETECCIÓN Y CUANTIFICACIÓN DE LOS ANTICUERPOS ANTI-HBs EN EL SUERO/PLASMA HUMANO POR EL MÉTODO INMUNOENZIMÁTICO IVD Control de calidad del fabricante
Monolisa HBe Ag-Ab PLUS tests HBe Ag - 96 tests HBe Ab
 Monolisa HBe Ag-Ab PLUS 72396 96 tests HBe Ag - 96 tests HBe Ab KIT DE DETECCIÓN DE LOS ANTÍGENOS HBe Y DE LOS ANTICUERPOS HBe POR EL MÉTODO INMUNOENZIMÁTICO IVD Control de calidad del fabricante Todos
Monolisa HBe Ag-Ab PLUS 72396 96 tests HBe Ag - 96 tests HBe Ab KIT DE DETECCIÓN DE LOS ANTÍGENOS HBe Y DE LOS ANTICUERPOS HBe POR EL MÉTODO INMUNOENZIMÁTICO IVD Control de calidad del fabricante Todos
GARANTIAS MINIMAS DE CALIDAD Y SEGURIDAD EXIGIBLES PARA LA UTILIZACION DE PLASMA RICO EN PLAQUETAS (PRP) EN LA COMUNIDAD AUTONOMA DE LA REGION DE
 GARANTIAS MINIMAS DE CALIDAD Y SEGURIDAD EXIGIBLES PARA LA UTILIZACION DE PLASMA RICO EN PLAQUETAS (PRP) EN LA COMUNIDAD AUTONOMA DE LA REGION DE MURCIA 1 GARANTIAS MINIMAS DE CALIDAD Y SEGURIDAD EXIGIBLES
GARANTIAS MINIMAS DE CALIDAD Y SEGURIDAD EXIGIBLES PARA LA UTILIZACION DE PLASMA RICO EN PLAQUETAS (PRP) EN LA COMUNIDAD AUTONOMA DE LA REGION DE MURCIA 1 GARANTIAS MINIMAS DE CALIDAD Y SEGURIDAD EXIGIBLES
PLATELIA HSV 1+2 IgM 96 PRUEBAS 72822. DETECCIÓN CUALITATIVA DE ANTICUERPOS IgM ANTI-HSV 1+2, EN SUERO O PLASMA HUMANO, POR MÉTODO INMUNOENZIMÁTICO
 PLATELIA HSV 1+2 IgM 96 PRUEBAS 72822 DETECCIÓN CUALITATIVA DE ANTICUERPOS IgM ANTI-HSV 1+2, EN SUERO O PLASMA HUMANO, POR MÉTODO INMUNOENZIMÁTICO 1. CAMPO DE APLICACIÓN Platelia HSV 1+2 IgM es una prueba
PLATELIA HSV 1+2 IgM 96 PRUEBAS 72822 DETECCIÓN CUALITATIVA DE ANTICUERPOS IgM ANTI-HSV 1+2, EN SUERO O PLASMA HUMANO, POR MÉTODO INMUNOENZIMÁTICO 1. CAMPO DE APLICACIÓN Platelia HSV 1+2 IgM es una prueba
CUANTIFICACIÓN DE ADENOSIN DESAMINASA (ADA)
 CUANTIFICACIÓN DE ADENOSIN DESAMINASA (ADA) PROTOCOLO ADA FUNDAMENTO DEL METODO: La adenosindesaminasa (ADA) es una enzima del catabolismo de las purinas que cataliza la conversión de la adenosina en inosina
CUANTIFICACIÓN DE ADENOSIN DESAMINASA (ADA) PROTOCOLO ADA FUNDAMENTO DEL METODO: La adenosindesaminasa (ADA) es una enzima del catabolismo de las purinas que cataliza la conversión de la adenosina en inosina
Absoluta sencillez. Absoluta seguridad. Simple. Confiable. Económico
 Absoluta sencillez. Absoluta seguridad. Simple. Confiable. Económico Más de 20 determinaciones HIV Anticuerpos, Ag p24 y confirmatorio HEPATITIS A, B y C ToRCH Toxoplasmosis (Toxo) Rubeola Citomegalovirus
Absoluta sencillez. Absoluta seguridad. Simple. Confiable. Económico Más de 20 determinaciones HIV Anticuerpos, Ag p24 y confirmatorio HEPATITIS A, B y C ToRCH Toxoplasmosis (Toxo) Rubeola Citomegalovirus
DANAGENE RNA PURIFICATION KIT
 DANAGENE RNA PURIFICATION KIT REF.0801.1 100 EXTRACCIONES REF.0801.2 500 EXTRACCIONES 1.INTRODUCCION Este kit permite la permite la obtención de ARN total a partir de cultivos celulares, tejidos animales,
DANAGENE RNA PURIFICATION KIT REF.0801.1 100 EXTRACCIONES REF.0801.2 500 EXTRACCIONES 1.INTRODUCCION Este kit permite la permite la obtención de ARN total a partir de cultivos celulares, tejidos animales,
Murex anti-hbc (total)
 es 8G21-01/-02 GE65/66 Primera edición 10/2009 Murex anti-hbc (total) Enzimoinmunoanálisis para la detección de anticuerpos frente al antígeno core del virus de la hepatitis B (anti-hbc) en suero o plasma
es 8G21-01/-02 GE65/66 Primera edición 10/2009 Murex anti-hbc (total) Enzimoinmunoanálisis para la detección de anticuerpos frente al antígeno core del virus de la hepatitis B (anti-hbc) en suero o plasma
4. DIL SAMP DILUYENTE DE LAS MUESTRAS: Tampón fosfato con proteínas estabilizadoras y conservantes. Listo para usar.
 bioelisa HIV-1+2 (rec) 3000-1143 LEER CAMBIOS SOMBREADOS 96 tests 3000-1144 480 tests Test de ELISA para la detección de anticuerpos contra HIV-1 y HIV-2 en suero o plasma humano. Sumario Como es conocido
bioelisa HIV-1+2 (rec) 3000-1143 LEER CAMBIOS SOMBREADOS 96 tests 3000-1144 480 tests Test de ELISA para la detección de anticuerpos contra HIV-1 y HIV-2 en suero o plasma humano. Sumario Como es conocido
TaqMan GMO Screening Kit. Part No: 4466334
 TaqMan GMO Screening Kit Part No: 4466334 1. Introducción Los organismos modificados genéticamente (OMG) se encuentran ampliamente distribuidos, siendo la soja y el maíz los vegetales que ocupan mayor
TaqMan GMO Screening Kit Part No: 4466334 1. Introducción Los organismos modificados genéticamente (OMG) se encuentran ampliamente distribuidos, siendo la soja y el maíz los vegetales que ocupan mayor
NEW LAV BLOT II 18 Determinaciones 72252
 NEW LAV BLOT II 18 Determinaciones 72252 KIT DE CONFIRMACIÓN PARA LA DETECCIÓN DE LOS ANTICUERPOS HUMANOS ANTI-HIV-2 EN EL SUERO/PLASMA POR INMUNOBLOTTING IVD Control de calidad del fabricante Todos los
NEW LAV BLOT II 18 Determinaciones 72252 KIT DE CONFIRMACIÓN PARA LA DETECCIÓN DE LOS ANTICUERPOS HUMANOS ANTI-HIV-2 EN EL SUERO/PLASMA POR INMUNOBLOTTING IVD Control de calidad del fabricante Todos los
TaqMan GMO Maize Quantification Kit. Part No: 4481972
 TaqMan GMO Maize Quantification Kit Part No: 4481972 1. Introducción Los organismos modificados genéticamente (OMG) se encuentran ampliamente distribuidos, siendo la soja y el maíz los vegetales que ocupan
TaqMan GMO Maize Quantification Kit Part No: 4481972 1. Introducción Los organismos modificados genéticamente (OMG) se encuentran ampliamente distribuidos, siendo la soja y el maíz los vegetales que ocupan
PRACTICA Núm. 16 RECUENTO DE BACTERIAS MESOFILAS AEROBIAS EN AGUA PARA CONSUMO HUMANO
 PRACTICA Núm. 16 RECUENTO DE BACTERIAS MESOFILAS AEROBIAS EN AGUA PARA CONSUMO HUMANO I. OBJETIVO Determinar la presencia de bacterias Mesófilas Aerobias en una muestra de agua potable por la técnica de
PRACTICA Núm. 16 RECUENTO DE BACTERIAS MESOFILAS AEROBIAS EN AGUA PARA CONSUMO HUMANO I. OBJETIVO Determinar la presencia de bacterias Mesófilas Aerobias en una muestra de agua potable por la técnica de
PROTOCOLOS DE OBTENCIÓN, CONSERVACIÓN Y ENVÍO DE MUESTRAS BIOLÓGICAS
 PROTOCOLOS DE OBTENCIÓN, CONSERVACIÓN Y ENVÍO DE MUESTRAS BIOLÓGICAS ESTUDIO TRASLACIONAL PROSPECTIVO DE DETERMINACIÓN DE FACTORES PREDICTIVOS DE EFICACIA Y TOXICIDAD EN PACIENTES CON CÁNCER ÍNDICE 1 INTRODUCCIÓN....
PROTOCOLOS DE OBTENCIÓN, CONSERVACIÓN Y ENVÍO DE MUESTRAS BIOLÓGICAS ESTUDIO TRASLACIONAL PROSPECTIVO DE DETERMINACIÓN DE FACTORES PREDICTIVOS DE EFICACIA Y TOXICIDAD EN PACIENTES CON CÁNCER ÍNDICE 1 INTRODUCCIÓN....
Componentes 1. MCPL MICROPLACA: 12 x 8 pocillos recubiertos con antígenos recombinantes de HCV (E. coli). Pocillos separables individualmente.
 bioelisa HCV 4.0 3000-1115 LEER CAMBIOS SOMBREADOS 96 tests 3000-1116 480 tests Test de ELISA para la detección de anticuerpos contra el virus de la hepatitis C (HCV) en suero o plasma humano para ser
bioelisa HCV 4.0 3000-1115 LEER CAMBIOS SOMBREADOS 96 tests 3000-1116 480 tests Test de ELISA para la detección de anticuerpos contra el virus de la hepatitis C (HCV) en suero o plasma humano para ser
SEGURIDAD DE PRODUCTOS SANITARIOS NOTA INFORMATIVA
 agencia española de Ref: 004 / Nov. 2004 SEGURIDAD DE PRODUCTOS SANITARIOS NOTA INFORMATIVA SEGUIMIENTO DE LAS INDICACIONES DEL ETIQUETADO Y LAS INSTRUCCIONES DE USO DE LOS PRODUCTOS SANITARIOS Ámbito
agencia española de Ref: 004 / Nov. 2004 SEGURIDAD DE PRODUCTOS SANITARIOS NOTA INFORMATIVA SEGUIMIENTO DE LAS INDICACIONES DEL ETIQUETADO Y LAS INSTRUCCIONES DE USO DE LOS PRODUCTOS SANITARIOS Ámbito
GUÍA PARA SISTEMAS DE RASTREABILIDAD
 REQUISITOS GENERALES Y RECOMENDACIONES PARA IMPLEMENTAR RASTREABILIDAD DE ALIMENTOS AGROPECUARIOS PRIMARIOS Y PIENSOS 1 CAMPO DE APLICACIÓN Esta guía específica los requisitos mínimos que debe cumplir
REQUISITOS GENERALES Y RECOMENDACIONES PARA IMPLEMENTAR RASTREABILIDAD DE ALIMENTOS AGROPECUARIOS PRIMARIOS Y PIENSOS 1 CAMPO DE APLICACIÓN Esta guía específica los requisitos mínimos que debe cumplir
Plan de Mantenimiento Preventivo de Aparatos y Equipos. Loles Franco Jose Manuel Cebrián
 Plan de Mantenimiento Preventivo de Aparatos y Equipos Loles Franco Jose Manuel Cebrián 1 1. Conceptos generales: Mantenimiento, Verificación y Calibración 2. Por qué se requiere el control de los equipos?
Plan de Mantenimiento Preventivo de Aparatos y Equipos Loles Franco Jose Manuel Cebrián 1 1. Conceptos generales: Mantenimiento, Verificación y Calibración 2. Por qué se requiere el control de los equipos?
Analizador portátil til CD4. Solución innovadora y revolucionaria para el seguimiento de pacientes HIV positivos
 Analizador portátil til CD4 Solución innovadora y revolucionaria para el seguimiento de pacientes HIV positivos Qué es PIMA? Es la primer solución point-of-care para el análisis de CD4. Diseñado para desempeñarse
Analizador portátil til CD4 Solución innovadora y revolucionaria para el seguimiento de pacientes HIV positivos Qué es PIMA? Es la primer solución point-of-care para el análisis de CD4. Diseñado para desempeñarse
6. Conservación y almacenaje de medicamentos
 6. Conservación y almacenaje de medicamentos 6.1. Normas generales de almacenamiento y conservación Los medicamentos deben conservarse en las condiciones idóneas para impedir su alteración. Los laboratorios
6. Conservación y almacenaje de medicamentos 6.1. Normas generales de almacenamiento y conservación Los medicamentos deben conservarse en las condiciones idóneas para impedir su alteración. Los laboratorios
Mantenimiento. Mantenimiento
 Mantenimiento Esta sección incluye: "Carga de tinta" en la página 7-32 "Vaciado de la bandeja de desechos" en la página 7-36 "Sustitución del kit de mantenimiento" en la página 7-39 "Limpieza de la cuchilla
Mantenimiento Esta sección incluye: "Carga de tinta" en la página 7-32 "Vaciado de la bandeja de desechos" en la página 7-36 "Sustitución del kit de mantenimiento" en la página 7-39 "Limpieza de la cuchilla
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
LABORATORIO: MICROBIOLOGÍA BIOQUÍMICA Y HEMATOLOGÍA.
 LABORATORIO: MICROBIOLOGÍA BIOQUÍMICA Y HEMATOLOGÍA. CS Illes Columbretes Página 1 En el laboratorio de microbiología se realizan investigaciones microbiológicas (diagnóstico bacteriológico, micológico,
LABORATORIO: MICROBIOLOGÍA BIOQUÍMICA Y HEMATOLOGÍA. CS Illes Columbretes Página 1 En el laboratorio de microbiología se realizan investigaciones microbiológicas (diagnóstico bacteriológico, micológico,
PRUEBA RAPIDA EN EMBARAZADAS (n=62,214 2009-Junio 2010) NO REACTIVO n=218 REACTIVO INDETERMINADO. Tabla 9: Resultados Prueba rápida
 11-RESULTADOS 11.1-Interpretación y análisis de resultados Un total de de 62,214 mujeres embarazadas se realizaron la prueba rápida de VIH durante años 2009 hasta junio 2010 (Tabla 9). De ellas, 61,808
11-RESULTADOS 11.1-Interpretación y análisis de resultados Un total de de 62,214 mujeres embarazadas se realizaron la prueba rápida de VIH durante años 2009 hasta junio 2010 (Tabla 9). De ellas, 61,808
DANAGENE SALIVA KIT. Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones
 DANAGENE SALIVA KIT Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones 1.INTRODUCCION DANAGENE SALIVA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de muestras
DANAGENE SALIVA KIT Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones 1.INTRODUCCION DANAGENE SALIVA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de muestras
PRUEBA DE VIH. Universidad de Panamá USAID Proyecto Capacity Centroamérica
 PRUEBA DE VIH Universidad de Panamá USAID Proyecto Capacity Centroamérica Es la prueba de detección que produce los resultados rápidamente, en aproximadamente 20 minutos y utiliza sangre de una vena o
PRUEBA DE VIH Universidad de Panamá USAID Proyecto Capacity Centroamérica Es la prueba de detección que produce los resultados rápidamente, en aproximadamente 20 minutos y utiliza sangre de una vena o
8. GESTIÓN DE RESIDUOS BIOSANITARIOS
 Página 1 de 8 8. GESTIÓN DE Los residuos biosanitarios generados en la UCLM son de diversa naturaleza por lo que cada tipo debe ser gestionado según la categoría a la que pertenece. La principal producción
Página 1 de 8 8. GESTIÓN DE Los residuos biosanitarios generados en la UCLM son de diversa naturaleza por lo que cada tipo debe ser gestionado según la categoría a la que pertenece. La principal producción
ANÁLISIS DE AGUAS: Metodología
 FTTM06 Rev-2,21/11/2013 INSTITUTO DE TOXICOLOGÍA DE LA DEFENSA Hospital Central de la Defensa. Glorieta del Ejército s/n. 28047 MADRID. Tel.: 914222625. Fax: 914222624 E- mail : toxicologia@oc.mde.es Web
FTTM06 Rev-2,21/11/2013 INSTITUTO DE TOXICOLOGÍA DE LA DEFENSA Hospital Central de la Defensa. Glorieta del Ejército s/n. 28047 MADRID. Tel.: 914222625. Fax: 914222624 E- mail : toxicologia@oc.mde.es Web
Indicadores 3M Monitor Mark y 3M Freeze Watch. Para una gestión eficaz de la cadena de frío. 3Innovación
 Indicadores M Monitor Mark y M Freeze Watch 5 4 2 1 Para una gestión eficaz de la cadena de frío Innovación Indicadores M Monitor Mark y M Freeze Watch Cuando se trata de productos que pueden deteriorarse
Indicadores M Monitor Mark y M Freeze Watch 5 4 2 1 Para una gestión eficaz de la cadena de frío Innovación Indicadores M Monitor Mark y M Freeze Watch Cuando se trata de productos que pueden deteriorarse
CONFIRMACIÓN EPIDEMIOLÓGICA DE LA ENFERMEDAD DE AUJESZKY ANTE LA PRESENCIA DE ANIMALES POSITIVOS AISLADOS O FALSOS POSITIVOS
 MINISTERIO DE MEDIO AMBIENTE Y MEDIO RURAL Y MARINO DG DE RECURSOS AGRICOLAS Y GANADEROS SUBDIRECCIÓN GENERAL DE SANIDAD DE LA PRODUCCIÓIN PRIMARIA PROTOCOLO DE ACTUACIÓN PARA LA CONFIRMACIÓN EPIDEMIOLÓGICA
MINISTERIO DE MEDIO AMBIENTE Y MEDIO RURAL Y MARINO DG DE RECURSOS AGRICOLAS Y GANADEROS SUBDIRECCIÓN GENERAL DE SANIDAD DE LA PRODUCCIÓIN PRIMARIA PROTOCOLO DE ACTUACIÓN PARA LA CONFIRMACIÓN EPIDEMIOLÓGICA
Plan de gestión intracentro para un ambulatorio de atención primaria
 Plan de gestión intracentro para un ambulatorio de atención primaria OBJETIVOS El objetivo que se persigue es establecer la sistemática de actuación para: Ä Segregar correctamente, y en origen, los Residuos
Plan de gestión intracentro para un ambulatorio de atención primaria OBJETIVOS El objetivo que se persigue es establecer la sistemática de actuación para: Ä Segregar correctamente, y en origen, los Residuos
NycoCard CRP Single Test
 NycoCard CRP Single Test ES DESCRIPCION DEL PRODUCTO Aplicaciones NycoCard CRP Single Test es un test de diagnóstico in vitro para medir de una forma rápida la proteína C reactiva (CRP) en la sangre humana.
NycoCard CRP Single Test ES DESCRIPCION DEL PRODUCTO Aplicaciones NycoCard CRP Single Test es un test de diagnóstico in vitro para medir de una forma rápida la proteína C reactiva (CRP) en la sangre humana.
EQUIPO PORTÁTIL PARA LA DETERMINACIÓN DE CLORO DISPONIBLE EN SOLUCIONES CONCENTRADAS DE HIPOCLORITO
 UNIDAD DE APOYO TÉCNICO PARA EL SANEAMIENTO BÁSICO DEL ÁREA RURAL EQUIPO PORTÁTIL PARA LA DETERMINACIÓN DE CLORO DISPONIBLE EN SOLUCIONES CONCENTRADAS DE HIPOCLORITO Centro Panamericano de Ingeniería Sanitaria
UNIDAD DE APOYO TÉCNICO PARA EL SANEAMIENTO BÁSICO DEL ÁREA RURAL EQUIPO PORTÁTIL PARA LA DETERMINACIÓN DE CLORO DISPONIBLE EN SOLUCIONES CONCENTRADAS DE HIPOCLORITO Centro Panamericano de Ingeniería Sanitaria
FICHA DE DATOS DE SEGURIDAD (MSDS) KIT CLART CMA KRAS BRAF PI3K
 1. Identificación de la sustancia y proveedor Nombre comercial CLART CMA KRAS BRAF PI3K Referencias: Amplificación KRAS 8 determinaciones Ref.: CS-0412-8 24 determinaciones Ref.: CS-0412-24 Amplificación
1. Identificación de la sustancia y proveedor Nombre comercial CLART CMA KRAS BRAF PI3K Referencias: Amplificación KRAS 8 determinaciones Ref.: CS-0412-8 24 determinaciones Ref.: CS-0412-24 Amplificación
Diagnóstico microbiológico de la infección por HIV
 Diagnóstico microbiológico de la infección por HIV Juan Carlos Rodríguez Díaz S. Microbiología Hospital General Universitario de Alicante E-mail: rodriguez_juadia@gva.es http://microbiología-alicante.umh.es
Diagnóstico microbiológico de la infección por HIV Juan Carlos Rodríguez Díaz S. Microbiología Hospital General Universitario de Alicante E-mail: rodriguez_juadia@gva.es http://microbiología-alicante.umh.es
Prospecto: información par el usuario. SEBUMSELEN champú Sulfuro de selenio / Benzalconio cloruro
 Prospecto: información par el usuario SEBUMSELEN champú Sulfuro de selenio / Benzalconio cloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
Prospecto: información par el usuario SEBUMSELEN champú Sulfuro de selenio / Benzalconio cloruro Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información
POR QUÉ YA NO SE RECOMIENDA ESPERAR 3 MESES PARA HACERSE LA PRUEBA DEL VIH?
 QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
Detección de IgE específica.
 Detección de IgE específica. Una forma de identificar los alérgenos responsables de los síntomas alérgicos es la detección de anticuerpos IgE específicos frente a dichos alérgenos. Estos anticuerpos están
Detección de IgE específica. Una forma de identificar los alérgenos responsables de los síntomas alérgicos es la detección de anticuerpos IgE específicos frente a dichos alérgenos. Estos anticuerpos están
INSTRUCCIONES DE INSTALACIÓN Y RECARGA CISS HP CARTUCHO SERIE 1
 Antes de empezar Es muy importante que no realice ninguna acción hasta leer completamente las instrucciones. Léalas de forma detenida y completa!!! Es muy importante que compruebe que su impresora se encuentra
Antes de empezar Es muy importante que no realice ninguna acción hasta leer completamente las instrucciones. Léalas de forma detenida y completa!!! Es muy importante que compruebe que su impresora se encuentra
Validación y verificación de métodos de examen cuantitativos
 Temas selectos de Calidad en Serología (aplicación en el banco de sangre) Validación y verificación de métodos de examen cuantitativos Ignacio Reyes Ramírez entidad mexicana de acreditación, a.c. Introducción
Temas selectos de Calidad en Serología (aplicación en el banco de sangre) Validación y verificación de métodos de examen cuantitativos Ignacio Reyes Ramírez entidad mexicana de acreditación, a.c. Introducción
GEBRAX DIVISION DIAGNÓSTICA
 GEBRAX T h e r a p e u t i c s & D i a g n o s t i c s DIVISION DIAGNÓSTICA Se recomienda que el prospecto deba ser leído antes de comenzar el procedimiento de prueba. Aunque el ensayo está diseñado para
GEBRAX T h e r a p e u t i c s & D i a g n o s t i c s DIVISION DIAGNÓSTICA Se recomienda que el prospecto deba ser leído antes de comenzar el procedimiento de prueba. Aunque el ensayo está diseñado para
Procesado de muestras en el laboratorio de la clínica (I)
 12.prevención de la salud Procesado de muestras en el laboratorio de la clínica (I) A lo largo de esta primera parte veremos como realizar un manejo correcto de las muestras de sangre, orina y líquidos
12.prevención de la salud Procesado de muestras en el laboratorio de la clínica (I) A lo largo de esta primera parte veremos como realizar un manejo correcto de las muestras de sangre, orina y líquidos
PROCESO DE SELLADO EN FRIO
 Página 1 de 6 PROCESO DE SELLADO EN FRIO Propuesta: QUALITAL Decisión de QUALANOD: Reunión junio 2010 y octubre 2011 Fecha de aplicación: 1º de enero de 2012 Parte de las Directrices a la que concierne
Página 1 de 6 PROCESO DE SELLADO EN FRIO Propuesta: QUALITAL Decisión de QUALANOD: Reunión junio 2010 y octubre 2011 Fecha de aplicación: 1º de enero de 2012 Parte de las Directrices a la que concierne
Autor: Microsoft Licencia: Cita Fuente: Ayuda de Windows
 Qué es Recuperación? Recuperación del Panel de control proporciona varias opciones que pueden ayudarle a recuperar el equipo de un error grave. Nota Antes de usar Recuperación, puede probar primero uno
Qué es Recuperación? Recuperación del Panel de control proporciona varias opciones que pueden ayudarle a recuperar el equipo de un error grave. Nota Antes de usar Recuperación, puede probar primero uno
PROCESAMIENTO DE MUESTRAS SANGUÍNEAS PARA
 PROCESAMIENTO DE MUESTRAS SANGUÍNEAS PARA DIAGNÓSTICO Proyecto AECID 2012 Nuevos procedimientos para el diagnóstico de enfermedades olvidadas utilizando tele-microscopía de bajo coste. 1 TABLA DE CONTENIDOS
PROCESAMIENTO DE MUESTRAS SANGUÍNEAS PARA DIAGNÓSTICO Proyecto AECID 2012 Nuevos procedimientos para el diagnóstico de enfermedades olvidadas utilizando tele-microscopía de bajo coste. 1 TABLA DE CONTENIDOS
imegen Alfa-1-AT Manual de Usuario Referencia: IMG-211
 Manual de Usuario imegen Alfa-1-AT Genotipado de las mutaciones Glu342Lys (PI-Z) y Glu264Val (PI-S) del gen SERPINA1 mediante PCR a tiempo real Referencia: Fabricado en España Garantías y responsabilidades
Manual de Usuario imegen Alfa-1-AT Genotipado de las mutaciones Glu342Lys (PI-Z) y Glu264Val (PI-S) del gen SERPINA1 mediante PCR a tiempo real Referencia: Fabricado en España Garantías y responsabilidades
SEPARACIÓN DE ALUMINIO A PARTIR DE MATERIAL DE DESECHO
 Actividad Experimental SEPARACIÓN DE ALUMINIO A PARTIR DE MATERIAL DE DESECHO Investigación previa 1.- Investigar las medidas de seguridad que hay que mantener al manipular KOH y H SO, incluyendo que acciones
Actividad Experimental SEPARACIÓN DE ALUMINIO A PARTIR DE MATERIAL DE DESECHO Investigación previa 1.- Investigar las medidas de seguridad que hay que mantener al manipular KOH y H SO, incluyendo que acciones
5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS
 5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS 5.1. Consideraciones generales Para abordar las actuaciones a realizar en un edificio/instalación asociado con casos de legionelosis se deben tener
5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS 5.1. Consideraciones generales Para abordar las actuaciones a realizar en un edificio/instalación asociado con casos de legionelosis se deben tener
Mercodia Ultrasensitive C-peptide ELISA
 Mercodia Ultrasensitive C-peptide ELISA Instrucciones para el uso 10-1141-01 REACTIVOS PARA 96 DETERMINACIONES Para uso diagnóstico in vitro ATENCIÓN! Protocolo de actualización Fabricado por Mercodia
Mercodia Ultrasensitive C-peptide ELISA Instrucciones para el uso 10-1141-01 REACTIVOS PARA 96 DETERMINACIONES Para uso diagnóstico in vitro ATENCIÓN! Protocolo de actualización Fabricado por Mercodia
Normalización de soluciones de NaOH 0,1N y HCl 0,1N.
 Laboratorio N 1: Normalización de soluciones de NaOH 0,1N y HCl 0,1N. Objetivos: - Determinar la normalidad exacta de una solución de hidróxido de sodio aproximadamente 0,1 N, utilizando biftalato de potasio
Laboratorio N 1: Normalización de soluciones de NaOH 0,1N y HCl 0,1N. Objetivos: - Determinar la normalidad exacta de una solución de hidróxido de sodio aproximadamente 0,1 N, utilizando biftalato de potasio
Código: IDX-016 Ver: 1 TOXO. Sistema para la detección de la presencia de ADN de Toxoplasma gondii. Reg. MSP 21205
 Sistema para la detección de la presencia de ADN de Toxoplasma gondii Reg. MSP 21205 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. info@atgen.com.uy www.atgen.com.uy
Sistema para la detección de la presencia de ADN de Toxoplasma gondii Reg. MSP 21205 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. info@atgen.com.uy www.atgen.com.uy
Control de Calidad en la Técnica de ELISA. Lic. Valentina Bastidas D.
 Control de Calidad en la Técnica de ELISA Lic. Valentina Bastidas D. TÉCNICA DE ELISA DEFINICIÓN E L I S A Ensayo Inmunoabsorbente Ligado a Enzimas Enzime-Linked ImmunoSorbent Assay TIPOS DE ELISA: ELISA
Control de Calidad en la Técnica de ELISA Lic. Valentina Bastidas D. TÉCNICA DE ELISA DEFINICIÓN E L I S A Ensayo Inmunoabsorbente Ligado a Enzimas Enzime-Linked ImmunoSorbent Assay TIPOS DE ELISA: ELISA
Estudio de validación de Kits de ELISA-I para el diagnóstico de Mycoplasma en aves
 Estudio de validación de Kits de ELISA-I para el diagnóstico de Mycoplasma en aves 1. Introducción Subdepartamento de Sanidad Animal El año 2009 se dio inició al Programa de Control de Mycoplasma sp. en
Estudio de validación de Kits de ELISA-I para el diagnóstico de Mycoplasma en aves 1. Introducción Subdepartamento de Sanidad Animal El año 2009 se dio inició al Programa de Control de Mycoplasma sp. en
Kit. Keratina. Quiéres un cabello más suave, manejable y con brillo?
 cómousar? Kit Keratina Quiéres un cabello más suave, manejable y con brillo? 1 2 3 SIN FORMOL MADE IN SPAIN E Por qué Eurostil? El Tratamiento de Keratina Antiencrespamiento, ha sido concebido para dotar
cómousar? Kit Keratina Quiéres un cabello más suave, manejable y con brillo? 1 2 3 SIN FORMOL MADE IN SPAIN E Por qué Eurostil? El Tratamiento de Keratina Antiencrespamiento, ha sido concebido para dotar
Código: IDK-010 Ver: 1. Proteína G C825T. Sistema para la detección de la mutación C825T en el gene de la proteína G.
 C825T Sistema para la detección de la mutación C825T en el gene de la proteína G. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy www.atgen.com.uy
C825T Sistema para la detección de la mutación C825T en el gene de la proteína G. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy www.atgen.com.uy
C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O. Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua
 C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno,
C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno,
Para base y subbase se harán los ensayos definidos en la especificación correspondiente.
 NORMATIVIDAD ASOCIADA: NEGC 200 y 1300. GENERALIDADES: Se refiere esta especificación a llenos con materiales de préstamo o material selecto de la excavación, compactados por métodos manuales o mecánicos,
NORMATIVIDAD ASOCIADA: NEGC 200 y 1300. GENERALIDADES: Se refiere esta especificación a llenos con materiales de préstamo o material selecto de la excavación, compactados por métodos manuales o mecánicos,
BRUCELOSIS: TÉCNICA DE POLARIZACIÓN FLUORESCENTE, PARA ESTAR SEGUROS
 BRUCELOSIS: TÉCNICA DE POLARIZACIÓN FLUORESCENTE, PARA ESTAR SEGUROS Giménez P.M. 1, Barcos O. G. 2, Moran R. D. 3. 2007. Revista Brangus, Bs. As., 29(55):62-66. 1 y 2.- Méd. Vet. Laboratorio Colon. 3.-
BRUCELOSIS: TÉCNICA DE POLARIZACIÓN FLUORESCENTE, PARA ESTAR SEGUROS Giménez P.M. 1, Barcos O. G. 2, Moran R. D. 3. 2007. Revista Brangus, Bs. As., 29(55):62-66. 1 y 2.- Méd. Vet. Laboratorio Colon. 3.-
BIOSEGURIDAD EN MICROBIOLOGIA: NUEVOS Y VIEJOS RETOS
 BIOSEGURIDAD EN MICROBIOLOGIA: NUEVOS Y VIEJOS RETOS JUAN CARLOS RODRÍGUEZ S. MICROBIOLOGÍA HOSPITAL GENERAL UNIVERSITARIO DE ALICANTE E-MAIL: rodriguez_juadia@gva.es http://microbiologia-alicante.umh.es
BIOSEGURIDAD EN MICROBIOLOGIA: NUEVOS Y VIEJOS RETOS JUAN CARLOS RODRÍGUEZ S. MICROBIOLOGÍA HOSPITAL GENERAL UNIVERSITARIO DE ALICANTE E-MAIL: rodriguez_juadia@gva.es http://microbiologia-alicante.umh.es
RESULTADOS Y DISCUSIÓN. Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv
 RESULTADOS Y DISCUSIÓN Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv La curva estándar con la que se estimó la concentración proteica del filtrado
RESULTADOS Y DISCUSIÓN Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv La curva estándar con la que se estimó la concentración proteica del filtrado
NMX-F-070-1964. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE TIAMINA. THIAMINE DETERMINATION. TEST METHOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS.
 NMX-F-070-1964. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE TIAMINA. THIAMINE DETERMINATION. TEST METHOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. ASUNTO Con fundamento en lo dispuesto en los Artículos
NMX-F-070-1964. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE TIAMINA. THIAMINE DETERMINATION. TEST METHOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. ASUNTO Con fundamento en lo dispuesto en los Artículos
PROCEDIMIENTO DE CONTROL DE DOPING: ORINA
 PROCEDIMIENTO DE CONTROL DE DOPING: ORINA INTERNATIONAL RUGBY BOARD PROCEDIMIENTO DE CONTROL DE DOPING: ORINA El Control de Doping juega un papel esencial en la promoción y protección del Rugby libre de
PROCEDIMIENTO DE CONTROL DE DOPING: ORINA INTERNATIONAL RUGBY BOARD PROCEDIMIENTO DE CONTROL DE DOPING: ORINA El Control de Doping juega un papel esencial en la promoción y protección del Rugby libre de
SEMINARIO PARA PERIODISTAS
 SEMINARIO PARA PERIODISTAS Mitos y realidades d de los medicamentos genéricos éi Madrid, 5 de noviembre de 2009 La opinión de los farmacéuticos en cuanto a la prescripción de medicamentos Equivalencia
SEMINARIO PARA PERIODISTAS Mitos y realidades d de los medicamentos genéricos éi Madrid, 5 de noviembre de 2009 La opinión de los farmacéuticos en cuanto a la prescripción de medicamentos Equivalencia
ENFERMEDADES PARASITARIAS TRANSMITIDOS POR ALIMENTOS: (CISTICERCOSIS, HIDATIDOSIS Y FASCIOLOSIS)
 ENFERMEDADES PARASITARIAS TRANSMITIDOS POR ALIMENTOS: (CISTICERCOSIS, HIDATIDOSIS Y FASCIOLOSIS) Dr. Hermes Escalante Añorga Profesor Principal de la Universidad Nacional de Trujillo Laboratorio Clínico
ENFERMEDADES PARASITARIAS TRANSMITIDOS POR ALIMENTOS: (CISTICERCOSIS, HIDATIDOSIS Y FASCIOLOSIS) Dr. Hermes Escalante Añorga Profesor Principal de la Universidad Nacional de Trujillo Laboratorio Clínico
La Directiva 98/79/CE sobre productos sanitarios para diagnóstico in vitro
 La Directiva 98/79/CE sobre productos sanitarios para diagnóstico in vitro F. Javier Gella Tomás División Reactivos BioSystems S.A. Barcelona Introducción Las directivas europeas son documentos legislativos,
La Directiva 98/79/CE sobre productos sanitarios para diagnóstico in vitro F. Javier Gella Tomás División Reactivos BioSystems S.A. Barcelona Introducción Las directivas europeas son documentos legislativos,
Grupo de trabajo sobre control e inspección de los medicamentos
 COMISIÓN EUROPEA DIRECCIÓN GENERAL DE EMPRESA Productos farmacéuticos y cosméticos Bruselas, 31 de marzo de 2000 ENTR/III/5717/99-ES g\common\legal-legislation\75-319 nd81-851\91-356\eudralexvol4\blood\jan
COMISIÓN EUROPEA DIRECCIÓN GENERAL DE EMPRESA Productos farmacéuticos y cosméticos Bruselas, 31 de marzo de 2000 ENTR/III/5717/99-ES g\common\legal-legislation\75-319 nd81-851\91-356\eudralexvol4\blood\jan
PRECAUCIONES ESTÁNDAR DEFINICIÓN:
 PRECAUCIONES ESTÁNDAR DEFINICIÓN: Son las precauciones que deben aplicarse a todos los pacientes independientemente de su diagnóstico, a fin de minimizar el riesgo de transmisión de cualquier tipo de microorganismo,
PRECAUCIONES ESTÁNDAR DEFINICIÓN: Son las precauciones que deben aplicarse a todos los pacientes independientemente de su diagnóstico, a fin de minimizar el riesgo de transmisión de cualquier tipo de microorganismo,
REQUISITOS PARA EL CONTROL Y SEGUIMIENTO DE MARCAPASOS Y DESFIBRILADORES AUTOMÁTICOS IMPLANTABLES
 Ministerio de Salud Pública Centro de Control Estatal de Equipos Médicos Ciudad de la Habana Calle 4 #455.Vedado Tel. 832-5072 835 3889 Email rem@cceem.sld.cu CCEEM ER e -1.1 2008.11.22 REGULACION REQUISITOS
Ministerio de Salud Pública Centro de Control Estatal de Equipos Médicos Ciudad de la Habana Calle 4 #455.Vedado Tel. 832-5072 835 3889 Email rem@cceem.sld.cu CCEEM ER e -1.1 2008.11.22 REGULACION REQUISITOS
IMPRESIÓN OFFSET SIN ALCOHOL O CON REDUCCIÓN DE ALCOHOL
 La mayor conciencia ecológica junto con disposiciones legales cada vez más estrictas han tenido como consecuencia una consideración cada vez más crítica de factores que pueden perjudicar el medio ambiente.
La mayor conciencia ecológica junto con disposiciones legales cada vez más estrictas han tenido como consecuencia una consideración cada vez más crítica de factores que pueden perjudicar el medio ambiente.
Medicamentos biológicos y biosimilares
 Medicamentos biológicos y biosimilares folleto biosimilares FILMAR.indd 1 24/10/12 10:09 En qué se diferencian los medicamentos biológicos de los medicamentos tradicionales? Introducción Gracias a la investigación
Medicamentos biológicos y biosimilares folleto biosimilares FILMAR.indd 1 24/10/12 10:09 En qué se diferencian los medicamentos biológicos de los medicamentos tradicionales? Introducción Gracias a la investigación
6.5. Documentación y archivo
 6.5. Documentación y archivo La documentación aportada por la validación de los controles de rutina durante el proceso de esterilización debe archivarse para acreditar la garantía de calidad del mismo.
6.5. Documentación y archivo La documentación aportada por la validación de los controles de rutina durante el proceso de esterilización debe archivarse para acreditar la garantía de calidad del mismo.
Los estudiantes observarán las diferencias entre células vegetales y animales.
 Laboratorio. Célula vegetal vs. Célula animal PSI Biología Nombre Objetivo Materiales Los estudiantes observarán las diferencias entre células vegetales y animales. Fórceps Cuentagotas de la medicina o
Laboratorio. Célula vegetal vs. Célula animal PSI Biología Nombre Objetivo Materiales Los estudiantes observarán las diferencias entre células vegetales y animales. Fórceps Cuentagotas de la medicina o
11.2-DISCUSIÓN Prueba rápida
 11.2-DISCUSIÓN Prueba rápida Como se observa en la tabla 9 del total de las embarazadas (62,214) a las que se les realizo la prueba rápida un 99.3%(61,808) de ellas dio como resultado no reactivo, tan
11.2-DISCUSIÓN Prueba rápida Como se observa en la tabla 9 del total de las embarazadas (62,214) a las que se les realizo la prueba rápida un 99.3%(61,808) de ellas dio como resultado no reactivo, tan
Intrucciones de uso KwikPen. ABASAGLAR 100 unidades/ml solución inyectable en una pluma precargada Insulina glargina
 Intrucciones de uso KwikPen ABASAGLAR 100 unidades/ml solución inyectable en una pluma precargada Insulina glargina POR FAVOR LEA ESTAS INSTRUCCIONES ANTES DE USAR Lea las instrucciones de uso antes de
Intrucciones de uso KwikPen ABASAGLAR 100 unidades/ml solución inyectable en una pluma precargada Insulina glargina POR FAVOR LEA ESTAS INSTRUCCIONES ANTES DE USAR Lea las instrucciones de uso antes de
EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE
 Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
GUIA TECNICAS MANUALES Y AUTOMATIZADAS DE VHS
 ESCUELA SALUD GUIA TECNICAS MANUALES Y AUTOMATIZADAS DE VHS DIRIGIDO A ALUMNOS DE: Técnico Superior de Laboratorio Clínico y Banco de Sangre PRE-REQUISITO: Laboratorio Clínico I, LCS 2100. INTRODUCCIÓN
ESCUELA SALUD GUIA TECNICAS MANUALES Y AUTOMATIZADAS DE VHS DIRIGIDO A ALUMNOS DE: Técnico Superior de Laboratorio Clínico y Banco de Sangre PRE-REQUISITO: Laboratorio Clínico I, LCS 2100. INTRODUCCIÓN
DETERMINACIÓN DE GLUTEN EN ALIMENTOS PARA CELÍACOS INDICE
 DETERMINACIÓN DE GLUTEN EN ALIMENTOS PARA CELÍACOS INDICE 1 Objetivo 2 2 Alcance 2 3 Desarrollo 2 4 Anexo 8 1.0. Objetivo Determinación de gluten en alimentos para celíacos. 2.0. Alcance Este método analítico
DETERMINACIÓN DE GLUTEN EN ALIMENTOS PARA CELÍACOS INDICE 1 Objetivo 2 2 Alcance 2 3 Desarrollo 2 4 Anexo 8 1.0. Objetivo Determinación de gluten en alimentos para celíacos. 2.0. Alcance Este método analítico
Avery Dennison Tintas Serie 4930 10 Años 1 Parte Solvente* Manual de instrucciones #8.40 Revisado: Mayo 2011
 Introducción Los Colores de proceso de la serie 4930 se han diseñado para su uso en todas las láminas retrorreflectantes Avery Dennison, tanto de tráfico como para obras moldeadas de alta intensidad y
Introducción Los Colores de proceso de la serie 4930 se han diseñado para su uso en todas las láminas retrorreflectantes Avery Dennison, tanto de tráfico como para obras moldeadas de alta intensidad y
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
-Determinación del cloro libre y combinado cuando no hay presencia de dióxido de cloro ni clorito.
 DETERMINACIÓN DEL CLORO, DIOXIDO DE CLORO, CLORITO Y CLORAMINAS EN EL AGUA POTABLE -Método del DPD. -Determinación del cloro libre y combinado cuando no hay presencia de dióxido de cloro ni clorito. -Determinación
DETERMINACIÓN DEL CLORO, DIOXIDO DE CLORO, CLORITO Y CLORAMINAS EN EL AGUA POTABLE -Método del DPD. -Determinación del cloro libre y combinado cuando no hay presencia de dióxido de cloro ni clorito. -Determinación
Servicio Prevención de Riesgos Laborales
 Servicio Prevención de Riesgos Laborales NORMAS DE TRABAJO SEGURO. GESTIÓN DE RESIDUOS SANITARIOS. Nº 25 (Art. 18 Ley 31/1995 de Prevención de Riesgos Laborales. Deber de información) INTRODUCCIÓN Bajo
Servicio Prevención de Riesgos Laborales NORMAS DE TRABAJO SEGURO. GESTIÓN DE RESIDUOS SANITARIOS. Nº 25 (Art. 18 Ley 31/1995 de Prevención de Riesgos Laborales. Deber de información) INTRODUCCIÓN Bajo
Trasplante renal. Dudas más frecuentes
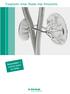 Trasplante renal. Dudas más frecuentes Por qué el trasplante de riñón? Cuando aparece una insuficiencia renal crónica irreversible, se plantean tres tipos de tratamiento: Hemodiálisis Diálisis peritoneal
Trasplante renal. Dudas más frecuentes Por qué el trasplante de riñón? Cuando aparece una insuficiencia renal crónica irreversible, se plantean tres tipos de tratamiento: Hemodiálisis Diálisis peritoneal
Importancia de la investigación clínica EN ONCOLOGÍA. ONCOvida. oncovida_20.indd 1 10/10/11 12:53
 Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz
 IDEXX VetLab Suite IDEXX SNAP Tests Laboratorio de Referencia IDEXX Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz Obtenga respuestas definitivas con la IDEXX RealPCR
IDEXX VetLab Suite IDEXX SNAP Tests Laboratorio de Referencia IDEXX Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz Obtenga respuestas definitivas con la IDEXX RealPCR
LABORATORIO NACIONAL DE VIALIDAD HORNO IGNICION Y CENTRIFUGA
 LABORATORIO NACIONAL DE VIALIDAD HORNO IGNICION Y CENTRIFUGA Rodrigo Uribe Olivares Jefe Área de Asfalto Curso de Capacitación 8 Junio 2015 a).- Ensaye: Extracción 8.302.36 (LNV 11) : Método para determinar
LABORATORIO NACIONAL DE VIALIDAD HORNO IGNICION Y CENTRIFUGA Rodrigo Uribe Olivares Jefe Área de Asfalto Curso de Capacitación 8 Junio 2015 a).- Ensaye: Extracción 8.302.36 (LNV 11) : Método para determinar
PROCEDIMIENTO DE GESTIÓN DE RESIDUOS ASIMILABLES A URBANOS (RAU) E INERTES UNIVERSIDAD DE NAVARRA (Campus Pamplona)
 Fecha cumpli: 01/09/2009 Rev 0 UNIVERSIDAD DE NAVARRA Hoja: 1/10 PROCEDIMIENTO DE GESTIÓN DE RESIDUOS ASIMILABLES A URBANOS (RAU) E INERTES UNIVERSIDAD DE NAVARRA (Campus Pamplona) MODIFICACIONES Nº REVISIÓN
Fecha cumpli: 01/09/2009 Rev 0 UNIVERSIDAD DE NAVARRA Hoja: 1/10 PROCEDIMIENTO DE GESTIÓN DE RESIDUOS ASIMILABLES A URBANOS (RAU) E INERTES UNIVERSIDAD DE NAVARRA (Campus Pamplona) MODIFICACIONES Nº REVISIÓN
