c = λν λ: cm; ν: ciclos/seg E = hν c: velocidad de la luz (en el vacío: 3 x 1010 cm/seg) E = hc/ν h: cte. de Planck (6.62 x 1027 erg/seg) Y
|
|
|
- Ignacio Ortiz Aranda
- hace 6 años
- Vistas:
Transcripción
1 Espectroscopía Espectroscopía ultravioleta-visible visible Espectroscopía infrarroja Espectroscopía de resonancia magnética nuclear Espectrometría de masas Pincipisd Principios de la Espectroscopía Molecular: Radiación Electromagnética
2 Radiación Electromagnética se propaga a la velocidad de la luz tiene propiedades de onda-partícula (dualidad de De Broglie) la energía de un fotón es proporcional a su frecuencia c = λν λ: cm; ν: ciclos/seg E = hν c: velocidad de la luz (en el vacío: 3 x 1010 cm/seg) E = hc/ν h: cte. de Planck (6.62 x 1027 erg/seg) Y λ X A Z El Espectro Electromagnético Menor Longitud de onda (λ) Mayor Longitud de onda (λ) 400 nm 750 nm Luz Visible Mayor Frecuencia (ν) Menor Frequencia (ν) Mayor Energía (E) Menor Energía (E)
3 El Espectro Electromagnético Menor Longitud de onda (λ) Mayor Longitud de onda (λ) Ultravioleta Infrarrojo Mayor Frecuencia (ν) Mayor Energía (E) Menor Frecuencia (ν) Menor Energía (E) El Espectro Electromagnético Energía Rayos cósmicos Rayos γ Rayos X Luz Ultravioleta Luz Visible Radiación Infrarroja Microondas Ondas de Radio
4 Espectroscopía de absorción La materia absorbe energía pasando a un estado de mayor energía. Se estudia la luz (λ) que se absorbe cuantitativamente, para deducir información estructural, cuantificar, etc ΔE E = hν E2 (Estado de alta energía) (Energía de un fotón) E1(Estado de baja energía) Espectroscopía de emisión También se puede estimular la muestra (luz, calor, electricidad) y estudiar el regreso al estado fundamental estudiandl la luz emitida. Qué clase de estados? electrónico vibracional rotacional spin nuclear UV-VisVis Infrarrojo microonda radiofrecuencia El Espectro Electromagnético
5 Espectroscopía UV- Visible Transiciones entre estados de energía electrónicos ΔE = hν Energía entre 200 y 800 nm La energía absorbida es discreta o cuantizada Características de transiciones electrónicas entre orbitales σ, π y η Transición λ (nm) Ejemplo σ σ* <200 idrocarburos saturados π π* Alquenos, alquinos, aromáticos η σ* O, C 3 O, C 3 Cl η π* Carbonilos, nitro, nitrato, carbonilo. Etileno: solapamiento frontal de 2 orbitales p da lugar a un OM enlazante π y a un OM antienlazante π. eteno formaldehido 2p π π 2p π π hυ π π E F E E
6 Orbitales Enlazantes y No Enlazantes Los orbitales π de unión resultan de la superposición de orbitales p del mismo signo. Los orbitales no enlazantes π* resultan de la superposición ió de orbitales p de signo opuesto. Niveles de energía y transiciones electrónicas En espectroscopía UV-Vis se irradia con luz de una energía tal como para provocar transiciones electrónicas, es decir, promover un electrón desde un orbital de baja energía a uno vacante de alta energía. Transiciones electrónicas posibles entre orbitales n: orbital que contiene par de electrones no compartidos: por ejemplo, O, N, Cl, etc. σ* anti-enlazante En UV- Vis la energía solo alcanza para las transiciones n π* yπ π* Energía π* anti-enlazante n no-enlazante π* enlazante σ* enlazante σ σ * UV lejano λ < 200 nm, compuestos orgánicos simples π π* UV λ ~ nm, compuestos insaturados n π* UV-visible λ ~ nm, insaturados con heteroátomos
7 Transición π π* en cis,trans-1,3 1,3-ciclooctadieno ψ 4 ψ 4 LUMO OMO ψ 3 ψ 2 ΔE = hν ψ 3 ψ 2 ψ 1 ψ 1 configuración π-electrónica más estable configuración π-electrónica en el estado excitado Las transiciones más favorecidas son entre el orbital ocupado de mayor energía (OMO) y el orbital desocupado de menor energía (LUMO) Transición π π* La banda de energía OMO-LUMO es afectada por los sustituyentes del doble enlace Cuando (ΔE) OMO-LUMO se hace menor, la λ max se desplaza a valores mayores
8 La inserción de un grupo alquílico causa un desplazamiento amayores λ max C 3 C C C C C 3 λ max 170 nm λ max 188 nm La extensión de la conjugación tiene un mayor efecto en λ max ; el desplazamiento es nuevamente a mayores longitudes de onda C C λ max 170 nm C C C C λ max 217 nm
9 C C C C 3 C λ max 217 nm dieno conjugado C C C C C C λ max 263 nm tin trieno conjugado mas dos alquilos C 3 Licopeno Pigmento naranja en zanahorias Pigmento rojo en tomates Absorben azul. Se ven rojos
10
11 El espectrómetro UV-Vis registra las longitudes de onda donde se produce absorción y cuantifica la absorción S 0 S 1 E S 2 S 1 ΔE (S1) = h. c / λ max S 0 S 2 S 0 El espectro se registra como Absorbancia (A) vs. longitud de onda (λ). Las bandas del espectro UV son anchas porque incluyen la estructura fina de transiciones vibracionales y rotacionales de menor energía. Información estructural limitada
12
13 Las transiciones más favorecidas son entre el OMO y el LUMO El espectrómetro UV-Vis registra las longitudes de onda a las que se produce absorción y la cuantifica cubeta muestra (en solución) luz UV DETECTOR El espectro se registra como Absorbancia (A) vs. longitud de onda (λ) Las bandas del espectro UV son anchas porque incluyen la estructura fina de transiciones vibracionales y rotacionales de menor energía
14 Absorción de la luz I 0 I A = log I = log I0 ( T ) 1.4 l I 0 = I + I abs antraceno I abs = I 0 A = ε. l. C A ( 1 10 ) Abso orbancia ε: coeficiente de extinción molar (M -1.cm -1 ) l: longitud de la celda (cm) C: concentración (M) A=Absorbancia, T= Transmitancia Longitud de onda (nm) Ley de Beer: A = ε c l A: Absorbancia Permite cuantificar la concentración de una muestra por UV ε: coeficiente de extinción (característico de cada sustancia) l: largo del paso de la cuba (cm) c: concentración (moles/l) La zona de longitudes de onda que se registra en un espectro UV- Vis es entre 200 y 800 nm En esta zona no absorben dobles ni triples enlaces aislados Solo van a absorber enlaces π conjugados y heteroátomos con pares de electrones no compartidos (O, N, etc.) Grupos que absorben luz = CROMÓFOROS
15 A medida que aumenta la conjugación, el sistema it absorbe a λ mayores, o sea que la absorción se desplaza hacia el visible. La conjugación acerca al OMO y al LUMO del sistema disminuyendo E de la transición π π*. Entonces, ocurre a λ menor
16 Otros Cromóforos Grupos carbonilo conjugados Compuestos aromáticos y heteroaromáticos A mayor conjugación de sistemas aromáticos la absorción se desplaza al visible Este compuesto es de color anaranjado
17 Cromóforos Auxócromos: sustituyente que unido a un cromóforo cambia su λ max y la intensidad de la absorción (ε) Desplazamiento batocrómico: desplazamiento hacia λ mayores debido a una sustitución determinada o a efecto de solvente. Desplazamiento hipsocrómico: desplazamiento hacia λ menores debido a una sustitución determinada o a efecto de solvente. Chromophore Example Excitation λ max, nm ε Solvent C=C Ethene π > π* ,000 hexane C C 1-exyne π > π* ,000 hexane C=O Ethanal n > π* π > π* ,000 hexane hexane N=O Nitromethane n > π* π > π* ,000 ethanol ethanol C-X X=Br Methyl bromide n > σ* hexane X=I Methyl Iodide n > σ* hexane
18 Pantallas solares PABA: ácido p-aminobenzoico Espectroscopía Infrarroja Información sobre grupos funcionales en la molécula
19 E2 (Estado de alta energía) ΔE E = hν (Energía de un fotón) E1 (Estado de baja energía) Qué clase de estados? electrónico vibracional rotacional spin nuclear UV-VisVis Infrarrojo microonda radiofrecuencia La región que se utiliza del espectro infrarojo es entre 2500 y nm En esta zona se consiguen excitar transiciones vibracionales de la molécula: estiramientos y flexiones de los enlaces Los enlaces covalentes se asemejan a resortes Al entregarles energía adecuada se pueden estirar y flexionar
20 Espectroscopia infrarroja La region más útil del infrarrojo se encuentra entre μm ( cm -1 ) Longitud de onda λ Número de onda 1/λ Transiciones entre estados vibracionales: estiramientos flexiones Estiramientos del grupo C 2 Simétrico Antisimétricotrico
21 Flexiones del grupo C 2 En el plano En el plano Flexiones del grupo C 2 Fuera del plano Fuera del plano
22 Todos los enlaces de una molécula van a sufrir transiciones vibracionales, cada una con una frecuencia determinada y característica, y cada una de estas transiciones va a provocar una banda de absorción El espectro IR va a registrar todas estas bandas Barrido de λ, IR-TF La complejidad de un espectro IR permite su uso para identificar sustancias ya que se transforma en una especie de huella digital del compuesto. Por otra parte la identificación de ciertas Por otra parte la identificación de ciertas bandas características brinda información sobre la presencia de grupos funcionales.
23 La frecuencia exacta de una transición para un enlace determinado va a depender, entre otras cosas, de la fuerza del enlace y de la masa de los átomos en los extremos del enlace υ= 1 (k/μ) μ: masa reducida m = M 1 M 2 /M 1 + M 2 2πc k: constante de fuerza υ: número de onda = υ/c Regiones típicas de un espectro IR Espectro Infrarojo de exano estiramiento C (streching) Flexión Flexión Flexión (bending) C 3 C 2 C 2 C 2 C 2 C Numero de onda, cm -1 Francis A. Carey, Organic Chemistry, Fourth Edition. Copyright 2000 The McGraw-ill Companies, Inc. All rights reserved.
24 Espectro infrarojo de 1-exeno C=C C=C C 2 C=C 2 C=CC 2 C 2 C 2 C Wave number, cm -1 Francis A. Carey, Organic Chemistry, Fourth Edition. Copyright 2000 The McGraw-ill Companies, Inc. All rights reserved. Espectro IR de butanona O
25 O Espectro IR de ciclobutanol Espectro IR de isobutiraldehido O
26 Frecuencias Absorción en el Infrarrojo Unidad estructural Frequencia, cm -1 estiramientos (uniones simples) sp C sp 2 C sp 3 C sp 2 C O 1200 sp 3 C O Frecuencias Absorción en el Infrarrojo Unidad estructural Frequencia, cm -1 Estiramientos (enlaces múltiples últiples) C C C C C N
27 Frecuencias Absorción en el Infrarrojo Unidad estructural Frequencia, cm -1 Estiramientos (grupos carbonilo) Aldehidos y cetonas ácidos carboxílicos anhidridos y Esteres Amidas C O Frecuencias Absorción en el Infrarrojo Unidad estructural Frequencia, cm -1 Flexiones en alquenos RC R 2 C C 2 C cis-rc CR' trans-rc CR' R 2 C CR'
28 Frecuencias Absorción en el Infrarrojo Unidad estructural Frequencia, cm -1 Flexiones de derivados del benceno Monosubstituídos y orto-disubstitu disubstituídosdos meta-disubstitu disubstituídosdos y para-disubstitu disubstituídosdos Frecuencias Absorción en el Infrarrojo Unidad estructural Estiramientos (uniones simples) Frecuencia, cm -1 O (alcoholes) O (ácidos carboxílicos) N
29 ter-butilbenceno Ar C 6 5 C(C 3 ) 3 C Monsubstituído benceno Número de onda, cm -1 Francis A. Carey, Organic Chemistry, Fourth Edition. Copyright 2000 The McGraw-ill Companies, Inc. All rights reserved. 2-exanol C O C 3 C 2 C 2 C 2 CC 3 O Wave number, cm -1 Francis A. Carey, Organic Chemistry, Fourth Edition. Copyright 2000 The McGraw-ill Companies, Inc. All rights reserved.
30 2-exanona C 3 C 2 C 2 C 2 CC 3 C O C=O Wave number, cm -1 Francis A. Carey, Organic Chemistry, Fourth Edition. Copyright 2000 The McGraw-ill Companies, Inc. All rights reserved.
Espectro Electromagnético
 1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
Tema 7: Espectroscopia Vibracional (IR)
 Tabla 1. El espectro electromagnético Región Longitud de onda Energía de excitación Tipo de excitación Rayos x, rayos cósmicos 286 (Kcal/mol) Ultravioleta Visible Infrarrojo próximo Infrarrojo
Tabla 1. El espectro electromagnético Región Longitud de onda Energía de excitación Tipo de excitación Rayos x, rayos cósmicos 286 (Kcal/mol) Ultravioleta Visible Infrarrojo próximo Infrarrojo
INTRODUCCION (2) espectroscopía de absorción Espectroscopía de Emisión RMN Espectrometría de Masas espectrometría de fragmentación
 INTRODUCCION (1) Una de las labores más difíciles dentro de la Química Orgánica es la elucidación estructural. En algunos casos es suficiente con algunos datos mínimos. Utilizando algunas propiedades Fisico-Químicas
INTRODUCCION (1) Una de las labores más difíciles dentro de la Química Orgánica es la elucidación estructural. En algunos casos es suficiente con algunos datos mínimos. Utilizando algunas propiedades Fisico-Químicas
Técnicas Espectroscópicas. Dr. Jorge A. Palermo
 Técnicas Espectroscópicas Dr. Jorge A. Palermo Espectro Electromagnético E = hν ν = c/λ Espctroscopía UV: cromóforos Espectroscopía IR: grupos funcionales rayos γ rayos x UV VIS IR µ-ondas radio 10-10
Técnicas Espectroscópicas Dr. Jorge A. Palermo Espectro Electromagnético E = hν ν = c/λ Espctroscopía UV: cromóforos Espectroscopía IR: grupos funcionales rayos γ rayos x UV VIS IR µ-ondas radio 10-10
Tema 7.- Principios de fotoquímica
 Tema 7.- Principios de fotoquímica Introducción La rama de la química que estudia las transformaciones de las moléculas producidas por la absorción de energía electromagnética Muchas especies en la atmósfera
Tema 7.- Principios de fotoquímica Introducción La rama de la química que estudia las transformaciones de las moléculas producidas por la absorción de energía electromagnética Muchas especies en la atmósfera
MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA
 MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA y EL VISIBLE La espectroscopia de absorción molecular en el ultravioleta y visible se emplea en el análisis cuantitativo y es
MATERIAL 09 TEMA: ESPECTROSCOPÍA DE ABSORCION MOLECULAR EN EL ULTRAVIOLETA y EL VISIBLE La espectroscopia de absorción molecular en el ultravioleta y visible se emplea en el análisis cuantitativo y es
ESPECTROSCOPíA INFRARROJA
 ESPECTROSCOPíA INFRARROJA Química Orgánica 1 Facultad de Farmacia y Bioquímica UBA 2016 Autor: Dra. Isabel Perillo 1 Espectro electromagnético Unidades de l usadas: para UV-visible: nm (mm): 10-9 m para
ESPECTROSCOPíA INFRARROJA Química Orgánica 1 Facultad de Farmacia y Bioquímica UBA 2016 Autor: Dra. Isabel Perillo 1 Espectro electromagnético Unidades de l usadas: para UV-visible: nm (mm): 10-9 m para
El espectro electromagnético
 Espectroscopía Espectroscopía ultravioleta-visible: visible: molecular Espectroscopía infra-rojaroja atómica Espectroscopía de resonancia magnética nuclear Espectrometría de masas Principios de la Espectroscopía
Espectroscopía Espectroscopía ultravioleta-visible: visible: molecular Espectroscopía infra-rojaroja atómica Espectroscopía de resonancia magnética nuclear Espectrometría de masas Principios de la Espectroscopía
Tema 7. Espectroscopia para el estudio de la materia. 1. Introducción. 1. Introducción. 1. Introducción
 1 Tema 7. Espectroscopia para el estudio de la materia 1801: Thomas Young. Naturaleza dual de la radiación y la materia. Interacción Radiación-materia. Ley de Lambert-Beer 3. Espectroscopía InfraRojos
1 Tema 7. Espectroscopia para el estudio de la materia 1801: Thomas Young. Naturaleza dual de la radiación y la materia. Interacción Radiación-materia. Ley de Lambert-Beer 3. Espectroscopía InfraRojos
Espectroscopia ultravioleta-visible (temas complementarios)
 1 Espectroscopia ultravioleta-visible (temas complementarios) Ley de Lambert y Beer Cuando se hace incidir radiación electromagnética en un medio, la energía dependerá de la longitud de onda de la radiación
1 Espectroscopia ultravioleta-visible (temas complementarios) Ley de Lambert y Beer Cuando se hace incidir radiación electromagnética en un medio, la energía dependerá de la longitud de onda de la radiación
(( )) Tema 5: Técnicas espectroscópicas: Espectrofotometría. visible Infrarrojo. Ultravioleta. Espectro de emisión de los cuerpos en equilibrio
 Tema 5: Técnicas espectroscópicas: Espectrofotometría 0 22 Hz Frecuencia 0 4 Hz 0 3 Hz γ X UV IR micro radio Rayos γ (gamma) λ < pm Rayos X pm-0nm Visible 400-800nm Ultravioleta 0-400 nm Longitud de onda
Tema 5: Técnicas espectroscópicas: Espectrofotometría 0 22 Hz Frecuencia 0 4 Hz 0 3 Hz γ X UV IR micro radio Rayos γ (gamma) λ < pm Rayos X pm-0nm Visible 400-800nm Ultravioleta 0-400 nm Longitud de onda
TALLER DE ESPECTROSCOPIA
 TALLER DE ESPECTROSCOPIA I. OBJETIVOS a) Conocer los principios fundamentales que rigen la interacción energía-materia (radiación electromagnética-moléculas) en uno de los métodos espectroscópicos más
TALLER DE ESPECTROSCOPIA I. OBJETIVOS a) Conocer los principios fundamentales que rigen la interacción energía-materia (radiación electromagnética-moléculas) en uno de los métodos espectroscópicos más
RADIACIÓN ELECTROMAGNÉTICA
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 1 RADIACIÓN ELECTROMAGNÉTICA Bibliografía: SKOOG, D.A.; Leary J.J.; ANÁLISIS INSTRUMENTAL, 4 ed.; Ed. McGraw-Hill (1994), págs.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 1 RADIACIÓN ELECTROMAGNÉTICA Bibliografía: SKOOG, D.A.; Leary J.J.; ANÁLISIS INSTRUMENTAL, 4 ed.; Ed. McGraw-Hill (1994), págs.
Tema 6. Espectroscopia para el estudio de la materia
 Tema 6. Espectroscopia para el estudio de la materia 1. Introducción. Naturaleza dual de la radiación y la materia 2. Interacción Radiación-materia. Ley de Lambert-Beer 3. Espectroscopía InfraRojo 4. Espectroscopía
Tema 6. Espectroscopia para el estudio de la materia 1. Introducción. Naturaleza dual de la radiación y la materia 2. Interacción Radiación-materia. Ley de Lambert-Beer 3. Espectroscopía InfraRojo 4. Espectroscopía
PRACTICO N 1: ESPECTROFOTOMETRIA
 UNIVERSIDAD MAYOR FACULTAD DE MEDICINA ESCUELA DE TECNOLOGIA MEDICA BIOQUIMICA PRACTICO N 1: ESPECTROFOTOMETRIA 1.- INTRODUCCIÓN Utilizando términos quizás excesivamente simplistas puede definirse la espectrofotometría
UNIVERSIDAD MAYOR FACULTAD DE MEDICINA ESCUELA DE TECNOLOGIA MEDICA BIOQUIMICA PRACTICO N 1: ESPECTROFOTOMETRIA 1.- INTRODUCCIÓN Utilizando términos quizás excesivamente simplistas puede definirse la espectrofotometría
Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA
 Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA 1. Objetivo Familiarizarse con los fundamentos de la identificación de moléculas a partir de su espectro de absorción infrarrojo.
Práctica 6 IDENTIFICACIÓN DE CONTAMINANTES MEDIANTE ESPECTROSCOPÍA INFRARROJA 1. Objetivo Familiarizarse con los fundamentos de la identificación de moléculas a partir de su espectro de absorción infrarrojo.
ESPECTROFOTOMETRIA. BASES FISICAS
 ESPECTROFOTOMETRIA. BASES FISICAS Radiación Electromagnética y su Interacción con la Materia El principio de funcionamiento de la espectrofotometría se basa en el empleo de las interacciones entre la radiación
ESPECTROFOTOMETRIA. BASES FISICAS Radiación Electromagnética y su Interacción con la Materia El principio de funcionamiento de la espectrofotometría se basa en el empleo de las interacciones entre la radiación
Espectro Electromagnético
 Espectro Electromagnético En las moléculas orgánicas se observan vibraciones moleculares con energías que corresponden a la porción del infrarrojo del espectro electromagnético. Describiendo de la forma
Espectro Electromagnético En las moléculas orgánicas se observan vibraciones moleculares con energías que corresponden a la porción del infrarrojo del espectro electromagnético. Describiendo de la forma
Espectroscopia de UV-Vis y Espectroscopia de Infrarrojo
 Espectroscopia de UV-Vis y Espectroscopia de Infrarrojo Double-click MARCIA Double-click BALAGUERA-GELVES here here to to edit edit text. text. Gisela León Colón Ph. D. UPR-Bayamón Espectroscopia y el
Espectroscopia de UV-Vis y Espectroscopia de Infrarrojo Double-click MARCIA Double-click BALAGUERA-GELVES here here to to edit edit text. text. Gisela León Colón Ph. D. UPR-Bayamón Espectroscopia y el
ESTRUCTURA DEL SEMINARIO:
 ESTRUCTURA DEL SEMINARIO: S1.1. Introducción a la espectrofotometría 1 S1.2. Radiación electromagnética 1 S1.3. Espectroscopía ultravioleta/visible 2 S1.4. Colorimetría 5 S1.1. Introducción a la espectrofotometría
ESTRUCTURA DEL SEMINARIO: S1.1. Introducción a la espectrofotometría 1 S1.2. Radiación electromagnética 1 S1.3. Espectroscopía ultravioleta/visible 2 S1.4. Colorimetría 5 S1.1. Introducción a la espectrofotometría
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA
 REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
ESPECTROSCOPÍA Y ELUCIDACIÓN ESTRUCTURAL. Química Orgánica III Primer Semestre 2016 Facultad de CC.QQ. Y Farmacia, USAC
 ESPECTROSCOPÍA Y ELUCIDACIÓN ESTRUCTURAL Química Orgánica III Primer Semestre 2016 Facultad de CC.QQ. Y Farmacia, USAC QSAR Las siglas corresponden al inglés Quantitative structure-activity relationship.
ESPECTROSCOPÍA Y ELUCIDACIÓN ESTRUCTURAL Química Orgánica III Primer Semestre 2016 Facultad de CC.QQ. Y Farmacia, USAC QSAR Las siglas corresponden al inglés Quantitative structure-activity relationship.
Espectroscopía de Absorción Molecular
 Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
Experimentos cuánticos I Curso 2012
 Experimentos cuánticos I Curso 2012 Espectroscopía UV vis: Repaso de aspectos básicos e instrumentales: Experimentos con cianinas: el pozo de potencial. Experimentos con centros de color. Regiones del
Experimentos cuánticos I Curso 2012 Espectroscopía UV vis: Repaso de aspectos básicos e instrumentales: Experimentos con cianinas: el pozo de potencial. Experimentos con centros de color. Regiones del
QUIMICA ORGÁNICA II TALLER ESPCTROSCOPIA UV-VISIBLE- IR TALLER DE ESPECTROSCOPIA IR
 TALLER DE ESPECTROSCOPIA IR Nomenclatura de los sistemas dieno: Dieno homoanular No sos dienos homoanular Dieno heteroanular No es dieno heteroanular Endo Exo Sistema cruzado no se aplica Wodward Fieser
TALLER DE ESPECTROSCOPIA IR Nomenclatura de los sistemas dieno: Dieno homoanular No sos dienos homoanular Dieno heteroanular No es dieno heteroanular Endo Exo Sistema cruzado no se aplica Wodward Fieser
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS. Tipos de radiaciones electromagnéticas según λ.
 RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
La Mecánica Cuántica. La Espectroscopia Infrarroja
 La Mecánica Cuántica. La Espectroscopia Infrarroja 1. La Espectroscopia Infrarroja La luz que ven nuestros ojos no es más que una parte del espectro electromagnético. La luz se puede considerar como un
La Mecánica Cuántica. La Espectroscopia Infrarroja 1. La Espectroscopia Infrarroja La luz que ven nuestros ojos no es más que una parte del espectro electromagnético. La luz se puede considerar como un
ESPECTROSCOPÍA ESPECTROSCOPIA ULTRAVIOLETA-VISIBLE
 ESPECTROSCOPÍA ESPECTROSCOPIA ULTRAVIOLETA-VISIBLE La espectroscopia ultravioleta-visible o espectrofotometría ultravioleta-visible (UV/VIS) es una espectroscopia de fotones y una espectrofotometría. Utiliza
ESPECTROSCOPÍA ESPECTROSCOPIA ULTRAVIOLETA-VISIBLE La espectroscopia ultravioleta-visible o espectrofotometría ultravioleta-visible (UV/VIS) es una espectroscopia de fotones y una espectrofotometría. Utiliza
ESPECTROMETRÍA VISIBLE Y ULTRAVIOLETA
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 4 LECTURA N 6 ESPECTROMETRÍA VISIBLE Y ULTRAVIOLETA Bibliografía: SKOOG, D.A.; Leary J.J., Holler F. James; PRINCIPIOS DE ANÁLISIS INSTRUMENTAL,
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 4 LECTURA N 6 ESPECTROMETRÍA VISIBLE Y ULTRAVIOLETA Bibliografía: SKOOG, D.A.; Leary J.J., Holler F. James; PRINCIPIOS DE ANÁLISIS INSTRUMENTAL,
Teoría cuántica y la estructura electrónica de los átomos
 Teoría cuántica y la estructura electrónica de los átomos Capítulo 7 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. PROPIEDADES DE LAS ONDAS Longitud de onda
Teoría cuántica y la estructura electrónica de los átomos Capítulo 7 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. PROPIEDADES DE LAS ONDAS Longitud de onda
VIBRACIONES CARACTERÍSTICAS DE ALGUNAS DE LAS FUNCIONES QUÍMICA-ORGÁNICAS MÁS IMPORTANTES.
 VIBRACIONES CARACTERÍSTICAS DE ALGUNAS DE LAS FUNCIONES QUÍMICA-ORGÁNICAS MÁS IMPORTANTES. ALCANOS NORMALES (LINEALES) En todos los alcanos normales o ramificados se espera encontrar solo estiramientos
VIBRACIONES CARACTERÍSTICAS DE ALGUNAS DE LAS FUNCIONES QUÍMICA-ORGÁNICAS MÁS IMPORTANTES. ALCANOS NORMALES (LINEALES) En todos los alcanos normales o ramificados se espera encontrar solo estiramientos
Espectroscopía Clase integradora
 Espectroscopía Clase integradora Qué es la espectroscopía? La espectroscopia es el estudio de la INTERACCIÓN entre la materia y energía radiante, por ejemplo, radiación electromagnética. Busca relacionar
Espectroscopía Clase integradora Qué es la espectroscopía? La espectroscopia es el estudio de la INTERACCIÓN entre la materia y energía radiante, por ejemplo, radiación electromagnética. Busca relacionar
TEMA 9. DETERMINACIÓN DE ESTRUCTURAS MEDIANTE MÉTODOS FÍSICOS
 TEMA 9. DETERMINACIÓN DE ESTRUCTURAS MEDIANTE MÉTODOS FÍSICOS 1. Interacción de la energía radiante y la materia orgánica. 2. Fundamentos de la espectroscopia infrarroja: regiones del IR y modos fundamentales
TEMA 9. DETERMINACIÓN DE ESTRUCTURAS MEDIANTE MÉTODOS FÍSICOS 1. Interacción de la energía radiante y la materia orgánica. 2. Fundamentos de la espectroscopia infrarroja: regiones del IR y modos fundamentales
Métodos Espectrofotométricos. Capítulos 24 y 25 de Fundamentos de Química Analítica Skoog-West-Holler-Crouch (octava Ed.)
 Métodos Espectrofotométricos Capítulos 24 y 25 de Fundamentos de Química Analítica Skoog-West-Holler-Crouch (octava Ed.) 1 Radiación electromagnética Longitud de onda : Frecuencia en s -1 Hertz Numero
Métodos Espectrofotométricos Capítulos 24 y 25 de Fundamentos de Química Analítica Skoog-West-Holler-Crouch (octava Ed.) 1 Radiación electromagnética Longitud de onda : Frecuencia en s -1 Hertz Numero
ESPECTROFOTOMETRÍA UV-VISIBLE. Mª Luisa Fernández de Córdova Universidad de Jaén
 ESPECTROFOTOMETRÍA UV-VISIBLE 1. Propiedades de la luz 2. Absorción de luz 2.1. Fenómeno de la absorción 2.2. Espectros de absorción molecular 2.3. Tipos de transiciones electrónicas 3. Ley de Lambert-Beer
ESPECTROFOTOMETRÍA UV-VISIBLE 1. Propiedades de la luz 2. Absorción de luz 2.1. Fenómeno de la absorción 2.2. Espectros de absorción molecular 2.3. Tipos de transiciones electrónicas 3. Ley de Lambert-Beer
Teoría cuántica y la estructura electrónica de los átomos. Capítulo 7
 Teoría cuántica y la estructura electrónica de los átomos Capítulo 7 Propiedades de las ondas Longitud de onda (λ) es la distancia que existe entre dos puntos idénticos en una serie de ondas. Amplitud:
Teoría cuántica y la estructura electrónica de los átomos Capítulo 7 Propiedades de las ondas Longitud de onda (λ) es la distancia que existe entre dos puntos idénticos en una serie de ondas. Amplitud:
Teoría Cuántica y la Estructura Electrónica de los Atomos
 Propiedades de la ondas Teoría Cuántica y la Estructura Electrónica de los Atomos Capítulo 7 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Largo de onda (λ)
Propiedades de la ondas Teoría Cuántica y la Estructura Electrónica de los Atomos Capítulo 7 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Largo de onda (λ)
Problemas de Química 2.º Bachillerato Estructura atómica 13/11/2017 Pág. 1
 Problemas de Química 2.º Bachillerato Estructura atómica 3//207 Pág.. A y B son átomos de distintos elementos situados en el mismo período y que tienen 5 y 7 electrones de valencia, respectivamente. Responda,
Problemas de Química 2.º Bachillerato Estructura atómica 3//207 Pág.. A y B son átomos de distintos elementos situados en el mismo período y que tienen 5 y 7 electrones de valencia, respectivamente. Responda,
Tema 3.-Espectroscopía de biomoléculas
 Tema 3.-Espectroscopía de biomoléculas Tema 3.-Espectroscopía de biomoléculas 3.1.-El espectro electromagnético 3.2.-Espectros de absorción y de emisión (espontánea y estimulada) 3.2.1.-Momento dipolar
Tema 3.-Espectroscopía de biomoléculas Tema 3.-Espectroscopía de biomoléculas 3.1.-El espectro electromagnético 3.2.-Espectros de absorción y de emisión (espontánea y estimulada) 3.2.1.-Momento dipolar
Interacción materia-radiación
 Interacción materia-radiación 1. Indicar en qué zona del espectro electromagnético aparece cada uno de los tránsitos siguientes: a) 3000 cm -1 ; b) 100 Kcal/mol; c) 3.3 10-1 ergios y d) 6 10 9 sg 1.. ierto
Interacción materia-radiación 1. Indicar en qué zona del espectro electromagnético aparece cada uno de los tránsitos siguientes: a) 3000 cm -1 ; b) 100 Kcal/mol; c) 3.3 10-1 ergios y d) 6 10 9 sg 1.. ierto
UNIVERSIDAD CENTRAL DEL ECUADOR Facultad de Ciencias Químicas. Fundamentos Espectroscópicos. Espectroscopia UV-Visible
 UNIVERSIDAD CENTRAL DEL ECUADOR Facultad de Ciencias Químicas Jhonny Arias Lenin Lombeida 2011-07-05 Fundamentos Espectroscópicos Espectroscopia UV-Visible Orbitales Atómicos Podemos decir que un orbital
UNIVERSIDAD CENTRAL DEL ECUADOR Facultad de Ciencias Químicas Jhonny Arias Lenin Lombeida 2011-07-05 Fundamentos Espectroscópicos Espectroscopia UV-Visible Orbitales Atómicos Podemos decir que un orbital
ESPECTROCOPIA DE RESONANCIA MAGNETICA NUCLEAR
 ESPECTROCOPIA DE RESONANCIA MAGNETICA NUCLEAR La Espectroscopía de Resonancia Magnética Nuclear (RMN) es la herramienta de determinación estructural más potente del químico orgánico. Mediante el RMN podemos
ESPECTROCOPIA DE RESONANCIA MAGNETICA NUCLEAR La Espectroscopía de Resonancia Magnética Nuclear (RMN) es la herramienta de determinación estructural más potente del químico orgánico. Mediante el RMN podemos
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS FUNDAMENTOS DE LA ESPECTROSCOPIA
 Integrantes: Ipiales Gabriela Química de Alimentos Olmos Wendy Química Farmacéutica Día: Miércoles 9-11 Fecha: 05/07/2011 DEFINICIÓN DE ORBITALES ATÓMICOS Un orbital atómico representa una región del espacio
Integrantes: Ipiales Gabriela Química de Alimentos Olmos Wendy Química Farmacéutica Día: Miércoles 9-11 Fecha: 05/07/2011 DEFINICIÓN DE ORBITALES ATÓMICOS Un orbital atómico representa una región del espacio
ANALISIS INSTRUMENTAL II 4. ESPECTROSCOPIA ULTRAVIOLETA 2
 ANALISIS INSTRUMENTAL II 4. ESPECTROSCOPIA ULTRAVIOLETA 2 La región ultravioleta del espectro electromagnético se caracteriza por tener radiaciones con la energía suficiente para afectar la energía electrónica
ANALISIS INSTRUMENTAL II 4. ESPECTROSCOPIA ULTRAVIOLETA 2 La región ultravioleta del espectro electromagnético se caracteriza por tener radiaciones con la energía suficiente para afectar la energía electrónica
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS. Partícula Masa (g) Carga (Coulombs) Carga unitaria. Electrón
 MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
Desplazamiento Químico. Dr. Jorge A. Palermo
 Desplazamiento Químico δ Dr. Jorge A. Palermo ν 0 = γ B 0 / 2π ECUACIÓN DE LARMOR E aumenta con B 0 Núcleo 1 2.35 Tesla 100 Mz 17.63 Tesla 750 Mz ν 0 aumenta con B 0 2 13 C 31 P 15.35 Mz 25.1 Mz 40.5 Mz
Desplazamiento Químico δ Dr. Jorge A. Palermo ν 0 = γ B 0 / 2π ECUACIÓN DE LARMOR E aumenta con B 0 Núcleo 1 2.35 Tesla 100 Mz 17.63 Tesla 750 Mz ν 0 aumenta con B 0 2 13 C 31 P 15.35 Mz 25.1 Mz 40.5 Mz
Espectroscopía de Absorción Molecular
 Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
Espectroscopía de Absorción Molecular La espectroscopía consiste en el estudio cualitativo y cuantitativo de la estructura de los átomos o moléculas o de distintos procesos físicos y químicos mediante
UNIVERSIDAD DE PUERTO RICO RECINTO DE RÍO PIEDRAS DEPARTAMENTO DE QUÍMICA QUÍMICA ORGÁNICA II (QUIM 3032)
 QUÍMICA RGÁNICA II (QUIM 3032) PRIMER EXAMEN PARCIAL UNIVERSIDAD DE PUERT RIC RECINT DE RÍ PIEDRAS DEPARTAMENT DE QUÍMICA 25 DE FEBRER DE 2016 SECCIÓN: NMBRE: NÚM. DE ESTUDIANTE: El examen consta de 13
QUÍMICA RGÁNICA II (QUIM 3032) PRIMER EXAMEN PARCIAL UNIVERSIDAD DE PUERT RIC RECINT DE RÍ PIEDRAS DEPARTAMENT DE QUÍMICA 25 DE FEBRER DE 2016 SECCIÓN: NMBRE: NÚM. DE ESTUDIANTE: El examen consta de 13
Espectroscopía de Infrarrojo (IR) y espectrometría de masas (MS)
 Espectroscopía de Infrarrojo (IR) y espectrometría de masas (MS) Elucidación Estructural de Compuestos Orgánicos Resonancia Magnética Nuclear (RMN) Espectrometría de Masa (MS) Espectroscopía de Infrarojo
Espectroscopía de Infrarrojo (IR) y espectrometría de masas (MS) Elucidación Estructural de Compuestos Orgánicos Resonancia Magnética Nuclear (RMN) Espectrometría de Masa (MS) Espectroscopía de Infrarojo
QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA
 QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010)
QUÍMICA de 2º de BACHILLERATO ESTRUCTURA DE LA MATERIA PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010)
ESPECTROSCOPIA INFRARROJA. Prof. Dr. Alberto Postigo
 ESPECTROSCOPIA INFRARROJA Prof. Dr. Alberto Postigo 1 2 Transición energética en el IR 3 A.-TEORIA DE LA ESPECTROSCOPIA IR (cm 1 ) = 1 (cm) (z) = c (cm) = c (cm/sec) (cm) cm 1 = 1 ( ) x 10,000 and = 1-1
ESPECTROSCOPIA INFRARROJA Prof. Dr. Alberto Postigo 1 2 Transición energética en el IR 3 A.-TEORIA DE LA ESPECTROSCOPIA IR (cm 1 ) = 1 (cm) (z) = c (cm) = c (cm/sec) (cm) cm 1 = 1 ( ) x 10,000 and = 1-1
EL ESPECTRO ELECTROMAGNÉTICO
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA
 INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA Objetivos Al finalizar el trabajo práctico los estudiantes estarán en capacidad de: - Conocer el principio que rige la espectrofotometría. - Interpretar el basamento
INTRODUCCIÓN A LA ESPECTROFOTOMETRÍA Objetivos Al finalizar el trabajo práctico los estudiantes estarán en capacidad de: - Conocer el principio que rige la espectrofotometría. - Interpretar el basamento
Teoría Cuántica y la Estructura Electrónica de los Atomos
 Teoría Cuántica y la Estructura Electrónica de los Atomos Capítulo 7 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Propiedades de la ondas Largo de onda (λ)
Teoría Cuántica y la Estructura Electrónica de los Atomos Capítulo 7 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Propiedades de la ondas Largo de onda (λ)
Las Ondas y la Luz. Las Ondas
 Las Ondas Una onda consiste en la propagación de una perturbación física en un medio que puede ser material (aire, agua, tierra, etc) o inmaterial (vacío), según la cual existe transporte de energía, pero
Las Ondas Una onda consiste en la propagación de una perturbación física en un medio que puede ser material (aire, agua, tierra, etc) o inmaterial (vacío), según la cual existe transporte de energía, pero
PLANIFICACIÓN DE ASIGNATURA
 PLANIFICACIÓN DE ASIGNATURA I IDENTIFICACION GENERAL DE LA ASIGNATURA CARRERA BIOQUÍMICA DEPARTAMENTO CIENCIAS DEL AMBIENTE ASIGNATURA QUIMICA ORGANICA I CÓDIGO 66114 PRERREQUISITOS Química General I y
PLANIFICACIÓN DE ASIGNATURA I IDENTIFICACION GENERAL DE LA ASIGNATURA CARRERA BIOQUÍMICA DEPARTAMENTO CIENCIAS DEL AMBIENTE ASIGNATURA QUIMICA ORGANICA I CÓDIGO 66114 PRERREQUISITOS Química General I y
Los fundamentos de la espectroscopia: teoría CONSTRUYENDO UNA CIENCIA MEJOR ENTRE AGILENT Y USTED
 Los fundamentos de la espectroscopia: teoría CONSTRUYENDO UNA CIENCIA MEJOR ENTRE AGILENT Y USTED 1 Agilent es una empresa comprometida con la comunidad educativa y no duda en ofrecer acceso a materiales
Los fundamentos de la espectroscopia: teoría CONSTRUYENDO UNA CIENCIA MEJOR ENTRE AGILENT Y USTED 1 Agilent es una empresa comprometida con la comunidad educativa y no duda en ofrecer acceso a materiales
Tema 5. Espectroscopias: Infrarroja, Ultravioleta-Visible, Absorción y Emisión Atómica
 Tema 5. Espectroscopias: Infrarroja, Ultravioleta-Visible, Absorción y Emisión Atómica 5.1 Introducción 5.2 Espectroscopía del Infrarrojo (IR). 5.2.1 Fundamentos 5.2.2 Descripción de la técnica 5.2.3 Interpretación
Tema 5. Espectroscopias: Infrarroja, Ultravioleta-Visible, Absorción y Emisión Atómica 5.1 Introducción 5.2 Espectroscopía del Infrarrojo (IR). 5.2.1 Fundamentos 5.2.2 Descripción de la técnica 5.2.3 Interpretación
2014_2C. Módulo IV. La interacción de la luz con la materia. lo que vemos y lo que nos permite ver Hewitt, Física conceptual. Actividades prácticas
 Módulo IV La interacción de la luz con la materia lo que vemos y lo que nos permite ver Hewitt, Física conceptual Arquitectura del Módulo IV Teóricos Polarización de la luz Interferencia y difracción Espectroscopias
Módulo IV La interacción de la luz con la materia lo que vemos y lo que nos permite ver Hewitt, Física conceptual Arquitectura del Módulo IV Teóricos Polarización de la luz Interferencia y difracción Espectroscopias
EL ÁTOMO CONTENIDOS. ANTECEDENTES HISTÓRICOS. ( ) MODELOS ATÓMICOS. RAYOS CATÓDICOS. MODELO DE THOMSON.
 EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
Química. Hibridación de Orbitales Atómicos en el Carbono
 Química Hibridación de Orbitales Atómicos en el Carbono La estructura electrónica de los átomos que constituyen una molécula orgánica determina la estructura tridimensional de ésta y sus propiedades. sp
Química Hibridación de Orbitales Atómicos en el Carbono La estructura electrónica de los átomos que constituyen una molécula orgánica determina la estructura tridimensional de ésta y sus propiedades. sp
Experimento 12 LÍNEAS ESPECTRALES. Objetivos. Teoría. Postulados de Bohr. El átomo de hidrógeno, H
 Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
S.E.P. S.E.I.T DIRECCION GENERAL DE INSTITUTOS TECNOLOGICOS
 S.E.P. S.E.I.T DIRECCION GENERAL DE INSTITUTOS TECNOLOGICOS NOMBRE DE LA ASIGNATURA: QUIMICA ANALITICA II (4-2-10) NIVEL: LICENCIATURA. CARRERA: INGENIERIA BIOQUIMICA INGENIERIA QUIMICA CLAVE: ACC-9331
S.E.P. S.E.I.T DIRECCION GENERAL DE INSTITUTOS TECNOLOGICOS NOMBRE DE LA ASIGNATURA: QUIMICA ANALITICA II (4-2-10) NIVEL: LICENCIATURA. CARRERA: INGENIERIA BIOQUIMICA INGENIERIA QUIMICA CLAVE: ACC-9331
TÉCNICAS BASADAS EN LA ABSORCIÓN DE RADIACIÓN
 TÉCNICAS BASADAS EN LA ABSORCIÓN DE RADIACIÓN Absorción de radiación y concentración. Ley de Beer. La espectroscopia de absorción molecular se basa en la medida de la transmitancia T o de la absorbancia
TÉCNICAS BASADAS EN LA ABSORCIÓN DE RADIACIÓN Absorción de radiación y concentración. Ley de Beer. La espectroscopia de absorción molecular se basa en la medida de la transmitancia T o de la absorbancia
Problema Interferencia de N ranuras.
 Problema 9. 4. Interferencia de N ranuras. Considere un obstáculo con tres ranuras separadas por una distancia d e iluminado con una onda plana de longitud de onda λ. Emplee el método de los fasores para
Problema 9. 4. Interferencia de N ranuras. Considere un obstáculo con tres ranuras separadas por una distancia d e iluminado con una onda plana de longitud de onda λ. Emplee el método de los fasores para
TEMA 3. Grupos funcionales con enlaces múltiples.
 TEMA 3. Grupos funcionales con enlaces múltiples. Alquenos. Alquinos. Compuestos aromáticos. El grupo carbonilo. Aldehídos. Cetonas. Ácidos carboxílicos. Ésteres. Anhídridos. Amidas Tioésteres, Fosfoésteres,
TEMA 3. Grupos funcionales con enlaces múltiples. Alquenos. Alquinos. Compuestos aromáticos. El grupo carbonilo. Aldehídos. Cetonas. Ácidos carboxílicos. Ésteres. Anhídridos. Amidas Tioésteres, Fosfoésteres,
ANARMONICIDAD Y RESONANCIA EN VIBRACIONES DE MOLÉCULAS
 ANARMONICIDAD Y RESONANCIA EN VIBRACIONES DE MOLÉCULAS PRESENTADO POR: ADRIANA LISSETH LUQUE DIAZ JORGE ENRIQUE JURADO TASCO MARCO ANTONIO HUERTA ORTIZ PABLO LABRA VÁZQUEZ MAESTRÍA EN CIENCIAS QUÍMICAS
ANARMONICIDAD Y RESONANCIA EN VIBRACIONES DE MOLÉCULAS PRESENTADO POR: ADRIANA LISSETH LUQUE DIAZ JORGE ENRIQUE JURADO TASCO MARCO ANTONIO HUERTA ORTIZ PABLO LABRA VÁZQUEZ MAESTRÍA EN CIENCIAS QUÍMICAS
Radiación. Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler. L. Infante 1
 Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
TEMA 3: Interacción de la radiación solar con la superficie de la Tierra y la atmósfera
 TEMA 3: Interacción de la radiación solar con la superficie de la Tierra y la atmósfera Objetivo Entender por qué la Tierra tiene un temperatura promedio global moderada que permite su habitabilidad, y
TEMA 3: Interacción de la radiación solar con la superficie de la Tierra y la atmósfera Objetivo Entender por qué la Tierra tiene un temperatura promedio global moderada que permite su habitabilidad, y
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS Alexis Lema Jueves 10-12 ESPECTROSCOPIA UV-VIS. COMBINACIÓN LINEAL DE ORBITALES ATOMICOS (CLOA). ORBITALES ATOMICOS
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS FUNDAMENTOS ESPECTROSCOPICOS Alexis Lema Jueves 10-12 ESPECTROSCOPIA UV-VIS. COMBINACIÓN LINEAL DE ORBITALES ATOMICOS (CLOA). ORBITALES ATOMICOS
Espectroscopía vibracional y rotacional
 Espectroscopía vibracional y rotacional Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Ultima actualización 19 de marzo de 2015 Índice 1. Interacción de la radiación con la materia
Espectroscopía vibracional y rotacional Antonio M. Márquez Departamento de Química Física Universidad de Sevilla Ultima actualización 19 de marzo de 2015 Índice 1. Interacción de la radiación con la materia
Unidad 1: Teoría Cuántica y Estructura Atómica. 1.2 Base experimental de la teoría cuántica
 Unidad 1: Teoría Cuántica y Estructura Atómica 1.2 Base experimental de la teoría cuántica Thompson Dalton Rutherford Demócrito Naturaleza eléctrica de la materia La naturaleza de la luz CUANTOS Descubrimiento
Unidad 1: Teoría Cuántica y Estructura Atómica 1.2 Base experimental de la teoría cuántica Thompson Dalton Rutherford Demócrito Naturaleza eléctrica de la materia La naturaleza de la luz CUANTOS Descubrimiento
Unidad 1: Materia, estructura y Periodicidad Base experimental de la teoría cuántica y estructura atómica.
 Unidad 1: Materia, estructura y Periodicidad 1.7. Base experimental de la teoría cuántica y estructura atómica. Modelo de Dalton En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia
Unidad 1: Materia, estructura y Periodicidad 1.7. Base experimental de la teoría cuántica y estructura atómica. Modelo de Dalton En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia
ESPECTROSCOPÍA EJEMPLOS DE ELUCIDACION ESTRUCTURAL DE COMPUESTOS. Elucidación estructural: Ejemplo 1 Dados los siguientes espectros:
 ESPECTROSCOPÍA EJEMPLOS DE ELUCIDACION ESTRUCTURAL DE COMPUESTOS Elucidación estructural: Ejemplo 1 Dados los siguientes espectros: 1) Empezaremos por encontrar la formula molecular, pues no la tenemos.
ESPECTROSCOPÍA EJEMPLOS DE ELUCIDACION ESTRUCTURAL DE COMPUESTOS Elucidación estructural: Ejemplo 1 Dados los siguientes espectros: 1) Empezaremos por encontrar la formula molecular, pues no la tenemos.
Moléculas poliatómicas con dobles enlaces conjugados en la aproximación de electrones libres
 aterial didáctico para el curso de Química Cuántica Andrés Cedillo Departamento de Química, UA-I arzo de 1991 oléculas poliatómicas con dobles enlaces conjugados en la aproximación de electrones libres
aterial didáctico para el curso de Química Cuántica Andrés Cedillo Departamento de Química, UA-I arzo de 1991 oléculas poliatómicas con dobles enlaces conjugados en la aproximación de electrones libres
Tema 3.-Espectroscopía de biomoléculas
 Tema 3.Espectroscopía de biomoléculas Tema 3.Espectroscopía de biomoléculas 3..El espectro electromagnético 3.2.Espectros de absorción y de emisión (espontánea y estimulada) 3.2..Momento dipolar de transición:
Tema 3.Espectroscopía de biomoléculas Tema 3.Espectroscopía de biomoléculas 3..El espectro electromagnético 3.2.Espectros de absorción y de emisión (espontánea y estimulada) 3.2..Momento dipolar de transición:
CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS
 CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia Departamento de Química Orgánica Sistemas Conjugados Los sistemas insaturados
CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia Departamento de Química Orgánica Sistemas Conjugados Los sistemas insaturados
DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR
 DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR 1 OBJETIVOS 1) Obtener el pk del naranja de metilo 2) Obtener el espectro de absorción del naranja de metilo en disoluciones i de diferente ph.
DETERMINACIÓN ESPECTROFOTOMÉTRICA DEL pk DE UN INDICADOR 1 OBJETIVOS 1) Obtener el pk del naranja de metilo 2) Obtener el espectro de absorción del naranja de metilo en disoluciones i de diferente ph.
Espectrofotometría UV- VIS
 Universidad Central de Venezuela Facultad de Agronomía Departamento de Química y Tecnología Cátedra de Análisis de Productos Agrícolas I 1 09/03/2015 9:20 Prof. Fanny Molina 5 1 Rad Electromagnética o
Universidad Central de Venezuela Facultad de Agronomía Departamento de Química y Tecnología Cátedra de Análisis de Productos Agrícolas I 1 09/03/2015 9:20 Prof. Fanny Molina 5 1 Rad Electromagnética o
PROGRAMA DE ANÁLISIS INSTRUMENTAL II
 Programa de Análisis Instrumental II Página 1 de 8 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE FISICOQUÍMICA PROGRAMA DE ANÁLISIS
Programa de Análisis Instrumental II Página 1 de 8 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE FISICOQUÍMICA PROGRAMA DE ANÁLISIS
EJERCICIOS DE INTERPRETACIÓN PARTE 2
 EJERCICIOS DE INTERPRETACIÓN PARTE 2 7 Ácido -Bromobutírico NMR 09 CH 3 CH 2 CH O C OH 3 1 Br 1 2 8 Feniletil Acetato NMR 14 5 O CH 2 CH 2 O C CH 3 3 2 2 9 Etil Succinato NMR 18 O O CH 3 CH 2 O C CH 2
EJERCICIOS DE INTERPRETACIÓN PARTE 2 7 Ácido -Bromobutírico NMR 09 CH 3 CH 2 CH O C OH 3 1 Br 1 2 8 Feniletil Acetato NMR 14 5 O CH 2 CH 2 O C CH 3 3 2 2 9 Etil Succinato NMR 18 O O CH 3 CH 2 O C CH 2
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA.
 CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en
CONOCIMIENTO DE TÉCNICAS ANALÍTICAS PARTE I: FUNDAMENTOS DE ESPECTROFOTOMETRÍA. I. OBJETIVO GENERAL Conocer y aplicar los fundamentos de la ESPECTROFOTOMETRÍA para la determinación de concentraciones en
interacción de la radiación con la atmósfera
 1 interacción de la radiación lección 4 sumario 2 Introducción. Composición de la atmósfera. Efectos atmosféricos: Dispersión. Absorción. Correcciones atmosféricas. introducción 3 La atmósfera se interpone
1 interacción de la radiación lección 4 sumario 2 Introducción. Composición de la atmósfera. Efectos atmosféricos: Dispersión. Absorción. Correcciones atmosféricas. introducción 3 La atmósfera se interpone
Química Orgánica I. Clase 2. Cont.
 Química Orgánica I Clase 2. Cont. Características Generales Orbitales Atómicos Orbitales íbridos Geometría Ejemplos Enlaces C-C Triples Alquinos Dobles Alquenos Sencillos Alcanos Longitudes de Enlace vs.
Química Orgánica I Clase 2. Cont. Características Generales Orbitales Atómicos Orbitales íbridos Geometría Ejemplos Enlaces C-C Triples Alquinos Dobles Alquenos Sencillos Alcanos Longitudes de Enlace vs.
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS
 REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de ADN. Conocer el manejo de micropipetas y espectrofotómetros. Espectrofotometría Es la
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de ADN. Conocer el manejo de micropipetas y espectrofotómetros. Espectrofotometría Es la
Modelo de Thomson Modelo de Rutherford. Estructura atómica. José Mariano Lucena Cruz 10 de mayo de 2010
 José Mariano Lucena Cruz chenalc@gmail.com 10 de mayo de 2010 Propiedades periódicas Aquellas cuyo valor se puede estimar según la posición que ocupen los elementos en la tabla periódica. Estas son: Tamaño
José Mariano Lucena Cruz chenalc@gmail.com 10 de mayo de 2010 Propiedades periódicas Aquellas cuyo valor se puede estimar según la posición que ocupen los elementos en la tabla periódica. Estas son: Tamaño
TEMA 1: DETERMINACIÓN DE LA FÓRMULA MOLECULAR Y DE LOS GRUPOS FUNCIONALES Introducción
 Introducción El número de compuestos orgánicos posibles es ilimitado, cada uno de los cuales posee una estructura definida y diferente, por lo que la determinación de la estructura debe llevar a establecer
Introducción El número de compuestos orgánicos posibles es ilimitado, cada uno de los cuales posee una estructura definida y diferente, por lo que la determinación de la estructura debe llevar a establecer
QUIMICA ANALITICA II Espectrofotometria (Parcial 1) Ayala UNISON-URS
 QUIMICA ANALITICA II Espectrofotometria (Parcial 1) Ayala UNISON-URS 1 Ondas eletromagnéticas Ondas electromagnéticas Son la combinación de un campo eléctrico y de un campo magnético, que se propagan en
QUIMICA ANALITICA II Espectrofotometria (Parcial 1) Ayala UNISON-URS 1 Ondas eletromagnéticas Ondas electromagnéticas Son la combinación de un campo eléctrico y de un campo magnético, que se propagan en
Química Orgánica I. Clase 2.
 Química Orgánica I Clase 2. Enlace Quimico. Teoria de Enlace de Valencia F 2 Enlace Covalente Polar: Enlace donde la densidad electronica esta polarizada hacia uno de los dos atomos. Electronegatividad
Química Orgánica I Clase 2. Enlace Quimico. Teoria de Enlace de Valencia F 2 Enlace Covalente Polar: Enlace donde la densidad electronica esta polarizada hacia uno de los dos atomos. Electronegatividad
CONTENIDOS MÍNIMOS septiembre
 DEPARTAMENTO DE FÍSICA Y QUÍMICA CONTENIDOS MÍNIMOS septiembre CONTENIDOS MÍNIMOS curso 2015/16 1º BACHILLERATO-FÍSICA Y QUÍMICA QUÍMICA ESTRUCTURA ATÓMICA -Partículas subatómicas. -Modelo atómico de Thompson.
DEPARTAMENTO DE FÍSICA Y QUÍMICA CONTENIDOS MÍNIMOS septiembre CONTENIDOS MÍNIMOS curso 2015/16 1º BACHILLERATO-FÍSICA Y QUÍMICA QUÍMICA ESTRUCTURA ATÓMICA -Partículas subatómicas. -Modelo atómico de Thompson.
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROSCOPÍA
 RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROSCOPÍA PROPIEDADES DE LA RADIACIÓN ELECTROMAGNÉTICA La RE es una clase de energía que se transmite por el espacio a enormes velocidades (3 x 10 a la 8 m/seg.) La RE
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROSCOPÍA PROPIEDADES DE LA RADIACIÓN ELECTROMAGNÉTICA La RE es una clase de energía que se transmite por el espacio a enormes velocidades (3 x 10 a la 8 m/seg.) La RE
Robert A. MILLIKAN ( )
 Robert A. MILLIKAN (1906 1914) Modelo atómico de Rutherford - Todo átomo está formado por un núcleo y corteza. - El núcleo, muy pesado, y de muy pequeño tamaño, formado por un número de protones igual
Robert A. MILLIKAN (1906 1914) Modelo atómico de Rutherford - Todo átomo está formado por un núcleo y corteza. - El núcleo, muy pesado, y de muy pequeño tamaño, formado por un número de protones igual
Examen de problemas (SOLUCIONADO)
 Aplicaciones de la Química Cuántica 3 de Químicas Convocatoria de Febrero 3 Feb 2006) Curso: 2005-06 Versión: 17 de febrero de 2006) Examen de problemas SOLUCIONADO) 1. [2.5 puntos]en el espectro Raman
Aplicaciones de la Química Cuántica 3 de Químicas Convocatoria de Febrero 3 Feb 2006) Curso: 2005-06 Versión: 17 de febrero de 2006) Examen de problemas SOLUCIONADO) 1. [2.5 puntos]en el espectro Raman
Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos
 Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos INTEGRANTES: * Nazate Amuy Ana * Veloz Hidalgo Polet TEMA: Combinación Lineal de Orbitales Atómicos ORBITAL ATÓMICO
Universidad Central del Ecuador Facultad de Ciencias Químicas Fundamentos Espectroscópicos INTEGRANTES: * Nazate Amuy Ana * Veloz Hidalgo Polet TEMA: Combinación Lineal de Orbitales Atómicos ORBITAL ATÓMICO
Res. Si n = 3 => l puede valer 0, 1 y 2. Por tanto, existen tres subniveles de energía: los correspondientes a los orbitales atómicos 3s, 3p y 3d.
 Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de calcio b) Hidróxido de cromo (III) c) Hexano-1,1-diol d) Hg 2 O 2 e) CdHPO 4 f) CH 2 =CHCH 2 CH 2 COOH Res. a) CaCrO 4 ; b) Cr(OH)
Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de calcio b) Hidróxido de cromo (III) c) Hexano-1,1-diol d) Hg 2 O 2 e) CdHPO 4 f) CH 2 =CHCH 2 CH 2 COOH Res. a) CaCrO 4 ; b) Cr(OH)
Como. Ley de Wien. CTE Wien = m K. Se puede usar para: Saber la Tª de una estrella Saber la Tª de un material (Pirómetros)
 Tema FÍSICA ATÓMICA.0.- Radiación de un cuerpo negro y Dualidad Onda-Partícula Cuerpo negro: Es un modelo en el cual se supone que: El cuerpo absorbe todas las radiaciones electromagnéticas que le llegan.
Tema FÍSICA ATÓMICA.0.- Radiación de un cuerpo negro y Dualidad Onda-Partícula Cuerpo negro: Es un modelo en el cual se supone que: El cuerpo absorbe todas las radiaciones electromagnéticas que le llegan.
MÉTODOS ESPECTROMÉTRICOS DE ANÁLISIS
 MÉTODOS ESPECTROMÉTRICOS DE ANÁLISIS Introducción: Además de las volumetrías y gravimetrías estudiadas, el químico analítico posee otros métodos de análisis que se basan, en general, en las propiedades
MÉTODOS ESPECTROMÉTRICOS DE ANÁLISIS Introducción: Además de las volumetrías y gravimetrías estudiadas, el químico analítico posee otros métodos de análisis que se basan, en general, en las propiedades
Serie 2 Fundamentos de Espectroscopia. = kg m/(s 2 A 2 2
 Serie Fundamentos de Espectroscopia. Las cuatro ecuaciones de Maxwell están dadas por: E B () E () t B E (3) B j (4) t Donde E y B son los campos eléctrico y magnético respectivamente, la densidad de carga,
Serie Fundamentos de Espectroscopia. Las cuatro ecuaciones de Maxwell están dadas por: E B () E () t B E (3) B j (4) t Donde E y B son los campos eléctrico y magnético respectivamente, la densidad de carga,
Recordando. Primer Modelo atómico (1900) Segundo Modelo atómico (1910) J. J. Thomson Budín de pasas. E. Rutherford Modelo planetario
 ANTECEDENTES DEL MODELO ACTUAL DEL ATOMO Raquel Villafrades Torres Universidad Pontificia Bolivariana Química General Química General Ingeniera Química Raquel Villafrades Torres Abril de 2009 Primer Modelo
ANTECEDENTES DEL MODELO ACTUAL DEL ATOMO Raquel Villafrades Torres Universidad Pontificia Bolivariana Química General Química General Ingeniera Química Raquel Villafrades Torres Abril de 2009 Primer Modelo
RESONANCIA MAGNÉTICA NUCLEAR
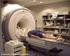 RESONANCIA MAGNÉTICA NUCLEAR SPIN DEL NUCLEO El nucleo de algunos átomos poseen SPIN. Estos núcleos se comportan como si estuvieran girando... no sabemos si realmente giran! Es como la propiedad de un
RESONANCIA MAGNÉTICA NUCLEAR SPIN DEL NUCLEO El nucleo de algunos átomos poseen SPIN. Estos núcleos se comportan como si estuvieran girando... no sabemos si realmente giran! Es como la propiedad de un
