Gases ideales. Introducción a la Física Ambiental. Tema 3. Tema 3.- " Gases ideales ".
|
|
|
- José Ramón Figueroa Ríos
- hace 8 años
- Vistas:
Transcripción
1 Gases deales. Introduccón a la Físca Abental. Tea 3. Tea 3. IFA (Prof. RAMOS) 1 Tea 3.- " Gases deales ". Ecuacón de estado: Gases deales. Energía nterna y Entalpía. Capacdades calorífcas: relacón de Mayer. Procesos cuas-estátcos: Isoteros y Adabátcos. Interpretacón cnétca de un gas deal: Presón y teperatura. Dstrbucón de velocdades oleculares. Mezcla de gases. Presón de vapor de agua en el are: Huedad relatva. Tea 3. IFA (Prof. RAMOS)
2 Gases deales: Ecuacones de estado. Propedades de coportaento de los gases deales. Ecuacón de estado: P nrt Ecuacón energétca: U U (T ) Coefcentes elástcos: 1 β T Tea 3. IFA (Prof. RAMOS) 3 1 κ T P Energía nterna y entalpía. Energía nterna: Al no exstr fuerzas de nteraccón olecular en los gases deales. U U (T ) En procesos a cte. δq du Entalpía: Sólo funcón de la teperatura en gases deales: H U + P U + nrt En procesos a Pcte. dh du + Pd δq P dh Tea 3. IFA (Prof. RAMOS) 4
3 Gases deales:capacdades Calorífcas. Capacdad calorífca a presón constante: δqp dh C p C p δq p du δw du + Pd dh Capacdad calorífca a voluen constante: C δq C δq du du Tea 3. IFA (Prof. RAMOS) 5 Coportaento de las capacdades calorífcas. Para los ssteas poco copresbles coo los sóldos y líqudos, β uy pequeño. El trabajo ecánco realzado durante una transforacón sóbara es práctcaente nulo. C P C Para aquellos ssteas uy copresbles (gases) en los que β>0, C P > C C P C > 0 Tea 3. IFA (Prof. RAMOS) 6
4 Ecuacones calorétrcas I. Capacdad calorífca a cte. en un gas deal. UU(T). du C Prera ecuacón calorétrca: du C δq C + Pd Tea 3. IFA (Prof. RAMOS) 7 Ecuacones calorétrcas II. Segunda ecuacón calorétrca: Gas deal: P nrt Dervando: Pd nr dp Utlzando la 1ª ecuacón calorétrca: δq ( C + nr) dp Segunda ecuacón calorétrca:» S pcte. δq ( C + nr) P dh δq CP dp dh C Tea 3. IFA (Prof. RAMOS) 8 P
5 Relacón de Mayer( relacón C p -C v?). De la ª ecuacón calorétrca obteneos: CP C nr Capacdades calorífcas para los gases deales onoatócos: 3 C nr 5 C P nr Problea 1. Hoja IFA3 Tea 3. IFA (Prof. RAMOS) 9 Procesos cuas-estátcos: Isoteros y Q0. Isotero Tcte. P cte Adabátco δq 0 Trabajo: W W 1 nrt d nrt nrtln( ) 1 1 d nrtln 1 Tea 3. IFA (Prof. RAMOS) 10
6 Procesos cuas-estátcos. Tea 3. IFA (Prof. RAMOS) 11 Procesos cuas-estátcos: Adabátcos (Q0). De las ec. calorétrcas: δq C + Pd 0 δq CP dp 0 Obteneos: C P dp C Integrando: Pd» Dvdendo: Trayectora adabátca: C C dp P P P d CP cp γ dp C c γ d γ P cte Tea 3. IFA (Prof. RAMOS) 1
7 Trayectoras adabátcas. Trayectoras adabátcas cuas-estátcas: γ P cte γ 1 T cte Trabajo adabátco: W Al ser un gas deal: C T c T du δw du C 1 γ γ P T cte ( Pf f P ) γ 1 Problea. Hoja IFA3 Tea 3. IFA (Prof. RAMOS) 13 Coefcente de copresbldad adabátco. Defncón: Isotero: Adabátco: Para un gas deal:»isotero:» Adabátco: κ (1/ ) P κ (1/ ) P T S 1 κ T P 1 κ S γp [ κ ] M 1 LT Problea 3. Hoja IFA3 Tea 3. IFA (Prof. RAMOS) 14
8 Interpretacón cnétca de un gas deal: Presón y teperatura. Bases Físcas: Hpótess atóca de la atera. Interpretacón ecancsta de los coponentes atócos (ecánca clásca). Gran núero de partículas (leyes estadístcas). N N A oléculas/ol. Tea 3. IFA (Prof. RAMOS) 15 Interpretacón cnétca de un gas deal:hpótess. Gran núero de partículas, en un sstea con baja densdad. Movento de las partículas defndo por la ecánca clásca. Interaccón entre partículas por choques elástcos. Fuerzas de nteraccón olecular desprecables. Gas puro. Sstea en equlbro térco. T gas cte. Tea 3. IFA (Prof. RAMOS) 16
9 Interpretacón cnétca de la presón I. La presón acroscópca es la sua de contrbucones croscópcas del ntercabo de oento lneal de las partículas del sstea contra las paredes del recpente que las contene. nº de oléculas en (v x ta): N ( vx ta) nº de oléculas sentdo ( ) : N ( vx ta) Tea 3. IFA (Prof. RAMOS) 17 Interpretacón cnétca de la presón II. Cabo de oento al chocar una partícula contra el recpente: p v ( v ) v x x x x Cabo de oento al chocar N partículas contra el recpente: 1 N N p n x ( vx ta) v x p x vx A t n A partr de la ley de Newton: Teneos, en ódulo: F 1 p P A A t r r dp F dt N P v x Tea 3. IFA (Prof. RAMOS) 18
10 Sgnfcado estadístco de la teperatura. Teneos, en 1-Densón: 1 P N < vx > N < vx > NkT P 1 1 < v x > kt En 3-D, sendo equprobables: < vx >< vy >< vz > La energía cnétca eda de las partículas será: < v > 3 < vx > E 1 3 < >< v > kt c Tea 3. IFA (Prof. RAMOS) 19 3kT < v > Dstrbucón de las velocdades oleculares. Funcón de Maxwell-Boltzann: S el núero total de oléculas es N, el nº de oléculas dn cuya velocdad está coprendda entre v y v+dv, es: dn Nf ( v) dv f ( v) 4 π kt v e v kt» elocdad ás probable:» Raíz de la velocdad cuadrátca eda: Tea 3. IFA (Prof. RAMOS) 0 M N R N Ak v ax 3 kt 3kT 3RT v rc < v > M A
11 Dstrbucón de las velocdades oleculares. Tea 3. IFA (Prof. RAMOS) 1 elocdades cuadrátcas edas. elocdad cuadrátca eda para H y O, para una teperatura de 300 k. el. O H 3kT (/s) < v > elocdad de escape en la Terra y Luna: GM T v e 1100 R s T GM L v e 300 R s L Para que exsta un gas: v < v 1 > 6 rn v e Tea 3. IFA (Prof. RAMOS)
12 Capacdades calorífcas. Gases onoatócos. Para un gas deal, la capacdad calorífca a cte: C du La energía cnétca para 3N grados de lbertad: 3 U < Ec > < v N N Capacdades calorífcas: C 3 3 Nk nr > C C nr P 3 NkT 5 C P nr Tea 3. IFA (Prof. RAMOS) 3 Mezcla de gases. Ley de Ggss-Dalton: Cada coponente gaseoso de la ezcla ocupa el voluen total a la teperatura de equlbro, coportaento deal (s hay -coponentes): nrt P La presón total de la ezcla será: RT P P P P n RT n nrt P Tea 3. IFA (Prof. RAMOS) 4
13 Mezcla de gases:propedades energétcas. Energía nterna de la ezcla de gases: c U U U U 1 u Calor específco a cte. du d 1 1 u Entalpía de la ezcla de gases: H H Calor especfco a Pcte. du c P dh 1 h 1 1 c u h dh 1 1 c c P Tea 3. IFA (Prof. RAMOS) 5 Presón de vapor de agua en el are. Se consdera al are coo una ezcla de gases (are seco + vapor de agua). Ecuacón de estado: + P P P La presón del vapor de agua sgue el coportaento del dagraa de equlbro del agua en sus dferentes fases (dagraa del punto trple): Tea 3. IFA (Prof. RAMOS) 6
14 Presón de vapor del agua en funcón de la teperatura. T(ºC) P (Hg) P (Kpa) Tea 3. IFA (Prof. RAMOS) 7 Huedad relatva. Punto de rocío: Teperatura a la que el vapor de agua está en saturacón con su fase líquda. Cuando se realza un enfraento del sstea a presón constante (dagraa de punto trple) el vapor se lcúa. Huedad absoluta: Masa total de agua, en fora de vapor, que por undad de voluen contene el sstea. H ab [ ] M Huedad relatva: Cocente entre la asa de agua, en fora de vapor, y la asa de saturacón en equlbro térco. n P RT P H (%) n P RT P sat s sat Problea 4. Hoja IFA3 Tea 3. IFA (Prof. RAMOS) 8
Física II: Termodinámica, ondas y fluidos
 Física II: Termodinámica, ondas y fluidos Índice PROPIEDADES TÉRMICAS DE LA MATERIA....1 INTRODUCCIÓN.... ECUACIONES DE ESTADO....3 PROPIEDADES MOLECULARES DE LA MATERIA... 7.4 MODELO CINÉTICO -MOLECULAR
Física II: Termodinámica, ondas y fluidos Índice PROPIEDADES TÉRMICAS DE LA MATERIA....1 INTRODUCCIÓN.... ECUACIONES DE ESTADO....3 PROPIEDADES MOLECULARES DE LA MATERIA... 7.4 MODELO CINÉTICO -MOLECULAR
Universidad Nacional de La Plata Facultad de Ciencias Astronómicas y Geofísicas. INTRODUCCIÓN a las CIENCIAS de la ATMÓSFERA
 Universidad Nacional de La Plata Facultad de Ciencias Astronóicas y Geofísicas INTRODUCCIÓN a las CIENCIAS de la ATMÓSFERA Práctica 3 : TEMPERATURA y HUMEDAD. Definiciones, ecuaciones y leyes básicas a)
Universidad Nacional de La Plata Facultad de Ciencias Astronóicas y Geofísicas INTRODUCCIÓN a las CIENCIAS de la ATMÓSFERA Práctica 3 : TEMPERATURA y HUMEDAD. Definiciones, ecuaciones y leyes básicas a)
Tema Nro. 2 Propiedades de las Sustancias Puras
 PET 06 P1 TERMODINAMICA In. Oscar Varas Antezana Tea Nro. Propiedades de las Sustancias Puras 1. SUSTANCIA PURA Es la sustancia cuyas coposiciones quíicas están bien deinidas. Es aquella sustancia de coposición
PET 06 P1 TERMODINAMICA In. Oscar Varas Antezana Tea Nro. Propiedades de las Sustancias Puras 1. SUSTANCIA PURA Es la sustancia cuyas coposiciones quíicas están bien deinidas. Es aquella sustancia de coposición
TERMODINÁMICA AVANZADA
 ERMODINÁMICA AANZADA Undad III: ermodnámca del Equlbro Fugacdad Fugacdad para gases, líqudos y sóldos Datos volumétrcos 9/7/ Rafael Gamero Fugacdad ropedades con varables ndependentes y ln f ' Con la dfncón
ERMODINÁMICA AANZADA Undad III: ermodnámca del Equlbro Fugacdad Fugacdad para gases, líqudos y sóldos Datos volumétrcos 9/7/ Rafael Gamero Fugacdad ropedades con varables ndependentes y ln f ' Con la dfncón
TRANSICIONES DE FASE EN ALIMENTOS
 TRANSICIONES DE FASE EN ALIMENTOS sistema multifásico de un solo componente: AGUA vapor de agua hielo agua líquida sistema mulltifásico con varios componentes TRANSICIONES DE FASE EN ALIMENTOS VARIACIONES
TRANSICIONES DE FASE EN ALIMENTOS sistema multifásico de un solo componente: AGUA vapor de agua hielo agua líquida sistema mulltifásico con varios componentes TRANSICIONES DE FASE EN ALIMENTOS VARIACIONES
Conservación del Momento Lineal y de la Energía
 Conservacón del Moento Lneal y de la Energía Conservacón del Moento Lneal y de la Energía Objetvos Coprobar experentalente la conservacón del oento lneal edante choques elástcos e nelástcos. Coprobar la
Conservacón del Moento Lneal y de la Energía Conservacón del Moento Lneal y de la Energía Objetvos Coprobar experentalente la conservacón del oento lneal edante choques elástcos e nelástcos. Coprobar la
TERMODINÁMICA Tema 10: El Gas Ideal
 TERMODINÁMICA Tema 10: El Gas Ideal Fundamentos Físicos de la Ingeniería 1 er Curso Ingeniería Industrial Dpto. Física Aplicada III 1 Índice Introducción Ecuación de estado Experimento de Joule Capacidades
TERMODINÁMICA Tema 10: El Gas Ideal Fundamentos Físicos de la Ingeniería 1 er Curso Ingeniería Industrial Dpto. Física Aplicada III 1 Índice Introducción Ecuación de estado Experimento de Joule Capacidades
1. Propiedades molares y propiedades molares parciales
 erodáca. ea 9 Ssteas abertos y ssteas cerrados de coposcó varable. ropedades olares y propedades olares parcales Ua agtud olar se dee coo: Sepre está asocada a u sstea terodáco de u úco copoete (sstea
erodáca. ea 9 Ssteas abertos y ssteas cerrados de coposcó varable. ropedades olares y propedades olares parcales Ua agtud olar se dee coo: Sepre está asocada a u sstea terodáco de u úco copoete (sstea
Primer principio de la termodinámica.
 Primer principio de la termodinámica. Introducción a la Física Ambiental. Tema. Tema IFA (Prof. RAMOS) Tema.- " Primer principio de la termodinámica". Calor y Trabajo. Capacidad calorífica, calores específicos
Primer principio de la termodinámica. Introducción a la Física Ambiental. Tema. Tema IFA (Prof. RAMOS) Tema.- " Primer principio de la termodinámica". Calor y Trabajo. Capacidad calorífica, calores específicos
Tema 2. DINÁMICA DE SISTEMAS DE PARTÍCULAS
 Tea. DIÁMICA DE SISTEMAS DE PARTÍCULAS. Intoduccón. Cento de asas.. Movento del cento de asas.. Masa educda..3 Consevacón del oento lneal..4 Consevacón del oento angula.3 Enegía de un sstea de patículas.3.
Tea. DIÁMICA DE SISTEMAS DE PARTÍCULAS. Intoduccón. Cento de asas.. Movento del cento de asas.. Masa educda..3 Consevacón del oento lneal..4 Consevacón del oento angula.3 Enegía de un sstea de patículas.3.
Mecánica. Cinemática Dinámica Trabajo y Energía. Sistemas de Partículas. Sólido Rígido. J.A. Moleón
 FÍSICA I ecánca Departaento de Físca Unersdad de Jaén Cneátca Dnáca Trabajo y Energía Ssteas de Partículas Sóldo Rígdo J.A. oleón - Introduccón Un Sstea de Partículas se defne coo un conjunto de puntos
FÍSICA I ecánca Departaento de Físca Unersdad de Jaén Cneátca Dnáca Trabajo y Energía Ssteas de Partículas Sóldo Rígdo J.A. oleón - Introduccón Un Sstea de Partículas se defne coo un conjunto de puntos
Dasometría / Celedonio L
 EJERCICIO Nº 6 Se ha realzado el nventaro forestal de una asa de Pnus pnaster no resnado, por uestreo estadístco, dseñado edante la toa de datos en parcelas rectangulares de 0 x 5 ts. El dáetro íno nventarable
EJERCICIO Nº 6 Se ha realzado el nventaro forestal de una asa de Pnus pnaster no resnado, por uestreo estadístco, dseñado edante la toa de datos en parcelas rectangulares de 0 x 5 ts. El dáetro íno nventarable
Cantidad de Momento, Conservación, Choques, Centro de Masa
 Cantdad de Moento, Conseracón, Choques, Centro de Masa Moentu líneal Las fuerzas aplcadas en una dreccón que no pasa por el centro de graedad de un objeto producen un gro en éste objeto. Para edr la agntud
Cantdad de Moento, Conseracón, Choques, Centro de Masa Moentu líneal Las fuerzas aplcadas en una dreccón que no pasa por el centro de graedad de un objeto producen un gro en éste objeto. Para edr la agntud
Ondas y Rotaciones. Colisiones Inelásticas
 Hoja de Trabajo 8 Ondas y Rotacones Colsones Inelástcas Jae Felcano Hernández Unersdad Autónoa Metropoltana - Iztapalapa Méxco, D. F. 5 de agosto de 0 INTRODUCCIÓN. Para edr el grado de elastcdad de una
Hoja de Trabajo 8 Ondas y Rotacones Colsones Inelástcas Jae Felcano Hernández Unersdad Autónoa Metropoltana - Iztapalapa Méxco, D. F. 5 de agosto de 0 INTRODUCCIÓN. Para edr el grado de elastcdad de una
MINISTERIO DE EDUCACIÓN - ARGENTINA ACCEDE - INGENIERÍA EN ALIMENTOS PROBLEMA Nº 6
 MINISTERIO DE EDUCACIÓN - ARGENTINA ACCEDE - INGENIERÍA EN ALIMENTOS PROBLEMA Nº 6 SITUACIÓN Un producto alentco fresco se deshdrata con are atosférco, en un secadero dscontnuo que opera con lotes de bandejas.
MINISTERIO DE EDUCACIÓN - ARGENTINA ACCEDE - INGENIERÍA EN ALIMENTOS PROBLEMA Nº 6 SITUACIÓN Un producto alentco fresco se deshdrata con are atosférco, en un secadero dscontnuo que opera con lotes de bandejas.
ced Au Au Au f Cu Cu Cu f
 Probleas calorietria Ejeplo 1.- 100 g de una aleación de oro y cobre, a la teperatura de 75.5ºC se introducen en un caloríetro con 502 g de agua a 25ºC, la teperatura del equilibrio es de 25.5ºC. Calcular
Probleas calorietria Ejeplo 1.- 100 g de una aleación de oro y cobre, a la teperatura de 75.5ºC se introducen en un caloríetro con 502 g de agua a 25ºC, la teperatura del equilibrio es de 25.5ºC. Calcular
Capacidad calorífica molar de un gas ideal: el principio de equipartición de la energía.
 Capacidad calorífica molar de un gas ideal: el principio de equipartición de la energía. Relación de Mayer Supóngase un gas ideal que realiza un proceso isobaro (Referido a las líneas con este nombre,
Capacidad calorífica molar de un gas ideal: el principio de equipartición de la energía. Relación de Mayer Supóngase un gas ideal que realiza un proceso isobaro (Referido a las líneas con este nombre,
Si consideramos un sistema PVT con N especies químicas π fases en equilibrio se caracteriza por: P v =P L = =P π
 EQUILIBRIO DE FASES Reglas de las fases. Teorema de Duhem S consderamos un sstema PVT con N especes químcas π fases en equlbro se caracterza por: P, T y (N-1) fraccones mol tal que Σx=1 para cada fase.
EQUILIBRIO DE FASES Reglas de las fases. Teorema de Duhem S consderamos un sstema PVT con N especes químcas π fases en equlbro se caracterza por: P, T y (N-1) fraccones mol tal que Σx=1 para cada fase.
IV. Análisis de energía en sistemas cerrados
 Objetivos:. Examinar el trabajo hecho por una frontera móvil.. Desarrollar el balance general de energía aplicado a sistemas. 3. Definir el calor específico a volumen constante y el calor específico a
Objetivos:. Examinar el trabajo hecho por una frontera móvil.. Desarrollar el balance general de energía aplicado a sistemas. 3. Definir el calor específico a volumen constante y el calor específico a
Figura del Problema # 1
 Separador Refrgeracón Mecánca (Copresón de vapor) PROBLEMA # 1 Utlzando el sstea de refrgeracón ostrado en la fgura, deterne las condcones de presón, teperatura, potenca total y la tasa de crculacón del
Separador Refrgeracón Mecánca (Copresón de vapor) PROBLEMA # 1 Utlzando el sstea de refrgeracón ostrado en la fgura, deterne las condcones de presón, teperatura, potenca total y la tasa de crculacón del
8 MECANICA Y FLUIDOS: Calorimetría
 8 MECANICA Y FLUIDOS: Calormetría CONTENIDOS Dencones. Capacdad caloríca. Calor especíco. Equlbro térmco. Calormetría. Calorímetro de las mezclas. Marcha del calorímetro. Propagacón de Errores. OBJETIVOS
8 MECANICA Y FLUIDOS: Calormetría CONTENIDOS Dencones. Capacdad caloríca. Calor especíco. Equlbro térmco. Calormetría. Calorímetro de las mezclas. Marcha del calorímetro. Propagacón de Errores. OBJETIVOS
TEMA 2.- ESTADOS DE AGREGACIÓN DE LA MATERIA. GASES (I).
 TEMA 2.- ESTADOS DE AGREGACIÓN DE LA MATERIA. GASES (I). 1. Introducción. 2. Leyes de los gases ideales. Concepto de presión. Relación entre p y V de un gas. Ley de Boyle. Relación entre T y V de un gas.
TEMA 2.- ESTADOS DE AGREGACIÓN DE LA MATERIA. GASES (I). 1. Introducción. 2. Leyes de los gases ideales. Concepto de presión. Relación entre p y V de un gas. Ley de Boyle. Relación entre T y V de un gas.
CUADERNILLO PREPARADO POR LA CÁTEDRA DE TERMODINÁMICA 1.1.1. TEMPERATURA:
 CUADERNILLO PREPARADO POR LA CÁTEDRA DE TERMODINÁMICA 1.1.1. TEMPERATURA: 1.1.. Introducción: El concepto de temperatura está muy relacionado con el diario vivir. Tenemos un concepto intuitivo de algo
CUADERNILLO PREPARADO POR LA CÁTEDRA DE TERMODINÁMICA 1.1.1. TEMPERATURA: 1.1.. Introducción: El concepto de temperatura está muy relacionado con el diario vivir. Tenemos un concepto intuitivo de algo
[1] [1 ] Esta condición evita que haya rotación del sistema Composición de fuerzas paralelas.
![[1] [1 ] Esta condición evita que haya rotación del sistema Composición de fuerzas paralelas. [1] [1 ] Esta condición evita que haya rotación del sistema Composición de fuerzas paralelas.](/thumbs/68/58837177.jpg) Tea 4 Ssteas de partículas 4.. Estátca y equlbro. 4... Condcones de equlbro. Las condcones de equlbro conssten en que para que un sstea esté en equlbro, la fuerza total externa aplcada debe ser nula: F
Tea 4 Ssteas de partículas 4.. Estátca y equlbro. 4... Condcones de equlbro. Las condcones de equlbro conssten en que para que un sstea esté en equlbro, la fuerza total externa aplcada debe ser nula: F
Deducción de parámetros y comportamiento
 Captulo 7. Deduccón de paráetros y coportaento presto por el odelo 287 Capítulo 7: presto por el odelo Deduccón de paráetros y coportaento S ben la utlzacón del odelo consttuto planteado requere la deternacón
Captulo 7. Deduccón de paráetros y coportaento presto por el odelo 287 Capítulo 7: presto por el odelo Deduccón de paráetros y coportaento S ben la utlzacón del odelo consttuto planteado requere la deternacón
1. Sistemas Físicos 1
 1. Sstemas Físcos 1. Sstemas Físcos 1 1.1. Introduccón 1.. Sstemas Mecáncos 3 1.3. Sstemas Eléctrcos 5 1.4. Sstemas Hdráulcos 7 1.5. Sstemas Múltples 11 1 1.1. Introduccón Sstemas lneales y no lneales.
1. Sstemas Físcos 1. Sstemas Físcos 1 1.1. Introduccón 1.. Sstemas Mecáncos 3 1.3. Sstemas Eléctrcos 5 1.4. Sstemas Hdráulcos 7 1.5. Sstemas Múltples 11 1 1.1. Introduccón Sstemas lneales y no lneales.
FASES Y ESTADOS DE LA MATERIA. Estados de la materia CAMBIOS DE FASE Y DIAGRAMAS DE FASE. Fase: CAMBIOS DE FASE FASE Y ESTADOS DE LA MATERIA
 FASES Y ESTADOS DE LA MATERIA CAMBIOS DE FASE Y DIAGRAMAS DE FASE Estados de la materia Bibliografía: Química la Ciencia Central - T.Brown, H.Lemay y B. Bursten. Quimica General - R. Petruci, W.S. Harwood
FASES Y ESTADOS DE LA MATERIA CAMBIOS DE FASE Y DIAGRAMAS DE FASE Estados de la materia Bibliografía: Química la Ciencia Central - T.Brown, H.Lemay y B. Bursten. Quimica General - R. Petruci, W.S. Harwood
Termodinámica I: Calores específicos
 Termodinámica I: Calores específicos I Semestre 2012 CALORES ESPECÍFICOS Se requieren distintas cantidades de energía para elevar un grado la temperatura de masas idénticas de diferentes sustancias. Es
Termodinámica I: Calores específicos I Semestre 2012 CALORES ESPECÍFICOS Se requieren distintas cantidades de energía para elevar un grado la temperatura de masas idénticas de diferentes sustancias. Es
TEMA 3: Dinámica II Capitulo 1. Trabajo y energía
 TMA 3: Dnáca II Captulo. Trabajo y energía Bran Cox sts the world's bggest acuu chaber (BBC Two) https://www.youtube.co/watch?43-cfukgs TMA 3: Dnáca II. Captulo : trabajo y energía Concepto de trabajo.
TMA 3: Dnáca II Captulo. Trabajo y energía Bran Cox sts the world's bggest acuu chaber (BBC Two) https://www.youtube.co/watch?43-cfukgs TMA 3: Dnáca II. Captulo : trabajo y energía Concepto de trabajo.
GASES IDEALES. mg A F A. Presión. Unidades: SI: Pascal (N / m 2 ) cgs: baria (dyna / cm 2 )
 GASES IDEALES Presión P F A mg A δg A δgh Unidades: SI: Pascal (N / m ) cgs: baria (dyna / cm ) Presión atmosférica Barómetro E. Torricelli Presión atmosférica Altura proporcional a la presión atmosférica
GASES IDEALES Presión P F A mg A δg A δgh Unidades: SI: Pascal (N / m ) cgs: baria (dyna / cm ) Presión atmosférica Barómetro E. Torricelli Presión atmosférica Altura proporcional a la presión atmosférica
PRIMER PRINCIPIO DE LA TERMODINÁMICA
 PRIMER PRINCIPIO DE LA ERMODINÁMICA ERMODINÁMICA estuda la transormacón de la energía de un sstema partcular, y como es el ntercambo de energía con el medo que lo rodea (medo ambente o unverso). Medo ambente
PRIMER PRINCIPIO DE LA ERMODINÁMICA ERMODINÁMICA estuda la transormacón de la energía de un sstema partcular, y como es el ntercambo de energía con el medo que lo rodea (medo ambente o unverso). Medo ambente
GUIA DE EJERCICIOS I. Gases Primera Ley de la Termodinámica Equilibrio Térmico (Ley Cero).
 UNIVERSIDAD PEDRO DE VALDIVIA TERMODINAMICA. GUIA DE EJERCICIOS I. Gases Primera Ley de la Termodinámica Equilibrio Térmico (Ley Cero). Gases - Primera ley de la Termodinámica Ley Cero. 1. Se mantiene
UNIVERSIDAD PEDRO DE VALDIVIA TERMODINAMICA. GUIA DE EJERCICIOS I. Gases Primera Ley de la Termodinámica Equilibrio Térmico (Ley Cero). Gases - Primera ley de la Termodinámica Ley Cero. 1. Se mantiene
Diagramas de Heissler para la solución de problemas de conducción transitoria.
 Dagraas de Hessler para la solucón de probleas de conduccón transtora. Cuando el núero de Bot odfcado, descrto en la seccón anteror supera el valor de 0,1, la resstenca nterna ya no es desprecable, de
Dagraas de Hessler para la solucón de probleas de conduccón transtora. Cuando el núero de Bot odfcado, descrto en la seccón anteror supera el valor de 0,1, la resstenca nterna ya no es desprecable, de
Estas operaciones se designan genéricamente como Humidificación y Deshumidificación.
 1 / 16. OPERACIONES DE HUMIFICACION: Son operaciones de contacto directo entre dos fases inmiscibles (gas/líquido), a diferente temperatura, e involucran transferencia de calor y de masa simultáneas a
1 / 16. OPERACIONES DE HUMIFICACION: Son operaciones de contacto directo entre dos fases inmiscibles (gas/líquido), a diferente temperatura, e involucran transferencia de calor y de masa simultáneas a
Es un sistema de dos vectores deslizables de la misma magnitud que están en distintas rectas sostén con la misma dirección pero sentido contrario
 MECANICA TEORÍA Moento Entonces Sistea Par o Cupla de Vectores Es un sistea de dos vectores deslizables de la isa agnitud que están en distintas rectas sostén con la isa dirección pero sentido contrario
MECANICA TEORÍA Moento Entonces Sistea Par o Cupla de Vectores Es un sistea de dos vectores deslizables de la isa agnitud que están en distintas rectas sostén con la isa dirección pero sentido contrario
Calor: energía transferida debida únicamente a diferencias de temperatura
 TERMODINÁMICA La termodinámica estudia la energía y sus transformaciones. Energía: capacidad para realizar trabajo. Formas de energía Energía radiante Energía térmica Energía química Energía potencial
TERMODINÁMICA La termodinámica estudia la energía y sus transformaciones. Energía: capacidad para realizar trabajo. Formas de energía Energía radiante Energía térmica Energía química Energía potencial
FLUIDOS. FLUIDOS: cualquier sustancia que puede fluir, líquidos y gases
 F100.4 Física II Periodo 20081 FLUIDOS Elisabetta Crescio FLUIDOS: cualquier sustancia que puede fluir, líquidos y gases ESTATICA DE FLUIDOS: estudio de fluidos en reposo en situaciones de equilibrio densidad,
F100.4 Física II Periodo 20081 FLUIDOS Elisabetta Crescio FLUIDOS: cualquier sustancia que puede fluir, líquidos y gases ESTATICA DE FLUIDOS: estudio de fluidos en reposo en situaciones de equilibrio densidad,
Clase 4. Agua en la Atmósfera
 Clase 4 Agua en la Atmósfera Preguntas claves 1. Cuanta agua hay en la aire? 2. Cómo se satura el aire? 3. Cómo se forman las gotas del lluvia? Condiciones en la atmósfera terrestre permiten la existencia
Clase 4 Agua en la Atmósfera Preguntas claves 1. Cuanta agua hay en la aire? 2. Cómo se satura el aire? 3. Cómo se forman las gotas del lluvia? Condiciones en la atmósfera terrestre permiten la existencia
Diagrama de Fases Temperatura de Ebullición-Composición de una Mezcla
 Diagrama de Fases Temperatura de Ebullición-Composición de una Mezcla Líquida Binaria. Fundamentos teóricos. 1.- Equilibrios líquido-vapor en sistemas binarios: Disoluciones ideales. 2.- Diagramas de fase
Diagrama de Fases Temperatura de Ebullición-Composición de una Mezcla Líquida Binaria. Fundamentos teóricos. 1.- Equilibrios líquido-vapor en sistemas binarios: Disoluciones ideales. 2.- Diagramas de fase
INGENIERÍA QUÍMICA Problemas propuestos Pág. 1 BALANCES DE ENERGÍA
 Problemas propuestos Pág. 1 BALANCES DE ENERGÍA Problema nº 31) [04-03] Considérese una turbina de vapor que funciona con vapor de agua que incide sobre la misma con una velocidad de 60 m/s, a una presión
Problemas propuestos Pág. 1 BALANCES DE ENERGÍA Problema nº 31) [04-03] Considérese una turbina de vapor que funciona con vapor de agua que incide sobre la misma con una velocidad de 60 m/s, a una presión
CÁLCULO VECTORIAL 1.- MAGNITUDES ESCALARES Y VECTORIALES. 2.- VECTORES. pág. 1
 CÁLCL ECTRIAL 1. Magntudes escalares y vectorales.. ectores. Componentes vectorales. ectores untaros. Componentes escalares. Módulo de un vector. Cosenos drectores. 3. peracones con vectores. 3.1. Suma.
CÁLCL ECTRIAL 1. Magntudes escalares y vectorales.. ectores. Componentes vectorales. ectores untaros. Componentes escalares. Módulo de un vector. Cosenos drectores. 3. peracones con vectores. 3.1. Suma.
SUELOS IDENTIFICACIÓN SENCILLA IDENTIFICACION SENCILLA IDENTIFICACION SENCILLA
 SUELOS IDENTIFICACIÓN SENCILLA El límite entre ambas fracciones está dado por la posibilidad de la distinción de sus partículas a simple vista. 0,075 mm = 75 m TAMIZ Nº 200 MATERIALES DE LA FRACCIÓN GRUESA
SUELOS IDENTIFICACIÓN SENCILLA El límite entre ambas fracciones está dado por la posibilidad de la distinción de sus partículas a simple vista. 0,075 mm = 75 m TAMIZ Nº 200 MATERIALES DE LA FRACCIÓN GRUESA
Tema 2. Propiedades termodinámicas de mezclas líquidas
 Generaldades Modelos de solucones líqudas deales Modelos de solucones líqudas NO deales UNIVERSIDAD CENTRAL Tema 2. Propedades termodnámcas de mezclas líqudas Termodnámca del Equlbro Escuela de Ingenería
Generaldades Modelos de solucones líqudas deales Modelos de solucones líqudas NO deales UNIVERSIDAD CENTRAL Tema 2. Propedades termodnámcas de mezclas líqudas Termodnámca del Equlbro Escuela de Ingenería
Unidad I. 1. 1. Definición de reacción de combustión. 1. 2. Clasificación de combustibles
 2 Undad I.. Defncón de reaccón de combustón La reaccón de combustón se basa en la reaccón químca exotérmca de una sustanca (o una mezcla de ellas) denomnada combustble, con el oxígeno. Como consecuenca
2 Undad I.. Defncón de reaccón de combustón La reaccón de combustón se basa en la reaccón químca exotérmca de una sustanca (o una mezcla de ellas) denomnada combustble, con el oxígeno. Como consecuenca
Problemas resueltos de termoquímica.
 Problemas resueltos de termoquímica. 12 de noviembre de 2014 1. Variables termodinámicas. 1. Calcula el volumen molar en ml/mol del H 2 O a 1 atm y 100 C si su densidad es ρ = 0,958 gr/cm 3. V m = V/P
Problemas resueltos de termoquímica. 12 de noviembre de 2014 1. Variables termodinámicas. 1. Calcula el volumen molar en ml/mol del H 2 O a 1 atm y 100 C si su densidad es ρ = 0,958 gr/cm 3. V m = V/P
Fugacidad. Mezcla de gases ideales
 Termodnámca del equlbro Fugacdad. Mezcla de gases deales rofesor: Alí Gabrel Lara 1. Fugacdad 1.1. Fugacdad para gases Antes de abarcar el caso de mezclas de gases, debemos conocer como podemos relaconar
Termodnámca del equlbro Fugacdad. Mezcla de gases deales rofesor: Alí Gabrel Lara 1. Fugacdad 1.1. Fugacdad para gases Antes de abarcar el caso de mezclas de gases, debemos conocer como podemos relaconar
Termodinámica de la atmósfera. Ana Lage González http://www.meteogalicia.es
 Termodinámica de la atmósfera. Ana Lage González http://www.meteogalicia.es La composición del aire seco es bastante uniforme y la composición relativa de los gases se mantiene casi cte. hasta unos 90
Termodinámica de la atmósfera. Ana Lage González http://www.meteogalicia.es La composición del aire seco es bastante uniforme y la composición relativa de los gases se mantiene casi cte. hasta unos 90
Cátedra de Ingeniería Rural Escuela Universitaria de Ingeniería Técnica Agrícola de Ciudad Real
 Tema 1. Hidráulica. Generalidades 1. Definición. Propiedades fundamentales de los líquidos 3. Conceptos previos: Peso, Densidad, Peso específico, Presión 4. Compresibilidad de un líquido 5. Tensión superficial
Tema 1. Hidráulica. Generalidades 1. Definición. Propiedades fundamentales de los líquidos 3. Conceptos previos: Peso, Densidad, Peso específico, Presión 4. Compresibilidad de un líquido 5. Tensión superficial
Neumática e Hidráulica
 Neumática e Hidráulica N. T0.- Introducción a la Neumática Las trasparencias son el material de apoyo del profesor para impartir la clase. No son apuntes de la asignatura. l alumno le pueden servir como
Neumática e Hidráulica N. T0.- Introducción a la Neumática Las trasparencias son el material de apoyo del profesor para impartir la clase. No son apuntes de la asignatura. l alumno le pueden servir como
Física I. TRABAJO y ENERGÍA MECÁNICA. Apuntes complementarios al libro de texto. Autor : Dr. Jorge O. Ratto
 ísca I Apuntes complementaros al lbro de teto TRABAJO y ENERGÍA MECÁNICA Autor : Dr. Jorge O. Ratto Estudaremos el trabajo mecánco de la sguente manera : undmensonal constante Tpo de movmento varable bdmensonal
ísca I Apuntes complementaros al lbro de teto TRABAJO y ENERGÍA MECÁNICA Autor : Dr. Jorge O. Ratto Estudaremos el trabajo mecánco de la sguente manera : undmensonal constante Tpo de movmento varable bdmensonal
Lección: Equilibrio Material
 Leccón: Equlbro Materal TEMA: Introduccón 1 Adolfo Bastda Pascual Unversdad de Murca. España. I. Equlbro materal............................2 I.A. Condcón general de equlbro materal...2 II. Equlbro de
Leccón: Equlbro Materal TEMA: Introduccón 1 Adolfo Bastda Pascual Unversdad de Murca. España. I. Equlbro materal............................2 I.A. Condcón general de equlbro materal...2 II. Equlbro de
PRÁCTICA 18 DIAGRAMA DE MISCIBILIDAD DEL SISTEMA AGUA-FENOL
 PRÁCTICA 18 DIAGRAMA DE MISCIBILIDAD DEL SISTEMA AGUA-FENOL OBJETIVOS Comprensión cualitativa del equilibrio líquido-líquido en un sistema binario con miscibilidad parcial. Observación de la separación
PRÁCTICA 18 DIAGRAMA DE MISCIBILIDAD DEL SISTEMA AGUA-FENOL OBJETIVOS Comprensión cualitativa del equilibrio líquido-líquido en un sistema binario con miscibilidad parcial. Observación de la separación
Tema 9: Calor, Trabajo, y Primer Principio
 1/34 Tema 9: Calor, Trabajo, y Primer Principio Fátima Masot Conde Ing. Industrial 2007/08 Tema 9: Calor, Trabajo, Primer Principio 2/34 Índice: 1. Introducción. 2. Capacidad calorífica. Calor específico.
1/34 Tema 9: Calor, Trabajo, y Primer Principio Fátima Masot Conde Ing. Industrial 2007/08 Tema 9: Calor, Trabajo, Primer Principio 2/34 Índice: 1. Introducción. 2. Capacidad calorífica. Calor específico.
FÍSICA. Dr. Roberto Pedro Duarte Zamorano 2017 Departamento de Física Universidad de Sonora
 FÍSICA Dr. Roberto Pedro Duarte Zaorano 07 Departaento de Físca Unersdad de Sonora TEMARIO. Mecánca.. Leyes de Newton.. Leyes de Conseracón. [9Ago-07Sep] a) Ley de Conseracón de la Energía. b) Ley de Conseracón
FÍSICA Dr. Roberto Pedro Duarte Zaorano 07 Departaento de Físca Unersdad de Sonora TEMARIO. Mecánca.. Leyes de Newton.. Leyes de Conseracón. [9Ago-07Sep] a) Ley de Conseracón de la Energía. b) Ley de Conseracón
Energía interna: ec. energética de estado. Energía interna de un gas ideal. Experimento de Joule. Primer principio de la Termodinámica
 CONTENIDO Calor: capacidad calorífica y calor específico Transiciones de fase: diagramas de fase Temperatura y presión de saturación Energía interna: ec. energética de estado. Energía interna de un gas
CONTENIDO Calor: capacidad calorífica y calor específico Transiciones de fase: diagramas de fase Temperatura y presión de saturación Energía interna: ec. energética de estado. Energía interna de un gas
Dpto. INGENIERÍA ENERGÉTICA Y FLUIDOMECÁNICA ESCUELA DE INGENIERÍAS INDUSTRIALES UNIVERSIDAD DE VALLADOLID
 AIRE HÚMEDO Y PROCESOS PSICROMÉRICOS Introduccón. Crcterístcs del re úedo. Dgrs pscroétrcos. Análss de los procesos pscroétrcos báscos del re úedo ASIGNAURA: ERMODINÁMICA ÉCNICA RANSMISIÓN DE CALOR GRADO:
AIRE HÚMEDO Y PROCESOS PSICROMÉRICOS Introduccón. Crcterístcs del re úedo. Dgrs pscroétrcos. Análss de los procesos pscroétrcos báscos del re úedo ASIGNAURA: ERMODINÁMICA ÉCNICA RANSMISIÓN DE CALOR GRADO:
Apéndice A. Principio de Mínima Acción y Energía Mecánica total.
 Apéndce A Prncpo de Mína Accón y Energía Mecánca total. E l prncpo de ína accón es equvalente a decr que la tayectora que sgue una partícula en el espaco de conguracón es aquella para la cual la dferenca
Apéndce A Prncpo de Mína Accón y Energía Mecánca total. E l prncpo de ína accón es equvalente a decr que la tayectora que sgue una partícula en el espaco de conguracón es aquella para la cual la dferenca
λ fus + λ vap = λ sub
 Cambios De Fase Ecuacion De Clasius V : diferencia de volumen entre ambas fases. λ = T(s f s i ) se denomina calor latente o entalpia de transición. Se considera normalmente como constante. Además se cumple
Cambios De Fase Ecuacion De Clasius V : diferencia de volumen entre ambas fases. λ = T(s f s i ) se denomina calor latente o entalpia de transición. Se considera normalmente como constante. Además se cumple
EJERCICIOS RESUELTOS GASES
 EJERCICIOS RESUELTOS GASES - Una cantidad de gas ocupa un vouen de 80 c a una presión de 750 g Qué vouen ocupará a una presión de, si a teperatura no cabia? Coo a teperatura y a asa peranecen constantes
EJERCICIOS RESUELTOS GASES - Una cantidad de gas ocupa un vouen de 80 c a una presión de 750 g Qué vouen ocupará a una presión de, si a teperatura no cabia? Coo a teperatura y a asa peranecen constantes
Cantidad de movimiento de una partícula: pi = mi vi Cantidad de movimiento del sistema: i i i. dt dt dt dt. Conjunto de partículas: 1 m 1
 DFARN -- FFI DINÁMICA DE LOS SISTEMAS A CANTIDAD DE MOVIMIENTO Para una partícula: Cantdad de ovento de una partícula: p v Cantdad de ovento del sstea: p p v d( v F + F Para el sstea (suando para todas
DFARN -- FFI DINÁMICA DE LOS SISTEMAS A CANTIDAD DE MOVIMIENTO Para una partícula: Cantdad de ovento de una partícula: p v Cantdad de ovento del sstea: p p v d( v F + F Para el sstea (suando para todas
UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGÍA I.P.N. ANTOLOGÍA DE LA ASIGNATURA TERMODINÁMICA ELABORADO POR
 UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGÍA I.P.N. ANTOLOGÍA DE LA ASIGNATURA TERMODINÁMICA ELABORADO POR M. EN C. MARÍA GUADALUPE ORDORICA MORALES 2006 M. en C. María Guadalupe Ordorica Morales
UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGÍA I.P.N. ANTOLOGÍA DE LA ASIGNATURA TERMODINÁMICA ELABORADO POR M. EN C. MARÍA GUADALUPE ORDORICA MORALES 2006 M. en C. María Guadalupe Ordorica Morales
PRÁCTICA 6 Diagrama de fases: Temperatura de ebullición Composición de una mezcla líquida binaria
 aboratorio de Química Física 1 Curso 2011-2012 Grado en Química PRÁCTICA 6 Diagrama de fases: Temperatura de ebullición Composición de una mezcla líquida binaria Material Productos 2 viales Metanol 2 matraces
aboratorio de Química Física 1 Curso 2011-2012 Grado en Química PRÁCTICA 6 Diagrama de fases: Temperatura de ebullición Composición de una mezcla líquida binaria Material Productos 2 viales Metanol 2 matraces
Termodinámica y Ondas
 Termodinámica y Ondas Prueba #1 Prof. Andrés Gomberoff Segundo semestre 2015 Ayudante: Constanza Farías 1. Para cierto sistema gaseoso se ha determinado que, para presiones suficientemente grandes (mayores
Termodinámica y Ondas Prueba #1 Prof. Andrés Gomberoff Segundo semestre 2015 Ayudante: Constanza Farías 1. Para cierto sistema gaseoso se ha determinado que, para presiones suficientemente grandes (mayores
Física I Apuntes de Clase 2, Turno D Prof. Pedro Mendoza Zélis
 Físca I Apuntes de Clase 2, 2018 Turno D Prof. Pedro Mendoza Zéls Isaac Newton 1643-1727 y y 1 y 2 j O Desplazamento Magntudes cnemátcas: v m r Velocdad meda r r 1 r 2 r velocdad s x1 2 r1 x1 + r2 x2 +
Físca I Apuntes de Clase 2, 2018 Turno D Prof. Pedro Mendoza Zéls Isaac Newton 1643-1727 y y 1 y 2 j O Desplazamento Magntudes cnemátcas: v m r Velocdad meda r r 1 r 2 r velocdad s x1 2 r1 x1 + r2 x2 +
www.fisicaeingenieria.es
 2.- PRIMER PRINCIPIO DE LA TERMODINÁMICA. 2.1.- Experencas de Joule. Las experencas de Joule, conssteron en colocar una determnada cantdad de agua en un calorímetro y realzar un trabajo, medante paletas
2.- PRIMER PRINCIPIO DE LA TERMODINÁMICA. 2.1.- Experencas de Joule. Las experencas de Joule, conssteron en colocar una determnada cantdad de agua en un calorímetro y realzar un trabajo, medante paletas
Tema 3: Adaptadores de Señal
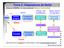 Tema 3: Adaptadores de Señal Sstema GENERAL de nstrumentacón (bloques( funconales): Señal sensor Fltrado, A/D Amplfcacón Rado, nternet bus de datos Medo Sensor prmaro Transductor de entrada Adaptacón de
Tema 3: Adaptadores de Señal Sstema GENERAL de nstrumentacón (bloques( funconales): Señal sensor Fltrado, A/D Amplfcacón Rado, nternet bus de datos Medo Sensor prmaro Transductor de entrada Adaptacón de
CAPÍTULO 5º. Resumen de teoría: Regla de las fases: ϕ Número de fases. r Número de reacciones químicas. Ejercicios y problemas de Termodinámica I
 CAPÍULO 5º Ejercicios y problemas de ermodinámica I ransiciones de fase. Regla de las fases. Resumen de teoría: Regla de las fases: ϕ + l = c r ρ + ϕ Número de fases. r Número de reacciones químicas. l
CAPÍULO 5º Ejercicios y problemas de ermodinámica I ransiciones de fase. Regla de las fases. Resumen de teoría: Regla de las fases: ϕ + l = c r ρ + ϕ Número de fases. r Número de reacciones químicas. l
TEMA 12.-TERMODINÁMICA QUÍMICA.
 EMA.-ERMODINÁMICA QUÍMICA. ema.- ermodinámica Química. Introducción.. Definiciones básicas. 3. rabajo y calor. 4. Primer principio de la termodinámica. 5. Calor específico y capacidad calorífica. 6. Medida
EMA.-ERMODINÁMICA QUÍMICA. ema.- ermodinámica Química. Introducción.. Definiciones básicas. 3. rabajo y calor. 4. Primer principio de la termodinámica. 5. Calor específico y capacidad calorífica. 6. Medida
Tema V: Trabajo, Potencia y Energía
 I.E. Juan Raón Jénez Tea V: Trabajo, Potenca y Energía La energía e una propedad que etá relaconada con lo cabo o proceo de tranforacón en la naturaleza. Sn energía nngún proceo fíco, quíco o bológco ería
I.E. Juan Raón Jénez Tea V: Trabajo, Potenca y Energía La energía e una propedad que etá relaconada con lo cabo o proceo de tranforacón en la naturaleza. Sn energía nngún proceo fíco, quíco o bológco ería
ENERGÍA INTERNA PARA GASES NO IDEALES.
 DEPARTAMENTO DE FISICA UNIERSIDAD DE SANTIAGO DE CHILE ENERGÍA INTERNA PARA GASES NO IDEALES. En el caso de los gases ideales o cualquier cuerpo en fase no gaseosa la energía interna es función de la temperatura
DEPARTAMENTO DE FISICA UNIERSIDAD DE SANTIAGO DE CHILE ENERGÍA INTERNA PARA GASES NO IDEALES. En el caso de los gases ideales o cualquier cuerpo en fase no gaseosa la energía interna es función de la temperatura
Tema 6: Equilibrio químico.
 Tema 6: Equilibrio químico. Equilibrio en las recciones químicas. Constante de equilibrio. Propiedades de las constantes de equilibrio. Constantes de equilibrio K c y K p. Equilibrio en mezclas heterogéneas.
Tema 6: Equilibrio químico. Equilibrio en las recciones químicas. Constante de equilibrio. Propiedades de las constantes de equilibrio. Constantes de equilibrio K c y K p. Equilibrio en mezclas heterogéneas.
22. COLUMNA DE DESTILACION SIMPLIFICADA
 22. COLUMNA DE DESTILACION SIMPLIFICADA 1. OBJETIVOS 1.1. Especfcar en fora splfcada una coluna de destlacón 1.2. Estar un taaño y desepeño splfcado de una coluna de destlacón edante el procedento de Fenske-Underwood-Glland
22. COLUMNA DE DESTILACION SIMPLIFICADA 1. OBJETIVOS 1.1. Especfcar en fora splfcada una coluna de destlacón 1.2. Estar un taaño y desepeño splfcado de una coluna de destlacón edante el procedento de Fenske-Underwood-Glland
El término teoría cinética hace referencia al modelo microscópico para un gas ideal Suposiciones: 1.- En los gases las moléculas son numerosas y la
 CAP 21 SERWAY El término teoría cinética hace referencia al modelo microscópico para un gas ideal Suposiciones: 1.- En los gases las moléculas son numerosas y la separación promedio entre ellas es grande
CAP 21 SERWAY El término teoría cinética hace referencia al modelo microscópico para un gas ideal Suposiciones: 1.- En los gases las moléculas son numerosas y la separación promedio entre ellas es grande
TEMA VI: Cálculo de recipientes de pared delgada
 TEMA VI: Cálculo de recipientes de pared delgada 1. Introducción. Envolventes de pequeño espesor Podemos definir una envolvente como aquel sólido elástico en el que una de sus dimensiones es mucha menor
TEMA VI: Cálculo de recipientes de pared delgada 1. Introducción. Envolventes de pequeño espesor Podemos definir una envolvente como aquel sólido elástico en el que una de sus dimensiones es mucha menor
CAMBIO DE FASE : VAPORIZACIÓN
 CAMBIO DE FASE : VAPORIZACIÓN Un líquido no tiene que ser calentado a su punto de ebullición antes de que pueda convertirse en un gas. El agua, por ejemplo, se evapora de un envase abierto en la temperatura
CAMBIO DE FASE : VAPORIZACIÓN Un líquido no tiene que ser calentado a su punto de ebullición antes de que pueda convertirse en un gas. El agua, por ejemplo, se evapora de un envase abierto en la temperatura
INTRODUCCIÓN A LA TERMODINÁMICA. Vicente Iranzo
 INTRODUCCIÓN A LA TERMODINÁMICA Vicente Iranzo 1 de septiembre de 2011 Índice general 1. Postulados básicos 4 1.1. Carácter macroscópico de la Termodinámica..................... 5 1.2. Conceptos y definiciones
INTRODUCCIÓN A LA TERMODINÁMICA Vicente Iranzo 1 de septiembre de 2011 Índice general 1. Postulados básicos 4 1.1. Carácter macroscópico de la Termodinámica..................... 5 1.2. Conceptos y definiciones
Tema 3-Sistemas de partículas
 Tema 3-Sstemas de partículas Momento lneal y colsones Momento lneal de un partícula Segunda ley de Newton dp F dt p mv Impulso I tb ta Fdt Teorema del mpulso I p B p A Centro de masas 1 r M m r con M m
Tema 3-Sstemas de partículas Momento lneal y colsones Momento lneal de un partícula Segunda ley de Newton dp F dt p mv Impulso I tb ta Fdt Teorema del mpulso I p B p A Centro de masas 1 r M m r con M m
TERMODINÁMICA MICA MICA
 TERMODINÁMICA MICA TERMODINÁMICA MICA - Estudia las relaciones entre las propiedades macroscópicas de un sistema - Estudia el calor, el trabajo, la energía y los cambios que ellos producen en los estados
TERMODINÁMICA MICA TERMODINÁMICA MICA - Estudia las relaciones entre las propiedades macroscópicas de un sistema - Estudia el calor, el trabajo, la energía y los cambios que ellos producen en los estados
Electricidad y calor
 Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
Gráficos de flujo de señal
 UNIVRSIDAD AUTÓNOMA D NUVO ÓN FACUTAD D INGNIRÍA MCANICA Y ÉCTRICA Gráfcos de flujo de señal l dagrama de bloques es útl para la representacón gráfca de sstemas de control dnámco y se utlza extensamente
UNIVRSIDAD AUTÓNOMA D NUVO ÓN FACUTAD D INGNIRÍA MCANICA Y ÉCTRICA Gráfcos de flujo de señal l dagrama de bloques es útl para la representacón gráfca de sstemas de control dnámco y se utlza extensamente
Electricidad y calor. Un repaso... Temas. 4. Primera ley de la Termodinámica. Webpage: Algunas definiciones
 Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
LEY DE BOYLE: A temperatura constante, el volumen (V) que ocupa una masa definida de gas es inversamente proporcional a la presión aplicada (P).
 CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS N 3 TEMA: GASES IDEALES OBJETIVO: Interpretación de las propiedades de los gases; efectos de la presión y la temperatura sobre los volúmenes de los gases. PRERREQUISITOS:
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS N 3 TEMA: GASES IDEALES OBJETIVO: Interpretación de las propiedades de los gases; efectos de la presión y la temperatura sobre los volúmenes de los gases. PRERREQUISITOS:
Tema 3 - LA SUSTANCIA PURA
 ema 3 - LA SUSANCIA PURA ÍNDICE 1. EL POSULADO DE ESADO...3.2 1.1 PROPIEDADES INDEPENDIENES Y DEPENDIENES...3.2 1.2 EL POSULADO DE ESADO...3.2 1.3 LA REGLA DE LAS FASES DE GIBBS...3.3 2. ECUACIONES DE
ema 3 - LA SUSANCIA PURA ÍNDICE 1. EL POSULADO DE ESADO...3.2 1.1 PROPIEDADES INDEPENDIENES Y DEPENDIENES...3.2 1.2 EL POSULADO DE ESADO...3.2 1.3 LA REGLA DE LAS FASES DE GIBBS...3.3 2. ECUACIONES DE
Propiedades básicas de suelos
 Proiedades básicas de suelos 2.1 Materiales y fases 1. Fase sólida Partículas de minerales 2. Fase líquida Agua adsorbida o libre Otro tio de líquido 3. Fase gaseosa Aire Gases Proiedades ara la identificación
Proiedades básicas de suelos 2.1 Materiales y fases 1. Fase sólida Partículas de minerales 2. Fase líquida Agua adsorbida o libre Otro tio de líquido 3. Fase gaseosa Aire Gases Proiedades ara la identificación
UNIDAD III. ESTADO LIQUIDO.
 REPUBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD EXPERIMENTAL SUR DEL LAGO Jesús María Semprúm PROGRAMA DE INGENIERÌA DE ALIMENTOS UNIDAD CURRICULAR: QUIMICA GENERAL UNIDAD III. ESTADO LIQUIDO. Prof. David
REPUBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD EXPERIMENTAL SUR DEL LAGO Jesús María Semprúm PROGRAMA DE INGENIERÌA DE ALIMENTOS UNIDAD CURRICULAR: QUIMICA GENERAL UNIDAD III. ESTADO LIQUIDO. Prof. David
PONTIFICIA UNIVERSIDAD CATOLICA DE CHILE FACULTAD DE FISICA FISICA I FIS101M. Sección 03. José Mejía López. jmejia@puc.cl
 PONTIFICIA UNIVERSIDAD CATOLICA DE CHILE FACULTAD DE FISICA FISICA I FIS11M Seccón 3 José Mejía López jmeja@puc.cl http://www.s.puc.cl/~jmeja/docenca/s11m.html JML s11m-1 Capítulo Dnámca Trabajo y energía
PONTIFICIA UNIVERSIDAD CATOLICA DE CHILE FACULTAD DE FISICA FISICA I FIS11M Seccón 3 José Mejía López jmeja@puc.cl http://www.s.puc.cl/~jmeja/docenca/s11m.html JML s11m-1 Capítulo Dnámca Trabajo y energía
Profesor: Joaquín Zueco Jordán Área de Máquinas y Motores Térmicos
 Comportamiento p-v-t en gases Profesor: Joaquín Zueco Jordán Área de Máquinas y Motores Térmicos _ P T v R Ecuación de estado en gases ideales _ lim P v J P 0 = R=8,3143 _ T mol k P v = R _ T PV = nrt
Comportamiento p-v-t en gases Profesor: Joaquín Zueco Jordán Área de Máquinas y Motores Térmicos _ P T v R Ecuación de estado en gases ideales _ lim P v J P 0 = R=8,3143 _ T mol k P v = R _ T PV = nrt
CAPITULO 13. CALOR Y LA PRIMERA LEY DE LA TERMODINAMICA.
 CAPITULO 13. CALOR Y LA PRIMERA LEY DE LA TERMODINAMICA. La termodinámica es la rama de la física que estudia los procesos donde hay transferencia de energía en forma de calor y de trabajo. Cuando dos
CAPITULO 13. CALOR Y LA PRIMERA LEY DE LA TERMODINAMICA. La termodinámica es la rama de la física que estudia los procesos donde hay transferencia de energía en forma de calor y de trabajo. Cuando dos
LECCIONES DEL CURSO DE MODELACIÓN MATEMÁTICA Y COMPUTACIONAL
 LECCIONES DEL CURSO DE MODELACIÓN MATEMÁTICA Y COMPUTACIONAL POSGRADOS DE CIENCIAS DE LA TIERRA Y DE CIENCIA E INGENIERÍA DE LA COMPUTACIÓN UNAM AUTOR: ISMAEL HERRERA REVILLA 1 Basado en el Lbro Mathematcal
LECCIONES DEL CURSO DE MODELACIÓN MATEMÁTICA Y COMPUTACIONAL POSGRADOS DE CIENCIAS DE LA TIERRA Y DE CIENCIA E INGENIERÍA DE LA COMPUTACIÓN UNAM AUTOR: ISMAEL HERRERA REVILLA 1 Basado en el Lbro Mathematcal
Videal. V m. = ZxVideal EJERCICIOS RESUELTOS:
 EJERCICIOS RESUELOS: Datos:. U taque rígdo cotee dos klool de gas trógeo y 6 klool de CO a 00ºK y 5 Mpa. Calcule el volue del taque basádose e: a. Ecuacó de gas deal b. Regla de Kay c. Factores de copresbldad
EJERCICIOS RESUELOS: Datos:. U taque rígdo cotee dos klool de gas trógeo y 6 klool de CO a 00ºK y 5 Mpa. Calcule el volue del taque basádose e: a. Ecuacó de gas deal b. Regla de Kay c. Factores de copresbldad
Aplicación de la termodinámica a las reacciones químicas Andrés Cedillo Departamento de Química Universidad Autónoma Metropolitana-Iztapalapa
 Aplcacón de la termodnámca a las reaccones químcas Andrés Cedllo Departamento de Químca Unversdad Autónoma Metropoltana-Iztapalapa Introduccón Las leyes de la termodnámca, así como todas las ecuacones
Aplcacón de la termodnámca a las reaccones químcas Andrés Cedllo Departamento de Químca Unversdad Autónoma Metropoltana-Iztapalapa Introduccón Las leyes de la termodnámca, así como todas las ecuacones
GASES 09/06/2011. La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: La atmósfera
 La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: GASES Nitrógeno 78% Oxígeno 21% Otros gases 1% La atmósfera también almacena otros gases Vapor
La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: GASES Nitrógeno 78% Oxígeno 21% Otros gases 1% La atmósfera también almacena otros gases Vapor
Ayudantía 6 - Soluciones 2da Ley de la Termodinámica y Condiciones de Equilibrio
 Ponticia Universidad Católica de Chile Facultad de Física Termodinámica y Teoría Cinética: Fiz 02 Ayudantía 6 - Soluciones 2da Ley de la Termodinámica y Condiciones de Equilibrio Profesor: Miguel Kiwi
Ponticia Universidad Católica de Chile Facultad de Física Termodinámica y Teoría Cinética: Fiz 02 Ayudantía 6 - Soluciones 2da Ley de la Termodinámica y Condiciones de Equilibrio Profesor: Miguel Kiwi
INTENSIDAD SONORA TEMA 3: MOVIMIENTO ONDULATORIO. http://www.rtve.es/noticias/20100328/niveles-decibelios-db-nuestro-entorno/322078.
 http://www.rtve.es/noticias/20100328/niveles-decibelios-db-nuestro-entorno/322078.shtml INTENSIDAD SONORA http://adaar-planetario.8m.com/acustica.htm VIDEO: http://www.youtube.com/watch?v=rd6_zrvwk7u&feature=player_embedded
http://www.rtve.es/noticias/20100328/niveles-decibelios-db-nuestro-entorno/322078.shtml INTENSIDAD SONORA http://adaar-planetario.8m.com/acustica.htm VIDEO: http://www.youtube.com/watch?v=rd6_zrvwk7u&feature=player_embedded
1.- Todo planeta que gira alrededor del Sol describiendo una órbita elíptica, en la cual el Sol ocupa una de los focos. Sol
 Leyes de Kepler 1.- Todo planeta que gira alrededor del Sol describiendo una órbita elíptica, en la cual el Sol ocupa una de los focos. Planeta Sol 2.- El radio focal que une a un planeta con el Sol describe
Leyes de Kepler 1.- Todo planeta que gira alrededor del Sol describiendo una órbita elíptica, en la cual el Sol ocupa una de los focos. Planeta Sol 2.- El radio focal que une a un planeta con el Sol describe
Balances de Materia y Energía en PFRs
 Balances de Matera y Energía en Ps En este tpo de reactores, el balance de atera se epresa coo: V r Y recordando el balance de energía: U D( π ( r Ĥ uando al cobnacón dáetro de tubo-longtud de tubo lo
Balances de Matera y Energía en Ps En este tpo de reactores, el balance de atera se epresa coo: V r Y recordando el balance de energía: U D( π ( r Ĥ uando al cobnacón dáetro de tubo-longtud de tubo lo
Tema 8. Termodinámica
 Física I. Curso 2010/11 Departamento de Física Aplicada. ETSII de Béjar. Universidad de Salamanca Profs. Alejandro Medina Domínguez y Jesús Ovejero Sánchez Tema 8. Termodinámica Índice 1. Conceptos básicos
Física I. Curso 2010/11 Departamento de Física Aplicada. ETSII de Béjar. Universidad de Salamanca Profs. Alejandro Medina Domínguez y Jesús Ovejero Sánchez Tema 8. Termodinámica Índice 1. Conceptos básicos
Tema I: Introducción a los sistemas de instrumentación
 ESCUELA TECNICA SUPERIOR DE INGENIEROS INDUSTRIALES Y DE TELECOMUNICACION UNIVERSIDAD DE CANTABRIA INSTRUMENTACION ELECTRÓNICA DE COMUNICACIONES (5º Curso Ingenería de Telecouncacón) Tea I: Introduccón
ESCUELA TECNICA SUPERIOR DE INGENIEROS INDUSTRIALES Y DE TELECOMUNICACION UNIVERSIDAD DE CANTABRIA INSTRUMENTACION ELECTRÓNICA DE COMUNICACIONES (5º Curso Ingenería de Telecouncacón) Tea I: Introduccón
CRITERIOS DE ESPONTANEIDAD
 CRITERIOS DE ESPONTANEIDAD Con ayuda de la Primera Ley de la Termodinámica podemos considerar el equilibrio de la energía y con La Segunda Ley podemos decidir que procesos pueden ocurrir de manera espontanea,
CRITERIOS DE ESPONTANEIDAD Con ayuda de la Primera Ley de la Termodinámica podemos considerar el equilibrio de la energía y con La Segunda Ley podemos decidir que procesos pueden ocurrir de manera espontanea,
