INFORME PER A LA COMISIÓ DE FARMÀCIA I TERAPÈUTICA ICO i LA SUB-COMISSIÓ DE CÀNCER DE l ICS
|
|
|
- Ángela Vázquez Contreras
- hace 6 años
- Vistas:
Transcripción
1 CAPECITABINA en combinación con GEMCITABINA (GEMCAP) EN ADENOCARCINOMA DE PÁNCREAS LOCALIZADO como tratamiento adyuvante (FFT) (Informe per a la Comissió de Farmàcia i Terapèutica del ICO i la subcomissió de cáncer de ) Data 28/11/2016 Informe complementario de un fármaco ya evaluado en la Comisión Farmacoterapéutica del ICO con fecha 13/10/2010 en combinación con oxaliplatino para carcinoma de colon estadio III. Se han realizado informes complementarios previamente a la comisión del 28/11/2016, evaluando: Capecitabina-oxaliplatino (CAPOX) Indicación fuera de ficha técnica (FFT): Tratamiento adyuvante en pacientes con cáncer gástrico tras gastrectomía D2. Informe para la Comisión de Farmacia y Terapéutica de Capecitabina-Cisplatino vs Capecitabina-Cisplatino-Radioterapia Indicación fuera de ficha técnica (FFT): Tratamiento adyuvante en pacientes con cáncer gástrico tras gastrectomía D2. EOX (epirubicina, oxaliplatino, capecitabina) en Carcinoma Gástrico Metastásico. Capecitabina Indicación fuera de ficha técnica (FFT): en 2ª línea en pacientes adultos con cáncer pancreático metastásico. Se solicita por primera vez capecitabina en combinación con gemcitabina (esquema GEMCAP) en el tratamiento adyuvante de pacientes adultos con adenocarcinoma de páncreas resecado. 1.- IDENTIFICACIÓ DEL FÀRMAC I AUTORS DE L INFORME Fàrmac: Capecitabina Declaració conflicte d interessos dels autors: No se declaran conflicto de intereses. 2.- SOL LICITUD i DADES DEL PROCÉS D AVALUACIÓ: Indicació clínica sol licitada: Se solicita el uso de capecitabina en combinación con gemcitabina para el tratamiento de pacientes adultos con adenocarcinoma de páncreas resecado con cirugía R0, en los cuales no esté indicado un tratamiento de radioterapia. Justificació de la sol licitud: Se solicita en base a los datos del estudio de Fase III ESPAC-4, que ha sido presentado en el Congreso Anual de la ASCO Data de recepció de la sol licitud: 23/06/ ÀREA DESCRIPTIVA DEL MEDICAMENTO Y DEL PROBLEMA DE SALUD 3.1. Area descriptiva del medicamento 2 Nom genèric: Capecitabina 1
2 Nom comercial: Xeloda Laboratori: Roche Registration Ltd Grup terapèutic: Denominació: Antimetabolitos análogos de las pirimidinas Codi ATC: L01BC06 Via d administració: oral Tipus de dispensació: Medicamento de Diagnóstico Hospitalario. Facturable al CatSalut. Vía de registro: Centralizada. Presentaciones y precios CN PVL (financiado)+ IVA Precio por unidad Xeloda 500 mg comprimidos C/120unidades 115,2 0,96 recubiertos con película Xeloda 150 mg comprimidos C/ 60 unidades ,4 0,29 recubiertos con película Precios consultados en el Nomenclator del CatSalut (Actualización Noviembre 2016) Àrea descriptiva del problema de salut 3.2.a.- Descripció estructurada del problema de salut. El cáncer de páncreas sigue siendo una de las principales causa de muerte por cáncer en el mundo, con una tasa de supervivencia a los 5 años de menos del 5% 3. Dado su mal pronóstico, la incidencia de este tumor es casi superponible a su tasa de mortalidad 4. En los primeros estadios de la enfermedad aparecen pocos signos o síntomas, por lo que el 90% de los pacientes se diagnostican en fases avanzadas o metastásicas. Sólo una pequeña proporción de pacientes (10%-20%) se consideraron resecables en el momento del diagnóstico pero casi el 80% recaen dentro de los 2 años siguientes de la resección quirúrgica 4. La tasa de superviviencia a los 5 años en los pacientes resecados sigue siendo del 20% a pesar de la terapia adyuvante. Además, un análisis molecular demostró que el cáncer de páncreas es altamente heterogéneo y cada tumor alberga múltiples anomalías genéticas 4. Se describen tres tipos de cáncer de páncreas, el adenocarcinoma ductal infiltrante, el carcinoma de células acinar y el pancreatoblastoma (principalmente en niños). El adenocarcinoma es el que presentan la mayoría de los pacientes (95%) b.- Tratamiento actual de la enfermedad: evidéncia. La resección quirúrgica es el único tratamiento potencialmente curativo del adenocarcinoma de páncreas. Sin embargo, en el momento del diagnóstico, <20% de los pacientes presenta un tumor resecable. El objetivo principal de la cirugía es lograr márgenes de resección negativos (R0). Después de la evaluación radiológica, sólo los pacientes con una alta probabilidad de resección R0 son buenos candidatos para la cirugía inicial 5. El tratamiento co-adyuvante para pacientes con cáncer de páncreas tras resección quirúrgica incluye quimioterapia y quimiorradioterapia. Sin embargo, la supervivencia media permanece aproximadamente en 20 meses a pesar del tratamiento con quimioterapia sistémica basada en gemcitabina o fluoropirimidinas 4. La quimioterapia adyuvante postoperatoria se evaluó en varios ensayos aleatorios. En el estudio ESPAC-1 (ensayo multicéntrico y aleatorizado, con un diseño factorial de 2 2, 289 pacientes con resección completa fueron aleatorizados a recibir una de las cuatro modalidades terapéuticas: quimioterapia adyuvante (bolus 5-fluorouracilo (5-FU) y ácido folínico), sólo quimiorradiación (40 Gy más 5-FU), o quimiorradiación seguido por quimioterapia u observación. Los pacientes que recibieron 2
3 quimioterapia tuvieron una supervivencia mediana más larga (20,1 vs. 15,5 meses, p=0,009) en comparación con los pacientes que no recibieron quimioterapia. Los resultados del ensayo CONKO- 001 que comparaba gemcitabina frente a la observación, confirmó el beneficio de la quimioterapia adyuvante. La gemcitabina administrada durante 24 semanas mejoró la supervivencia libre de progresión (13,4 frente a 6,9 meses, p<0,001) y la supervivencia global (SG) (22,8 frente a 20,2 meses, P=0,005). El ensayo ESPAC-3 comparó la administración de dos quimioterapias adyuvantes (5-fluorouracilo y ácido folínico vs. gemcitabina) durante 6 ciclos de tratamiento. No hubo diferencias estadísticamente significativas en cuanto a la SG, ni en calidad de vida 5. Según la Guía ESMO de cáncer de páncreas, tanto el 5-FU/ácido folínico como la gemcitabina en monoterapia son considerados el estándar de tratamiento adyuvante tras cirugía (nivel de evidencia I- A) 5. En cuanto a la quimiorradiación adyuvante, el ensayo ESPAC-1 demostró un efecto deletéreo de la quimiorradiación adyuvante en cuanto a la supervivencia libre de recurrencia de 10,7 meses en el brazo de quimiorradiación frente a 15,2 meses en el brazo que recibió cirugía sólo (p=0,04). En los pacientes con resección R1, no se observó beneficio con la quimiorradiación adyuvante. Según la Guía ESMO de cáncer de páncreas, no recomiendan la quimiorradiación después de cirugía, excepto en ensayos clínicos (nivel de evidencia I-E) 5. Actualmente están en marcha varios ensayos clínicos aleatorizados en adyuvancia, que evalúan combinaciones citotóxicas activas para la enfermedad avanzada incluyendo FOLFIRINOX, gemcitabina en combinación con nab-paclitaxel y gemcitabina en combinación con capecitabina 4. La inmunoterapia con vacunas basadas en células genéticamente modificadas está desarrollándose en varios estudios en pacientes con cáncer de páncreas resecado 4. En la siguiente figura se muestra el algoritmo de diagnóstico y tratamiento según la Guía de práctica clínica ESMO de cáncer de páncreas: 3
4 4.- ÀREA D ACCIÓ FARMACOLÒGICA. 4.1 Mecanismo de acción 6. La capecitabina es un carbamato de fluorpirimidina no citotóxica con actividad antineoplásica. Es un profármaco oral de 5'-deoxi-5-fluorouridina (5'-DFUR) que, gracias a la acción de la enzima timidina fosforilasa (ThyPasa) es transformado en el citotóxico 5-fluorouracilo (5-FU). Esta enzima se encuentra, habitualmente en mayores concentraciones, los tejidos tumorales que los tejidos normales o plasma. Las células normales y las tumorales metabolizan tanto el 5-FU como los precursores 5-fluoro-2'- deoxiuridina monofosfato (FdUMP) y 5-fluorouridina trifosfato (FUTP). Estos metabolitos producen daño celular por dos mecanismos. Primero bloquean la reacción de metilación del ácido deoxiuridílic hacia el ácido timidílic, interfiriendo así con la síntesis del ácido desoxirribonucleico (ADN). En segundo lugar, enzimas nucleares transcripcional pueden incorporar erróneamente FUTP en lugar de uridin trifosfato (UTP) durante la síntesis del ARN. Este error interfiere en la formación del ARN y la síntesis proteica. Estas dos acciones provocan un déficit de timidina que da lugar a un crecimiento desequilibrado de las células y en la apoptosis. Los efectos de la privación del ADN y el ARN son mayores en aquellas células con una proliferación más rápida y que metabolizan el 5-FU con mayor velocidad. 4.2 Indicacions clíniques formalment aprovades i data d aprovació (indicació avaluada). EMEA (02/02/2001)/AEMPS 2 (22/02/2001): Tratamiento adyuvante tras cirugía en pacientes con cáncer de colon estadio III (estadio C de Dukes) Cáncer colorrectal metastásico. Tratamiento en primera línea del cáncer gástrico avanzado en combinación con un régimen que incluya platino. En combinación con docetaxel para el tratamiento de pacientes con cáncer de mama localmente avanzado o metastásico tras fallo de quimioterapia citotóxica. La terapia previa debe haber incluido una antraciclina. En monoterapia para el tratamiento de pacientes con cáncer de mama localmente avanzado o metastásico tras fallo a taxanos y a un régimen quimioterápico que incluya una antraciclina o bien para aquellos pacientes en los que no esté indicada una terapia posterior con antraciclinas. La indicación en combinación con gemcitabina como tratamiento adyuvante tras cirugía para cáncer de páncreas no está aprobada. FDA 7 (30/04/1998): Tratamiento adyuvante en cáncer de colon (pacientes con cáncer de colon estadio C de Dukes). Cáncer colorrectal metastásico: - En primera línea como monoterapia cuando se prefiere el tratamiento con fluoropirimidina sola. Cáncer de mama metastásico: - En combinación con docetaxel tras fallo de terapia previa con antraciclinas. - En monoterapia en pacientes resistentes tanto al paclitaxel como a la terapia con antraciclinas. El tratamiento del cáncer gástrico avanzado no está contemplado en la FDA. 4
5 4.3 Posología, forma de preparación i administración 2,6. La posología recomendada en monoterapia para el tratamiento de cáncer de colon, cáncer colorrectal metastásico o cáncer de mama localmente avanzado o metastásico es de mg/m 2 administrados dos veces al día (por la mañana y por la noche; equivalente a una dosis diaria total de mg/m 2 ) durante 14 días, seguidos de un periodo de descanso de 7 días. Como esta indicación no se encuentra aprobada en la EMA, la posología recomendada por el solicitante y por el ensayo clínico fase III es (el esquema de combinación de gemcitabina y capecitabina utilizado en este estudio proviene de los datos de fase I publicados por Schilsky et al.): Capecitabina 830 mg/m 2 /12h o 1660 mg/m 2 /24h durante 21 días en ciclos de 28 días, en combinación con gemcitabina 1000mg/m 2 los días 1,8 y 15 del ciclo, durante 6 ciclos. Duración del tratamiento: 6 meses (24 semanas). 4.5 Características comparadas con otras alternativas medicamentosas en la misma indicación, disponibles en el Hospital/mercado. Presentaciones Posología Vía de administración Indicación Efectos adversos (EA) destacables Otras características Capecitabina-Gemcitabina Capecitabina comp 150 o 500 mg Gemcitabina vial 1 g Capecitabina vo 850 mg/m 2 /12h días del 1 al 21 c/28 días Gemcitabina iv 1000 mg/m2 días 1, 8 y 15 c/28 días Capecitabina vía oral Gemcitabina vía intravenosa Indicación de la combinación no aprobada por agencias reguladoras Elevada tasa de Síndrome eritrodisestesia palmoplantar grado 1 y 2, fatiga/astenia, Diarrea, Vómitos, Nauseas, Estomatitis, Dolor abdominal+ EA gemcitabina Gemcitabina se administra en hospital de día Gemcitabina Vial 1 g 1000 mg/m2 iv días 1, 8 y 15 c/28 días Vía intravenosa -Adenocarcinoma localmente avanzado o metastásico del páncreas -Cáncer de vejiga localmente avanzado o metastático -En combinación con cisplatino, en CPNM avanzado o metastásico -En combinación con carboplatino, en carcinoma epitelial de ovario localmente avanzado o metastático con enfermedad recurrente -En combinación con paclitaxel, en cáncer de mama metastático o localmente avanzado, no resecable, siempre que estos pacientes hayan recurrido tras un tratamiento quimioterapéutico previo adyuvante o neoadyuvante Náuseas, con o sin vómitos, elevaciones en las transaminasas hepáticas (AST/ALT) y fosfatasa alcalina, notificadas en 60 % de los pacientes; proteinuria y hematuria notificadas en 50 %; erupción cutánea de tipo alérgico en 25 %, que está asociada a prurito en un 10% Se administra en hospital de día 5.- AVALUACIÓ DE l EFICÀCIA 5.1 Ensayos clínicos disponibles para indicación solicitada A fecha 09/11/2016, se realizó una búsqueda bibliográfica en Medline (Pubmed), con las palabras claves capecitabine AND gemcitabine AND adjuvant chemotherapy AND páncreas en clinical queries, 5
6 obteniéndose 11 resultados. Todos fueron revisiones de la patología y ensayos clínicos en la enfermedad localmente avanzada o metastásica. Los resultados del análisis primario del estudio fase III que evalúa la eficacia y seguridad del esquema GEMCAP no están publicados (se espera que se publiquen en Junio de 2017). Se dispone del estudio fase III del Grupo Europeo para el Estudio de Cáncer de Páncreas (ESPAC-4) presentado en el Congreso Anual ASCO 2016: Estudio ESPAC-4 (ISRCTN ) 8-9 : John P. Neoptolemos, Dan Palmer, Paula Ghaneh, et al. ESPAC-4: A multicenter, international, open-label randomized controlled phase III trial of adjuvant combination chemotherapy of gemcitabine (GEM) and capecitabine (CAP) versus monotherapy gemcitabine in patients with resected pancreatic ductal adenocarcinoma Estudio ESPAC-4, Fase III: J. Neoptolemos, D. Palmer, P. Ghaneh, et al. ESPAC-4: A multicenter, international, open-label randomized controlled phase III trial of adjuvant combination chemotherapy of gemcitabine (GEM) and capecitabine (CAP) versus monotherapy gemcitabine in patients with resected pancreatic ductal adenocarcinoma. Diseño: Estudio fase III, abierto, multicéntrico, aleatorizado (1:1). Nº pacientes: 730. Se incluyeron pacientes desde 10 de Noviembre del 2008 hasta 11 de Septiembre del Análisis de los resultados con los datos de corte de Marzo del Estratificación: La aleatorización se estratificó según el margen de resección (R0 vs R1) y el país. Tratamientos: -Brazo experimental: Capecitabina 830 mg/m 2 /12 h (desayuno y cena, dosis total al día 1660 mg/m 2 ) días 1-21 c/28 días + Gemcitabina 1000 mg/m 2 días 1,8 y 15 c/28 días, hasta un máximo de 6 ciclos de tratamiento (N=364) -Brazo control: Gemcitabina 1000 mg/m 2 días 1,8 y 15 c/28 días, hasta un máximo de 6 ciclos de tratamiento (24 semanas). (N=366) El esquema de combinación de gemcitabina y capecitabina utilizado en este estudio proviene de los datos de fase I publicados por Schilsky et al. Criterios de inclusión: -Adultos ( 18 años) que han sido sometidos a una resección macroscópica completa para el adenocarcinoma ductal de páncreas resecado (resección R0 o R1) -Confirmación histológica del diagnóstico primario -Examen histológico de todos los márgenes de resección -No evidencia de ascitis maligna, metástasis hepáticas, diseminación a otros órganos abdominales lejanos, metástasis peritoneal, diseminación a órganos extra-abdominales -PS 2 -Esperanza de vida > 3 meses -Sin historia previa de malignidad (excepto el carcinoma basocelular tratado y el carcinoma in situ del cérvix) Criterios de exclusión: -Quimioterapia neoadyuvante u otra quimioterapia concomitante -Linfoma pancreático -Tumor macroscópicamente remanente (resección R2) -Pacientes con enfermedad en estadio IVb -New York Heart Association Classification Grado III o IV -Quimioterapia previa -Malabsorción conocida Variables principal: Supervivencia global (SG), con un seguimiento de 60 meses tras la cirugía. Variables secundarias: Toxicidad (seguimiento 60 meses tras la cirugía), supervivencia libre de recaída (seguimiento 60 meses tras la cirugía), tasa de supervivencia a los 2 y 5 años y calidad de vida (evaluada por la Organización Europea de Investigación y Tratamiento del Cáncer, el cuestionario de Calidad de Vida EORTC QLQ-C30 al inicio del estudio, a los 3, 6, 12, 16 y 24 meses y anualmente hasta 60 meses). Cálculo del tamaño muestral: Se consideró que se requerían al menos 480 eventos (722 pacientes, 361 en cada brazo) para que el análisis tuviera una potencia del 90% para detectar una diferencia del 10% en la tasa de supervivencia a los 2 años (test log-rank bilateral con α al 5%). Tipo análisis: Análisis por intención de tratar (ITT). Variable principal Parámetros de eficacia Gemcitabina+Capecitabina (N=364) Gemcitabina (N=366) Mediana SG (meses) (IC95%) 28,0 (23,5-31,5) 25,5 (22,7-27,9) HR (Tratamiento vs control) (IC95%); 0,82 (0,68-0,98); p=0,032 p 6
7 Variables secundarias Tasa de supervivencia a los 2 años, % (IC95%) Tasa de supervivencia a los 5 años, % (IC95%) p ,8% (22,9-35,2) 16,3% (10,2-23,7) p=0,032 Análisis de subgrupos de SG según márgenes de resección, extraído de la presentación en el Congreso ASCO: Evaluación de la validez interna y externa/utilidad práctica de los resultados En cuanto al diseño del estudio, se trata de un estudio fase III, abierto y aleatorizado (1:1) a recibir capecitabina más gemcitabina o gemcitabina en monoterapia. Estratificación realizada según la localización geográfica y el margen de resección (R0 vs R1). Se trata de un análisis por intención de tratar. La principal limitación del estudio es que se trata de un ensayo abierto. Esta limitación puede justificarse por la aparición esperada del síndrome mano-pie (común con el tratamiento con capecitabina) en el brazo de capecitabina+gemcitabina versus gemcitabina. Sin embargo, ya que la variable principal fue la SG (variable final), no parece que esta limitación vaya a influir de forma relevante en los resultados. El ensayo ESPAC-4 utiliza un comparador adecuado, ya que la terapia con gemcitabina se considera el estándar de tratamiento actualmente según la bibliografía en este perfil de pacientes. Como variables secundarias se evaluaron la supervivencia libre de recaída, tasa de supervivencia a los 2 y 5 años y la calidad de vida. 7
8 En cuanto a las características basales de la población, la mediana de edad fue de 65 años (rango 37-81), 57% hombres. El ECOG PS fue 0, 1 ó 2 en el 42%, 55% y 3%, respectivamente. La mediana postoperatoria del CA19-9 fue de 18,7 ku/l (rango 0,1-8,112). El tamaño máximo promedio del tumor fue de 30 mm (rango 0-110), con la mayoría de los pacientes con un tumor pobre (39%) o moderadamente (50%) diferenciado. De la población total, el 60% fueron resecciones R1 y el 40% resecciones R0. La mayoría de pacientes (80%) presentaban ganglios metastásicos positivos. La mediana de seguimiento (n=272) fue de 43,2 meses (IC95% 39,7-45,5). Hubo 187 pacientes (69%) con un seguimiento de al menos 24 meses. Actualmente los resultados del estudio ESPAC-4 no están publicados, y no disponemos del análisis de las variables secundarias, incluyendo el análisis de calidad de vida. La gemcitabina como tratamiento adyuvante es el estándar de tratamiento para el adenocarcinoma ductal pancreático resecado, con una supervivencia global similar y menor toxicidad en comparación con el 5-fluorouracilo/ácido folínico, como se muestra en el ensayo ESPAC El estudio ESPAC-4 de capecitabina/gemcitabina demuestra un aumento de supervivencia de 2,5 meses frente a la monoterapia con gemcitabina [HR 0,82 (0,68-0,98); p=0,032]. Los pacientes con margen de resección R0 que fueron aleatorizados al brazo de gemcitabina y capecitabina obtuvieron mayor beneficio en SG comparado con el brazo de gemcitabina en monoterapia (39,5 vs. 27,9 meses, respectivamente; HR 0,677 [IC95% 32,0-58,0]). En los pacientes con margen de resección R1 no hubo diferencias estadísticamente significativas en SG (23,7 vs. 23,0 meses, respectivamente; HR 0,901 [IC95% 0,717-1,13]). 5.2 Resultados de ensayos clínicos de otras alternativas terapéuticas. Estudio ESPAC-3 10 (Fase III, aleatorizado, abierto) N=1088 pacientes con Adenocarcinoma pancreático ductal Análisis ITT Fármaco Ácido folínico 20mg/m FU 425 mg/m 2 días 1-5 c/28 días (N=551) vs Gemcitabina 1000 mg/m 2 a la semana (durante 3 semanas) c/28 días (N=537) Duración del tratamiento 6 meses El 14% del brazo de 5-FU (97 eventos) presentaron algún evento adverso serio comparado con el 7,5% del brazo de gemcitabina (52 eventos) (p<0,001) Variable principal SG SG 23,0 vs 23,6 meses HR 0,94 (IC95% 0,81-1,08); p=0,39 SLP 14,1 vs 14,3 meses HR, 0,96 (IC95% 0,84-1,10); p=0,53 ORR - CONKO (Fase III, aleatorizado, abierto, multicéntrico) N=368 pacientes Gemcitabina días 1, 8, y 15 c/4 semanas (n=179) (hasta 6 ciclos) vs observación SLP 22,1 vs 20,2 meses p=0,06 13,4 vs 6,9 meses p<0,001-8
9 con resección R0 (>80% pacientes) o R1 Análisis ITT (n=175) Mediana de ciclos=6 (0-6) No hubo diferencias significativas de SLP en los subgrupos según resección (R0 vs R1) ; p<0,001 9
10 5.4 Evaluación de fuentes secundarias Guías de Práctica Clínica: -NCCN Clinical Practice Guidelines in Oncology: versión Pancreatic Adenocarcinoma 12 : Como quimioterapia adyuvante sóla recomiendan gemcitabina (categoría 1 de evidencia), 5-FU (+ ácido folínico; categoría 1) o infusión continua de 5-FU, o capecitabina (categoría 2A). La guía incluye en el apartado de terapia adyuvante los resultados de SG presentados en el Congreso ASCO 2016 del estudio ESPAC-4, aunque concluyen (incluyendo el análisis del estudio CONKO-005, estudio fase III que compara gemcitabina en monoterapia frente a la combinación de gemcitabina con erlotinib como terapia adyuvante) que las combinaciones no producen una mejora estadísticamente significativa en la SG y SLP, comparado con gemcitabina en monoterapia. En la siguiente figura se muestra el algoritmo de tratamiento propuesto: - Guías ESMO 5 : Recomiendan como terapia estándar para el tratamiento de la enfermedad localizada, 5-FU (combinado con ácido folínico) o gemcitabina tras la resección quirúrgica (adyuvancia). La Guía ESMO para el diagnóstico, tratamiento y seguimiento de adenocarcinoma de páncreas (2015) no refleja el uso de capecitabina en combinación con gemcitabina. En la siguiente figura se muestra la estrategia de tratamiento que recomiendan: 10
11 5.4.2 Evaluaciones previas por organismos independientes (NICE/SMC): Actualmente no hay publicadas recomendaciones en las guías NICE ni evaluaciones sobre la combinación de capecitabina con gemcitabina como tratamiento adyuvante en el adenocarcinoma de páncreas localizado. 6. EVALUACIÓN DE LA SEGURIDAD 6.1 Descripción de los efectos adversos más significativos (por la frecuencia o gravedad) 2,6 El perfil de seguridad global de capecitabina se basa en los datos de más de 3000 pacientes tratados con capecitabina en monoterapia o con capecitabina en combinación con diferentes regímenes de quimioterapia en múltiples indicaciones. Los perfiles de seguridad de capecitabina en monoterapia son comparables en las poblaciones con cáncer de mama metastásico, cáncer colorrectal metastásico y cáncer de colon adyuvante. Las reacciones adversas relacionadas con el tratamiento (RAMs) más frecuentemente notificadas y/o clínicamente relevantes fueron: alteraciones gastrointestinales (especialmente diarrea, náuseas, vómitos, dolor abdominal, estomatitis), síndrome mano-pie (eritrodisestesia palmo-plantar), fatiga, astenia, anorexia, cardiotoxicidad, aumento de la insuficiencia renal en aquellos pacientes con una función renal previa comprometida y trombosis/embolismo. 11
12 6.2. Seguridad: Ensayos clínicos comparativos. No disponemos de los resultados publicados del análisis de seguridad del estudio ESPAC-4. Según el abstract presentado en el Congreso ASCO 2016, 196 de 366 pacientes que recibieron gemcitabina en monoterapia informaron de 481 eventos adversos de grado 3/4, mientras que 226 de 359 en el brazo de capecitabina+gemcitabina informaron de 608 eventos adversos de grado 3/4 (p=0,242). Los eventos adversos de grado 3/4, (diarrea, neutropenia y síndrome mano-pie) fueron significativamente más frecuentes en el brazo de gemcitabina más capecitabina en comparación con el brazo de monoterapia de gemcitabina. Las infecciones e infestaciones fueron significativamente más frecuentes en el brazo de gemcitabina en monoterapia en comparación con el brazo de la terapia de combinación. Según un análisis exploratorio en términos de eventos adversos serios, no hubo diferencias significativas entre los dos grupos de tratamiento (p>0,05). En la siguiente figura se muestran los eventos adversos grado 3/4 extraída del abstract publicado en el Congreso ASCO 2016: 6.3 Precauciones de uso en situaciones especiales 2,6. Precauciones: Durante el embarazo y la lactancia. En pacientes con leucopenia, neutropenia o trombocitopenia graves. En pacientes con insuficiencia hepática grave. En pacientes con insuficiencia renal grave (aclaramiento de creatinina por debajo de 30 ml/min). 12
13 Tratamiento con sorivudina o sus análogos químicamente relacionados, tal como la brivudina. Poblaciones especiales: - Insuficiencia hepática: No hay datos suficientes de seguridad y eficacia en pacientes con insuficiencia hepática. Se aconseja monitorizar estrechamente estos pacientes. - Insuficiencia renal: Contraindicada en pacientes con IR grave (ClCr < 30mL / min). En IR moderada no es necesario reducir la dosis. - Embarazo: Estudios en animales han demostrado mortalidad embrionaria y teratogenia. El uso de capecitabina está contraindicado durante el embarazo. - Lactancia: Se desconoce si capecitabina se elimina por la leche materna, pero en base a los resultados de los estudios en animales se recomienda suspender la lactancia durante el tratamiento. - Ancianos: Se aconseja una monitorización estrecha en pacientes> 60anys en tratamiento con capecitabina, ya que se ha observado una mayor incidencia de reacciones adversas grado 3/4 en este grupo de población. Contraindicaciones: Hipersensibilidad a capecitabina, sus metabolitos (incluido fluorouracilo) o algún excipiente (excipientes de declaración obligatoria: lactosa, croscarmelosa sódica). En pacientes con ausencia completa probada de actividad de dihidropirimidina dehidrogenasa (DPD). Interacciones: Se ha observado alteración de los parámetros de coagulación y/o sangrado en pacientes con tratamiento concomitante con capecitabina y anticoagulantes orales derivados de la cumarina. En estos pacientes hay que monitorizar estrictamente los parámetros de la coagulación. El tratamiento con capecitabina puede aumentar las concentraciones plasmáticas de fenitoina. La toxicidad de capecitabina puede verse aumentada si se administra junto con ácido folínico. La administración concomitante con alopurinol puede disminuir la eficacia de la capecitabina. 7. ÀREA ECONÒMICA 7.1-Coste tratamiento Cálculo del coste del tratamiento con el precio financiado: Se debe considerar que actualmente capecitabina en combinación con gemcitabina no está aprobada en la indicación solicitada. Nombre del fármaco Capecitabina + Gemcitabina Gemcitabina Precio unitario (PVL-RD+IVA)* Gemcitabina 42 vial 1g Capecitabina 500mg 115,2 c/120 comprimidos Capecitabina 150mg 17,4 c/60 comprimidos vial 1g
14 Posología Capecitabina vo 1660 mg/día repartido en dos veces del día 1 al 21 c/28 días (3cáps/12h) Gemcitabina iv 1000 mg/m2 (1700mg) días 1, 8 y 15 c/28 días 1000 mg/m2 iv días 1, 8 y 15 c/28 días Coste del tratamiento por ciclo Coste tratamiento completo ** Coste incremental (diferencial) respecto a la terapia de referencia +726 Referencia * Coste calculado por paciente de 70 kg y SC 1,7m2, con precio disponible en Nomenclator. ** El precio del tratamiento completo se calcula teniendo en cuenta la mediana de ciclos recibidos en los ensayos clínicos disponibles. Para ambos tratamientos se ha considerado una mediana de 6 ciclos de tratamiento (según resultados de los estudios ESPAC-4/ESPAC-3 y CONKO-001). 7.2-Coste eficacia incremental (CEI) Se realiza el coste eficacia incremental en base a los resultados del estudio ESPAC-4. Variable evaluada SG (Estudio ESPAC-4) Eficacia GEMCAP Eficacia Gemcitabi na 28,0 meses 25,5 meses Diferenci a de eficacia 2,5 meses (0,2083 años) Costes calculados según precio financiado reflejado en el Nomenclator. Coste incremental vs gemcitabina CEI por paciente y mes de vida ganado CEI por paciente y año de vida ganado ,4 /mes 3.484,8 /año Según los datos del estudio ESPAC-4, el coste del tratamiento por cada año de vida ganado es de 3.484, Estudios farmacoeconómicos No hay datos disponibles de la combinación. 8.- BIBLIOGRAFÍA. 1. Web Grupo de Evaluación de Novedades, Estandarización e Investigación en Selección de Medicamentos (GENESIS) de la Sociedad Española de Farmacia Hospitalaria (SEFH). Programa MADRE Ficha técnica de capecitabina. Base de datos de medicamentos de la Agencia Europea del Medicamento [base de datos en Internet]. Agencia Europea del Medicamento. Disponible en: _Product_Information/human/000316/WC pdf [Acceso: Noviembre 2016]. 3. Owain Peris Jones, James Daniel Melling, Paula Ghaneh. Adjuvant therapy in pancreatic cancer. World J Gastroenterol 2014 October 28; 20(40): Tolutope Oyasiji, Wen Wee Ma. Novel adjuvant therapies for pancreatic adenocarcinoma. J Gastrointest Oncol 2015; 6(4): M. Ducreux, A. Sa. Cuhna et al. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 26 (Supplement 5): v56 v68,
15 6. Capecitabina 2ª línea en càncer pancreàtico metastàtic (FFT). Informe per a la Comissió de Farmàcia i terapèutica de l'institut Català d'oncologia. Disponible en: [Acceso: Noviembre 2016] 7. Ficha técnica de xeloda FDA. Disponible en: [Acceso: Noviembre 2016] 8. John P. Neoptolemos, Dan Palmer, Paula Ghaneh, et al. ESPAC-4: A multicenter, international, open-label randomized controlled phase III trial of adjuvant combination chemotherapy of gemcitabine (GEM) and capecitabine (CAP) versus monotherapy gemcitabine in patients with resected pancreatic ductal adenocarcinoma. J Clin Oncol 34, 2016 (suppl; abstr LBA4006). 9. A trial comparing gemcitabine alone with gemcitabine and capecitabine together after surgery to remove cancer of the pancreas. ISRCTN registry. Disponible en: [Acceso: Noviembre 2016] 10. Neoptolemos JP, Stocken DD, Bassi C et al. Adjuvant chemotherapy with fluorouracil plus folinic acid vs gemcitabine following pancreatic cancer resection: a randomized controlled trial. JAMA 2010; 304: Oettle H, Post S, Neuhaus P et al. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer: a randomized controlled trial. JAMA 2007; 297: NCCN Guideline Versión Pancreatic Adenocarcinoma. Disponible en: [Acceso: Noviembre 2016]. 15
El Inmunomomento en Melanoma: Nivolumab más respuestas y larga supervivencia? Alfonso Berrocal
 El Inmunomomento en Melanoma: Nivolumab más respuestas y larga supervivencia? Alfonso Berrocal Proporción vivos Supervivencia con Ipilumumab en acceso expandido 1.0 0.9 0.8 Mediana de supervivencia meses
El Inmunomomento en Melanoma: Nivolumab más respuestas y larga supervivencia? Alfonso Berrocal Proporción vivos Supervivencia con Ipilumumab en acceso expandido 1.0 0.9 0.8 Mediana de supervivencia meses
Hospital Universitario Dr. Peset Valencia, 20 de octubre de 2011.
 EFICIENCIA DE BEVACIZUMAB IRINOTECÁN FLUOROURACILO VERSUS IRINOTECÁN FLUOROURACILO EN PRIMERA LÍNEA DE CARCINOMA COLORRECTAL METASTÁSICO Ruiz Millo O. 1, Sendra García A. 1, Albert Marí A. 1, González
EFICIENCIA DE BEVACIZUMAB IRINOTECÁN FLUOROURACILO VERSUS IRINOTECÁN FLUOROURACILO EN PRIMERA LÍNEA DE CARCINOMA COLORRECTAL METASTÁSICO Ruiz Millo O. 1, Sendra García A. 1, Albert Marí A. 1, González
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
Impacto de los nuevos tratamientos. Nuria Muñoz Muñoz Hospital Universitario Virgen Macarena
 Impacto de los nuevos tratamientos Nuria Muñoz Muñoz Hospital Universitario Virgen Macarena Indicaciones. Ipilimumab (Yervoy): EMA: tratamiento del melanoma avanzado (irresecable o metastásico) en adultos
Impacto de los nuevos tratamientos Nuria Muñoz Muñoz Hospital Universitario Virgen Macarena Indicaciones. Ipilimumab (Yervoy): EMA: tratamiento del melanoma avanzado (irresecable o metastásico) en adultos
Uso Clínico-Oncológico- Bioquímico de Marcadores tumorales. Angel Gabriel D Annunzio Médico Oncólogo
 Uso Clínico-Oncológico- Bioquímico de Marcadores tumorales Angel Gabriel D Annunzio Médico Oncólogo Ca 19.9 Baja Especificidad Cancer de Colon Tumores de vía biliar Cáncer de estómago Tumores de la vía
Uso Clínico-Oncológico- Bioquímico de Marcadores tumorales Angel Gabriel D Annunzio Médico Oncólogo Ca 19.9 Baja Especificidad Cancer de Colon Tumores de vía biliar Cáncer de estómago Tumores de la vía
MIELOMA MÚLTIPLE: MP 1/5. 1. DENOMINACIÓN DEL ESQUEMA: MP (Melfalán-Prednisona).
 MIELOMA MÚLTIPLE: MP 1/5 1. DENOMINACIÓN DEL ESQUEMA: MP (Melfalán-Prednisona). 2. USO TERAPÉUTICO (1). Mieloma múltiple. Tratamiento de primera línea cuando no está indicado el trasplante de células progenitoras
MIELOMA MÚLTIPLE: MP 1/5 1. DENOMINACIÓN DEL ESQUEMA: MP (Melfalán-Prednisona). 2. USO TERAPÉUTICO (1). Mieloma múltiple. Tratamiento de primera línea cuando no está indicado el trasplante de células progenitoras
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
Tratamiento del cáncer de cérvix Amalia Gómez Bernal Complejo Asistencial Universitario de Salamanca
 Tratamiento del cáncer de cérvix 2016 Amalia Gómez Bernal Complejo Asistencial Universitario de Salamanca Datos estadísticos INCIDENCIA Es el 3º tumor más frecuente en las mujeres en el mundo y el 7º del
Tratamiento del cáncer de cérvix 2016 Amalia Gómez Bernal Complejo Asistencial Universitario de Salamanca Datos estadísticos INCIDENCIA Es el 3º tumor más frecuente en las mujeres en el mundo y el 7º del
CONTROVERSIAS HIPERTENSION PULMONAR
 CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
CONTROVERSIAS HIPERTENSION PULMONAR Mª Carmen Torreiro Penas Hospital Xeral-Calde Lugo Eficacia/precio de los fármacos f aprobados? Es necesario evaluar los fármacos f aprobados? TRATAMIENTO Importantes
FICHA TÉCNICA. Capecitabina Sandoz 500 mg comprimidos recubiertos con película EFG
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Capecitabina Sandoz 500 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Capecitabina Sandoz 500 mg comprimidos recubiertos:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Capecitabina Sandoz 500 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Capecitabina Sandoz 500 mg comprimidos recubiertos:
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
Bibliográfico AOCC. Cáncer de pulmón no células pequeñas EIIIA. Controversias El rol de la quimioterapia
 Cáncer de pulmón no células pequeñas EIIIA Controversias El rol de la quimioterapia Bibliográfico AOCC Franco Calzolari Especialista en Medicina Interna Residente 3er año Oncología Sanatorio Allende Los
Cáncer de pulmón no células pequeñas EIIIA Controversias El rol de la quimioterapia Bibliográfico AOCC Franco Calzolari Especialista en Medicina Interna Residente 3er año Oncología Sanatorio Allende Los
CASO CLINICO: TRATAMIENTO NEOADYUVANTE EN CANCER MAMA HER-2 + Anabel Ballesteros García Hospital Universitario de La Princesa
 CASO CLINICO: TRATAMIENTO NEOADYUVANTE EN CANCER MAMA HER-2 + Anabel Ballesteros García Hospital Universitario de La Princesa CASO CLINICO 1 Mujer de 35 años ANTECEDENTES PERSONALES: Linfoma de Hodgkin
CASO CLINICO: TRATAMIENTO NEOADYUVANTE EN CANCER MAMA HER-2 + Anabel Ballesteros García Hospital Universitario de La Princesa CASO CLINICO 1 Mujer de 35 años ANTECEDENTES PERSONALES: Linfoma de Hodgkin
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Bevacizumab en Cáncer de Colon
 1 Bevacizumab ONCOLOGÍA en Cáncer de Colon 2013 Bevacizumab en Cáncer de Colon Recomendaciones para su Uso Coordinador: Dr. Esteban Lifschitz Autores: Dr. Patricio Servienti, Dr. Ventura Simonovich Evaluación
1 Bevacizumab ONCOLOGÍA en Cáncer de Colon 2013 Bevacizumab en Cáncer de Colon Recomendaciones para su Uso Coordinador: Dr. Esteban Lifschitz Autores: Dr. Patricio Servienti, Dr. Ventura Simonovich Evaluación
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
Nab-paclitaxel en 1ªlínea cáncer páncreas metastásico INFORME CFT- HOSPITAL REINA SOFÍA CÓRDOBA
 Nab-paclitaxel en 1ªlínea cáncer páncreas metastásico INFORME CFT- HOSPITAL REINA SOFÍA CÓRDOBA 1.- Identificación del fármaco: Nombre Genérico: Nab-paclitaxel Nombre Comercial: Abraxane Presentaciones:
Nab-paclitaxel en 1ªlínea cáncer páncreas metastásico INFORME CFT- HOSPITAL REINA SOFÍA CÓRDOBA 1.- Identificación del fármaco: Nombre Genérico: Nab-paclitaxel Nombre Comercial: Abraxane Presentaciones:
PROSPECTO INFORMACIÓN PARA PROFESIONALES (Adaptado a la Disposición ANMAT N 5904/96)
 PROSPECTO INFORMACIÓN PARA PROFESIONALES (Adaptado a la Disposición ANMAT N 5904/96) Avastin Bevacizumab Roche Concentrado para solución para infusión Industria Suiza Expendio bajo receta archivada Composición
PROSPECTO INFORMACIÓN PARA PROFESIONALES (Adaptado a la Disposición ANMAT N 5904/96) Avastin Bevacizumab Roche Concentrado para solución para infusión Industria Suiza Expendio bajo receta archivada Composición
2. USO TERAPÉUTICO (4) Tratamiento paliativo del cáncer colorrectal metastásico en primera o segunda línea. Medicamento Dosis Días Administración
 1. DENOMINACIÓN DEL ESQUEMA (1,3,4) : IRINOTECAN-LEUCOVORIN- FLUOROURACILO (FOLFIRI) 2. USO TERAPÉUTICO (4) Tratamiento paliativo del cáncer colorrectal metastásico en primera o segunda línea. 3. ESQUEMA
1. DENOMINACIÓN DEL ESQUEMA (1,3,4) : IRINOTECAN-LEUCOVORIN- FLUOROURACILO (FOLFIRI) 2. USO TERAPÉUTICO (4) Tratamiento paliativo del cáncer colorrectal metastásico en primera o segunda línea. 3. ESQUEMA
INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) INSULINAS
 Centro de Información de Medicamentos. Servicio de Farmacia. INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) Datos del solicitante INSULINAS Dr. Pedro José Pines Corrales, FEA del servicio
Centro de Información de Medicamentos. Servicio de Farmacia. INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ( 06/ 10/ 2008) Datos del solicitante INSULINAS Dr. Pedro José Pines Corrales, FEA del servicio
A PROPÓSITO DE UN CASO: ENFERMEDAD OLIGOMETASTÁSICA
 A PROPÓSITO DE UN CASO: ENFERMEDAD OLIGOMETASTÁSICA Virginia Calvo de Juan Oncología Médica Hospital Universitario Puerta de Hierro Madrid, 26 de Abril de 2016 CÁNCER DE PULMÓN NO CÉLULA PEQUEÑA, ENFERMEDAD
A PROPÓSITO DE UN CASO: ENFERMEDAD OLIGOMETASTÁSICA Virginia Calvo de Juan Oncología Médica Hospital Universitario Puerta de Hierro Madrid, 26 de Abril de 2016 CÁNCER DE PULMÓN NO CÉLULA PEQUEÑA, ENFERMEDAD
REUNION BIBLIOGRAFICA CLINICA UNIVERSITARIA REINA FABIOLA
 REUNION BIBLIOGRAFICA CLINICA UNIVERSITARIA REINA FABIOLA INTRODUCCION La respuesta al tratamiento sistémico en el cáncer de mama temprano puede ser controlada si el tratamiento se administra previo a
REUNION BIBLIOGRAFICA CLINICA UNIVERSITARIA REINA FABIOLA INTRODUCCION La respuesta al tratamiento sistémico en el cáncer de mama temprano puede ser controlada si el tratamiento se administra previo a
FICHA TÉCNICA. Capecitabina KERN PHARMA 150 mg Cada comprimido recubierto con película contiene 150 mg de capecitabina.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Capecitabina KERN PHARMA 150 mg comprimidos recubiertos con película EFG Capecitabina KERN PHARMA 500 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Capecitabina KERN PHARMA 150 mg comprimidos recubiertos con película EFG Capecitabina KERN PHARMA 500 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Capecitabina Teva 150 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Capecitabina Teva 150 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Francisco de Asís Aparisi Aparisi. Hospital Virgen de los Lirios, Alcoy
 Estudio fase II de cisplatino (CDDP) y vinorelbina oral (VRLO) concomitante con radioterapia (RT) como tratamiento del cáncer de pulmón no microcítico localmente avanzado(cpnm-la): Resultados del objetivo
Estudio fase II de cisplatino (CDDP) y vinorelbina oral (VRLO) concomitante con radioterapia (RT) como tratamiento del cáncer de pulmón no microcítico localmente avanzado(cpnm-la): Resultados del objetivo
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Capecitabina KERN PHARMA 150 mg EFG EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Capacetabina KERN PHARMA 150 mg Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Capecitabina KERN PHARMA 150 mg EFG EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Capacetabina KERN PHARMA 150 mg Cada
RESULTADOS PRELIMINARES
 ESTUDIO DE LA EFICACIA DE LICOTRIZ COMO CREMA REGENERATIVA Y REGENERADORA EN EL TRATAMIENTO DE CICATRICES POSTQUIRÚRGICAS EN PACIENTES SOMETIDAS A RADIOTERAPIA POR CÁNCERES GINECOLÓGICOS. INTRODUCCIÓN
ESTUDIO DE LA EFICACIA DE LICOTRIZ COMO CREMA REGENERATIVA Y REGENERADORA EN EL TRATAMIENTO DE CICATRICES POSTQUIRÚRGICAS EN PACIENTES SOMETIDAS A RADIOTERAPIA POR CÁNCERES GINECOLÓGICOS. INTRODUCCIÓN
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Tratamiento de la recai da del ca ncer de ovario en pacientes no candidatas a platino
 Tratamiento de la recai da del ca ncer de ovario en pacientes no candidatas a platino Ana Santaballa Bertrán, MD, PhD Servicio Oncologi a Me dica, Hospital Universitario y Polite cnico la Fe, Valencia
Tratamiento de la recai da del ca ncer de ovario en pacientes no candidatas a platino Ana Santaballa Bertrán, MD, PhD Servicio Oncologi a Me dica, Hospital Universitario y Polite cnico la Fe, Valencia
TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL
 TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL Título del reporte: efectividad y seguridad de lapatinib (terapia anti-her2) en cáncer de mama HER2 positivo Autores: grupo desarrollador
TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL Título del reporte: efectividad y seguridad de lapatinib (terapia anti-her2) en cáncer de mama HER2 positivo Autores: grupo desarrollador
TRATAMIENTO NEO-ADYUVANTE CON GEMCITABINA Y CIS-PLATINO EN CÁNCER DE PULMÓN (NO CÉLULAS PEQUEÑAS)
 TRATAMIENTO NEO-ADYUVANTE CON GEMCITABINA Y CIS-PLATINO EN CÁNCER DE PULMÓN (NO CÉLULAS PEQUEÑAS) DR. CARLOS W. MONTESINO A.*, DRA. SARA J. CORONEL V.* RESUMEN: 25 pacientes con diagnóstico de cáncer de
TRATAMIENTO NEO-ADYUVANTE CON GEMCITABINA Y CIS-PLATINO EN CÁNCER DE PULMÓN (NO CÉLULAS PEQUEÑAS) DR. CARLOS W. MONTESINO A.*, DRA. SARA J. CORONEL V.* RESUMEN: 25 pacientes con diagnóstico de cáncer de
Estadíos tumor maligno de cuello uterino
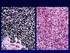
 TUMOR MALIGNO DE CUELLO UTERINO Codificación CIE10 C53 tumor maligno del cuello del útero Problema: El cáncer cervical usualmente es un carcinoma de células escamosas (70% de todos los cánceres cervicales),
TUMOR MALIGNO DE CUELLO UTERINO Codificación CIE10 C53 tumor maligno del cuello del útero Problema: El cáncer cervical usualmente es un carcinoma de células escamosas (70% de todos los cánceres cervicales),
2.1 EFICACIA. Cetuximab en combinación con quimioterapia
 EVALUACIÓN DE MEDICAMENTOS PARA LA ELABORACIÓN DE LA LISTA COMPLEMENTARIA DE MEDICAMENTOS PARA EL TRATAMIENTO DE ENFERMEDADES NEOPLASICAS AL PETITORIO NACIONAL UNICO DE MEDICAMENTOS ESENCIALES I. DATOS
EVALUACIÓN DE MEDICAMENTOS PARA LA ELABORACIÓN DE LA LISTA COMPLEMENTARIA DE MEDICAMENTOS PARA EL TRATAMIENTO DE ENFERMEDADES NEOPLASICAS AL PETITORIO NACIONAL UNICO DE MEDICAMENTOS ESENCIALES I. DATOS
PERTUZUMAB AUMENTA LA SUPERVIVENCIA GLOBAL EN CÁNCER DE MAMA METASTÁSICO HER2 POSITIVO
 Los especialistas españoles coinciden en que es el avance más relevante en una década y que permitirá afrontar una necesidad médica urgente PERTUZUMAB AUMENTA LA SUPERVIVENCIA GLOBAL EN CÁNCER DE MAMA
Los especialistas españoles coinciden en que es el avance más relevante en una década y que permitirá afrontar una necesidad médica urgente PERTUZUMAB AUMENTA LA SUPERVIVENCIA GLOBAL EN CÁNCER DE MAMA
Cáncer de mama avanzado
 Cáncer de mama avanzado Santander 1 de Julio 2016 Tàrsila Ferro Directora de Cuidados Instituto Catalán de Oncología Profesora Universidad de Barcelona Definiciones Cáncer de mama recurrente o recurrencia:
Cáncer de mama avanzado Santander 1 de Julio 2016 Tàrsila Ferro Directora de Cuidados Instituto Catalán de Oncología Profesora Universidad de Barcelona Definiciones Cáncer de mama recurrente o recurrencia:
Coste por unidad PVL con IVA Vial 100 mg/ 50 ml 1 vial 745026 246,69 204,60
 Servei de Farmàcia Informe CFT: 1/6 Cetuximab Tratamiento de cáncer de células escamosas de cabeza y cuello localmente avanzado, en combinación con radioterapia Informe para la Comisión Farmacoterapéutica
Servei de Farmàcia Informe CFT: 1/6 Cetuximab Tratamiento de cáncer de células escamosas de cabeza y cuello localmente avanzado, en combinación con radioterapia Informe para la Comisión Farmacoterapéutica
Avastin se utiliza para el tratamiento de adultos con los siguientes tipos de cáncer en combinación con otros medicamentos contra el cáncer:
 EMA/175824/2015 EMEA/H/C/000582 Resumen del EPAR para el público general bevacizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de
EMA/175824/2015 EMEA/H/C/000582 Resumen del EPAR para el público general bevacizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) de. En él se explica cómo el Comité de
Tumor phyllodes. Erika Fonseca Chimá Residente de obstetricia Universidad de Antioquia. Asesor: Dr. German Garcia
 Tumor phyllodes Erika Fonseca Chimá Residente de obstetricia Universidad de Antioquia Asesor: Dr. German Garcia Carcinoma: mayoría de tumores malignos de mama Sarcomas primarios de mama: tejido mesenquimal
Tumor phyllodes Erika Fonseca Chimá Residente de obstetricia Universidad de Antioquia Asesor: Dr. German Garcia Carcinoma: mayoría de tumores malignos de mama Sarcomas primarios de mama: tejido mesenquimal
abril :30-10:45 Etapificación y seguimiento del cáncer de esófago, rol del PET CT.
 2007-10:30-11:35 SLAGO Miércoles 05 de Abril SALÓN PACÍFICO Inauguración SLAGO MÓDULO CÁNCER ESÓFAGO PRESIDEN : Dr. Guillermo Méndez - Dr. Pablo González 10:30-10:45 Etapificación y seguimiento del cáncer
2007-10:30-11:35 SLAGO Miércoles 05 de Abril SALÓN PACÍFICO Inauguración SLAGO MÓDULO CÁNCER ESÓFAGO PRESIDEN : Dr. Guillermo Méndez - Dr. Pablo González 10:30-10:45 Etapificación y seguimiento del cáncer
Nab-paclitaxel, nuevo estándar de tratamiento en el cáncer de páncreas MERCEDES SALGADO FERNÁNDEZ
 Nab-paclitaxel, nuevo estándar de tratamiento en el cáncer de MERCEDES SALGADO FERNÁNDEZ VISIÓN GENERAL: EVOLUCIÓN DEL TRATAMIENTO EN 1ª LÍNEA DEL CÁNCER DE PÁNCREAS CASO CLÍNICO ESTUDIO MPAC: UN NUEVO
Nab-paclitaxel, nuevo estándar de tratamiento en el cáncer de MERCEDES SALGADO FERNÁNDEZ VISIÓN GENERAL: EVOLUCIÓN DEL TRATAMIENTO EN 1ª LÍNEA DEL CÁNCER DE PÁNCREAS CASO CLÍNICO ESTUDIO MPAC: UN NUEVO
ENSAYOS Cáncer de mama. Investigador Principal: Dr. Manuel Ramos
 CENTRO ONCOLOGICO DE GALICIA ENSAYOS CLINICOS ACTIVOS (en fase de reclutamiento de pacientes) SERVICIO ONCOLOGIA MÉDICA ENSAYOS Cáncer de mama. Investigador Principal: Dr. Manuel Ramos 1. Estudio piloto
CENTRO ONCOLOGICO DE GALICIA ENSAYOS CLINICOS ACTIVOS (en fase de reclutamiento de pacientes) SERVICIO ONCOLOGIA MÉDICA ENSAYOS Cáncer de mama. Investigador Principal: Dr. Manuel Ramos 1. Estudio piloto
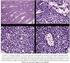
EL EQUIPO MULTIDISCIPLINAR XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO BIOMARCADORES PREDICTIVOS
 XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO ACTUALIZACION EN BIOMARCADORES Y GUIA DE RECOMENDACIONES EN TUMORES DEL APARATO DIGESTIVO # DIAGNOSTICO # APORTACION
XXVI CONGRESO DE LA SEAP/IAP PAPEL DEL PATOLOGO EN LOS TUMORES DEL APARATO DIGESTIVO ACTUALIZACION EN BIOMARCADORES Y GUIA DE RECOMENDACIONES EN TUMORES DEL APARATO DIGESTIVO # DIAGNOSTICO # APORTACION
MEGAPLEX 160mg. Nombre Comercial. Megaplex 160mg. Nombre Genérico. Acetato de Megestrol 160mg. Concentración. 160mg. Denominación Común Internacional
 MEGAPLE 160mg 1. Identificación del Medicamento Nombre Comercial Megaplex 160mg Nombre Genérico Acetato de Megestrol 160mg Concentración 160mg Denominación Común Internacional Acetato de Megestrol N Registro
MEGAPLE 160mg 1. Identificación del Medicamento Nombre Comercial Megaplex 160mg Nombre Genérico Acetato de Megestrol 160mg Concentración 160mg Denominación Común Internacional Acetato de Megestrol N Registro
SIMPOSIO DE MAMA DIAGNÓSTICO Y SUBTIPOS MOLECULARES
 UNIVERSIDAD DE COSTA RICA HOSPITAL SAN JUAN DE DIOS SIMPOSIO DE MAMA DIAGNÓSTICO Y SUBTIPOS MOLECULARES Dra. Jeannina Álvarez Yannarella Residente de Patología INFORMACIÓN CLÍNICA Sexo y edad Antecedentes
UNIVERSIDAD DE COSTA RICA HOSPITAL SAN JUAN DE DIOS SIMPOSIO DE MAMA DIAGNÓSTICO Y SUBTIPOS MOLECULARES Dra. Jeannina Álvarez Yannarella Residente de Patología INFORMACIÓN CLÍNICA Sexo y edad Antecedentes
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
MIELOMA MÚLTIPLE: Tacidex o ThaCyDex 1/6. Mieloma múltiple resistente o refractario al tratamiento estándar. La Sociedad
 MIELOMA MÚLTIPLE: Tacidex o ThaCyDex 1/6 1. DENOMINACIÓN DEL ESQUEMA (1) : TACIDEX o THACYDEX (Talidomida + Ciclofosfamida + Dexametasona). 2. INDICACIÓN. Mieloma múltiple resistente o refractario al tratamiento
MIELOMA MÚLTIPLE: Tacidex o ThaCyDex 1/6 1. DENOMINACIÓN DEL ESQUEMA (1) : TACIDEX o THACYDEX (Talidomida + Ciclofosfamida + Dexametasona). 2. INDICACIÓN. Mieloma múltiple resistente o refractario al tratamiento
9. Profilaxis de la ITU
 9. Profilaxis de la ITU 9.1. Profilaxis antibiótica en población pediátrica sin alteraciones estructurales y/o funcionales del tracto urinario comprobadas En lactantes y población pediátrica sin alteraciones
9. Profilaxis de la ITU 9.1. Profilaxis antibiótica en población pediátrica sin alteraciones estructurales y/o funcionales del tracto urinario comprobadas En lactantes y población pediátrica sin alteraciones
Comissió de Millora de l'adequació de la Pràctica Assistencial i Clínica (MAPAC) Resumen de la evaluación 2011/01
 Comissió de Millora de l'adequació de la Pràctica Assistencial i Clínica (MAPAC) Resumen de la evaluación 2011/01 PREGUNTAS PRESTACIONES EVALUADAS Está recomendado en términos de supervivencia y calidad
Comissió de Millora de l'adequació de la Pràctica Assistencial i Clínica (MAPAC) Resumen de la evaluación 2011/01 PREGUNTAS PRESTACIONES EVALUADAS Está recomendado en términos de supervivencia y calidad
Grupo de estudio internacional del cáncer de mama (IBCSG) 23-01
 Grupo de estudio internacional del cáncer de mama (IBCSG) 23-01 Disección axilar vs. no disección axilar en cáncer de mama con axila clínicamente negativa y micrometástasis en ganglio centinela Viviana
Grupo de estudio internacional del cáncer de mama (IBCSG) 23-01 Disección axilar vs. no disección axilar en cáncer de mama con axila clínicamente negativa y micrometástasis en ganglio centinela Viviana
SARCOMA DE EWING Y TUMOR NEUROECTODERMICO PRIMITIVO.
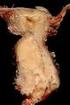
 SARCOMA DE EWING Y TUMOR NEUROECTODERMICO PRIMITIVO. Una vez que el paciente ha sido diagnosticado por biopsia como Tumor Neuroectodermico Primitivo o Sarcoma de Ewing, se realizarán los siguientes estudios:
SARCOMA DE EWING Y TUMOR NEUROECTODERMICO PRIMITIVO. Una vez que el paciente ha sido diagnosticado por biopsia como Tumor Neuroectodermico Primitivo o Sarcoma de Ewing, se realizarán los siguientes estudios:
GESTION INTEGRAL DEL BANCO DROGAS ONCOLOGICAS
 GESTION INTEGRAL DEL BANCO DROGAS ONCOLOGICAS DR MAURICIO LIRUSSI DIRECTOR BANCO DE DROGAS ANTINEOPLASICAS PROVINCIA DE SAN JUAN BANCO DROGAS ANTINEOPLASICOS PROVINCIA DE SAN JUAN 144 PACIENTES TRATADOS
GESTION INTEGRAL DEL BANCO DROGAS ONCOLOGICAS DR MAURICIO LIRUSSI DIRECTOR BANCO DE DROGAS ANTINEOPLASICAS PROVINCIA DE SAN JUAN BANCO DROGAS ANTINEOPLASICOS PROVINCIA DE SAN JUAN 144 PACIENTES TRATADOS
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
Varón de 52 años Agosto 2006: Estudiado en Urología por cólicos renales. Se detectan en ecografía LOES hepáticas.
 Varón de 52 años Agosto 2006: Estudiado en Urología por cólicos renales. Se detectan en ecografía LOES hepáticas. ECO abdominal: Múltiples LOES en ambos lóbulos del hígado Anamnesis dirigida: No flushing
Varón de 52 años Agosto 2006: Estudiado en Urología por cólicos renales. Se detectan en ecografía LOES hepáticas. ECO abdominal: Múltiples LOES en ambos lóbulos del hígado Anamnesis dirigida: No flushing
El comité de cáncer de la Federación Internacional de Ginecología y Obstetricia (FIGO) ha establecido la siguiente guía para el diagnóstico de
 El comité de cáncer de la Federación Internacional de Ginecología y Obstetricia (FIGO) ha establecido la siguiente guía para el diagnóstico de Neoplasia Trofoblastica gestacional pos molar. Cuatro valores
El comité de cáncer de la Federación Internacional de Ginecología y Obstetricia (FIGO) ha establecido la siguiente guía para el diagnóstico de Neoplasia Trofoblastica gestacional pos molar. Cuatro valores
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
Monitorización de niveles de vancomicina en Pediatría
 Monitorización de niveles de vancomicina en Pediatría Chevorn Suzette Adams (R3 Pediatría) María Luz Boquera Ferrer (R4 Farmacia Hospitalaria) Tutor: Dr. Luis Moral 3 febrero, 2016, HGUA. Objetivo Repasar
Monitorización de niveles de vancomicina en Pediatría Chevorn Suzette Adams (R3 Pediatría) María Luz Boquera Ferrer (R4 Farmacia Hospitalaria) Tutor: Dr. Luis Moral 3 febrero, 2016, HGUA. Objetivo Repasar
FICHA TÉCNICA. La duración estimada del tratamiento será de dos semanas.
 FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
Cetuximab en Cáncer de Colon
 1 Cetuximab ONCOLOGÍA en Cáncer de Colon 2013 Cetuximab en Cáncer de Colon Recomendaciones para su Uso Coordinador: Dr. Esteban Lifschitz Autores: Dr. Patricio Servienti, Dr. Ventura Simonovich Evaluación
1 Cetuximab ONCOLOGÍA en Cáncer de Colon 2013 Cetuximab en Cáncer de Colon Recomendaciones para su Uso Coordinador: Dr. Esteban Lifschitz Autores: Dr. Patricio Servienti, Dr. Ventura Simonovich Evaluación
Experiencia con vinflunina en pacientes con cáncer urotelial e ILP prolongado
 Experiencia con vinflunina en pacientes con cáncer urotelial e ILP prolongado Cáncer urotelial estadio IV Estrategia de tratamiento en 2ª línea El tratamiento del carcinoma urotelial avanzado tras fracaso
Experiencia con vinflunina en pacientes con cáncer urotelial e ILP prolongado Cáncer urotelial estadio IV Estrategia de tratamiento en 2ª línea El tratamiento del carcinoma urotelial avanzado tras fracaso
ETOPOSIDO 100mg/5mL. 1. Identificación del Medicamento. Nombre Comercial. Etoposido 100mg/5mL Solución Inyectable. Nombre Genérico.
 ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
Tratamiento inmunoterápico de las metástasis cerebrales. Alfonso Berrocal Hospital General de Valencia
 Tratamiento inmunoterápico de las metástasis cerebrales Alfonso Berrocal Hospital General de Valencia Inmunidad y metástasis cerebrales Cancer 2013;119:2737-46. Ipilimumab y metástasis SNC Ipilimumab bloquea
Tratamiento inmunoterápico de las metástasis cerebrales Alfonso Berrocal Hospital General de Valencia Inmunidad y metástasis cerebrales Cancer 2013;119:2737-46. Ipilimumab y metástasis SNC Ipilimumab bloquea
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
CAPECITABINA Informe para la Comisión de Farmacia y Terapéutica del Hospital de Cabueñes Fecha 16/04/2012
 CAPECITABINA Informe para la Comisión de Farmacia y Terapéutica del Hospital de Cabueñes Fecha 16/04/01 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Indicación clínica solicitada: Cáncer
CAPECITABINA Informe para la Comisión de Farmacia y Terapéutica del Hospital de Cabueñes Fecha 16/04/01 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Indicación clínica solicitada: Cáncer
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
SERPIENTES Definición:
 SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
SERPIENTES Definición: Las serpientes u ofidios son reptiles caracterizados por la ausencia de extremidades y un cuerpo muy alargado. En España hay solo dos familias de serpientes venenosas: las víboras
Tratamiento del cáncer de Pulmón
 Tratamiento del cáncer de Pulmón Autor Isla Casado TRATAMIENTO DEL CARCINOMA NO MICROClTlCO DE PULMON El tratamiento del carcinoma no microcítico de pulmón considerado por estadios es el siguiente: 1)
Tratamiento del cáncer de Pulmón Autor Isla Casado TRATAMIENTO DEL CARCINOMA NO MICROClTlCO DE PULMON El tratamiento del carcinoma no microcítico de pulmón considerado por estadios es el siguiente: 1)
Tratamiento de la enfermedad tromboembólica venosa y cáncer.
 Tratamiento de la enfermedad tromboembólica venosa y cáncer. 1er Curso Trombosis y Hemostasia Martes, 13 de Octubre de 2015 Sala 10, Acadèmia Can Caralleu Actividad Avalada por: Elisa Orna Montero Laboratorio
Tratamiento de la enfermedad tromboembólica venosa y cáncer. 1er Curso Trombosis y Hemostasia Martes, 13 de Octubre de 2015 Sala 10, Acadèmia Can Caralleu Actividad Avalada por: Elisa Orna Montero Laboratorio
PROYECTOS PRESENTADOS
 Área Calidad, Formación, Investigación y Desarrollo Enfermería PREMIO NACIONAL DE INVESTIGACIÓN EN ENFERMERÍA 15ª EDICIÓN año 2013 PROYECTOS PRESENTADOS TRABAJO Nº 1 Título: EFECTOS Y CONSECUENCIAS DE
Área Calidad, Formación, Investigación y Desarrollo Enfermería PREMIO NACIONAL DE INVESTIGACIÓN EN ENFERMERÍA 15ª EDICIÓN año 2013 PROYECTOS PRESENTADOS TRABAJO Nº 1 Título: EFECTOS Y CONSECUENCIAS DE
: Cáncer renal avanzado o metastásico
 EVALUACIÓN DE MEDICAMENTOS PARA LA ELABORACIÓN DE LA LISTA COMPLEMENTARIA DE MEDICAMENTOS PARA EL TRATAMIENTO DE ENFERMEDADES NEOPLASICAS AL PETITORIO NACIONAL UNICO DE MEDICAMENTOS ESENCIALES I. DATOS
EVALUACIÓN DE MEDICAMENTOS PARA LA ELABORACIÓN DE LA LISTA COMPLEMENTARIA DE MEDICAMENTOS PARA EL TRATAMIENTO DE ENFERMEDADES NEOPLASICAS AL PETITORIO NACIONAL UNICO DE MEDICAMENTOS ESENCIALES I. DATOS
Informe de Posicionamiento Terapéutico de eribulina (Halaven ) en el cáncer de mama
 INFORME DE POSICIONAMIENTO TERAPÉUTICO PT-ERIBULINA/V3/10072015 Informe de Posicionamiento Terapéutico de eribulina (Halaven ) en el cáncer de mama Fecha de publicación: 24 de julio de 2015 El cáncer de
INFORME DE POSICIONAMIENTO TERAPÉUTICO PT-ERIBULINA/V3/10072015 Informe de Posicionamiento Terapéutico de eribulina (Halaven ) en el cáncer de mama Fecha de publicación: 24 de julio de 2015 El cáncer de
SOLICITUD DE MEDICAMENTOS ONCOLOGICOS CON AUDITORIA PREVIA. Pulmón 2 Renal 4 Colon 5 Mama 6 Cabeza y Cuello 8 Tumores SNS 9 Cancer Gastrico 10
 SOLICITUD DE MEDICAMENTOS ONCOLOGICOS CON AUDITORIA PREVIA Pulmón 2 Renal 4 Colon 5 Mama 6 Cabeza y Cuello 8 Tumores SNS 9 Cancer Gastrico 10 1 CANCER PULMON ESTADIO IV 1ra Línea Cisplatino y-o Carboplatino
SOLICITUD DE MEDICAMENTOS ONCOLOGICOS CON AUDITORIA PREVIA Pulmón 2 Renal 4 Colon 5 Mama 6 Cabeza y Cuello 8 Tumores SNS 9 Cancer Gastrico 10 1 CANCER PULMON ESTADIO IV 1ra Línea Cisplatino y-o Carboplatino
Adecuación de tratamiento con nuevos anticoagulantes orales
 Adecuación de tratamiento con nuevos anticoagulantes orales Prevención primaria de episodios tromboembólicos venosos en pacientes adultos sometidos a cirugía de reemplazo total de CADERA O RODILLA. Dabigatrán
Adecuación de tratamiento con nuevos anticoagulantes orales Prevención primaria de episodios tromboembólicos venosos en pacientes adultos sometidos a cirugía de reemplazo total de CADERA O RODILLA. Dabigatrán
INSTRUCTIVO REGISTRO PARA LAS ATENCIONES DE QUIMIOTERAPIA
 1. OBJETIVO: Establecer una orientación clara y precisa que permita oficializar el sistema de registro de los tratamientos de quimioterapia en adultos del Hospital Regional de Arica Dr. Juan Noé Crevani,
1. OBJETIVO: Establecer una orientación clara y precisa que permita oficializar el sistema de registro de los tratamientos de quimioterapia en adultos del Hospital Regional de Arica Dr. Juan Noé Crevani,
Descripción CLASES MAGISTRALES, TALLERES PRÁCTICOS DE CITOLOGÍA Y PRESENTACIÓN DE CASOS CLÍNICOS
 CURSO DE POSGRADO EN ONCOLOGÍA VETERINARIA De lo molecular a lo clínico Facultad de Ciencias Agropecuarias Universidad Católica de Córdoba Cupo MÍNIMO 10, MÁXIMO 30 ALUMNOS Descripción CLASES MAGISTRALES,
CURSO DE POSGRADO EN ONCOLOGÍA VETERINARIA De lo molecular a lo clínico Facultad de Ciencias Agropecuarias Universidad Católica de Córdoba Cupo MÍNIMO 10, MÁXIMO 30 ALUMNOS Descripción CLASES MAGISTRALES,
LAS GARANTÍAS DE LAS NUEVAS PATOLOGÍAS A QUE TENDRÁN DERECHO LOS BENEFICIARIOS DE ISAPRE. COMIENZAN EL 1 DE JULIO DE 2013.
 LAS GARANTÍAS DE LAS NUEVAS PATOLOGÍAS A QUE TENDRÁN DERECHO LOS BENEFICIARIOS DE ISAPRE. COMIENZAN EL 1 DE JULIO DE 2013. Fuente WEB Ministerio de Salud www.minsal.cl A partir del 1 de julio de 2013,
LAS GARANTÍAS DE LAS NUEVAS PATOLOGÍAS A QUE TENDRÁN DERECHO LOS BENEFICIARIOS DE ISAPRE. COMIENZAN EL 1 DE JULIO DE 2013. Fuente WEB Ministerio de Salud www.minsal.cl A partir del 1 de julio de 2013,
1. DENOMINACIÓN DEL ESQUEMA: CARBOPLATINO- PACLITAXEL. Cáncer de pulmón no microcítico metastásico o localmente avanzado en 1ª línea.
 1. DENOMINACIÓN DEL ESQUEMA: CARBOPLATINO- PACLITAXEL 2. USO TERAPÉUTICO Cáncer de pulmón no microcítico metastásico o localmente avanzado en 1ª línea. 3. ESQUEMA (1,2,3) Medicamento Dosis Días Administración
1. DENOMINACIÓN DEL ESQUEMA: CARBOPLATINO- PACLITAXEL 2. USO TERAPÉUTICO Cáncer de pulmón no microcítico metastásico o localmente avanzado en 1ª línea. 3. ESQUEMA (1,2,3) Medicamento Dosis Días Administración
Equivalentes terapéuticos
 Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
Hepatectomía en 2 tiempos. para metástasis no resecables de cáncer colorectal:
 Hepatectomía en 2 tiempos Preparada por : para metástasis no resecables de cáncer colorectal: Mario Uribe Maturana Internos : Alejandro Mercado Felipe Valenzuela Servicio y Departamento de Cirugía Universidad
Hepatectomía en 2 tiempos Preparada por : para metástasis no resecables de cáncer colorectal: Mario Uribe Maturana Internos : Alejandro Mercado Felipe Valenzuela Servicio y Departamento de Cirugía Universidad
FLUCONAZOL. Solución para infusión IV. 200 mg. ALFARMA S.A., PANAMÁ, REPÚBLICA DE PANAMÁ. Fabricante, país:
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: FLUCONAZOL Solución para infusión IV 200 mg Estuche por un frasco de PEBD con 100 ml. Titular
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: Forma farmacéutica: Fortaleza: Presentación: FLUCONAZOL Solución para infusión IV 200 mg Estuche por un frasco de PEBD con 100 ml. Titular
5. Cáncer de próstata en progresión bioquímica
 5. Cáncer de próstata en progresión bioquímica 5.1. efinición de progresión bioquímica Pregunta para responder: En pacientes con cáncer de próstata sometidos a prostatectomía o radioterapia con intención
5. Cáncer de próstata en progresión bioquímica 5.1. efinición de progresión bioquímica Pregunta para responder: En pacientes con cáncer de próstata sometidos a prostatectomía o radioterapia con intención
Ceccato F, Gontero R, Negri M, Rolla I, Crabbe E, Ortiz A, Paira S. Sección Reumatología, Hospital Cullen. Santa Fe, Argentina.
 Elevación de las enzimas hepáticas y leucopenia en pacientes con Artritis Reumatoidea y Artropatía Psoriática tratados con metotrexate y/o leflunomida. Ceccato F, Gontero R, Negri M, Rolla I, Crabbe E,
Elevación de las enzimas hepáticas y leucopenia en pacientes con Artritis Reumatoidea y Artropatía Psoriática tratados con metotrexate y/o leflunomida. Ceccato F, Gontero R, Negri M, Rolla I, Crabbe E,
PROPUESTA DE FICHA TÉCNICA
 PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
PROPUESTA DE FICHA TÉCNICA 1. DENOMINACION DEL MEDICAMENTO EBASTINA COMBIX 10 mg comprimidos recubiertos con película EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película
Experiencia con Vinorelbina Oral en el tratamiento del CPNM con histología no escamoso. Dr. Javier de Castro
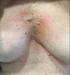 Experiencia con Vinorelbina Oral en el tratamiento del CPNM con histología no escamoso Dr. Javier de Castro Caso Clínico: carcinoma de pulmón no escamoso avanzado Mujer de 60 años Fumadora de 30 cig/d
Experiencia con Vinorelbina Oral en el tratamiento del CPNM con histología no escamoso Dr. Javier de Castro Caso Clínico: carcinoma de pulmón no escamoso avanzado Mujer de 60 años Fumadora de 30 cig/d
Congreso Nacional GeSida 2014
 Lo mejor del año. VHC Dr. Juan Macías Hospital Universitario de Valme Sevilla VI Congreso Nacional de GESIDA Málaga, 28 noviembre 2014 Lo mejor del año. VHC Es posible tratar con éxito con pautas (muy)
Lo mejor del año. VHC Dr. Juan Macías Hospital Universitario de Valme Sevilla VI Congreso Nacional de GESIDA Málaga, 28 noviembre 2014 Lo mejor del año. VHC Es posible tratar con éxito con pautas (muy)
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
Paracetamol DC 90 equivalente a mg de Paracetamol
 INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre comercial: TAFIROL 2. Nombre genérico PARACETAMOL 3. Forma farmacéutica y formulación: Cada tableta contiene: Paracetamol DC 90 equivalente a. 1000 mg de Paracetamol
INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre comercial: TAFIROL 2. Nombre genérico PARACETAMOL 3. Forma farmacéutica y formulación: Cada tableta contiene: Paracetamol DC 90 equivalente a. 1000 mg de Paracetamol
Versión Electrónica. Enero 2007 GUÍA DE DIAGNÓSTICO Y TRATAMIENTO DEL CANCER DE PROSTATA
 Versión Electrónica. Enero 2007 GUÍA DE DIAGNÓSTICO Y TRATAMIENTO DEL CANCER DE PROSTATA Colectivo de Autores: Cirugía: Dr. Jorge González Hernández, Dr. Antonio Bouzo López, Dr. Celestino Labori Cardas
Versión Electrónica. Enero 2007 GUÍA DE DIAGNÓSTICO Y TRATAMIENTO DEL CANCER DE PROSTATA Colectivo de Autores: Cirugía: Dr. Jorge González Hernández, Dr. Antonio Bouzo López, Dr. Celestino Labori Cardas
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO. URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Xeloda 150 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Xeloda 150 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN
 Universidad Ricardo Palma Facultad de Medicina Humana ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN Esquema de presentación para la elaboración del proyecto de trabajo de los Residentes del Segundo Año.
Universidad Ricardo Palma Facultad de Medicina Humana ESCUELA DE RESIDENTADO MÉDICO Y ESPECIALIZACIÓN Esquema de presentación para la elaboración del proyecto de trabajo de los Residentes del Segundo Año.
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
Informe de Posicionamiento Terapéutico de Eribulina (Halaven ) en el cáncer de mama
 INFORME DE POSICIONAMIENTO TERAPÉUTICO PT/V1/04092013 Informe de Posicionamiento Terapéutico de Eribulina (Halaven ) en el cáncer de mama Fecha: 4 de Septiembre 2013 El cáncer de mama es el cáncer más
INFORME DE POSICIONAMIENTO TERAPÉUTICO PT/V1/04092013 Informe de Posicionamiento Terapéutico de Eribulina (Halaven ) en el cáncer de mama Fecha: 4 de Septiembre 2013 El cáncer de mama es el cáncer más
PANITUMUMAB EN CANCER DE COLON METASTÁSICO:
 PANITUMUMAB EN CANCER DE COLON METASTÁSICO: Romero Soria L 1, Jaraquemada Peláez T 2, Martin Clavo S 1, Rivero Cava MS 1, Braga Fuentes JL, Rangel Mayoral JF 1. 1 Servicio de Farmacia Hospitalaria 2 Servicio
PANITUMUMAB EN CANCER DE COLON METASTÁSICO: Romero Soria L 1, Jaraquemada Peláez T 2, Martin Clavo S 1, Rivero Cava MS 1, Braga Fuentes JL, Rangel Mayoral JF 1. 1 Servicio de Farmacia Hospitalaria 2 Servicio
INFORMACION PARA PRESCRIBIR AMPLIA
 INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: PAMIGEN 2. Nombre Genérico: GEMCITABINA 3. Forma Farmacéutica y Formulación: Solución Cada frasco ámpula con liofilizado contiene: Clorhidrato de
INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: PAMIGEN 2. Nombre Genérico: GEMCITABINA 3. Forma Farmacéutica y Formulación: Solución Cada frasco ámpula con liofilizado contiene: Clorhidrato de
GUÍA CLÍNICA PARA PREVENCIÓN Y SEGUIMIENTO DE CÁNCER DE MAMA 2015
 GUÍA CLÍNICA PARA PREVENCIÓN Y SEGUIMIENTO DE CÁNCER DE MAMA 2015 Tomada y adaptada de MSAL Complementaria de Guía de Examen periódico de salud del adulto 2015. EPIDEMIOLOGÍA El cáncer de mama es la primera
GUÍA CLÍNICA PARA PREVENCIÓN Y SEGUIMIENTO DE CÁNCER DE MAMA 2015 Tomada y adaptada de MSAL Complementaria de Guía de Examen periódico de salud del adulto 2015. EPIDEMIOLOGÍA El cáncer de mama es la primera
LO ÚLTIMO EN PATOLOGÍA RESPIRATORIA MARÍA LIZARITURRRY R3 MEDICINA INTERNA HOSPITAL UNIVERSITARIO LA PAZ
 LO ÚLTIMO EN PATOLOGÍA RESPIRATORIA MARÍA LIZARITURRRY R3 MEDICINA INTERNA HOSPITAL UNIVERSITARIO LA PAZ 13.12.2013 VARÓN, 62 AÑOS. Fumador 30 cigarrillos/día desde hace 40 años Asintomático PRUEBA DE
LO ÚLTIMO EN PATOLOGÍA RESPIRATORIA MARÍA LIZARITURRRY R3 MEDICINA INTERNA HOSPITAL UNIVERSITARIO LA PAZ 13.12.2013 VARÓN, 62 AÑOS. Fumador 30 cigarrillos/día desde hace 40 años Asintomático PRUEBA DE
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
