Una vez obtenido el valor de X se procede a calcular las concentraciones de equilibrio de todas las especies: 0,0073 2
|
|
|
- Sergio Quintero Araya
- hace 6 años
- Vistas:
Transcripción
1 8 Caítulo 1. ara la reaión : HI (g) H (g) + I (g), 0,00 a 448 C. Se alienta 1 mol de HI en una ámara vaía de 30 L hasta 448 C, alular las onentraiones de todas las eseies en el equilibrio. Soluión: Método 1 : Se omienza a llenar la tabla, realizando reviamente el siguiente análisis:» La onentraión molar iniial de HI es: [HI] 1/30 0,033 mol/l.» Al iniio de la reaión sólo hay HI, or lo tanto algo de éste debe desomonerse ara dar lugar a la formaión de rodutos.» Igual que en el roblema anterior, se desonoe uanto HI se desomone, entones esta antidad se exresa omo mol/l.» Los rodutos formados también se exresan en funión de, tomando en uenta que la euaión india que uando reaionan moles de HI se forma 1 mol de ada roduto, entones ara mol/l de HI que reaiona se forman / mol/l de H y / mol/l de I. HI (g ) H (g) + I (g) onentraión iniial 0, antidad que reaiona antidad que se forma / / onentraión equilibrio 0,033- / / Reemlazando estas antidades en la exresión de equilibrio se obtiene: [ H ][ I ] [ HI ] 0,00 ( 0,033 - ) ( 0,033 - ) saando raíz uadrada, queda 0,141(0,033 - ) 0,0073
2 Equilibrio Químio 83 Una vez obtenido el valor de se roede a alular las onentraiones de equilibrio de todas las eseies: [ HI ] 0,033-0,033-0,0073 0,06 mol/l 0,0073 [ ] [ I ] 0,0036 mol/l H Método : Una alternativa ara el método reién desrito onsiste en asignar a todas las antidades desonoidas, anteoniendo un oefiiente igual al orresondiente a la euaión estequiométria. Este roedimiento ermite mantener la relaión que existe entre las inógnitas sin un análisis muy omliado. HI (g) H (g) + I (g) onentraión iniial 0, antidad que reaiona antidad que se forma onentraión equilibrio 0,033- Con este razonamiento se está definiendo omo a los moles de ada roduto formado, a diferenia del método anterior en que reresentaban los moles de HI que reaionan.. En todo aso, on ualquiera de los dos métodos se mantiene la relaión estequiométria :1:1 entre los moles de reatante y rodutos. Reemlazando los valores de onentraión en equilibrio de todas las eseies en la euaión de, se tiene: 0,00 (0,033- ) saando raíz uadrada y desarrollando 0,141(0,033 - ) 0, ,8 0,0036 Al sustituir este valor en las exresiones de equilibrio de ada eseie resulta: [ HI ] 0,033-0,033 - (0,0036) 0,06 mol / L [ H ] [ I ] 0,0036 mol / L
3 84 Caítulo Como se uede ver, las onentraiones de equilibrio resultaron igual que on el método anterior. Si se mantiene la roorión entre las inógnitas se llega a resultados iguales, aunque el valor de alulado sea diferente, deendiendo del oefiiente que se anteonga a las. ara mayor failidad y raidez, en los futuros roblemas se usarán los oefiientes estequiométrios en las inógnitas ara asegurar la roorión entre las antidades de reatantes y rodutos. 13. ara el equilibrio NO (g) + Br (g) NOBr (g), 0,36 a una ierta temeratura. Determine las onentraiones de todas las eseies en el equilibrio, si se introdue 1 mol de NO y 0,8 mol de Br en un reiiente de L, se ierra y se alienta hasta que alane el equilibrio a diha temeratura Soluión: Se alula rimero las onentraiones molares de ada uno de los reatantes: 1mol L [ NO ] 0,5 mol/l 0,8 mol L [ ] 0,4 mol/l Br NO (g) + Br (g NOBr (g) onentraiones iniiales 0,5 0,4 0 antidad que reaiona antidad que se forma onentraión de equilibrio (0,5 - ) (0,4 - ) Reemlazando estos valores en la exresión de equilibrio de la reaión: [ NOBr] [ NO] [ Br ] ( ) 0,36 ( 0,5 ) ( 0,4 - )
4 Equilibrio Químio 85 que desarrollada quedará: 3 1,44 +,7 + 0,38 0,036 Resolviendo or el método del tanteo, que onsiste en darse un valor ara, sustituir ese valor en la euaión, resolver y omarar el resultado obtenido on el de la euaión: 3 144, +,7 + 0,38 0,036 ara 0,05 0,058 0,07 0,040 0,065 0,0356 0,036 Se debe haer notar que el método del tanteo será más fáil si se analizan los resultados que se van obteniendo ara los valores de asumidos:» rimero, se uede deduir ráidamente que no uede ser igual o suerior a 0,5, ya que on este valor la onentraión de NO en el equilibrio daría 0. Además omo 0,36, se uede suoner que la antidad de reatante que se transforma en roduto no debe ser muy grande. Bajo estas onsideraiones se asume el valor 0,05 omo valor iniial. Es imortante haer un análisis revio, que ermita asumir un buen valor de artida, on el fin de disminuir el tiemo requerido ara enontrar el valor de.» El resultado obtenido reemlazando 0,05 india que el valor busado no está muy lejos, ya que 0,058 es bastante erano a 0,036. Como el valor nos dio un oo menor que el busado, se uede deduir que el valor verdadero de es mayor que 0,05. No es reomendable, sin embargo, intentar enontrar el valor de aumentando en inrementos equeños orque uede resultar un roedimiento muy largo. Es referible aumentar el valor a 0,07 on el ual se obtiene un resultado de 0,040, que resulta ligeramente mayor que 0,036 y ermite estrehar el rango. Ahora, on estos dos álulos se uede observar que debe ser un valor entre 0,05 y 0,07. Es difíil obtener una buena aroximaión de inmediato, si no se tiene rátia en la utilizaión de este método, ero de todas maneras ermite aerarse más ráido al valor orreto.» Si se observa el resultado de los dos álulos iniiales, se uede notar que el valor de debe estar más era de 0,07 que de 0,05, orque 0,040 es más róximo a 0,036 que 0,058. Esta observaión es imortante ara esoger el siguiente valor de, or lo tanto la siguiente ifra a reemlazar es 0,065.
5 86 Caítulo» Con 0,065 no da exatamente 0,036 sino un valor ligeramente inferior. Se uede intentar aerarse en forma más exata al valor, ero habría resultado un número on tres ifras signifiativas, en irunstanias que a través del roblema se ha utilizado sólo ifras signifiativas, or lo tanto no tiene sentido seguir aotando el valor de. El valor de es entones 0,065. Este valor de se reemlaza en las exresiones de las onentraiones de equilibrio de las tres eseies del sistema: [NO] 0,5-0,5 - (0,065) 0,37 mol/l [Br ] 0,4-0,4-0,065 0,34 mol/l [NOBr] (0,065) 0,13 mol/l 14. ara la reaión : N (g) + 3 H (g) NH 3(g), 0,0816 a C. En un reiiente errado se tiene una mezla en equilibrio de los tres gases a esa temeratura. Se sabe que la onentraión de nitrógeno y amoníao en el equilibrio son 0,64 mol/l y 0,0185 mol/l, resetivamente. Calular la onentraión de H en el reiiente. Soluión: Hay que reordar que en la exresión de equilibrio las onentraiones de equilibrio de ada eseie se elevan a un exonente igual al oefiiente estequiométrio, or lo tanto si se onoen las onentraiones de equilibrio, entones sólo se reemlazan: [ NH3] [ N ][ H ] 3 ( 0,0185) 3,4 10 0, ( 0,64)( ) 0, de donde 0,51 En este ejemlo, aunque el oefiiente del hidrógeno en la euaión es 3, la inógnita es simlemente orque es la únia antidad desonoida. Los oefiientes estequiométrios se utilizan en las inógnitas sólo uando existen dos o más antidades desonoidas y éstas están relaionadas entre sí.
6 Equilibrio Químio Mezlando a ierta temeratura 1 mol de áido benzoio y 1 mol de etanol, se obtiene 0,5 moles de agua, de auerdo a la reaión: C 6 H 5 -COOH (l) + C H 5 -OH (l) H O (l) + C 6 H 5 -COO-C H 5(l) Calular (a) el valor de ; (b) la omosiión de la mezla resultante, a la misma temeratura, si se mezlan 6 moles de áido on 4 moles de etanol. Soluión: (a) No se onoe el volumen del reiiente de reaión, ero omo el número de moles de rodutos y de reatantes es igual, se uede trabajar diretamente on los moles, tal omo se exlió en el roblema 9. Al igual que en ejemlos anteriores, se ingresan los datos del roblema a una tabla: C 6 H 5 -COOH + C H 5 -OH H O + C 6 H 5 -COO-C H 5 n i n reaiona n formados n eq 0,5 En esta tabla se uede ver que en el equilibrio hay 0,5 mol de H O. Como iniialmente no existía H O, entones se dedue que los moles formados de H O son 0,5 mol y or lo tanto los moles que reaionan tanto de áido benzoio omo de etanol es 0,5 ya que la relaión estequiométria entre reatantes y rodutos es 1:1:1:1. or esta misma razón se dedue que la antidad de benzoato de etilo formada debe ser 0,5 mol, quedando todas las eseies en el equilibrio on una antidad igual a 0,5 moles. C 6 H 5 -COOH + C H 5 -OH H O + C 6 H 5 -COO-C H 5 n i n reaiona 0,5 0,5 n formados 0,5 0,5 n eq 0,5 0,5 0,5 0,5 y or lo tanto [ H O][ C H -COO -C H ] [ C H -COOH][ C H -OH]
7 88 Caítulo (0,5) (0,5) 1 (0,5) (0,5) (b) ara resolver esta regunta, se utiliza el valor de reién determinado y se ingresa en la tabla las antidades que nos india el roblema: C 6 H 5 -COOH + C H 5 -OH H O + C 6 H 5 -COO-C H 5 n i n reaiona n formados n eq reemlazando estos valores en la exresión de equilibrio: [ HO][ C6H5 -COO - CH5] [ C H - COOH][ C H - OH] 6 5 ( )( ) 1 ( 6 - )( 4 - ) ,4 10 Sabiendo el valor de, se reemlaza ara obtener las antidades de ada eseie en el equilibrio: [ O] [ C H - COO -C H ],4 moles H [ H -COOH] 6-6 -,4 3,6 moles C 6 5 [ H -OH] 4-4 -,4 1,6 moles C 5
8 Equilibrio Químio A 300 C el valor de ara la reaión Cl 5(g) Cl 3(g) + Cl (g) es 0,56. En un reiiente de 10 L hay una mezla formada or 0,9 moles de Cl, 1,8 moles de Cl 3 y 0,4 moles de Cl 5. Determinar: a) está diha mezla en equilibrio? b) si no lo está, en qué sentido evoluionará el sistema? Soluión: (a) En este ejemlo se saben las antidades de ada una de las eseies que onforman el sistema. Si estuviera en equilibrio, al reemlazar las onentraiones molares de ellas en la exresión de equilibrio, se obtendría exatamente el valor orresondiente a la onstante ara esa temeratura: Cálulo de las onentraiones molares 0,9 mol [ ] 0,09 mol L Cl 10 L 1,8 mol [ ] 0,18 mol L Cl 3 10 L 0,4 mol [ ] 0,04 mol L Cl 5 10 Reemlazando en la exresión de equilibrio L [ Cl3][ Cl] [ Cl ] 5 ( 0,18 )( 0,09 ) 0,675 ( 0,04 ) El valor de es 0,56 y no 0,675, or lo tanto este sistema no está en equilibrio b) ara determinar en que sentido evoluionará el sistema ara alanzar el equilibrio, basta on omarar el valor 0,675 on el valor de. Como es la razón entre rodutos y reatantes, el valor 0,675 (mayor que ), signifia que la relaión rodutos/reatantes es mayor que la que orresonde al estado de equilibrio, or lo tanto se requiere que la onentraión de rodutos disminuya y la onentraión de reatantes aumente, de tal modo que el valor de la fraión rodutos/reatantes alane el valor que orresonde a. ara que esto
9 90 Caítulo sueda, se requiere que los rodutos reaionen entre si y den lugar a la formaión de más antidad de reatante.. or este razonamiento se onluye que el sistema debe evoluionar favoreiendo la formaión de reatante, es deir de dereha a izquierda. ( ). 17. A 50 C, 1,78 ara el equilibrio : Cl 5(g) Cl 3(g) + Cl (g), alule. Soluión: al omo se desribió en la introduión teória a este aítulo, se uede alular a artir de, o vieversa, utilizando la siguiente exresión: (R) - n g donde R 0,08 atm L -1 mol n g n g(rod.) - n g(reat.) entones 1,78 (0,08 53) 0, Una mezla de N e H se alienta a una temeratura de 63 C y una resión onstante de 30,0 atm. Si se usa una roorión estequiométria de ambos gases se enuentra que en el equilibrio la resión de N es 4,0 atm. Calule la onstante de equilibrio ara la reaión N (g) + 3 H (g) NH 3(g). Soluión: Como se utilizan antidades estequiométrias de los reatantes, es deir en relaión 1:3 entre N e H, ualquiera sean las antidades que reaionan de ada uno de éstos, los moles en el equilibrio onservan la roorión estequiométria y or lo tanto si la resión arial del N en el equilibrio es de 4,0 atm, la resión de H debe ser el trile, es deir, 1,0 atm. Como se sabe, la resión total del sistema, es 30,0 atm, entones la resión arial del NH 3 en el equilibrio será 30,0 - (1,0 + 4,0) 14,0 atm.
10 Equilibrio Químio 91 Reemlazando estas antidades en la exresión de equilibrio en funión de las resiones ariales: NH 3 3 N H ( 14,0) ( 4,0)( 1,0) 3 0, ara la reaión: Cl 3(g) + Br 3(g) Cl Br (g) + ClBr (g), la onstante de equilibrio es 1,5 a una ierta temeratura. La resión de equilibrio de Cl Br es igual a la de ClBr y es 6,0 m de Hg. Si la resión de Cl 3 es 5,0 m de Hg, determine la resión de equilibrio de Br 3. Soluión: En este roblema se da la resión arial de equilibrio de tres de los uatro omonentes del sistema y la onstante de equilibrio.: ClBr Cl3 ClBr Br3 1, Br 3 4,8 m de Hg 0. En una ámara vaía de 10 L se haen reaionar a 448 C, 0,5 moles de H y 0,5 moles de I. ara la reaión H (g) + I (g) HI (g), 50 a 448 C. Calule: a) uál es el valor de? b) uál es la resión total en la ámara? ) uál es la resión arial de ada omonente en la mezla de equilibrio? Soluión: (a) El álulo de a artir de se realiza a artir de: n ( R) g
11 9 Caítulo donde R 0, n g - 0 or lo ual 50 (b) H (g) + I (g) HI (g), n i 0,5 0,5 0 n r n f n eq 0,5-0,5- or lo tanto en el equilibrio el número total de moles será: n (0,5 - ) + (0,5 - ) + 1,0 mol t esto demuestra que indeendiente de uanto reatante se transforme en roduto el número total de moles no ambia, debido a que n g 0. ara alular la resión total en el reiiente se utiliza la euaión de estado: V nr nr V 1 mol 0,08 (atm L mol ) L 5,9 atm () ara onoer la resión arial de ada omonente en el equilibrio se debe determinar el valor de ara saber el número de moles de ada eseie en el equilibrio. Como se onoe y se uede utilizar ualquiera de los dos equilibrios. Método 1: [ HI ] [ H ][ I ] ,5 0,
12 Equilibrio Químio ( 0,5 - ) , ± ,14 ± 9 9 de donde 1 0,7 0,39 el valor 1 se desarta orque no uede reaionar más de la antidad disonible iniialmente, or lo tanto 0,39. moles de HI 0,39 0,78 moles de H 0,5-0,5-0,39 0,11 moles de I 0,5-0,5-0,39 0,11 Las resiones ariales de las tres eseies se determina ahora aliando: i χ i donde Χ i es la fraión molar del omonente i : Χ i i n n el número de moles totales, n 1 0,78 HI 5,9 atm 4,6 atm 1 0,11 1 H I 5,9 0,65 atm Se uede verifiar el álulo aliando la ley de Dalton que india que la suma de las resiones ariales de una mezla gaseosa debe ser igual a la resión total: HI + H + I 5,9 atm 4,6 + 0,65 + 0,65 5,9
13 94 Caítulo Método : H HI I reemlazando las resiones ariales or las exresiones en funión de la fraión molar: ,5-0,5-1 1 saando raíz uadrada 7,07(0,5 - ) ( ) ( 0,5 - ) 3,54-7,07 0,39 Una vez onoido el valor de se sustituye en las exresiones ara las resiones ariales: HI 5,9 0,39 5,9 4,6 atm H I (0,5 - ) 5,9 (0,5-0,39) 5,9 0,65 atm Se uede areiar que este último método es signifiativamente más senillo. Método 3: Se uede deduir una exresión general que relaione on las fraiones molares de los omonentes gaseosos. Así, ara una reaión del tio: aa (g) + bb (g) C (g) + dd (g) Reemlazando las resiones ariales de ada omonente, exresión de onstante de equilibrio se tiene: Χ en la i i d ( C ) ( D ) a ( ) ( ) b A B
14 Equilibrio Químio 95 (+ d)-(a+ b) d ( C ) ( D ) a ( ) ( ) b A B ng C a A d D b B Con los datos roorionados en el roblema tenemos que: 50 5,9 atm n g 0 y la exresión de en funión de las fraiones molares es: ng Χ H HI I reemlazando las fraiones molares en funión del número de moles se tiene: n HI n HI n H n n I n H I or lo tanto ng H HI I 0 n HI n nh n n n I entones n nhi n H I ( ) ( 0,5 - )( 0,5 - ) desarrollando la exresión anterior, se llega a los mismos resultados de los métodos anteriores.
15 96 Caítulo 1. Se introdue Cl 5 en una ámara vaía estableiéndose el equilibrio a 50 C y,00 atm. La mezla de equilibrio ontiene 40,7 % de loro en volumen. Determine: a) las resiones ariales de Cl 5 y Cl 3 en el equilibrio. b) el valor de a esa temeratura. ) si la mezla gaseosa se exansiona hasta 0,00 atm a 50 C, uál será el orentaje de disoiaión, el % en volumen de loro y la resión arial de este gas? Soluión: (a) El roblema sólo entrega el orentaje en volumen de loro en el equilibrio, ero aquí nuevamente se uede haer uso de la euaión ara estableer los valores restantes Al igual que en ejeriios anteriores, se debe haer un análisis que ermita llegar a estableer los orentajes restantes.» La euaión no es suministrada diretamente, ero die que se agrega iniialmente Cl 5 y no india que se agregue algún otro, or lo tanto el Cl 5 es el únio reativo.» Se india que en el equilibrio hay 40,7 % en volumen de loro, or lo tanto este es uno de los rodutos de la reaión.» Como se trata de una reaión de desomosiión, se uede deduir que el otro roduto es Cl 3, que es lo que queda uando se le quita Cl al Cl 5. De todas maneras, esto queda onfirmado en la regunta, uando se iden las resiones ariales de Cl 3 y Cl 5.» De la euaión se evidenia que se rodue igual antidad de Cl 3 que de Cl, or lo tanto si el loro oua un 40,7% en volumen de la mezla en equilibrio, el Cl 3 debe reresentar un volumen igual. El Cl 5 entones orresonde al orentaje restante. Cl 5(g) Cl 3(g) + Cl (g) en el equilibrio 18,6% 40,7 % 40,7% Las resiones ariales de Cl 5 y Cl 3 en el equilibrio se ueden determinar a artir de los orentajes en volumen de ada eseie: % V ,7 100 Cl 3 Cl,00 0,814 atm
16 Equilibrio Químio 97 18,6 100 Cl 5,00 0,37 atm (b) El álulo de se realiza a artir de las resiones ariales: Cl 3 Cl5 Cl 0,814 0,814 0,37 1,78 () Resulta un buen ejeriio haer un análisis del omortamiento eserado ara este sistema uando modifiamos la resión total:» Cuando la resión total disminuye, el sistema deberá evoluionar haia donde hayan más moles gaseosos, en este aso haia la formaión de rodutos, or lo tanto se esera que aumente la disoiaión de Cl 5, Esto se traduirá en un orentaje de loro mayor que 40,7 en volumen.» Este tio de análisis ermitirá verifiar los resultados numérios obtenidos osteriormente, además de onstituir un refuerzo de los onetos teórios que sustentan este tio de álulos.» Como la onstante de equilibrio deende de la temeratura y no se ha variado ésta, or lo tanto se onoe el valor de, que es 1,78. Al modifiar la resión total, sin embargo, el orentaje de disoiaión del Cl 5 será diferente.» ara alular el orentaje de disoiaión se asume una antidad iniial de reatante. ara exresar la antidad disoiada en términos de orentaje es más senillo asumir una antidad iniial de 1 mol. Cl 5(g) Cl 3(g) + Cl (g) n i n d n f n eq 1- n n eq Hasta ahora se tiene el número de moles de ada eseie y el número de moles totales en el equilibrio, exresados en funión de, que reresenta el orentaje de disoiaión a la nueva resión (0,00 atm). ara ada eseie la resión arial se uede exresar en funión de la fraión molar: Χ A A t
17 98 Caítulo n A A n Reemlazando los datos de la tabla: t 1-1+ Cl 5 0,00 atm 1+ Cl 3 Cl 0,00 atm Sustituyendo las resiones ariales en la exresión de equilibrio: Cl3 Cl Cl5 0,00 atm 0,00 atm ,00 atm 1+ 0,00 (1+ ) (1- ) 1,78 0, , - 1,78 0,00 1,78 1,98 0,948 Como se asumió 1 mol iniial, de los uales se disoiaron 0,948, entones el orentaje de disoiaión es 94,8 %. ara el álulo del orentaje en volumen de loro se debe resolver el valor de la fraión molar de este gas: Χ Cl 0,948 0, ,948
18 Equilibrio Químio 99 Si se tiene resente que la fraión molar reresenta el número de moles or ada mol de mezla total, ara exresar esta antidad en orentaje basta multiliar or 100: % Cl 0, ,7 Este resultado onuerda on la rediión heha más arriba. La última regunta, reseto a la resión arial de loro se uede resolver de las siguientes dos maneras: Método 1: A artir de la fraión molar alulada: Cl Χ Cl Cl 0,487 t 0,00 atm 0,0974 atm Método : A artir del orentaje en volumen de la eseie: % Cl Cl ,7 100 Cl t 0,00 atm 0,0974 atm
(g) XeF 4. Se mezclan 0,4 moles de xenón con 0,8 moles de flúor en un recipiente de 2,0 L. En el equilibrio, el 60 % del Xe se ha convertido en XeF 4
 A 00º C de temeratura, se rodue la reaión: Xe g + F g XeF 4 g Se mezlan 0,4 moles de xenón on 0,8 moles de flúor en un reiiente de,0 L. En el equilibrio, el 60 % del Xe se ha onvertido en XeF 4. Determina:
A 00º C de temeratura, se rodue la reaión: Xe g + F g XeF 4 g Se mezlan 0,4 moles de xenón on 0,8 moles de flúor en un reiiente de,0 L. En el equilibrio, el 60 % del Xe se ha onvertido en XeF 4. Determina:
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 6, Oión A Reserva 1, Ejeriio, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio 6, Oión A Reserva, Ejeriio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 00 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 6, Oión A Reserva 1, Ejeriio, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio 6, Oión A Reserva, Ejeriio,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2008 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 008 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Reserva 1, Ejeriio 6, Oión A Reserva, Ejeriio 3, Oión A Reserva, Ejeriio 6, Oión B Reserva 3, Ejeriio 3, Oión A Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 008 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Reserva 1, Ejeriio 6, Oión A Reserva, Ejeriio 3, Oión A Reserva, Ejeriio 6, Oión B Reserva 3, Ejeriio 3, Oión A Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2013 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 013 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio 3, Oión A Reserva 3, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 013 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio 3, Oión A Reserva 3, Ejeriio
EQUILIBRIO QUÍMICO QCA 07
 1.- Dado el equilibrio: N (g) + 3 H (g) NH 3 (g) Justifique la influenia sobre el mismo de: a) Un aumento de la resión total. b) Una disminuión de la onentraión de N. ) Una disminuión de la temeratura.
1.- Dado el equilibrio: N (g) + 3 H (g) NH 3 (g) Justifique la influenia sobre el mismo de: a) Un aumento de la resión total. b) Una disminuión de la onentraión de N. ) Una disminuión de la temeratura.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
Equilibrio en las reacciones químicas: equilibrio dinámico. Energía de Gibbs y constante de equilibrio
 Equilibrio en las reaiones químias: equilibrio dinámio Constante t de equilibrio: i eq,, Control inétio y ontrol termodinámio Coiente de reaión Priniio de Le Châtelier Energía de Gibbs y onstante de equilibrio
Equilibrio en las reaiones químias: equilibrio dinámio Constante t de equilibrio: i eq,, Control inétio y ontrol termodinámio Coiente de reaión Priniio de Le Châtelier Energía de Gibbs y onstante de equilibrio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 6, Oión A Reserva, Ejeriio 3, Oión A Reserva, Ejeriio 5, Oión B Reserva 3, Ejeriio 3, Oión A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 006 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 6, Oión A Reserva, Ejeriio 3, Oión A Reserva, Ejeriio 5, Oión B Reserva 3, Ejeriio 3, Oión A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 005 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Oión B Junio, Ejeriio 6, Oión B Reserva 1, Ejeriio 3, Oión A Reserva 1, Ejeriio 5, Oión B Reserva, Ejeriio
EJERCICIOS DE EQUILIBRIO QUÍMICO. R// a)0,8 moles, 2,4 moles, 0,4 moles, 2,22 atm, 6,66 atm, 1,11 atm. b)kp= 1,
 EJERCICIS DE EQUILIBRI QUÍMIC 1-.- A 70ºC se mezlan 1 mol de N y moles de H, al llegar al equilibrio, se han formado 0, moles de NH, y la resión es de 10 atm. Hallar: a) los moles de ada gas y la resión
EJERCICIS DE EQUILIBRI QUÍMIC 1-.- A 70ºC se mezlan 1 mol de N y moles de H, al llegar al equilibrio, se han formado 0, moles de NH, y la resión es de 10 atm. Hallar: a) los moles de ada gas y la resión
EQUILIBRIO QUÍMICO QCA 04 ANDALUCÍA
 1.- Considérese el siguiente sistema en equilibrio: SO 3 (g) SO (g) + 1/ O (g) H > 0 Justifique la veraidad o falsedad de las siguientes afirmaiones: a) Al aumentar la onentraión de oxígeno, el equilibrio
1.- Considérese el siguiente sistema en equilibrio: SO 3 (g) SO (g) + 1/ O (g) H > 0 Justifique la veraidad o falsedad de las siguientes afirmaiones: a) Al aumentar la onentraión de oxígeno, el equilibrio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2001 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 001 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 3, Opión B Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión A Reserva 1, Ejeriio
PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 001 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 3, Opión B Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión A Reserva 1, Ejeriio
2.1. CONSTANTE DE EQUILIBRIO. LEY DE ACCIÓN DE MASAS. Si tenemos un proceso químico expresado de forma general como: c C (g) + d D (g)
 Las reaiones químias se pueden dividir en reversibles e irreversibles, según puedan transurrir en los dos sentidos o en uno sólo. En las reaiones reversibles tanto las sustanias reaionantes omo los produtos
Las reaiones químias se pueden dividir en reversibles e irreversibles, según puedan transurrir en los dos sentidos o en uno sólo. En las reaiones reversibles tanto las sustanias reaionantes omo los produtos
Equilibrio Químico (I) Kc. Cociente de reacción
 K. Coiente de reaión IES La Magdalena. Avilés. Asturias Cuando se lleva a abo una reaión químia podemos enontrarnos on las siguientes situaiones: Las onentraiones iniiales de los reativos van disminuyendo
K. Coiente de reaión IES La Magdalena. Avilés. Asturias Cuando se lleva a abo una reaión químia podemos enontrarnos on las siguientes situaiones: Las onentraiones iniiales de los reativos van disminuyendo
EQUILIBRIO QUÍMICO QCA 01
 1.- En un reiiente de 1L, a 000, se introduen 6 1 10-3 moles de CO y una ierta antidad de H, roduiéndose la reaión: H (g) + CO (g) H O(g) + CO(g) Si uando se alanza el equilibrio, la resión total es de
1.- En un reiiente de 1L, a 000, se introduen 6 1 10-3 moles de CO y una ierta antidad de H, roduiéndose la reaión: H (g) + CO (g) H O(g) + CO(g) Si uando se alanza el equilibrio, la resión total es de
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2011 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Opión A Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión B Reserva 1, Ejeriio 6, Opión B Reserva,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 011 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 3, Opión A Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión B Reserva 1, Ejeriio 6, Opión B Reserva,
La relación que existe entre un cambio de elevación h, en un líquido y un cambio en la presión, Δp, p h [Kg/m 2 ]
![La relación que existe entre un cambio de elevación h, en un líquido y un cambio en la presión, Δp, p h [Kg/m 2 ] La relación que existe entre un cambio de elevación h, en un líquido y un cambio en la presión, Δp, p h [Kg/m 2 ]](/thumbs/62/48298239.jpg) II.3. DESRROLLO DE L RELCION PRESION-ELEVCION es: La relaión que existe entre un ambio de elevaión h, en un líquido un ambio en la resión, Δ, h [Kg/m ].3. Donde γ es el eso eseífio del líquido, esta viene
II.3. DESRROLLO DE L RELCION PRESION-ELEVCION es: La relaión que existe entre un ambio de elevaión h, en un líquido un ambio en la resión, Δ, h [Kg/m ].3. Donde γ es el eso eseífio del líquido, esta viene
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 01 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 5, Opión B Reserva 1, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión A Reserva, Ejeriio 6, Opión B Reserva 3,
PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 01 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 5, Opión B Reserva 1, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión A Reserva, Ejeriio 6, Opión B Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 5, Opión B Reserva 1, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión B Reserva, Ejeriio 6, Opión B Reserva
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 5, Opión B Reserva 1, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión B Reserva, Ejeriio 6, Opión B Reserva
Lección 4. Ecuaciones diferenciales. 4. Propiedades algebraicas de las soluciones. Fórmulas de Abel y Liouville.
 GRADO DE INGENIERÍA AEROESPACIAL. CURSO 0. 4. Proiedades algebraias de las soluiones. Fórmulas de Abel y Liouville. A lo largo de esta seión suondremos que P, Q y R son funiones ontinuas en un intervalo
GRADO DE INGENIERÍA AEROESPACIAL. CURSO 0. 4. Proiedades algebraias de las soluiones. Fórmulas de Abel y Liouville. A lo largo de esta seión suondremos que P, Q y R son funiones ontinuas en un intervalo
TEMA 10: EQUILIBRIO QUÍMICO
 TEMA : EQUILIBRIO QUÍMICO. Conepto de equilibrio químio: reaiones reversibles. Existen reaiones, denominadas irreversibles, que se araterizan por transurrir disminuyendo progresivamente la antidad de sustanias
TEMA : EQUILIBRIO QUÍMICO. Conepto de equilibrio químio: reaiones reversibles. Existen reaiones, denominadas irreversibles, que se araterizan por transurrir disminuyendo progresivamente la antidad de sustanias
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2001 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 001 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 3, Opión B Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión A Reserva 1, Ejeriio
PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 001 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 3, Opión B Junio, Ejeriio 6, Opión B Reserva 1, Ejeriio 3, Opión A Reserva 1, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2015 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 05 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 5, Opión B Reserva, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión B Reserva, Ejeriio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 05 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejeriio 4, Opión A Junio, Ejeriio 5, Opión B Reserva, Ejeriio 6, Opión A Reserva, Ejeriio 3, Opión B Reserva, Ejeriio
Máquinas de combustión interna rotativas:
 67.2/7 UBA Ing. O. Jaimovih Caítulo 16 Máquinas de interna rotativas: Son aquellas en las uales se umlen rátiamente las mismas evoluiones que en las alternativas, es deir, admisión - omresión - igniión,
67.2/7 UBA Ing. O. Jaimovih Caítulo 16 Máquinas de interna rotativas: Son aquellas en las uales se umlen rátiamente las mismas evoluiones que en las alternativas, es deir, admisión - omresión - igniión,
Recursión y Relaciones de Recurrencia. UCR ECCI CI-1204 Matemáticas Discretas M.Sc. Kryscia Daviana Ramírez Benavides
 Reursión y Relaiones de Reurrenia UCR ECCI CI-04 Matemátias Disretas M.S. Krysia Daviana Ramírez Benavides Algoritmos Reursivos Un algoritmo es reursivo si se soluiona un problema reduiéndolo a una instania
Reursión y Relaiones de Reurrenia UCR ECCI CI-04 Matemátias Disretas M.S. Krysia Daviana Ramírez Benavides Algoritmos Reursivos Un algoritmo es reursivo si se soluiona un problema reduiéndolo a una instania
Para aprender Termodinámica resolviendo problemas
 GASES REAES. Fator de ompresibilidad. El fator de ompresibilidad se define omo ( ) ( ) ( ) z = real = real y es funión de la presión, la temperatura y la naturaleza de ada gas. Euaión de van der Waals.
GASES REAES. Fator de ompresibilidad. El fator de ompresibilidad se define omo ( ) ( ) ( ) z = real = real y es funión de la presión, la temperatura y la naturaleza de ada gas. Euaión de van der Waals.
PAU Movimiento Vibratorio Ejercicios resueltos
 PU Moviiento Vibratorio jeriios resueltos 99-009 PU CyL S995 ley Hooke alitud y freuenia Colgado de un soorte hay un resorte de onste = 0 N/ del que uelga una asa de kg. n estas irunsias y en equilibrio,
PU Moviiento Vibratorio jeriios resueltos 99-009 PU CyL S995 ley Hooke alitud y freuenia Colgado de un soorte hay un resorte de onste = 0 N/ del que uelga una asa de kg. n estas irunsias y en equilibrio,
TRANSFERENCIA DE MASA POR CONVECCION
 TRSFERECI DE MS POR COVECCIO Fenómenos de Transorte Ing. Mag. Myriam Villarreal 1 TRSFERECI DE MS POR COVECCIO Es la transferenia de materia que se realiza entre una suerfiie sólida y un fluido en movimiento
TRSFERECI DE MS POR COVECCIO Fenómenos de Transorte Ing. Mag. Myriam Villarreal 1 TRSFERECI DE MS POR COVECCIO Es la transferenia de materia que se realiza entre una suerfiie sólida y un fluido en movimiento
MODELOS DE STOCK ESTOCÁSTICOS
 MODELO DE TOCK ETOCÁTICO DR/3 Modelos de tok Estoástios Modelizaión Cuantitativa: Modelos de eríodo únio y un solo item. Modelos de eríodos fijos y lotes variables. Modelizaión or imulaión de Montearlo:
MODELO DE TOCK ETOCÁTICO DR/3 Modelos de tok Estoástios Modelizaión Cuantitativa: Modelos de eríodo únio y un solo item. Modelos de eríodos fijos y lotes variables. Modelizaión or imulaión de Montearlo:
RESPUESTAS AL PROBLEMARIO No 3, PROPIEDADES COLIGATIVAS
 RESPUESTAS AL PROBLEMARIO No 3, PROPIEDADES COLIGATIVAS. A 80, ºC, punto de ebulliión noral del beneno, la presión de apor de una soluión forada por 3,54 g de dinitrobeneno, C 6H 4(NO ), y 4,6 g de beneno,
RESPUESTAS AL PROBLEMARIO No 3, PROPIEDADES COLIGATIVAS. A 80, ºC, punto de ebulliión noral del beneno, la presión de apor de una soluión forada por 3,54 g de dinitrobeneno, C 6H 4(NO ), y 4,6 g de beneno,
Ciclones. 1.- Descripción.
 Cilones 1.- Desriión. Los ilones son equios meánios estaionarios, amliamente utilizados en la industria, que ermiten la searaión de artíulas de un sólido o de un líquido que se enuentran susendidos en
Cilones 1.- Desriión. Los ilones son equios meánios estaionarios, amliamente utilizados en la industria, que ermiten la searaión de artíulas de un sólido o de un líquido que se enuentran susendidos en
SESIÓN DE APRENDIZAJE
 INSTITUCIÓN EDUCATIVA INMACULADA DE LA MERCED SESIÓN DE APRENDIZAJE APRENDIZAJE ESPERADO Determina la regla de orrespondenia de una funión Representa e Identifia funiones Resuelve operaiones on funiones
INSTITUCIÓN EDUCATIVA INMACULADA DE LA MERCED SESIÓN DE APRENDIZAJE APRENDIZAJE ESPERADO Determina la regla de orrespondenia de una funión Representa e Identifia funiones Resuelve operaiones on funiones
ÁCIDO BASE QCA 09 ANDALUCÍA
 ÁCIDO BASE QCA 9 ANDALUCÍA.- El ph de L de disoluión auosa de hidróxido de litio es. Calule: a) Los gramos de hidróxido que se han utilizado para prepararla. b) El volumen de agua que hay que añadir a
ÁCIDO BASE QCA 9 ANDALUCÍA.- El ph de L de disoluión auosa de hidróxido de litio es. Calule: a) Los gramos de hidróxido que se han utilizado para prepararla. b) El volumen de agua que hay que añadir a
Ley de Acción de masas. Constante de equilibrio.
 Tema 5. Equilibrio Químio Ley e Aión e masas. Constante e equilibrio. Coiente e reaión. Caraterístias el equilibrio químio. Formas e eresar las onstantes e equilibrio y relaiones entre ellas. Grao e isoiaión.
Tema 5. Equilibrio Químio Ley e Aión e masas. Constante e equilibrio. Coiente e reaión. Caraterístias el equilibrio químio. Formas e eresar las onstantes e equilibrio y relaiones entre ellas. Grao e isoiaión.
Ecuación Solución o raíces de una ecuación.
 Euaión Igualdad que ontiene una o más inógnitas Soluión o raíes de una euaión. Valores de las inógnitas que umplen la igualdad. 15 = 3x + 6 15 6 = 3x 9 = 3x 3 = x on Existen diversos métodos de hallar
Euaión Igualdad que ontiene una o más inógnitas Soluión o raíes de una euaión. Valores de las inógnitas que umplen la igualdad. 15 = 3x + 6 15 6 = 3x 9 = 3x 3 = x on Existen diversos métodos de hallar
PRÁCTICA 14 DESPLAZAMIENTO DEL EQUILIBRIO QUÍMICO: EFECTO DE LA CONCENTRACIÓN Y DE LA TEMPERATURA
 PRÁCTICA 14 DESPLAZAMIENTO DEL EQUILIBRIO QUÍMICO: EFECTO DE LA CONCENTRACIÓN Y DE LA TEMPERATURA OBJETIVOS Fijar el onepto de equilibrio químio mediante el estudio experimental de distintas mezlas de
PRÁCTICA 14 DESPLAZAMIENTO DEL EQUILIBRIO QUÍMICO: EFECTO DE LA CONCENTRACIÓN Y DE LA TEMPERATURA OBJETIVOS Fijar el onepto de equilibrio químio mediante el estudio experimental de distintas mezlas de
a) Aumento de la temperatura K c b) Adición de I 2 O 5 (s) Cantidad de I 2 c) Aumento de la presión Cantidad de CO
 1.- Cosidere el siguiete sistema geeral e equilibrio: a A(g) + b B(g) C(g) + d D(g) H < a) Idique razoadamete e qué aso so iguales los valores de las ostates y. b) Justifique ómo afetará al sistema la
1.- Cosidere el siguiete sistema geeral e equilibrio: a A(g) + b B(g) C(g) + d D(g) H < a) Idique razoadamete e qué aso so iguales los valores de las ostates y. b) Justifique ómo afetará al sistema la
TOBERAS Y DIFUSORES. José Agüera Soriano
 TOBERAS Y DIFUSORES José Agüera Soriano 0 Primer riniio ara sistemas abiertos RECORDATORIO euaión de la energía Q h h dq dh d dw t trabajo ténio W d dw W t t W r d d t dw r José Agüera Soriano 0 RECORDATORIO
TOBERAS Y DIFUSORES José Agüera Soriano 0 Primer riniio ara sistemas abiertos RECORDATORIO euaión de la energía Q h h dq dh d dw t trabajo ténio W d dw W t t W r d d t dw r José Agüera Soriano 0 RECORDATORIO
LÍMITES DE FUNCIONES. CONTINUIDAD Y RAMAS INFINITAS Tipos de Discontinuidades en un Punto 1 - Tiene ramas infinitas en un punto
 LÍMITES DE FUNCIONES. CONTINUIDAD Y RAMAS INFINITAS Tipos de Disontinuidades en un Punto - Tiene ramas infinitas en un punto y 5 La reta 5 es una asíntota vertial - Presenta un salto en un punto, si y
LÍMITES DE FUNCIONES. CONTINUIDAD Y RAMAS INFINITAS Tipos de Disontinuidades en un Punto - Tiene ramas infinitas en un punto y 5 La reta 5 es una asíntota vertial - Presenta un salto en un punto, si y
Equilibrio Químico (II) Kp. Principio de Le Chatelier. Mezclas de gases. Presión parcial
 . Priiio de e Chatelier IES a Magdalea. vilés. sturias Mezlas de gases. Presió arial E ua mezla de gases odemos alular la resió total de la mezla si ooemos el úmero total de moles gaseosos ( Tot ) aliado
. Priiio de e Chatelier IES a Magdalea. vilés. sturias Mezlas de gases. Presió arial E ua mezla de gases odemos alular la resió total de la mezla si ooemos el úmero total de moles gaseosos ( Tot ) aliado
CAPITULO 2 CONTROLADORES PID
 CAPITULO CONTROLADORES PID. INTRODUCCIÓN El ontrol automátio de un roeo requiere de un itema que ajute automátiamente una variable del roeo ara mantener otra dentro de límite etableido. Una de la forma
CAPITULO CONTROLADORES PID. INTRODUCCIÓN El ontrol automátio de un roeo requiere de un itema que ajute automátiamente una variable del roeo ara mantener otra dentro de límite etableido. Una de la forma
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA. Ingeniería Química
 UNIVERSIDAD NACIONAL EXERIMENTAL OLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEARTAMENTO DE INGENIERÍA QUÍMICA Ingeniería Químia Unidad III. Balane de materia Sistemas Monofásios Clase
UNIVERSIDAD NACIONAL EXERIMENTAL OLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEARTAMENTO DE INGENIERÍA QUÍMICA Ingeniería Químia Unidad III. Balane de materia Sistemas Monofásios Clase
Intensimetría acústica aplicada al aislamiento sonoro
 4. TEORÍA DEL AILAMIENTO El aislamiento o índie de reduión sonora R, se define omo diez vees el logaritmo del oiente entre la otenia sonora que inide sobre el objeto de rueba que se onsidere,, y la otenia
4. TEORÍA DEL AILAMIENTO El aislamiento o índie de reduión sonora R, se define omo diez vees el logaritmo del oiente entre la otenia sonora que inide sobre el objeto de rueba que se onsidere,, y la otenia
TEMA 6: EQUILIBRIO QUÍMICO
 1. Definiión de equilibrio químio TEM 6: EQUILIBRIO QUÍMICO Hasta ahora has trabajado on la idea de que al mezlar dos reativos en unas ondiiones favorables de presión y temperatura la reaión irá progresando
1. Definiión de equilibrio químio TEM 6: EQUILIBRIO QUÍMICO Hasta ahora has trabajado on la idea de que al mezlar dos reativos en unas ondiiones favorables de presión y temperatura la reaión irá progresando
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 ROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 00 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Oción A Junio, Ejercicio 6, Oción B Reserva 1, Ejercicio 3, Oción A Reserva 1, Ejercicio 5, Oción B Reserva,
ROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 00 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Oción A Junio, Ejercicio 6, Oción B Reserva 1, Ejercicio 3, Oción A Reserva 1, Ejercicio 5, Oción B Reserva,
Cuestiones. Problemas EQUILIBRIO QUÍMICO
 Cuestiones y Problemas EQUILIBRIO QUÍMICO AUTOR: TOMÁS MATA GARCÍA PROBLEMAS 1. En un reipiente de 4 litros, a una ierta temperatura, se introduen las antidades de HCl, O y Cl indiadas en la tabla, estableiéndose
Cuestiones y Problemas EQUILIBRIO QUÍMICO AUTOR: TOMÁS MATA GARCÍA PROBLEMAS 1. En un reipiente de 4 litros, a una ierta temperatura, se introduen las antidades de HCl, O y Cl indiadas en la tabla, estableiéndose
ANÁLISIS DE LA EXTENSIÓN DE LA GRÁFICA DE UNA FUNCIÓN
 ANÁLISIS DE LA EXTENSIÓN DE LA GRÁFICA DE UNA FUNCIÓN Sugerenias al Profesor: Trabajar úniamente on funiones polinomiales y raionales, alarando que generalmente al bosquejar sus gráfias solo se muestra
ANÁLISIS DE LA EXTENSIÓN DE LA GRÁFICA DE UNA FUNCIÓN Sugerenias al Profesor: Trabajar úniamente on funiones polinomiales y raionales, alarando que generalmente al bosquejar sus gráfias solo se muestra
2.4 Transformaciones de funciones
 8 CAPÍTULO Funiones.4 Transformaiones de funiones En esta seión se estudia ómo iertas transformaiones de una funión afetan su gráfia. Esto proporiona una mejor omprensión de ómo grafiar Las transformaiones
8 CAPÍTULO Funiones.4 Transformaiones de funiones En esta seión se estudia ómo iertas transformaiones de una funión afetan su gráfia. Esto proporiona una mejor omprensión de ómo grafiar Las transformaiones
Procedimiento específico: PEMA03V CÁLCULO DE LA DENSIDAD DEL AIRE HÚMEDO. Copia No Controlada. Instituto Nacional de Tecnología Industrial
 Instituto Naional de enología Industrial Centro de Desarrollo e Inestigaión en Físia y Metrología Proedimiento eseífio: PEMA3V CÁLCULO DE LA DENSIDAD DEL AIRE HÚMEDO Reisión: Junio 15 Este doumento se
Instituto Naional de enología Industrial Centro de Desarrollo e Inestigaión en Físia y Metrología Proedimiento eseífio: PEMA3V CÁLCULO DE LA DENSIDAD DEL AIRE HÚMEDO Reisión: Junio 15 Este doumento se
Práctica 3 DETERMINACIÓN DE LA CONSTANTE DE EQUILIBRIO DEL ÁCIDO ACÉTICO MEDIANTE MEDIDAS DE CONDUCTIVIDAD
 Dpto. Cienias Abientales - Área de Quíia Físia Prátia 3 DETERMINACIÓN DE LA CONSTANTE DE EQUILIBRIO DEL ÁCIDO ACÉTICO MEDIANTE MEDIDAS DE CONDUCTIVIDAD 1. Objetivo Se pretende alular el grado de disoiaión
Dpto. Cienias Abientales - Área de Quíia Físia Prátia 3 DETERMINACIÓN DE LA CONSTANTE DE EQUILIBRIO DEL ÁCIDO ACÉTICO MEDIANTE MEDIDAS DE CONDUCTIVIDAD 1. Objetivo Se pretende alular el grado de disoiaión
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2003 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 003 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 6, Oción A Reserva 1, Ejercicio 3, Oción A Reserva 1, Ejercicio 5, Oción B Reserva, Ejercicio 6, Oción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 003 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 6, Oción A Reserva 1, Ejercicio 3, Oción A Reserva 1, Ejercicio 5, Oción B Reserva, Ejercicio 6, Oción
PREGUNTAS DE TEST SOBRE EQUILIBRIOS QUÍMICOS
 REGUNTAS DE TEST SOBRE EQUILIBRIOS QUÍMIS A - DEFINICIONES GENERALES: B - NSTANTES DE EQUILIBRIO: C - RINCIIO DE LE CHATELIER: A - DEFINICIONES GENERALES: A-01 - ara que una reacción química ueda llamarse
REGUNTAS DE TEST SOBRE EQUILIBRIOS QUÍMIS A - DEFINICIONES GENERALES: B - NSTANTES DE EQUILIBRIO: C - RINCIIO DE LE CHATELIER: A - DEFINICIONES GENERALES: A-01 - ara que una reacción química ueda llamarse
Pruebas de Acceso a Ensen anzas Universitarias Oficiales de Grado (PAEG)
 PAEG junio 016 Propuesta B Matemátias II º Bahillerato Pruebas de Aeso a Ensen anzas Universitarias Oiiales de Grado (PAEG) Matemátias II (Universidad de Castilla-La Manha) junio 016 Propuesta B EJERCICIO
PAEG junio 016 Propuesta B Matemátias II º Bahillerato Pruebas de Aeso a Ensen anzas Universitarias Oiiales de Grado (PAEG) Matemátias II (Universidad de Castilla-La Manha) junio 016 Propuesta B EJERCICIO
LEY DE SENOS. Ya hemos visto como resolver triángulos rectángulos ahora veremos todas las técnicas para resolver triángulos generales.
 LEY DE SENOS Ya hemos visto omo resolver triángulos retángulos ahora veremos todas las ténias para resolver triángulos generales a γ α Este es un triángulo el ángulo α se esrie en el vértie de, el ángulo
LEY DE SENOS Ya hemos visto omo resolver triángulos retángulos ahora veremos todas las ténias para resolver triángulos generales a γ α Este es un triángulo el ángulo α se esrie en el vértie de, el ángulo
TEMA V: EQUILIBRIO QUIMICO
 EMA V: EQUILIBRIO QUIMICO 1.- El CO gaseoso se disocia a 1000K según la reacción: CO (g) CO (g) + (g) Calcule el valor de Kp cuando la presión de equilibrio es 1 atm y el grado de disociación del CO es
EMA V: EQUILIBRIO QUIMICO 1.- El CO gaseoso se disocia a 1000K según la reacción: CO (g) CO (g) + (g) Calcule el valor de Kp cuando la presión de equilibrio es 1 atm y el grado de disociación del CO es
j Sigue practicando El trabajo de extracción es: = hf = 6,62 10 J s 9,38 10 s = 6,21 10 J
 FÍSICA RELATIVISTA Y FÍSICA CUÁNTICA 99 j Sigue ratiando Un otón de luz roja de 700 nm de longitud de onda tiene una energía igual a,4 0 9 J Cuál es la energía de un otón de luz erde de 550 nm? La relaión
FÍSICA RELATIVISTA Y FÍSICA CUÁNTICA 99 j Sigue ratiando Un otón de luz roja de 700 nm de longitud de onda tiene una energía igual a,4 0 9 J Cuál es la energía de un otón de luz erde de 550 nm? La relaión
Solución: Observamos que los números de la sucesión se pueden escribir de la siguiente L de esta manera la suma de los primeros
 roblema : uánto suman los primeros 008 términos de la suesión 0,,,,, L? Soluión: Observamos que los números de la suesión se pueden esribir de la siguiente 0 manera,,,,, L de esta manera la suma de los
roblema : uánto suman los primeros 008 términos de la suesión 0,,,,, L? Soluión: Observamos que los números de la suesión se pueden esribir de la siguiente 0 manera,,,,, L de esta manera la suma de los
PROBLEMAS DEL TEMA 1: CIRCUITOS ELÉCTRICOS EN AC. Problemas de reactancias
 ey Juan Carlos POBEMAS DE TEMA : CICUITOS EÉCTICOS EN AC Problemas de reatanias Problema 4. Una bobina on = 5 mh se oneta a un generador de tensión alterna sinusoidal de V ef = 80 V. Calula la reatania
ey Juan Carlos POBEMAS DE TEMA : CICUITOS EÉCTICOS EN AC Problemas de reatanias Problema 4. Una bobina on = 5 mh se oneta a un generador de tensión alterna sinusoidal de V ef = 80 V. Calula la reatania
REPARTIDO EQUILIBRIO
 REPARTIDO 6 007 EQUILIBRIO Bibliografía: - Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B. Bursten. Ed. Prentice-Hall, México, 1998, 7 ma Ed. Caítulo 15, ágs. 539-565 Caítulo 16, ágs. 573-605
REPARTIDO 6 007 EQUILIBRIO Bibliografía: - Química, La Ciencia Central, T.L.Brown, H.E.LeMay, Jr., B. Bursten. Ed. Prentice-Hall, México, 1998, 7 ma Ed. Caítulo 15, ágs. 539-565 Caítulo 16, ágs. 573-605
Guía # 5. Pruebas de hipótesis
 INSTITUCION UNIVERSITARIA ANTONIO JOSÉ CAMACHO Asignatura: ESTADÍSTICA APLICADA 010-1 Guía # 5. Pruebas de hipótesis Temas: Pruebas de hipótesis para la media poblaional (µ) Pruebas de hipótesis para la
INSTITUCION UNIVERSITARIA ANTONIO JOSÉ CAMACHO Asignatura: ESTADÍSTICA APLICADA 010-1 Guía # 5. Pruebas de hipótesis Temas: Pruebas de hipótesis para la media poblaional (µ) Pruebas de hipótesis para la
LA INCERTIDUMBRE DE MEDICIÓN EN EL CONTROL ESTADÍSTICO DE PROCESOS
 Simosio de Metrología 004 5 al 7 de Otubre LA INCETIDUMBE DE MEDICIÓN EN EL CONTOL ESTADÍSTICO DE POCESOS Enrique Villa Dihare Centro de Investigaión en Matemátias, A. C. Jaliso s/n, Mineral de Valeniana,
Simosio de Metrología 004 5 al 7 de Otubre LA INCETIDUMBE DE MEDICIÓN EN EL CONTOL ESTADÍSTICO DE POCESOS Enrique Villa Dihare Centro de Investigaión en Matemátias, A. C. Jaliso s/n, Mineral de Valeniana,
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE. septiembre 2013 QUÍMICA. CÓDIGO 160
 PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE Opión A: septiembre 2013 QUÍMICA. CÓDIGO 160 1. Dadas las siguientes onfiguraiones eletrónias de dos elementos A: [Ne]3s 2 3p 1 y B:[Ne]3s
PRUEBAS DE ACCESO A LA UNIVERSIDAD PARA ALUMNOS DE BACHILLERATO LOE Opión A: septiembre 2013 QUÍMICA. CÓDIGO 160 1. Dadas las siguientes onfiguraiones eletrónias de dos elementos A: [Ne]3s 2 3p 1 y B:[Ne]3s
Ecuaciones de primer grado
 Euaiones de primer grado. Resuelve las siguientes euaiones de primer grado on paréntesis. 3( + ) + ( 3 ) = 7 3( ) ( 3 ) ( + ) = 3( ) ( + ) ( + 3) = 3 + = 5 ( 7 ). Resuelve las siguientes euaiones de primer
Euaiones de primer grado. Resuelve las siguientes euaiones de primer grado on paréntesis. 3( + ) + ( 3 ) = 7 3( ) ( 3 ) ( + ) = 3( ) ( + ) ( + 3) = 3 + = 5 ( 7 ). Resuelve las siguientes euaiones de primer
CONJUNTOS. Según se ha visto en el ejercicio anterior, para que la intersección de dos conjuntos A y B sea A, se tiene que verificar que A B.
 CONJUNTOS 1. Si se umple: a) = b) = ) = (Convoatoria junio 2001. Examen tipo E ) Es laro que la opión orreta es la a). Cuando un onjunto está dentro de otro, la interseión es el onjunto pequeño y la unión
CONJUNTOS 1. Si se umple: a) = b) = ) = (Convoatoria junio 2001. Examen tipo E ) Es laro que la opión orreta es la a). Cuando un onjunto está dentro de otro, la interseión es el onjunto pequeño y la unión
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2016 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO
 PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 016 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Juio, Ejeriio 6, Oió A Reserva, Ejeriio 5, Oió B Reserva 3, Ejeriio 3, Oió A Reserva 3, Ejeriio 6, Oió B Setiembre, Ejeriio
PROBLEMAS RESUELOS SELECIVIDAD ANDALUCÍA 016 QUÍMICA EMA 5: EQUILIBRIO QUÍMICO Juio, Ejeriio 6, Oió A Reserva, Ejeriio 5, Oió B Reserva 3, Ejeriio 3, Oió A Reserva 3, Ejeriio 6, Oió B Setiembre, Ejeriio
EQUILIBRIO QUÍMICO. Concentraciones molares, presiones y constantes K c y K p.
 EQUILIBRIO QUÍMICO Concentraciones molares, presiones y constantes K c y K p. 1.- La formación del N 2 O 4 se explica mediante las dos reacciones siguientes: 2 NO (g) + O 2 (g) 2 NO 2 (g); 2 NO 2 (g) N
EQUILIBRIO QUÍMICO Concentraciones molares, presiones y constantes K c y K p. 1.- La formación del N 2 O 4 se explica mediante las dos reacciones siguientes: 2 NO (g) + O 2 (g) 2 NO 2 (g); 2 NO 2 (g) N
1. Propiedades de la Presión Hidrostática.
 Tema. Hidrostátia. Proiedades de la Presión Hidrostátia.. Euaión fundamental de la Hidrostátia.. Presión Hidrostátia en los líquidos. Euaión de equilirio de los líquidos esados. ota ieométria. 4. Suerfiie
Tema. Hidrostátia. Proiedades de la Presión Hidrostátia.. Euaión fundamental de la Hidrostátia.. Presión Hidrostátia en los líquidos. Euaión de equilirio de los líquidos esados. ota ieométria. 4. Suerfiie
A'' D'' C'' B'' A' C' Figura 1. Verdadera Magnitud de ángulos de rectas.
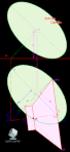 Tema 5: Ángulos entre retas y planos. Triedros Angulo de dos retas. El ángulo de dos retas es una de las magnitudes de las formas planas, y para obtener su verdadera magnitud se aplia el ambio de plano,
Tema 5: Ángulos entre retas y planos. Triedros Angulo de dos retas. El ángulo de dos retas es una de las magnitudes de las formas planas, y para obtener su verdadera magnitud se aplia el ambio de plano,
Calor específico Calorimetría
 Calor espeíio Calorimetría Físia II Lieniatura en Físia 2003 Autores: Andrea Fourty María de los Angeles Bertinetti Adriana Foussats Calor espeíio y alorimetría Cátedra Físia II (Lieniatura en Físia) 1.-
Calor espeíio Calorimetría Físia II Lieniatura en Físia 2003 Autores: Andrea Fourty María de los Angeles Bertinetti Adriana Foussats Calor espeíio y alorimetría Cátedra Físia II (Lieniatura en Físia) 1.-
LECCIÓN 44A EXPRESIONES ALGEBRAICAS
 LECCIÓN 44A EXPRESIONES ALGEBRAICAS Las exresiones algebraicas son como las exresiones numéricas que vimos en la lección anterior exceto que usted uede usar letras y números en tales exresiones. Para resolver,
LECCIÓN 44A EXPRESIONES ALGEBRAICAS Las exresiones algebraicas son como las exresiones numéricas que vimos en la lección anterior exceto que usted uede usar letras y números en tales exresiones. Para resolver,
En el sistema S las fórmulas de aberración relativista y efecto Doppler dan
 FÍSICA TEÓRICA 1 2do. Cuatrimestre 2015 Fresnel relativista Guía 6, problema 3 Se trata de enontrar las ondas reflejadas y transmitidas en el sistema del laboratorio uando una onda plana inide sobre la
FÍSICA TEÓRICA 1 2do. Cuatrimestre 2015 Fresnel relativista Guía 6, problema 3 Se trata de enontrar las ondas reflejadas y transmitidas en el sistema del laboratorio uando una onda plana inide sobre la
Ejercicios de Matrices, determinantes y sistemas de ecuaciones lineales. Álgebra 2008
 Ejeriios de Matries, deterinantes sisteas de euaiones lineales. Álgebra 8 - Dado el sistea de euaiones lineales 5 (a) ['5 puntos] Clasifíalo según los valores del paráetro λ. (b) [ punto] Resuélvelo para
Ejeriios de Matries, deterinantes sisteas de euaiones lineales. Álgebra 8 - Dado el sistea de euaiones lineales 5 (a) ['5 puntos] Clasifíalo según los valores del paráetro λ. (b) [ punto] Resuélvelo para
PROBLEMAS DE FLUIDOS ( )
 ROBLEMA DE FLUIDO (-) riniio de Arquímedes FLUIDO. Un sólido metálio se susende de un dinamómetro y se mide su eso, que resulta ser de.5 N. eguidamente se somete a las siguientes oeraiones:. El sólido
ROBLEMA DE FLUIDO (-) riniio de Arquímedes FLUIDO. Un sólido metálio se susende de un dinamómetro y se mide su eso, que resulta ser de.5 N. eguidamente se somete a las siguientes oeraiones:. El sólido
AN ALISIS MATEM ATICO B ASICO. C ALCULO DE PRIMITIVAS. FUNCIONES RACIONALES.
 AN ALISIS MATEM ATICO B ASICO. C ALCULO DE PRIMITIVAS. FUNCIONES RACIONALES. Cuando tenemos el problema de alular la primitiva de una funion raional P (x) an x n + a n x n + + a x + a 0 b m x m + b m x
AN ALISIS MATEM ATICO B ASICO. C ALCULO DE PRIMITIVAS. FUNCIONES RACIONALES. Cuando tenemos el problema de alular la primitiva de una funion raional P (x) an x n + a n x n + + a x + a 0 b m x m + b m x
EQUILIBRIO QUÍMICO SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD. para cada una de las siguientes reacciones reversibles: O (g) FNO. p p.
 8 EQUILIBRIO QUÍMICO SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Constante de equilibrio 1 Escribe la eresión de las constantes de equilibrio K y K c ara cada una de las siguientes reacciones reversibles:
8 EQUILIBRIO QUÍMICO SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Constante de equilibrio 1 Escribe la eresión de las constantes de equilibrio K y K c ara cada una de las siguientes reacciones reversibles:
7.2 Equilibrio químico
 70 t 1/ ln ln. (7.19) k Aexp E ( RT ) Despejando la temperatura de la euaión (7.19), y sustituyendo los valores dados, nos queda: -1 Ea 11700 J.mol T 30. ln -1-1 0,693 Rln 8,3144 J.mol. ln 1-1 6,19 10
70 t 1/ ln ln. (7.19) k Aexp E ( RT ) Despejando la temperatura de la euaión (7.19), y sustituyendo los valores dados, nos queda: -1 Ea 11700 J.mol T 30. ln -1-1 0,693 Rln 8,3144 J.mol. ln 1-1 6,19 10
Fórmula integral de Cauchy
 Fórmula integral de Cauhy Fórmula integral de Cauhy. Si una funión f es analítia en una región que ontiene a urva simple errada y a su interior, entones para ada punto z 0 enerrado por, dz = 2πi f(z 0
Fórmula integral de Cauhy Fórmula integral de Cauhy. Si una funión f es analítia en una región que ontiene a urva simple errada y a su interior, entones para ada punto z 0 enerrado por, dz = 2πi f(z 0
3. PRIMERA LEY DE LA TERMODINÁMICA EN SISTEMAS CERRADOS
 3. PRIMERA LEY DE LA TERMODINÁMICA EN SISTEMAS CERRADOS En todo lo que sigue no hay ambios en la masa del sistema termodinámio que estamos estudiando, o en otras alabras el número de moléulas del sistema
3. PRIMERA LEY DE LA TERMODINÁMICA EN SISTEMAS CERRADOS En todo lo que sigue no hay ambios en la masa del sistema termodinámio que estamos estudiando, o en otras alabras el número de moléulas del sistema
DEPARTAMENTO DE INGENIERÍA QUÍMICA Y AMBIENTAL
 www.upt.es DEARTAMENTO DE INGENIERÍA QUÍMICA Y AMBIENTAL BLOQUE ENERGÍA Y DINÁMICA 8 DE LAS REACCIONES QUÍMICAS EQUILIBRIO QUÍMICO Objetivos 1. Conoer los proesos inámios que tienen lugar en el equilibrio
www.upt.es DEARTAMENTO DE INGENIERÍA QUÍMICA Y AMBIENTAL BLOQUE ENERGÍA Y DINÁMICA 8 DE LAS REACCIONES QUÍMICAS EQUILIBRIO QUÍMICO Objetivos 1. Conoer los proesos inámios que tienen lugar en el equilibrio
Ley del Coseno 1. Ley del Coseno. Dado un triángulo ABC, con lados a, b y c, se cumple la relación:
 Ley del Coseno 1 Ley del Coseno Dado un triángulo ABC, on lados a, b y, se umple la relaión: = a + b abosc (Observe que la relaión es simétria para los otros lados del triángulo.) Para demostrar este teorema,
Ley del Coseno 1 Ley del Coseno Dado un triángulo ABC, on lados a, b y, se umple la relaión: = a + b abosc (Observe que la relaión es simétria para los otros lados del triángulo.) Para demostrar este teorema,
EJERCICIOS RESUELTOS TEMA 5
 Fundaento Quíio 1º Ineniería énia Aríola EJECICIO EUELO EMA 5 1.- A 2 ºC la preión de vapor del éter etílio (C 4 H 1 O) e iual a 44 H. Calular la preión de vapor de una dioluión que ontiene 54 de anilina
Fundaento Quíio 1º Ineniería énia Aríola EJECICIO EUELO EMA 5 1.- A 2 ºC la preión de vapor del éter etílio (C 4 H 1 O) e iual a 44 H. Calular la preión de vapor de una dioluión que ontiene 54 de anilina
-14 - ENTALPÍA DE FUSIÓN DEL HIELO
 -4 - ENTALPÍA DE FUSIÓN DEL HIELO OBJETIVO Determinar la entalpía de usión del hielo utilizando el método de las mezlas. Previamente, ha de determinarse el equivalente en agua del alorímetro, K, para uantiiar
-4 - ENTALPÍA DE FUSIÓN DEL HIELO OBJETIVO Determinar la entalpía de usión del hielo utilizando el método de las mezlas. Previamente, ha de determinarse el equivalente en agua del alorímetro, K, para uantiiar
MODELOS DE PROBABILIDAD II
 MODELOS DE PROBABILIDAD II DISTRIBUCIÓN GEOMÉTRICA DISTRIBUCIÓN BINOMIAL NEGATIVA DISTRIBUCIÓN HIPERGEOMÉTRICA DISTRIBUCIÓN DE PÓLYA INTRODUCCIÓN A LA ESTIMACIÓN BAYESIANA DE PROPORCIONES DISTRIBUCIÓN
MODELOS DE PROBABILIDAD II DISTRIBUCIÓN GEOMÉTRICA DISTRIBUCIÓN BINOMIAL NEGATIVA DISTRIBUCIÓN HIPERGEOMÉTRICA DISTRIBUCIÓN DE PÓLYA INTRODUCCIÓN A LA ESTIMACIÓN BAYESIANA DE PROPORCIONES DISTRIBUCIÓN
10. GASES Y FLUIDOS REALES
 10. GASES Y FLUIDOS REALES En caítulos anteriores estudiamos las consecuencias de la Primera y Segunda Ley y los métodos analíticos ara alicar la ermodinámica a sistemas físicos. De ahora en más usaremos
10. GASES Y FLUIDOS REALES En caítulos anteriores estudiamos las consecuencias de la Primera y Segunda Ley y los métodos analíticos ara alicar la ermodinámica a sistemas físicos. De ahora en más usaremos
Donde: M = es la molaridad (mol l -1 )
 Exresiones de Concentración en Términos de la Cantidad de Soluto or Cantidad de Disolución Vale la ena recordar aquí que un mol es la cantidad de sustancia que contiene el número de Avogadro (NA) de artículas
Exresiones de Concentración en Términos de la Cantidad de Soluto or Cantidad de Disolución Vale la ena recordar aquí que un mol es la cantidad de sustancia que contiene el número de Avogadro (NA) de artículas
1 2 +! $ = # 1$ $ Pensamiento Algebraico GUÍA DE PARA LOS ASPIRANTES A LA MME Temas que debe dominar:
 Pensamiento lgebraio Temas que debe dominar: GUÍ DE PR LOS SPIRNTES L MME-06 Definiión, operaiones y propiedades de: Números Naturales Números Enteros Números raionales Números irraionales Números omplejos
Pensamiento lgebraio Temas que debe dominar: GUÍ DE PR LOS SPIRNTES L MME-06 Definiión, operaiones y propiedades de: Números Naturales Números Enteros Números raionales Números irraionales Números omplejos
Química 2º Bach 1º 3ª evaluación.
 Química º Bach 1º ª evaluación. Nombre Núm lase Fecha Nota 0-marzo- 017 /8 1) Estamos investigando sobre el mecanismo de reacción del roceso: (1,5 ; 0,5 cada aartado) NO5 4 NO O y tenemos dos mecanismos
Química º Bach 1º ª evaluación. Nombre Núm lase Fecha Nota 0-marzo- 017 /8 1) Estamos investigando sobre el mecanismo de reacción del roceso: (1,5 ; 0,5 cada aartado) NO5 4 NO O y tenemos dos mecanismos
Introducción a la Termodinámica de Materiales Dra. Stella Ordoñez
 : REACCIONES QUE INVOLUCRAN GASES 0.. INTRODUCCIÓN En el caítulo VIII se vio que la ausencia de fuerzas interatómicas entre los átomos de los gases ideales rovoca que el calor de mezcla de estos gases
: REACCIONES QUE INVOLUCRAN GASES 0.. INTRODUCCIÓN En el caítulo VIII se vio que la ausencia de fuerzas interatómicas entre los átomos de los gases ideales rovoca que el calor de mezcla de estos gases
* FUERZAS EN VIGAS Y CABLES
 UNIVERSIDAD NAIONAL DEL ALLAO FAULTAD DE INGENIERÍA ELÉTRIA Y ELETRÓNIA ESUELA PROFESIONAL DE INGENIERÍA ELÉTRIA * FUERZAS EN VIGAS Y ALES ING. JORGE MONTAÑO PISFIL ALLAO, 1 FUERZAS EN VIGAS Y ALES 1.
UNIVERSIDAD NAIONAL DEL ALLAO FAULTAD DE INGENIERÍA ELÉTRIA Y ELETRÓNIA ESUELA PROFESIONAL DE INGENIERÍA ELÉTRIA * FUERZAS EN VIGAS Y ALES ING. JORGE MONTAÑO PISFIL ALLAO, 1 FUERZAS EN VIGAS Y ALES 1.
Capítulo 6 Acciones de control
 Capítulo 6 Aiones de ontrol 6.1 Desripión de un bule de ontrol Un bule de ontrol por retroalimentaión se ompone de un proeso, el sistema de mediión de la variable ontrolada, el sistema de ontrol y el elemento
Capítulo 6 Aiones de ontrol 6.1 Desripión de un bule de ontrol Un bule de ontrol por retroalimentaión se ompone de un proeso, el sistema de mediión de la variable ontrolada, el sistema de ontrol y el elemento
2. CARGA Y DESCARGA DE UN CONDENSADOR
 2. ARGA Y DESARGA DE UN ONDENSADOR a. PROESO DE ARGA La manera más senilla de argar un ondensador de apaidad es apliar una diferenia de potenial V entre sus terminales mediante una fuente de.. on ello,
2. ARGA Y DESARGA DE UN ONDENSADOR a. PROESO DE ARGA La manera más senilla de argar un ondensador de apaidad es apliar una diferenia de potenial V entre sus terminales mediante una fuente de.. on ello,
Ejercicios de Arquitectura de Computadoras
 Ejeriios de Arquitetura de Computadoras José Garzía 9 Arquitetura de Computadora Ejeriios de la Seión de Proesamiento Explique qué es el rebose uando se suman dos números sin signo y ómo puede ser detetado
Ejeriios de Arquitetura de Computadoras José Garzía 9 Arquitetura de Computadora Ejeriios de la Seión de Proesamiento Explique qué es el rebose uando se suman dos números sin signo y ómo puede ser detetado
Momentos de Inercia de cuerpos sólidos: EJE. Varilla delgada. Disco. Disco. Cilíndro. Esfera. Anillo I = MR
 91 Momentos de Ineria de uerpos sólidos: EJE Varilla delgada 1 I = ML 1 Diso 1 I = M Diso 1 I = M 4 ilíndro 1 I = M Esfera I = M 5 Anillo I = M 9 Observaión: Los momentos de ineria on respeto a ejes paralelos
91 Momentos de Ineria de uerpos sólidos: EJE Varilla delgada 1 I = ML 1 Diso 1 I = M Diso 1 I = M 4 ilíndro 1 I = M Esfera I = M 5 Anillo I = M 9 Observaión: Los momentos de ineria on respeto a ejes paralelos
Modulo de Desigualdades e Inecuaciones. 3º Medio
 Modulo de Desigualdades e Ineuaiones. º Medio TEMA : Orden, Valor Absoluto y sus propiedades Definiión : La desigualdad a < b es una relaión de orden en el universo de los números reales. Por lo tanto
Modulo de Desigualdades e Ineuaiones. º Medio TEMA : Orden, Valor Absoluto y sus propiedades Definiión : La desigualdad a < b es una relaión de orden en el universo de los números reales. Por lo tanto
GRADO EN FARMACIA. Asignatura: FISICA APLICADA GUIA DE ESTUDIO UNIDAD 1. ENERGIA Y TERMODINAMICA
 GRADO EN FARMAIA Asignatura: FIIA APLIADA Año aadémio: 03-04 GIA DE EDIO. Energía. rabajo. Ley de onservaión de la energía 3. alor. Equilibrio térmio 4. Introduión a la ermodinámia 5. Primer Priniio de
GRADO EN FARMAIA Asignatura: FIIA APLIADA Año aadémio: 03-04 GIA DE EDIO. Energía. rabajo. Ley de onservaión de la energía 3. alor. Equilibrio térmio 4. Introduión a la ermodinámia 5. Primer Priniio de
6. Acción de masas y dependencia del potencial químico con la concentración
 6 Aión de masas y dependenia del potenial químio on la onentraión Tema: Dependenia del potenial químio on la onentraión y apliaiones más importantes 61 El onepto de aión de masas Desde hae muho tiempo
6 Aión de masas y dependenia del potenial químio on la onentraión Tema: Dependenia del potenial químio on la onentraión y apliaiones más importantes 61 El onepto de aión de masas Desde hae muho tiempo
Núcleo e Imagen de una Transformación Lineal
 Núleo e Imagen de una Transformaión Lineal Departamento de Matemátias CCIR/ITESM 8 de junio de Índie 7.. Núleo de una transformaión lineal................................. 7.. El núleo de una matri la
Núleo e Imagen de una Transformaión Lineal Departamento de Matemátias CCIR/ITESM 8 de junio de Índie 7.. Núleo de una transformaión lineal................................. 7.. El núleo de una matri la
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS. Fracciones continuas, ecuación de Pell y unidades en el anillo de enteros de los cuerpos cuadráticos
 UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS FACULTAD DE CIENCIAS MATEMÁTICAS EAP DE MATEMÁTICA PURA Fracciones continuas, ecuación de Pell y unidades en el anillo de enteros de los cueros cuadráticos Caítulo
UNIVERSIDAD NACIONAL MAYOR DE SAN MARCOS FACULTAD DE CIENCIAS MATEMÁTICAS EAP DE MATEMÁTICA PURA Fracciones continuas, ecuación de Pell y unidades en el anillo de enteros de los cueros cuadráticos Caítulo
 www.viakon.om 60 6 RESISTENCIA ELECTRICA CA, REACTANCIA INDUCTIVA E IMPEDANCIA PARA CABLES DE V, OPERANDO A o C EN UN SISTEMA TRIFASICO A 60 HZ: 3 CABLES UNIPOLARES EN UN MISMO DUCTO AWG/ kmil Reatania
www.viakon.om 60 6 RESISTENCIA ELECTRICA CA, REACTANCIA INDUCTIVA E IMPEDANCIA PARA CABLES DE V, OPERANDO A o C EN UN SISTEMA TRIFASICO A 60 HZ: 3 CABLES UNIPOLARES EN UN MISMO DUCTO AWG/ kmil Reatania
