51 Int. CI.: C12R 1/885 ( ) A01N 63/00 ( ) TRADUCCIÓN DE PATENTE EUROPEA
|
|
|
- Alfredo Montero Álvarez
- hace 7 años
- Vistas:
Transcripción
1 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: Int. CI.: C12N 1/14 (06.01) A01N 63/00 (06.01) C12R 1/88 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Fecha de presentación y número de la solicitud europea: E (7) 97 Fecha y número de publicación de la concesión europea: EP Título: Cepa de Trichoderma atroviride, método de aislamiento de dicha cepa, método de obtención de un producto basado en dicha cepa y uso de dicha cepa Prioridad: FR Fecha de publicación y mención en BOPI de la traducción de la patente: Titular/es: AGROLOR CENTRE D'AFFAIRES "LE CAHN" (0.0%) 17 RUE LAURENT BONNEVAY NANCY, FR 72 Inventor/es: DHUICQ, LAURENT 74 Agente/Representante: LAZCANO GAINZA, Jesús ES T3 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art del Convenio sobre concesión de Patentes Europeas).
2 E DESCRIPCIÓN Cepa de Trichoderma atroviride, método de aislamiento de dicha cepa, método de obtención de un producto basado en dicha cepa y uso de dicha cepa La presente invención está relacionada con la utilización de la especie Trichoderma atroviride contra las enfermedades de las plantas, y más particularmente una nueva cepa de Trichoderma atroviride, denominada AGR2, y su utilización como producto fitosanitario destinado a la protección de los cultivos contra las enfermedades criptogámicas, específicamente para la vid. La nueva cepa de Trichoderma atroviride AGR2 fue aislada de un suelo francés cultivado y presentada ante la Colección Nacional de Cultivo de Microorganismos (CNCM) del Instituto Pasteur con el número I-2738, el 19 de octubre de 01. Los hongos del género Trichoderma se usan generalmente como productos de base para innumerables preparaciones fitosanitarias, destinadas al tratamiento de enfermedades criptogámicas. De esta forma, la patente FR describe una composición de microorganismos utilizada para combatir determinadas enfermedades criptogámicas que afectan la vid, como son los casos de la esca o la eutipiosis. Esta composición está constituida por una mezcla de una bacteria, una levadura y un hongo, específicamente una cepa de Trichoderma. La patente FR describe una cepa particular de Trichoderma harzanium que constituye la base de un producto fitosanitario destinado a la lucha biológica de enfermedades criptogámicas de la madera de la vid, como la esca o el eutipiosis. El documento Elmer P A G ET AL. : «Biosuppression of Botrytis cinerea in grapes» PLANT PATHOLOGY (OXFORD), vol., no. 2, abril 06, páginas 1-177, describe la utilización de Trichoderma atroviride LC2 en la lucha contra las enfermedades de las plantas, en particular contra Botrytis cinerea. El documento JP describe la utilización de Trichoderma atroviride SKT-1, SKT-2 y SKT-3 en la lucha contra las enfermedades de las plantas. El documento EP describe la utilización de la especie Trichoderma atroviride en la lucha contra las enfermedades de las plantas, como el producto fitosanitario por pulverización, como el producto fitosanitario constituido por este microorganismo solamente y como el producto destinado a la simulación en las raíces, la germinación y el crecimiento de las plantas. El documento Schubert Mark «in vitro und ad planta Studien zum Einsatz von Trichoderma-Arten für die Biologische Kontrolle Holz abbauender Pilze an Bäumen" 06, Freiburg im Breisgau Extrait de l Internet: URL: divulga un estudio sobre el empleo de diversas cepas de Trichoderma para control biológico de hongos linofagos en los árboles. La presente invención propone la especie Trichoderma atroviride así como una nueva cepa de Trichoderma atroviride y su utilización, sola o en un producto fitosanitario, para la protección de los cultivos contra las enfermedades criptogámicas, específicamente para la vid contra las enfermedades de la madera: - la Esca, debido a un complejo fúngico, compuesto de dos categorías de hongos, los hongos pioneros (Eutypa lata, Phaemoniella chlamydospora, Phaeoacremonium aleophilum) y los hongos secundarios (Fomitiporia punctata, Stereum hirsutum), - Brazo Negro Muerto, causado por Botryosphaeria dothidea, B. stevensii, Botryophaeria spp, - Eutipiosis causado por un solo hongo, Eutypa tata, que penetra en la madera a partir de las heridas ocasionadas por cortes, causando un debilitamiento de la madera, - y Excoriosis debido a Phomopsis viticola. Según la invención la especie Trichoderma atroviride en general así como la nueva cepa AGR2 en particular permiten igualmente luchar contra las enfermedades criptogámicas para todos los cultivos, específicamente: - el Moho gris debido a Botrytis cinérea, B. aili, - la Esclerotinia debido a S. sclerotiorum, S. minor, S. cepivorum, - la Fusariosa debido a Microdocchium nivale, F. oxysporum, - la Armillaira debido a Armillaria mella. Para este fin, la presente invención tiene como objeto la utilización de la especie Trichoderma atroviride en la lucha contra las enfermedades de las plantas. 2
3 E La misma se relaciona igualmente con una cepa de Trichoderma atroviride caracterizada porque se trata de la cepa de Trichoderma atroviride AGR2 presentada ante en la Colección Nacional de Cultivo de Microorganismos (CNCM) del Instituto Pasteur con el número I La cepa de Trichoderma atroviride AGR2 según la invención fue identificada por medio de diversos métodos. La observación microscópica de la morfología, de la medición de los elementos conidiógenos y de las conidias globulosas no ornamentales, así como un olor característico arrojó como conclusión un hongo de la especie Trichoderma atroviride. La identificación de la cepa fue más depurada por un análisis molecular basado en la secuencia de la región ITS1-ITS2 des ARNr (ácido ribonucleico ribosomal) 18S y 2S. Una comparación de las homologías de dichas regiones con la secuencia de la cepa de referencia de la especie permite identificar la cepa como un hongo de la especie Trichoderma atroviride. Las técnicas moleculares, en particular la secuenciación del gen EF1α, permiten identificar sin ambigüedad la especie como un Trichoderma atroviride seguido de una comparación de la secuencia del gen con el de la especie de referencia. Por otra parte, la prueba de detección denominada «test 11» resulta positiva, confirmando así la pertenencia de la cepa a la especie Trichoderma atroviride. Como conclusión, dicha cepa de hongo se ubica así en la taxonomía de los microorganismos : Eucaryota, Fungi, Ascomycota, Pezizomycotina, Sordariomycetes, Hypocreomycetidae, Hypocreales, Hypocreaceae, Hypocrea, Trichoderma atroviride. El aislamiento del género Trichoderma puede realizarse a partir de una muestra de tierra o a partir de materias orgánicas. El suelo será de preferencia húmedo, cultivado o de jardín de manera que posea una concentración importante de Trichoderma. Después de tose marlas, las muestras se secan a temperatura fresca (-2 C), trituran y homogeneízan y después se conservan en sacos de plástico en un lugar fresco (4- C) en espera de proceder al aislamiento. Aunque pueden ser mantenidas por varios meses, es preferible, sin embargo, tratarlas lo más rápidamente posible. El aislamiento de la población de Trichoderma, en particular la Trichoderma atroviride AGR2, tomada de muestra se realizará en medios específicos seleccionados: - el medio de Davet compuesto por: o Ca(NO 3) 2: 1g, o CaCl 2, 2H 2O : 1 g, o KNO 3: mg, o MgSO 4, 7H 2O : mg, o KH 2PO 4: 12 mg, o sacarosa : 2g, o ácido cítrico : 0 mg, o gel de agar: 2 g, o agua destilada : 00 ml. Después de pasarlo por la autoclave, el ph es ajustado a 4, con HCl 1 N antes de añadir al medio tibio sulfato de estreptomicina ( mg), vinclozolina (2, mg), y alcohol alílico (0, ml). - el medio TSM de Elad y otros que comprende: o MgSO 4, 7H 2O : 0 mg, o KH 2PO 4: 900 mg, o KCI : mg, o NH 4NO 3: 1 g, o glucosa: 3g, o cloranfenicol: mg, o fenaminosulfo : 0 mg, o quintozeno : 0 mg, o rosa bengala : mg, o gel de agar : g, o agua destilada: 00 ml. - el medio TME de Papavizas compuesto por: 3
4 E o glucosa : 1g, o gel de agar: g, o agua destilada : 800 ml La mezcla se coloca después en el autoclave. Se le añaden 0 ml de V-8, el ph debe estar comprendido entre 3,8 y 4. En el medio aún tibio, se añade sulfato de neomicina (0 mg), bacitracina (0 mg), penicilina G (0 mg), cloroneb (0 mg), nistatina ( mg), clortetraciclina HCl (2 mg), y propionato de sodio (00 mg). Cuando se realiza el aislamiento a partir de una muestra de tierra, se emplea la técnica de la incorporación directa del suelo. El medio de aislamiento es vertido y mantenido en sobrefusión en placas de Petri a 37- C, una pequeña cantidad de tierra ( a 1 mg) es espolvoreada e inmediatamente dispersa en el medio, mientras se agita suavemente hasta la solidificación. Los cultivos se colocan posteriormente en incubación durante algunos días. Tras la detección de las colonias que no entran en confluencia, se procede al examen, a la enumeración y después al aislamiento de las colonias. Un pesaje de la muestra de tierra antes y después de la siembra permite conocer precisamente la masa de tierra analizada y así calcular el número de propágulos presentes por gramo de tierra. Para el aislamiento a partir de materias orgánicas, se emplea la técnica de las suspensiones-diluciones. Este principio consiste en poner la muestra de suelo en suspensión en el agua estéril, y luego en incorporar las diferentes diluciones de dicha suspensión en el medio de aislamiento. Con este fin, se adicionan gramos de tierra a 90 ml de agua estéril con una gota de Tween. El conjunto se agita por espacio de minutos para constituir la solución madre (dilución a -1 ). Las muestras sucesivas de ml de dicha suspensión madre y luego las siguientes, a las que se adicionan 90 ml de agua estéril constituyen las diluciones siguientes ( -2, hasta -6 en general). En el momento del análisis, se vierten ml de cada solución en un erlenmeyer que contiene 90 ml de medio selectivo de aislamiento, mantenido en sobrefusión en baño de María a 37- C. Después de la homogeneización, lo s 0 ml se reparten en las placas de Petri y se colocan en condiciones propicias en aislamiento de Trichoderma. Después de 3 a días de incubación, se observa la dilución que presenta un número de colonias suficientes pero sin confluencia, lo que traería como resultado complicar el aislamiento. Una vez escogida la dilución de trabajo, se puede proceder al examen, a la enumeración y al aislamiento de las colonias. Tras replantarse en el medio PDA, y exponer a la luz por 4 o días, se procede a la purificación, es decir, al aislamiento monospórico de cada una de las colonias. Para cada colonia, se toman las esporas de color verde, se suspenden en agua estéril a fin de disociarlas antes de ponerlas a cultivar para cada espora. Se selecciona cada colonia que parezca la más vigorosa en cada placa de Petri y luego se trasplanta en una nueva placa de Petri y se recolecta. A fin de seleccionar la cepa susceptible de poseer el mejor potencial antagonista, se escoge realizar una prueba de confrontación una con respecto a la otra de una cepa de Botrytis cinerea, que es un patógeno polífago de numerosos cultivos. El clon de Trichoderma atroviride AGR2 se selecciona como el de mayor eficacia con respecto al Moho gris. Estos resultados pueden resumirse igualmente en la aplicación de la especie Trichoderma atroviride. Las placas de Petri se incuban a C durante alguno s días hasta 2738, que se mantiene como la aparición de una esporulación. Estas esporas se recogen con la ayuda de una pequeña pinza, y luego se conservan en micoteca. Se realizó un estudio sobre la cepa de Trichoderma atroviride AGR2, que fue trasplantada cada 4 días hasta la vigésima generación. El método de RAPD (Random Amplified Polymorphic DNA) no permitió evidenciar ninguna mutación de la cepa. En conclusión, la cepa de Trichoderma atroviride AGR2 presenta una estabilidad genética, permitiendo su utilización en los viñedos y otros cultivos. Se realizaron varios estudios a fin de evaluar la eficacia del hongo contra diferentes agentes patógenos. El poder antagónico de Trichoderma atroviride, y en particular de la cepa AGR2, se midió con respecto a los hongos asociados a las enfermedades de la madera de la vid: Phaeomoniella chlamydospora, Phaeoacremonium aleophilum, Fomitiporia punctata, Eutypa lata, Botryosphaeria obtusa, Botryosphaeria parva, Botryosphaeria stevensii. Estos diferentes hongos, aislados de cepas perjudiciales de esca, eutipiosis, de marchitez de la Syrah, de BDA o de plantas injerto, se conservan a 4 C en tubo en medi o de malta-agar (1 g de malta y g de gel de agar para un litro de agua. El medio es esterilizado a 1 C durante m n). Se trasplantan de los tubos de conservación en medio maltaagar a las placas de Petri para la multiplicación y las pruebas de confrontación con Trichoderma atroviride AGR2. Por otro lado, una cepa de referencia de Trichoderma harzianum se incluyó en esta prueba. Durante la realización de la confrontación, se extraen dos implantes de micelios de 6 mm de diámetro de los hongos a estudiar de una colonia en crecimiento activo en medio de malta y se colocan en la placa de Petri de manera 4
5 E diametralmente opuesta. La distancia entre los dos implantes es de 4 mm. Producto del crecimiento lento de algunos hongos, la siembra de estos se anticipó 8 días (caso de E. lata, F. punctata, P. aleophilum) o 1 días (caso de P. chlamydospora) con relación al Trichoderma en confrontación. Las cajas se incubaron a 2 C. Por cada par, se efectúan tres rep eticiones. El testigo corresponde al crecimiento del hongo solo (sin la presencia del Trichoderma). Durante la primera semana, las placas se observan y se toma nota sobre ellas todos los días. Estas operaciones se realizan posteriormente todas las semanas. Los apuntes consisten en evaluar la inhibición del crecimiento de la colonia micelial. La tasa de inhibición, expresada en mm, corresponde a la diferencia entre el radio R1 de la colonia de la placa testigo y el radio R2 que está situado a la derecha vinculando el centro de los dos protagonistas en confrontación (I = R1 - R2). La tasa de inhibición se calcula al término de 4 días para B. parva, días para los B. obtusa y B. stevensii, 7 días para E. lata y F. punctata, 9 días para P. chlamydospora y 12 días para P. aleophilum. La lectura de los resultados se hace igualmente por observación de los micelios en confrontación: presencia de una zona de inhibición, recubrimiento de un micelio por otro, competencia espacial, zonas de melanización, fructificaciones... Al término de las confrontaciones, cada implante se coloca nuevamente en un medio de cultivo de malta (1 g de malta y g de gel de agar para un litro de agua. El medio se esteriliza a 1 C durante min). Entonces se observa la iniciación o no de la colonia. Los resultados se representan en la tabla II 2 Tabla II Tasa de inhibición (expresada en mm) del crecimiento micelial de los diferentes hongos implicados en las enfermedades de la madera de la viña frente a la cepa de Trichoderma atroviride AGR2 (medida al cabo de los 4 a 12 días de confrontación) MICROORGANISMOS Patógenos Tasa de inhibición (mm) Radio de la colonia T. harzianum testigo T. atroviride AGR2 (ref.) ,7 Phaeomoniella chlamydospora LR47 Phaeomoniella chlamydospora 16 3 LR81 Phaeoacremonium aleophilum 17, 7,7 1,7 LR3 Phaeoacremonium aleophilum 1,2 3, -6,8 LR23 Fomitiporia punctata LR14 22,7 8,3 3,7 Fomitiporia punctata LR 26,7 Eutypa lata cc ,7 1, Eutypa lata MT247 38,7,7 9,4 Botryosphaeria obtusa F ,2 2,2 22,6 Botryosphaeria obtusa F ,9 23,9 19,9 Botryosphaeria parva Bd021 48,6 21,9 18,3 Botryosphaeria stevensii Bs001 4,1 29,4 2,7 3 4 El antagonismo de Trichoderma atroviride AGR2, y en general el de la especie Trichoderma atroviride, es entonces real con respecto a los hongos patógenos Phaeomoniella chlamydospora, Phaeoacremonium aleophilum, Fomitiporia punctata, Eutypa lata, Botryosphaeria obtusa, Botryosphaeria parva, Botryosphaeria stevensii. La cepa de Trichoderma atroviride AGR2 inhibe el crecimiento de las cepas y recubre con frecuencia las colonias produciendo fructificaciones en sus superficies. El recultivo de los implantes de Phaeomoniella chlamydospora, Phaeoacremonium aleophilum, Fomitiporia punctata, Eutypa lata, Botryosphaeria obtusa, Botryosphaeria parva, Botryosphaeria stevensii muestra que éstos vuelven a desarrollarse raramente. Otras pruebas permitieron igualmente mostrar el rol antagónico de la cepa según la invención hacia otros hongos patógenos de la viña como Stereum hirsutum, Phomopsis viticola, Phellinus ignarius, Phellinus viticola, Armillaria mella. Por otra parte, las tasas de inhibición de la cepa de referencia de Trichoderma harzianum son inferiores a la de la cepa de Trichoderma atroviride AGR2, mostrando así un antagonismo superior que el del género Trichoderma harzanium. La observación del comportamiento de la referencia Trichoderma harzianum muestra que la misma no recubre la colonia de Phaeomoniella chlamydospora ni la de Phaeoacremonium aleophilum. Los dos protagonistas se quedan solamente
6 E en contacto. El recultivo del implante de la colonia probada muestra que los aislantes patógenos no se desarrollan. Por el contrario, ésta recubre la colonia de Fomitiporia y produce fructificaciones en su superficie. El recultivo del implante de la colonia probada muestra que las cepas patógenas Fp 14 y Fp no se desarrollan. La tasa de inhibición de Trichoderma harzianum en el encuentro de la cepa d'eutypa lata cc260 es muy baja: la cepa no recubre la colonia patógena, que posteriormente se desarrolla en la colonia de Trichoderma. Por el contrario la tasa de inhibición contra la cepa de Eutypa lata MT247 puede ser considerada como similar a la de Trichoderma atroviride. La cepa de Trichoderma harzianum no coloniza el cultivo de los Botryosphaeria. Posteriormente, B. obtusa, B. parva y B. stevensii recubren Trichoderma harzianum. La nueva puesta del implante de la colonia probada en el medio de cultivo muestra que B. obtusa, B. parva y B. stevensii se desarrollan. Así entonces, si Trichoderma harzianum ejerce una determinada tasa de inhibición, ésta es frecuentemente muy baja con respecto a los diferentes hongos de la madera y no parece ser un buen antagonista para la lucha contra las enfermedades de la madera, contrariamente al Trichoderma atroviride. Por último, el poder antagónico de la especie Trichoderma atroviride, y en particular el de la cepa de Trichoderma atroviride AGR2 fue igualmente evaluado con respecto a los hongos patógenos de los otros cultivos: Sclérotinia sclerotirum, Sclérotinia minor, Botrytis cinerea, Phomopsis, Microdocchium nivale, Fusarium culmorum. Estos diferentes hongos, aislados a partir de cultivos logrados de esclerotinia (Colza, lechugas), Moho gris (viña), fusariosa (cereales), Fomopsis (tornasol), se conservan a 4 C en un tubo en medio de malta-agar (1 g de malta y g de gel de agar para un litro de agua. El medio se esteriliza a 1 C durante min). Estos se trasplan tan de los tubos de conservación en medio malta-agar a las placas de Petri para la multiplicación y las pruebas de confrontación con Trichoderma atroviride. Durante la confrontación, se recogen dos implantes miceliales de 6 mm de diámetro de los hongos a estudiar de una colonia en crecimiento activo en medio de malta y se colocan en la placa de Petri de manera diametralmente opuesta. La distancia entre los dos implantes es de 0 mm. Las cajas se incuban a 2 C. Para cada pareja, se ef ectúan tres repeticiones. El testigo corresponde al crecimiento del hongo solo (sin la presencia del Trichoderma). Durante 6 días, las cajas son observadas y se toman apuntes. Los apuntes consisten en evaluar la inhibición del crecimiento de la colonia micelial. La tasa de inhibición, expresada en mm, corresponde a la diferencia entre el radio R1 de la colonia de la placa testigo y el radio R2 que está situado a la derecha vinculando el centro de los dos protagonistas en confrontación (I = R1 - R2). La tasa de inhibición se calcula al cabo de 6 días. La lectura de los resultados se hace igualmente por observación de los micelios en confrontación: presencia de una zona de inhibición, recubrimiento de un micelio por otro, competencia espacial, zonas de melanización, fructificaciones... Los resultados son representados en la tabla III Tabla III Tasa de inhibición (expresada en mm) del crecimiento micelial de los diferentes hongos patógenos de los cultivos frente a la cepa de Trichoderma atroviride AGR2 (medida a los 4 a 6 días de confrontación) Tasa de inhibición (mm) MICROORGANISMOS Radio de la colonia T. harzianum PATÓGENOS testigo T. atroviride AGR2 (ref.) Sclérotinia sclerotirum Sclérotinia minor Botrytis cinerea 77, Phomopsis hélianthi 6, Microdocchium nivale Fusarium culmorum 4, El antagonismo de Trichoderma es entonces real con respecto a los hongos patógenos Sclérotinia sclerotirum, Sclérotinia minor, Botrytis cinerea, Phomopsis viticola, Microdocchium nivale, Fusarium culmorum. La cepa de Trichoderma atroviride AGR2 inhibe el crecimiento de los aislados y recubre muy frecuentemente las colonias produciendo fructificaciones en sus superficies. El recultivo de los implantes de Sclérotinia sclerotirum, Sclérotinia minor, Botrytis cinerea, Phomopsis viticola, Microdocchium nivale, Fusarium culmorum muestra que éstos no se vuelven a desarrollar. Por último, cuando la especie Trichoderma atroviride, y en particular la cepa de Trichoderma atroviride AGR2, se incorporan en una tierra previamente esterilizada, es decir, en ausencia de patógenos, se observa una acción de estimulación de la germinación y el crecimiento de las lechugas. El ensayo se realizó en cápsulas de 672 cm2, rellenas con tierra esterilizada y sembradas con Trichoderma atroviride AGR2 en 3 dosis (33,6, 67,2 y 672 mg de producto técnico por cápsula) antes de sembrar la lechuga (variedad laituelactosa Titan) a razón de lechugas por cápsula. Se garantiza un rociado regular diariamente durante 3 días. Los resultados son representados en la tabla IV 6
7 E Tabla IV Estimulación de la germinación y el crecimiento de la lechuga por incorporación de la cepa de Trichoderma atroviride AGR2 en una tierra esterilizada (índice 0 para el testigo). 1 2 Criterio de observación Testigo Dosis A (33,2 mg) Dosis B (67,2 mg) Dosis C (672 mg) Germinación a J ,2 138, 11,4 Número de hojas a 0 11,1 12,8 112,1 J+33 Longitud de las hojas a J ,1 146,7 123,8 El efecto de estimulación actúa desde la primera dosis (33,2 mg/cápsula). La concentración veces superior (672 mg) muestra una buena selectividad ya que la estimulación está siempre presente; sin embargo, ésta es menos importante que para las dosis A y B. Se realizaron ensayos de resistencia y sensibilidad de la cepa de Trichoderma atroviride AGR2 frente a agentes antimicrobianos, utilizados como fungicidas de los cultivos. Además de su carácter práctico para una utilización del clon I por los agricultores, los resultados pueden igualmente permitir un mejor conocimiento de Trichoderma atroviride AGR2. Las pruebas de crecimiento in vitro del Trichoderma atroviride AGR2 se realizan en gel de agar enriquecido con productos comerciales que contienen sustancias fungicidas estudiadas. La metodología empleada es la siguiente: - constitución de una solución de 0 ml para cada producto a probar en el cual se diluye el producto comercial - adición de 0,126 ml de la solución en medio de cultivo Sabouraud (peptona micológica a g.l -1, glucosa a g.l -1, agar a 1 g.l -1 ) - depósito de un implante micelial de Trichoderma atroviride AGR2 de 3 mm y cultivado a temperatura ambiente. - Medición del crecimiento del testigo Los resultados son representados en la tabla V Tabla V Inhibición del crecimiento micelial la cepa de Trichoderma atroviride AGR2 por diferentes productos fitosanitarios (crecimiento expresado en porcentaje del testigo) Producto comercial (marcas colocadas) Cursor Materia (s) activa(s) Concentración de la solución (/0ml) 7 J+1 J+2 J+3 Cimoxanil+Folpel 1,2 g,46 3,38 6,8 +Mancozeb +Cobre Microthiol Azufre 6,2 g 90,00 8,63 0,00 Round up Glifosato 6 ml 9,9 94,16 0,00 Stroby DF Kresoxi-metil 0,1 g 74,8 81,88 0,00 Témoin - - 0,00 0,00 0,00 Acrobat Dimetomorfo +Mancozeb 1,2 g 62,6 68,4 88,63 Légend Quinoxifén 0,1 ml 6,68 90,1 88,0 Scala Pirimetanil 1,2 ml 9,14 90,1 87,2 Valiant Fosetil-Al+Folpel 1, g 66,22 76,61 86,76 +Cimoxanil Hoggar Espiroxamina 0,3 ml 2,00 61,02 81,7 Odéna Folpel +Iprovanicarbo 1 g 66,16 6,17 81,17 Tairel F Benalaxil+Folpel 1,2 ml 8,66 60,41 76,86 Surfassol Diclobenil 0 g 38,07 0,67 76,08 Dobran Kresoxi-metil 0,1 g 77,18 73,02 74,93 Olymp Fluzilazol 0,1 ml 9,13 62,4 72,73 Basta Glufosinato-amonio 1,2 ml 77,18 64,72 64,2 Panthéos Dimetomorfo +Folpel 1 g 79,96 61,0 8,38 Karathane Dinocap 0,3 ml 89,19 64,1,13 Score Difenoconazol 0,06 ml 66,2 48,07 48,4 Sumisclex Procimidón 0,1 ml 49,6 29,3 24,42 Sekoya Fluazinam 0,7 ml 33,99,1 17,93
8 E Sting Glifosato,4 ml 43,06 1,49 12,19 Jonk Dietofencarbo 1 ml 0,00 0,00 0,00 +Carbendazima Geoxe Fludioxonilo 0, g 0,00 0,00 0, Con el objeto de obtener un producto técnico que sirva de base a la producción de un producto fitosanitario destinado a proteger los cultivos, se desarrolló una técnica de producción. La misma se divide en dos etapas: la primera guarda relación con la realización del inóculo primario, que tuvo lugar en el laboratorio. La segunda fase consiste en la realización adecuada del producto técnico. En un primer momento, la producción del inóculo primario de Trichoderma atroviride AGR2 en el laboratorio se realiza en placas de Petri, en un medio de cultivo Sabouraud (peptona micológica a g.l -1, glucosa a g.l -1, agar a 1 g.l -1 ) o un medio malta-agar. Se añade a este medio cloranfenicol a una concentración de 2 ml.l -1 de una solución a g/0 ml de etanol, el cloranfenicol impide el desarrollo de bacterias indeseables. La cepa utilizada para la producción del inóculo primario es la cepa madre depositada en el Instituto Pasteur. Tras el cultivo y la observación visual de los hongos presentes en la placa de Petri, las placas de Petri eventualmente contaminadas por microorganismos que no son de la cepa de Trichoderma atroviride AGR2 se eliminan. La segunda fase consiste en preparar el producto técnico propiamente dicho. Para ello, las esporas de Trichoderma atroviride AGR2, contenidas en las placas de Petri se inoculan en un sustrato orgánico como las pulpas de remolacha, papa, hojuelas de avena, cebada o maíz, malta-agar o PDA estériles. A fin de favorecer la esporación de la cepa de Trichoderma atroviride AGR2, se añade cloruro de calcio a razón de 4 g.kg -1 de soporte orgánico. La realización de dicha fase se lleva a cabo de la manera siguiente: el contenido en esporas de las placas de Petri se mezcla en un sistema de elaboración con agua y CaCl 2. La mezcla se reparte en plataformas para incubación en un recinto climatizado a -2 C, donde se mantiene un a higrometría y una aeración necesarias para el crecimiento del Trichoderma atroviride. A los 4 a 6 días de incubación, el conjunto se seca y microniza en forma de polvo para constituir el producto técnico, rico en esporas de Trichoderma atroviride AGR2. Un recuento de células de Malassez determina su concentración en esporas: según los soportes orgánicos utilizados, éste va de 8 a esporas por gramo. Un procedimiento ventajoso reivindicado por la presente invención consiste en utilizar un sustrato orgánico extruido, lo que permite un crecimiento rápido de Trichoderma y de las concentraciones elevadas en esporas por gramo. Este polvo constituye la base de productos fitosanitarios múltiples adaptados a los diferentes usos deseados. Se llevaron a cabo diferentes estudios a fin de verificar la inocuidad de la cepa de Trichoderma atroviride AGR2 en el hombre y su medioambiente, ya sea durante la fabricación del producto técnico o durante su aplicación en los cultivos. Así, cuatro estudios realizados en lombrices de tierra, peces, delfines y algas demostraron la perfecta seguridad de la cepa para el medioambiente. No se reportó ningún efecto de la cepa de Trichoderma atroviride AGR2 en las micorrizas, los hongos nematófagos, ni los nemátodos. El crecimiento micelial de la cepa de Trichoderma atroviride AGR2 es óptimo a una temperatura comprendida entre y 2 C. Por el contrario, su crecimiento es nulo a 37 C, lo que hace suponer que no puede desarrollarse in vivo en el hombre. No obstante, se realizaron las pruebas complementarias siguientes a fin de evaluar los efectos que puede tener el producto técnico en los mamíferos y por extrapolación el hombre. Estas pruebas se relacionan con: - la sensibilización cutánea, - la sensibilización por inhalación, - la toxicidad aguda por vía oral, - la toxicidad aguda por la vía intraperitoneal, - la toxicidad aguda por vía dérmica, - la irritación aguda en los ojos, - la aberración cromosómica de los linfocitos humanos, - la toxicidad, patogenicidad e infecciosidad agudas por vía intratraqueal. Cada una de estas pruebas reveló que la cepa según la invención es perfectamente segura y que no produce ningún metabolito sensible que pueda representar un riesgo perceptible para la salud humana o para el medioambiente. Como consecuencia, Trichoderma atroviride AGR2 y el producto técnico no presentan ningún efecto tóxico, patógeno e infeccioso en caso de exposición. Un uso ventajoso de la presente invención, es decir, la cepa de Trichoderma atroviride AGR2, es su utilización en la formulación de un producto fitosanitario como materia activa. Así, el polvo obtenido por el modo de producción descrito con anterioridad puede ser mezclado o no en uno o varios componentes tales como: una o varias de otras materias activas, uno o varios sustratos nutritivos y/u orgánicos y/o minerales, uno o varios humectantes, uno o varios dispersantes, uno o varios anti-espumas, etc... para obtener un producto final con las características y en la 8
9 E concentración en esporas deseadas El producto de tratamiento fitosanitario a base de la cepa natural de Trichoderma atroviride AGR2 está destinado al tratamiento de las enfermedades fúngicas que afectan la vid como la eutipiosis, la esca, el brazo negro muerto, la excoriosis la armilaria y el Moho gris, en la medida en donde la cepa actúa sobre estos hongos patógenos que atacan la vid. Así, según un primer uso, el producto fitosanitario será aplicado por pulverización o recubrimiento en las cepas de vid, después de la poda o en cualquier otro periodo del año para efectuar una protección contra las enfermedades de la madera. Así, se llevó a cabo un estudio en el viñedo, confirmando los resultados precedentes realizados en vitro. En invierno, el día de la poda, el producto fitosanitario a base de Trichoderma atroviride AGR2 o de Trichoderma atroviride se pulverizada en las zonas afectadas a concentraciones variables de %, 2,% y 1%. Se toman dos porciones de ramas, primero 7 días después de la pulverización, luego a los 4 días. A partir de la cara, la madera se cortada en 8 láminas de 1 milímetro de espesor. Dichas láminas se colocan en placas de Petri que contienen un medio de gel de agar a fin de ser artificialmente contaminadas con las esporas de los dos hongos pioneros patógenos: Eutypa lata y Phaeomoniella chalmydospora. Cuando el producto fitosanitario se aplica a una dilución a 2,%, presenta una buena capacidad de control del desarrollo del hongo patógeno Eutypa lata. El producto fitosanitario se mantiene eficaz en un periodo de 4 días mínimo después de la poda. Para el control de Phaeomoniella chlamydospora, una dilución a 2,% del producto fitosanitario es suficiente que se mantiene eficaz inclusive 4 días después de la poda. Este estudio demuestra igualmente que la eficacia de la pulverización del producto fitosanitario a base de Trichoderma atroviride AGR2 es superior al de una solución al 1% de un producto químico que contiene 12 g/l de Flusilazol + g/l de Carbendazima, cuyo derivado se emplea habitualmente para el tratamiento de la esca. La especie Trichoderma atroviride y la cepa de Trichoderma atroviride AGR2, en forma de un producto fitosanitario, actúan bien sobre los hongos patógenos Phaemoliella chlamydospora y Eutypa lata. En otros ensayos, la pulverización de una composición a base de Trichoderma atroviride AGR2 en las heridas por cortes muestra que este coloniza la madera hasta una profundidad de 1 milímetros, y se mantiene presente por un periodo de 6 a meses. Según un segundo uso, el producto según la invención podrá ser aplicado en el suelo y/o ser utilizado para embarrar (cubrir) las raíces de las plantas jóvenes antes de plantarlas a fin de estimular el crecimiento de sus raíces y luchar contra la Armillaria. Según un tercer uso, el producto según la invención puede ser pulverizado en los racimos de uvas para luchar contra el Moho gris, agente responsable de la pudrición de las uvas. En efecto, en este caso, la cepa de Trichoderma atroviride AGR2 debe luchar contra los efectos nocivos de los rayos UV. Sin embargo, la misma posee un gen phr1 inducido por la luz azul, que se expresa a la vez en el micelio vegetativo puesto que carece de los pigmentos fotoprotectores, y en los conidióforos. Este gen codifica para fotólisis, catalizando la reparación del ADN. Por otra parte, la luz visible induce el desarrollo de esporas pigmentadas y resistentes. Es así posible considerar una utilización de la cepa de Trichoderma atroviride AGR2 durante un tratamiento aéreo de los cultivos, sin arriesgar un fenómeno de foto degradación excesiva por los rayos UV. La cepa de Trichoderma atroviride AGR2 coloniza igualmente el suelo, en particular cuando se comienza el cultivo, y sobre todo cuando se realiza un aporte en materia orgánica. Es en efecto un hongo conocido por presentar una buena aptitud en el desarrollo saprofítico en el suelo. Según un cuarto uso, los productos según la invención podrán ser entonces aplicados en el suelo y/o ser utilizados para embarrar (cubrir) las raíces de las plantas jóvenes antes de sembrarlas a fin de luchar contra las enfermedades de infección de las raíces, específicamente para las producciones de hortalizas, tales como Esclerotinia, Rhizoctonia, Botrytis, Fonte de siembras relacionadas con el fusarium, Pitio, etc... Como se ha observado, durante los ensayos en terrina, un crecimiento más rápido de las plantas de lechugas, esto podrá ser ventajosamente utilizado para estimular el crecimiento de las plantas y raíces, y luchar contra el síndrome de la fatiga de los suelos, específicamente en los plantones de fresas. Se comprueba que la cepa de Trichoderma atroviride AGR2 no presenta ningún riesgo para el medioambiente, en la misma medida en que la cepa no presenta ninguna toxicidad, ni poder infeccioso sobre ninguno de los organismos vivos con los cuales el producto fitosanitario pudiera entrar en contacto durante su utilización, y específicamente ninguna incidencia en el hombre. El producto fitosanitario puede ser empleado entonces como medio alternativo de protección de los cultivos, en el contexto de tratamientos biológicos, sólo o como complemento de los tratamientos químicos privilegiando en estos 9
10 E últimos los más respetuosos de la cepa de Trichoderma atroviride AGR2. El hecho de utilizar el producto técnico o fitosanitario en forma de un polvo humectable aplicado por pulverización facilita el tratamiento de las vides, en la medida que es más rápido de utilizar que el lavado químico empleado habitualmente para el tratamiento de las heridas por cortes y que representa una operación minuciosa, extensa y molesta. Aunque la invención se describe con medios de realización particulares, la misma comprende todos los equivalentes técnicos de los medios descritos.
11 E REIVINDICACIONES 1 1. Cepa de Trichoderma atroviride caracterizada porque se trata de la cepa de Trichoderma atroviride AGR2 depositada ante la Colección Nacional de Cultivo de Microorganismos (CNCM) del Instituto Pasteur con el número I Método para aislar la cepa de Trichoderma atroviride AGR2 según la reivindicación 1, caracterizado porque comprende las etapas siguientes: a. recoger la cepa de Trichoderma atroviride AGR2 en una muestra de tierra, b. espolvorear y dispersar la muestra recogida en la etapa anterior en una placa de Petri a 37- C conteniendo un medio de aislamiento, c. agitar suavemente hasta la solidificación del medio, d. incubar por varios días, e. examinan, enumerar y aislar las colonias de Trichoderma atroviride AGR2. 3. Método para aislar la cepa de Trichoderma atroviride AGR2 según la reivindicación 1, caracterizado porque comprende las etapas siguientes: a. recoger una muestra de tierra compuesta de materias orgánicas, b. suspender dicha muestra (g) en 90 ml de agua estéril con una gota de Tween, c. agitar durante minutos, d. tomar de ml de dicha solución y luego sucesivas diluciones hasta -6, e. adicionar ml de cada solución en 90 ml de medio de aislamiento, mantenido en sobrefusión en baño de María a 37- C, f. homogeneizar y repartir en placas de Petri, g. incubar durante 3 a días, h. examinan, enumerar y aislar las colonias de Trichoderma atroviride AGR2. 4. Método de aislamiento según una de las reivindicaciones 2 ó 3, caracterizado porque comprende las etapas siguientes: a. trasplantar las colonias aisladas en medio PDA, y exponer a la luz durante 4 a días, b. recoger las esporas de color verde, c. suspender las esporas en el agua estéril, d. seleccionar la colonia más vigorosa, e. trasplantar a una placa de Petri, f. prueba de confrontación con una cepa de Botrytis cinerea.. Método de aislamiento según una de las reivindicaciones 2 ó 3, caracterizado porque el medio de aislamiento es el medio de Davet, constituido por: - Ca(NO 3) 2: 1g, -CaCl 2, 2H 2O: 1g, - KNO 3: mg, - MgSO 4, 7H 2O: mg, - KH 2PO 4: 12 mg, - sacarosa: 2g, - ácido cítrico: 0 mg, - gel de agar: 2 g, - agua destilada: 00 ml; el medio se coloca posteriormente en el autoclave, con ajuste del ph a 4, con HCl 1 N; y luego añadir al medio tibio de sulfato de estreptomicina ( mg), vinclozolina (2, mg), y alcohol alílico (0, ml). 6. Método de aislamiento según una de las reivindicaciones 2 ó 3, caracterizada porque el medio de aislamiento es el medio TSM de Elad y otros que comprende: Mg SO 4, 7H 2O: 0 mg, - KH 2PO 4: 900 mg, - KCl : mg, - NH 4NO 3: 1g, - glucosa: 3g, - cloranfenicol: mg, - fenaminosulf : 0 mg, - quintozeno : 0 mg, 11
12 E rosa bengala : mg, - gel de agar: g, - agua destilada 00 ml el medio se coloca después en el autoclave, y se le añaden 0 ml de V-8, el ph debe estar comprendido entre 3,8 y 4 ; cuando está aún tibio, al medio se le añade sulfato de neomicina (0 mg), bacitracina (0 mg), penicilina G (0 mg), cloroneb (0 mg), nistatina ( mg), clorotetraciclina HCL (2 mg), propionato de sodio (00 mg). 7. Método de aislamiento según una de las reivindicaciones 2 ó 3, caracterizado porque el medio de aislamiento es el medio de aislamiento TME de Papavizas constituido por : - glucosa : 1 g, - gel de agar: g, - agua destilada: 800 ml, que se coloca posteriormente en el autoclave, luego se le añaden 0 ml de V-8, el ph debe estar comprendido entre 3,8 y 4 ; cuando está aún tibio, se le adiciona sulfato de neomicina (0 mg), bacitracina (0 mg), penicilina G (0 mg), cloroneb (0 mg), nistatina ( mg), clorotetraciclina HCL (2 mg), y propionato de sodio (00 mg). 8. Método de obtención de un producto a base de Trichoderma atroviride AGR2 obtenido según el método de una de las reivindicaciones 2 a 7, caracterizado porque consiste en diferentes etapas : a. producir la cepa de Trichoderma atroviride AGR2 realizada en placas de Petri conteniendo un medio de cultivo Sabouraud o malta-agar, que contiene cloranfenicol, b. aislar las cepas de Trichoderma atroviride AGR2, presentándose en forma de esporas, c. inocular la cepa del hongo en pulpas de remolacha, papa, hojuelas de avena, de cebada o de maíz, de malta-agar o PDA estériles, d. extruir el conjunto del sustrato, lo que permite obtener una concentración elevada de esporas, e. adicionar cloruro de calcio. f. incubar en cámara no estéril durante 4 a 6 días, g. secar y micronizar en forma de polvo. 9. Utilización de la cepa de Trichoderma atroviride AGR2 según la reivindicación 1 u obtenida según el método de una de las reivindicaciones 2 a 8 en la lucha contra las enfermedades de las plantas.. Utilización de la cepa de Trichoderma atroviride AGR2 según la reivindicación 1 u obtenida según el método de una de las reivindicaciones 2 a 8, como producto fitosanitario por pulverización, o recubrimiento, o por embarre de las raíces. 11. Utilización de la cepa de Trichoderma atroviride AGR2 según la reivindicación 1 u obtenida según el método de una de las reivindicaciones 2 a 8, como el producto fitosanitario constituido por este sólo microorganismo. 12. Utilización de la cepa de Trichoderma atroviride AGR2 según la reivindicación 1 u obtenida según el método de una de las reivindicaciones 2 a 8, como producto fitosanitario en asociación con otros fungicidas químicos. 13. Utilización de la cepa de Trichoderma atroviride AGR2 según la reivindicación 1 u obtenida según el método de una de las reivindicaciones 2 a 8, como medio de lucha contra la esca, la eutipiosis, el brazo negro muerto, la excoriosis y la esclerotinia. 14. Utilización de la cepa de Trichoderma atroviride AGR2 según la reivindicación 1 u obtenida según el método de una de las reivindicaciones 2 a 8, como producto fitosanitario que actúa contra los hongos patógenos como Eutypa lata, Phaeomoniella chlamydospora, Phaeomoniella aleophilum, Fomitiporia punctata, Stereum hirsutum, Botryosphaeria dothidea y stevensii, Phomopsis viticola, Botrytis cinerea, Sclerotinia minor, sclerotiorum et cepivorum, Microdocchium nivale, Armillaria mella, Phomopsis hélianthi. 1. Utilización de la cepa de Trichoderma atroviride AGR2 según la reivindicación 1 u obtenida según el método de una de las reivindicaciones 2 a 8, como producto destinado a la estimulación de las raíces, la germinación y el crecimiento de las plantas, en particular las de lechugas. 16. Utilización de la cepa de Trichoderma atroviride AGR2 según la reivindicación 1 u obtenida según el método de una de las reivindicaciones 2 a 8, como elemento colonizador de la madera en los primeros centímetros. 12
Uso de Trichoderma y Glomus para el control de enfermedades de la madera en vid. Dra. Rufina Hernández Martínez
 Uso de Trichoderma y Glomus para el control de enfermedades de la madera en vid Dra. Rufina Hernández Martínez 1 Enfermedades de la madera Agentes causales: hongos Eutypa lata Botryosphaeria spp Phaeomoniella
Uso de Trichoderma y Glomus para el control de enfermedades de la madera en vid Dra. Rufina Hernández Martínez 1 Enfermedades de la madera Agentes causales: hongos Eutypa lata Botryosphaeria spp Phaeomoniella
LAS ENFERMEDADES DE LA MADERA DE LA VID : IMPACTOS Y SOLUCIONES Marc Grenet, Agrauxine y Miguel Mercier, Etbs Mercier
 GRENET y MERCIER, LAS ENFERMEDADES DE LA MADERA DE LA VID : IMPACTOS Y SOLUCIONES. PÁG. 1 LAS ENFERMEDADES DE LA MADERA DE LA VID : IMPACTOS Y SOLUCIONES Marc Grenet, Agrauxine y Miguel Mercier, Etbs Mercier
GRENET y MERCIER, LAS ENFERMEDADES DE LA MADERA DE LA VID : IMPACTOS Y SOLUCIONES. PÁG. 1 LAS ENFERMEDADES DE LA MADERA DE LA VID : IMPACTOS Y SOLUCIONES Marc Grenet, Agrauxine y Miguel Mercier, Etbs Mercier
BIORREACTRES. Estudios básicos y aplicados sobre procesos de fermentación
 BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
SITUACIÓN ACTUAL DE LAS ENFERMEDADES DE LA MADERA DE LA VID EN ESPAÑA
 PROBLEMÁTICA DE LAS ENFERMEDADES DE LA MADERA DE LA VID EN PLANTA JOVEN Josep Armengol 2 de julio de 2014 Jornada técnica Winetech Plus SITUACIÓN ACTUAL DE LAS ENFERMEDADES DE LA MADERA DE LA VID EN ESPAÑA
PROBLEMÁTICA DE LAS ENFERMEDADES DE LA MADERA DE LA VID EN PLANTA JOVEN Josep Armengol 2 de julio de 2014 Jornada técnica Winetech Plus SITUACIÓN ACTUAL DE LAS ENFERMEDADES DE LA MADERA DE LA VID EN ESPAÑA
Las enfermedades fúngicas de la madera de la vid: una amenaza para la productividad del viñedo.
 Las enfermedades fúngicas de la madera de la vid: una amenaza para la productividad del viñedo. Josep Armengol, jarmengo@eaf.upv.es Mérida, mayo 2016 VITICULTURA SOSTENIBLE Organización Internacional de
Las enfermedades fúngicas de la madera de la vid: una amenaza para la productividad del viñedo. Josep Armengol, jarmengo@eaf.upv.es Mérida, mayo 2016 VITICULTURA SOSTENIBLE Organización Internacional de
CURSO DE CONTROL BIOLÓGICO DE PATÓGENOS DE PLANTAS
 CURSO DE CONTROL BIOLÓGICO DE PATÓGENOS DE PLANTAS Introducción: Se considera que en la actualidad el Control Biológico de las enfermedades de plantas ha tomado una trascendental importancia. Esto es debido
CURSO DE CONTROL BIOLÓGICO DE PATÓGENOS DE PLANTAS Introducción: Se considera que en la actualidad el Control Biológico de las enfermedades de plantas ha tomado una trascendental importancia. Esto es debido
PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA
 PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA Capacidades a lograr: 1. Conoce y aplica técnicas de siembra, cultivo y cuantificación del proceso fermentativo para producción
PRACTICA N 02: PROCESOS FERMENTATIVOS: PRODUCCION DE PROTEÍNA UNICELULAR O BIOMASA Capacidades a lograr: 1. Conoce y aplica técnicas de siembra, cultivo y cuantificación del proceso fermentativo para producción
11 Número de publicación: Int. Cl. 7 : A61K 39/ Inventor/es: Davelaar, Frans, Gerrit. 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 224 294 1 Int. Cl. 7 : A61K 39/17 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9793833.7 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 224 294 1 Int. Cl. 7 : A61K 39/17 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9793833.7 86 Fecha de presentación:
Cultivo Puro. Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica
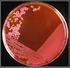 Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
11 knúmero de publicación: kint. Cl. 6 : A61K 31/405
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 116 811 1 kint. Cl. 6 : A61K 31/ A61K 9/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 961842.8
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 116 811 1 kint. Cl. 6 : A61K 31/ A61K 9/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 961842.8
Métodos de aislamiento
 Métodos de aislamiento Aislamiento de hongos y bacterias Unidad de Fitopatología Dto. de Protección Vegetal Facultad de Agronomía. Dr. Pedro Mondino Métodos de aislamiento Técnicas de Aislamiento de hongos
Métodos de aislamiento Aislamiento de hongos y bacterias Unidad de Fitopatología Dto. de Protección Vegetal Facultad de Agronomía. Dr. Pedro Mondino Métodos de aislamiento Técnicas de Aislamiento de hongos
Desarrollo de estrategias naturales para el control de enfermedades de madera de vid
 Desarrollo de estrategias naturales para el control de enfermedades de madera de vid Dr. Juan José Rubio Coque Julio, 2014 1).- DEFINICIÓN. El término enfermedades de madera de vid (grapevine trunk diseases)
Desarrollo de estrategias naturales para el control de enfermedades de madera de vid Dr. Juan José Rubio Coque Julio, 2014 1).- DEFINICIÓN. El término enfermedades de madera de vid (grapevine trunk diseases)
Int. Cl.: 72 Inventor/es: Verneau, Bernadette. 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 288 296 1 Int. Cl.: A61K 31/22 (06.01) A61K 31/1 (06.01) A61P 3/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 288 296 1 Int. Cl.: A61K 31/22 (06.01) A61K 31/1 (06.01) A61P 3/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud
11 Número de publicación: Int. Cl. 7 : B60G 21/ Agente: Buceta Facorro, Luis
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 6 869 1 Int. Cl. 7 : BG 21/0 B21D 3/84 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud: 981977.8 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 6 869 1 Int. Cl. 7 : BG 21/0 B21D 3/84 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud: 981977.8 86 Fecha de presentación:
k 11 N. de publicación: ES k 51 Int. Cl. 5 : A61K 7/48
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 02 041 1 Int. Cl. : A61K 7/48 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 896.4 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 02 041 1 Int. Cl. : A61K 7/48 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 896.4 86 Fecha de presentación
PRÁCTICA # 01 PREPARACIÓN DE DISOLUCIONES
 REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA DEFENSA AVIACIÓN MILITAR VENEZOLANA U.E.A.M LIBERTADOR ASIGNATURA: QUÍMICA PROF(A): ANGÉLICA RODRÍGUEZ MARBELIS MELENDEZ CURSO: 4to
REPÚBLICA BOLIVARIANA DE VENEZUELA MINISTERIO DEL PODER POPULAR PARA LA DEFENSA AVIACIÓN MILITAR VENEZOLANA U.E.A.M LIBERTADOR ASIGNATURA: QUÍMICA PROF(A): ANGÉLICA RODRÍGUEZ MARBELIS MELENDEZ CURSO: 4to
PRACTICA Núm. 20 DETERMINACION DE CLOSTRIDIOS SULFITO REDUCTORES EN AGUA
 PRACTICA Núm. 20 DETERMINACION DE CLOSTRIDIOS SULFITO REDUCTORES EN AGUA I. OBJETIVO Determinar la presencia de Clostridios sulfito reductores en agua por el método de recuento en tubo. II. INTRODUCCION
PRACTICA Núm. 20 DETERMINACION DE CLOSTRIDIOS SULFITO REDUCTORES EN AGUA I. OBJETIVO Determinar la presencia de Clostridios sulfito reductores en agua por el método de recuento en tubo. II. INTRODUCCION
PROCEDIMIENTO ENUMERACION DE LEVADURAS Y MOHOS EN ALIMENTOS BAM ONLINE
 PRT-712.02-048 Página 1 de 7 1. OBJETIVO Detectar el número de unidades formadoras de colonias (ufc) de levaduras y de mohos en el alimento 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a
PRT-712.02-048 Página 1 de 7 1. OBJETIVO Detectar el número de unidades formadoras de colonias (ufc) de levaduras y de mohos en el alimento 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a
Laboratorio de Agroindustria II. Calidad de Leche
 Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
Laboratorio de Agroindustria II. Calidad de Leche Medio de cultivo: Caldo lactosado biliado verde brillante (Brilliant Green Bile Lactose: BGBL) Composición - Peptona 10 g. - Lactosa 10 g. - Bilis de buey
PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO
 PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO I. OBJETIVO Aislar dos microorganismos por la técnica de siembra de dilución por estría en placa de agar y obtener un
PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO I. OBJETIVO Aislar dos microorganismos por la técnica de siembra de dilución por estría en placa de agar y obtener un
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Int. Cl. 7 : A61M 5/ Agente: Díez de Rivera y Elzaburu, Ignacio
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 248 029 1 Int. Cl. 7 : A61M /14 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 001684.6 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 248 029 1 Int. Cl. 7 : A61M /14 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 001684.6 86 Fecha de presentación
Evaluación sobre soja de 2 mezclas de fungicidas curasemillas desafiadas con la inoculación al suelo de Pythium sp, raza patógena.
 Evaluación sobre soja de 2 mezclas de fungicidas curasemillas desafiadas con la inoculación al suelo de Pythium sp, raza patógena. Ing. Agr. Guillermo Arrospide; Lab. Federico Acosta; Ing. Agr. Alfonso
Evaluación sobre soja de 2 mezclas de fungicidas curasemillas desafiadas con la inoculación al suelo de Pythium sp, raza patógena. Ing. Agr. Guillermo Arrospide; Lab. Federico Acosta; Ing. Agr. Alfonso
GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS
 ESCUELA DE SALUD GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia Informática
ESCUELA DE SALUD GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia Informática
PRODUCCION DE MICELIO. ( Pleourotus Spp.)
 PRODUCCION DE MICELIO ( Pleourotus Spp.) Aislamiento y mantenimiento de cepas Medios de cultivo Para el desarrollo del micelio de los hongos en el laboratorio, se emplean medios de cultivo sólidos que
PRODUCCION DE MICELIO ( Pleourotus Spp.) Aislamiento y mantenimiento de cepas Medios de cultivo Para el desarrollo del micelio de los hongos en el laboratorio, se emplean medios de cultivo sólidos que
RESOLUCIÓN OIV-OENO
 RESOLUCIÓN OIV-OENO 459-2013 MONOGRAFÍA SOBRE LAS LEVADURAS INACTIVADAS LA ASAMBLEA GENERAL Visto el artículo 2 párrafo 2 iv del Acuerdo del 3 de abril de 2001 por el que se crea la Organización Internacional
RESOLUCIÓN OIV-OENO 459-2013 MONOGRAFÍA SOBRE LAS LEVADURAS INACTIVADAS LA ASAMBLEA GENERAL Visto el artículo 2 párrafo 2 iv del Acuerdo del 3 de abril de 2001 por el que se crea la Organización Internacional
Incidencia de las enfermedades de madera de vid en Castilla-La Mancha
 Incidencia de las enfermedades de madera de vid en Castilla-La Mancha Pedro Miguel Izquierdo Cañas, 5 de Noviembre de 2014 Muestras recibidas en IVICAM: 2008-2013 Recogidas por Servicios Sanidad Vegetal
Incidencia de las enfermedades de madera de vid en Castilla-La Mancha Pedro Miguel Izquierdo Cañas, 5 de Noviembre de 2014 Muestras recibidas en IVICAM: 2008-2013 Recogidas por Servicios Sanidad Vegetal
Int. Cl. 7 : A61K 31/ Agente: Ponti Sales, Adelaida
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 24 361 1 Int. Cl. 7 : A61K 31/38 A61P 31/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01929703. 86
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 24 361 1 Int. Cl. 7 : A61K 31/38 A61P 31/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01929703. 86
TEMA 10. DIAGNÓSTICO DE LABORATORIO DE LAS ENFERMEDADES INFECCIOSAS BUCODENTALES
 TEMA 10. DIAGNÓSTICO DE LABORATORIO DE LAS ENFERMEDADES INFECCIOSAS BUCODENTALES 1. Objetivo del diagnóstico microbiológico 2. Toma de muestra 3. Diagnóstico directo - bacterias - hongos - protozoos -
TEMA 10. DIAGNÓSTICO DE LABORATORIO DE LAS ENFERMEDADES INFECCIOSAS BUCODENTALES 1. Objetivo del diagnóstico microbiológico 2. Toma de muestra 3. Diagnóstico directo - bacterias - hongos - protozoos -
11 Número de publicación: Int. Cl. 7 : A45D 8/ Inventor/es: Bolito, Marius. 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 214 238 1 Int. Cl. 7 : A4D 8/ 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 004.4 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 214 238 1 Int. Cl. 7 : A4D 8/ 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 004.4 86 Fecha de presentación:
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO. OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico.
 GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
Preparación de medios de cultivo
 Objetivos Preparación de medios de cultivo Curso: Métodos en fitopatología 24 de abril de 2009 Dr. Pedro Mondino Conocer a que denominamos medio de cultivo en el laboratorio de Fitopatología. Reconocer
Objetivos Preparación de medios de cultivo Curso: Métodos en fitopatología 24 de abril de 2009 Dr. Pedro Mondino Conocer a que denominamos medio de cultivo en el laboratorio de Fitopatología. Reconocer
k 11 N. de publicación: ES k 51 Int. Cl. 5 : A61K 31/28
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 044 k 1 Int. Cl. : A61K 31/28 A61K 47/02 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90134.9 86
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 044 k 1 Int. Cl. : A61K 31/28 A61K 47/02 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90134.9 86
11 Número de publicación: Int. Cl. 7 : A61M 1/ Inventor/es: Bartolome, Francis. 74 Agente: Torner Lasalle, Elisabet
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 214 246 1 Int. Cl. 7 : A61M 1/00 A61M 3/02 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 009008.8 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 214 246 1 Int. Cl. 7 : A61M 1/00 A61M 3/02 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 009008.8 86 Fecha
PROCEDIMIENTO TECNICA NMP STAPHYLOCOCCUS AUREUS EN ALIMENTOS. BAM ONLINE 2001
 PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
29/10/2013. Manejo integrado de enfermedades de granado en el cultivo de granado. Luis Alvarez Bernaola. Enfermedades del granado
 Enfermedades del granado Manejo integrado de enfermedades de granado en el cultivo de granado Enfermedades con origen en el suelo o de la parte aérea Enfermedades pos cosecha Luis Alvarez Bernaola nematodo
Enfermedades del granado Manejo integrado de enfermedades de granado en el cultivo de granado Enfermedades con origen en el suelo o de la parte aérea Enfermedades pos cosecha Luis Alvarez Bernaola nematodo
11 Número de publicación: Int. Cl.: 72 Inventor/es: Günter, Walter. 74 Agente: Arpe Fernández, Manuel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 264 27 1 Int. Cl.: C09J 7/02 (06.01) B32B 27/06 (06.01) B32B 37/00 (06.01) B29C 47/06 (06.01) B32B 41/02 (06.01) 12 TRADUCCIÓN
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 264 27 1 Int. Cl.: C09J 7/02 (06.01) B32B 27/06 (06.01) B32B 37/00 (06.01) B29C 47/06 (06.01) B32B 41/02 (06.01) 12 TRADUCCIÓN
11 Número de publicación: Int. Cl.: 72 Inventor/es: Uttley, John Stewart y Rushton, Carl. 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 264 963 1 Int. Cl.: A47C 27/12 (06.01) A47C 27/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 264 963 1 Int. Cl.: A47C 27/12 (06.01) A47C 27/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
PROCEDIMIENTO ENUMERACION DE LEVADURAS Y MOHOS EN ALIMENTOS BAM ONLINE
 PRT-712.02-048 Página 1 de 7 1. OBJETIVO Detectar el número de unidades formadoras de colonias (ufc) de levaduras y de mohos en el alimento 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a
PRT-712.02-048 Página 1 de 7 1. OBJETIVO Detectar el número de unidades formadoras de colonias (ufc) de levaduras y de mohos en el alimento 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a
1. OBJETIVO Detectar enterotoxina A de C. perfringens por método de aglutinación pasiva en látex en cepas aisladas de alimentos
 PRT-712.04-080 Página 1 de 9 1. OBJETIVO Detectar enterotoxina A de C. perfringens por método de aglutinación pasiva en látex en cepas aisladas de alimentos 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este
PRT-712.04-080 Página 1 de 9 1. OBJETIVO Detectar enterotoxina A de C. perfringens por método de aglutinación pasiva en látex en cepas aisladas de alimentos 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este
MICROBIOLOGÍA AGRÍCOLA
 MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
GLOSARIO DE TÉRMINOS CUALIFICACIÓN PROFESIONAL: PRODUCCIÓN Y RECOLECCIÓN DE SETAS Y TRUFAS. Código: FME185_2 NIVEL: 2
 MINISTERIO DE EDUCACIÓN, CULTURA Y DEPORTE SECRETARÍA DE ESTADO DE EDUCACIÓN, FORMACIÓN PROFESIONAL Y UNIVERSIDADES DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES
MINISTERIO DE EDUCACIÓN, CULTURA Y DEPORTE SECRETARÍA DE ESTADO DE EDUCACIÓN, FORMACIÓN PROFESIONAL Y UNIVERSIDADES DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES
ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TÉCNICA RECUENTO EN PLACA
 PRT-712.03-040 Página 1 de 6 1. OBJETIVO Determinar el número de Enterobactereaceae presentes en un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
PRT-712.03-040 Página 1 de 6 1. OBJETIVO Determinar el número de Enterobactereaceae presentes en un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA
 PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRÁCTICO N 4. Análisis de fertilidad del suelo
 PRÁCTICO N 4 Análisis de fertilidad del suelo OBJETIVOS Conocer las técnicas actuales de recuento de microorganismos. Conocer la importancia del monitoreo de abundancia, actividad y diversidad de los microorganismos
PRÁCTICO N 4 Análisis de fertilidad del suelo OBJETIVOS Conocer las técnicas actuales de recuento de microorganismos. Conocer la importancia del monitoreo de abundancia, actividad y diversidad de los microorganismos
k 11 N. de publicación: ES k 51 Int. Cl. 5 : A47J 31/54
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 03 987 k 1 Int. Cl. : A47J 31/4 A47J 31/36 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 89109296.7
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 03 987 k 1 Int. Cl. : A47J 31/4 A47J 31/36 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 89109296.7
REQUISITOS PARA EL REGISTRO DE BIOFERTILIZANTES
 REQUISITOS PARA EL REGISTRO DE BIOFERTILIZANTES 1.-PLANILLA DE SOLICITUD DE REGISTRO DE PRODUCTO 2.-PLANILLA DE DEPÓSITO BANCARIO 3.-CARTA DE SOLICITUD DE REGISTRO DEL PRODUCTO 4.-CERTIFICADOS: - CERTIFICADO
REQUISITOS PARA EL REGISTRO DE BIOFERTILIZANTES 1.-PLANILLA DE SOLICITUD DE REGISTRO DE PRODUCTO 2.-PLANILLA DE DEPÓSITO BANCARIO 3.-CARTA DE SOLICITUD DE REGISTRO DEL PRODUCTO 4.-CERTIFICADOS: - CERTIFICADO
Aplicación a escala de laboratorio
 Aplicación a escala de laboratorio Índice de contenidos Velcorin Aplicación a escala de laboratorio págs. 3 5 Introducción pág. 3 Medidas de precaución pág. 3 Método de trabajo (sensorial) pág. 4 Método
Aplicación a escala de laboratorio Índice de contenidos Velcorin Aplicación a escala de laboratorio págs. 3 5 Introducción pág. 3 Medidas de precaución pág. 3 Método de trabajo (sensorial) pág. 4 Método
PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA
 PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA I. OBJETIVO Investigar la presencia de Estreptococos fecales en una muestra de agua mediante la técnica del Número Más Probable (NMP) usando
PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA I. OBJETIVO Investigar la presencia de Estreptococos fecales en una muestra de agua mediante la técnica del Número Más Probable (NMP) usando
11 Número de publicación: Int. Cl. 7 : A01N 43/ Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 229 160 1 Int. Cl. 7 : A01N 43/40 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02748322.1 86 Fecha de
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 229 160 1 Int. Cl. 7 : A01N 43/40 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02748322.1 86 Fecha de
k 11 N. de publicación: ES k 51 Int. Cl. 5 : B43L 9/24 k 72 Inventor/es: Bergonzi, Roberto k 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 041 42 1 Int. Cl. : B43L 9/24 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 90216.8 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 041 42 1 Int. Cl. : B43L 9/24 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 90216.8 86 Fecha de presentación
11 knúmero de publicación: kint. Cl. 7 : A01K 39/01. k 73 Titular/es: k 72 Inventor/es: Martin, Thierry y
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 172 03 1 Int. Cl. 7 : A01K 39/01 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 98108029.4 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 172 03 1 Int. Cl. 7 : A01K 39/01 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 98108029.4 86 Fecha de presentación:
PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN DE LAS COMPETENCIAS PROFESIONALES CUESTIONARIO DE AUTOEVALUACIÓN PARA LAS TRABAJADORAS Y TRABAJADORES
 MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
TRABAJO PRÁCTICO N 6 FERTILIZANTES BIOLÓGICOS: DESARROLLO Y CONTROL DE CALIDAD DE INOCULANTES
 TRABAJO PRÁCTICO N 6 FERTILIZANTES BIOLÓGICOS: DESARROLLO Y CONTROL DE CALIDAD DE INOCULANTES Objetivos Conocer los parámetros para la selección de cepas. Conocer las metodologías y procedimientos microbiológicos
TRABAJO PRÁCTICO N 6 FERTILIZANTES BIOLÓGICOS: DESARROLLO Y CONTROL DE CALIDAD DE INOCULANTES Objetivos Conocer los parámetros para la selección de cepas. Conocer las metodologías y procedimientos microbiológicos
Métodos de inoculación
 Métodos de inoculación Curso: Métodos en fitopatología Unidad de Fitopatología Dto. de Protección Vegetal Facultad de Agronomía. Dr. Pedro Mondino Inoculación en plantas La inoculación en plantas la realizamos
Métodos de inoculación Curso: Métodos en fitopatología Unidad de Fitopatología Dto. de Protección Vegetal Facultad de Agronomía. Dr. Pedro Mondino Inoculación en plantas La inoculación en plantas la realizamos
11 Número de publicación: Int. Cl. 7 : B32B 1/ Inventor/es: Garois, Nicolas. 74 Agente: Esteban Pérez-Serrano, María Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 219 82 1 Int. Cl. 7 : B32B 1/08 F16L 11/12 F16L 11/08 F16L 11/04 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 219 82 1 Int. Cl. 7 : B32B 1/08 F16L 11/12 F16L 11/08 F16L 11/04 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
11 Número de publicación: Int. Cl. 7 : B41F 21/ Agente: Isern Jara, Jorge
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 23 732 1 Int. Cl. 7 : B41F 21/10 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 0012130.0 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 23 732 1 Int. Cl. 7 : B41F 21/10 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 0012130.0 86 Fecha de presentación:
Obtención de Agentes de Control Biológico.
 Obtención de Agentes de Control Biológico. Métodos de aislamiento y selección Objetivos: de ACB Transmitir la importancia de los procesos de búsqueda y selección de ACB como base del éxito de un programa
Obtención de Agentes de Control Biológico. Métodos de aislamiento y selección Objetivos: de ACB Transmitir la importancia de los procesos de búsqueda y selección de ACB como base del éxito de un programa
y desinfección. Medios de cultivo. Objetivos Métodos de esterilización Definiciones Calor seco Calor seco MECÁNICOS FISICOS: QUIMICOS
 Métodos de esterilización y desinfección. n. Medios de cultivo. Curso: Diagnósticos en Fitopatología 17 de setiembre de 2015 Ing. Agr. MSc. Vivienne Gepp Objetivos Familiarizarse con los procesos de desinfección
Métodos de esterilización y desinfección. n. Medios de cultivo. Curso: Diagnósticos en Fitopatología 17 de setiembre de 2015 Ing. Agr. MSc. Vivienne Gepp Objetivos Familiarizarse con los procesos de desinfección
Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos.
 BIPLACA HYCHECK Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos. Son estadísticamente comparables a una Torunda
BIPLACA HYCHECK Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos. Son estadísticamente comparables a una Torunda
1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS
 1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS Existen diferentes métodos para la obtención de ADN bacteriano que varían en duración y complejidad del procedimiento en función de la calidad del ADN que queramos
1. OBTENCIÓN DE ADN DE BACTERIAS PATÓGENAS Existen diferentes métodos para la obtención de ADN bacteriano que varían en duración y complejidad del procedimiento en función de la calidad del ADN que queramos
11 Número de publicación: Int. Cl. 7 : A47G 25/ Inventor/es: Wegscheider, Gustav. 74 Agente: Aguilar Camprubí, M.
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 223 979 1 Int. Cl. 7 : A47G 2/30 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 0200473.6 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 223 979 1 Int. Cl. 7 : A47G 2/30 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 0200473.6 86 Fecha de presentación:
51 Int. CI.: A22C 7/00 ( ) A22C 17/00 ( ) TRADUCCIÓN DE PATENTE EUROPEA. 73 Titular/es: 72 Inventor/es: 74 Agente/Representante:
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 60 083 1 Int. CI.: A22C 7/00 (2006.01) A22C 17/00 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Fecha de presentación y número
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 60 083 1 Int. CI.: A22C 7/00 (2006.01) A22C 17/00 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Fecha de presentación y número
11 knúmero de publicación: kint. Cl. 7 : A01N 59/20
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 143 1 1 Int. Cl. 7 : A01N 9/ 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9699.4 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 143 1 1 Int. Cl. 7 : A01N 9/ 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9699.4 86 Fecha de presentación
11 Número de publicación: Int. Cl. 7 : A63B 71/ Inventor/es: Andreotti, Paolo. 74 Agente: Aguilar Camprubí, M.
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 198 423 1 Int. Cl. 7 : A63B 71/06 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9101462.0 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 198 423 1 Int. Cl. 7 : A63B 71/06 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9101462.0 86 Fecha de presentación:
11 kn. de publicación: ES kint. Cl. 6 : B26B 1/04. k 73 Titular/es: Wenger S.A. k 72 Inventor/es: Jobin, Jacques
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 071 36 1 Int. Cl. 6 : B26B 1/04 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 93810494.0 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 071 36 1 Int. Cl. 6 : B26B 1/04 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 93810494.0 86 Fecha de presentación
Int. Cl.: 72 Inventor/es: Dauvergne, Francois. 74 Agente: Carvajal y Urquijo, Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 28 066 1 Int. Cl.: A47J 37/07 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 03293212.1 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 28 066 1 Int. Cl.: A47J 37/07 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 03293212.1 86 Fecha
- Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio microbiológico.
 Microbiología General e Inmunología Año 2012 Trabajo Práctico Nº1 Objetivos: Que el alumno sea capaz de: - Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio
Microbiología General e Inmunología Año 2012 Trabajo Práctico Nº1 Objetivos: Que el alumno sea capaz de: - Mencionar las Normas de Bioseguridad y precauciones necesarias para trabajar en el laboratorio
TIMSEN EN AGRICULTURA Desinfección natural. Rancho de Producción de Ganado Dos Matas
 TIMSEN EN AGRICULTURA Desinfección natural Rancho de Producción de Ganado Dos Matas Qué es TIMSEN? Sal mejorada catiónica, tensoactiva y de alta actividad biocida. Producto de años de intensa investigación
TIMSEN EN AGRICULTURA Desinfección natural Rancho de Producción de Ganado Dos Matas Qué es TIMSEN? Sal mejorada catiónica, tensoactiva y de alta actividad biocida. Producto de años de intensa investigación
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I
 PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I P # 1 P # 2 P # 3 P # 4 P # 5 P # 6 Uso y cuidados en el manejo del Microscopio Esterilización de materiales y medios Técnicas de Tinción
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I P # 1 P # 2 P # 3 P # 4 P # 5 P # 6 Uso y cuidados en el manejo del Microscopio Esterilización de materiales y medios Técnicas de Tinción
1. INTRODUCCIÓN Preámbulo... 3
 ÍNDICE 1. INTRODUCCIÓN... 1 1.1. SUBPRODUCTOS Y RESIDUOS DE LA INDUSTRIA AGROALIMENTARIA... 3 1.1.1. Preámbulo... 3 1.1.2. Residuos generados. Sus características y composición. Problemática... 5 1.1.2.1.
ÍNDICE 1. INTRODUCCIÓN... 1 1.1. SUBPRODUCTOS Y RESIDUOS DE LA INDUSTRIA AGROALIMENTARIA... 3 1.1.1. Preámbulo... 3 1.1.2. Residuos generados. Sus características y composición. Problemática... 5 1.1.2.1.
Tema 11. Procesos Fermentativos. Fases de un proceso fermentativo
 Tema 11. Procesos Fermentativos 1. Introducción 2. Diseño y funcionamiento del fermentador 3. Tipos de fermentaciones I. Fermentación discontinua II. Fermentación alimentada III. Fermentación continua
Tema 11. Procesos Fermentativos 1. Introducción 2. Diseño y funcionamiento del fermentador 3. Tipos de fermentaciones I. Fermentación discontinua II. Fermentación alimentada III. Fermentación continua
ENFERMEDADES FÚNGICAS DE LA MADERA DE LA VID
 ENFERMEDADES FÚNGICAS F DE LA MADERA DE LA VID Dr. Ing. Agr. Sandra Alaniz Setiembre de 2010 DEFINICIÓN: ENFERMEDADES CAUSADAS POR HONGOS QUE PROVOCAN LA ALTERACIÓN DE LA MADERA Y QUE PUEDEN CONLLEVAR,
ENFERMEDADES FÚNGICAS F DE LA MADERA DE LA VID Dr. Ing. Agr. Sandra Alaniz Setiembre de 2010 DEFINICIÓN: ENFERMEDADES CAUSADAS POR HONGOS QUE PROVOCAN LA ALTERACIÓN DE LA MADERA Y QUE PUEDEN CONLLEVAR,
Valoración de desinfectantes. Método de diluciónneutralización.
 A. ÁLVAREZ ALCÁNTARA, E. ESPIGARES RODRÍGUEZ y R. GÁLVEZ VARGAS 1 Higiene y Sanidad Ambiental, 1: 1-5 (2001) Valoración de desinfectantes. Método de diluciónneutralización. A. Álvarez Alcántara, E. Espigares
A. ÁLVAREZ ALCÁNTARA, E. ESPIGARES RODRÍGUEZ y R. GÁLVEZ VARGAS 1 Higiene y Sanidad Ambiental, 1: 1-5 (2001) Valoración de desinfectantes. Método de diluciónneutralización. A. Álvarez Alcántara, E. Espigares
Int. Cl.: 74 Agente: Temiño Ceniceros, Ignacio
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 286 07 1 Int. Cl.: A61F 7/00 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01274669.9 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 286 07 1 Int. Cl.: A61F 7/00 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01274669.9 86 Fecha
TEMA 12. Pruebas de sensibilidad a los antimicrobianos
 TEMA 12 Pruebas de sensibilidad a los antimicrobianos Tema 12. Pruebas de sensibilidad a los antimicrobianos 1. Nacimiento de la era de los antibióticos 2. Pruebas de sensibilidad a los antimicrobianos
TEMA 12 Pruebas de sensibilidad a los antimicrobianos Tema 12. Pruebas de sensibilidad a los antimicrobianos 1. Nacimiento de la era de los antibióticos 2. Pruebas de sensibilidad a los antimicrobianos
CuPROTAL Beneficios de Cuprotal en el cultivo de la lechuga
 CuPROTAL Beneficios de Cuprotal en el cultivo de la lechuga Ensayo de campo realizado por FS Trials para ARTAL Agronutrientes Ensayo de campo de CuPROTAL para el control de enfermedades en lechuga. ÍNDICE
CuPROTAL Beneficios de Cuprotal en el cultivo de la lechuga Ensayo de campo realizado por FS Trials para ARTAL Agronutrientes Ensayo de campo de CuPROTAL para el control de enfermedades en lechuga. ÍNDICE
AISLAMIENTO DE MICROORGANISMOS
 PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
11 Número de publicación: Int. Cl.: 74 Agente: Gil Vega, Víctor
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 274 433 1 Int. Cl.: B23Q 3/00 (2006.01) B23Q 16/00 (2006.01) B2H 1/02 (2006.01) B2B 11/00 (2006.01) 12 TRADUCCIÓN DE PATENTE
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 274 433 1 Int. Cl.: B23Q 3/00 (2006.01) B23Q 16/00 (2006.01) B2H 1/02 (2006.01) B2B 11/00 (2006.01) 12 TRADUCCIÓN DE PATENTE
EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS
 EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS Los hongos poseen un genoma complejo consistente en: ADN nuclear (n ADN) ADN mitocondrial (mt ADN) en algunos casos ADN plasmídico EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS
EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS Los hongos poseen un genoma complejo consistente en: ADN nuclear (n ADN) ADN mitocondrial (mt ADN) en algunos casos ADN plasmídico EXTRACCIÓN DE ADN DE HONGOS FILAMENTOSOS
8. PRUEBAS DE SUSCEPTIBILIDAD PARA Mycobacterium tuberculosis. Estudios científicos han determinado que al menos el 1 % de los bacilos tuberculosos
 8. PRUEBAS DE SUSCEPTIBILIDAD PARA Mycobacterium tuberculosis. Estudios científicos han determinado que al menos el 1 % de los bacilos tuberculosos de un paciente determinado son resistentes in Vitro a
8. PRUEBAS DE SUSCEPTIBILIDAD PARA Mycobacterium tuberculosis. Estudios científicos han determinado que al menos el 1 % de los bacilos tuberculosos de un paciente determinado son resistentes in Vitro a
11 Número de publicación: Int. Cl. 7 : B60G 7/ Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 204 439 1 Int. Cl. 7 : B60G 7/02 B62D 21/11 B60P 3/22 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud: 00127486.9
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 204 439 1 Int. Cl. 7 : B60G 7/02 B62D 21/11 B60P 3/22 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud: 00127486.9
Evaluación de cultivares de tomate (Solanum lycopersicum) con tolerancia a marchitez bacteriana (Ralstonia solanacearum).
 Evaluación de cultivares de tomate (Solanum lycopersicum) con tolerancia a marchitez bacteriana (Ralstonia solanacearum). Fulvio Enrique Rivas. Técnico del programa de hortalizas. SAN ANDRÉS 30 JUNIO DE
Evaluación de cultivares de tomate (Solanum lycopersicum) con tolerancia a marchitez bacteriana (Ralstonia solanacearum). Fulvio Enrique Rivas. Técnico del programa de hortalizas. SAN ANDRÉS 30 JUNIO DE
Control químico y biológico en árboles con síntoma de tristeza del aguacate en Matanguaran Mpio. de Uruapan Michoacán, México
 Control químico y biológico en árboles con síntoma de tristeza del aguacate en Matanguaran Mpio. de Uruapan Michoacán, México R. Martínez 1, J. Ledesma 1, J. Morales 1, M. Pedraza 1, A. Chávez 1, K. Morales
Control químico y biológico en árboles con síntoma de tristeza del aguacate en Matanguaran Mpio. de Uruapan Michoacán, México R. Martínez 1, J. Ledesma 1, J. Morales 1, M. Pedraza 1, A. Chávez 1, K. Morales
Microbiología. Trabajo Práctico 3. Cultivo e identificación de bacterias. GRACIELA NATALIA PUCCI
 Microbiología Trabajo Práctico 3. Cultivo e identificación de bacterias. GRACIELA NATALIA PUCCI Objetivos: Reconocer los distintos medios de cultivo utilizados para la recuperación de bacterias, y comprender
Microbiología Trabajo Práctico 3. Cultivo e identificación de bacterias. GRACIELA NATALIA PUCCI Objetivos: Reconocer los distintos medios de cultivo utilizados para la recuperación de bacterias, y comprender
11 Número de publicación: Int. Cl. 7 : A01G 9/ Inventor/es: Visser, Cornelis, Frans, Taco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 232 494 1 Int. Cl. 7 : A01G 9/ G01N 9/36 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00961261. 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 232 494 1 Int. Cl. 7 : A01G 9/ G01N 9/36 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00961261. 86 Fecha
11 Número de publicación: Int. Cl. 7 : A24F 17/ Inventor/es: Pisarski, Olivier y Galia, Sylvie. 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 248 497 1 Int. Cl. 7 : A24F 17/00 A24C /40 A24F 13/26 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02291368.
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 248 497 1 Int. Cl. 7 : A24F 17/00 A24C /40 A24F 13/26 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02291368.
11 kn. de publicación: ES kint. Cl. 6 : A01K 1/01. k 73 Titular/es: k 72 Inventor/es: Favreau, Jean. k 74 Agente: Isern Jara, Marta
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 07 499 1 Int. Cl. 6 : A01K 1/01 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 92103829. 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 07 499 1 Int. Cl. 6 : A01K 1/01 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 92103829. 86 Fecha de presentación
11 knúmero de publicación: kint. Cl. 7 : A47G 23/06
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 192 18 1 Int. Cl. 7 : A47G 23/06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00906264.7 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 192 18 1 Int. Cl. 7 : A47G 23/06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00906264.7 86 Fecha de presentación:
11 knúmero de publicación: kint. Cl. 7 : A61K 35/08. k 72 Inventor/es: Yvin, Jean-Claude; k 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 172 332 1 Int. Cl. 7 : A61K 3/08 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9992667.1 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 172 332 1 Int. Cl. 7 : A61K 3/08 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9992667.1 86 Fecha de presentación:
11 Número de publicación: Int. Cl. 7 : C09D 11/ Inventor/es: De Rossi, Umberto. 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 23 7 1 Int. Cl. 7 : C09D 11/00 // B41J 2/01 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00127343.2 86
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 23 7 1 Int. Cl. 7 : C09D 11/00 // B41J 2/01 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00127343.2 86
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
1 Tratamientos de invierno en viña
 1 Tratamientos de invierno en viña INFORMACIÓN TÉCNICA Los tratamientos de invierno en la viña comprenden una serie de prácticas cuyo objetivo es eliminar o reducir los problemas que originan las plagas
1 Tratamientos de invierno en viña INFORMACIÓN TÉCNICA Los tratamientos de invierno en la viña comprenden una serie de prácticas cuyo objetivo es eliminar o reducir los problemas que originan las plagas
ESTRATEGIAS DE CONTROL DE LAS ENFERMEDADES DE LA MADERA DE LA VID
 ESTRATEGIAS DE CONTROL DE LAS ENFERMEDADES DE LA MADERA DE LA VID Dr Jordi Luque i Font IRTA Cabrils JORNADA TRANSFERENCIA TECNOLOGÍA IVICAM ENFERMEDADES DE LA MADERA DE LA VID Tomelloso 5 de Noviembre
ESTRATEGIAS DE CONTROL DE LAS ENFERMEDADES DE LA MADERA DE LA VID Dr Jordi Luque i Font IRTA Cabrils JORNADA TRANSFERENCIA TECNOLOGÍA IVICAM ENFERMEDADES DE LA MADERA DE LA VID Tomelloso 5 de Noviembre
11 Número de publicación: Int. Cl. 7 : A47J 31/ Inventor/es: Rolland, Jacky. 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 223 81 1 Int. Cl. 7 : A47J 31/44 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 019199.3 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 223 81 1 Int. Cl. 7 : A47J 31/44 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 019199.3 86 Fecha de presentación:
PRODUCCION INDUSTRIAL Y COMERCIALIZACION DE AGENTES DE CONTROL BIOLOGICO
 PRODUCCION INDUSTRIAL Y COMERCIALIZACION DE AGENTES DE CONTROL BIOLOGICO Experiencia Nacional Claudine Folch LAGE y Cia. Antagonista Producción Formulación Aplicación Producto comercial Comercialización
PRODUCCION INDUSTRIAL Y COMERCIALIZACION DE AGENTES DE CONTROL BIOLOGICO Experiencia Nacional Claudine Folch LAGE y Cia. Antagonista Producción Formulación Aplicación Producto comercial Comercialización
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO F.E.S. IZTACALA METODOLOGÍA CIENTÍFICA IV Práctica 2: Determinación físico-química de suelo y agua.
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO F.E.S. IZTACALA METODOLOGÍA CIENTÍFICA IV Práctica 2: Determinación físico-química de suelo y agua. Objetivo general: Que el alumno aplique las técnicas, comúnmente
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO F.E.S. IZTACALA METODOLOGÍA CIENTÍFICA IV Práctica 2: Determinación físico-química de suelo y agua. Objetivo general: Que el alumno aplique las técnicas, comúnmente
MICOFLORA EN FRUTOS FRESCOS DE ARANDANOS ACONDICIONADOS PARA EXPORTACIÓN
 MICOFLORA EN FRUTOS FRESCOS DE ARANDANOS ACONDICIONADOS PARA EXPORTACIÓN Programa de Investigación 18 de Marzo de 2011 en Producción Frutícola Serie Actividades de INIA Salto Grande Difusión N 642 Instituto
MICOFLORA EN FRUTOS FRESCOS DE ARANDANOS ACONDICIONADOS PARA EXPORTACIÓN Programa de Investigación 18 de Marzo de 2011 en Producción Frutícola Serie Actividades de INIA Salto Grande Difusión N 642 Instituto
TECNOLOGIA PARA PROTECCION PROLONGADA
 TECNOLOGIA PARA PROTECCION PROLONGADA CHAMP DP es un fungicida y bactericida inorgánico multisitio, de amplio espectro, selectivo, con acción preventiva de contacto, persistente, que frena el avance de
TECNOLOGIA PARA PROTECCION PROLONGADA CHAMP DP es un fungicida y bactericida inorgánico multisitio, de amplio espectro, selectivo, con acción preventiva de contacto, persistente, que frena el avance de
PRÁCTICA 1 PREPARACIÓN DE SOLUCIONES MADRE, REGULADORES DE CRECIMIENTO Y MEDIOS DE CULTIVO
 PRÁCTICA 1 PREPARACIÓN DE SOLUCIONES MADRE, REGULADORES DE CRECIMIENTO Y MEDIOS DE CULTIVO Objetivos Conocer las instalaciones y el equipo del Laboratorio de Biotecnología de Plantas, así como su correcto
PRÁCTICA 1 PREPARACIÓN DE SOLUCIONES MADRE, REGULADORES DE CRECIMIENTO Y MEDIOS DE CULTIVO Objetivos Conocer las instalaciones y el equipo del Laboratorio de Biotecnología de Plantas, así como su correcto
