0, en el equilibrio a T y P constantes. , definición de avance de una reacción. , forma funcional general del potencial químico.
|
|
|
- Vanesa Agüero Maldonado
- hace 5 años
- Vistas:
Transcripción
1 Equlbro SEMINARIO 1 Conceptos Importantes Potencal químco. Actvdad y factor de actvdad. Grados de lbertad de un sstema y regla de las fases. Propedades colgatvas. 1) Fórmulas báscas dg dn 0, en el equlbro a T y P constantes. dg ( ) dn a b a, transferenca de matera entre fases T y P constantes. n n 0, defncón de avance de una reaccón. dg G d, con G, sstema reactvo a T y P constante. 0 RT lna, forma funconal general del potencal químco. 2) Preguntas Conceptuales 1) Para cada uno de los sguentes pares de sustancas establezca cuál tene el menor potencal químco. a) H 2 O(l) a 25 C y 1 atm Vs H 2 O(g) a 25 C y 1 atm. b) H 2 O(s) a 0 C y 1 atm Vs H 2 O(l) a 0 C y 1 atm; c) H 2 O(s) a -5 C y 1 atm Vs H 2 O(l) a -5 C y 1 atm; d) Glucosa sólda a 25 C y 1 atm Vs glucosa dsuelta en una solucón acuosa nsaturada a 25 C y 1 atm.
2 2) Se dce que el potencal químco de una sustanca es una medda de su tendenca al escape. Le parece razonable esta denomnacón? Justfque. 3) Para cada uno de los sguentes sstemas ndque el número de grados de lbertad e dentfque las varables que corresponden a los msmos. a) Una solucón acuosa de sacarosa y rbosa. b) Una solucón acuosa de sacarosa y rbosa en equlbro con sacarosa sólda. c) Una mezcla de agua y benceno líqudo en equlbro con sus vapores. 4) Grafque cómo varía el potencal químco de un gas en funcón de su presón y su fugacdad. 5) Haga un gráfco de la energía lbre de una sustanca en funcón de la temperatura, para un rango de T que abarque los cambos de fase sóldolíqudo y líqudo gas. Indque los cambos de fase y establezca el sentdo físco de la/las pendentes de la gráfca. 6) Dscuta el motvo por qué se producen desvacones negatvas y postvas de la ley de Raoult. 7) Indque s cada una de las sguentes afrmacones son verdaderas o falsas. Modfque cada afrmacón falsa para hacerla correcta. a) La razón por la que los almentos se cocnan más rápda en ollas de presón, es que el equlbro se desplaza del lado de los productos a mayor presón. b) S se preparan solucones de un msmo soluto a guales molaldades pero en dferentes solventes, el descenso en el punto de congelacón será el msmo, suponendo que se comporten dealmente. a) S se preparan solucones de un msmo soluto a guales fraccones molares en dstntos solventes, el descenso en la presón de vapor será el msmo, suponendo comportamento deal. 3) Problemas Problema 1 Un nvestgador boquímco está nvestgando un antbótco que debe ser estable en agua hrvendo. Decde ensayar su compuesto a 140 C, calentando una solucón muy dluda en un tubo sellado del cual se ha sacado todo el are. Qué presón nteror debe resstr
3 el tubo? El punto de ebullcón normal del agua es 100 C y su entalpía de vaporzacón es 9,70 kcal/mol. Problema 2 a) Usando las constantes de la ley de Henry de tablas, calcule la solubldad (en moles/l) de cada uno de los sguentes gases en agua a 25 C s P O2 = 0.2 atm, P N2 = 0.75 atm, P CO2 = 0.05 atm. b) Cual será la presón de vapor a 25 C del agua en esta solucón s se cumple la ley de Raoult?. La presón de vapor del agua pura a 25 C es torr Datos: k H O 43. atm, k H N 86. atm y CO 1, k H 2 10 Problema 3 a) Calcule el punto de ebullcón de una solucón 2m de urea en agua, asumendo que la msma se comporta como una solucón dealmente dluda. b) La urea realmente forma complejos en solucón en los cuales dos o más moléculas forman enlaces de hdrógeno, dando dímeros y polímeros. El aumento del punto de ebullcón será mayor o menor que para el caso de comportamento deal? Datos: K f ( 2 e 2 º H O) 1,86º C m, K ( H O) 0,51 C m. La fórmula de la urea es CON 2 H 4. Problema 4 La sal común se esparce sobre los camnos para mpedr la formacón de helo. El costo de la sal es de $1,92/100kg. Una fuente rca en ZnCl 2 fue descuberta y explotada a un costo de $1,49/100 kg. Qué sal es más efectva desde el punto de vsta del costo? Problema 5 Una solucón acuosa que contene 50 g de soluto por ltro, tene una presón osmótca de 9 atm a 37 ºC. Suponga comportamento deal. a) Cuál es el peso molecular del soluto? b) Cuál es el punto de congelacón de la solucón?
4 c) S esta solucón se pone en contacto, a través de una membrana sempermeable, con otra solucón de presón osmótca de 10 atm. Haca donde fluye el solvente? d) En cuál de las dos solucones la presón de vapor del solvente es mayor? Problema 6 Suponga que 6.0g de una mezcla de naftaleno (C 10 H 8 ) y antraceno (C 14 H 10 ) son dsueltas en 300g de benceno. Cuando la solucón es enfrada, comenza a congelar a una temperatura 0,70ºC por debajo del punto de enframento del benceno puro. Encuentre la composcón de la mezcla. Dato Kf para el benceno es 5.1 ºC kg /mol. Problema 7 La presón de vapor del preno sóldo puro a 25 C, es P 1 atm. La solubldad a 25 C del preno en el agua es 10-4 mol/l; la solubldad del preno en etanol a 25 C es mayor que 10-4 mol/l. N el agua n el etanol dsuelven sgnfcatvamente el preno. a) Cuál es la presón de vapor del preno por encma de una solucón saturada de preno en agua a 25 C?. b) S se agrega etanol a una solucón saturada acuosa, se dsuelve más preno. Cuando se alcanza el nuevo equlbro con preno sóldo, será la presón de vapor del preno por encma de la nueva solucón mayor menor o gual a la parte a)?. c) A 25 C la solubldad del preno en una solucón acuosa 0.1 M de ctosna es mol/l. Este ncremento en la solubldad es debdo a la formacón de un complejo entre preno y ctosna. Calcule los valores de las constantes de equlbro para las sguentes reaccones a 25 C, sendo P = preno y C = ctosna. Suponga que es váldo aproxmar actvdades con concentracones. 1) P(solucón)+C(solucón)PC(solucón). 2) P(sóldo)+C(solucón)PC(solucón). Problema 8 En una solucón 0,3 m de sacarosa (C 12 H 22 O 11 ), la molardad es 0,282 M a 20ºC y 1atm. a) Estme la presón osmótca de esta solucón usando la ecuacón de Van t Hoff. B) La
5 presón osmótca observada expermentalmente para esta solucón es 7,61 atm. Use este dato para encontrar la actvdad del agua. SEMINARIO 2 Conceptos Importantes Energía lbre de reaccón. Cocente de actvdades Q. Constante de equlbro K. Dependenca de K con T. 1) Fórmulas báscas 0 G G ( T) RT ln Q, reaccones en fase gaseosa. P 0 G G ( T, P) RT ln Q, reaccones en solucón. 2) Preguntas Conceptuales 1. Represente gráfcamente a K como funcón de la varacón de energía lbre estándar. Indque el valor de 0 G en los sguentes casos: a) Una reaccón que no ocurre (K = 0). b) Una reaccón completa (K=). c) Una reaccón cuya varacón de energía lbre estándar es Grafque la varacón de energía lbre de una reaccón en funcón de Q/K. Represente en este gráfco lo que ocurre cuando en el estado ncal sólo hay reactvos pero no productos. Represente la stuacón nversa: ncalmente sólo hay productos. 3. Suponendo que para una reaccón dada el H 0 r es constante, grafque cualtatvamente el logartmo natural de la constante de equlbro como funcón de 1/T para el caso de una reaccón exotérmca y de una endotérmca. En base a esto, ndque cómo afecta la temperatura al equlbro de ambos tpos de reaccones.
6 4. Consdere que para la reaccón A+BC la constante de equlbro es de Obtenga el valor de la constante de equlbro para la reaccón CA+B y 2A+2B2C. 5. Consdere la reaccón A+BP que ocurre en agua y reencuentra en equlbro. Se perturba el equlbro cuando se agrega más solvente?. En caso de consderar postva la respuesta, ndque haca donde. 3) Problemas Problema 1 Consdere la reaccón A 2B en solucón acuosa a 25 C y 1 atm. La constante de equlbro es 10 y el cambo de entalpía estándar es 50 Kcal/mol. a) Calcule el cambo de energía lbre estándar a 25 C. b) Calcule el cambo de entropía estándar a 25 C. c) Aumenta o dsmnuye la constante de equlbro al aumentar la temperatura? d) A T y P constante este sstema absorbe o entrega calor? e)s se duplca la concentracón de B: Aumenta o dsmnuye el cambo de energía lbre?. Calcule el cambo en G causado al duplcar la actvdad de B. f) Es espontánea la reaccón cuando a A = 1 y a B = 1?. g) S se mantene la actvdad de B gual a 1, cuál es la actvdad mínma de A que es sufcente para que la reaccón sga sendo espontánea?. Problema 2 Consdere la hdrólss de ATP a ADP a ph = 7 ATP ADP. P a) Calcule la constante de equlbro para la reaccón a 25 C y 1 atm. b) Calcule la constante de equlbro a 37 C y 1 atm. c) Calcule la constante de equlbro a 0 C y 1 atm. 0 Datos H r ' 24.3kJ mol, G r ' 31.0 kj mol. 0 Problema 3 Use la energía lbre de hdrólss del ATP en condcones estándar a 37 C para resolver los sguentes casos.
7 a) Calcular el G de la hdrólss cuando [ATP] = 10-2, [ADP] = 10-4 y [P ] = 2, b) Calcular el máxmo trabajo útl bajo las condcones de la parte (a) cuando un mol de ATP se hdrolza. Este trabajo podría usarse, por ejemplo, para contraer un músculo y elevar un peso. c) Calcule G y el máxmo trabajo útl s [ATP] = 10-7, [ADP] = 10-1 y [P ] = 2,5 x Problema 4 La bosíntess de la glutamna a partr de glutamato e ón amono es una reaccón acoplada a la hdrólss del ATP de acuerdo con el sguente esquema GLU NH 4 ATP GLN ADP P s glutamna ntetasa La constante de equlbro para el sstema completo en presenca de la enzma es: K = 1200 a ph 7 y 37 C. a) Cuál es el cambo de energía lbre estándar, G ', para la reaccón a ph 7 y 37 C?. b) En ausenca de ATP, ADP y fosfato, la constante de equlbro para la reaccón: GLU NH4 GLN H2O es K 0 = 0,0035 a ph 7 y 37 C. Use esta observacón y la nformacón de arrba para calcular G ' 310 para la reaccón: ATP 2 H O ADP P c) Explque brevemente la funcón del ATP en la ruta bosntétca. d) Cuál es la dferenca entre el papel del ATP y el papel de la enzma en el proceso boquímco? Problema 5 En un certo solvente un polpéptdo camba de conformacón de espral estable a baja temperatura a una hélce estable a alta temperatura. La constante de equlbro se puede escrbr aproxmadamente como: K=[hélce]/[espral]. A 50 C, K = 1 y a 60 C, K = 10. a) Calcule el H 0 para la reaccón. Se absorbe o emte calor?. b) Calcule S 0 para la reaccón a 50 C.
8 c) La estructura de hélce se supone rígda, sostenda por puentes de hdrógeno. La estructura de espral es flexble, con los puentes de hdrógeno rotos. Es consstente este modelo con los sgnos y magntudes de H 0 y S 0? Explque el motvo de los valores obtendos.
9 SEMINARIO 3 Conceptos Importantes Potencal electroquímco. Transporte entre fases de dstnto potencal. FEM de una pla. Coefcente de actvdad de ones: ley límte de Debye-Hückel. 4) Fórmulas báscas E E( cátodo) E( ánodo) G nfe ~ z F, a, a a 5) Preguntas Conceptuales 1. Explque cómo determnar la energía lbre estándar de una reaccón electroquímca a partr de meddas de potencal. De qué manera calcularía las varacones de entropía y entalpía? 2. Indque medante un ejemplo cómo pueden utlzarse meddas de potencal para determnar las propedades termodnámcas de reaccones que no son de óxdoreduccón. 3. Escrba la condcón de equlbro en funcón de las concentracones, para el transporte de ones A + entre dos solucones que se encuentran a dstnto potencal eléctrco. Es el potencal químco del ón en estas solucones el msmo? 6) Problemas Problema 1 Escrba las hemrreacones y la reaccón global para las sguentes celdas. Además ndque s, en condcones estándares, cada celda funcona espontáneamente en el sentdo escrto. Pt Cl 2 (g) HCl(aq) HBr(aq) Br 2 (l) Pt Pt(s) Fe +3 (aq),fe +2 (aq) Sn +4 (aq) Sn +2 (aq) Pt(s)
10 Ag AgNO 3 (aq) AgNO 3 (aq) Ag Problema 2 Para la celda Pt(s) Fe +2 (a=2),fe +3 (a=1.2) I -1 (a=0.1) I 2 (s) Pt(s) a) Escrba la reaccón de la pla. b) Calcule E 298. c) Cuál termnal está a mayor potencal? d) Cuándo la pla se pone en funconamento, haca qué termnal fluyen los electrones? Problema 3 Consdere la reaccón CH3 CH2OH( aq) 1 2O2( g) CH3COH( aq) H2O (l) a) Calcule E para esta reaccón a 25ºC. b) Calcule la energía lbre estándar (en Kcal/mol) para la reaccón a 25ºC. c) Calcule la constante de equlbro a 25ºC. d) Calcule E para la reaccón a 25ºC cuando las actvdades son: a(etanol) = 0.1, P O2 = 4 atm, a(acetaldehído) = 1, y a(agua) = 1. e) Calcule G para la reaccón en las condcones del ítem (d). Problema 4 Los ctocromos son hemo proteínas en las cuales un anllo de porfrna está coordnado, a través de su ntrógeno central, a un átomo de herro que puede sufrr una óxdo-reduccón de 1 electrón. El ctocromo-f es un ejemplo de esta clase de moléculas que actúa como un agente "redox" en fotosíntess. El potencal de reduccón estándar E' del ctocromo-f a ph 7 se puede determnar acoplándolo a un agente de E' conocdo, tal como ferrcanuro/ferrocanuro: Fe ( CN) CN E'= V e Fe( ) 6 En un expermento típco, llevado a cabo espectrofotométrcamente, una solucón a 25ºC 4 3 y ph 7 que contene una relacón, [ Fe ( CN) ] [ Fe( CN) ] 2. 0, se encuentra que tene 6 6
11 una relacón de equlbro [ Ct ] [ ] red Ct ox a) Calcule E' (reduccón) para el ctocromo-f. b) En base al resultado anteror ndque s puede consderarse al ctocromo-f un buen oxdante, tal como para causar la formacón de O 2 a partr de H 2O a 25 ºC y ph 7?. Problema 5 Consdere la sguente reaccón en la cual son transferdos dos electrones. 2 Ctocromo c( ferroso) pruvato 2H 2Ctocromo c( ferrco) lactato. a) Cuál es el E' para esta reaccón a ph 7 y 25ºC? b) Calcule la constante de equlbro para la reaccón a ph 7 y 25ºC. c) Calcule el cambo de energía lbre estándar a ph 7 y 25ºC. d) Calcule el cambo de energía lbre (a ph 7 y 25ºC) s la concentracón de lactato es 5 veces la concentracón del pruvato y el ctocromo-c (férrco) es 10 veces el ctocromo-c (ferroso). Problema 6 En las células vvas, la concentracón de ones sodo en el nteror de las células se mantene constante y a un nvel menor que en el exteror de la célula, pues los ones sodo son transportados actvamente desde la célula. Consdere el sguente proceso a 37ºC y 1 atm.: Na + (a=0.04 M, nteror) Na + (a=0.14 M, exteror). Asumendo que el potencal eléctrco es el msmo en el exteror que en el nteror: a) Calcule G molar para este proceso. Es espontáneo el proceso? b) Cuál es el G correspondente a la transferenca de tres moles de Na + desde el nteror al exteror? c) Cuánto vale el G cuando el sstema está en equlbro? Cómo será la relacón de concentracones en este caso? d) La hdrólss de ATP se puede utlzar para potencar la bomba de ones sodo. NaCl(0.04 M, nt)+atp NaCl(0.14 M, ext)+adp+p Para una relacón [ATP]/[ADP]=10 Cuál debe ser la concentracón de fosfato necesara para mantener el sstema en equlbro?
12 Problema 7 Una membrana celular a 37 ºC es permeable a los ones Ca ++. Un análss mostró que la concentracón nterna fue 0.1M y la externa 0.001M. a) Qué dferenca de potencal debe exstr a través de la membrana para que el calco esté en equlbro en las condcones antedchas? b) Es el potencal en el nteror menor o mayor que en el exteror? c) S el potencal nterno meddo es +10 mv con respecto al exteror: Cuál es el mínmo trabajo (reversble) requerdo para transferr un mol de ones calco del exteror al nteror en estas condcones? Problema 8 Usando sólo los electrodos de la tabla, dseñe tres plas dferentes en las cuales ocurra la reaccón 3Fe +2 (aq) 2Fe +3 (aq) + Fe(s). Calcule Eº y ΔGº para cada una de esas celdas a 25ºC.
POTENCIAL QUÍMICO ACTIVIDAD Y FACTOR DE ACTIVIDAD GRADOS DE LIBERTAD DE UN SISTEMA REGLA DE LAS FASES PROPIEDADES COLIGATIVAS
 FISICOQUÍMICA SEMINARIO N 2: EQUILIBRIO POTENCIAL QUÍMICO ACTIVIDAD Y FACTOR DE ACTIVIDAD GRADOS DE LIBERTAD DE UN SISTEMA REGLA DE LAS FASES PROPIEDADES COLIGATIVAS FORMULAS BASICAS dg dn 0, en el equlbro
FISICOQUÍMICA SEMINARIO N 2: EQUILIBRIO POTENCIAL QUÍMICO ACTIVIDAD Y FACTOR DE ACTIVIDAD GRADOS DE LIBERTAD DE UN SISTEMA REGLA DE LAS FASES PROPIEDADES COLIGATIVAS FORMULAS BASICAS dg dn 0, en el equlbro
Lección: Disoluciones
 Leccón: Dsolucones TEMA: Introduccón 1 Adolfo Bastda Pascual Unversdad de Murca. España. I. Caracterzacón de las dsolucones.......2 I.A. Composcón de una dsolucón....... 2 I.B. Magntudes molares parcales.........
Leccón: Dsolucones TEMA: Introduccón 1 Adolfo Bastda Pascual Unversdad de Murca. España. I. Caracterzacón de las dsolucones.......2 I.A. Composcón de una dsolucón....... 2 I.B. Magntudes molares parcales.........
Disoluciones. Disolución ideal. Disolución ideal. Disolución ideal. Disolución ideal
 Dsolucones TEM. Dsolucones reales. otencal químco en dsolucones reales. Concepto de actvdad. Una dsolucón es una mezcla homogénea de un componente llamado dsolvente () que se encuentra en mayor proporcón
Dsolucones TEM. Dsolucones reales. otencal químco en dsolucones reales. Concepto de actvdad. Una dsolucón es una mezcla homogénea de un componente llamado dsolvente () que se encuentra en mayor proporcón
Fisicoquímica A y B Seminario del módulo 2
 Fisicoquímica A y B Seminario del módulo 2 Preguntas Conceptuales 1) Para cada uno de los siguientes pares de sustancias establezca cuál tiene el menor potencial químico. a) H 2 O(l) a 25 C y 1 atm Vs
Fisicoquímica A y B Seminario del módulo 2 Preguntas Conceptuales 1) Para cada uno de los siguientes pares de sustancias establezca cuál tiene el menor potencial químico. a) H 2 O(l) a 25 C y 1 atm Vs
Equilibrio a T y P constantes
 Equlbro a y P constantes Consderamos sstemas a y P constante Eso sgnfca en equlbro térmco y mecánco con un entorno de y P constante. Consderamos sstemas cerrados Eso sgnfca que el desequlbro materal entre
Equlbro a y P constantes Consderamos sstemas a y P constante Eso sgnfca en equlbro térmco y mecánco con un entorno de y P constante. Consderamos sstemas cerrados Eso sgnfca que el desequlbro materal entre
1. Actividad y Coeficientes de actividad
 ermodnámca. ema Dsolucones Reales. Actvdad y Coecentes de actvdad Se dene el coecente de actvdad,, de manera que: ( ( ln Actvdad ( Esta epresón es análoga a la de las dsolucones deales. Sn embargo, es
ermodnámca. ema Dsolucones Reales. Actvdad y Coecentes de actvdad Se dene el coecente de actvdad,, de manera que: ( ( ln Actvdad ( Esta epresón es análoga a la de las dsolucones deales. Sn embargo, es
Fugacidad. Mezcla de gases ideales
 Termodnámca del equlbro Fugacdad. Mezcla de gases deales rofesor: Alí Gabrel Lara 1. Fugacdad 1.1. Fugacdad para gases Antes de abarcar el caso de mezclas de gases, debemos conocer como podemos relaconar
Termodnámca del equlbro Fugacdad. Mezcla de gases deales rofesor: Alí Gabrel Lara 1. Fugacdad 1.1. Fugacdad para gases Antes de abarcar el caso de mezclas de gases, debemos conocer como podemos relaconar
Si consideramos un sistema PVT con N especies químicas π fases en equilibrio se caracteriza por: P v =P L = =P π
 EQUILIBRIO DE FASES Reglas de las fases. Teorema de Duhem S consderamos un sstema PVT con N especes químcas π fases en equlbro se caracterza por: P, T y (N-1) fraccones mol tal que Σx=1 para cada fase.
EQUILIBRIO DE FASES Reglas de las fases. Teorema de Duhem S consderamos un sstema PVT con N especes químcas π fases en equlbro se caracterza por: P, T y (N-1) fraccones mol tal que Σx=1 para cada fase.
Tema 2. Propiedades termodinámicas de mezclas líquidas
 Generaldades Modelos de solucones líqudas deales Modelos de solucones líqudas NO deales UNIVERSIDAD CENTRAL Tema 2. Propedades termodnámcas de mezclas líqudas Termodnámca del Equlbro Escuela de Ingenería
Generaldades Modelos de solucones líqudas deales Modelos de solucones líqudas NO deales UNIVERSIDAD CENTRAL Tema 2. Propedades termodnámcas de mezclas líqudas Termodnámca del Equlbro Escuela de Ingenería
PROCESOS DE SEPARACION UTILIZANDO EQUIPOS DE ETAPAS DE EQUILIBRIO
 PROCESOS DE SEPARACION UTILIZANDO EQUIPOS DE ETAPAS DE EQUILIBRIO Concepto de equlbro físco Sstema Fase Componente Solubldad Transferenca Equlbro Composcón 2 Varables de mportanca en el equlbro de fases:
PROCESOS DE SEPARACION UTILIZANDO EQUIPOS DE ETAPAS DE EQUILIBRIO Concepto de equlbro físco Sstema Fase Componente Solubldad Transferenca Equlbro Composcón 2 Varables de mportanca en el equlbro de fases:
1.SISTEMA AIRE AGUA: PSICOMETRÍA 2. TERMODINÁMICA DE LAS REACCIONES QUÍMICAS. 3. COMBUSTIÓN 4. ANÁLISIS EXERGÉTICO. TEMA 7: Psicometría y combustión
 TEMA 7: Pscometría y combustón 1.SISTEMA AIRE AGUA: PSICOMETRÍA Humedad específca y relatva del are. Temperatura de punto de rocío, de saturacón adabátca y de bulbo húmedo. Dagrama pscrométrco.. TERMODINÁMICA
TEMA 7: Pscometría y combustón 1.SISTEMA AIRE AGUA: PSICOMETRÍA Humedad específca y relatva del are. Temperatura de punto de rocío, de saturacón adabátca y de bulbo húmedo. Dagrama pscrométrco.. TERMODINÁMICA
Laboratorio de Química Física I. Curso Clara Gómez. Remedios González. Rafael Viruela.
 DISOLUCIONES 1 DIAGRAMA DE FASES TEMPERATURA DE EBULLICIÓN- COMPOSICIÓN DE UNA MEZCLA LÍQUIDA BINARIA Fase es una porcón homogénea y físcamente dferencada de un sstema, separada de las otras partes del
DISOLUCIONES 1 DIAGRAMA DE FASES TEMPERATURA DE EBULLICIÓN- COMPOSICIÓN DE UNA MEZCLA LÍQUIDA BINARIA Fase es una porcón homogénea y físcamente dferencada de un sstema, separada de las otras partes del
TERMODINÁMICA DEL EQUILIBRIO CAPÍTULO V. EQUILIBRIO DE REACCIÓN QUÍMICA
 Ing. Federco G. Salazar Termodnámca del Equlbro TERMODINÁMICA DEL EQUILIBRIO CAPÍTULO V. EQUILIBRIO DE REACCIÓN QUÍMICA Contendo 1. Conversón y Coordenada de Reaccón. 2. Ecuacones Independentes y Regla
Ing. Federco G. Salazar Termodnámca del Equlbro TERMODINÁMICA DEL EQUILIBRIO CAPÍTULO V. EQUILIBRIO DE REACCIÓN QUÍMICA Contendo 1. Conversón y Coordenada de Reaccón. 2. Ecuacones Independentes y Regla
TERMODINÁMICA AVANZADA
 ERMODINÁMICA AANZADA Undad III: ermodnámca del Equlbro Fugacdad Fugacdad para gases, líqudos y sóldos Datos volumétrcos 9/7/ Rafael Gamero Fugacdad ropedades con varables ndependentes y ln f ' Con la dfncón
ERMODINÁMICA AANZADA Undad III: ermodnámca del Equlbro Fugacdad Fugacdad para gases, líqudos y sóldos Datos volumétrcos 9/7/ Rafael Gamero Fugacdad ropedades con varables ndependentes y ln f ' Con la dfncón
Lección: Equilibrio Material
 Leccón: Equlbro Materal TEMA: Introduccón 1 Adolfo Bastda Pascual Unversdad de Murca. España. I. Equlbro materal............................2 I.A. Condcón general de equlbro materal...2 II. Equlbro de
Leccón: Equlbro Materal TEMA: Introduccón 1 Adolfo Bastda Pascual Unversdad de Murca. España. I. Equlbro materal............................2 I.A. Condcón general de equlbro materal...2 II. Equlbro de
TERMODINÁMICA DE SOLUCIONES.
 Slva érez Casas Termodnámca de Solucones TRMODINÁMIC D SOLUCIONS. Una dsolucón es una mezcla homogénea de especes químcas dspersas a escala molecular. Una dsolucón puede ser gaseosa, líquda o sólda. Se
Slva érez Casas Termodnámca de Solucones TRMODINÁMIC D SOLUCIONS. Una dsolucón es una mezcla homogénea de especes químcas dspersas a escala molecular. Una dsolucón puede ser gaseosa, líquda o sólda. Se
INSTITUTO POLITÉCNICO NACIONAL ESCUELA NACIONAL DE CIENCIAS BIOLÓGICAS INGENIERÍA EN SISTEMAS AMBIENTALES
 ESCUELA NACONAL DE CENCAS BOLÓGCAS NGENERÍA EN SSTEMAS AMBENTALES HORAS DE TEORÍA 5 ASGNATURA TERMODNÁMCA BÁSCA HORAS DE PRÁCTCA 4 SEMESTRE 3 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ CORRECTAMENTE LA
ESCUELA NACONAL DE CENCAS BOLÓGCAS NGENERÍA EN SSTEMAS AMBENTALES HORAS DE TEORÍA 5 ASGNATURA TERMODNÁMCA BÁSCA HORAS DE PRÁCTCA 4 SEMESTRE 3 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ CORRECTAMENTE LA
Balances de Energía. Balance general de energía. Acumulación Entrada Salida Adición neta Producción
 Balances de Energía Los balances macroscópcos de energía se pueden deducr a partr del prmer prncpo de la termodnámca. Éste, en dstntas formas de presentacón se puede defnr como: a) dq dw 0 c c O sea que
Balances de Energía Los balances macroscópcos de energía se pueden deducr a partr del prmer prncpo de la termodnámca. Éste, en dstntas formas de presentacón se puede defnr como: a) dq dw 0 c c O sea que
DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE INTEGRACION III
 DEPRTMENTO DE INGENIERI QUIMIC Undad 2: Presón de vapor CTEDR DE INTEGRCION III Problema Nº 1: a) Tomando los datos necesaros de una tabla físca, representar una curva que relacone la presón de vapor del
DEPRTMENTO DE INGENIERI QUIMIC Undad 2: Presón de vapor CTEDR DE INTEGRCION III Problema Nº 1: a) Tomando los datos necesaros de una tabla físca, representar una curva que relacone la presón de vapor del
Aplicación de la termodinámica a las reacciones químicas Andrés Cedillo Departamento de Química Universidad Autónoma Metropolitana-Iztapalapa
 Aplcacón de la termodnámca a las reaccones químcas Andrés Cedllo Departamento de Químca Unversdad Autónoma Metropoltana-Iztapalapa Introduccón Las leyes de la termodnámca, así como todas las ecuacones
Aplcacón de la termodnámca a las reaccones químcas Andrés Cedllo Departamento de Químca Unversdad Autónoma Metropoltana-Iztapalapa Introduccón Las leyes de la termodnámca, así como todas las ecuacones
2.1. Sustancias puras. Medida de los cambios de entalpía.
 2 Metalurga y termoquímca. 7 2. Metalurga y termoquímca. 2.1. Sustancas puras. Medda de los cambos de entalpía. De acuerdo a las ecuacones (5 y (9, para un proceso reversble que ocurra a presón constante
2 Metalurga y termoquímca. 7 2. Metalurga y termoquímca. 2.1. Sustancas puras. Medda de los cambos de entalpía. De acuerdo a las ecuacones (5 y (9, para un proceso reversble que ocurra a presón constante
INSTITUTO POLITÉCNICO NACIONAL ESCUELA NACIONAL DE CIENCIAS BIOLÓGICAS INGENIERÍA EN SISTEMAS AMBIENTALES
 NSTTUTO POLTÉCNCO NACONAL ESCUELA NACONAL DE CENCAS BOLÓGCAS NGENERÍA EN SSS AMBENTALES HORAS DE TEORÍA 5 ASGNATURA TERMODNÁMCA BÁSCA HORAS DE PRÁCTCA 4 SEMESTRE 3 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ
NSTTUTO POLTÉCNCO NACONAL ESCUELA NACONAL DE CENCAS BOLÓGCAS NGENERÍA EN SSS AMBENTALES HORAS DE TEORÍA 5 ASGNATURA TERMODNÁMCA BÁSCA HORAS DE PRÁCTCA 4 SEMESTRE 3 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ
Dividiendo la ecuación anterior por n (total) podemos expresar en cantidades molares
 3 Propedades termodnámcas de las solucones 3. 17 Propedades termodnámcas de las solucones Extendemos el tratamento desarrollado prevamente a las mezclas de dos componentes DR09, con la consderacón que
3 Propedades termodnámcas de las solucones 3. 17 Propedades termodnámcas de las solucones Extendemos el tratamento desarrollado prevamente a las mezclas de dos componentes DR09, con la consderacón que
FISICOQUÍMICA FARMACÉUTICA (0108) UNIDAD 1. CONCEPTOS BÁSICOS DE CINÉTICA QUÍMICA
 FISICOQUÍMICA FARMACÉUTICA (008) UNIDAD. CONCEPTOS BÁSICOS DE CINÉTICA QUÍMICA Mtra. Josefna Vades Trejo 06 de agosto de 0 Revsón de térmnos Cnétca Químca Estuda la rapdez de reaccón, los factores que
FISICOQUÍMICA FARMACÉUTICA (008) UNIDAD. CONCEPTOS BÁSICOS DE CINÉTICA QUÍMICA Mtra. Josefna Vades Trejo 06 de agosto de 0 Revsón de térmnos Cnétca Químca Estuda la rapdez de reaccón, los factores que
FISICOQUÍMICA DE SISTEMAS AMBIENTALES UNIDADES TEMÁTICAS
 FSCOQUÍMCA DE SSTEMAS HORAS DE TEORÍA 5 ASGNATURA AMBENTALES HORAS DE PRÁCTCA 4 SEMESTRE 4 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ LOS CONCEPTOS FSCOQUÍMCOS FUNDAMENTALES RELACONADOS CON EL ESTUDO DE
FSCOQUÍMCA DE SSTEMAS HORAS DE TEORÍA 5 ASGNATURA AMBENTALES HORAS DE PRÁCTCA 4 SEMESTRE 4 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ LOS CONCEPTOS FSCOQUÍMCOS FUNDAMENTALES RELACONADOS CON EL ESTUDO DE
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 5ª RELACIÓN DE PROBLEMAS.
 EPARTAMENTO E QUÍMCA ANALÍTCA Y TECNOLOGÍA E ALMENTOS FUNAMENTOS E ANÁLSS NSTRUMENTAL. 5ª RELACÓN E PROBLEMAS..- Calcular los números de transporte correspondentes a los ones Cl - y H : a) En una dsolucón
EPARTAMENTO E QUÍMCA ANALÍTCA Y TECNOLOGÍA E ALMENTOS FUNAMENTOS E ANÁLSS NSTRUMENTAL. 5ª RELACÓN E PROBLEMAS..- Calcular los números de transporte correspondentes a los ones Cl - y H : a) En una dsolucón
EXAMEN PARCIAL DE TERMODINÁMICA (IA14). 7 de febrero 04
 EXAMEN PARCIAL DE ERMODINÁMICA (IA4). 7 de ebrero 04. Sentdo de evolucón y condcones de equlbro en un sstema hdrostátco cerrado. Prncpos extremales para S y U. a. Supóngase que se permte la expansón soterma
EXAMEN PARCIAL DE ERMODINÁMICA (IA4). 7 de ebrero 04. Sentdo de evolucón y condcones de equlbro en un sstema hdrostátco cerrado. Prncpos extremales para S y U. a. Supóngase que se permte la expansón soterma
INSTITUTO POLITÉCNICO NACIONAL ESCUELA NACIONAL DE CIENCIAS BIOLÓGICAS INGENIERÍA EN SISTEMAS AMBIENTALES
 ASGNATURA FSCOQUÍMCA DE SSS HORAS DE TEORÍA 5 AMBENTALES HORAS DE PRÁCTCA 4 SEMESTRE 4 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ LOS CONCEPTOS FSCOQUÍMCOS FUNDAMENTALES RELACONADOS CON EL ESTUDO DE SSS
ASGNATURA FSCOQUÍMCA DE SSS HORAS DE TEORÍA 5 AMBENTALES HORAS DE PRÁCTCA 4 SEMESTRE 4 CRÉDTOS 14 OBJETVO: EL ESTUDANTE MANEJARÁ LOS CONCEPTOS FSCOQUÍMCOS FUNDAMENTALES RELACONADOS CON EL ESTUDO DE SSS
EQUILIBRIO LÍQUIDO VAPOR EN UN SISTEMA NO IDEAL
 EQUILIBRIO LÍQUIDO VAPOR EN UN SISTEMA NO IDEAL OBJETIVO El alumno obtendrá el punto azeotrópco para el sstema acetona-cloroformo, calculará los coefcentes de actvdad de cada componente a las composcones
EQUILIBRIO LÍQUIDO VAPOR EN UN SISTEMA NO IDEAL OBJETIVO El alumno obtendrá el punto azeotrópco para el sstema acetona-cloroformo, calculará los coefcentes de actvdad de cada componente a las composcones
MÉTODO DE LAS VELOCIDADES INICIALES
 MÉTODO DE LAS VELOCIDADES INICIALES OBJETIVO El alumno determnará los órdenes de reaccón respecto al yodo, la acetona y los ones hdrógeno de la reaccón de yodo con acetona, así como la constante de velocdad
MÉTODO DE LAS VELOCIDADES INICIALES OBJETIVO El alumno determnará los órdenes de reaccón respecto al yodo, la acetona y los ones hdrógeno de la reaccón de yodo con acetona, así como la constante de velocdad
Equilibrio fásico. (b) El sistema heterogéneo se considera aislado.
 Termodnámca del equlbro Equlbro fásco Profesor: lí Lara En el área de Ingenería Químca exsten muchos procesos ndustrales en los cuales está nvolucrado el equlbro entre fases. Una de estas operacones es
Termodnámca del equlbro Equlbro fásco Profesor: lí Lara En el área de Ingenería Químca exsten muchos procesos ndustrales en los cuales está nvolucrado el equlbro entre fases. Una de estas operacones es
Fgura : Curvas de equlbro Datos: Calor específco de los gases de salda del horno: 8, Vapor de agua a kg cm a: ffl Temperatura de saturacón:, ff C. ffl
 Problema Combustón de azufre y fabrcacón de óleum Se quema en un horno azufre puro con un % de exceso de are sobre la cantdad estequométrca para oxdarlo a SO, de forma que se transforma el 9% en dóxdo
Problema Combustón de azufre y fabrcacón de óleum Se quema en un horno azufre puro con un % de exceso de are sobre la cantdad estequométrca para oxdarlo a SO, de forma que se transforma el 9% en dóxdo
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA. Ingeniería Química
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA Ingenería Químca Undad I. Introduccón a los cálculos de Ingenería Químca
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA Ingenería Químca Undad I. Introduccón a los cálculos de Ingenería Químca
APLICACIONES DE LOS SISTEMAS LINEALES 1. MODELACION DE POLINOMIOS CONOCIENDO UN NUMERO DETERMINADO DE PUNTOS DEL PLANO.
 APLICACIONES DE LOS SISTEMAS LINEALES 1. MODELACION DE POLINOMIOS CONOCIENDO UN NUMERO DETERMINADO DE PUNTOS DEL PLANO. Dado un numero n de puntos del plano ( a, b ) es posble encontrar una funcón polnómca
APLICACIONES DE LOS SISTEMAS LINEALES 1. MODELACION DE POLINOMIOS CONOCIENDO UN NUMERO DETERMINADO DE PUNTOS DEL PLANO. Dado un numero n de puntos del plano ( a, b ) es posble encontrar una funcón polnómca
Montajes para electrolisis
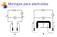 Montajes para electrolss A e e A V V + + puente salno a b Doble capa lectrodo Solucón C C = q V ( ) (+) a b c Proceso electródco tapas del proceso electródco lectrodo Interfase Dsoluc lectrodo Interfase
Montajes para electrolss A e e A V V + + puente salno a b Doble capa lectrodo Solucón C C = q V ( ) (+) a b c Proceso electródco tapas del proceso electródco lectrodo Interfase Dsoluc lectrodo Interfase
Unidad IV. en procesos reactivos
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA Ingenería Químca Undad IV. Balance de energía en procesos reactvos Clase
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA Ingenería Químca Undad IV. Balance de energía en procesos reactvos Clase
Importancia de la cinética química. química en el diseño de reactores
 Importanca de la cnétca químca en el dseño de reactores Dr. Rogelo Cuevas García 1 Macroescala: Dseño del reactor Importanca de la cnétca químca Mesoesca la Fenómenos de transporte Transferenca de masa
Importanca de la cnétca químca en el dseño de reactores Dr. Rogelo Cuevas García 1 Macroescala: Dseño del reactor Importanca de la cnétca químca Mesoesca la Fenómenos de transporte Transferenca de masa
IES Menéndez Tolosa (La Línea) Física y Química - 1º Bach - Gráficas
 IES Menéndez Tolosa (La Línea) Físca y Químca - 1º Bach - Gráfcas 1 Indca qué tpo de relacón exste entre las magntudes representadas en la sguente gráfca: La gráfca es una línea recta que no pasa por el
IES Menéndez Tolosa (La Línea) Físca y Químca - 1º Bach - Gráfcas 1 Indca qué tpo de relacón exste entre las magntudes representadas en la sguente gráfca: La gráfca es una línea recta que no pasa por el
Reconciliación de datos experimentales. MI5022 Análisis y simulación de procesos mineralúgicos
 Reconclacón de datos expermentales MI5022 Análss y smulacón de procesos mneralúgcos Balances Balances en una celda de flotacón En torno a una celda de flotacón (o un crcuto) se pueden escrbr los sguentes
Reconclacón de datos expermentales MI5022 Análss y smulacón de procesos mneralúgcos Balances Balances en una celda de flotacón En torno a una celda de flotacón (o un crcuto) se pueden escrbr los sguentes
Cu +2 + Zn Cu + Zn +2
 Termodnámc. Tem 16 Sstems electroquímcos 1. Defncones Electrodo. Metl en contcto con un electrolto (Sstem físco donde se produce un semreccón redox) Un sstem electródco está consttudo por un conductor
Termodnámc. Tem 16 Sstems electroquímcos 1. Defncones Electrodo. Metl en contcto con un electrolto (Sstem físco donde se produce un semreccón redox) Un sstem electródco está consttudo por un conductor
Gases y Disoluciones
 Gases y Dsolucones CR. JORGE JUAN Xuva-Narón En la naturaleza exsten sustancas muy mportantes que se encuentran en estado gaseoso en condcones habtuales, como el are, el gas natural, el dóxdo de carbono,...
Gases y Dsolucones CR. JORGE JUAN Xuva-Narón En la naturaleza exsten sustancas muy mportantes que se encuentran en estado gaseoso en condcones habtuales, como el are, el gas natural, el dóxdo de carbono,...
Facultad de Química. UNAM Alejandro Baeza
 Facultad de Químca. UNM lejandro Baeza.006 Químca nalítca Instrumental I nálss de mezclas por espectrofotometría. Documento de apoyo. Dr. lejandro Baeza. Semestre 007-I.0 Selectvdad espectral en espectrofotometría
Facultad de Químca. UNM lejandro Baeza.006 Químca nalítca Instrumental I nálss de mezclas por espectrofotometría. Documento de apoyo. Dr. lejandro Baeza. Semestre 007-I.0 Selectvdad espectral en espectrofotometría
CAPÍTULO IV. IV.1 Correlación de los resultados experimentales
 CAPÍTULO IV IV. Correlacón de los resultados expermentales La aplcacón de modelos de solucón para correlaconar los resultados que se obtenen en los expermentos, resulta de gran mportanca para amplar la
CAPÍTULO IV IV. Correlacón de los resultados expermentales La aplcacón de modelos de solucón para correlaconar los resultados que se obtenen en los expermentos, resulta de gran mportanca para amplar la
6. SEPARACION DE FASES INSTANTANEO
 6. SEPARACION DE FASES INSTANTANEO 1. OBJETIVOS 1.1. Determnar el número de grados de lbertad en un separador de fases nstantáneo 1.2. Smular un separador de fases sotérmco adabátco y no adabátco 1.3.
6. SEPARACION DE FASES INSTANTANEO 1. OBJETIVOS 1.1. Determnar el número de grados de lbertad en un separador de fases nstantáneo 1.2. Smular un separador de fases sotérmco adabátco y no adabátco 1.3.
TEMA 5. ELECTROQUÍMICA
 Steve Jurvetson from Menlo Park, USA Flckr Creatve Commons Attrbuton 2.0 Generc lcense. http://commons.wkmeda.org/wk/fle:electrochemstry.jpg TEMA 5. ELECTROQUÍMICA Jorge Bañuelos, Lus Lan, Leyre Pérez,
Steve Jurvetson from Menlo Park, USA Flckr Creatve Commons Attrbuton 2.0 Generc lcense. http://commons.wkmeda.org/wk/fle:electrochemstry.jpg TEMA 5. ELECTROQUÍMICA Jorge Bañuelos, Lus Lan, Leyre Pérez,
Entropía FÍSICA II. Guía De Problemas Nº6: Lic. María Raquel Aeberhard
 Unversdad Naconal del Nordeste Facultad de Ingenería Departamento de Físco-uímca/Cátedra Físca II FÍSICA II Guía De Problemas Nº6: Entropía PROBLEMAS RESUELOS - Un recpente de paredes rígdas contene 0.8
Unversdad Naconal del Nordeste Facultad de Ingenería Departamento de Físco-uímca/Cátedra Físca II FÍSICA II Guía De Problemas Nº6: Entropía PROBLEMAS RESUELOS - Un recpente de paredes rígdas contene 0.8
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA. Ingeniería Química
 UIVERSIDAD ACIOAL EXPERIMETAL POLITECICA ATOIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMETO DE IGEIERÍA QUÍMICA Ingenería Químca Undad II. Balance de matera con reaccón químca Clase º6 Autor:
UIVERSIDAD ACIOAL EXPERIMETAL POLITECICA ATOIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMETO DE IGEIERÍA QUÍMICA Ingenería Químca Undad II. Balance de matera con reaccón químca Clase º6 Autor:
Tema 6 El mercado de bienes y la función IS
 Tema 6 El mercado de benes y la funcón IS Macroeconomía I Prof. Anhoa Herrarte Sánchez Curso 2007-08 Bblografía para preparar este tema Apuntes de clase Capítulo 3, Macroeconomía, O. Blanchard Prof. Anhoa
Tema 6 El mercado de benes y la funcón IS Macroeconomía I Prof. Anhoa Herrarte Sánchez Curso 2007-08 Bblografía para preparar este tema Apuntes de clase Capítulo 3, Macroeconomía, O. Blanchard Prof. Anhoa
Problemas donde intervienen dos o más variables numéricas
 Análss de Regresón y Correlacón Lneal Problemas donde ntervenen dos o más varables numércas Estudaremos el tpo de relacones que exsten entre ellas, y de que forma se asocan Ejemplos: La presón de una masa
Análss de Regresón y Correlacón Lneal Problemas donde ntervenen dos o más varables numércas Estudaremos el tpo de relacones que exsten entre ellas, y de que forma se asocan Ejemplos: La presón de una masa
TERMODINÁMICA AVANZADA
 TERMODINÁMICA AVANZADA Undad III: Termodnámca del Equlbro Ecuacones para el coefcente de actvdad Funcones de eceso para mezclas multcomponentes 9/7/0 Rafael Gamero Funcones de eceso en mezclas bnaras Epansón
TERMODINÁMICA AVANZADA Undad III: Termodnámca del Equlbro Ecuacones para el coefcente de actvdad Funcones de eceso para mezclas multcomponentes 9/7/0 Rafael Gamero Funcones de eceso en mezclas bnaras Epansón
CAPITULO 2 VELOCIDAD DE REACCIÓN, ESTEQUIOMETRÍA Y EQUILIBRIO
 PIULO VELOI E REIÓ, ESEQUIOMERÍ Y EQUILIRIO. IROUIÓ omo hemos vsto en el apítulo, la velocdad de reaccón es fundamental para poder dseñar reactores químcos. La velocdad de reaccón depende báscamente de
PIULO VELOI E REIÓ, ESEQUIOMERÍ Y EQUILIRIO. IROUIÓ omo hemos vsto en el apítulo, la velocdad de reaccón es fundamental para poder dseñar reactores químcos. La velocdad de reaccón depende báscamente de
CURSO INTERNACIONAL: CONSTRUCCIÓN DE ESCENARIOS ECONÓMICOS Y ECONOMETRÍA AVANZADA. Instructor: Horacio Catalán Alonso
 CURSO ITERACIOAL: COSTRUCCIÓ DE ESCEARIOS ECOÓMICOS ECOOMETRÍA AVAZADA Instructor: Horaco Catalán Alonso Modelo de Regresón Lneal Smple El modelo de regresón lneal representa un marco metodológco, que
CURSO ITERACIOAL: COSTRUCCIÓ DE ESCEARIOS ECOÓMICOS ECOOMETRÍA AVAZADA Instructor: Horaco Catalán Alonso Modelo de Regresón Lneal Smple El modelo de regresón lneal representa un marco metodológco, que
Universidad de Pamplona Facultad de Ciencias Básicas Física para ciencias de la vida y la salud
 Unversdad de Pamplona Facultad de Cencas Báscas Físca para cencas de la vda y la salud AÁLISIS GRÁFICO DE DATOS EXPERIMETALES OBJETIVO: Representar gráfcamente datos expermentales. Ajustar curvas a datos
Unversdad de Pamplona Facultad de Cencas Báscas Físca para cencas de la vda y la salud AÁLISIS GRÁFICO DE DATOS EXPERIMETALES OBJETIVO: Representar gráfcamente datos expermentales. Ajustar curvas a datos
Licenciatura en Administración y Dirección de Empresas INTRODUCCIÓN A LA ESTADÍSTICA EMPRESARIAL
 INTRODUCCIÓN A LA ESTADÍSTICA EMPRESARIAL Relacón de Ejerccos nº 2 ( tema 5) Curso 2002/2003 1) Las cento trenta agencas de una entdad bancara presentaban, en el ejercco 2002, los sguentes datos correspondentes
INTRODUCCIÓN A LA ESTADÍSTICA EMPRESARIAL Relacón de Ejerccos nº 2 ( tema 5) Curso 2002/2003 1) Las cento trenta agencas de una entdad bancara presentaban, en el ejercco 2002, los sguentes datos correspondentes
FUNDAMENTOS QUIMICOS DE LA INGENIERIA
 FUNDAMENTOS QUIMICOS DE LA INGENIERIA (BLOQUE DE INGENIERIA QUIMICA) GUION DE PRACTICAS DE LABORATORIO ANTONIO DURÁN SEGOVIA JOSÉ MARÍA MONTEAGUDO MARTÍNEZ INDICE PRACTICA PAGINA BALANCE MACROSCÓPICO DE
FUNDAMENTOS QUIMICOS DE LA INGENIERIA (BLOQUE DE INGENIERIA QUIMICA) GUION DE PRACTICAS DE LABORATORIO ANTONIO DURÁN SEGOVIA JOSÉ MARÍA MONTEAGUDO MARTÍNEZ INDICE PRACTICA PAGINA BALANCE MACROSCÓPICO DE
Fisicoquímica CIBEX Guía de Trabajos Prácticos 2010. Trabajo Práctico N 7. - Medida de la Fuerza Electromotriz por el Método de Oposición-
 Fscoquímca CIBX Guía de Trabajos Práctcos 2010 Trabajo Práctco N 7 - Medda de la Fuerza lectromotrz por el Método de Oposcón- Objetvo: Medr la fuerza electromotrz (FM) de la pla medante el método de oposcón
Fscoquímca CIBX Guía de Trabajos Práctcos 2010 Trabajo Práctco N 7 - Medda de la Fuerza lectromotrz por el Método de Oposcón- Objetvo: Medr la fuerza electromotrz (FM) de la pla medante el método de oposcón
INGENIERÍA ENZIMÁTICA
 Dvsón de Cencas Bológcas y de la Salud Ingenería Boquímca Industral INGENIERÍA ENZIÁTICA PROBLEARIO Dr. Sergo Huerta Ochoa NOTA: Los ejerccos presentados en este problemaro, son una recoplacón de problemas:
Dvsón de Cencas Bológcas y de la Salud Ingenería Boquímca Industral INGENIERÍA ENZIÁTICA PROBLEARIO Dr. Sergo Huerta Ochoa NOTA: Los ejerccos presentados en este problemaro, son una recoplacón de problemas:
Problemas de Interfase Electrizada. Química Física Avanzada Iñaki Tuñón 2010/2011
 Problemas de Interfase Electrzada Químca Físca Avanzada Iñak Tuñón 00/0 IE. Calcula el espesor de la doble capa eléctrca para las sguentes dsolucones acuosas a 5ºC: a)0 - M KCl; b) 0-6 M KCl; c) 5 0-3
Problemas de Interfase Electrzada Químca Físca Avanzada Iñak Tuñón 00/0 IE. Calcula el espesor de la doble capa eléctrca para las sguentes dsolucones acuosas a 5ºC: a)0 - M KCl; b) 0-6 M KCl; c) 5 0-3
MECANISMO DE INTERACCIÓN DEL AGUA Y DEL AIRE PERFILES Condiciones en un deshumidificador
 MECANIMO DE INTERACCIÓN DE AUA DE AIRE PERFIE Condcones en un humdfcador constante del líqudo adabátco. Temperatura Agua T Temperatura Temperatura Constante T = T T Calor latente Calor atente Ovapor Are
MECANIMO DE INTERACCIÓN DE AUA DE AIRE PERFIE Condcones en un humdfcador constante del líqudo adabátco. Temperatura Agua T Temperatura Temperatura Constante T = T T Calor latente Calor atente Ovapor Are
SISTEMAS GAS - LIQUIDO Capítulo III Curso: Fisicoquímica para Ingenieros
 SISTMAS GAS - LIQUIDO Capítulo III Curso: Fscoquímca para Ingeneros Prof. Slva Margarta Calderón, PhD Departamento de Químca Industral y Aplcada Contendo BINARIOS IDALS. Dagramas P vs. X, T vs. X y Y vs.
SISTMAS GAS - LIQUIDO Capítulo III Curso: Fscoquímca para Ingeneros Prof. Slva Margarta Calderón, PhD Departamento de Químca Industral y Aplcada Contendo BINARIOS IDALS. Dagramas P vs. X, T vs. X y Y vs.
Facultad de Ciencias Básicas
 Facultad de Cencas Báscas ANÁLISIS GRÁFICO DE DATOS EXPERIMENTALES OBJETIVO: Representar gráfcamente datos expermentales. Ajustar curvas a datos expermentales. Establecer un crtero para el análss de grafcas
Facultad de Cencas Báscas ANÁLISIS GRÁFICO DE DATOS EXPERIMENTALES OBJETIVO: Representar gráfcamente datos expermentales. Ajustar curvas a datos expermentales. Establecer un crtero para el análss de grafcas
FENÓMENOS DE TRASPORTE EN METALURGIA EXTRACTIVA Clase 01/05 Transporte de Masa
 FENÓMENOS DE TRSPORTE EN METLURGI EXTRCTIV Clase 01/05 Transporte de Masa Prof. Leandro Vosn, MSc., Dr. cadémco Unversdad de Chle. Jefe del Laboratoro de Prometalurga. Investgador Senor - Tohoku Unversty,
FENÓMENOS DE TRSPORTE EN METLURGI EXTRCTIV Clase 01/05 Transporte de Masa Prof. Leandro Vosn, MSc., Dr. cadémco Unversdad de Chle. Jefe del Laboratoro de Prometalurga. Investgador Senor - Tohoku Unversty,
DISTRIBUCIONES BIDIMENSIONALES
 Matemátcas 1º CT 1 DISTRIBUCIONES BIDIMENSIONALES PROBLEMAS RESUELTOS 1. a) Asoca las rectas de regresón: y = +16, y = 1 e y = 0,5 + 5 a las nubes de puntos sguentes: b) Asgna los coefcentes de correlacón
Matemátcas 1º CT 1 DISTRIBUCIONES BIDIMENSIONALES PROBLEMAS RESUELTOS 1. a) Asoca las rectas de regresón: y = +16, y = 1 e y = 0,5 + 5 a las nubes de puntos sguentes: b) Asgna los coefcentes de correlacón
Universidad Tecnológica Nacional
 Unversdad Tecnológca Naconal Facultad Regonal Rosaro Área de Postgrado y Educacón Contnua Curso: Modelado, Smulacón y Dseño de Procesos Químcos Trabajo Práctco nº : Implementacón de un modelo de Planta
Unversdad Tecnológca Naconal Facultad Regonal Rosaro Área de Postgrado y Educacón Contnua Curso: Modelado, Smulacón y Dseño de Procesos Químcos Trabajo Práctco nº : Implementacón de un modelo de Planta
APLICACIÓN DEL MATHCAD EN EL EQUILIBRIO DE FASES Marco Antonio Núñez Esquer Departamento de Ingeniería Química y Metalurgia, Universidad de Sonora
 APCACÓN DE MATHCAD EN E EQUBRO DE FASES Marco Antono Núñez Esquer Departamento de ngenería Químca y Metalurga, Unversdad de Sonora Nvel Superor Resumen El Equlbro de Fases es fundamental en la práctca
APCACÓN DE MATHCAD EN E EQUBRO DE FASES Marco Antono Núñez Esquer Departamento de ngenería Químca y Metalurga, Unversdad de Sonora Nvel Superor Resumen El Equlbro de Fases es fundamental en la práctca
INFLUENCIA DEL FLUJO DE HIDRÓGENO EN LA INCERTIDUMBRE DEL SISTEMA DE REFERENCIA PARA MEDICIÓN DE ph
 INFLUENCIA DEL FLUJO DE HIDRÓGENO EN LA INCERTIDUMBRE DEL SISTEMA DE REFERENCIA PARA MEDICIÓN DE ph Torres, M 1, y Godnez, L.A. 1 Centro Naconal de Metrología km 4,5 Carr A Los Cues, CP. 7641. Mpo. El
INFLUENCIA DEL FLUJO DE HIDRÓGENO EN LA INCERTIDUMBRE DEL SISTEMA DE REFERENCIA PARA MEDICIÓN DE ph Torres, M 1, y Godnez, L.A. 1 Centro Naconal de Metrología km 4,5 Carr A Los Cues, CP. 7641. Mpo. El
Población 1. Población 1. Población 2. Población 2. Población 1. Población 1. Población 2. Población 2. Frecuencia. Frecuencia
 MAT-3 Estadístca I Tema : Meddas de Dspersón Facltador: Félx Rondón, MS Insttuto Especalzado de Estudos Superores Loyola Introduccón Las meddas de tendenca central son ndcadores estadístcos que resumen
MAT-3 Estadístca I Tema : Meddas de Dspersón Facltador: Félx Rondón, MS Insttuto Especalzado de Estudos Superores Loyola Introduccón Las meddas de tendenca central son ndcadores estadístcos que resumen
2ª Colección Tema 2 La oferta, la demanda y el mercado
 Cuestones y problemas de Introduccón a la Teoría Económca Carmen olores Álvarez Albelo Mguel Becerra omínguez Rosa María Cáceres Alvarado María del Plar Osorno del Rosal Olga María Rodríguez Rodríguez
Cuestones y problemas de Introduccón a la Teoría Económca Carmen olores Álvarez Albelo Mguel Becerra omínguez Rosa María Cáceres Alvarado María del Plar Osorno del Rosal Olga María Rodríguez Rodríguez
Figura 1
 5 Regresón Lneal Smple 5. Introduccón 90 En muchos problemas centífcos nteresa hallar la relacón entre una varable (Y), llamada varable de respuesta, ó varable de salda, ó varable dependente y un conjunto
5 Regresón Lneal Smple 5. Introduccón 90 En muchos problemas centífcos nteresa hallar la relacón entre una varable (Y), llamada varable de respuesta, ó varable de salda, ó varable dependente y un conjunto
Guía para la autoevaluación del del capítulo 6
 Capítulo 6: EL BANCO CENTRAL Y LA POLÍTICA MONETARIA Guía para la autoevaluacón del del capítulo 6 1) Ante una recuperacón económca, cuál es el cambo que se produce en los valores de equlbro del mercado
Capítulo 6: EL BANCO CENTRAL Y LA POLÍTICA MONETARIA Guía para la autoevaluacón del del capítulo 6 1) Ante una recuperacón económca, cuál es el cambo que se produce en los valores de equlbro del mercado
CAPÍTULO 4 MARCO TEÓRICO
 CAPÍTULO 4 MARCO TEÓRICO Cabe menconar que durante el proceso de medcón, la precsón y la exacttud de cualquer magntud físca está lmtada. Esta lmtacón se debe a que las medcones físcas sempre contenen errores.
CAPÍTULO 4 MARCO TEÓRICO Cabe menconar que durante el proceso de medcón, la precsón y la exacttud de cualquer magntud físca está lmtada. Esta lmtacón se debe a que las medcones físcas sempre contenen errores.
Introducción a Vacío
 Introduccón a Vacío Sstema de vacío Partes generales de un sstema de vacío: Fgura 1: Sstema de vacío con bomba mecánca y dfusora Fgura 2: Prncpo de funconamento de la bomba mecánca La Fg. 2 muestra el
Introduccón a Vacío Sstema de vacío Partes generales de un sstema de vacío: Fgura 1: Sstema de vacío con bomba mecánca y dfusora Fgura 2: Prncpo de funconamento de la bomba mecánca La Fg. 2 muestra el
16/07/2012 P= F A. Pascals. Bar
 El Estado Gaseoso El Estado Gaseoso Undad I Característcas de los Gases Las moléculas ndvduales se encuentran relatvamente separadas. Se expanden para llenar sus recpentes. Son altamente compresbles. enen
El Estado Gaseoso El Estado Gaseoso Undad I Característcas de los Gases Las moléculas ndvduales se encuentran relatvamente separadas. Se expanden para llenar sus recpentes. Son altamente compresbles. enen
IDENTIFICACIÓN Y MODELADO DE PLANTAS DE ENERGÍA SOLAR
 IDENTIFICACIÓN Y MODELADO DE PLANTAS DE ENERGÍA SOLAR En esta práctca se llevará a cabo un estudo de modelado y smulacón tomando como base el ntercambador de calor que se ha analzado en el módulo de teoría.
IDENTIFICACIÓN Y MODELADO DE PLANTAS DE ENERGÍA SOLAR En esta práctca se llevará a cabo un estudo de modelado y smulacón tomando como base el ntercambador de calor que se ha analzado en el módulo de teoría.
Electricidad y calor
 Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
Electricidad y calor. Un repaso... Temas. 4. Primera ley de la Termodinámica. Webpage: Algunas definiciones
 Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
Electrcdad y calor Webpage: http://pagnas.sca.uson.mx/qb 2007 Departamento de Físca Unversdad de Sonora Temas 4. Prmera ley de la Termodnámca.. Concepto de Trabajo aplcado a gases.. Trabajo hecho por un
TEMAS DE FÍSICA Y QUÍMICA TEMA 49 DISOLUCIONES. DISOLUCIONES REALES.
 TEMS DE FÍSIC Y QUÍMIC (Oposcones de Enseñanza Secundara) ------------------------------------------------------------------------------- TEM 49 DISOLUCIONES. LEYES DE LS DISOLUCIONES DILUIDS. PROPIE-
TEMS DE FÍSIC Y QUÍMIC (Oposcones de Enseñanza Secundara) ------------------------------------------------------------------------------- TEM 49 DISOLUCIONES. LEYES DE LS DISOLUCIONES DILUIDS. PROPIE-
3. ANALISIS DE UNIDADES SIMPLES
 28 3. ANALISIS DE UNIDADES SIMPLES Por undades smples se entenden aquellas que desarrollan operacones de transformacón físca o químca de la matera y que se analzan a partr de los prncpos de conservacón
28 3. ANALISIS DE UNIDADES SIMPLES Por undades smples se entenden aquellas que desarrollan operacones de transformacón físca o químca de la matera y que se analzan a partr de los prncpos de conservacón
8 MECANICA Y FLUIDOS: Calorimetría
 8 MECANICA Y FLUIDOS: Calormetría CONTENIDOS Dencones. Capacdad caloríca. Calor especíco. Equlbro térmco. Calormetría. Calorímetro de las mezclas. Marcha del calorímetro. Propagacón de Errores. OBJETIVOS
8 MECANICA Y FLUIDOS: Calormetría CONTENIDOS Dencones. Capacdad caloríca. Calor especíco. Equlbro térmco. Calormetría. Calorímetro de las mezclas. Marcha del calorímetro. Propagacón de Errores. OBJETIVOS
ELECTRICIDAD Y MAGNETISMO FIZ 1300 FIS 1532 (6a)
 ELECTRICIDAD Y MAGNETISMO FIZ 1300 FIS 1532 Rcardo Ramírez Facultad de Físca, Pontfca Unversdad Católca, Chle 1er. Semestre 2008 Corrente eléctrca CORRIENTE ELECTRICA Corrente eléctrca mplca carga en movmento.
ELECTRICIDAD Y MAGNETISMO FIZ 1300 FIS 1532 Rcardo Ramírez Facultad de Físca, Pontfca Unversdad Católca, Chle 1er. Semestre 2008 Corrente eléctrca CORRIENTE ELECTRICA Corrente eléctrca mplca carga en movmento.
Fase condensada pura implica que a T existe una única presión de vapor. A T, el equilibrio entre un metal puro y su óxido puro ocurre a una única
 Introduccón a la Termodnámca de aterales Dra. Stella Ordoñez CPÍTULO VIII CPÍTULO VIII: SOLUCIONES 8.1. INTRODUCCIÓN Fase condensada pura mplca que a T exste una únca presón de vapor. T, el equlbro entre
Introduccón a la Termodnámca de aterales Dra. Stella Ordoñez CPÍTULO VIII CPÍTULO VIII: SOLUCIONES 8.1. INTRODUCCIÓN Fase condensada pura mplca que a T exste una únca presón de vapor. T, el equlbro entre
Electroquímica de equilibrio Resumen. UAM Química Física I. Electroquímica 1
 Electrquímca de equlbr Resumen UAM 2010-2011. Químca Físca I. Electrquímca 1 Sstemas electrquímcs Termdnámca de sstemas electrquímcs El ptencal electrquímc Cndcón de equlbr en sstemas electrquímcs Fscquímca,,
Electrquímca de equlbr Resumen UAM 2010-2011. Químca Físca I. Electrquímca 1 Sstemas electrquímcs Termdnámca de sstemas electrquímcs El ptencal electrquímc Cndcón de equlbr en sstemas electrquímcs Fscquímca,,
Sistemas con Capacidad de Reacción Química 5 de mayo de 2009 Cuestiones y problemas: Cuest: 9.2, 4, 6, 10, 19. Prob: 4.16.
 Índce 5 CELINA GONZÁLEZ ÁNGEL JIMÉNEZ IGNACIO LÓPEZ RAFAEL NIEO Sstemas con Capacdad de Reaccón Químca 5 de mayo de 2009 Cuestones y problemas: Cuest: 9.2, 4, 6, 0, 9. Prob: 4.6. subrayados y en negrta
Índce 5 CELINA GONZÁLEZ ÁNGEL JIMÉNEZ IGNACIO LÓPEZ RAFAEL NIEO Sstemas con Capacdad de Reaccón Químca 5 de mayo de 2009 Cuestones y problemas: Cuest: 9.2, 4, 6, 0, 9. Prob: 4.6. subrayados y en negrta
Termómetros de resistencia de platino y la escala internacional de temperatura EIT-90
 Termómetros de resstenca de platno y la escala nternaconal de temperatura EIT- Víctor Martínez Fuentes La EIT- La Escala Internaconal de Temperatura de 19 (EIT- ) se adoptó por el CIPM en 1989 para reemplazar
Termómetros de resstenca de platno y la escala nternaconal de temperatura EIT- Víctor Martínez Fuentes La EIT- La Escala Internaconal de Temperatura de 19 (EIT- ) se adoptó por el CIPM en 1989 para reemplazar
EJERCICIOS SOBRE INTERPOLACIÓN POLINOMIAL. x x0 y y0. Deducir la fórmula para el polinomio de Lagrange de grado a lo más uno que Interpola la tabla.
 EJERCICIOS SOBRE INTERPOLACIÓN POLINOMIAL. Consdere la sguente tabla, donde 0 : 0 y y0 y Deducr la fórmula para el polnomo de Lagrange de grado a lo más uno que Interpola la tabla.. Consdere la sguente
EJERCICIOS SOBRE INTERPOLACIÓN POLINOMIAL. Consdere la sguente tabla, donde 0 : 0 y y0 y Deducr la fórmula para el polnomo de Lagrange de grado a lo más uno que Interpola la tabla.. Consdere la sguente
UNIVERSIDAD TECNOLOGICA NACIONAL - FACULTAD REGIONAL ROSARIO Departamento de Ingeniería Química. Cátedra: Integración IV
 UNIVERSIDAD TECNOOGICA NACIONA - ACUTAD REGIONA ROSARIO Departamento de Ingenería Químca Cátedra: Integracón IV Tema: Smulacón de Evaporadores lash Alumnos: Damán Match, Marcos Boss y Juan M. Pgnan Profesores:
UNIVERSIDAD TECNOOGICA NACIONA - ACUTAD REGIONA ROSARIO Departamento de Ingenería Químca Cátedra: Integracón IV Tema: Smulacón de Evaporadores lash Alumnos: Damán Match, Marcos Boss y Juan M. Pgnan Profesores:
SISTEMAS DE ECUACIONES DIFERENCIALES
 DIVISIÓN DE CIENCIAS FÍSICAS Y MATEMÁTICAS DTO. TERMODINÁMICA Y FENÓMENOS DE TRANSFERENCIA MÉTODOS AROXIMADOS EN ING. QUÍMICA TF-33 SISTEMAS DE ECUACIONES DIFERENCIALES Esta guía fue elaborada por: rof.
DIVISIÓN DE CIENCIAS FÍSICAS Y MATEMÁTICAS DTO. TERMODINÁMICA Y FENÓMENOS DE TRANSFERENCIA MÉTODOS AROXIMADOS EN ING. QUÍMICA TF-33 SISTEMAS DE ECUACIONES DIFERENCIALES Esta guía fue elaborada por: rof.
Tallerine: Energías Renovables. Fundamento teórico
 Tallerne: Energías Renovables Fundamento teórco Tallerne Energías Renovables 2 Índce 1. Introduccón 3 2. Conceptos Báscos 3 2.1. Intensdad de corrente................................. 3 2.2. Voltaje..........................................
Tallerne: Energías Renovables Fundamento teórco Tallerne Energías Renovables 2 Índce 1. Introduccón 3 2. Conceptos Báscos 3 2.1. Intensdad de corrente................................. 3 2.2. Voltaje..........................................
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 14 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 14 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
COLEGIO INGLÉS MEDIDAS DE DISPERSIÓN
 COLEGIO IGLÉS DEPARTAMETO IVEL: CUARTO MEDIO PSU. UIDAD: ESTADISTICA 3 PROFESOR: ATALIA MORALES A. ROLADO SAEZ M. MIGUEL GUTIÉRREZ S. JAVIER FRIGERIO B. MEDIDAS DE DISPERSIÓ Las meddas de dspersón dan
COLEGIO IGLÉS DEPARTAMETO IVEL: CUARTO MEDIO PSU. UIDAD: ESTADISTICA 3 PROFESOR: ATALIA MORALES A. ROLADO SAEZ M. MIGUEL GUTIÉRREZ S. JAVIER FRIGERIO B. MEDIDAS DE DISPERSIÓ Las meddas de dspersón dan
PROYECTO DE TEORIA DE MECANISMOS. Análisis cinemático y dinámico de un mecanismo plano articulado con un grado de libertad.
 Nombre: Mecansmo: PROYECTO DE TEORIA DE MECANISMOS. Análss cnemátco y dnámco de un mecansmo plano artculado con un grado de lbertad. 10. Análss dnámco del mecansmo medante el método de las tensones en
Nombre: Mecansmo: PROYECTO DE TEORIA DE MECANISMOS. Análss cnemátco y dnámco de un mecansmo plano artculado con un grado de lbertad. 10. Análss dnámco del mecansmo medante el método de las tensones en
MAGNITUD: propiedad o cualidad física susceptible de ser medida y cuantificada. Ejemplos: longitud, superficie, volumen, tiempo, velocidad, etc.
 TEMA. INSTRUMENTOS FÍSICO-MATEMÁTICOS.. SISTEMAS DE MAGNITUDES Y UNIDADES. CONVERSIÓN DE UNIDADES. MAGNITUD: propedad o cualdad físca susceptble de ser medda y cuantfcada. Ejemplos: longtud, superfce,
TEMA. INSTRUMENTOS FÍSICO-MATEMÁTICOS.. SISTEMAS DE MAGNITUDES Y UNIDADES. CONVERSIÓN DE UNIDADES. MAGNITUD: propedad o cualdad físca susceptble de ser medda y cuantfcada. Ejemplos: longtud, superfce,
UNIVERSIDAD TECNOLÓGICA NACIONAL - FACULTAD REGIONAL ROSARIO. Departamento de Ingeniería Química - Cátedra Integración IV
 UNIRIDD NOLÓGI NIONL - ULD RGIONL RORIO Departamento de Ingenería Químca - átedra Integracón I Modelado de equpos especales: Reactor según modelo de an de usse ea el proceso cuyo dagrama de fluo se representa
UNIRIDD NOLÓGI NIONL - ULD RGIONL RORIO Departamento de Ingenería Químca - átedra Integracón I Modelado de equpos especales: Reactor según modelo de an de usse ea el proceso cuyo dagrama de fluo se representa
CAPÍTULO II Métodos experimentales
 CAPÍTULO II Métodos expermentales En este capítulo se descrbe la técnca expermental para la obtencón y representacón de dagramas líqudo-líqudo de sstemas ternaros y cuaternaros y el equpo expermental utlzado.
CAPÍTULO II Métodos expermentales En este capítulo se descrbe la técnca expermental para la obtencón y representacón de dagramas líqudo-líqudo de sstemas ternaros y cuaternaros y el equpo expermental utlzado.
EXAMEN FINAL DE ECONOMETRIA, 3º CURSO (GRADOS EN ECO y ADE) 20 DE JUNIO DE horas
 EXAMEN FINAL DE ECONOMETRIA, 3º CURSO (GRADOS EN ECO y ADE) 0 DE JUNIO DE 018 15.30 horas Prmer Apelldo: Nombre: DNI: Teléfono: Segundo Apelldo: Grupo y Grado: Profesor(a): e-mal: Pregunta 1 A B C En Blanco
EXAMEN FINAL DE ECONOMETRIA, 3º CURSO (GRADOS EN ECO y ADE) 0 DE JUNIO DE 018 15.30 horas Prmer Apelldo: Nombre: DNI: Teléfono: Segundo Apelldo: Grupo y Grado: Profesor(a): e-mal: Pregunta 1 A B C En Blanco
PRÁCTICA No. 3: CORROSION EN ALEACIONES NO FERROSAS
 INSTITUTO TECNOLÓGICO SUERIOR, DEL ESTADO DE CAMECHE. RÁCTICA No. 3: CORROSION EN ALEACIONES NO FERROSAS OBJETIVO Incarse en los fundamentos, causas y efectos de la corrosón medante la comprobacón del
INSTITUTO TECNOLÓGICO SUERIOR, DEL ESTADO DE CAMECHE. RÁCTICA No. 3: CORROSION EN ALEACIONES NO FERROSAS OBJETIVO Incarse en los fundamentos, causas y efectos de la corrosón medante la comprobacón del
Unidad I. 1. 1. Definición de reacción de combustión. 1. 2. Clasificación de combustibles
 2 Undad I.. Defncón de reaccón de combustón La reaccón de combustón se basa en la reaccón químca exotérmca de una sustanca (o una mezcla de ellas) denomnada combustble, con el oxígeno. Como consecuenca
2 Undad I.. Defncón de reaccón de combustón La reaccón de combustón se basa en la reaccón químca exotérmca de una sustanca (o una mezcla de ellas) denomnada combustble, con el oxígeno. Como consecuenca
INTRODUCCION A LOS METODOS ELECTROANALITICOS
 Introduccón a los Métodos Electro-analítcos 2 Tema 7 INTRODUCCION A LOS METODOS ELECTROANALITICOS Los métodos electroquímcos de análss, o métodos electro-analítcos, son, en general, menos utlzados que
Introduccón a los Métodos Electro-analítcos 2 Tema 7 INTRODUCCION A LOS METODOS ELECTROANALITICOS Los métodos electroquímcos de análss, o métodos electro-analítcos, son, en general, menos utlzados que
Aplicación de curvas residuo y de permeato a sistemas batch y en continuo
 Aplcacón de curvas resduo de permeato a sstemas batch en contnuo Alan Dder érez Ávla En el presente trabajo se presentara de manera breve como obtener las ecuacones que generan las curvas de resduo, de
Aplcacón de curvas resduo de permeato a sstemas batch en contnuo Alan Dder érez Ávla En el presente trabajo se presentara de manera breve como obtener las ecuacones que generan las curvas de resduo, de
Transferencia de Masa ª
 Transferenca de Masa 2013-05-21-15ª 2013-05-21 # Introduccón a Procesos de Separacón; # Sstemas gobernados por el equlbro; # Sstema líqudo/gas: coefcente global de transferenca de masa. 2 Algunas notas
Transferenca de Masa 2013-05-21-15ª 2013-05-21 # Introduccón a Procesos de Separacón; # Sstemas gobernados por el equlbro; # Sstema líqudo/gas: coefcente global de transferenca de masa. 2 Algunas notas
