Universidad Nacional de San Martín Instituto de Investigaciones Biotecnológicas GENÉTICA MOLECULAR 2009
|
|
|
- José Luis San Segundo Domínguez
- hace 8 años
- Vistas:
Transcripción
1 Universidad Nacional de San Martín Instituto de Investigaciones Biotecnológicas GENÉTICA MOLECULAR 2009 GUíA DE TRABAJOS PRÁCTICOS Docentes Dra. Paula ALVAREZ Lic. Lara AVILA Lic. Alejandro CASSOLA Dra. Alejandra D ANTUONO Dr. Javier DE GAUDENZI Lic. Georgina MORETTI Lic. Cintia SANCHEZ Lic. María Paula ZAPPIA CONDICIONES DE CURSADA Y APROBACIÓN DEL TP
2 El horario de los TP será los martes y viernes de 14:00 a 19:00 hs. Los TPs son de asistencia obligatoria. Durante el cuatrimestre los alumnos serán evaluados en: (1) Un seminario de bibliografía, (2) Un parcialito después de cada clase de seminarios, (3) Un parcialito antes de cada práctico y (4) Un informe final donde se explique el trabajo realizado y los resultados obtenidos con el fin de integrar todos los trabajos prácticos y demostrar comprensión de la estrategia global. El mismo deberá tener formato de manuscrito científico (Título, Resumen, Introducción, Métodos, Resultados y Discusión) y no deberá exceder de 10 páginas tamaño A4 escritas con letra Times New Roman 12 pts a simple espacio. (5) Un parcial práctico. Régimen de aprobación- Se deberá asistir como mínimo al 80% de las clases de seminarios y laboratorios. Dos asistencias computadas como TARDE equivalen a un AUSENTE. Se podrá faltar o desaprobar un máximo de 2 parcialitos de TP y dos parcialitos de seminarios. Se deberá aprobar el informe final con nota = 5. De ser desaprobado este informe podrá ser presentado por segunda vez. Se deberá aprobar un examen práctico con nota = 5. Este parcial puede ser recuperado. Composición de la nota- Nota final de TP = 10% Nota de Concepto* + 15% Nota de Seminario de bibliografía + 15% Nota del informe + 60% Nota de Parcial práctico. Los TP se aprobarán con una nota final = 5, mientras que para promocionar será necesaria una nota = 7. *Obtenida a partir del trabajo realizado por el alumno en el laboratorio, de la participación en los distintos seminarios de bibliografía y resolución de problemas durante la cursada del TP. Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
3 OBJETIVO GENERAL DEL TP Introducir al alumno en técnicas básicas de biología molecular las cuales se utilizarán para resolver un problema concreto. El objetivo central del TP será que el alumno enfrente problemas reales del laboratorio realizando diversos protocolos de manipulación y clonado de moléculas de ácido desoxiribonucleico (ADN). En particular se subclonará un gen de Aequorea victoria, que codifica para una proteína verde fluorescente, en un vector de expresión procariota para obtener la proteína recombinante con actividad biológica. La misma emite luz visible al ser excitada con luz ultravioleta (UV) debido a su estructura tridimensional particular. Para ello se partirá de un clon proveniente de una biblioteca genómica de fragmentos grandes del ADN de A. victoria sobre el cual se realizará UNA AMPLIFICACION POR PCR para obtener el gen completo de la proteína verde. Luego se realizará el subclonado del gen completo a un plásmido que permita su expresión inducible en la bacteria Escherichia coli. ADNg de A. victoria? Diseño de oligonucleótidos para PCR? Amplificación del gen gfp por PCR a partir de ADNg? Ligación en vector pbluescript del gen gfp (paso llevado a cabo por los docentes)? Subclonado del gen gfp en vector de expresión procariota (pgex)? Inducción de la expresión de la proteína GFP Purificación de la proteina recombinante? Inmunodetección de GFP por Western blot Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
4 TP #1 DISEÑO DE OLIGONUCLEÓTIDOS Uno de los parámetros más importantes para tener éxito en la amplificación por reacción en cadena de la polimerasa (PCR) es el diseño de los oligonucleótidos cebadores (comúnmente denominados, oligos o primers ). Si éstos no están bien diseñados la PCR puede no proceder eficientemente; el resultado es la amplificación baja o nula del producto debido a amplificación no específica o a la formación de dímeros de primers que pueden competir con la amplificación del producto deseado. Qué factores debemos tener en cuenta a la hora de diseñar oligonucleótidos para PCR? 1. Tamaño del oligonucleótido 2. Temperatura de fusión o melting 3. Especificidad 4. Secuencias complementarias 5. Contenido en G/C y tractos de polipirimidinas (T, C) o polipurinas (A, G) 6. Secuencia 3 terminal 7. Secuencia 5 terminal y regiones centrales 1. Tamaño del oligonucleótido. El tamaño del oligonucleótido influye en la especificidad, en la temperatura de fusión y en el tiempo necesario para la hibridación del oligonucleótido a su secuencia complementaria, y por lo tanto es decisivo para que ocurra la reacción. Los oligonucleótidos de 18 a 24 bases son muy específicos de secuencia, siempre que la temperatura de hibridación sea óptima. El tamaño del oligonucleótido es proporcional a la eficiencia de hibridación. En general, cuanto más largo sea el oligonucleótido más ineficiente será la hibridación. Si en cada paso de PCR hay pocas secuencias de ADN molde con su oligonucleótido hibridado, el resultado va a ser muy poco producto amplificado. Los oligos no deberían ser demasiado cortos a menos que se especifique lo contrario en el protocolo. La meta es diseñar un oligonucleótido con una temperatura de hibridación (la que programamos en el termociclador) de al menos 50 C. La relación entre temperatura de hibridación y temperatura de fusión es muy importante en la PCR. Como regla general la temperatura de hibridación (o annealing en inglés) Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
5 debe ser 5-8 C más baja que la de fusión (o melting en inglés). Por tanto, si queremos un oligonucleótido con una temperatura de hibridación de al menos 50 C, correspondería a un oligonucleótido con una temperatura de fusión de ~55-58 C. A menudo, la temperatura de hibridación así determinada no resulta óptima y es necesario determinarla empíricamente. Se puede hacer fácilmente con un termociclador con gradiente (por ej. el Mastercycler gradient de Eppendorf). 2. Temperatura de fusión. La temperatura de fusión (Tm) de un oligo depende de varios factores: longitud, secuencia, contenido G+C, y el tipo y concentración de los cationes presentes en la reacción, particularmente el ión Na+. Pueden emplearse diversas fórmulas para estimar este valor, una buena aproximación surge de utilizar la regla de Wallace (generalmente válida para oligos en el rango de bases) donde la Tm se puede calcular con la siguiente fórmula: Tm = 2 * (A+T) + 4 * (C+G) (1) En la siguiente tabla hay valores de Tm de oligonucleótidos de varios tamaños usando la fórmula de Wallace asumiendo un contenido en G/C del 50%. Tamaño Tm = 2 (A+T) + 4(G+C) Tamaño del Tm = 2 (A+T) + 4(G+C) del Oligonucleótido Oligonucleótido 4 12 C C 6 18 C C 8 24 C C C C C C C C C C C C C C Notar que las temperaturas calculadas usando esta regla son inexactas en los valores extremos. Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
6 En la materia emplearemos la fórmula de Wallace para calcular el Tm de los primers. Sin embargo, para oligos que varián entre 20 y 100 bases también puede aplicarse la siguiente fórmula: Tm = *[%(C+G)] - 395/longitud (2) Una tercera ecuación incluye factores como concentración de formamida (F) y de cationes monovalentes (M): Tm = log M (%(C+G)) - 500/longitud - 0.6*F (3) y es recomendable para oligos mayores de 50 bases en un rango de ph de 5 a 9. Es importante tener en cuenta que en una reacción de PCR hay dos oligonucleótidos y que ambos deben diseñarse de manera que tengan temperaturas de fusión similares. Si los oligonucleótidos no tienen Tm parecidas, la amplificación será menos eficiente o incluso puede no funcionar ya que el oligonucleótido con la Tm más alta hibridará mal o inespecíficamente a bajas temperaturas mientras que el oligonucleótido con la Tm más baja puede no hibridar a temperaturas más altas. Además hay que cuidar que la Tm del producto sea lo suficientemente baja para asegurar que esté totalmente desnaturalizado a C. Este parámetro ayudará a asegurar una PCR más eficiente, pero no siempre es necesario para amplificar por PCR. En general, productos entre pares de bases se amplifican eficientemente en muchas reacciones de PCR. En caso de duda, la Tm del producto también puede calcularse empleando la fórmula 3 indicada anteriormente. 3. Especificidad. La especificidad del oligonucleótido depende parcialmente del tamaño del oligonucleótido. Es evidente que hay más combinaciones de oligos de 24 bases que de 15 bases. Con todo, debemos elegir oligonucleótidos que tengan una secuencia única en el molde de ADN que queremos amplificar. Por ejemplo: un oligonucleótido diseñado con una secuencia altamente repetitiva resultará en un manchado cuando amplifiquemos ADN genómico; sin embargo, el mismo oligonucleótido puede dar una sola banda si amplificamos un clon de una genoteca de ADN. Como la enzima Taq Polimerasa es activa en un amplio rango de temperaturas, puede extender el oligonucleótido a temperaturas bajas de hibridación. Si la temperatura es demasiado baja, puede suceder una hibridación no específica que será extendida por la Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
7 polimerasa con que haya una pequeña similitud en el extemo 3 del oligonucleótido. En general, una temperatura de fusión de C es la más adecuada (Notar que corresponde a un tamaño de oligonucleótido de bases según la regla de Wallace). 4. Complementariedad en la secuencia de los oligonucleótidos. Es conveniente que los oligonucleótidos no tengan secuencias complementarias en más de 4-6 pares de bases dado que se pueden formar estructuras intracatenarias de doble cadena que interferirán con la hibridación al ADN molde. Otro problema es la complementariedad entre los dos oligonucleótidos. Similitud parcial en las regiones medias de dos oligonucleótidos puede interferir con la hibridación. Si el apareamiento ocurriese en el extremo 3' de cada oligonucleótido, se dará la formación de dímeros de oligonucleótido que impedirán la formación del producto por competición. 5. Contenido en G/C y extensiones de polipirimidinas (T, C) o polipurinas (A, G). La composición de bases de los oligonucleótidos debería ser del 45% al 55% en GC. La secuencia del oligonucleótido debería elegirse de manera que no contenga zonas de poli(g) o poli(c) que puedan llevar a hibridación no específica. Hay que evitar también las zonas ricas en poli(a) y poli(t) ya que es por donde puede desestabilizarse el complejo molde oligonucleótido lo que llevaría a una menor eficiencia de amplificación. También hay que evitar secuencias ricas en polipirimidinas (T, C) y polipurinas (A, G). Idealmente el oligonucleótido deberá tener una mezcla casi a alzar de nucleótidos, un contenido en GC del 50% y ~22 bases (en este caso la Tm estará en el rango de C). 6. Secuencia 3 -terminal. Se sabe que la posición 3' terminal de los oligonucleótidos de PCR es esencial para controlar el apareamiento incorrecto. Ya hemos visto el problema de la complementariedad del oligonucleótido en esas regiones. Otra variable que hay que considerar es que haya algún residuo de G ó C en el extremo 3' del oligonucleótido. Este cepo de GC (en inglés CG Clamp ) ayuda a asegurar que el extremo 3 hibride correctamente debido a los enlaces de hidrógeno que se dan entre los residuos de GC. También ayuda a mejorar la eficiencia de la reacción de PCR minimizando cualquier desestabilización que pudiese ocurrir. Por lo general, esta condición se puede cumplir incluyendo como mucho dos residuos G ó C en la últimas cinco bases del extremo 3 terminal. Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
8 7. Secuencia 5 -terminal y regiones centrales. Es conveniente incluir en esas zonas secuencias ricas en residuos GC para dar mayor estabilidad a la hibridación del oligonucleótido con su secuencia blanco. A modo de resumen, los primers deben cumplir los siguientes criterios: Criterios positivos para el diseño de primers Temperatura de melting (Tm) Tm FORWARD = Tm REVERSE Tm = 60-66ºC T hibridación = Tm 5 C Tamaño del primer nt, óptimo 18 a 24 nt Contenido en G+C Ideal del 45% al 55% Contenido GC en 3 Termina en T; G ó C en dos (máx.) de cinco últimas bases Contenido GC en 5 Incluir varias G ó C en las últimas bases Apareamiento de primers Únicos Criterios negativos para el diseño de primers Evitar apareamientos incorrectos Evitar interacción primer-primer (Tm) Evitar estructuras en horquilla EJERCICIO 1. Realice una búsqueda en bases de datos para conseguir la secuencia completa del gen que se quiere aislar. Para ello realice una búsqueda por similitud de secuencia empleando el programa BLAST ( y el fragmento del gen proporcionado en el Apéndice. Indique descripción del gen, organismo y número de acceso del primer hit obtenido. Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
9 2. Identifique los nucleótidos correspondientes a los codones de inicio y fin de la traducción y diseñe oligonucleótidos para amplificar dicha región codificante. Oligo Reverse (de 5 a 3 )... Oligo Forward (de 5 a 3 ) Calcular la Tm de los primers por la fórmula de Wallace. Oligo Reverse:.. C. Oligo Forward:.. C. 4. Busque herramientas bioinformáticas disponibles online (o consulte a los docentes) y compruebe los siguientes parámetros de los primers que acaba de diseñar: a) Cálculo de Tm, contenido en GC, tamaño y peso molecular de los oligos. b) Estructuras secundarias, hibridaciones entre los dos primers, repeticiones o palíndromos. 5. Por último, se quiere clonar el gen gfp en el sitio múltiple de clonado de un vector de expresión (BamHI, SmaI, EcoRI) para poder expresar la proteína. Diseña (o modifica) unos primers para que contengan secuencias de enzimas de restricción. En que extremo de la molécula las adicionarías? Calcular el Tm de los primers. Oligo Reverse 5... Oligo Forward 5... Cómo son los oligos Forward y Reverse en relación a la secuencia blanco que se quiere amplificar? Uno de ellos es complementario y el otro es idéntico en secuencia. Diga cuál es cuál. Bibliografía El contenido teórico de este TP fue extraído de Ingeniería Genética. Curso Universidad de Málaga, Área de Genética, Facultad de Ciencias, Licenciatura en Ciencias Biológicas. Profesora: Ana Grande Pérez. Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
10 TP #2 REACCION EN CADENA DE LA POLIMERASA (PCR) DIA 1 A) Reacción de PCR 1. Colocar en un tubo Eppendorf una mezcla de reacción considerando volúmenes suficientes para. tubos de PCR. Discutir que controles se deben incluir en este u otro ensayo y que dato puede aportar. Concentración final x 1 rxn x rxns Templado 0; 1; 2,5; 5; 10; 20 ng Buffer Taq Polimerasa 10X 1X MgCl2 (50 mm) 0; 0,5; 1; 2; 5 mm dntp (10mM c/u) 0, 50,100, 250, 500 µm Primer I (100 ng/µl) 0; 0,1; 0,5; 1; 10 ng/?l Primer II (100 ng/µl) 0; 0,1; 0,5; 1; 10 ng/?l Enzima Taq Polimerasa (5U/?l) 0; 0,05; 0,5; 1; 2 U/rxn H2O csp 25?l? Enzima. Taq ADN polimerasa, aislada de Thermus aquaticus. Por qué se utiliza este organismo como fuente de una ADN polimerasa? Buscar la definición de unidad.? Buffer: 200 mm Tris-HCl (ph 8,4), KCl 500 mm.? MgCl2. Concentración final: entre 1 y 5 mm. En que fenómeno de la reacción está actuando este ion? En qué afectan los extremos de este rango?? dntps (datp, dctp, dgtp, dttp). Concentración final 100 µm. Discutir en que fenómeno de la reacción está actuando? Oligonucleótidos: Se utilizarán los oligonucleótidos específicos GFPs y GFPa (ver apéndice) separados por 200 pb. Llevar a concentración final: 1 ng/µl. Discutir diseño y especificidad. Cálculo de Tm para cada uno de los oligos de acuerdo a la secuencia nucleotídica de los mismos y al Tm que usted utilizaría para la PCR.? Templado: ADNg de A. victoria. Tiene alguna importancia la topología del ADN molde en el rendimiento de la reacción? 2 Completar y llevar a cabo la reacción de PCR bajo el siguiente protocolo: a) 1 ciclo 94 C 3 min (desnaturalización) b) 35 ciclos. C 30 seg (desnaturalización). C 30 seg (apareamiento). C. seg (elongación) c) 1 ciclo. C 10 min (elongación final) Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
11 En que se basa para elegir las temperaturas y tiempos de desnaturalización, annealing de los primers y polimerización? DIA 2 B) Análisis de los productos obtenidos en geles de agarosa 1 Colocar la solución de agarosa (aproximadamente 50 ml/gel) por 1 minuto en microondas. Esta solución contiene: Agarosa 1-2% TBE 0,5 X 2 Cuando la solución se encuentre fundida y homogénea dejarla enfriar hasta que se pueda tocar con la mano y agregar Bromuro de etidio 0,5 µg/ml. El Bromuro de Etidio es un potente mutágeno, manejar todas las soluciones que lo contengan con guantes! 3 Volcar la solución de agarosa en la cuba, que debe tener colocados el peine y los separadores. Evitar la formación de burbujas. Esperar hasta que gelifique completamente antes de usar 4 Agregar TBE 0,5 X hasta cubrir el gel y retirar cuidadosamente el peine y los espaciadores. Preparación de las muestras y siembra del gel 1 Mezclar la solución de ADN con el buffer de siembra (que se encuentra preparado 6 veces por encima de su concentración de uso; esto es, 6X en la jerga) 2 Cargar la pipeta con la muestra. Apoyar con delicadeza en uno de los bordes del pocillo (calle, en la jerga). Descargar lentamente la pipeta hasta el primer tope. No llevar al segundo tope aunque no haya descargado por completo para evitar la formación de burbujas. 3 Conectar la fuente teniendo cuidado de que el polo positivo este en el lado opuesto al sitio de siembra. Correr a voltaje constante (se usan unos 5 Volt/cm, midiendo la distancia entre los polos de la cuba) hasta lograr una buena resolución de fragmentos. 4 Apagar la fuente. Colocar el gel sobre un transiluminador de luz UV. Observar manteniendo en todo momento los ojos protegidos de la radiación UV! Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
12 Soluciones utilizadas TBE 1X Tris Base 135 mm Ac. Bórico 45 mm EDTA 2,5 mm Buffer de siembre 6X: Orange G o Azul de bromofenol 0,25% Glicerol 30% Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
13 TP #3 CLONADO y SUBCLONADO Cada grupo recibirá un plásmido recombinante que porta el gen gfp completo de A. victoria. A partir de este plásmido, y mediante una restricción del mismo, se purificará el fragmento correspondiente al inserto gfp (714 pb) y se lo ligará al vector pgex (GE Healthcare Life Sciences). Los productos de ligación serán introducidos por transformación en bacterias E. coli DH5a competentes. Las colonias portadoras del plásmido recombinante serán identificadas por digestión. El vector de expresión de la línea pgex, permite obtener una proteína de fusión a Glutatión-S-transferasa (GST). Utilizando los mapas de ambos vectores y del inserto (ver apéndice) se determinarán los sitios de restricción a utilizar. NOTA. Los manuales de laboratorio recomiendan la utilización de 1 U de enzima de restricción por µg de ADN a digerir. En la práctica, debido a las concentraciones en que vienen las enzimas y a que las enzimas no se pueden guardar diluídas, se suele utilizar un exceso de las mismas (5-10 U/µg). Realizar las reacciones de acuerdo a los protocolos elaborados en la clase. DIA 1 A) Digestión con enzimas de restricción 1) Colocar en un tubo Eppendorf: DNA (1 µg/µl) µl Buffer de reacción µl Enzima 1 (10 UE/µl) µl Enzima 2 (10 UE/µl) µl H20 csp µl 2) Incubar a 37 C por 2 horas. Transcurrido este tiempo, guardar los tubos a -20 C hasta el próximo TP. DIA 2 A) Desfosforilación del ADN Las fosfatasas alcalinas catalizan la eliminación de un grupo fosfato 5 de una cadena de Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
14 ADN. Es conveniente desfosforilar un vector que ha sido digerido con una enzima de restricción con la finalidad de evitar la religación del mismo. Esto impediría la ligación del fragmento de ADN que se quiere ligar. En este caso el ADN doble cadena del inserto aporta dos grupos fosfatos 5 para participar en dos de los cuatro enlaces que serían necesarios para formar 1hebra de ADN doble cadena recombinante circular cerrado. Procedimiento Agregar al mismo tubo donde se hizo la reacción de digestión del plásmido pgex, 1U de CIP (Calf Intestinal Phosphatase) por pmol de terminales de ADN. El alumno deberá calcular la cantidad de enzima necesaria y las condiciones exactas de reacción de acuerdo a los manuales de laboratorio. B) Electroforesis preparativa - Purificación de fragm. de ADN utilizando QIAEX II 1 Sembrar en un gel de agarosa la reacción de digestión del plásmido pgem-t-gfp, así como el vector pgex desfosforilado 2 Correr hasta obtener una buena resolución de los fragmentos 3 Terminar la electroforesis y poner el gel sobre un transiluminador UV. Comprobar que la digestión fue total. Qué espera obtener para cada caso? Protegerse los ojos de la radiación UV! Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
15 4 Cortar la porción de gel correspondiente al fragmento de ADN deseado usando un escalpelo (cuidado de no rayar el transiluminador), colocarla dentro de un tubo eppendorf de 1,5 ml y pesarla 5 Purificar utilizando el kit comercial QIAEX II Procedimiento QIAEX II 1 Agregar 3 volúmenes de una solución NaI 6M (buffer QX1) e incubar durante 5 min a 52ºC para derretir la agarosa 2 Controlar el ph de la solución mediante el indicador coloreado de la solución QX1. Debe permanecer amarillo (ácido), en caso de virar al rojo, reajustar el ph agregando 10µl AcONa 3M ph Agregar 10 µl de resina Qiaex II, resuspender bien con vórtex e incubar por 10 min a 52ºC agitando ocasionalmente 4 Centrifugar durante 1 min a rpm 5 Descartar el sobrenadante y resupender el pellet en 500 µl de solución de lavado (buffer PE). Para el caso del inserto, proveniente de gel, repetir el lavado con QX1, previo al lavado con PE 6 Repetir el lavado 2 veces 7 Extraer la solución del último lavado y dejar secar 5 min en un bloque a 37ºC. 8 Resuspender el pellet en 15 µl de agua, vortexear e incubar 10 min a 50ºC agitando ocasionalmente. 9 Centrifugar durante 1 min a rpm y guardar el sobrenadante. 10 Cuantificar el rendimiento en gel de agarosa con Bromuro de etidio. Alternativa. Purificación de fragmentos de ADN por precipitación con etanol 1 Realizar una extracción con cloroformo y centrifugar (conservar la fase acuosa). 2 Agregar 0,1 volúmenes de acetato de sodio 3M ph 5,2 y luego 3 volúmenes de etanol 100% frío. 3 Incubar a -20 C 30 min. 4 Centrifugar durante 30min en microcentrífuga a rpm. 5 Secar el pellet y resuspender en buffer TE. En qué propiedades se basa cada método para la separación? C) Ligación de fragmentos de ADN El fragmento purificado por cada grupo se ligará al vector pgex en diferentes relaciones molares. Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
16 Se incluirán dos controles de background, uno de vector solo sin ligasa (para conocer la cantidad de vector no cortado por ninguna enzima) y otro de vector solo con ligasa (para conocer la cantidad de vector capaz de recircularizarse sin inserción, es decir cortado con sólo una de las dos enzimas utilizadas). Podría realizar un control adicional? Los componentes de la mezcla de ligación son:? Inserto y Vector (usar de ng) Recuerde que: ng Inserto = ng Vector x kb Inserto x relación molar Inserto:Vector kb Vector? Buffer T4 ADN ligasa 10X: 50 Mm Tris ph7.5, 10 Mm Cl2Mg, 10 Mm DTT, 1 Mm ATP, 25 µg/ml BSA? T4 ADN ligasa: se usan 20 a 40U/por reacción de ligación (1 µl de una dilucion 1/10)? Agua: csp 10 µl 1) Rotular tubos eppendorf como A, B, C, D, E y F y agregarles (las cantidades están en µl): Componentes A B C D E F Inserto (0,7kb X ng/µl) - - Vector (5,6kb 20 ng/µl) - Buffer 10X T4 ligasa (40U/µl) H2Odd csp 10 µl 10 µl 10 µl 10 µl 10 µl 10 µl Nota. Si los volumenes de inserto a agregar lo permiten, se sugiere realizar la reacción de ligación utilizando 50 ng de vector en vez de 20 ng y ajustar las cantidades de inserto acorde a esta modificación. Discutir esta opción con los docentes. 2) Incubar a temperatura ambiente durante 4 horas. Alternativamente puede dejarse toda la noche a 16 C. 3) Guardar a -20 C hasta el momento de la transformación bacteriana. Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
17 TP #4 TRANSFORMACIÓN BACTERIANA A) Transformación baceriana 1 Descongelar las bacterias y dejarlas inmediatamente en hielo 10 min. Cada tubo contiene 200 µl de bacterias E. coli competentes por el método de Cl 2 Ca. 2 Agregar 10 µl de la reacción de ligación. 3 Incubar en hielo 30 min. 4 Incubar segundos a 42 C y luego reposar 2 minutos en hielo (shock térmico). 5 Inocular tubos conteniendo 1 ml de LB y agitar 1 hora a 37 C (recuperación). 6 Sembrar 200 µl en placas de petri con LB agar conteniendo ampicilina 100 µg/ml final. B) Preparación de placas de LB agar 1 Se derrite una solución de LB agar en el microondas y se deja enfriar hasta que pueda ser tocada con la mano (aprox. 50ºC). 2 Agregar ampicilina 100 µg/ml concentración final. 3 Alicuotar en esterilidad (aproximadamente 15 ml/placa) y dejar solidificar. 4 Incubar a 37ºC en forma invertida para secarlas. Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
18 TP #5 PURIFICACION DE ADN PLASMIDICO. SCREENING A) Purificación de ADN plasmídico por el método de lisis alcalina 1 Inocular las colonias aisladas de las transformaciones en 4 ml de medio LB con ampicilina (100µg/ml), dejar crecer ON a 37 C con agitación 2 Centrifugar el cultivo bacteriano (3 ml total) durante 2 minutos a 6000 rpm a temperatura ambiente en microcentrífuga 3 Descartar el sobrenadante por inversión 4 Resuspender completamente el pellet bacteriano en 200 µl de buffer P1 5 Agregar 200 µl de buffer P2. Mezclar suavemente por inversión del tubo (4-6 veces). Incubar a temperatura ambiente 5 minutos exactos! 6 Agregar 200 µl de buffer P3 frío. Mezclar inmediatamente y muy suavemente. Incubar en hielo 10 minutos. 7 Centrifugar 15 minutos a rpm. 8 Transferir el sobrenadante a otro tubo eppendorf y mezclar con 0.7 volúmenes de isopropanol. Agitar por inversión 4-5 veces y centrifugar inmediatamente a rpm durante 30 minutos 9 Descartar el sobrenadante cuidadosamente 10 Lavar el ADN con 200 µl de etanol 70 % (no agitar ni resuspender) 11 Centrifugar 5 minutos a rpm 12 Descartar el sobrenadante cuidadosamente 13 Secar el pellet durante 5 minutos a 37ºC y resuspender en 30 µl de H2O o Tris/HCl 10mM ph 7 14 Cuantificar en gel de agarosa el rendimiento de la purificación por comparación de la intensidad de fluorescencia con cantidades conocidas de ADN del fago?. Buffer P1 (buffer de resuspensión) RNasa A 100 µg/ml Tris/HCl ph 8 50 mm EDTA ph mm Buffer P2 (buffer de lisis) NaOH 200 mm SDS 1 % Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
19 Buffer P3 (buffer de neutralización) AcK ph M B) Identificación de clones positivos por restricción 1) Colocar en un tubo Eppendorf: DNA (1 µg/µl) µl Buffer de reacción µl Enzima 1 (10 UE/µl) µl Enzima 2 (10 UE/µl) µl H20 csp µl 2) Incubar a 37 C por 2 horas; 3) Analizar en gel de agarosa. Qué otras metodologías podría emplear para determinar los clones que contienen el inserto de intrés? Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
20 TP #6 PROTEINAS RECOMBINANTES DIA 1 A) Inducción de la expresión proteica 1 Tomar 0,3 ml del cultivo crecido O.N. (pgex-gfp) e inocular 3 ml de medio Terrific Broth. Realizar la operación por duplicado (uno será el control sin inducir) 2 Incubar 1 h a 37ºC con agitación 3 Inducir uno de los cultivos por agregado de IPTG a una concentración final de 0.2 mm, e incubar 2 h a 37ºC con agitación 4 Cosechar 3 ml de cada cultivo, centrifugando 1,5 ml por 5 min a 5000 rpm. Descartar el sobrenadante por volcado y volver a cosechar 1,5 ml en el mismo tubo. Descartar el sobrenadante. 5 Observar al UV y comparar los pellets de cultivos inducidos y no inducidos. Guardar los pellets congelados a 70ºC hasta el próximo TP. DIA 2 A) Purificación de proteinas recombinantes fusionadas a GST 1 Resuspender los pellets congelados en 500 µl de TBS conteniendo inhibidores de proteasas (PMSF1mM y EDTA 3mM) 2 Sonicar las muestras 3 pulsos de 20 segundos con intervalos de otros 20 segundos en hielo 3 Agregar a cada muestra Triton X-100 1% final e incubar en hielo por 10 minutos 4 Centrifugar 10 minutos a rpm 5 Tomar el sobrenadante e incubarlo con la resina (glutation agarosa) previamente hidratada en TBS durante 1 hora a temperatura ambiente 6 Centrifugar 1 min a 3000 rpm, sacar sobrenadante y guardarlo en tubo nuevo en hielo. 7 Realizar 3 lavados con 500 µl TBS-Triton X100 1%. Se centrifuga 1 min a 3000 rpm entre lavados. Descartar los lavados. 8 Realizar la elución en dos pasos: 8.1 Incubar la resina en presencia de Trombina (1 Unidad), durante 1 hora con agitación, en un volumen final de 100 µl de TBS-CaCl 2 3 mm. Esta es una proteasa que corta específicamente en la secuencia de reconocimiento presente en la proteína de fusión (Donde cree usted que está ubicada la secuencia de corte para la Trombina en la proteína Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
21 de fusión? Para que cree usted que se incluye un sitio de corte para una proteasa como parte de esta proteína de fusión?). Luego guardar el sobrenadante en hielo (4ºC). 8.2 Lavar la resina con 1 ml de con TBS-Triton X100 1% 8.3 Incubar la resina con 100 µl de glutation reducido 15 mm por 10 minutos en agitación y guardar el sobrenadante 9 Congelar los tubos hasta el próximo TP. DIA 3 A) Electroforesis en condiciones desnaturalizantes A.1) Preparación de la muestra para geles desnaturalizantes (SDS-PAGE ) 1 Mezclar 14 µl de cada muestra con DTT (0.1M final) y Cracking buffer 5X (1X final) e incubarlo por 3 minutos a 100 ºC 2 Centrifugar 2 min a rpm 3 Sembrar las muestras en geles 10% acrilamida-bisacrilamida 29:1 de acuerdo a la indicación del docente. A.2) Preparación geles desnaturalizantes y electroforesis Gel Separador 10% (10ml gel) Acri: Bis (29:1) 3.33 ml Agua 2.76 ml SDS 10% 0.1 ml Tris-HCl 1M ph ml APS 10% 100 µl Temed 10 µl Gel Stacking 5% (5 ml gel) Acri: Bis (29:1) 0.83 ml Agua 3.45 ml SDS 10% 0.05 ml Tris-HCl 1M ph ml APS 10% 50 µl Temed 5 µl Running Buffer 5X (1litro) Glicina 72g Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
22 Tris SDS 15g 5g A.3) Coloración Una vez corrido el gel, se lo separa de los vidrios cuidadosamente (utilize guantes!). Colorear el gel con Coomasie Blue R-250 (0.2% Coomasie, 50% Metanol y 10% Acético) durante 1 hora. Decolorar realizando varios cambios de solución fijadora (20% Metanol, 10% ácido acético, 70% agua) B) Electroforesis en condiciones nativas B.1) Preparación de la muestra para geles nativos 1 Mezclar 14 µl de cada muestra con Cracking buffer nativo hasta 1X final 2 Sembrar los geles PAGE nativos 8% y correrlos a 120V constantes. B.2) Preparación geles nativos Gel Separador 8% (10ml gel) Acri: Bis (29:1) 2.5 ml Agua 3.6 ml Tris-HCl 1M ph APS 10% 100 µl Temed 10 µl Gel Stacking 5% (5 ml gel) Acri: Bis (29:1) 0.83 ml Agua 3.45 ml Tris-HCl 1M ph ml APS 10% 50 µl Temed 5 µl B.3) Visualización de GFP en geles nativos Una vez corridos los geles, se los separa de los vidrios cuidadosamente utilizando guantes. Los geles nativos se irradian con luz UV onda corta (~245nm) con el objetivo de identificar la proteína de fusión con GFP producida y purificada. Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
23 TP #7 TRANSFERENCIA Y WESTERN BLOT A) Transferencia Materiales - dos casetes de transferencia (son parte del set de transferencia); - cuatro papeles Whatman (3MM o similar); - filtro de nitrocelulosa o nylon, cortados del tamaño del gel a transferir (levemente más grandes). Precauciones I? Todo el material a utilizar debe equilibrarse en el buffer de transferencia. En el caso de la membrana primero se humedece en agua destilada y recién después se equilibra en el buffer de transferencia;? El sandwich de transferencia debe armarse siempre sumergido en el buffer para evitar burbujas de aire;? UTILIZAR EN TODO MOMENTO GUANTES (el contacto con la piel puede engrasar la membrana y/o el gel de poliacrilamida y evitar la transferencia). Una vez embebido el material en el buffer de transferencia colocar por orden: 1. Tapa plástica negra (se ubicará en el electrodo negativo) 2. dos unidades de papel Whatman 3. gel de electroforesis (pasarlo con cuidado) 4. membrana de nitrocelulosa o nylon 5. dos unidades de papel Whatman 6. cerrar con la tapa plástica blanca (será el positivo) Precauciones II Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
24 Cuidar que no queden burbujas de aire en ningún lugar del sandwich, pues no pasará corriente eléctrica en ese punto. RECOMENDACION: entre el paso 5 y 6 anteriores (es decir, antes de cerrar la segunda tapa de plástico) ayudarse con una varilla de vidrio o pipeta para sacar todas las burbujas que pudieran haber quedado. Condiciones de transferencia? 200 ma en 1 hs (corriente limitante), ó 30 ma O.N. Hecha la transferencia, desarmar el dispositivo y secar la membrana sobre un papel de filtro (este filtro se puede guardar o pasar directamente a su procesado). NOTA: En este punto se pueden teñir las membranas de nitro o nylon para ver todas las proteínas que se han transferido, con el colorante rojo Ponceau en TBS. B) Inmunodetección Todo el procesamiento se lleva a cabo a temperatura ambiente. a) Bloquear un mínimo de 30 min. en TBS - 5% leche descremada - 0,3% Tween; b) Incubar con el anticuerpo primario diluido en TBS - 2% leche descremada - 0,3% Tween por el lapso de una hora (la dilución a usar depende de la calidad y título del anticuerpo; se definirá en el momento de hacerlo) (todo a temperatura ambiente). c) Lavar TBS 10min TBS + Tween 0,3% 10min TBS 10min; d) Incubar con el anticuerpo secundario (anti-ig de conejo conjugado con fosfatasa alcalina) diluido 1:2000 en TBS - 2% leche descremada - 0,3% Tween, una hora. e) idem punto c) Revelado a) Pasar el filtro a recipiente con 10 ml de solución de DAB (di-amino benzidina). b) Detener la reacción cambiando el filtro a un recipiente con abundante agua. Soluciones Buffer de transferencia : Tris-base 9.09 g Glicina 43.2 g Metanol 600 ml llevar a 3 litros con agua deionizada Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
25 TBS (Tris buffered saline): Tris.HCl ph mM NaCl 150mM Solución de revelado (DAB): 6mg en 10ml de PBS + 10?l de peróxido de hidrógeno. Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
26 APÉNDICE I. SECUENCIA Query Y OLIGONUCLEÓTIDOS EMPLEADOS >partial_cds aacatacggaaaacttacccttaaatttatttgcactactgggaagctacctgttccatgg ccaacacttgtcactactttctcttatggtgtacaatgcttctcaagatacccagatcata tgaaacagcatgactttctcaagagtgccatgcccgaaggttatgtacaggaaagaactat attttacaaagatgacgggaactacaagacacgtgctgaagtcaagtttgagggtgatacc cttgttaatagaatcgagttaaaaggtattgattttaaagaagatggaaacattcttggac acaaaatggaatacaactataactcacataatgtatacatcatgggagacaaaccaaagaa tggcatcaaagttaacttcaaaattagacacaacattaaagatggaagcgttcaattagca Las secuencias de los oligonucleótidos utilizados son (de 5 a 3 ): GFPs / GGGATGAGTAAAGGAGAAGAACTT GFPa / CATATGACTGGGTATCTCGC II. VECTORES Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
27 Gen. Mol. y Biol. Mol. del Desarrollo - Guía de trabajos prácticos
Módulo 1 Biología Molecular Genética Molecular II 2009. Módulo 1. Amplificación de un fragmento de ADN genómico por PCR
 Módulo 1 Amplificación de un fragmento de ADN genómico por PCR En este primer módulo se amplificará por PCR, mediante el uso de oligonucleótidos específicos, un fragmento de ADN genómico de Aspergillus
Módulo 1 Amplificación de un fragmento de ADN genómico por PCR En este primer módulo se amplificará por PCR, mediante el uso de oligonucleótidos específicos, un fragmento de ADN genómico de Aspergillus
3. COMPONENTES. Tampón de electroforesis concentrado 2 x 50 ml 10 X (2 envases 500ml)
 PCR SIMULADA Ref.PCR Simulada (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
PCR SIMULADA Ref.PCR Simulada (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
5. DETECCION DE GENES DE VIRULENCIA MEDIANTE HIBRIDACIÓN CON SONDAS DE ADN
 5. DETECCION DE GENES DE VIRULENCIA MEDIANTE HIBRIDACIÓN CON SONDAS DE ADN Materiales - Eppendorf de 1,5 ml estériles - Eppendorf de pared fina para PCR - Puntas de pipeta estériles desechables - Guantes
5. DETECCION DE GENES DE VIRULENCIA MEDIANTE HIBRIDACIÓN CON SONDAS DE ADN Materiales - Eppendorf de 1,5 ml estériles - Eppendorf de pared fina para PCR - Puntas de pipeta estériles desechables - Guantes
ELABORACIÓN N DE MEZCLA PARA PCR. Raquel Asunción Lima Cordón
 ELABORACIÓN N DE MEZCLA PARA PCR Raquel Asunción Lima Cordón PCR Polymerase Chain reaction (reacción en cadena de la polimerasa) Sintetizar muchas veces un fragmento de ADN PCR: simulación de lo que sucede
ELABORACIÓN N DE MEZCLA PARA PCR Raquel Asunción Lima Cordón PCR Polymerase Chain reaction (reacción en cadena de la polimerasa) Sintetizar muchas veces un fragmento de ADN PCR: simulación de lo que sucede
ELECTROFORESIS BASICA
 Ref.ELECBASICA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS BASICA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Ref.ELECBASICA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS BASICA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
PCR. Técnica inventada por Kary Mullis :1987. Premio Nobel 1993. Amplifica una ÚNICA secuencia a partir de una mezcla compleja de ADN
 PCR PCR Técnica inventada por Kary Mullis :1987 Premio Nobel 1993 Amplifica una ÚNICA secuencia a partir de una mezcla compleja de ADN Aprovecha los requerimientos de la replicación Templete ADN Nucleótidos
PCR PCR Técnica inventada por Kary Mullis :1987 Premio Nobel 1993 Amplifica una ÚNICA secuencia a partir de una mezcla compleja de ADN Aprovecha los requerimientos de la replicación Templete ADN Nucleótidos
CURSO DE EXTENSIÓN TEÓRICO PRÁCTICO HERRAMIENTAS EFICIENTES PARA LA IDENTIFICACIÓN DE LEVADURAS DE INTERÉS AGROINDUSTRIAL
 LIBRO DE MEMORIAS 2 CURSO DE EXTENSIÓN TEÓRICO PRÁCTICO HERRAMIENTAS EFICIENTES PARA LA IDENTIFICACIÓN DE LEVADURAS DE INTERÉS AGROINDUSTRIAL Santiago de Cali, 23 al 28 de agosto de 2010 3 Libro de memorias
LIBRO DE MEMORIAS 2 CURSO DE EXTENSIÓN TEÓRICO PRÁCTICO HERRAMIENTAS EFICIENTES PARA LA IDENTIFICACIÓN DE LEVADURAS DE INTERÉS AGROINDUSTRIAL Santiago de Cali, 23 al 28 de agosto de 2010 3 Libro de memorias
PROBLEMAS MÁS FRECUENTES Y POSIBLES SOLUCIONES
 PROBLEMAS MÁS FRECUENTES Y POSIBLES SOLUCIONES NO SE PRODUCE REACCIÓN O ÉSTA DECAE POCO DESPUÉS DE COMENZAR No hay ADN o hay menos del necesario No hay cebador o la concentración es inferior a la necesaria.
PROBLEMAS MÁS FRECUENTES Y POSIBLES SOLUCIONES NO SE PRODUCE REACCIÓN O ÉSTA DECAE POCO DESPUÉS DE COMENZAR No hay ADN o hay menos del necesario No hay cebador o la concentración es inferior a la necesaria.
PROBLEMAS MAS FRECUENTES DURANTE LA SECUENCIACIÓN NO SE PRODUCE REACCION O ESTA DECAE POCO DESPUÉS DE COMENZAR
 PROBLEMAS MAS FRECUENTES DURANTE LA SECUENCIACIÓN NO SE PRODUCE REACCION O ESTA DECAE POCO DESPUÉS DE COMENZAR Las causas pueden ser las siguientes: No hay ADN o se encuentra en muy baja concentración.
PROBLEMAS MAS FRECUENTES DURANTE LA SECUENCIACIÓN NO SE PRODUCE REACCION O ESTA DECAE POCO DESPUÉS DE COMENZAR Las causas pueden ser las siguientes: No hay ADN o se encuentra en muy baja concentración.
3/22/2010. Iván Ferrer Rodríguez, PhD Catedrático. En el 1983, Kary Mullis dio a conocer la Técnica de reacción en cadena de la Polimerasa o PCR.
 Iván Ferrer Rodríguez, PhD Catedrático En el 1983, Kary Mullis dio a conocer la Técnica de reacción en cadena de la Polimerasa o PCR. Síntesis "in vitro" de secuencias específicas de ADN son amplificadas.
Iván Ferrer Rodríguez, PhD Catedrático En el 1983, Kary Mullis dio a conocer la Técnica de reacción en cadena de la Polimerasa o PCR. Síntesis "in vitro" de secuencias específicas de ADN son amplificadas.
Materiales para la secuenciación de ADN
 Introduccion La Secuenciación Sanger es un método de secuenciación de ADN en el que el ADN diana se desnaturaliza y se hibrida con un cebador de oligonucleótidos, que se extiende entonces gracias a la
Introduccion La Secuenciación Sanger es un método de secuenciación de ADN en el que el ADN diana se desnaturaliza y se hibrida con un cebador de oligonucleótidos, que se extiende entonces gracias a la
DANAGENE RNA PURIFICATION KIT
 DANAGENE RNA PURIFICATION KIT REF.0801.1 100 EXTRACCIONES REF.0801.2 500 EXTRACCIONES 1.INTRODUCCION Este kit permite la permite la obtención de ARN total a partir de cultivos celulares, tejidos animales,
DANAGENE RNA PURIFICATION KIT REF.0801.1 100 EXTRACCIONES REF.0801.2 500 EXTRACCIONES 1.INTRODUCCION Este kit permite la permite la obtención de ARN total a partir de cultivos celulares, tejidos animales,
ELECTROFORESIS AVANZADA
 Ref.ELECAVANZADA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Ref.ELECAVANZADA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Detección de patógenos en alimentos, utilizando la técnica de PCR, reacción en cadena de la polimerasa.
 Detección de patógenos en alimentos, utilizando la técnica de PCR, reacción en cadena de la polimerasa. Lic. Esp. Mariano Diego Massari 1er Congreso Bioquímico Córdoba 2011 8ª Jornada de Actualización
Detección de patógenos en alimentos, utilizando la técnica de PCR, reacción en cadena de la polimerasa. Lic. Esp. Mariano Diego Massari 1er Congreso Bioquímico Córdoba 2011 8ª Jornada de Actualización
APLICACIÓN DE LA PCR: DIAGNÓSTICO DE PARÁSITOS
 Prácticas docentes en la COD: 10-71 APLICACIÓN DE LA PCR: DIAGNÓSTICO DE PARÁSITOS FUNDAMENTO TEÓRICO La PCR es una técnica que permite llevar a cabo la síntesis in vitro de fragmentos de ADN. Está basada
Prácticas docentes en la COD: 10-71 APLICACIÓN DE LA PCR: DIAGNÓSTICO DE PARÁSITOS FUNDAMENTO TEÓRICO La PCR es una técnica que permite llevar a cabo la síntesis in vitro de fragmentos de ADN. Está basada
38. Purificación de ADN plasmídico y electroforesis del mismo en gel de agarosa
 38. Purificación de ADN plasmídico y electroforesis del mismo en gel de agarosa José Luis Caballero Repullo, Enriqueta Moyano, Juan Muñoz Blanco Departamento de Bioquímica y Biología Molecular, Campus
38. Purificación de ADN plasmídico y electroforesis del mismo en gel de agarosa José Luis Caballero Repullo, Enriqueta Moyano, Juan Muñoz Blanco Departamento de Bioquímica y Biología Molecular, Campus
Práctico: Genética bacteriana 2007.
 Práctico: Genética bacteriana 2007. Actividad integrada Departamento de Genética Departamento de Bacteriología y Virología. OBJETIVOS Objetivos generales El estudiante al terminar la actividad práctica
Práctico: Genética bacteriana 2007. Actividad integrada Departamento de Genética Departamento de Bacteriología y Virología. OBJETIVOS Objetivos generales El estudiante al terminar la actividad práctica
CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA. Grado en Medicina
 DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR III FACULTAD DE MEDICINA UNIVERSIDAD COMPLUTENSE DE MADRID CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA Grado en Medicina CURSO ACADÉMICO 2014/2015 INDICE
DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR III FACULTAD DE MEDICINA UNIVERSIDAD COMPLUTENSE DE MADRID CUADERNO DE PRÁCTICAS GENETICA MOLECULAR HUMANA Grado en Medicina CURSO ACADÉMICO 2014/2015 INDICE
Reacción en cadena de la polymerasa (PCR)
 Reacción en cadena de la polymerasa (PCR) 1 PCR Que es? Es una técnica in vitro diseñada para amplificar una región específica de DNA. Es extremadamente sensible, con la capacidad de amplificar millones
Reacción en cadena de la polymerasa (PCR) 1 PCR Que es? Es una técnica in vitro diseñada para amplificar una región específica de DNA. Es extremadamente sensible, con la capacidad de amplificar millones
Western Blotting (o inmunotransferencia) es un procedimiento estándar de laboratorio que permite a
 Introducción Western Blotting (o inmunotransferencia) es un procedimiento estándar de laboratorio que permite a los investigadores verificar la expresión de una proteína, determinar la cantidad relativa
Introducción Western Blotting (o inmunotransferencia) es un procedimiento estándar de laboratorio que permite a los investigadores verificar la expresión de una proteína, determinar la cantidad relativa
5. MATERIALES Y MÉTODOS
 5. MATERIALES Y MÉTODOS 5.1 Equipos Los siguientes termocicladores se emplearon para la amplificación por PCR: - Perkin Elmer, GeneAmp PCR System 2400. - Perkin Elmer, GeneAmp PCR System 9600. - Applied
5. MATERIALES Y MÉTODOS 5.1 Equipos Los siguientes termocicladores se emplearon para la amplificación por PCR: - Perkin Elmer, GeneAmp PCR System 2400. - Perkin Elmer, GeneAmp PCR System 9600. - Applied
Practica la genética Ficha didáctica del profesorado Bachillerato
 Ficha didáctica del profesorado Bachillerato www.eurekamuseoa.es Extracción de ADN Cuál es la función de cada uno de los ingredientes utilizados para realizar la disolución tampón para la visualización
Ficha didáctica del profesorado Bachillerato www.eurekamuseoa.es Extracción de ADN Cuál es la función de cada uno de los ingredientes utilizados para realizar la disolución tampón para la visualización
Código: IDX-016 Ver: 1 TOXO. Sistema para la detección de la presencia de ADN de Toxoplasma gondii. Reg. MSP 21205
 Sistema para la detección de la presencia de ADN de Toxoplasma gondii Reg. MSP 21205 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. info@atgen.com.uy www.atgen.com.uy
Sistema para la detección de la presencia de ADN de Toxoplasma gondii Reg. MSP 21205 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. info@atgen.com.uy www.atgen.com.uy
C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O. Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua
 C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno,
C A P Í T U L O 3 M A T E R I A L E S Y M É T O D O Se ejecutaron varias pruebas para la inactivación de Escherichia Coli ATCC 25922 en agua destilada utilizando Dióxido de Titanio dopado con Nitrógeno,
TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR
 TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DOCENTES: Andrés Ciocchini, Gabriela Niemirowicz. DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR Purificación de ácido desoxiribonucleico (ADN) por partición diferencial
TRABAJO PRÁCTICO Nº 5: ÁCIDOS NUCLEICOS DOCENTES: Andrés Ciocchini, Gabriela Niemirowicz. DESCRIPCIÓN DE LOS MÉTODOS A UTILIZAR Purificación de ácido desoxiribonucleico (ADN) por partición diferencial
velocidades de movimiento mediante la aplicación de un campo eléctrico a través de una matriz porosa
 INTRODUCCIÓN En general, la electroforesis es una técnica que separa las moléculas en base a sus diferentes velocidades de movimiento mediante la aplicación de un campo eléctrico a través de una matriz
INTRODUCCIÓN En general, la electroforesis es una técnica que separa las moléculas en base a sus diferentes velocidades de movimiento mediante la aplicación de un campo eléctrico a través de una matriz
CUESTIONES. 1. Por qué la PCR convencional no es cuantitativa?
 2º BIOQUÍMICA CUESTIONES 1. Por qué la PCR convencional no es cuantitativa? En la PCR convencional, la cuantificación del ADN de la muestra es complicada debido a que la eficacia de amplificación va disminuyendo
2º BIOQUÍMICA CUESTIONES 1. Por qué la PCR convencional no es cuantitativa? En la PCR convencional, la cuantificación del ADN de la muestra es complicada debido a que la eficacia de amplificación va disminuyendo
P.C.R. "Técnica de amplificación enzimática de secuencias específicas de DNA"
 P.C.R. "Técnica de amplificación enzimática de secuencias específicas de DNA" Paso 1: Desnaturalización del DNA Paso 2: Hibridación de los "Primers" Paso 3: Extensión Paso 1: Desnaturalización del DNA
P.C.R. "Técnica de amplificación enzimática de secuencias específicas de DNA" Paso 1: Desnaturalización del DNA Paso 2: Hibridación de los "Primers" Paso 3: Extensión Paso 1: Desnaturalización del DNA
ELECTROFORESIS EN GELES DE AGAROSA. Agustín Garrido. agugarrido@hotmail.com
 1 ELECTROFORESIS EN GELES DE AGAROSA Agustín Garrido agugarrido@hotmail.com Introducción En este trabajo práctico se utilizó la técnica de electroforesis. Este proceso se basa en la migración de las moléculas
1 ELECTROFORESIS EN GELES DE AGAROSA Agustín Garrido agugarrido@hotmail.com Introducción En este trabajo práctico se utilizó la técnica de electroforesis. Este proceso se basa en la migración de las moléculas
Identificación varietal en vid por técnicas de Biología Molecular. Lic. Luciana Garcia Lic. Carolina Chiconofri
 Identificación varietal en vid por técnicas de Biología Molecular. Lic. Luciana Garcia Lic. Carolina Chiconofri OBJETIVO Desarrollar un banco de datos a partir de plantas de origen indudable y del uso
Identificación varietal en vid por técnicas de Biología Molecular. Lic. Luciana Garcia Lic. Carolina Chiconofri OBJETIVO Desarrollar un banco de datos a partir de plantas de origen indudable y del uso
DANAGENE SALIVA KIT. Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones
 DANAGENE SALIVA KIT Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones 1.INTRODUCCION DANAGENE SALIVA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de muestras
DANAGENE SALIVA KIT Ref.0603.4 50 Extracciones / Ref.0603.41 160 Extracciones 1.INTRODUCCION DANAGENE SALIVA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de muestras
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 Unidad Curricular: Virología y Micología Veterinaria 1 TRABAJO PRÁCTICO No. 3 AMPLIFICACIÓN DE GENES VIRALES Reacción en Cadena de la Polimerasa, conocida como PCR (por sus siglas en inglés: Polimerase
Unidad Curricular: Virología y Micología Veterinaria 1 TRABAJO PRÁCTICO No. 3 AMPLIFICACIÓN DE GENES VIRALES Reacción en Cadena de la Polimerasa, conocida como PCR (por sus siglas en inglés: Polimerase
DETECCIÓN DE C. jejuni EN HAMBURGUESA DE POLLO POR PCR TRADICIONAL PRT-712.04-082
 Página 1 de 5 1. OBJETIVO Detectar la presencia de Campylobacter jejuni en hamburguesa de pollo mediante técnica de PCR. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a muestras de hamburguesa
Página 1 de 5 1. OBJETIVO Detectar la presencia de Campylobacter jejuni en hamburguesa de pollo mediante técnica de PCR. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a muestras de hamburguesa
MICROBIOLOGÍA DE LOS ALIMENTOS 2015 INGENIERÍA EN ALIMENTOS LICENCIATURA EN BIOQUÍMICA TRABAJO PRÁCTICO N 1 REACCIÓN EN CADENA DE LA POLIMERASA (PCR)
 MICROBIOLOGÍA DE LOS ALIMENTOS 2015 INGENIERÍA EN ALIMENTOS LICENCIATURA EN BIOQUÍMICA TRABAJO PRÁCTICO N 1 REACCIÓN EN CADENA DE LA POLIMERASA (PCR) OBJETIVOS - Definir PCR, conocer los reactivos que
MICROBIOLOGÍA DE LOS ALIMENTOS 2015 INGENIERÍA EN ALIMENTOS LICENCIATURA EN BIOQUÍMICA TRABAJO PRÁCTICO N 1 REACCIÓN EN CADENA DE LA POLIMERASA (PCR) OBJETIVOS - Definir PCR, conocer los reactivos que
Criterios para diseñar primers. Iván Ferrer Rodríguez, Ph.D. Catedrático
 Criterios para diseñar primers Iván Ferrer Rodríguez, Ph.D. Catedrático 1 Qué es un primer? Es una cadena corta de nucleótidos, un oligonucleótido. Sirve como punto de partida para la replicación del DNA.
Criterios para diseñar primers Iván Ferrer Rodríguez, Ph.D. Catedrático 1 Qué es un primer? Es una cadena corta de nucleótidos, un oligonucleótido. Sirve como punto de partida para la replicación del DNA.
CLASE DE RESOLUCIÓN DE PROBLEMAS DE PCR LIC. BIOTECNOLOGÍA 2015
 CLASE DE RESOLUCIÓN DE PROBLEMAS DE PCR LIC. BIOTECNOLOGÍA 2015 DEFINICIÓN PCR: Constituye la técnica más importante para amplificar ácidos nucleicos in vitro. Ambas hebras del DNA de interés son replicadas
CLASE DE RESOLUCIÓN DE PROBLEMAS DE PCR LIC. BIOTECNOLOGÍA 2015 DEFINICIÓN PCR: Constituye la técnica más importante para amplificar ácidos nucleicos in vitro. Ambas hebras del DNA de interés son replicadas
METODOLOGÍAS UTILIZADAS EN INVESTIGACIÓN BÁSICA Y APLICADA REACCION EN CADENA DE LA POLIMERASA (PCR)
 METODOLOGÍAS UTILIZADAS EN INVESTIGACIÓN BÁSICA Y APLICADA REACCION EN CADENA DE LA POLIMERASA (PCR) Centro de de Microscopía Electrónica Facultad de de Ciencias Médicas Universidad Nacional de de Córdoba
METODOLOGÍAS UTILIZADAS EN INVESTIGACIÓN BÁSICA Y APLICADA REACCION EN CADENA DE LA POLIMERASA (PCR) Centro de de Microscopía Electrónica Facultad de de Ciencias Médicas Universidad Nacional de de Córdoba
PCR. Componentes del PCR. PCR Polymerase Chain Reaction (Reacción en Cadena de la Polimerasa)
 PCR PCR Polymerase Chain Reaction (Reacción en Cadena de la Polimerasa) Es una técnica de biología molecular descrita en 1986 por Kary Mullis. (Nobel de química en 1993) Necesidad de pruebas de diagnóstico
PCR PCR Polymerase Chain Reaction (Reacción en Cadena de la Polimerasa) Es una técnica de biología molecular descrita en 1986 por Kary Mullis. (Nobel de química en 1993) Necesidad de pruebas de diagnóstico
DETERMINACIÓN DEL FACTOR Rh por PCR
 Ref.PCRRh DETERMINACIÓN DEL FACTOR Rh por PCR 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
Ref.PCRRh DETERMINACIÓN DEL FACTOR Rh por PCR 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
SECUENCIACIÓN SANGER DE ADN: GUÍA DE SOLUCIONES TÉCNICAS
 SECUENCIACIÓN SANGER DE ADN: GUÍA DE SOLUCIONES TÉCNICAS Secugen recomienda que para la visualización de las secuencias se usen programas que permitan ver el dato crudo, ya que a partir de ese dato se
SECUENCIACIÓN SANGER DE ADN: GUÍA DE SOLUCIONES TÉCNICAS Secugen recomienda que para la visualización de las secuencias se usen programas que permitan ver el dato crudo, ya que a partir de ese dato se
NMX-F-070-1964. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE TIAMINA. THIAMINE DETERMINATION. TEST METHOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS.
 NMX-F-070-1964. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE TIAMINA. THIAMINE DETERMINATION. TEST METHOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. ASUNTO Con fundamento en lo dispuesto en los Artículos
NMX-F-070-1964. MÉTODO DE PRUEBA PARA LA DETERMINACIÓN DE TIAMINA. THIAMINE DETERMINATION. TEST METHOD. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. ASUNTO Con fundamento en lo dispuesto en los Artículos
Protocolo de laboratorio para purificación manual de ADN a partir de una muestra de 0,5 ml
 Protocolo de laboratorio para purificación manual de ADN a partir de una muestra de 0,5 ml Para la purificación de ADN genómico de todos los kits de colección Oragene y ORAcollect. Visite nuestro sitio
Protocolo de laboratorio para purificación manual de ADN a partir de una muestra de 0,5 ml Para la purificación de ADN genómico de todos los kits de colección Oragene y ORAcollect. Visite nuestro sitio
Técnicas de Biología Molecular
 Técnicas de Biología Molecular DNA I. Enzimas de restricción Análisis Las enzimas de restricción fueron aisladas de bacterias; su función natural es proteger contra DNA extraño II. Separación electroforética
Técnicas de Biología Molecular DNA I. Enzimas de restricción Análisis Las enzimas de restricción fueron aisladas de bacterias; su función natural es proteger contra DNA extraño II. Separación electroforética
7.012 Serie de ejercicios 5
 Nombre Grupo 7.012 Serie de ejercicios 5 Pregunta 1 Al estudiar los problemas de esterilidad, usted intenta aislar un hipotético gen de conejo que explique la prolífica reproducción de estos animales.
Nombre Grupo 7.012 Serie de ejercicios 5 Pregunta 1 Al estudiar los problemas de esterilidad, usted intenta aislar un hipotético gen de conejo que explique la prolífica reproducción de estos animales.
Técnicas de ADN recombinante: la manipulación genética
 Técnicas de ADN recombinante: la manipulación genética A partir de los años 70 se desarrollaron las herramientas de la biología molecular o la ingeniería genética o lo que se ha llamado técnicas del ADN
Técnicas de ADN recombinante: la manipulación genética A partir de los años 70 se desarrollaron las herramientas de la biología molecular o la ingeniería genética o lo que se ha llamado técnicas del ADN
TEST de PATERNIDAD. Ref.PCR paternidad (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO
 Ref.PCR paternidad (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO TEST de PATERNIDAD Este experimento introduce a los alumnos en el uso del ADN y la PCR para simular una determinación de paternidad. Los estudiantes
Ref.PCR paternidad (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO TEST de PATERNIDAD Este experimento introduce a los alumnos en el uso del ADN y la PCR para simular una determinación de paternidad. Los estudiantes
FRAGMENTO OLIGO 5-3 Hebra SECUENCIA 5' - - > 3' TAMAÑO (pb) F1. hmtl 569 L AACCAAACCCCAAAGACACC hmth2982 H CTGATCCAACATCGAGGTCG
 ANEXO 1 Protocolo para la PCR para la amplificación del mtdna en 10 fragmentos solapantes: Se prepara la siguiente mezcla: Tampón ( TRIS 100 mm, MgCl 2 12 mm, KCl 500 mm, ph 8,3): 10X dntps : 10 mm (cada
ANEXO 1 Protocolo para la PCR para la amplificación del mtdna en 10 fragmentos solapantes: Se prepara la siguiente mezcla: Tampón ( TRIS 100 mm, MgCl 2 12 mm, KCl 500 mm, ph 8,3): 10X dntps : 10 mm (cada
Código: IDK-010 Ver: 1. Proteína G C825T. Sistema para la detección de la mutación C825T en el gene de la proteína G.
 C825T Sistema para la detección de la mutación C825T en el gene de la proteína G. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy www.atgen.com.uy
C825T Sistema para la detección de la mutación C825T en el gene de la proteína G. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy www.atgen.com.uy
El Banco Nacional de ADN oferta un control de calidad de muestras de ADN y ARN.
 PROGRAMA CONTROL DE CALIDAD DE MUESTRAS El Banco Nacional de ADN oferta un control de calidad de muestras de ADN y ARN. El programa completo de control de calidad de muestras de ADN y ARN engloba diferentes
PROGRAMA CONTROL DE CALIDAD DE MUESTRAS El Banco Nacional de ADN oferta un control de calidad de muestras de ADN y ARN. El programa completo de control de calidad de muestras de ADN y ARN engloba diferentes
1. Título. Cuantificacion de ADN por espectrofluorometría mediante el uso de Quant- it PicoGreen dsaadnssay Kit (Invitrogen ).
 1. Título. Cuantificacion de ADN por espectrofluorometría mediante el uso de QuantiT PicoGreen dsaadnssay Kit (Invitrogen ). 2. Finalidad. El presente documento describe el Procedimiento Normalizado de
1. Título. Cuantificacion de ADN por espectrofluorometría mediante el uso de QuantiT PicoGreen dsaadnssay Kit (Invitrogen ). 2. Finalidad. El presente documento describe el Procedimiento Normalizado de
ELECTROFORESIS. Agarosa. Poliacrilamida
 ELECTROFORESIS DE ADN ELECTROFORESIS Agarosa Poliacrilamida Finalidad de la electroforesis Separar Identificar Purificar 1 2 3 4 5 Tinción del ADN Bromuro de etidio Absorbancia a 302 y 366 y emisión a
ELECTROFORESIS DE ADN ELECTROFORESIS Agarosa Poliacrilamida Finalidad de la electroforesis Separar Identificar Purificar 1 2 3 4 5 Tinción del ADN Bromuro de etidio Absorbancia a 302 y 366 y emisión a
AUTOR: JORGE CONTRERAS PINEDA 1. Titulo:
 Página 1 de 1 1. Titulo: Electroforesis de DNA 2. Objetivo Conocer los principios básicos de la electroforesis horizontal en geles de agarosa y aplicarlo para la separación de DNA humano, plasmídico, recombinante
Página 1 de 1 1. Titulo: Electroforesis de DNA 2. Objetivo Conocer los principios básicos de la electroforesis horizontal en geles de agarosa y aplicarlo para la separación de DNA humano, plasmídico, recombinante
PRACTICA Núm. 16 RECUENTO DE BACTERIAS MESOFILAS AEROBIAS EN AGUA PARA CONSUMO HUMANO
 PRACTICA Núm. 16 RECUENTO DE BACTERIAS MESOFILAS AEROBIAS EN AGUA PARA CONSUMO HUMANO I. OBJETIVO Determinar la presencia de bacterias Mesófilas Aerobias en una muestra de agua potable por la técnica de
PRACTICA Núm. 16 RECUENTO DE BACTERIAS MESOFILAS AEROBIAS EN AGUA PARA CONSUMO HUMANO I. OBJETIVO Determinar la presencia de bacterias Mesófilas Aerobias en una muestra de agua potable por la técnica de
Reacción en cadena de la polimerasa (PCR)
 Dr. Alejandro Leal Reacción en cadena de la polimerasa (PCR) La reacción en cadena de la polimerasa (PCR, por sus siglas en inglés de "polymerase chain reaction") es un método de amplificación in vitro
Dr. Alejandro Leal Reacción en cadena de la polimerasa (PCR) La reacción en cadena de la polimerasa (PCR, por sus siglas en inglés de "polymerase chain reaction") es un método de amplificación in vitro
PCR gen 18S ARNr humano
 PCR gen 18S ARNr humano Ref.PCR18S 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa (PCR)
PCR gen 18S ARNr humano Ref.PCR18S 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa (PCR)
CUANTIFICACIÓN DE ADENOSIN DESAMINASA (ADA)
 CUANTIFICACIÓN DE ADENOSIN DESAMINASA (ADA) PROTOCOLO ADA FUNDAMENTO DEL METODO: La adenosindesaminasa (ADA) es una enzima del catabolismo de las purinas que cataliza la conversión de la adenosina en inosina
CUANTIFICACIÓN DE ADENOSIN DESAMINASA (ADA) PROTOCOLO ADA FUNDAMENTO DEL METODO: La adenosindesaminasa (ADA) es una enzima del catabolismo de las purinas que cataliza la conversión de la adenosina en inosina
Tecnología HaloPlex by Genycell Biotech España
 Paneles de genes custom-made Tecnología HaloPlex by Genycell Biotech España SERVICIO NGS CLÍNICA HALO: OVERVIEW 1. DISEÑO DEL PANEL DE GENES Y DEL KIT DE CAPTURA 2. PREPARACIÓN DE LA MUESTRA EN EL LABORATORIO
Paneles de genes custom-made Tecnología HaloPlex by Genycell Biotech España SERVICIO NGS CLÍNICA HALO: OVERVIEW 1. DISEÑO DEL PANEL DE GENES Y DEL KIT DE CAPTURA 2. PREPARACIÓN DE LA MUESTRA EN EL LABORATORIO
REACCIONES DE IONES METÁLICOS
 Actividad Experimental 4 REACCIONES DE IONES METÁLICOS Investigación previa -Investigar las medidas de seguridad para trabajar con amoniaco -Investigar las reglas de solubilidad de las sustancias químicas.
Actividad Experimental 4 REACCIONES DE IONES METÁLICOS Investigación previa -Investigar las medidas de seguridad para trabajar con amoniaco -Investigar las reglas de solubilidad de las sustancias químicas.
Programa donde se inscribe la beca y/o la tesis: Interacciones biológicas: de las
 Titulo: Potencial uso simultáneo de micopatógenos biocontroladores de hormigas cortadoras de hojas. Autores: Natalia G. Armando, Jorge A. Marfetán, Patricia J. Folgarait Correo: ng.armando14@gmail.com
Titulo: Potencial uso simultáneo de micopatógenos biocontroladores de hormigas cortadoras de hojas. Autores: Natalia G. Armando, Jorge A. Marfetán, Patricia J. Folgarait Correo: ng.armando14@gmail.com
Curso Posgrado 2014 Dra. María Gabriela Lacoste
 Curso Posgrado 2014 Dra. María Gabriela Lacoste EldiseñodelosprimersparaunaPCResFUNDAMENTAL. Longitud Especificidad Temperatura de Hibridación Complementariedad de secuencias Contendido GC Reconocer una
Curso Posgrado 2014 Dra. María Gabriela Lacoste EldiseñodelosprimersparaunaPCResFUNDAMENTAL. Longitud Especificidad Temperatura de Hibridación Complementariedad de secuencias Contendido GC Reconocer una
QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12. Lic. Ana María Martín
 QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12 Lic. Ana María Martín Lic. Ana María Martín Introducción SOLUCIONES REGULADORAS DE ph Muchas de las reacciones químicas que se producen en
QUIMICA ANALÍTICA (63.05) SOLUCIONES REGULADORAS DE ph 63.05.12 Lic. Ana María Martín Lic. Ana María Martín Introducción SOLUCIONES REGULADORAS DE ph Muchas de las reacciones químicas que se producen en
MANUAL DE PRÁCTICAS DE LABORATORIO
 MANUAL DE PRÁCTICAS DE LABORATORIO INGENIERIA ENBIOTECNOLOGÍA INGENIERÍA GENÉTICA FICHA TECNICA FICHA TÉCNICA SEMINARIO DE BIOTECNOLOGÍA MÉDICO-FARMACÉUTICA Fecha: Nombre del catedrático: 10-Julio-2012
MANUAL DE PRÁCTICAS DE LABORATORIO INGENIERIA ENBIOTECNOLOGÍA INGENIERÍA GENÉTICA FICHA TECNICA FICHA TÉCNICA SEMINARIO DE BIOTECNOLOGÍA MÉDICO-FARMACÉUTICA Fecha: Nombre del catedrático: 10-Julio-2012
DNA RECONBINANTE Depende de enzimas capaces de: Cortar Unir Replicar Transcribir inversamente el RNA Otra herramienta es el uso de Sondas específicas
 DNA RECONBINANTE Depende de enzimas capaces de: Cortar Unir Replicar Transcribir inversamente el RNA Otra herramienta es el uso de Sondas específicas ELEMENTOS BÁSICOS DE LA INVESTIGACIÓN EN GENES Análisis
DNA RECONBINANTE Depende de enzimas capaces de: Cortar Unir Replicar Transcribir inversamente el RNA Otra herramienta es el uso de Sondas específicas ELEMENTOS BÁSICOS DE LA INVESTIGACIÓN EN GENES Análisis
17.- Electroforesis de ácidos nucleicos en geles de agarosa. Aislamiento y caracterización electroforética de DNA plasmídico
 17.- Electroforesis de ácidos nucleicos en geles de agarosa. Aislamiento y caracterización electroforética de DNA plasmídico Carmen Alicia Padilla Peña, Jesús Diez Dapena, Emilia Martínez Galisteo, José
17.- Electroforesis de ácidos nucleicos en geles de agarosa. Aislamiento y caracterización electroforética de DNA plasmídico Carmen Alicia Padilla Peña, Jesús Diez Dapena, Emilia Martínez Galisteo, José
TaqMan GMO Maize Quantification Kit. Part No: 4481972
 TaqMan GMO Maize Quantification Kit Part No: 4481972 1. Introducción Los organismos modificados genéticamente (OMG) se encuentran ampliamente distribuidos, siendo la soja y el maíz los vegetales que ocupan
TaqMan GMO Maize Quantification Kit Part No: 4481972 1. Introducción Los organismos modificados genéticamente (OMG) se encuentran ampliamente distribuidos, siendo la soja y el maíz los vegetales que ocupan
Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz
 IDEXX VetLab Suite IDEXX SNAP Tests Laboratorio de Referencia IDEXX Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz Obtenga respuestas definitivas con la IDEXX RealPCR
IDEXX VetLab Suite IDEXX SNAP Tests Laboratorio de Referencia IDEXX Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz Obtenga respuestas definitivas con la IDEXX RealPCR
Detección de la secuencia Alu mediante la técnica Reacción en Cadena de la Polimerasa (PCR ) N. Rodríguez
 Detección de la secuencia Alu mediante la técnica Reacción en Cadena de la Polimerasa (PCR ) N. Rodríguez 1 Objetivos Entender la técnica: Reacción de Polimerasa en Cadena (PCR por sus siglas en inglés)
Detección de la secuencia Alu mediante la técnica Reacción en Cadena de la Polimerasa (PCR ) N. Rodríguez 1 Objetivos Entender la técnica: Reacción de Polimerasa en Cadena (PCR por sus siglas en inglés)
Protocolos de secuenciación de ADN
 1 Protocolos de secuenciación de ADN Introducción El método de secuenciación utilizado aquí es el desarrollado por Sanger en 1975. Este consiste en la incorporación de didesixinucleótidos marcados fluorescentemente
1 Protocolos de secuenciación de ADN Introducción El método de secuenciación utilizado aquí es el desarrollado por Sanger en 1975. Este consiste en la incorporación de didesixinucleótidos marcados fluorescentemente
Determinación del equivalente eléctrico del calor
 Determinación del equivalente eléctrico del calor Julieta Romani Paula Quiroga María G. Larreguy y María Paz Frigerio julietaromani@hotmail.com comquir@ciudad.com.ar merigl@yahoo.com.ar mapaz@vlb.com.ar
Determinación del equivalente eléctrico del calor Julieta Romani Paula Quiroga María G. Larreguy y María Paz Frigerio julietaromani@hotmail.com comquir@ciudad.com.ar merigl@yahoo.com.ar mapaz@vlb.com.ar
Clonación molecular. Clonar significa hacer copias idénticas
 INGENIERÍA GENÉTICA Clonación molecular Clonar significa hacer copias idénticas Este término originalmente fue aplicado al procedimiento de aislar una célula y permitirle reproducirse creando una población
INGENIERÍA GENÉTICA Clonación molecular Clonar significa hacer copias idénticas Este término originalmente fue aplicado al procedimiento de aislar una célula y permitirle reproducirse creando una población
V MATERIALES Y MÉTODOS
 V MATERIALES Y MÉTODOS 5.1 Aislamiento de bacterias e identificación 5.1.1 Cepas tomadas del cepario de la Universidad de las Américas-Puebla En el cepario del Departamento de Química y Biología hay algunas
V MATERIALES Y MÉTODOS 5.1 Aislamiento de bacterias e identificación 5.1.1 Cepas tomadas del cepario de la Universidad de las Américas-Puebla En el cepario del Departamento de Química y Biología hay algunas
EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE
 Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
I. 15microlitros de agua esteril, perforar el pozo y diluir. II. Se tomaron 2 microlitros para la primera transformación.
 23 de agosto 2007 Se comenzó la elaboración de la bitácora Medio LB Broth, Billar (Luria-Bertani) 25gr/litro Se preparó 500 mililitros agregando 12.5 gramos Se diluyó y esterilizó por autoclave Medio LB
23 de agosto 2007 Se comenzó la elaboración de la bitácora Medio LB Broth, Billar (Luria-Bertani) 25gr/litro Se preparó 500 mililitros agregando 12.5 gramos Se diluyó y esterilizó por autoclave Medio LB
TÉCNICAS GENÓMICAS. 2) Cuantificación del número de virus presentes en muestras de sangre o suero: carga vírica
 TÉCNICAS GENÓMICAS Utilidad/Objetivos: 1) Detección de microorganismos directamente en muestras clínicas identificando un fragmento específico del genoma del microorganismo concreto 2) Cuantificación del
TÉCNICAS GENÓMICAS Utilidad/Objetivos: 1) Detección de microorganismos directamente en muestras clínicas identificando un fragmento específico del genoma del microorganismo concreto 2) Cuantificación del
Bioquímica III- 2009
 Facultad de Ciencias Exactas, Universidad Nacional de La Plata Bioquímica III- 2009 Trabajo Práctico Nro 4 Extracción de RNA y DNA bacteriano INTRODUCCIÓN El RNA es el ácido nucleico más abundante en la
Facultad de Ciencias Exactas, Universidad Nacional de La Plata Bioquímica III- 2009 Trabajo Práctico Nro 4 Extracción de RNA y DNA bacteriano INTRODUCCIÓN El RNA es el ácido nucleico más abundante en la
Prácticas de Análisis Instrumental
 Prácticas de Análisis Instrumental Asignatura: Análisis Instrumental Alumno: Daniel González Mancebo Practica 1. DETERMINACIÓN DE CONSTANTES DE EQUILIBRIO MEDIANTE ESPECTROFOTOMETRÍA UV- VISIBLE. Lo primero
Prácticas de Análisis Instrumental Asignatura: Análisis Instrumental Alumno: Daniel González Mancebo Practica 1. DETERMINACIÓN DE CONSTANTES DE EQUILIBRIO MEDIANTE ESPECTROFOTOMETRÍA UV- VISIBLE. Lo primero
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I
 UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
Soluciones de la serie de ejercicios 4 (Curso 7.012)
 Pregunta 1 Soluciones de la serie de ejercicios 4 (Curso 7.012) Usted está estudiando la síntesis del aminoácido triptófano en las bacterias. Las enzimas TrpA, TrpB, TrpC, TrpD, TrpE and AroH son necesarias
Pregunta 1 Soluciones de la serie de ejercicios 4 (Curso 7.012) Usted está estudiando la síntesis del aminoácido triptófano en las bacterias. Las enzimas TrpA, TrpB, TrpC, TrpD, TrpE and AroH son necesarias
GUIA DE LABORATORIO PRACTICA 8 EXTRACCIÓN ADN PROGRAMA DE ENFERMERIA CURSO INTEGRADO DE PROCESOS BIOLOGICOS
 GUIA DE LABORATORIO PRACTICA 8 EXTRACCIÓN ADN PROGRAMA DE ENFERMERIA CURSO INTEGRADO DE PROCESOS BIOLOGICOS Leidy Diana Ardila Leal Docente. INTRODUCCIÓN En esta práctica se va a realizar la extracción
GUIA DE LABORATORIO PRACTICA 8 EXTRACCIÓN ADN PROGRAMA DE ENFERMERIA CURSO INTEGRADO DE PROCESOS BIOLOGICOS Leidy Diana Ardila Leal Docente. INTRODUCCIÓN En esta práctica se va a realizar la extracción
Revelado de películas blanco y negro con exposición a sensibilidad nominal.
 Revelado de películas blanco y negro con exposición a sensibilidad nominal. Equipo de revelado. El revelado de los negativos blanco y negro se realiza en un recipiente llamado tanque de revelado. Este
Revelado de películas blanco y negro con exposición a sensibilidad nominal. Equipo de revelado. El revelado de los negativos blanco y negro se realiza en un recipiente llamado tanque de revelado. Este
PROTOCOLOS DE OBTENCIÓN, CONSERVACIÓN Y ENVÍO DE MUESTRAS BIOLÓGICAS
 PROTOCOLOS DE OBTENCIÓN, CONSERVACIÓN Y ENVÍO DE MUESTRAS BIOLÓGICAS ESTUDIO TRASLACIONAL PROSPECTIVO DE DETERMINACIÓN DE FACTORES PREDICTIVOS DE EFICACIA Y TOXICIDAD EN PACIENTES CON CÁNCER ÍNDICE 1 INTRODUCCIÓN....
PROTOCOLOS DE OBTENCIÓN, CONSERVACIÓN Y ENVÍO DE MUESTRAS BIOLÓGICAS ESTUDIO TRASLACIONAL PROSPECTIVO DE DETERMINACIÓN DE FACTORES PREDICTIVOS DE EFICACIA Y TOXICIDAD EN PACIENTES CON CÁNCER ÍNDICE 1 INTRODUCCIÓN....
Caracterización morfo-agronómica y molecular de frijoles criollos de color rojo claro en Nicaragua y de frijoles negros en Ipala, Guatemala
 Caracterización morfo-agronómica y molecular de frijoles criollos de color rojo claro en Nicaragua y de frijoles negros en Ipala, Guatemala IICA/Red SICTA-CIAT INFORME DE AVANCE Gerardo Gallego - Harold
Caracterización morfo-agronómica y molecular de frijoles criollos de color rojo claro en Nicaragua y de frijoles negros en Ipala, Guatemala IICA/Red SICTA-CIAT INFORME DE AVANCE Gerardo Gallego - Harold
PRACTICA No. 9 PREPARACION DE DISOLUCIONES
 1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No. 9 PREPARACION DE DISOLUCIONES INTRODUCCION:
1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No. 9 PREPARACION DE DISOLUCIONES INTRODUCCION:
39. Aislamiento y purificación del DNA de un plásmido recombinante
 39. Aislamiento y purificación del DNA de un plásmido recombinante Aurora Galván Cejudo, Manuel Tejada, Antonio Camargo, José Javier Higuera, Vicente Mariscal, Emilio Fernández Reyes Departamento de Bioquímica
39. Aislamiento y purificación del DNA de un plásmido recombinante Aurora Galván Cejudo, Manuel Tejada, Antonio Camargo, José Javier Higuera, Vicente Mariscal, Emilio Fernández Reyes Departamento de Bioquímica
II. METODOLOGÍA. El proceso de elaboración del biodiesel se constituye de siete pasos fundamentales: 6.1. DETERMINACIÓN DE LOS GRAMOS DE CATALIZADOR
 II. METODOLOGÍA 6. PROCESO DE ELABORACIÓN El proceso de elaboración del biodiesel se constituye de siete pasos fundamentales: 1. Determinación de los gramos de catalizador 2. Preparación del Metóxido de
II. METODOLOGÍA 6. PROCESO DE ELABORACIÓN El proceso de elaboración del biodiesel se constituye de siete pasos fundamentales: 1. Determinación de los gramos de catalizador 2. Preparación del Metóxido de
RESULTADOS Y DISCUSIÓN. Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv
 RESULTADOS Y DISCUSIÓN Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv La curva estándar con la que se estimó la concentración proteica del filtrado
RESULTADOS Y DISCUSIÓN Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv La curva estándar con la que se estimó la concentración proteica del filtrado
PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN DE LAS COMPETENCIAS PROFESIONALES CUESTIONARIO DE AUTOEVALUACIÓN PARA LAS TRABAJADORAS Y TRABAJADORES
 MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
Recomendaciones para el envío de muestras para análisis de Anisoles
 Recomendaciones para el envío de muestras para análisis de Anisoles Se ha demostrado que todo el material plástico de los envases, (p/ej tapas de los envases, bolsas de polietileno, corchos sintéticos,
Recomendaciones para el envío de muestras para análisis de Anisoles Se ha demostrado que todo el material plástico de los envases, (p/ej tapas de los envases, bolsas de polietileno, corchos sintéticos,
ADN y RNA caracterización y métodos de estudio
 ADN y RNA caracterización y métodos de estudio Separación por centrifugación de equilibrio en gradiente de densidad de en CsCl Separación por centrifugación de equilibrio en gradiente de densidad de en
ADN y RNA caracterización y métodos de estudio Separación por centrifugación de equilibrio en gradiente de densidad de en CsCl Separación por centrifugación de equilibrio en gradiente de densidad de en
FACULTAD REGIONAL ROSARIO
 FACULTAD REGIONAL ROSARIO CATEDRA BIOTECNOLOGIA ROFESOR: Ing. Eduardo Santambrosio JTP: Ing. Marta Ortega AUX 1ª : Ing. Pablo Garibaldi PCR (Polymerase chain reaction) Reacción en cadena de la polimerasa
FACULTAD REGIONAL ROSARIO CATEDRA BIOTECNOLOGIA ROFESOR: Ing. Eduardo Santambrosio JTP: Ing. Marta Ortega AUX 1ª : Ing. Pablo Garibaldi PCR (Polymerase chain reaction) Reacción en cadena de la polimerasa
4. Materiales y Métodos. Los equipos que a continuación se mencionan se encuentran en el laboratorio de
 39 4. Materiales y Métodos 4.1 Equipos Los equipos que a continuación se mencionan se encuentran en el laboratorio de Ingeniería Ambiental de la Universidad de las Américas Puebla y en el Laboratorio de
39 4. Materiales y Métodos 4.1 Equipos Los equipos que a continuación se mencionan se encuentran en el laboratorio de Ingeniería Ambiental de la Universidad de las Américas Puebla y en el Laboratorio de
23. Hidrólisis ácida y enzimática del glucógeno
 23. Hidrólisis ácida y enzimática del glucógeno Emilia Martínez Galisteo, Carmen Alicia Padilla Peña, Concepción García Alfonso, José Antonio Bárcena Ruiz, Jesús Diez Dapena. Departamento de Bioquímica
23. Hidrólisis ácida y enzimática del glucógeno Emilia Martínez Galisteo, Carmen Alicia Padilla Peña, Concepción García Alfonso, José Antonio Bárcena Ruiz, Jesús Diez Dapena. Departamento de Bioquímica
BIOTECNOLOGÍA. 1.- Ingeniería Genética, ADN recombinante
 BIOTECNOLOGÍA 1.- Ingeniería Genética, ADN recombinante Técnica del ADN recombinante: es la más usada en ingeniería genética, esta basada en el uso de las enzimas de restricción o endonucleasas de restricción
BIOTECNOLOGÍA 1.- Ingeniería Genética, ADN recombinante Técnica del ADN recombinante: es la más usada en ingeniería genética, esta basada en el uso de las enzimas de restricción o endonucleasas de restricción
MEMORIA DE PRÁCTICAS SILVIA PÉREZ SOLANA
 MEMORIA DE PRÁCTICAS SILVIA PÉREZ SOLANA DATOS DE LA EMPRESA Instituto de Biotecnología y Biomedicina de Cantabria (CSIC-UC- SODERCAN), Avda. Herrera Oria s/n. Santander. El tutor CSIC fue Raúl Fernández
MEMORIA DE PRÁCTICAS SILVIA PÉREZ SOLANA DATOS DE LA EMPRESA Instituto de Biotecnología y Biomedicina de Cantabria (CSIC-UC- SODERCAN), Avda. Herrera Oria s/n. Santander. El tutor CSIC fue Raúl Fernández
ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDS-PAGE. Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE)
 ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDSPAGE Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE) Método rápido, reproducible y de bajo costo Utilizado para cuantificar, comparar
ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDSPAGE Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE) Método rápido, reproducible y de bajo costo Utilizado para cuantificar, comparar
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
BANCOS. Manejo de Bancos. Como crear una ficha de Banco? Como modificar los datos de una ficha de Banco? Como borrar una ficha de Banco?
 BANCOS El Sistema de Gestión Administrativa permite el manejo de los movimientos bancarios. Seleccionada la opción de Bancos, el sistema presentara las siguientes opciones. Manejo de Bancos Manejo de movimientos
BANCOS El Sistema de Gestión Administrativa permite el manejo de los movimientos bancarios. Seleccionada la opción de Bancos, el sistema presentara las siguientes opciones. Manejo de Bancos Manejo de movimientos
PRACTICA N 13 ANÁLISIS DE GRASAS Y ACEITES: INDICE DE REFRACCIÓN, YODO, SAPONIFICACIÓN Y PERÓXIDO.
 PRACTICA N 13 ANÁLISIS DE GRASAS Y ACEITES: INDICE DE REFRACCIÓN, YODO, SAPONIFICACIÓN Y PERÓXIDO. I. INTRODUCCIÓN: El análisis de algunas de las características físicas y químicas de las grasas y aceites
PRACTICA N 13 ANÁLISIS DE GRASAS Y ACEITES: INDICE DE REFRACCIÓN, YODO, SAPONIFICACIÓN Y PERÓXIDO. I. INTRODUCCIÓN: El análisis de algunas de las características físicas y químicas de las grasas y aceites
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 4ª RELACIÓN DE PROBLEMAS.
 FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 4ª RELACIÓN DE PROBLEMAS. 1.- Para determinar el contenido en plomo en una muestra de leche contaminada, se toma 1.0 ml de la leche y se diluye a un volumen final
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 4ª RELACIÓN DE PROBLEMAS. 1.- Para determinar el contenido en plomo en una muestra de leche contaminada, se toma 1.0 ml de la leche y se diluye a un volumen final
GUÍA PARA LA SECUENCIACIÓN AUTOMÁTICA DE DNA
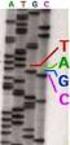 Página 1 de 16 GUÍA PARA LA SECUENCIACIÓN AUTOMÁTICA DE DNA SERVICIO DE SECUENCIACIÓN-S.C.S.I.E. UNIVERSITAT DE VALÈNCIA Página 2 de 16 CONTENIDOS: 1.- Secuenciación automática de DNA 2.- Tipos de molde
Página 1 de 16 GUÍA PARA LA SECUENCIACIÓN AUTOMÁTICA DE DNA SERVICIO DE SECUENCIACIÓN-S.C.S.I.E. UNIVERSITAT DE VALÈNCIA Página 2 de 16 CONTENIDOS: 1.- Secuenciación automática de DNA 2.- Tipos de molde
