11 Número de publicación: Int. Cl.: 74 Agente: Elzaburu Márquez, Alberto
|
|
|
- Veronica Espejo Martin
- hace 7 años
- Vistas:
Transcripción
1 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: Int. Cl.: C12N 9/64 (06.01) C07K 16/ (06.01) C12Q 1/37 (06.01) G01N 33/86 (06.01) C07K 14/74 (06.01) A61K 38/48 (06.01) A61K 38/49 (06.01) A61K 38/7 (06.01) A61L /38 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: Fecha de presentación : Número de publicación de la solicitud: Fecha de publicación de la solicitud: Título: Proteasa para activar el factor de coagulación VII. Prioridad: DE DE DE DE DE DE Fecha de publicación de la mención BOPI: Titular/es: ZLB Behring GmbH Emil-von-Behring-Strasse Marburg, DE 72 Inventor/es: Römisch, Jürgen; Stöhr, Hans-Arnold y Feussner, Annette 4 Fecha de la publicación del folleto de la patente: Agente: Elzaburu Márquez, Alberto ES T3 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. Pº de la Castellana, Madrid
2 Proteasa para activar el factor de coagulación VII. DESCRIPCIÓN La invención se refiere a una proteasa para activar el factor de la coagulación de la sangre VII, a un procedimiento para aislarla, detectarla y desactivarla, y a preparaciones medicinales que comprenden esta proteasa. El sistema de coagulación de la sangre comprende dos vías en cascada diferentes para activar los factores de la coagulación que están presentes en el plasma. La vía intrínseca o la extrínseca se usan preferentemente para iniciar la coagulación, dependiendo del mecanismo de desencadenamiento. Cuando un tejido es dañado, la tromboplastina (factor tisular, TF con fosfolípidos) es expuesto por las células afectadas como el iniciador de la vía de coagulación extrínseca. La tromboplastina situada en la membrana puede unirse tanto al factor de la coagulación VII (FVII) como al factor FVII activado circulante (FVIIa). En presencia de iones de calcio y lípidos, este complejo de TF-FVIIa conduce a la unión de FX, que se convierte en su forma activada (FXa) mediante proteinólisis limitada. FXa conduce posteriormente, mediante la activación de protrombina para formar trombina, a la formación de fibrina y de ese modo, por último, al cierre de la herida. Aunque la activación adicional del FVII unido a tromboplastina tiene lugar inicialmente de forma autocatalítica, en particular, es mantenida, después de que la cascada de coagulación se ha iniciado, por FXa y trombina, en particular, conduciendo a un refuerzo notable de la reacción en cascada. La administración de FVIIa o concentrados que contienen FVIIa está indicada en ciertas situaciones clínicas. La denominada actividad de bypass del inhibidor de FVIII (FEIBA) de FVIIa se usa en pacientes que están padeciendo, por ejemplo, hemofilia A y han desarrollado anticuerpos frente a FVIII como consecuencia de la administración de FVIII. Conforme a hallazgos disponibles actualmente, el FVIIa es bien tolerado en este contexto y, mientras que no conduce a ninguna tendencia a la trombosis, es adecuado para asegurar que la coagulación tenga lugar hasta un grado limitado pero adecuado. Ya se está usando FVIIa recombinante terapéutica y profilácticamente. El FVII que se ha aislado del plasma sanguíneo puede activarse también y luego usarse. Las proteasas tales como la trombina pueden usarse para esta activación; sin embargo, estas proteasas, como tales, pueden activar fuertemente la coagulación y conducir al riesgo de una trombosis. Por esta razón, es necesaria la retirada o desactivación posterior de la trombina, y conduce a pérdidas de rendimiento. Como resultado del riesgo de trombosis que está asociado con ello, el uso de FXa o FIIa (trombina) está contraindicado frecuentemente, y solamente está indicado para emergencias, por ejemplo, en relación con una extremada pérdida de sangre y hemorragias no restañables. El FVIIa se encuentra en concentraciones muy bajas en el plasma de sujetos sanos. Hasta ahora se conoce sólo muy poco sobre la formación y el origen de FVIIa que está circulando en la sangre. Pequeñas cantidades de tromboplastina que se ha expresado o liberado en relación con la destrucción celular pueden jugar un papel en este contexto. Aunque se conoce que el factor XIIa, por ejemplo, puede conducir a la activación de FVII bajo ciertas condiciones, todavía no se ha aclarado la relevancia fisiológica de esta reacción. Sorprendentemente, se ha encontrado actualmente, en relación con el fraccionamiento de plasma humano y ciertos concentrados de complejos de protrombina, una proteasa activadora de FVII que se diferencia de todas las proteasas conocidas previamente. Investigaciones acerca de esta proteasa han mostrado que manifiesta una actividad amidolítica particularmente alta frente al sustrato peptídico S-2288 (H-D-isoleucil-L-prolil-L-arginina-p-nitroanilina (pna)) de Chromogenix AB, Suecia. Una característica particular de esta proteasa es que la actividad amidolítica es inhibida eficazmente por la aprotinina. También son adecuados para la inhibición otros inhibidores, tales como el complejo heparina/antitrombina III. Por otra parte, su actividad aumenta mediante la heparina y sustancias relacionadas con la heparina tales como sulfato de heparano o sulfato de dextrano e iones de calcio. Finalmente, se ha encontrado que esta proteasa es capaz, de una manera que depende del tiempo y su concentración, de convertir FVII en FVIIa. Esta reacción, también, es inhibida por la aprotinina. Parte de la materia objeto de la invención es, por lo tanto, una proteasa para activar el factor de la coagulación de la sangre VII, que: a) es inhibida por la presencia de aprotinina, b) aumenta su actividad mediante iones de calcio y/o heparina o sustancias relacionadas con la heparina, y 6 c) en electroforesis en geles de poliacrilamida con dodecilsulfato sódico (SDS-PAGE), tras la tinción posterior en el estado no reducido, tiene una o más bandas en el intervalo de pesos moleculares desde 0 hasta 7 kda y en el estado reducido tiene una banda de a kda y una o más bandas en el intervalo de pesos moleculares desde hasta 3 kda. En el texto siguiente, la forma activada de la proteasa se denomina proteasa, mientras que la forma no activada se denomina proenzima. 2
3 Investigaciones adicionales con esta proteasa han mostrado que, después de enriquecimiento o aislamiento, experimenta una rápida pérdida de actividad, que se observó en una disolución que contenía trometamol mm, NaCl 0, M a un ph de 7,. La adición de albúmina a una concentración de 0,1% no fue capaz de impedir que la actividad de la proteasa disminuyera en 0% después de una hora a temperatura ambiente. Por otra parte, se observó una muy buena estabilización de la proteasa en una disolución tamponada a un ph de 6, con citrato de Na 0 mm. Si no se añaden estabilizantes particulares a la disolución de proteasa, no se observan, o sólo se observan ligeras, pérdidas de actividad si la disolución se ajusta a un ph de entre 4 y 7,2, preferiblemente a un ph de entre,0 y 7,0. Sin embargo, es conveniente añadir estabilizantes a la disolución, siendo estabilizantes adecuados en particular, aparte de citrato, glutamato, aminoácidos, tales como arginina, glicina o lisina, iones de calcio y azúcares tales como glucosa, arabinosa o manosa, en cantidades de 1-0 mmoles/l, preferiblemente en cantidades de -0 mmoles/l. También se logró una estabilización eficaz añadiendo glicoles tales como etilenglicol o glicerol, usándose cantidades de -80% en peso, preferiblemente de -% en peso. El ph de la disolución estabilizada debe estar entonces entre los valores de ph de 4-9. La nueva proteasa, y también la proenzima, pueden obtenerse mediante fraccionamiento de plasma sanguíneo o de concentrados de complejos de protrombina (PPSB). El material de partida es luego, en primer lugar, sometido a cromatografía de intercambio aniónico, seguido por cromatografía de afinidad del producto eluido. Es particularmente adecuada para la cromatografía de afinidad una heparina que esté inmovilizada en una matriz, o una sustancia relacionada con heparina, tal como sulfato de heparano o sulfato de dextrano. Cuando se usa tal método cromatográfico, la nueva proteasa y/o la proenzima puede unirse selectivamente y luego ser eluida una vez más usando métodos conocidos. El uso de un espaciador es aconsejable para acoplar el ligando a la matriz. Se ha encontrado que una matriz de heparina-lisina es particularmente adecuada para aislar la nueva proteasa. En SDS-PAGE con tinción posterior, la proteasa que se ha aislado mediante este método manifiesta, en el estado no reducido, de una a varias bandas que se encuentran próximas unas a otras en el intervalo de pesos moleculares de -7 kda. Después de la reducción, se observaron de una a varias bandas en el intervalo de pesos moleculares de - 3 kda y se observó una banda a - kda. Una banda más, entre y 6 kda, que, después de una exploración y determinación cuantitativa, constituyó -% de la proteína total, mostró que una proenzima no activada estaba también presente. Este resultado fue apoyado por investigaciones apropiadas usando anticuerpos monoclonales frente a esta proteasa. Se concluyó por lo tanto que la proenzima de esta proteasa puede también prepararse, pasteurizarse y usarse mediante el método conforme a la invención. Parte de la materia objeto de la invención es, por lo tanto, la proenzima de la proteasa para activar el factor de la coagulación de la sangre VII. La proporción de la proenzima está indicada por la banda entre y 6 kda. Correspondientes a la secuencia de aminoácidos que constituye la región de activación de la proenzima, la trombina, calicreína, o FXIIa son, de acuerdo con sus especificidades de sustrato, ejemplos de activadores fisiológicos adecuados de la proenzima. Algunas de las propiedades de la nueva proteasa que se han descrito, es decir, el hecho de que puede aislarse a partir de plasma o a partir de concentrados de complejos de protrombina (PPSB) que son derivados de plasma, la inhibición de su actividad amidolítica mediante aprotinina, y el comportamiento de migración descrito en SDS-PAGE, tanto en el estado reducido como en el no reducido, recuerdan una proteasa que fue aislada por Hunfeld et al. (Ann. Hematol. 1997; 74; A87, 113; Ann. Hematol. 1998; 76; A1, P294, y Etscheid et al. Ann. Hematol. 1999, 78: A42) a partir de un concentrado de PPSB que no se definió con ningún detalle más. En ese caso, la preparación se logró esencialmente usando una matriz de aprotinina. Como resultado de la escisión amidolítica de ciertos sustratos peptídicos, se describió la actividad como una actividad semejante a la de trombina. Hunfeld et al. no encontraron ninguna influencia sobre los parámetros globales de coagulación tales como tiempo de protrombina, Quick or agregación plaquetaria. La secuenciación aminoterminal de la proteasa descrita por Hunfeld et al. muestra concordancias con una proteína cuyo ADN complementario fue descrito por Choi-Miura et al. (J. Biochem. 119: (1996)). En su estructura primaria, la proteína correspondiente manifiesta homología con una enzima denominada enzima activadora del factor de crecimiento de hepatocitos (HGFA). Cuando dos bandas que se aislaron a partir de SDS-PAGE bajo condiciones reductoras se sometieron a secuenciación aminoterminal, se establecieron las siguientes concordancias: Intervalo de pesos moleculares Secuencia de aminoácidos Autor de la banda -3 kda YGGFKSTAGK Presente invención kda IYGGFKSTAG Hunfeld et al. 17 kda IYGGFKSTAGKH Choi-Miura et al. - kda LLESLDP Presente invención 6 0 kda SLDP Hunfeld et al. 0 kda SLLESLDPWTPD Choi-Miura et al. 3
4 También se han encontrado concordancias en otros resultados de ensayos tales como especificidad de sustrato y la capacidad de que la actividad sea inhibida. A pesar de esto, todavía no es posible actualmente asumir con confianza que estas proteínas sean idénticas. De todos modos, no se ha informado que las proteínas investigadas previamente, mencionadas anteriormente, posean la propiedad de activar FVII o activar otros factores (véase más adelante). Sobre la base de sus propiedades descritas, la nueva proteasa puede usarse diagnóstica y terapéuticamente. 1. Sistemas de ensayo que usan la nueva proteasa La nueva proteasa puede usarse como medio diagnóstico en reactivos de ensayo. De este modo, la presencia de factor VII puede determinarse cualitativa y cuantitativamente en un ensayo de coagulación añadiendo la nueva proteasa. A la inversa, el sistema de ensayo desarrollado para medir la activación de FVII puede usarse también para detectar y cuantificar la proteasa. Para esto, se mezcla una disolución que contiene la proteasa con una disolución que contiene FVII y, después de un tiempo de incubación apropiado, se determina la cantidad resultante de FVIIa. Esto puede llevarse a cabo, por ejemplo, usando el ensayo Staclot FVIIa-rTF (Stago/Boehringer Mannheim). Cuando se usa un procedimiento preferido, este ensayo no está limitado por la concentración de FVII suministrada. Si se conoce la cantidad de proteasa en forma de la proporción de proteína total, proporción que puede determinarse - en una preparación de proteasa pura, por medio del método Kjeldahl o por medio de otro análisis de proteínas con el que la persona experta está familiarizada, o - usando un ensayo de antígenos, por ejemplo basado en anticuerpos específicos y un método de determinación inmunoquímica apropiado, tal como ELISA, la actividad especifica de la preparación de proteasa puede medirse lego de una manera correspondiente. Sorprendentemente, se ha encontrado actualmente una propiedad, en relación con una caracterización más a fondo de la proteasa, que hace posible llevar a cabo un método de determinación adicional. En relación con la incubación de los factores de la coagulación de la sangre VIII/VIIIa y V/Va con dicha proteasa, y la subsiguiente cuantificación, se hizo claro que dichos factores de coagulación se desactivan de una manera que depende de la concentración de proteasa y de la duración de la incubación. Otra parte de la materia objeto de la invención es por lo tanto un nuevo sistema de ensayo para detectar cualitativa y cuantitativamente la proteasa que activa el factor de la coagulación de la sangre VII, sistema en el que la proteasa puede determinarse mediante su acción desactivadora de los factores de la coagulación de la sangre VIII/VIIIa o V/Va. Este sistema de ensayo está basado en una disolución que contiene la proteasa incubándose con factor VIII/VIIIa o factor V/Va, y la cantidad restante de factor VIII/VIIIa o la cantidad restante de factor V/Va midiéndose por medio de un ensayo de actividad convencional, y la cantidad de proteasa determinándose luego cuantitativamente a partir de éste por comparación con una curva patrón. Al llevar a cabo este ensayo, se inhibe la incubación de la actividad de la proteasa, después de periodos predeterminados de tiempo, mediante la adición limitada de aprotinina, que tiene la ventaja de que no tiene efecto, a estas concentraciones, sobre las mediciones posteriores del sistema de ensayo. Después de eso, las actividades restantes de los factores de coagulación se miden por medio de un ensayo que es conocido por la persona experta. Para esto, un sistema de ensayo ha demostrado, en particular, su valía, en el que se hace uso del denominado ensayo de factor VIII Coamatic (Chromogenix AB), que contiene esencialmente factores IXa y X, cuantificándose la cantidad restante de FXa, en presencia de un inhibidor de trombina, por medio de la conversión de un sustrato cromógeno (véase último tercio de la página 2). Esta cantidad es proporcional a la cantidad de FVIII o FVIIIa. La determinación de la actividad residual de FVIII hace entonces posible deducir la concentración de proteasa que está presente. La degradación de FVIII/FVIIIa o FV/FVa debido al efecto proteinolítico puede demostrarse claramente mediante SDS-PAGE. Dependiendo del tiempo durante el que la proteasa es incubada, por ejemplo, con un concentrado de FVIII, las bandas que son típicas para FVIII desaparecen mientras que surgen otras nuevas bandas, o aumenta la intensidad de bandas débiles. Por consiguiente, la actividad de la proteasa puede correlacionarse también cuantificando las bandas decrecientes o crecientes, y por lo tanto, medirse cuantitativamente, por ejemplo, usando un patrón de proteasa. Los cambios de las intensidades de las bandas en el electroforetograma de la SDS-PAGE o siguiendo otros métodos electroforéticos pueden cuantificarse, por ejemplo, usando un dispositivo explorador, con el que una persona experta está familiarizado, y el programa apropiado. Además de esto, pueden usarse anticuerpos frente a dichos factores de coagulación para inmunotransferencia (Western blotting), y emplearse para la determinación de la manera descrita. Los anticuerpos que detectan específicamente las bandas decrecientes o, en particular, las bandas que surgen, son particularmente adecuados. En este contexto, estos anticuerpos pueden usarse también para crear otros ensayos inmunoquímicos tales como un ELISA. La desactivación proteinolítica que se ha descrito en el caso de FVIII/FVIIIa se observa también cuando la proteasa es incubada con factor V/Va, que manifiesta un cierto grado de homología estructural con FVIII. La degradación puede seguirse en sistemas de ensayo de actividad adecuados, y en SDS-PAGE/inmunotransferencia (Western blotting). 4
5 A pesar de las desactivaciones de FV y FVIII, se ha encontrado actualmente que añadiendo la proteasa a la sangre, a plasma rico en trombocitos, o a plasma, se acortan los tiempos de coagulación, que es el efecto procoagulante que predomina en diversos denominados ensayos globales de coagulación. Se entiende que estos sistemas de ensayo son, por ejemplo, el tiempo de tromboplastina parcial no activada (NAPTT), el tiempo de protrombina (PT), y el tiempo de recalcificación. Ya que el acortamiento de estos tiempos, como se mide, por ejemplo, en los denominados coagulómetros, por medio de tromboelastografía o además en ensayos cromogénicos, correlaciona con la concentración de una sustancia que favorece la coagulación, la concentración de la sustancia en una muestra puede deducirse a la inversa usando una curva de calibración del tiempo de coagulación. La concentración del activador de FVII puede determinarse igualmente usando ensayos globales de coagulación seleccionados. También fue sorprendente encontrar que el activador de FVII es también capaz de producir una activación eficaz de urocinasa monocatenaria (scupa, activador del plasminógeno de urocinasa monocatenario) y tpa monocatenario (sctpa, activador del plasminógeno tisular monocatenario), esto es, puede actuar como activador del activador del plasminógeno (PAA). La actividad de los PA activados puede medirse, por ejemplo, usando sustratos cromógenos. Por consiguiente, esta propiedad puede por lo tanto usarse también para detectar y cuantificar el activador de FVII. La activación de los activadores del plasminógeno puede determinarse también en una reacción acoplada en presencia de plasminógeno, o por formación de la propia plasmina o por la disolución de un coágulo de fibrina que es producido por plasmina. En resumen, por lo tanto, puede afirmarse que la proteasa puede tanto detectarse como cuantificarse incubándola con una disolución que contenga FVIII o FVIIIa, y determinando luego la cantidad restante de FVIII/VIIIa por medio de un ensayo de actividad adecuado. De la misma manera, FV o FVa pueden incubarse con la proteasa y puede cuantificarse posteriormente la cantidad restante de FV/FVa. La concentración de proteasa desconocida puede determinarse cuantitativamente por comparación con una curva patrón de cantidades crecientes de proteasa que es incluida en el ensayo. Diversos ensayos globales de coagulación son asimismo adecuados para la cuantificación, leyéndose la concentración de proteasa en una curva de calibración sobre la base del acortamiento del tiempo de coagulación. La actividad de PAA de la proteasa puede usarse también con fines de determinación. Otra característica de estos ensayos es que la desactivación de FV y FVIII y la actividad de PAA se manifiestan particularmente bien en presencia de concentraciones adecuadamente altas de calcio, preferiblemente >0,001 mm, preferiblemente de manera particular >0,00 mm, por ejemplo, en forma de CaCl 2. Por contraste con el análisis cromogénico directo, en el que, como se ha descrito anteriormente, tanto la heparina como las sustancias semejantes a la heparina y también el calcio aumentan la actividad de la proteasa, la desactivación de FV/FVIII no es favorecida, o sólo favorecida de manera insignificante, por la heparina. Por contraste, la actividad de PAA es estimulada en presencia de ambos agentes, esto es, por calcio y/o heparina o sustancias semejantes a la heparina. Las reacciones en las que la proteasa actúa como mediador pueden reducirse muy eficazmente o impedirse incubando la proteasa con inhibidores, particularmente antitrombina III en presencia de heparina o sustancias semejantes a la heparina (preferiblemente en presencia de heparina), inhibidor de C1-esterasa, α2-antiplasmina, inhibidor de inter-α-tripsina, o inhibidores de proteasa de bajo peso molecular sintéticos conocidos tales como el éster para-etoxicarbonilfenílico del ácido guanidinocaproico, que está disponible con la marca registrada FOY. Estas sustancias pueden usarse por lo tanto para detener la reacción, para, por ejemplo, definir tiempos de incubación con precisión, o para aumentar todavía más la especificidad del ensayo. Reducir los iones de calcio libres en la mezcla con un agente quelante, por ejemplo, puede usarse también con este fin. 2. Preparaciones estabilizadas de factor V y factor VIII Una tarea adicional resulta ahora, a partir de las observaciones descritas anteriormente relacionadas con las acciones proteinolíticas de la nueva proteasa sobre los factores de la coagulación V y VIII, de inhibir la proteasa o reducir su actividad para evitar pérdidas de rendimiento y la formación de lo que pueda ser posiblemente fragmentos proteínicos que interfieren. Esto es lo más relevante, ya que FV y FVIII se preparan usualmente a partir de crioprecipitados que se han obtenido a partir de plasma y en presencia de iones de calcio porque los últimos son necesarios para mantener las conformaciones proteínicas. Otra parte de la materia objeto de la invención es por lo tanto una preparación estabilizada de FV o FVIII que no tenga fragmentos de factor V o factor VIII formados debido a la degradación proteinolítica, como resultado del hecho de que es inhibida la proteasa activadora del factor de la coagulación de la sangre VII. Ya que investigaciones más detalladas han mostrado que la desactivación del factor V y del factor VIII por dicha proteasa tiene lugar eficazmente de manera particular en presencia de concentraciones de iones de calcio superiores a 0, mm, la preparación del factor V o VIII puede estabilizarse eficazmente si, para la inhibición de la proteasa activadora del factor de la coagulación de la sangre VII, las concentraciones de iones de calcio en la preparación del factor V o del factor VIII se ajustan a un valor inferior a 1,0 mm, preferiblemente inferior a 0, mm. Mientras que las propiedades de desactivación del factor V y factor VIII de la proteasa se reducen notablemente a estas concentraciones, la cantidad de iones de calcio es todavía suficiente para estabilizar las conformaciones de las moléculas de FV y FVIII. Las cantidades mencionadas anteriormente de iones de calcio no deben sobrepasarse, no sólo en el producto final, sino también en el propio crioprecipitado y en las siguientes etapas de purificación.
6 De acuerdo con la afinidad descrita anteriormente de la proteasa o la proenzima con la heparina y sustancias semejantes a la heparina, la proteasa/la proenzima puede retirarse de la disolución que contiene FVIII o FV por incubación con heparina inmovilizada u otros inmunoadsorbentes o adsorbentes de afinidad adecuados. Los anticuerpos policlonales o monoclonales, los respectivos fragmentos de anticuerpos que son útiles en la preparación de los inmunoadsorbentes son fácilmente disponibles mediante técnicas conocidas en la técnica para usar toda o parte de la proteasa o proenzima como antígeno. Sin embargo, también pueden emplearse inhibidores de proteasa naturales o sintéticos, cuando sea apropiado, además de reducir la cantidad de iones de calcio, para impedir la degradación proteinolítica del FV o el FVIII. Pueden emplearse como inhibidores proteínas tales como aprotinina, α2-antiplasmina, inhibidor de C1-esterasa o inhibidor de inter-α-tripsina. También pueden usarse en este contexto sustancias de bajo peso molecular conocidas por la persona experta como inhibidores de serina-proteasa sintéticos. Pueden añadirse asimismo inhibidores, tales como antitrombina III, cuyo potencial inhibidor aumenta con heparina o heparinoides. De este modo, se ha encontrado sorprendentemente, que mientras la heparina es por sí misma capaz de aumentar la actividad amidolítica de la proteasa frente a sustancias cromógenas pequeñas, no apoya la desactivación de FV/FVIII. 3. Productos farmacéuticos que comprenden la nueva proteasa La nueva proteasa y/o su proenzima pueden usarse también terapéuticamente. Pueden emplearse como agentes coagulantes de la sangre, o por sí mismos o junto con sustancias que aumentan la actividad de la proteasa, tales como heparina, o sustancias relacionadas con la heparina, tal como sulfato de heparano, y/o iones de calcio, siendo posible también añadir adicionalmente factor VII, en su forma inactiva, a este agente. El uso de tal agente, en el que se explota su actividad de bypass del inhibidor de FVIII (FEIBA), por ejemplo, puede estar indicado cuando existan intolerancias frente a FVIII y/o FIX y/o FXI y/o las proteínas de la fase de contacto, tales como FXII, por ejemplo por causa de la presencia de anticuerpos, o cuando existan otros tipos de situaciones de carencia. En relación con esto, el FVII puede activarse o in vitro, en el plasma, en fracciones enriquecidas o actuando sobre FVII purificado. También es posible usar el nuevo agente de coagulación de la sangre ex vivo, para profilaxis general de hemorragias o para hemorragias no restañables. Por otra parte, la inhibición observada de la nueva proteasa mediante aprotinina o los inhibidores mencionados anteriormente, puede usarse para desarrollar un agente que comprende un inhibidor de proteasa y que reduce la capacidad de la sangre para coagular. Además de esto, la nueva proteasa puede usarse también para identificar factores fisiológicos o no fisiológicos, tales como péptidos sintéticos, que perjudican la coagulación de la sangre debido a su efecto inhibidor de proteasa. Las secuencias peptídicas de los sustratos cromógenos que se transforman eficazmente de manera particular, tales como los de S-2288 (véase anteriormente para detalles), pueden usarse como base estructural para esto. La adición de inhibidores adecuados a preparaciones coagulantes, o durante su preparación, puede ser necesaria si estas preparaciones no han de tener actividades proteinolíticas. Sorprendentemente, se ha encontrado actualmente una propiedad, en relación con la caracterización más a fondo de la proteasa, que abre la posibilidad de un uso adicional para la denominada proteasa activadora del factor VII. Cuando se incuban activadores del plasminógeno monocatenarios tales como prourocinasa (urocinasa monocatenaria, scupa, activador del plasminógeno de urocinasa monocatenario) o sctpa (activador del plasminógeno tisular monocatenario), el activador del factor VII produce la activación de estos activadores del plasminógeno (PA). Con respecto a esto, hay una proteinólisis limitada de los PA monocatenarios, que da como resultado la formación de proteasas bicatenarias, que son particularmente adecuadas para activar el plasminógeno. La plasmina resultante es la efectora de la fibrinólisis, que es el sistema fisiológico que es responsable de disolver los trombos. Los PA, tales como prourocinasa o tpa, son proteínas endógenas que se liberan cuando se necesita y que, como es conocido, se activan mediante plasmina o mediante calicreína (scupa). El mecanismo mediante el cual se activa scupa en el estado sano no se ha aclarado todavía completamente. Los activadores del plasminógeno se emplean terapéuticamente, como proteínas aisladas o preparadas mediante ingeniería genética, en preparaciones farmacéuticas en relación con enfermedades o complicaciones tromboembólicas, tales como en flebotrombosis, infarto de miocardio o ictus. De acuerdo con las propiedades del activador del factor VII que se han encontrado actualmente, el último puede usarse para la activación in vivo o ex vivo de los activadores del plasminógeno tales como prourocinasa o sctpa. Esta actividad puede aplicarse también usando dicha proteasa para la profilaxis o tratamiento de enfermedades tromboembólicas, específicamente en combinación con activadores del plasminógeno monocatenarios o bicatenarios, o también anticoagulantes. Este posible uso no es contradictorio con el hecho de que la proteasa es también capaz de actuar de un modo procoagulante. La cuestión de cual de las dos reacciones predomina se resuelve probablemente por la disponibilidad de los sustratos fisiológicos. Conforme al estado actual de conocimiento, el factor VII es activado moderadamente en el plasma y mantiene continuamente una cierta concentración de FVIIa para ser capaz de contrarrestar inmediatamente cualquier daño vascular súbito. Por otra parte, en un mililitro de plasma sanguíneo sólo están presentes nanogramos de activador del plasminógeno tisular y activador del plasminógeno de urocinasa. Solamente cuando se produce la precipitación de fibrina o trombos hay un aumento de la concentración, por secreción o síntesis, de activadores del plasminógeno, que muestran luego su actividad trombolítica activando el plasminógeno después de haber sido activados localmente, en particular, cuando se unen al trombo. Cuando están presentes PA monocatenarios, 6
7 particularmente de una manera restringida localmente, su activación puede tener más peso que la activación de FVII, haciendo posible de ese modo ajustarse a la situación fisiológica. Por consiguiente, esta proteasa puede regular también la hemostasia, indicándose de ese modo una reposición con la proteasa en caso de carencias congénitas y adquiridas Otra parte de la materia objeto de la invención es, por lo tanto, una preparación farmacéutica que comprende una cantidad de proteasa activadora del factor de la coagulación de la sangre VII y/o su forma de proenzima, que es suficiente para disolver trombos que contienen fibrina. Esta preparación puede comprender adicionalmente activadores del plasminógeno monocatenarios (PA) y/o anticoagulantes. Cuando la proenzima está presente, es ventajoso que comprenda un agente activador adecuado dentro o junto con la preparación farmacéutica anterior. Ya que se ha encontrado que el efecto de refuerzo de activadores del plasminógeno del activador de FVII está favorecido particularmente por calcio y/o heparina y sustancias semejantes a la heparina, tales como sulfato de dextrano, pueden emplearse ventajosamente de manera particular preparaciones farmacéuticas que comprendan adicionalmente sales solubles de calcio y/o heparina o sustancias semejantes a la heparina para disolver, de acuerdo con la invención, trombos que contengan fibrina. En este contexto, la proteasa/proenzima puede emplearse por sí misma o en combinación con activadores del plasminógenos monocatenarios o bicatenarios, con o sin sustancias que manifiesten afinidades particulares por la proteasa, y aumentando de ese modo su actividad como sustancias que actúan como vehículos para prolongar la semivida en el plasma o como mediadores para superficies. Las preparaciones farmacéuticas que comprenden la proteasa activadora del factor de la coagulación de la sangre VII pueden, debido a su efecto fibrinolítico especial, emplearse para tratar enfermedades que están provocadas por trombos que contienen fibrina. Los procesos fibrinolíticos están implicados también en procesos de cicatrización de heridas. En relación con esto, dichas proteasa y/o proenzima pueden administrarse por vía intravenosa o local, subcutánea, intradérmica o intramuscular, o además tópica en caso de lesiones y heridas, o unidas a un matriz que actúa como vehículo adecuada. Tanto la proteasa como la proenzima que se han aislado a partir de fluidos corporales tales como sangre o plasma, y la proteasa/proenzima que se han preparado mediante ingeniería genética o de modo transgénico, pueden emplearse en este contexto. La proteasa/proenzima es también adecuada para usar como componente de un denominado adhesivo de fibrina, que no debe contener ninguna sustancia, tal como aprotinina, que inhiba la proteasa/proenzima. En este caso, pueden usarse las propiedades de acortamiento de la coagulación de la proteasa. La proteasa/proenzima anterior puede usarse para carencias hemostáticas hereditarias o adquiridas, en sucesos hemorrágicos (difusos) en las respectivas complicaciones asociadas con la trombosis. Si se usa para tratar hemorragias, la combinación de proteasa/proenzima junto con F VIII, opcionalmente con adición de más factores de coagulación, es ventajosa. 4. Procedimiento para pasteurizar la proteasa activadora del FVII Como proteína que se ha aislado a partir de plasma humano, la nueva proteasa y/o su proenzima puede emplearse solamente como una preparación farmacéutica si se ha sometido previamente a un procedimiento para desactivar virus. El procedimiento de pasteurización es reconocido en particular como el procedimiento más importante para desactivar virus. Sin embargo, el calentamiento a aproximadamente ºC durante hasta horas requiere que la proteína que ha de tratarse sea de una estabilidad adecuada. Los estabilizantes óptimos han de determinarse por separado para cada proteína, y sus concentraciones han de optimizarse. En el caso de la nueva proteasa y/o su proenzima, las condiciones que estabilizan la proteína en disolución, sin llevarse a cabo ninguna pasteurización, ya se han mencionado anteriormente. Con respecto a esto, se ha demostrado que un intervalo de ph ligeramente ácido es ventajoso. Sin embargo, cuando se lleva a cabo una pasteurización en estas condiciones, como regla, la nueva proteasa y/o su proenzima pierden más de 0% de su actividad original. Se ha encontrado actualmente que una pasteurización de una preparación farmacéutica que comprende la nueva proteasa y/o su proenzima, asegura unos resultados óptimos de estabilización si la preparación se prepara: a) en un intervalo de ph desde 3, hasta 8,0, preferiblemente en un intervalo de ph desde 4,0 hasta 6,8; 6 b) en presencia de uno o más aminoácidos añadidos en una cantidad de más de 0,01 moles/l, preferiblemente más de 0,0 moles/l; y/o c) en presencia de un azúcar o de una combinación de diferentes azúcares añadidos que tienen una concentración total de más de 0,0 g/ml, preferiblemente más de 0,2 g/ml; y/o d) en presencia de una o más sustancias añadidas que son capaces de formar complejos con iones de calcio, tales como citrato, oxalato, ácido etilendiaminotetraacético, etc. También pueden usarse aditivos tales como albúmina, Haemaccel, heparina y heparinoides, glicerol, glicol y polietilenglicol, por separado o mezclados unos con otros. Después de haberse completado la pasteurización, los azúcares, aminoácidos y otros aditivos que se hayan añadido como estabilizantes pueden reducirse, o retirarse completamente de la preparación, usando métodos que son familiares para la persona experta. Los resultados de los procedimientos de pasteurización se presentan en los ejemplos 12 y 13. 7
8 Ejemplo 1 El sistema de ensayo Staclot FVIIa-rTF (Stago/Boehringer Mannheim) se usó para demostrar la activación de FVII mediante la proteasa preparada. Este sistema de detección se basa en la propiedad particular del factor tisular soluble (rtf) (recombinante), que es solamente capaz de usar el FVII activado preformado (FVIIa) para iniciar la vía de coagulación extrínseca. Por contraste con la situación cuando se usa el factor tisular completo, esto hace posible determinar el contenido real de FVIIa con precisión. Se usó FVII aislado (Enzyme Research Labs) para los experimentos de activación. Este mismo FVII contiene pequeñas cantidades de FVIIa, ya que es aislado de plasma humano. La concentración se ajustó a 0,0 UI de FVII/ml diluyendo con tampón. El FVII se incubó a temperatura ambiente durante min con las sustancias de ensayo, y luego se ensayó para determinar el contenido verdadero de FVIIa. Los contenidos de FVIIa se cuantificaron usando una curva de referencia que se construyó en paralelo. Se descubrió en experimentos preliminares, que no se describen en la presente invención, que mientras, en la concentración empleada, la aprotinina inhibió completamente la actividad de la proteasa preparada, no tuvo efecto directo en el FVIIa ni ningún efecto significativo en el sistema de ensayo FVIIa-rTF. Los resultados que se presentan a continuación se refieren en cada caso a determinaciones por triplicado. Se establecieron por lo tanto los siguientes análisis experimentales: 1. FVII 2 Resultado: mui de FVIIa/ml Se usó FVII no activado como el análisis testigo. Este ya contenía pequeñas cantidades de FVIIa (véase anteriormente) en el orden de magnitud de mui de FVIIa/ml FVII + aprotinina En este análisis, se incubó FVII en presencia de aprotinina, y se usó en el análisis de FVIIa-rTF para demostrar que el propio FVIIa no fue inhibido, y el ensayo tampoco fue afectado por la aprotinina empleada. Esto fue confirmado (en comparación con el análisis 1). 3. Proteasa + FVII (incubación), seguido por la adición de aprotinina Resultado: 18 mui de FVIIa/ml 4 En este caso, se dio tiempo a la proteasa para activar el FVIIa. Se añadió solamente aprotinina, para inhibir la proteasa, después de que la incubación de minutos hubo tenido lugar. El FVIIa resultante fue cuantificado en el análisis de FVIIa-rTF. Restando el valor de base de FVIIa (análisis 1), se habían formado por lo tanto 8 mui de FVIIa/ml por la acción de la proteasa bajo las condiciones elegidas. 4. Proteasa + aprotinina, seguido por la adición de FVII Resultado: 11 mui de FVIIa/ml 0 En este análisis, la proteasa fue inhibida con aprotinina antes del contacto con FVII. Ni la incubación posterior con FVII, ni la siguiente cuantificación de FVIIa condujo a ningún aumento significativo del contenido de FVIIa (porque del intervalo de variación en el análisis, 11 frente a mui/ml en el análisis 1, no ha de considerarse como significativo).. Proteasa Resultado: 0 mui de FVIIa/ml Este análisis demostró que, a la concentración seleccionada, la proteasa no tuvo por sí misma ningún efecto en el sistema de ensayo FVIIa-rTF. En resumen, de lo anterior resulta que: - la proteasa descrita activa FVII; 6 - la activación de FVII por la proteasa tiene lugar directamente, esto es, independientemente de la presencia de rtf; 8
9 - la activación de FVII puede ser inhibida por aprotinina; a la concentración seleccionada, la propia aprotinina no tiene ninguna influencia significativa sobre el sistema de ensayo. 2 Ejemplo 2 Este ejemplo describe cómo es activado FVII en una reacción que depende de la concentración de la proteasa y del tiempo durante el cual la proteasa es incubada con FVII. Se seleccionaron sistemas de ensayo y reactivos para corresponder con las condiciones descritas en el ejemplo 1. En una primera serie de experimentos, el FVII introducido inicialmente fue preincubado con diferentes diluciones (1:, 1: y 1:) de las disoluciones que contenían la proteasa ( min a temperatura ambiente), luego fue tratado con aprotinina (para inhibir la proteasa), y posteriormente ensayado para determinar el contenido de FVIIa en el análisis FVIIa-rTF. Una vez más, los análisis paralelos, en los que la proteasa había sido inhibida por aprotinina antes del contacto con FVII, sirvieron como análisis testigo. Los resultados se presentan como factores de activación, es decir, corresponden a x veces el valor que fue medido en el análisis testigo mencionado anteriormente: Análisis Testigo Proteasa + FVII Proteasa + aprotinina Incubación Incubación + aprotinina + FVII Dilución de la Factor de activación disolución de proteasa 1: 2,6 1,0 1: 2,0 1,0 1: 1,6 1,0 El factor de activación 1:0 de los análisis testigo corresponde al testigo, que se incluyó adicionalmente y en el que sólo el tampón de ensayo, que contenía el FVII empleado, se trató en idénticas condiciones de incubación, y se ensayó. Esto es, no tuvo lugar una activación significativa en los análisis testigo. De esto resulta que el FVII es activado por la proteasa de una manera que depende de la concentración de la proteasa. Se demostró de manera similar que, cuando las concentraciones de los agentes correaccionantes se mantienen constantes, el FVII es activado por la proteasa de una manera que depende de la duración de la incubación. Cuando se incubaron conjuntamente volúmenes iguales de una disolución que contenía 0,2 UI de FVII/ml y una disolución de proteasa diluida 1:, se obtuvieron los siguientes contenidos de FVIIa después de incubar durante los tiempos adecuados, y añadir posteriormente aprotinina (para detener la activación): Duración de la incubación Factor de activación 0 min 1,0 2, min 1,3,0 min 2,0,0 min 2,8,0 min >3,8 De esto resulta que el FVII es activado por la proteasa de una manera que depende del tiempo. Ejemplo 3 Usando este ejemplo, se demostrará que la activación de FVII por la proteasa aumenta en presencia de iones de calcio y heparina. 9
10 Se mezclaron 2 µl de la disolución que contenía proteasa con 0 µl de: - tampón (testigo) - CaCl 2 mm - 0 unidades USP (farmacopea de EE.UU.) de heparina/ml Pathromtin (mezcla de lípidos, cantidad disuelta de acuerdo con las instrucciones del fabricante) a temperatura ambiente durante min, y luego se trataron con 0 µl de una disolución tampón de trometamol/nacl (ph, 8,2) y 2 µl del sustrato cromógeno S-2288 (3 mm); se midió luego el cambio dependiente del tiempo en la extinción a nm (a 37ºC). Los factores de activación, relacionados con el testigo tampón (x veces), se presentan en la tabla siguiente: Análisis Factor de activación (x veces el testigo tampón) Testigo tampón 1,0 + CaCl 2 3,6 + heparina 2,6 + lípido 0,9 + CaCl 2 + heparina 4,3 + CaCl 2 + lípido 3,3 + heparina + lípido 2,7 + CaCl 2 + heparina + lípido 3,7 Bajo las condiciones usadas en este ejemplo, pueden observarse aumentos notables de la actividad de la proteasa en presencia de iones de calcio y/o heparina. Ejemplo 4 En cada caso, se mezclaron 2 µl de una disolución que contenía, 1 ó 0,1 µg de proteasa/ml con 2 µl de FVIII (2 UI/ml), después de lo cual se añadieron 2 µl de CaCl 2 (2 mm) y 2 µl de Pathromtin (Dade Behring GmbH). Después de incubar a 37ºC durante 0, 3, y min, la reacción de detuvo añadiendo 0 µl de aprotinina (00 kui/mg). Una muestra en la que inicialmente se introdujo aprotinina sirvió como testigo. Cada muestra se diluyó en tampón de trometamol/seroalbúmina bovina (BSA). En cada caso, se mezclaron 0 µl de esta disolución con 0 µl del reactivo de factores (compuesto esencialmente de FIXa, FX y un inhibidor de trombina, modificado apropiadamente de acuerdo con el ensayo de FVIII Coamatic, Chromogenix AB), y se incubaron a 37ºC durante min. Después de que se hubieran añadido 0 µl de sustrato (por ejemplo, S-276, Na-Cbo-D-Arg-Gly- Arg-p-nitroanilina), la reacción se detuvo después de un periodo predeterminado de incubación, añadiendo 0 µl de ácido acético (0%), y se midió entonces la DO a nm. Se usó una curva patrón para FVIII para determinar la concentración en la muestra. Resultados En un primer análisis, se mantuvo constante ( min) el tiempo durante el que se incubó la proteasa con FVIII (2 UI/ml), pero se varió la concentración de la proteasa (0,1, 1 y µg/ml). La reacción se detuvo y se determinó la concentración residual de FVIII activo. Conforme aumentaba la concentración de proteasa, más FVIII era desactivado equivalentemente (figura 1). El contenido de proteasa de una muestra puede cuantificarse usando una curva patrón apropiada. En un segundo análisis, la concentración de la proteasa se mantuvo constante ( µg/ml), pero se varió el tiempo de incubación con FVIII (2 UI/ml). Se vio una reducción notable en la concentración residual de FVIII activo conforme aumentaba el tiempo de incubación (figura 2). Ejemplo 6 Se investigó la influencia del activador de FVII sobre la actividad del factor V: Se incubaron 2 µl de disolución que contenía proteasa (0-0 µg/ml) con 0 µl de FV ( UI/ml) y 2 µl de CaCl 2 2 mm (0- min) y, después de eso, se añadieron 0 µl de tampón que contenía 0 kui de aprotinina/ml.
11 En cada caso, se incubaron luego 0 µl de cada análisis de incubación con 0 µl de plasma con carencia de FV, a 37ºC durante 1 min, después de lo cual se mezclaron dentro 0 µl de Thromborel S, y se determinaron los tiempos de coagulación en un coagulómetro Schnitger and Gross. Se determinaron las actividades residuales de FV. Resultados Concentración de proteasa (µg/ml) Actividad residual de FV Tiempo durante el cual la proteasa se incubó con FV (min) Este ejemplo demuestra que FV fue desactivado por la proteasa con el tiempo. Ejemplo Se investigó la influencia del activador de FVII sobre los tiempos de coagulación en los denominados ensayos globales, usando coagulómetros Schnitger and Gross. Todos los valores de diferencias listados corresponden a los tiempos de coagulación que fueron acortados con esta cantidad. NAPTT (tiempo de tromboplastina parcial no activada) La disolución que contenía proteasa se diluyó con tampón hasta 0,, y 3 µg/ml. 0 µl de cada una de estas disoluciones se incubó, a 37ºC durante 2 min, con 0 µl de plasma con citrato (mezcla de plasmas humanos estándar o de donantes individuales) y 0 µl de Pathromtin, después de lo cual se añadieron 0 µl de CaCl 2 2 mm; se determinaron luego los tiempos de coagulación. Se determinaron las diferencias entre estos valores medidos y los tiempos de coagulación correspondientes obtenidos con disolución de tampón en vez de la proteasa. Muestra Nº Diferencias de tiempo de coagulación (tampón menos muestra) (s) Concentración de proteasa (µg/ml) Plasma humano estándar (213 s) La adición de activador de FVII dio como resultado un acortamiento de NAPTT dependiente de la concentración. 6 Tiempo de recalcificación del plasma La disolución que contenía proteasa se diluyó con tampón hasta 0,, y 3 µg/ml. 0 µl de cada una de estas disoluciones se incubó con 0 µl de plasma con citrato (mezcla de plasmas humanos estándar o de donantes individuales), a 37ºC durante 1 min, después de lo cual se añadieron 0 µl de CaCl 2 2 mm; se determinaron luego los tiempos de coagulación. Se determinaron las diferencias entre estos valores medidos y los tiempos de coagulación correspondientes obtenidos con disolución de tampón en vez de la proteasa. 11
12 Muestra Nº Diferencias de tiempo de coagulación (tampón menos muestra) (s) Concentración de proteasa (µg/ml) Plasma humano estándar (283 s) 0 17,2,1, 0, ,8 1,7,3 90, ,2 1,7 69, 1, ,0-39,0 74, ,3 42,7,6 91,8 0 44,3 69,1 1,2 134,2 2 PT (tiempo de protrombina) La disolución que contenía proteasa se diluyó con tampón hasta 0,, y 3 µg/ml. 0 µl de cada una de estas disoluciones se incubó con 0 µl de plasma con citrato (mezcla de plasmas humanos estándar o de donantes individuales), a 37ºC durante 1 min, después de lo cual se añadieron 0 µl de Thromborel S (Dade Behring GmbH); y se determinaron luego los tiempos de coagulación. Se determinaron las diferencias entre estos valores medidos y los tiempos de coagulación correspondientes obtenidos con disolución de tampón en vez de la proteasa. Muestra Nº Diferencias de tiempo de coagulación (tampón menos muestra) (s) Concentración de proteasa (µg/ml) Plasma humano estándar (13,6 s) 0 1,0 1,7 1, 2, ,7 1,3 2,4 2, ,3 0,4 1,7 3, ,4 0,7 1, 1, ,1 0,7 1,8 3,1 0 0,3 0, 1,2 2,8 0 Los tiempos de coagulación en los ensayos globales anteriores se acortaron de una manera dependiente de la concentración de proteasa. De una manera correspondiente, fue posible, después de calibrar un plasma que se usó con una cantidad conocida del activador de FVII, determinar la concentración de proteasa en una muestra por lectura a partir de una curva patrón. 6 Ejemplo 7 Las propiedades de activación del activador del plasminógeno del activador de FVII se investigaron usando urocinasa monocatenaria (scupa) y tpa monocatenario (sctpa). 0,1 ml de disolución de PA ( µg de scupa/ml o 0 µg de sctpa/ml) +0,1 ml de tampón de ensayo o 0 U de heparina/ml en el tampón de ensayo o CaCl 2 mm en el tampón de ensayo +0, ml de tampón de ensayo 12
13 +0,1 ml de proteasa/muestra (concentraciones crecientes: 2- µg de scupa/ml o 0-0 µg de sctpa/ml) Incubación 37ºC +0,1 ml de 0 kui de aprotinina/ml en tampón de ensayo Incubación a 37ºC durante 2 min +0,1 ml de sustrato S-2444 (3 mm) Como testigo, se introdujo aprotinina inicialmente, en vez del activador del plasminógeno (PA), antes de la primera incubación, y se llevó a cabo en cada caso. En cambio, no se añadió PA hasta más tarde, en lugar de aprotinina. La diferencia de las mediciones ( ) DO nm se determinó mediante fotometría. Los valores testigo que se obtuvieron se restaron a los valores de muestra/proteasa, y de este modo se determinó la actividad de PA que fue causada por la actividad de PAA (en mui/min). Resultados 2 Activación de scupa ( µg de scupa/ml, 2- µg de activador de FVII /ml) A. Estimulante: ninguno Tiempo de Incubación (min) Actividad de PA resultante ( mui/min) Activador de FVII (µg/ml) B. Estimulante: heparina 4 Tiempo de Incubación (min) Actividad de PA resultante ( mui/min) Activador de FVII (µg/ml) C. Estimulante: CaCl 2 Tiempo de Incubación (min) Actividad de PA resultante ( mui/min) Activador de FVII (µg/ml)
11 Número de publicación: Int. Cl.: 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 29 114 1 Int. Cl.: C07K 16/36 (06.01) C12N / (06.01) C07K 2/00 (06.01) C07K 14/74 (06.01) A61K 39/39 (06.01) G01N 33/77 (06.01)
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 29 114 1 Int. Cl.: C07K 16/36 (06.01) C12N / (06.01) C07K 2/00 (06.01) C07K 14/74 (06.01) A61K 39/39 (06.01) G01N 33/77 (06.01)
REACCION BASICA DE LA COAGULACION. cascada de la coagulación. trombina. fibrina (polímero insoluble) tico. fibrinolisis cicatrización
 HEMOSTASIA II REACCION BASICA DE LA COAGULACION fibrinógeno (proteína soluble) cascada de la coagulación trombina fibrina (polímero insoluble) tapón n plaquetario tapón n hemostático tico fibrinolisis
HEMOSTASIA II REACCION BASICA DE LA COAGULACION fibrinógeno (proteína soluble) cascada de la coagulación trombina fibrina (polímero insoluble) tapón n plaquetario tapón n hemostático tico fibrinolisis
HEMOSTASIA. Dra. Carmen Aída Martínez
 HEMOSTASIA Dra. Carmen Aída Martínez Hemostasia Detención del sangrado ocasionado por un vaso dañado Trombo: tapón sanguíneo Hemo: sangre stasis: detención Tras una Lesión Vascular se dan 3 Acontecimientos:
HEMOSTASIA Dra. Carmen Aída Martínez Hemostasia Detención del sangrado ocasionado por un vaso dañado Trombo: tapón sanguíneo Hemo: sangre stasis: detención Tras una Lesión Vascular se dan 3 Acontecimientos:
PRUEBAS DE COAGULACION
 PRUEBAS DE COAGULACION MECANISMOS HEMOSTATICOS Hemostasia primaria: Como se adhieren las plaquetas Al endotelio. Hemostasia secundaria: Como se forma el coagulo de fibrina MECANISMOS LIMITANTES DE LA COAGULACION
PRUEBAS DE COAGULACION MECANISMOS HEMOSTATICOS Hemostasia primaria: Como se adhieren las plaquetas Al endotelio. Hemostasia secundaria: Como se forma el coagulo de fibrina MECANISMOS LIMITANTES DE LA COAGULACION
Teoría Actual del Mecanismo de la Coagulación Sanguínea
 Teoría Actual del Mecanismo de la Coagulación Sanguínea Prof. Delfina Almagro Vázquez Instituto de Hematología e Inmunología Componentes del mecanismo hemostático Pared Vascular Plaquetas Mecanismo de
Teoría Actual del Mecanismo de la Coagulación Sanguínea Prof. Delfina Almagro Vázquez Instituto de Hematología e Inmunología Componentes del mecanismo hemostático Pared Vascular Plaquetas Mecanismo de
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I
 Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I Tema 29 Prof. Miguel Skirzewski Prevención de la pérdida de
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Dep. Ciencias Funcionales, Sección de Fisiología Fisiología I Tema 29 Prof. Miguel Skirzewski Prevención de la pérdida de
Diagnóstico de laboratorio de las enfermedades hemorrágicas. Dra. Dunia Castillo González Lic. Yaneth Zamora González
 Diagnóstico de laboratorio de las enfermedades hemorrágicas Dra. Dunia Castillo González Lic. Yaneth Zamora González Hemostasia Complejo mecanismo de defensa del organismo, que impide las pérdidas de sangre
Diagnóstico de laboratorio de las enfermedades hemorrágicas Dra. Dunia Castillo González Lic. Yaneth Zamora González Hemostasia Complejo mecanismo de defensa del organismo, que impide las pérdidas de sangre
COMPUESTOS SÓLIDOS: MEDIO LÍQUIDO: FUNCIONES: Eritrocitos, leucocitos y plaquetas. Plasma Una vez coagulada queda Suero.
 Dra. Angélica Girón COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Respiración Nutrición y excreción Equilibrio ácido-base e hídrico
Dra. Angélica Girón COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Respiración Nutrición y excreción Equilibrio ácido-base e hídrico
CAPÍTULO 1. Qué nociones básicas de hemostasia o coagulación son necesarias para el control de los pacientes con anticoagulación oral?
 CAPÍTULOS de Anticoagulación Oral para Enfermería CAPÍTULO 1 Qué nociones básicas de hemostasia o coagulación son necesarias para el control de los pacientes con anticoagulación oral? Dra. Amparo Santamaría
CAPÍTULOS de Anticoagulación Oral para Enfermería CAPÍTULO 1 Qué nociones básicas de hemostasia o coagulación son necesarias para el control de los pacientes con anticoagulación oral? Dra. Amparo Santamaría
El proceso fisiológico de la hemostasia.
 Servicio de Farmacia El proceso fisiológico de la hemostasia. Madrid 29-Noviembre-2017 Dr. Jose A. Romero Garrido. Servicio de Farmacia. Hospital Universitario La Paz. Servicio de Farmacia INTRODUCCIÓN:
Servicio de Farmacia El proceso fisiológico de la hemostasia. Madrid 29-Noviembre-2017 Dr. Jose A. Romero Garrido. Servicio de Farmacia. Hospital Universitario La Paz. Servicio de Farmacia INTRODUCCIÓN:
El proceso fisiológico de la hemostasia y sus dianas terapéuticas.
 El proceso fisiológico de la hemostasia y sus dianas terapéuticas. Madrid 7-Octubre-2015 Dr. Jose A. Romero Garrido.. Hospital Universitario La Paz. INTRODUCCIÓN: Sistema Circulatorio INTRODUCCIÓN: Sangre
El proceso fisiológico de la hemostasia y sus dianas terapéuticas. Madrid 7-Octubre-2015 Dr. Jose A. Romero Garrido.. Hospital Universitario La Paz. INTRODUCCIÓN: Sistema Circulatorio INTRODUCCIÓN: Sangre
Lic. Jürgen Freer B.
 Lic. Jürgen Freer B. Distintos estudios han demostrado una relación entre la desestabilización del control fisiológico de la hemostasia y la incidencia de enfermedades cardiovasculares. Así la angina de
Lic. Jürgen Freer B. Distintos estudios han demostrado una relación entre la desestabilización del control fisiológico de la hemostasia y la incidencia de enfermedades cardiovasculares. Así la angina de
TEMA 8: HEMATOLOGÍA. Hematíes: < Anemia, > Policitemia Leucocitos:<Leucopenia,>Leucocitosis Plaquetas: <Trombocitopenia, > Trombocitosis
 b) Métodos automáticos: basados en variaciones en la conductividad o resistencia, basados en la difracción Células: TEMA 8: HEMATOLOGÍA Hematíes: < Anemia, > Policitemia Leucocitos:Leucocitosis
b) Métodos automáticos: basados en variaciones en la conductividad o resistencia, basados en la difracción Células: TEMA 8: HEMATOLOGÍA Hematíes: < Anemia, > Policitemia Leucocitos:Leucocitosis
COAGULACIÓN SANGUÍNEA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la Hemostasia Vasoconstricción
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la Hemostasia Vasoconstricción
11 Número de publicación: Int. Cl. 7 : A01N 43/ Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 229 160 1 Int. Cl. 7 : A01N 43/40 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02748322.1 86 Fecha de
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 229 160 1 Int. Cl. 7 : A01N 43/40 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02748322.1 86 Fecha de
FARMACOLOGÍA DE LA FIBRINOLISIS VIAS DE LA COAGULACION
 FARMACOLOGÍA DE LA FIBRINOLISIS S VIAS DE LA COAGULACION 1 TROMBOSIS -Por exceso en la respuesta hemostática -Por desencadenamiento intravascular sin finalidad fisiológica TROMBO ARTERIAL (trombo blanco)
FARMACOLOGÍA DE LA FIBRINOLISIS S VIAS DE LA COAGULACION 1 TROMBOSIS -Por exceso en la respuesta hemostática -Por desencadenamiento intravascular sin finalidad fisiológica TROMBO ARTERIAL (trombo blanco)
11 Número de publicación: Int. Cl.: 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 264 437 1 Int. Cl.: A61K 31/198 (2006.01) A61P 1/16 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 264 437 1 Int. Cl.: A61K 31/198 (2006.01) A61P 1/16 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
k 11 N. de publicación: ES k 51 Int. Cl. 5 : A61K 31/28
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 044 k 1 Int. Cl. : A61K 31/28 A61K 47/02 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90134.9 86
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 044 k 1 Int. Cl. : A61K 31/28 A61K 47/02 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90134.9 86
COAGULACIÓN SANGUÍNEA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez Fases de la
11 Número de publicación: Int. Cl.: 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 270 543 51 Int. Cl.: A61M 1/02 (2006.01) A61J 1/10 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 270 543 51 Int. Cl.: A61M 1/02 (2006.01) A61J 1/10 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
Fisiología de la Hemostasia.
 Fisiología de la Hemostasia. J. Mateo. Unitat d Hemostàsia I Trombosi. Hospital de la Santa Creu I Sant Pau. Barcelona Barcelona 2016 INTRODUCCIÓN Introducción La Hemostasia permite al organismo: Bloquear
Fisiología de la Hemostasia. J. Mateo. Unitat d Hemostàsia I Trombosi. Hospital de la Santa Creu I Sant Pau. Barcelona Barcelona 2016 INTRODUCCIÓN Introducción La Hemostasia permite al organismo: Bloquear
HEMOSTASIA. Dra. Ana Cecilia Haro 2017
 HEMOSTASIA Dra. Ana Cecilia Haro 2017 Etapa Pre-analítica Evaluación de la Hemostasia ANAMNESIS Antecedentes familiares Antecedentes personales Fármacos, hábitos dietéticos, etc CLÍNICA Hemorrágica Trombótica
HEMOSTASIA Dra. Ana Cecilia Haro 2017 Etapa Pre-analítica Evaluación de la Hemostasia ANAMNESIS Antecedentes familiares Antecedentes personales Fármacos, hábitos dietéticos, etc CLÍNICA Hemorrágica Trombótica
PLAQUETAS, HEMOSTASIA Y COAGULACIÓN
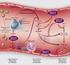 UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS DE LA SALUD DEPARTAMENTO DE CIENCIAS FUNCIONALES PLAQUETAS, HEMOSTASIA Y COAGULACIÓN Lic. Ana López-Fonseca ana.lopez@.ucla.edu.ve CONTENIDO
UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS DE LA SALUD DEPARTAMENTO DE CIENCIAS FUNCIONALES PLAQUETAS, HEMOSTASIA Y COAGULACIÓN Lic. Ana López-Fonseca ana.lopez@.ucla.edu.ve CONTENIDO
ES A1 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA. (PKA) y procedimiento de obtención de las mismas. 11 Número de publicación:
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 221 817 21 Número de solicitud: 018 1 Int. Cl. 7 : A61K 38/38 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación: 26.07.04 43
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 221 817 21 Número de solicitud: 018 1 Int. Cl. 7 : A61K 38/38 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación: 26.07.04 43
Hemostasia y Trombosis: dos caras de una misma moneda
 SOCIEDAD VENEZOLANA DE HEMATOLOGIA DIA MUNDIAL DE LA TROMBOSIS 13 DE OCTUBRE Jornadas sobre avances en hemostasia y trombosis 10 de octubre. Hotel Rasil. Puerto Ordáz. Estado Bolivar Hemostasia y Trombosis:
SOCIEDAD VENEZOLANA DE HEMATOLOGIA DIA MUNDIAL DE LA TROMBOSIS 13 DE OCTUBRE Jornadas sobre avances en hemostasia y trombosis 10 de octubre. Hotel Rasil. Puerto Ordáz. Estado Bolivar Hemostasia y Trombosis:
Tema 6 Cuantificación de proteínas
 Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
11 Número de publicación: Int. Cl. 7 : A61K 38/ Agente: Lehmann Novo, María Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 244 043 1 Int. Cl. 7 : A61K 38/18 A61K 47/26 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 989044.2 86
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 244 043 1 Int. Cl. 7 : A61K 38/18 A61K 47/26 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 989044.2 86
CALIBRADOR ESPECIALIZADO
 CALIBRADOR ESPECIALIZADO CRYOcheck Normal Reference Plasma. CRYOCHECK NORMAL REFERENCE PLASMA CCNRP-05 CCNRP-0 Plasma de calibración para las mediciones cuantitativas especializadas para parámetros en
CALIBRADOR ESPECIALIZADO CRYOcheck Normal Reference Plasma. CRYOCHECK NORMAL REFERENCE PLASMA CCNRP-05 CCNRP-0 Plasma de calibración para las mediciones cuantitativas especializadas para parámetros en
Pruebas básicas de Coagulación. Departamento de Hemostasia y Trombosis. IIHEMA Academia Nacional de Medicina
 Pruebas básicas de Coagulación Departamento de Hemostasia y Trombosis. Academia Nacional de Medicina VIA EXTRINSECA DE LA COAGULACION Bioq. Silvia Grosso Departamento Hemostasia y Trombosis Academia Nacional
Pruebas básicas de Coagulación Departamento de Hemostasia y Trombosis. Academia Nacional de Medicina VIA EXTRINSECA DE LA COAGULACION Bioq. Silvia Grosso Departamento Hemostasia y Trombosis Academia Nacional
P07 FISIOLOGÍA DE LA HEMOSTASIA
 P07 FISIOLOGÍA DE LA HEMOSTASIA Objetivos de la práctica Conocer las pruebas para el estudio de las diferentes vías coagulación y su significado clínico. Adquirir los conceptos de tiempo de sangría, tiempo
P07 FISIOLOGÍA DE LA HEMOSTASIA Objetivos de la práctica Conocer las pruebas para el estudio de las diferentes vías coagulación y su significado clínico. Adquirir los conceptos de tiempo de sangría, tiempo
Fisiología del Tejido Sanguíneo HEMOSTASIA
 Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Programa de Enfermería Departamento de Ciencias Funcionales Sección de Fisiología Fisiología del Tejido Sanguíneo HEMOSTASIA
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Programa de Enfermería Departamento de Ciencias Funcionales Sección de Fisiología Fisiología del Tejido Sanguíneo HEMOSTASIA
11 Número de publicación: Int. Cl. 7 : A61K 39/ Inventor/es: Davelaar, Frans, Gerrit. 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 224 294 1 Int. Cl. 7 : A61K 39/17 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9793833.7 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 224 294 1 Int. Cl. 7 : A61K 39/17 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9793833.7 86 Fecha de presentación:
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL
 CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
RESULTADOS Y DISCUSIÓN
 RESULTADOS Y DISCUSIÓN Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv La curva estándar con la que se estimó la concentración proteica del filtrado
RESULTADOS Y DISCUSIÓN Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv La curva estándar con la que se estimó la concentración proteica del filtrado
11 Número de publicación: Int. Cl.: 72 Inventor/es: Barak, Shlomo. 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 262 326 51 Int. Cl.: A61B 17/04 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99929684.1 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 262 326 51 Int. Cl.: A61B 17/04 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99929684.1 86 Fecha
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez 2009
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez 2009 Vasoconstricción inicial del vaso dañado. Formación de agregado plaquetario. Formación de una malla de fibrina (trombo blanco, rojo y/o depósito diseminado).
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez 2009 Vasoconstricción inicial del vaso dañado. Formación de agregado plaquetario. Formación de una malla de fibrina (trombo blanco, rojo y/o depósito diseminado).
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM Hemostasis y coagulación
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM 2016 Hemostasis y coagulación HEMOSTASIS Definición: Conjunto de respuestas que llevan a la detención de la pérdida de sangre cuando las paredes de los vasos han
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM 2016 Hemostasis y coagulación HEMOSTASIS Definición: Conjunto de respuestas que llevan a la detención de la pérdida de sangre cuando las paredes de los vasos han
Purificación de Proteínas Parte II
 Purificación de Proteínas Parte II Fase I. Obtención del extracto crudo Lisis celular. Válido para células sin pared celular como las células de tejidos animales, pero no es suficiente para células vegetales
Purificación de Proteínas Parte II Fase I. Obtención del extracto crudo Lisis celular. Válido para células sin pared celular como las células de tejidos animales, pero no es suficiente para células vegetales
11 knúmero de publicación: kint. Cl. 7 : A61N 5/06. k 72 Inventor/es: Thiberg, Rolf. k 74 Agente: Alvarez López, Fernando
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 186 712 1 Int. Cl. 7 : A61N /06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9907186.1 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 186 712 1 Int. Cl. 7 : A61N /06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9907186.1 86 Fecha de presentación:
11 Número de publicación: Int. Cl.: 72 Inventor/es: Isaksson, Jan y Nilsson, Bo. 74 Agente: Durán Moya, Carlos
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 29 137 1 Int. Cl.: B27N 3/14 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 03719044.4 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 29 137 1 Int. Cl.: B27N 3/14 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 03719044.4 86 Fecha
INFORMACIÓN PARA PRESCRIBIR AMPLIA
 INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA FANHDI 2. DENOMINACIÓN GENÉRICA Factor VIII de la coagulación sanguínea humana 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución Inyectable
INFORMACIÓN PARA PRESCRIBIR AMPLIA IPP-A 1. DENOMINACIÓN DISTINTIVA FANHDI 2. DENOMINACIÓN GENÉRICA Factor VIII de la coagulación sanguínea humana 3. FORMA FARMACÉUTICA Y FORMULACIÓN Solución Inyectable
PARTE II REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDTAR DE PROTEÍNA
 PARTE II REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDTAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo
PARTE II REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDTAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA
 REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
REVISIÓN DE MÉTODOS ESPECTROSCÓPICOS Y ELABORACIÓN DE CURVA ESTÁNDAR DE PROTEÍNA OBJETIVOS Aplicar un método espectrofotométrico para medir la concentración de una proteína. Conocer el manejo de micropipetas
11 Número de publicación: Int. Cl. 7 : A23C 9/ Inventor/es: Haindl, Rudolf y Mandl, Hans
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 238 232 1 Int. Cl. 7 : A23C 9/14 A23C 13/14 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00120497.3 86
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 238 232 1 Int. Cl. 7 : A23C 9/14 A23C 13/14 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00120497.3 86
11 kn. de publicación: ES kint. Cl. 6 : C12N 9/64
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 098 48 1 kint. Cl. 6 : C12N 9/64 C12N 11/08 A61K 38/49 C12P 21/08 12 k TRADUCCION DE PATENTE EUROPEA T3 86 k Número de solicitud
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 098 48 1 kint. Cl. 6 : C12N 9/64 C12N 11/08 A61K 38/49 C12P 21/08 12 k TRADUCCION DE PATENTE EUROPEA T3 86 k Número de solicitud
11 knúmero de publicación: kint. Cl. 7 : A61K 38/36
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 178 13 1 kint. Cl. 7 : A61K 38/36 C07K 14/7 A61L 24/ 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 178 13 1 kint. Cl. 7 : A61K 38/36 C07K 14/7 A61L 24/ 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
11 Número de publicación: Int. Cl.: 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 27 224 1 Int. Cl.: A24B 13/00 (06.01) A24B 1/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 04739497.8
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 27 224 1 Int. Cl.: A24B 13/00 (06.01) A24B 1/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 04739497.8
COAGULACIÓN SANGUÍNEA. Dr. Mynor A. Leiva Enríquez
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Respiración Nutrición y excresión
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Respiración Nutrición y excresión
11 Número de publicación: Int. Cl. 7 : A23L 2/66. de un suplemento energético y suplemento energético que contiene tal aditivo.
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 236 801 1 Int. Cl. 7 : A23L 2/66 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 97918069.2 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 236 801 1 Int. Cl. 7 : A23L 2/66 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 97918069.2 86 Fecha de presentación:
11 Número de publicación: Int. Cl.: 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 267 71 1 Int. Cl.: A61Q 19/00 (06.01) A61K 8/92 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01923849.2
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 267 71 1 Int. Cl.: A61Q 19/00 (06.01) A61K 8/92 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01923849.2
MATERIALES Y MÉTODOS. Tipo de Estudio. Muestra
 MATERIALES Y MÉTODOS Tipo de Estudio Experimental. Este tipo de estudio tiene como característica primordial el poder manipular y controlar las variables, siendo en este caso la fuerza iónica y el ph.
MATERIALES Y MÉTODOS Tipo de Estudio Experimental. Este tipo de estudio tiene como característica primordial el poder manipular y controlar las variables, siendo en este caso la fuerza iónica y el ph.
11 knúmero de publicación: kint. Cl. 7 : A61K 38/37
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 144 293 1 kint. Cl. 7 : A61K 38/37 C07K 14/7 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 971631.
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 144 293 1 kint. Cl. 7 : A61K 38/37 C07K 14/7 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 971631.
11 knúmero de publicación: kint. Cl. 6 : A61K 31/405
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 116 811 1 kint. Cl. 6 : A61K 31/ A61K 9/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 961842.8
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 116 811 1 kint. Cl. 6 : A61K 31/ A61K 9/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 961842.8
k 11 N. de publicación: ES k 51 Int. Cl. 5 : A61K 7/48
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 02 041 1 Int. Cl. : A61K 7/48 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 896.4 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 02 041 1 Int. Cl. : A61K 7/48 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 896.4 86 Fecha de presentación
Int. Cl.: 74 Agente: Carvajal y Urquijo, Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 283 3 1 Int. Cl.: A61L 12/14 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 027004.9 86 Fecha de
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 283 3 1 Int. Cl.: A61L 12/14 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 027004.9 86 Fecha de
11 Número de publicación: Int. Cl.: 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 277 437 1 Int. Cl.: A61K 39/29 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99924871.9 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 277 437 1 Int. Cl.: A61K 39/29 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99924871.9 86 Fecha
DECLARACIÓN DE CONFORMIDAD
 2018 - AÑO DEL CENTENARIO DE LA REFORMA UNIVERSITARIA Ministerio de Salud Secretaría de Regulación y Gestión Sanitaria A.N.M.A.T. DECLARACIÓN DE CONFORMIDAD En nombre y representación de la firma Productos
2018 - AÑO DEL CENTENARIO DE LA REFORMA UNIVERSITARIA Ministerio de Salud Secretaría de Regulación y Gestión Sanitaria A.N.M.A.T. DECLARACIÓN DE CONFORMIDAD En nombre y representación de la firma Productos
Int. Cl. 7 : A61K 31/ kfecha de presentación: k Solicitante/s: SMITHKLINE BEECHAM S.A. C/ Valle de la Fuenfría Madrid, ES
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 172 391 21 k Número de solicitud: 0000988 1 k Int. Cl. 7 : A61K 31/46 A61P 31/04 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 172 391 21 k Número de solicitud: 0000988 1 k Int. Cl. 7 : A61K 31/46 A61P 31/04 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
11 Número de publicación: Int. Cl. 7 : A01G 9/ Inventor/es: Visser, Cornelis, Frans, Taco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 232 494 1 Int. Cl. 7 : A01G 9/ G01N 9/36 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00961261. 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 232 494 1 Int. Cl. 7 : A01G 9/ G01N 9/36 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00961261. 86 Fecha
11 kn. de publicación: ES kint. Cl. 5 : A23L 1/16. k 72 Inventor/es: Guarneri, Roberto. k 74 Agente: Elzaburu Márquez, Fernando
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 062 848 1 Int. Cl. : A23L 1/16 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 92876.7 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 062 848 1 Int. Cl. : A23L 1/16 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 92876.7 86 Fecha de presentación
11 Número de publicación: Int. Cl. 7 : A61K 31/ Agente: Carvajal y Urquijo, Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 225 789 51 Int. Cl. 7 : A61K 31/405 A61P 35/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02732330.2
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 225 789 51 Int. Cl. 7 : A61K 31/405 A61P 35/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02732330.2
TEMA 14. Métodos inmunológicos para la identificación microbiana
 TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
METODOLOGÍA DE EXTRACCIÓN Y PURIFICACIÓN DE INHIBIDORES DE PROTEASAS EN Opuntia streptacantha
 METODOLOGÍA DE EXTRACCIÓN Y PURIFICACIÓN DE INHIBIDORES DE PROTEASAS EN Opuntia streptacantha RESUMEN Estudiante: Jannet Alejandra Vargas Sánchez Instituto Tecnológico de Roque jannettitajm@hotmail.com
METODOLOGÍA DE EXTRACCIÓN Y PURIFICACIÓN DE INHIBIDORES DE PROTEASAS EN Opuntia streptacantha RESUMEN Estudiante: Jannet Alejandra Vargas Sánchez Instituto Tecnológico de Roque jannettitajm@hotmail.com
11 knúmero de publicación: kint. Cl. 7 : C22C 5/02
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 170 850 51 kint. Cl. 7 : C22C 5/02 C22F 1/14 A44C 27/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 170 850 51 kint. Cl. 7 : C22C 5/02 C22F 1/14 A44C 27/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
11 Número de publicación: Int. Cl. 7 : A61K 7/ Inventor/es: Pinzon, Carlos y Thau, Paul. 74 Agente: Zuazo Araluze, Alexander
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 219 724 1 Int. Cl. 7 : A61K 7/46 A61K 7/42 A61K 7/48 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9716.6
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 219 724 1 Int. Cl. 7 : A61K 7/46 A61K 7/42 A61K 7/48 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9716.6
COAGULACIÓN SANGUÍNEA. Dr. Mynor A. Leiva Enríquez
 COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Nutrición y excreción Defensa:
COAGULACIÓN SANGUÍNEA Dr. Mynor A. Leiva Enríquez COMPUESTOS SÓLIDOS: Eritrocitos, leucocitos y plaquetas. MEDIO LÍQUIDO: Plasma Una vez coagulada queda Suero. FUNCIONES: Nutrición y excreción Defensa:
Dra. Dunia Castillo González Instituto de Hematología e Inmunología ALAPAC 2009
 Dra. Dunia Castillo González Instituto de Hematología e Inmunología ALAPAC 2009 MANIFESTACIONES HEMORRÁGICAS Medidas generales a tener en cuenta en pacientes con tendencia hemorrágica Realizar un interrogatorio
Dra. Dunia Castillo González Instituto de Hematología e Inmunología ALAPAC 2009 MANIFESTACIONES HEMORRÁGICAS Medidas generales a tener en cuenta en pacientes con tendencia hemorrágica Realizar un interrogatorio
RESOLUCIÓN OIV/OENO 427/2010
 RESOLUCIÓN OIV/OENO 427/2010 CRITERIOS PARA LOS MÉTODOS DE CUANTIFICACIÓN DE LOS RESIDUOS, POTENCIALMENTE ALERGÉNICOS, DE PROTEÍNAS USADAS EN LA CLARIFICACIÓN DE LOS VINOS La ASAMBLEA GENERAL, De conformidad
RESOLUCIÓN OIV/OENO 427/2010 CRITERIOS PARA LOS MÉTODOS DE CUANTIFICACIÓN DE LOS RESIDUOS, POTENCIALMENTE ALERGÉNICOS, DE PROTEÍNAS USADAS EN LA CLARIFICACIÓN DE LOS VINOS La ASAMBLEA GENERAL, De conformidad
51 Int. CI.: C10G 17/09 ( ) C10G 29/06 ( ) C10C 3/02 ( ) TRADUCCIÓN DE PATENTE EUROPEA. 72 Inventor/es: 74 Agente/Representante:
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 66 931 1 Int. CI.: CG 17/09 (06.01) CG 29/06 (06.01) CC 3/02 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 66 931 1 Int. CI.: CG 17/09 (06.01) CG 29/06 (06.01) CC 3/02 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Fecha de presentación
Int. Cl.: 72 Inventor/es: Nestler, Reimar. 74 Agente: Lehmann Novo, María Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 279 246 1 Int. Cl.: A63B 23/00 (06.01) A61H 23/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 279 246 1 Int. Cl.: A63B 23/00 (06.01) A61H 23/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas.
 Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
11 Número de publicación: Int. Cl. 7 : A61K 38/ Agente: Carvajal y Urquijo, Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 236 2 1 Int. Cl. 7 : A61K 38/46 A61P 17/12 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 0273818.4 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 236 2 1 Int. Cl. 7 : A61K 38/46 A61P 17/12 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 0273818.4 86 Fecha
VALIDACIÓN DE LOS PROCEDIMIENTOS ANALÍTICOS EMPLEADOS EN EL EXAMEN DE LOS MATERIALES FARMACÉUTICOS
 INFORME 32 ANEXO 5 VALIDACIÓN DE LOS PROCEDIMIENTOS ANALÍTICOS EMPLEADOS EN EL EXAMEN DE LOS MATERIALES FARMACÉUTICOS 1. En qué consiste la validación analítica? El control analítico de un producto farmacéutico,
INFORME 32 ANEXO 5 VALIDACIÓN DE LOS PROCEDIMIENTOS ANALÍTICOS EMPLEADOS EN EL EXAMEN DE LOS MATERIALES FARMACÉUTICOS 1. En qué consiste la validación analítica? El control analítico de un producto farmacéutico,
11 Número de publicación: Int. Cl.: 72 Inventor/es: Van der Starre, Huibert. 74 Agente: Tomás Gil, Tesifonte Enrique
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 282 189 1 Int. Cl.: A01G 9/02 (2006.01) A01G 9/12 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 282 189 1 Int. Cl.: A01G 9/02 (2006.01) A01G 9/12 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
11 knúmero de publicación: kint. Cl. 7 : A23L 1/305
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 168 08 1 kint. Cl. 7 : A23L 1/ A61K 31/19 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 9693264.6
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 168 08 1 kint. Cl. 7 : A23L 1/ A61K 31/19 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 9693264.6
A. El punto 3 del método Reactivos queda de la siguiente manera:
 RESOLUCIÓN OIV-OENO 349-2011 COMPLEMENTO DEL MÉTODO DE DETERMINACIÓN DE LA OCRATOXINA A MEDIANTE COLUMNA DE INMUNOAFINIDAD (16/2001) LA ASAMBLEA GENERAL, De conformidad con el Párrafo 2 iv del Artículo
RESOLUCIÓN OIV-OENO 349-2011 COMPLEMENTO DEL MÉTODO DE DETERMINACIÓN DE LA OCRATOXINA A MEDIANTE COLUMNA DE INMUNOAFINIDAD (16/2001) LA ASAMBLEA GENERAL, De conformidad con el Párrafo 2 iv del Artículo
Enfermedades Hemorrágicas. Clínica y Diagnóstico de Laboratorio. Dra. Maria Mercedes Morales Hospital Roberto del Rio
 Enfermedades Hemorrágicas. Clínica y Diagnóstico de Laboratorio Dra. Maria Mercedes Morales Hospital Roberto del Rio Síndromes Hemorrágicos. Consulta frecuente Impacto en morbi-mortalidad Diagnóstico y
Enfermedades Hemorrágicas. Clínica y Diagnóstico de Laboratorio Dra. Maria Mercedes Morales Hospital Roberto del Rio Síndromes Hemorrágicos. Consulta frecuente Impacto en morbi-mortalidad Diagnóstico y
CÁTEDRA DE FISIOLOGÍA FACULTAD DE ODONTOLOGÍA UNC
 CÁTEDRA DE FISIOLOGÍA FACULTAD DE ODONTOLOGÍA UNC TEMAS: Facultad de Odontología UNC. 1 TRABAJO PRÁCTICO VOLEMIA- HEMOSTASIA- GRUPOS SANGUÍNEOS Objetivos: Destacar la importancia de la volemia e interpretar
CÁTEDRA DE FISIOLOGÍA FACULTAD DE ODONTOLOGÍA UNC TEMAS: Facultad de Odontología UNC. 1 TRABAJO PRÁCTICO VOLEMIA- HEMOSTASIA- GRUPOS SANGUÍNEOS Objetivos: Destacar la importancia de la volemia e interpretar
11 knúmero de publicación: kint. Cl. 7 : C22C 33/02
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 164 89 1 kint. Cl. 7 : C22C 33/02 B22F 3/ C23C 8/22 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 164 89 1 kint. Cl. 7 : C22C 33/02 B22F 3/ C23C 8/22 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
COAGULOPATÍA INTRAVASCULAR DISEMINADA
 COAGULOPATÍA INTRAVASCULAR DISEMINADA COAGULOPATIA INTRAVASCULAR DISEMINADA (CID) Se considera una enfermedad individual sin la consideración del evento inicial. Es un desorden trombo hemorrágico sistémico
COAGULOPATÍA INTRAVASCULAR DISEMINADA COAGULOPATIA INTRAVASCULAR DISEMINADA (CID) Se considera una enfermedad individual sin la consideración del evento inicial. Es un desorden trombo hemorrágico sistémico
11 Número de publicación: Int. Cl. 7 : A61M 1/ Inventor/es: Greter, Andy y Weber, Beda. 74 Agente: Ungría López, Javier
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 220 93 1 Int. Cl. 7 : A61M 1/06 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01100241.7 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 220 93 1 Int. Cl. 7 : A61M 1/06 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 01100241.7 86 Fecha de presentación:
Lección 32. Antiagregantes, Anticoagulantes y Fibrinolíticos UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS
 Ricardo Brage e Isabel Trapero - Lección 32 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 32 Antiagregantes, Anticoagulantes y Fibrinolíticos 1. FUNDAMENTOS 2. CLASIFICACIÓN Guión Ricardo
Ricardo Brage e Isabel Trapero - Lección 32 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 32 Antiagregantes, Anticoagulantes y Fibrinolíticos 1. FUNDAMENTOS 2. CLASIFICACIÓN Guión Ricardo
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS
 FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Describir el mecanismo anticoagulante de la Heparina. 2.- Valorar las reacciones
FARMACOLOGIA DE LA SANGRE OBJETIVOS Y COMPETENCIAS Al finalizar el estudio de este Tema el alumno deberá ser capaz de: 1.- Describir el mecanismo anticoagulante de la Heparina. 2.- Valorar las reacciones
IDARUCIZUMAB es un anticuerpo humanizado (fragmento de la región variable) que se une y neutraliza la acción anticoagulante de dabigatrán
 Cuarta cuestión CUÁLES SON LOS DATOS DE EFICACIA Y SEGURIDAD DISPONIBLES CON LOS ANTÍDOTOS DE DABIGATRAN Y DE LOS ACODS CON ACTIVIDAD ANTI-FXA? CUÁL ES EL MECANISMO DE SU FUNCIONAMIENTO? IDARUCIZUMAB IDARUCIZUMAB
Cuarta cuestión CUÁLES SON LOS DATOS DE EFICACIA Y SEGURIDAD DISPONIBLES CON LOS ANTÍDOTOS DE DABIGATRAN Y DE LOS ACODS CON ACTIVIDAD ANTI-FXA? CUÁL ES EL MECANISMO DE SU FUNCIONAMIENTO? IDARUCIZUMAB IDARUCIZUMAB
VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE
 VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE EQUIPO ADICIONAL NO SUMINISTRADO: La preparación de los reactivos requiere el empleo de micropipetas o sistemas que permitan dispensar los volúmenes especificados.
VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE EQUIPO ADICIONAL NO SUMINISTRADO: La preparación de los reactivos requiere el empleo de micropipetas o sistemas que permitan dispensar los volúmenes especificados.
Int. Cl. 7 : F28F 9/ Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 246 358 51 Int. Cl. 7 : F28F 9/02 B29C 65/08 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02005579.4 86
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 246 358 51 Int. Cl. 7 : F28F 9/02 B29C 65/08 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 02005579.4 86
Int. Cl.: 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 271 878 1 Int. Cl.: A61L 27/ (06.01) A61L 27/06 (06.01) A61F 2/12 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 271 878 1 Int. Cl.: A61L 27/ (06.01) A61L 27/06 (06.01) A61F 2/12 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud
Prof. Carlos Montelara Tirado
 Prof. Carlos Montelara Tirado 1 Composición de la Sangre Introducción (Figura 17-1) Compuesta de plasma y elementos formes. Medio de transporte que realiza los servicios de captación y liberación para
Prof. Carlos Montelara Tirado 1 Composición de la Sangre Introducción (Figura 17-1) Compuesta de plasma y elementos formes. Medio de transporte que realiza los servicios de captación y liberación para
Hemostasia. Dra. Cynthia González Ruíz
 Hemostasia Dra. Cynthia González Ruíz Contenido Temático Hemostasia Mecanismos Primarios Mecanismos Secundarios Referencias Consultadas Hemo stasia = Prevención perdida de la sangre. Detención de la Sangre.
Hemostasia Dra. Cynthia González Ruíz Contenido Temático Hemostasia Mecanismos Primarios Mecanismos Secundarios Referencias Consultadas Hemo stasia = Prevención perdida de la sangre. Detención de la Sangre.
11 Número de publicación: Int. Cl.: 72 Inventor/es: Bobenhausen, Axel. 74 Agente: Roeb Díaz-Álvarez, María
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 27 718 1 Int. Cl.: A62C 3/08 (06.01) G08B 17/00 (06.01) B64D 47/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 27 718 1 Int. Cl.: A62C 3/08 (06.01) G08B 17/00 (06.01) B64D 47/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud
FICHA TECNICA DE PRODUCTOS Y EQUIPOS
 1 de 5 NOMBRE DEL PRODUCTO: GENTAMICINA REFERENCIA: 6801711 MARCA: JOHNSON & JOHNSON GENERALIDADES 1. Aplicación Para uso diagnóstico in vitro. El VITROS Chemistry Products GENT Reagent se usa para determinar
1 de 5 NOMBRE DEL PRODUCTO: GENTAMICINA REFERENCIA: 6801711 MARCA: JOHNSON & JOHNSON GENERALIDADES 1. Aplicación Para uso diagnóstico in vitro. El VITROS Chemistry Products GENT Reagent se usa para determinar
11 Número de publicación: Int. Cl. 7 : A61K 31/ Inventor/es: Valenti, Mauro. 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 237 16 1 Int. Cl. 7 : A61K 31/48 A61K 9/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9990690.0 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 237 16 1 Int. Cl. 7 : A61K 31/48 A61K 9/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9990690.0 86 Fecha
11 Número de publicación: Int. Cl.: 72 Inventor/es: Uttley, John Stewart y Rushton, Carl. 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 264 963 1 Int. Cl.: A47C 27/12 (06.01) A47C 27/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 264 963 1 Int. Cl.: A47C 27/12 (06.01) A47C 27/00 (06.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea:
Sólo basta que se que produzca una destrucción del endotelio vascular para que se produzca el trombo plaquetario primario.
 HEMOSTASIA La hemostasia se defina como la serie de mecanismos que evitan que se mantenga en el tiempo una pérdida de sangre cuando se produce situación de continuidad entre el vaso y el medio interno
HEMOSTASIA La hemostasia se defina como la serie de mecanismos que evitan que se mantenga en el tiempo una pérdida de sangre cuando se produce situación de continuidad entre el vaso y el medio interno
ENDOTELIO Y COAGULACION. Erick Valencia MD. EDIC. Anestesiólogo Intensivista
 ENDOTELIO Y COAGULACION Erick Valencia MD. EDIC. Anestesiólogo Intensivista Nuevos mecanismos de coagulacion FVII FT Xa X Va FT FII FIIa VIII/vWF FVIIa X IX V FII Va Plaqueta VIIIa XIa IXa IXa FVIIIa Xa
ENDOTELIO Y COAGULACION Erick Valencia MD. EDIC. Anestesiólogo Intensivista Nuevos mecanismos de coagulacion FVII FT Xa X Va FT FII FIIa VIII/vWF FVIIa X IX V FII Va Plaqueta VIIIa XIa IXa IXa FVIIIa Xa
ELISA y Western Blot
 Universidad Central de Venezuela Facultad de Medicina Escuela de Medicina José María Vargas Cátedra de Inmunología ELISA y Western Blot Práctica 1 2018 Prof. Edwin Escobar edscobar@gmail.com Aplicaciones
Universidad Central de Venezuela Facultad de Medicina Escuela de Medicina José María Vargas Cátedra de Inmunología ELISA y Western Blot Práctica 1 2018 Prof. Edwin Escobar edscobar@gmail.com Aplicaciones
