TEMA 6.- GASES: TEORÍA CINÉTICA MOLECULAR
|
|
|
- David Blanco San Segundo
- hace 6 años
- Vistas:
Transcripción
1 EMA 6.- GASES: EORÍA CINÉICA MOLECULAR 6..-RELACIÓN ENRE LA RESIÓN Y EL OLUMEN DE UN GAS. LEY DE BOYLE. Robert Boyle estudió el efecto de la presió sobre los olúees de los gases y obseró que todos los gases se coporta de igual odo al ser soetidos a cabios de presió, siepre que la teperatura se atega costate. Eperietalete ecotró los siguietes datos que correlacioa presió y olue de u gas. RESIÓN Hg OLUMEN c A partir de estos datos se iteta buscar ua ecuació ateática que los relacioe. odeos hacer arias represetacioes gráficas de estos datos: e fució de ; fora ua hipérbola e fució de /; es ua recta e fució de /; es ua recta Log e fució de log ; es ua recta. resió s olue resió s olue - resió - s olue 950 0,008 0, , olue (c / 0,00 0,00 0,008 0,006 olue (c ,004 0, , ,0009 0,004 0,009 0,004 resió ( Hg) resió ( Hg) / 55
2 log () s log(),95,9,85 log (,8,75,7,65,6,55,5,6,7,8,9, log () La ecuació de ua líea recta es y a + b, e la que se obtiee alores de y para cada alor de. Siedo b la ordeada e el orige (alor de y cuado ale 0, si b es cero, la líea pasa por el orige de coordeadas) y a es la pediete de la recta. A partir de las represetacioes ateriores se deduce que la presió y el olue de u gas so iersaete proporcioales: cte o bie cte log ( ) cte log( ) Estas ecuacioes represeta el euciado ordiario de la ley de Boyle: E ua asa dada de gas, la presió es iersaete proporcioal al olue, si la teperatura peraece costate. Si cada alor de se ultiplica por el alor correspodiete de, los productos so uy aproiadaete los isos para u gas a teperatura costate. or tato: cte obie Esta ecuació represeta la hipérbola que se obtiee trazado la gráfica de e fució de Los gases o cuple eactaete la ley de Boyle especialete a presioes eleadas y a bajas teperaturas por lo que esta ley es ta sólo aproiada. U gas que se supoe cuple la ley de Boyle se cooce coo GAS ERFECO o ejor GAS IDEAL. 6.. LEY DE CHARLES Sabeos que el aire se epade al ser caletado, disiuyedo su desidad. or esta razó los globos hichados co aire caliete se leata. 56
3 Uos 00 años ates de que Boyle restableciera su ley Jacques Charles ( ) idió los efectos que u cabio de teperatura producía e u deteriado olue de aire. Deostró que e fució de es ua líea recta que itersecta la escala cetígrada e -7ºC, o la escala Fahreheit e -460 ºF. Charles epresó esta ley así C (t + 7) Dode es el olue del gas, t la teperatura e la escala cetígrada y C ua costate de proporcioalidad. Más tarde Lord Keli ( ) sugirió que el puto de itersecció a -7º represetaba u íio absoluto de teperatura que o podría rebasarse e setido egatio. Actualete se utiliza la escala Keli de teperatura absoluta, co 0 K 7,6 ºC y O ºC 7,6 K. La Ley de Charles se epresa ahora: cte Dode es la teperatura absoluta e grados Keli, es decir (t + 7). Esta ecuació ateática os idica que a presió costate, el olue de u gas es directaete proporcioal a la teperatura absoluta. 6.. LEY DE GAY LUSSAC A olue costate, la presió de ua asa dada de gas aría directaete co la teperatura: cte 57
4 6.4. LEY COMBINADA DE LOS GASES Segú ua regla de proporcioalidad; si ua catidad es idepedieteete proporcioal a otras dos catidades, la priera es proporcioal al producto de las otras dos restates. Heos isto que es proporcioal a / y a. or lo que aplicado la regla de proporcioalidad teeos: cte o bie cte o bie La ley cobiada de los gases predice que para ua asa dada de gas, el olue es directaete proporcioal a la teperatura absoluta e iersaete proporcioal a la presió MEDICIONES DE LA MAERIA GASEOSA Los gases ocupa el olue de la asija que los cotiee y ejerce a su ez ejerce la isa presió sobre la asija. Al ejercer la presió por el pricipio de acció y reacció el recipiete ejerce sobre el gas la isa presió. Si o fuese así ocurriría gas > paredes eplota el recipiete gas < paredes el gas se coprie eor olue La presió se defie coo la fuerza ejercida por uidad de superficie. F S La presió puede represetarse e uchas uidades. E el sistea iteracioal las uidades de la presió so Newto/. abié llaados ascales (a), otras uidades so las atósferas, bares, ilíetros de ercurio o etros de agua. bar a at 760Hg at 0. H at 05a O Cuado os referios geeralete a la presió atosférica, o coo la que ejerce éste sobre ua sustacia, la referios al peso de ua colua de u líquido. Dado que: 58
5 F g ρ h S odeos escribir la fórula de la presió coo: F g g ρ h S/ g ρ h g ρ S S S S/ h g ρ s kg kg s M L [ ] Dado que el ercurio tiee ua desidad ρ Hg.600kg / y la costate de la graedad ale g 9 8 /s. Sustituyedo estos datos e la fórula aterior, teeos que 760 de Hg proporcioa ua presió de a que es el alor de la presió atosférica ( at). La ecuació aterior os idica que para u líquido deteriado a teperatura costate, la presió será proporcioal a la altura. U depósito secillo para edir la presió es el baróetro ietado por orricelli a ediados del siglo XII. Lleó u tubo co ercurio co u dedo tapaba e iertía e ua cubeta co ercurio. El iel de ercurio cae hasta u deteriado iel, de fora que la presió que ejerce la altura del líquido es la isa que la atósfera ejerce sobre la superficie de la cubeta. La altura ariaba c. segú día y hora de eperiecia, si la eperiecia se realizaba e codicioes abietales, la altura de la colua de ercurio era de 76 c. ó de 760. La presió que ejerce a atósfera es la isa que la que ejerce ua colua de 76 c de ercurio. E la h a iplícita la uidad de fuerza y superficie 59
6 La desidad y la altura so iersaete proporcioales: h g ρ Así para u líquido eos deso que el ercurio la altura de la colua equialete a 760 de Hg será ucho ayor. or ejeplo para el caso del agua H 0 se ecesita u tubo de ás de 0. de largo INDEENDENCIA DE GASES DISINOS EN MEZCLAS. LEY DE DALON. Sustacias gaseosas distitas ezcladas actúa co cierta idepedecia. Se ha obserado que esto ocurre realete co la presió que ejerce. Dalto obseró e su ley de las presioes parciales que e ua ezcla de gases, cada uo de ellos ejerce su propia presió, idepedieteete de los deás gases presetes y que la presió total de las ezclas es la sua de las presioes parciales de los gases copoetes, edidos idiidualete e el iso olue y la isa teperatura Esto se epresa idiidualete coo i i Dode i es la presió parcial debida a ua sustacia gaseosa i dada e ua ezcla; es la presió total y i la fracció olar de i Coo ya se estudió la fracció olar será igual a: i i j i j Dode idica el úero de oles EJEMLO Ua ezcla gaseosa de olue 00 c a 00 K y a 600 Hg cotiee 50% e peso de Helio y 50% de Xeó e peso Cuáles so las presioes parciales idiiduales de los gases? º Se calcula el úero de oles de He y Xe 60
7 Xe He 50 g 0'8ol ' g / ol 50 g '5ol 4'0 g / ol º Fracció olar de cada copoete Xe He 0'8ol '5ol + 0'8ol '5ol '5ol + 0'8ol 0'09 0'970ol º Segú la ley de Dalto la presió parcial de dada copoete se epresa coo: He Xe He Xe 0'970600Hg 58Hg 0'00600Hg 8Hg 6.7. OSULADOS DE LA EORÍA CÍNÉICA DE LOS GASES La teoría ciética de los gases pretede eplicar el coportaieto acroscópico de los gases ediate el estudio del oiieto caótico de las oléculas del gas. Esta teoría fue desarrollada por Berouilli, Clausius, Mawell y Boltza, especialete por los dos últios. La teoría ciética está basada e las siguietes hipótesis:. odos los gases está costituidos por u gra úero de oléculas que se halla e cotiuo oiieto.. Si las oléculas so ooatóicas, su oiieto es úicaete de traslació, e cabio, si está foradas por arios átoos, eiste, adeás del de traslació, u oiieto de ibració de los átoos y u oiieto de rotació de la olécula.. Los choques de las oléculas cotra la superficie del recipiete e que está coteidas so las causates de la presió ejercida por el gas. 4. Auque etraordiariaete pequeño coparado co el olue del recipiete, las oléculas posee u olue propio, por lo que choca etre si, produciédose u oiieto de zig-zag, e todas direccioes y co distitas elocidades. 5. Los choques de las oléculas, tato etre si coo co las paredes del recipiete, so perfectaete elásticas, por cosiguiete, o hay pérdida de eergía ciética. 6
8 6. El alor de la eergía ciética de las oléculas de u gas es directaete proporcioal a la teperatura absoluta. 7. Las fuerzas de atracció etre las oléculas del gas depede de su estructura, de su posició relatia y de la distacia que les separa. D A + l C - B 6.8. DEDUCCIÓN DE LA LEY DE BOYLE A ARIR DE LA EORÍA CINÉICA. Ua eigecia iportate de cualquier teoría es que las leyes obseradas pueda deducirse de sus postulados. Ahora epodreos ua de las aeras e que pueda deducirse la ley cobiada de los gases partiedo de los postulados ateriores. Choque de la olécula cotra ua pared ostrado el cabio de direcció del copoete de la elocidad. Cosideraos oléculas de u gas ecerradas e u recito de olue, y deseaos deteriar la presió ejercida por el iso. Segú los postulados las oléculas gaseosas se uee e todas las direccioes y co distitas elocidades, ahora bie, a efectos de cálculo, podreos proceder coo si cada ua de ellas discurriese co ua elocidad costate, obteida proediado las elocidades reales de todas. ues bie, cuado ua olécula que se desplaza co ua elocidad, cuya copoete e la direcció del eje es, choca cotra la cara A B C D, ejerce sobre ella ua fuerza -F al iso tiepo su catidad de oiieto eperieta u icreeto, ya que la copoete de la elocidad pasa del alor a -. Defiios dos agitudes físicas que o será de utilidad. Ipulso ecáico: El ipulso ecáico es ua agitud física igual al producto de ua 6
9 fuerza por el tiepo que está actuado. El ipulso ecáico es igual a la ariació de la catidad de oiieto. I F t Catidad de oiieto: Catidad fudaetal que caracteriza el oiieto de cualquier objeto. Es el producto de la asa de u cuerpo e oiieto y de su elocidad lieal. p El ipulso ecáico es igual a la ariació de la catidad de oiieto. I p F t Coo e la pared la copoete de la elocidad pasa de + a - el icreeto e la catidad de oiieto será: p F t ( ) Dode: F es la fuerza ejercida cotra la pared YZ es asa de la olécula es la elocidad de la olécula e la direcció El tiepo será l t ya que el recorrido será l+l (ida y uelta de la logitud de la caja). Sustituyedo: l F t F F l Lo descrito hasta ahora es para ua olécula para oléculas tedreos: F l Calculareos ahora la presió ejercida por las oléculas. Dado que la presió es la fuerza ejercida por uidad de superficie, la cara A B C D, que es u cuadrado, tedrá ua superficie 6
10 64 igual a l. l F Fialete, los alores proedios de, y y z debe ser iguales, obteeos e fució de. Coo z y z y + + Dode es la edia de los cuadrados de la elocidad, ya que o podeos supoer que todas las oléculas tega la isa elocidad. Sustituyedo esto e la ecuació de la presió: Co lo que: Segú el 6º postulado, la eergía ciética edia (E c ) es proporcioal a la teperatura. b E c b E c Sustituyedo esta epresió e la ecuació obteida ateriorete, teeos: b E c Co esto llegaos a la ecuació fial: K Dode b K recibe el obre de costate de Boltza. Esto es la ecuació de la ley cobiada de los gases, dode K es igual a la costate de proporcioalidad, por lo tato uestro odelo de gas es coherete co las propiedades obseradas por Charles, Boyle y Gay Lussac.
11 K,8 0 - J K - olécula - K,8 0-6 ergios K - olécula - K 8, e K - olécula COMORAMIENO NO IDEAL La ley cobiada de los gases que heos obteido ideales. K es álida para gases Lo estudiado hasta ahora sólo es álido para gases ideales. El hecho de que los gases codese y fore líquidos y sólidos, sugiere que las oléculas se atrae etre si. Esta atracció iterolecular producirá cierta ielasticidad e los choques etre las oléculas. La icopresibilidad de los líquidos y sólidos sugiere que las oléculas ocupa u olue por lo que o puede ser igorado cuado éstas se aproia utuaete. or lo tato ua teoría copleta debe icluir la atracció iterolecular y el taaño de las oléculas. Muchas propiedades fisicoquíicas de los gases puede aproiarse, co u error uy pequeño, utilizado las ecuacioes de los gases ideales. Especialete cuado se trata de gases a baja presió co e los gases a baja presió, dode las distacias iteroleculares so relatiaete grades. CERO ABSOLUO, si la teperatura ide la eergía ciética edia de traslació de las oléculas e u sistea gaseoso, ha de eistir u cero absoluto de teperatura cuado cese teóricaete este oiieto. Refiriédoos a la ley de Charles, el cero absoluto es la teperatura a la que el olue de u gas ideal se hace cero DIFUSIÓN DE GASES Las oléculas gaseosas está e costate oiieto, que es costate y caótico, por esta razó difude rápidaete detro de cualquier recipiete. Si se itroduce ua ezcla de gases e u recipiete co paredes porosas, las oléculas difudirá a traés de las paredes. Las oléculas ás ligeras difudirá a traés de las paredes a ayor elocidad ya que se uee ás rápidaete. hoas Graha obseró que la elocidad de difusió de las substacias gaseosas era iersaete proporcioal a la raíz cuadrada de la desidad del gas. K K ρ ρ 65
12 Si K es la isa el coportaieto geeral de los gases se atiee y podeos relacioar las elocidades relatias de difusió Dado que la desidad de u gas iee dada por el la asa del gas e u deteriado olue y los graos a pesos oleculares y la asa de u gas iee deteriada por su peso olecular, podeos escribir a ecuació aterior coo: ρ ρ M M Los ios resultados puede deducirse de la teoría ciética que requiere que e dos substacias gaseosas (de asas oleculares y y elocidades oleculares y ) e las isas codicioes de presió, teperatura y olue, se erifique: Ec Ec Es decir: A ua teperatura dada, las eergías ciéticas totales de dos gases diferetes so iguales Operado las epresioes ateriores teeos: La relació etre las elocidades de las oléculas debe ser la iersa de la relació etre las raíces cuadradas de sus asas. Dado que la asa de u gas iee deteriada por su peso olecular podeos escribir: M M Está ecuació es idética a la obteida por Graha. 6.. LAS LEYES DE LOS GASES EN ÉRMINOS MOLARES La defiició de ol proporcioa ua uidad de trabajo para edir catidades de substacias. ara u gas ideal podeos escribir la ecuació N K coo R Dode es el úero de oles del gas y R la costate uiersal de los gases 66
13 R puede epresarse e diferetes uidades segú las uidades e que se eprese la presió y el olue: R 0,08 l at K - ol - 8,47 Α 0 7 g c - s - K - ol - 8,47 J K - ol -,986 cal K - ol - Otra fora de epresar la ecuació de los gases ideales e térios de la asa y el peso olecular de ua sustacia. Dado que el úero de oles de ua sustacia es igual a la asa de sustacia partido por su peso olecular: M odeos escribir la ecuació de los gases coo: M R Despejado teeos: M R Dado que la desidad de ua sustacia es igual a su asa diidida por su olue: edreos: ρ M ρ R Mediate estas epresioes es posible calcular la desidad de u gas coocidas su presió y teperatura, o calcular el peso olecular de u gas a partir de su desidad a ua teperatura y presió dadas. EJEMLO: La desidad del dióido de carboo es de,695 g l - a 00 K y 70 Hg. Calcular su peso olecular. g at l,695 0,08 00 K R M ρ l ol K 44, 0 g at 70Hg 760Hg ol 67
14 Esto coicide co la fórula asigada al dióido de carboo CO. 6.. IOS DE MOIMIENO MOLECULAR Los gases o so perfectos. Los gases codesa y fora líquidos y sólidos. Dado que los líquidos y sólidos eiste a teperaturas superiores al cero absoluto y que supoeos que la teperatura ide la eergía ciética edia de traslació de las oléculas, debe eistir u oiieto olecular e los líquidos y sólidos, tal coo eiste e los gases. Esto ha sido cofirado por eperietos que uestra c6o la difusió e líquidos y sólidos es real, pero ucho eor que e los gases. La libertad de traslació de las oléculas e estado líquido queda seriaete disiuida y es casi ula e el estado sólido. Cosidereos ua olécula diatóica secilla (es decir átoos uidos etre si). Los oiietos de traslació, rotació y ibració os lo podeos iagiar de la siguiete fora: raslació Rotació ibració Se supoe que e estado gaseoso tiee lugar los tipos de oiieto. E estado líquido, es probable que las oléculas pueda teer ibració y rotació pero eiste uy poca traslació. E los sólidos, probableete la ibració es el úico oiieto iportate. 6.. GASES REALES. DESIACIONES DEL COMORAMIENO IDEAL. ECUACIONES DE ESADO. Si los gases fuera ideales el producto debería ser costate a todas las presioes. E realidad, todos los gases se desía del coportaieto predicho e la ayor parte de las codicioes. or lo tato si se represeta el producto de fució de la presió, a teperatura costate, la gráfica que se obtiee debe ser ua líea recta. Si ebargo lo que se obtiee e realidad dista bastate de la liealidad que debería aparecer, tal coo se aprecia e las siguietes figuras. 68
15 N CH4 H NH N CH4 H NH E las siguietes figuras se uestra: a) Coparació etre las Curas de resió -olue para el N y para u gas ideal a teperatura costate. b) frete a de u ol de gas etao a diferetes teperaturas, la teperatura de R Boyle es de 640 K. R 00 K Gas ideal 500 K 640 K Gas real a) b) Cualitatiaete las curas puede iterpretarse de la fora siguiete 69
16 A baja presió el gas es copriido y la fuerza de la atracció iterolecular aueta a edida que las oléculas se aproia etre si, haciedo que el olue disiuya ás de lo que predice la ley cobiada de los gases y dado alores bajos de. A presioes altas, debido a que las oléculas, o so asas putuales, éstas se ecuetras ecesiaete cocetradas, haciedo que las repulsioes iteroleculares eite que el olue disiuya hasta el alor predicho por la ley de los gases. or tato el alor de es alto. Geeralete la cura e fució de de u gas real pasa por u íio. E todos los gases eiste ua teperatura coocida co el obre de teperatura de Boyle a la que desaparece el íio de la cura e fució de, y el producto se hace igual o ayor que el producto R de u ol de gas a cualquier presió. Si ebargo el íio se hace uy isible cerca de la teperatura de codesació cuado se espera que el gas o se coporte idealete ECUACIONES DE ESADO QUE DESCRIBEN EL COMORAMIENO DE LOS GASES REALES Se ha propuesto arias ecuacioes llaadas de estado para predecir co ayor eactitud el coportaieto de los gases reales. La ás coocida es la debida a a der Waals.87. Esta ecuació tiee la isa fora geeral que la ley de los gases ideales ecepto el tério a/ que corrige la presió y el tério b que corrige el olue, dode a y b so costates características de cada gas. Estos térios correctores deria del hecho de que u gas real o se coporta segú las suposicioes siplificadas epleadas para deducir la ley de los gases ideales. riero el olue dispoible para las oléculas de gas o es, el olue total del recipiete, si o eos el olue ocupado por las oléculas del gas -b, dode b está claraete relacioado co el taaño de las oléculas del gas. Naturalete el taaño efectio de ua olécula está deteriado por la agitud de las fuerzas de repulsió iteroleculares. Segudo, resulta deasiado siplificado supoer que las oléculas de u gas real o iteractúa etre si. E realidad siepre eiste débiles fuerzas de atracció iterolecular, que so las resposables de la eistecia de gases codesados. Debido a las fuerzas iteroleculares, la presió que se ide e u gas es eor de la predicha por la teoría ciética olecular. eaos el ejeplo de la figura. 70
17 ARED M ARED M a) Reducció de la presió de u gas real coo resultado de las atraccioes oleculares a) Gas a baja desidad, b) Gas a alta desidad. Ua olécula M de u gas a eleada desidad golpea la pared co ua fuerza eor que si estuiera a baja desidad, porque las atraccioes de sus oléculas ecias reduce la fuerza del ipacto. La atracció debida al gas es proporcioal a a, e iersaete proporcioal a. or lo tato se añade la catidad a/ la presió edida para copesar los efectos de las fuerzas de atracció de a der Waals. La ecuació de estado de a der Waals para oles de gas es: a + ( b) R Otra ecuació de estado. La llaada ecuació de irial que cotiee ua serie de potecias de /. b) R B C D ara u ol de gas La ecuació se propuso de fora copletaete epírica, siedo elegidos los alores de B, C, etc. a fi de que los alores eperietales coicidiera co los de la ecuació. Si ebargo el segudo tério de la derecha se ha relacioado teóricaete co la eergía potecial etre pares de oléculas, el tercero etre grupos de tres, etc. A diferecia de las curas de resió frete a olue descritas e la ley de Boyle, las curas para fluidos reales, tiee la fora que se uestra a cotiuació. 7
18 eperatura crítica. odos los gases reales tiee ua teperatura crítica (c) esto es la teperatura ayor a la que puede licuarse el gas por aueto de la presió. Así pues u gas o puede ser licuado por ecia de su teperatura critica, sea cual sea la presió. A la teperatura y presió crítica, resulta iposible distiguir la fase gas de la liquida. Las costates críticas c y c de u gas se obtiee a partir de la isotera crítica, coo la seguda deriada de la presió respecto el olue e u puto tal que se aule. Dado que e el puto crítico aparece u puto de ifleió e la isotera. c 0 y c 0 7
EJERCICIOS DISOLUCIONES (ejercicios fáciles para iniciarse) Primero debemos poner la fórmula con la que se calcula el %masa: masasoluto
 EJERCICIOS DISOLUCIONES (ejercicios fáciles para iiciarse) Solució: Priero debeos poer la fórula co la que se calcula el %asa: asa % asa asadisolució El (copoete ioritario) es la glucosa y el disolvete
EJERCICIOS DISOLUCIONES (ejercicios fáciles para iiciarse) Solució: Priero debeos poer la fórula co la que se calcula el %asa: asa % asa asadisolució El (copoete ioritario) es la glucosa y el disolvete
La característica más resaltante de la capitalización con tasa de. interés simple es que el valor futuro de un capital aumenta de manera
 La Capitalizació co ua Tasa de Iterés Siple El Iterés Siple La característica ás resaltate de la capitalizació co tasa de iterés siple es que el valor futuro de u capital aueta de aera lieal. Sea u pricipal
La Capitalizació co ua Tasa de Iterés Siple El Iterés Siple La característica ás resaltate de la capitalizació co tasa de iterés siple es que el valor futuro de u capital aueta de aera lieal. Sea u pricipal
Capítulo V. Teoría cinética elemental de los procesos de transporte
 Capítulo V. Teoría ciética eleetal de los procesos de trasporte Lecció Gas diluido. Desequilibrio. Colisioes. Recorrido libre edio Lecció Viscosidad y trasporte de oeto. Coeficiete de iscosidad de u gas
Capítulo V. Teoría ciética eleetal de los procesos de trasporte Lecció Gas diluido. Desequilibrio. Colisioes. Recorrido libre edio Lecció Viscosidad y trasporte de oeto. Coeficiete de iscosidad de u gas
DESTILACIÓN FRACCIONADA
 UNIVERSIA NACIONAL EXPERIMENTAL RANCISCO E MIRANA ÁREA E TECNOLOGÍA COMPLEJO ACAÉMICO EL SABINO OPERACIONES UNITARIAS II ESTILACIÓN RACCIONAA 7. MÉTOO MCCABE THIELE. udaeto: McCabe y Thiele ha desarrollado
UNIVERSIA NACIONAL EXPERIMENTAL RANCISCO E MIRANA ÁREA E TECNOLOGÍA COMPLEJO ACAÉMICO EL SABINO OPERACIONES UNITARIAS II ESTILACIÓN RACCIONAA 7. MÉTOO MCCABE THIELE. udaeto: McCabe y Thiele ha desarrollado
Estado gaseoso. Mezclas de gases ideales presión parcial de un gas en una mezcla de gases ideales ley de Dalton
 Estado gaseoso Ecuació de estado de los gases perfectos o ideales Mezclas de gases ideales presió parcial de u gas e ua mezcla de gases ideales ley de Dalto Feómeos de disolució de gases e líquidos leyes
Estado gaseoso Ecuació de estado de los gases perfectos o ideales Mezclas de gases ideales presió parcial de u gas e ua mezcla de gases ideales ley de Dalto Feómeos de disolució de gases e líquidos leyes
REFRACCIÓN. OBJETIVOS Después de completar el estudio de este tema podrá usted:
 REFRACCIÓN OBJETIVOS Después de copletar el estudio de este tea podrá usted:. Defiir el ídice de refracció y expresar tres leyes que describe el coportaieto de la luz refractada.. Aplicar la ley de Sell
REFRACCIÓN OBJETIVOS Después de copletar el estudio de este tea podrá usted:. Defiir el ídice de refracció y expresar tres leyes que describe el coportaieto de la luz refractada.. Aplicar la ley de Sell
Regla de Tres. Prof. Maria Peiró
 Regla de Tres Prof. Maria Peiró .- Regla de Tres: Es ua fora de resolver probleas que utiliza ua proporció etre tres o ás valores coocidos y u valor descoocido. La Regla de Tres puede ser siple ó copuesta.
Regla de Tres Prof. Maria Peiró .- Regla de Tres: Es ua fora de resolver probleas que utiliza ua proporció etre tres o ás valores coocidos y u valor descoocido. La Regla de Tres puede ser siple ó copuesta.
Capítulo 5. Oscilador armónico
 Capítulo 5 Oscilador aróico 5 Oscilador aróico uidiesioal 5 Reescalaieto 5 Solució e series 53 Valores propios 54 Noralizació 55 Eleetos de atriz 5 Operadores de creació y de aiquilació 5 Ecuació de valores
Capítulo 5 Oscilador aróico 5 Oscilador aróico uidiesioal 5 Reescalaieto 5 Solució e series 53 Valores propios 54 Noralizació 55 Eleetos de atriz 5 Operadores de creació y de aiquilació 5 Ecuació de valores
1. Hallar un número cuadrado perfecto de cinco cifras sabiendo que el producto de esas cinco cifras es 1568.
 Hoja de Probleas º Algebra. Hallar u úero cuadrado perfecto de cico cifras sabiedo que el producto de esas cico cifras es 568. Solució: Sea x 0 4 x 0 3 x 3 0 x 4 0 x 5 el úero que buscaos y sea a 0 b 0
Hoja de Probleas º Algebra. Hallar u úero cuadrado perfecto de cico cifras sabiedo que el producto de esas cico cifras es 568. Solució: Sea x 0 4 x 0 3 x 3 0 x 4 0 x 5 el úero que buscaos y sea a 0 b 0
2,0 1,5. 1/v. Cooperatividad negativa 1,0 0,5
 Ezimología Efecto cooperatio 1 EFECTO COOPERATIVO El efecto cooperatio ocurre e ezimas oligoméricas que posee arios sitios para la uió de sustrato y es el feómeo por el cual la uió de u ligado a ua ezima
Ezimología Efecto cooperatio 1 EFECTO COOPERATIVO El efecto cooperatio ocurre e ezimas oligoméricas que posee arios sitios para la uió de sustrato y es el feómeo por el cual la uió de u ligado a ua ezima
09/05/2011. Fuerzas intermoleculares pequeñas. Movimientos rápidos e independientes
 ESTADO GASEOSO Gases Fuerzas itermoleculares pequeñas Movimietos rápidos e idepedietes Volume El comportamieto de u gas se defie por medio de variable : Temperatura Presió N de moles 1 Medidas e gases
ESTADO GASEOSO Gases Fuerzas itermoleculares pequeñas Movimietos rápidos e idepedietes Volume El comportamieto de u gas se defie por medio de variable : Temperatura Presió N de moles 1 Medidas e gases
APUNTES DE FÍSICA I Profesor: José Fernando Pinto Parra UNIDAD 11 DINÁMICA DEL MOVIMIENTO ROTACIONAL
 APUNTES DE FÍSICA I Profesor: José Ferado Pito Parra UNIDAD 11 DINÁMICA DEL MOVIMIENTO ROTACIONAL Cuado u objeto real gira alrededor de algú eje, su movimieto o se puede aalizar como si fuera ua partícula,
APUNTES DE FÍSICA I Profesor: José Ferado Pito Parra UNIDAD 11 DINÁMICA DEL MOVIMIENTO ROTACIONAL Cuado u objeto real gira alrededor de algú eje, su movimieto o se puede aalizar como si fuera ua partícula,
Números complejos. Un cuerpo conmutativo es un conjunto de números que pueden sumarse, restarse, multiplicarse y dividirse.
 Núeros coplejos 1. Cuerpos U cuerpo coutativo es u cojuto de úeros que puede suarse, restarse, ultiplicarse y dividirse. Los úeros racioales, esto es, los úeros que puede escribirse e fora de fracció,
Núeros coplejos 1. Cuerpos U cuerpo coutativo es u cojuto de úeros que puede suarse, restarse, ultiplicarse y dividirse. Los úeros racioales, esto es, los úeros que puede escribirse e fora de fracció,
DIFERENCIAL DE UNA FUNCIÓN REAL DE DOS VARIABLES REALES
 Cálculo III- Dierecial-TVMCD-Geeralizació Diereciabilidad DIFERENCIL DE UN FUNCIÓN REL DE DOS VRILES RELES a R : R b R R z : E las codicioes ateriores si llaaos a la ució : R R observaos que es ua trasoració
Cálculo III- Dierecial-TVMCD-Geeralizació Diereciabilidad DIFERENCIL DE UN FUNCIÓN REL DE DOS VRILES RELES a R : R b R R z : E las codicioes ateriores si llaaos a la ució : R R observaos que es ua trasoració
GUIA DE MATEMÁTICAS 2 Bloque 2
 GUIA DE MATEMÁTICAS 2 Bloque 2 Eje teático: SN y PA Coteido: 8.2. Resolució de probleas que iplique adició y sustracció de ooios. Itecioes didácticas: Que los aluos distiga las características de los térios
GUIA DE MATEMÁTICAS 2 Bloque 2 Eje teático: SN y PA Coteido: 8.2. Resolució de probleas que iplique adició y sustracció de ooios. Itecioes didácticas: Que los aluos distiga las características de los térios
UNIDAD 1: MATRICES Y DETERMINANTES
 IES NERVIÓN. MTEMÁTICS PLICDS CIENCIS SOCILES II Uidad 1: MTRICES Y DETERMINNTES UNIDD 1: MTRICES Y DETERMINNTES 1. MTRICES 1.1. DEFINICIONES BÁSICS Matriz de orde : es ua serie de úeros reales distribuidos
IES NERVIÓN. MTEMÁTICS PLICDS CIENCIS SOCILES II Uidad 1: MTRICES Y DETERMINNTES UNIDD 1: MTRICES Y DETERMINNTES 1. MTRICES 1.1. DEFINICIONES BÁSICS Matriz de orde : es ua serie de úeros reales distribuidos
Permutaciones y combinaciones
 Perutacioes y cobiacioes Cotaos posibilidades Coezaos co u secillo ejeplo E España los coches tiee ua atrícula que costa de cuatro dígitos deciales seguidos de tres letras sacadas de u alfabeto de 26 Cuátas
Perutacioes y cobiacioes Cotaos posibilidades Coezaos co u secillo ejeplo E España los coches tiee ua atrícula que costa de cuatro dígitos deciales seguidos de tres letras sacadas de u alfabeto de 26 Cuátas
ÁREA DE INGENIERÍA QUÍMICA Prof. Isidoro García García. Operaciones Básicas de Transferencia de Materia. Tema 4
 ÁRE DE IGEIERÍ QUÍMIC Operacioes Básicas de Trasferecia de Materia Tea 4 Operacioes Básicas de Trasferecia de Materia ITRODUCCIÓ a aoría de las corrietes de u proceso quíico está costituidas por varios
ÁRE DE IGEIERÍ QUÍMIC Operacioes Básicas de Trasferecia de Materia Tea 4 Operacioes Básicas de Trasferecia de Materia ITRODUCCIÓ a aoría de las corrietes de u proceso quíico está costituidas por varios
Área de Matemáticas. Curso 2015/2016 RELACIÓN DE EJERCICIOS RESUELTOS TEMA 8 Geometría Analítica en el Plano
 Área de Mateáticas. Curso 05/06 TEMA 8 Geoetría Aalítica e el Plao Ejercicio º a Escribe la ecuació de la recta r que pasa por los putos. b Obté la ecuació de la recta s que pasa por tiee pediete. c Halla
Área de Mateáticas. Curso 05/06 TEMA 8 Geoetría Aalítica e el Plao Ejercicio º a Escribe la ecuació de la recta r que pasa por los putos. b Obté la ecuació de la recta s que pasa por tiee pediete. c Halla
Unidad 1: Las Ecuaciones Diferenciales y Sus Soluciones
 Uidad : Las Ecuacioes Difereciales y Sus Solucioes. Itroducció. Tato e las ciecias como e las igeierías se desarrolla modelos matemáticos para compreder mejor los feómeos físicos. Geeralmete, estos modelos
Uidad : Las Ecuacioes Difereciales y Sus Solucioes. Itroducció. Tato e las ciecias como e las igeierías se desarrolla modelos matemáticos para compreder mejor los feómeos físicos. Geeralmete, estos modelos
Principio de multiplicación. Supongamos que un procedimiento designado como 1, puede hacerse de n 1
 MÉTODOS DE ENUMERACIÓN Y CONTEO. Pricipio de ultiplicació. Supogaos que u procediieto desigado coo puede hacerse de aeras. Supogaos que u segudo procediieto desigado coo se puede hacer de aeras. Tabié
MÉTODOS DE ENUMERACIÓN Y CONTEO. Pricipio de ultiplicació. Supogaos que u procediieto desigado coo puede hacerse de aeras. Supogaos que u segudo procediieto desigado coo se puede hacer de aeras. Tabié
ANÁLISIS DIMENSIONAL Y SEMEJANZA DINÁMICA
 ANÁISIS IENSIONA Y SEEJANZA INÁICA PROOIPOS Y OEOS os procediietos aalíticos basados e las ecuacioes geerales de la ecáica de los fluidos, o perite resolver, adecuadaete, todos los probleas que se preseta
ANÁISIS IENSIONA Y SEEJANZA INÁICA PROOIPOS Y OEOS os procediietos aalíticos basados e las ecuacioes geerales de la ecáica de los fluidos, o perite resolver, adecuadaete, todos los probleas que se preseta
Existen varios montajes experimentales que permiten la determinación del momento magnético. Aquí discutiremos tres de ellos.
 Solució Problea xiste varios otajes experietales que perite la deteriació del oeto agético. Aquí discutireos tres de ellos. 1) Atracció frotal etre iaes La figura uestra el otaje experietal que propoeos
Solució Problea xiste varios otajes experietales que perite la deteriació del oeto agético. Aquí discutireos tres de ellos. 1) Atracció frotal etre iaes La figura uestra el otaje experietal que propoeos
OPERACIONES CON POLINOMIOS.
 OPERACIONES CON POLINOMIOS. EXPRESIONES ALGEBRAICAS. Ua epresió ateática que usa úeros o variables o abos para idicar productos o cocietes es u tério. Los térios,, (ab), so todos epresioes algebraicas.
OPERACIONES CON POLINOMIOS. EXPRESIONES ALGEBRAICAS. Ua epresió ateática que usa úeros o variables o abos para idicar productos o cocietes es u tério. Los térios,, (ab), so todos epresioes algebraicas.
Se plantean una serie de cuestiones y ejercicios resueltos relacionados con la cinética de las reacciones químicas.
 ESUEL UNIVERSIRI DE INGENIERÍ ÉNI INDUSRIL UNIVERSIDD POLIÉNI DE MDRID Roda de Valecia, 3 80 Madrid www.euiti.upm.es sigatura: Igeiería de la Reacció Química Se platea ua serie de cuestioes y ejercicios
ESUEL UNIVERSIRI DE INGENIERÍ ÉNI INDUSRIL UNIVERSIDD POLIÉNI DE MDRID Roda de Valecia, 3 80 Madrid www.euiti.upm.es sigatura: Igeiería de la Reacció Química Se platea ua serie de cuestioes y ejercicios
Ejercicios sobre la aplicación de las diferentes leyes que caracterizan a los gases
 Ejercicios sobre la aplicació de las diferetes leyes que caracteriza a los gases 1. g de oxígeo se ecuetra ecerrados e u recipiete de L, a ua presió de 1,5 atm. Cuál es la temperatura del gas si se supoe
Ejercicios sobre la aplicació de las diferetes leyes que caracteriza a los gases 1. g de oxígeo se ecuetra ecerrados e u recipiete de L, a ua presió de 1,5 atm. Cuál es la temperatura del gas si se supoe
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Juio, Ejercicio 4, Opció A Juio, Ejercicio 5, Opció B Reserva 1, Ejercicio 2, Opció B Reserva 2, Ejercicio 5, Opció
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Juio, Ejercicio 4, Opció A Juio, Ejercicio 5, Opció B Reserva 1, Ejercicio 2, Opció B Reserva 2, Ejercicio 5, Opció
GUIA DE ESTUDIO Nro 1
 MATERIA: MATEMÁTICA I CURSO: I AÑO EJE ESTRUCTURAL I: CONCEPTOS FUNDAMENTALES DEL ALGEBRA GRUPOS CONCEPTUALES: - Epresioes algebraicas. Poliomios. - Ecuacioes. Iecuacioes. TEMARIO: GUIA DE ESTUDIO Nro
MATERIA: MATEMÁTICA I CURSO: I AÑO EJE ESTRUCTURAL I: CONCEPTOS FUNDAMENTALES DEL ALGEBRA GRUPOS CONCEPTUALES: - Epresioes algebraicas. Poliomios. - Ecuacioes. Iecuacioes. TEMARIO: GUIA DE ESTUDIO Nro
FUNCIONES. ( a) IGUALDAD DE FUNCIONES Sí y son dos funciones, diremos que las funciones f y
 CALCULO P.C.I. PRIMER SEMESTRE 04 FUNCIONES Sí A y B so dos cojutos o vacío, ua fució de A e B asiga a cada elemeto a perteeciete al cojuto A u úico elemeto b de B que deomiamos image de a. Además diremos
CALCULO P.C.I. PRIMER SEMESTRE 04 FUNCIONES Sí A y B so dos cojutos o vacío, ua fució de A e B asiga a cada elemeto a perteeciete al cojuto A u úico elemeto b de B que deomiamos image de a. Además diremos
Tema 7: FLEXIÓN: HIPERESTATICIDAD
 Tea 7: Flexió: Hiperestaticidad Tea 7: FEXÓN: HPERESTTCDD Prof.: Jaie Sato Doigo Satillaa E.P.S.-Zaora (U.S.) - 008 Tea 7: Flexió: Hiperestaticidad 7..- NTRODUCCÓN Segú vios e la secció 4.4 ua viga o ua
Tea 7: Flexió: Hiperestaticidad Tea 7: FEXÓN: HPERESTTCDD Prof.: Jaie Sato Doigo Satillaa E.P.S.-Zaora (U.S.) - 008 Tea 7: Flexió: Hiperestaticidad 7..- NTRODUCCÓN Segú vios e la secció 4.4 ua viga o ua
P en su plano, siendo C las correspondientes
 PRINIPIO DE OS TRBJOS VIRTUES El Pricipio de los Trabajos Virtuales se expresa diciedo: Para ua deforació virtual ifiitaete pequeña de u cuerpo que se ecuetra e equilibrio, el trabajo virtual de las fuerzas
PRINIPIO DE OS TRBJOS VIRTUES El Pricipio de los Trabajos Virtuales se expresa diciedo: Para ua deforació virtual ifiitaete pequeña de u cuerpo que se ecuetra e equilibrio, el trabajo virtual de las fuerzas
Introducción al Método de Fourier. Grupo
 Itroducció al Método de Fourier. Grupo 536. 14-1-211 Problema 1.) Ua cuerda elástica co ρ, y logitud L coocidos, tiee el extremo de la izquierda libre y el de la derecha sujeto a u muelle de costate elástica
Itroducció al Método de Fourier. Grupo 536. 14-1-211 Problema 1.) Ua cuerda elástica co ρ, y logitud L coocidos, tiee el extremo de la izquierda libre y el de la derecha sujeto a u muelle de costate elástica
a. Tetraedro: Tiene 4 caras (triángulos equiláteros), 4 vértices, 6 aristas.
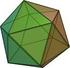 POLIEDROS Y VOLUMEN POLIEDRO: Cuerpo liitado por cuatro o ás polígoos dode cada polígoo se deoia cara, sus lados so aristas y la itersecció de las aristas se llaa vértices. PRISM: Poliedro liitado por
POLIEDROS Y VOLUMEN POLIEDRO: Cuerpo liitado por cuatro o ás polígoos dode cada polígoo se deoia cara, sus lados so aristas y la itersecció de las aristas se llaa vértices. PRISM: Poliedro liitado por
INTERÉS SIMPLE COMO FUNCIÓN LINEAL.
 INTERÉS SIMPLE COMO FUNCIÓN LINEAL. EJERCICIOS PROPUESTOS. 1.- Grafica las fucioes Moto e Iterés: a) C = + 0, co C e miles de pesos ; : meses y R. Para graficar estar fucioes, debemos dar valores a, por
INTERÉS SIMPLE COMO FUNCIÓN LINEAL. EJERCICIOS PROPUESTOS. 1.- Grafica las fucioes Moto e Iterés: a) C = + 0, co C e miles de pesos ; : meses y R. Para graficar estar fucioes, debemos dar valores a, por
UNIDAD 1 Ecuaciones Diferenciales de Primer Orden
 UNIDAD UNIDAD Ecuacioes Difereciales de Primer Orde Defiició lasificació de las Ecuacioes Difereciales Ua ecuació diferecial es aquélla que cotiee las derivadas o difereciales de ua o más variables depedietes
UNIDAD UNIDAD Ecuacioes Difereciales de Primer Orde Defiició lasificació de las Ecuacioes Difereciales Ua ecuació diferecial es aquélla que cotiee las derivadas o difereciales de ua o más variables depedietes
NOMBRE: CURSO: FECHA:
 AMLIACIÓN co solucioes. EJERCICIO RESUELTO E ua jeriguilla cogemos 3 cm 3 de aire. E ese mometo la presió que ejerce dicho gas es de a. a) Escribe el valor de la presió e atmósferas, e milímetros de mercurio,
AMLIACIÓN co solucioes. EJERCICIO RESUELTO E ua jeriguilla cogemos 3 cm 3 de aire. E ese mometo la presió que ejerce dicho gas es de a. a) Escribe el valor de la presió e atmósferas, e milímetros de mercurio,
4. TEORÍA ATÓMICA-MOLECULAR
 4. TEORÍA ATÓMICA-MOLECULAR 1. Indica cuáles de los siguientes procesos son cabios físicos y cuáles quíicos: a) La aduración de una fruta. b) La ebullición del agua. c) La congelación del agua. d) La corrosión
4. TEORÍA ATÓMICA-MOLECULAR 1. Indica cuáles de los siguientes procesos son cabios físicos y cuáles quíicos: a) La aduración de una fruta. b) La ebullición del agua. c) La congelación del agua. d) La corrosión
Tema 5: Organización de la memoria: memoria principal.
 Objetivos: Tea 5: Orgaizació de la eoria: eoria pricipal Coocer las características geerales de los diferetes tipos de eoria que aparece e u coputador digital y aalizar la ecesidad de su orgaizació jerárquica
Objetivos: Tea 5: Orgaizació de la eoria: eoria pricipal Coocer las características geerales de los diferetes tipos de eoria que aparece e u coputador digital y aalizar la ecesidad de su orgaizació jerárquica
7 Energía electrostática Félix Redondo Quintela y Roberto Carlos Redondo Melchor Universidad de Salamanca
 7 Eergía electrostática Félix Redodo Quitela y Roberto Carlos Redodo Melchor Uiersidad de alamaca Eergía electrostática de ua distribució de carga eléctrica Hasta ahora hemos supuesto distribucioes de
7 Eergía electrostática Félix Redodo Quitela y Roberto Carlos Redodo Melchor Uiersidad de alamaca Eergía electrostática de ua distribució de carga eléctrica Hasta ahora hemos supuesto distribucioes de
COLEGIO CRISTIANA FERNÁNDEZ DE MERINO Trípoli No. 112, Col. Portales, México, D. F. Tel. 5604-3628, 5605-1509
 COLEGIO CRISTIANA FERNÁNDEZ DE MERINO Trípoli No. 112, Col. Portales, México, D. F. Tel. 5604-3628, 5605-1509 MATEMATICAS SEGUNDO GRADO SECCIÓN SECUNDARIA ACTIVIDADES PARA DESARROLLAR EN CLASE CURSO 2015-2016
COLEGIO CRISTIANA FERNÁNDEZ DE MERINO Trípoli No. 112, Col. Portales, México, D. F. Tel. 5604-3628, 5605-1509 MATEMATICAS SEGUNDO GRADO SECCIÓN SECUNDARIA ACTIVIDADES PARA DESARROLLAR EN CLASE CURSO 2015-2016
Límite y Continuidad de Funciones.
 Límite Cotiuidad de Fucioes. Eleazar José García. eleagarcia9@hotmail.com. Límite de ua fució.. Defiició de límite de ua fució.. Ifiitésimo.. Ifiitésimos equivalete.. Límite por la izquierda.. Límite por
Límite Cotiuidad de Fucioes. Eleazar José García. eleagarcia9@hotmail.com. Límite de ua fució.. Defiició de límite de ua fució.. Ifiitésimo.. Ifiitésimos equivalete.. Límite por la izquierda.. Límite por
MATEMÁTICAS FINANCIERAS
 MATEMÁTICAS FINANCIERAS LECCIÓN 2: Leyes fiacieras clásicas.- Itroducció. El úero de expresioes ateáticas que podría ser leyes fiacieras, por cuplir las propiedades expuestas ateriorete, es uy ueroso.
MATEMÁTICAS FINANCIERAS LECCIÓN 2: Leyes fiacieras clásicas.- Itroducció. El úero de expresioes ateáticas que podría ser leyes fiacieras, por cuplir las propiedades expuestas ateriorete, es uy ueroso.
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA. Ingeniería Química
 UNIERSIDAD NACIONAL EXERIMENAL OLIECNICA ANONIO JOSÉ DE SUCRE ICERRECORADO BARQUISIMEO DEARAMENO DE INGENIERÍA QUÍMICA Igeiería Química Uidad III. Balace de materia Sistemas Moofásicos Clase Nº0 Autor:
UNIERSIDAD NACIONAL EXERIMENAL OLIECNICA ANONIO JOSÉ DE SUCRE ICERRECORADO BARQUISIMEO DEARAMENO DE INGENIERÍA QUÍMICA Igeiería Química Uidad III. Balace de materia Sistemas Moofásicos Clase Nº0 Autor:
DISOLUCIONES. Sistema material. Mezcla. Mezcla. coloidal
 DISOLUCIONES CONTENIDOS 1.- Sistemas materiales. 2.- Disolucioes. Compoetes. Clasificacioes. 3.- Cocetració de ua disolució 3.1. E g/l (repaso). 3.2. % e masa (repaso). 3.3. % e masa/volume. 3.4. Molaridad.
DISOLUCIONES CONTENIDOS 1.- Sistemas materiales. 2.- Disolucioes. Compoetes. Clasificacioes. 3.- Cocetració de ua disolució 3.1. E g/l (repaso). 3.2. % e masa (repaso). 3.3. % e masa/volume. 3.4. Molaridad.
Introducción al Análisis Estático Comparativo
 Itroducció al Aálisis Estático Coparativo Adrés J. Maggi Marzo 24 Modelo ateático Itroducció al Aálisis Estático Coparativo Errores coetarios a adres_aggi@hotail.co A eudo los ecooistas supoe que el udo
Itroducció al Aálisis Estático Coparativo Adrés J. Maggi Marzo 24 Modelo ateático Itroducció al Aálisis Estático Coparativo Errores coetarios a adres_aggi@hotail.co A eudo los ecooistas supoe que el udo
MODELOS DE PROBABILIDAD
 3 MODELOS DE PROBABILIDAD.- VARIABLES ALEATORIAS DISCRETAS E ocasioes, alguas variables aleatorias sigue distribucioes de probabilidad uy cocretas, coo por ejeplo el estudio a u colectivo ueroso de idividuos
3 MODELOS DE PROBABILIDAD.- VARIABLES ALEATORIAS DISCRETAS E ocasioes, alguas variables aleatorias sigue distribucioes de probabilidad uy cocretas, coo por ejeplo el estudio a u colectivo ueroso de idividuos
TEMA 6: DISOLUCIONES. Sistema material. Mezcla. Mezcla. coloidal
 TEMA : DISOLUCIONES Sistema material Sustacias puras Elemeto Compuesto Homogéea Heterogéea coloidal Suspesió 1.- DISOLUCIÓN (CONCEPTO) Es ua mezcla homogéea de dos o mas sustacias químicas tal que el tamaño
TEMA : DISOLUCIONES Sistema material Sustacias puras Elemeto Compuesto Homogéea Heterogéea coloidal Suspesió 1.- DISOLUCIÓN (CONCEPTO) Es ua mezcla homogéea de dos o mas sustacias químicas tal que el tamaño
M arcelo, de vez en vez, usa una reata de 10 m de largo y 2 cm de grueso para
 GEOMETRÍA, TRIGONOMETRÍA Y SERIES Tema 4 Series uméricas M arcelo, de vez e vez, usa ua reata de 10 m de largo y cm de grueso para medir el cotoro de los terreos que fumiga. Para que la reata que usa o
GEOMETRÍA, TRIGONOMETRÍA Y SERIES Tema 4 Series uméricas M arcelo, de vez e vez, usa ua reata de 10 m de largo y cm de grueso para medir el cotoro de los terreos que fumiga. Para que la reata que usa o
FUNCIONES DE VARIAS VARIABLES: DOMINIO, RANGO, CURVAS DE NIVEL 1 FUNCIONES DE VARIAS VARIABLES.
 FUNCIONES DE VARIAS VARIABLES: DOMINIO, RANGO, CURVAS DE NIVEL FUNCIONES DE VARIAS VARIABLES. DEFINICIONES DE FUNCIONES EN VARIAS VARIABLES. Ua fució de variable es u cojuto de pares ordeados de la forma
FUNCIONES DE VARIAS VARIABLES: DOMINIO, RANGO, CURVAS DE NIVEL FUNCIONES DE VARIAS VARIABLES. DEFINICIONES DE FUNCIONES EN VARIAS VARIABLES. Ua fució de variable es u cojuto de pares ordeados de la forma
UNIDAD 2 Ecuaciones Diferenciales Lineales de Orden Superior
 UNIDAD Ecuacioes Difereciales Lieales de Orde Superior. Defiició Ua ecuació diferecial lieal de orde tiee la forma: d y a a a a y= g d d d Si las fucioes a a so todas costates (o cero) etoces se dice que
UNIDAD Ecuacioes Difereciales Lieales de Orde Superior. Defiició Ua ecuació diferecial lieal de orde tiee la forma: d y a a a a y= g d d d Si las fucioes a a so todas costates (o cero) etoces se dice que
IES IGNACIO ALDECOA 1 AMPLIACIÓN DE MATEMÁTICAS 4º ESO CURSO 10/11
 IES IGNACIO ALDECOA AMPLIACIÓN DE MATEMÁTICAS º ESO CURSO 0/ TEMA : SUCESIONES DE NÚMEROS REALES Se llama sucesió a u cojuto de úmeros dispuestos uo a cotiuació de otro. Podemos cosiderar ua sucesió como
IES IGNACIO ALDECOA AMPLIACIÓN DE MATEMÁTICAS º ESO CURSO 0/ TEMA : SUCESIONES DE NÚMEROS REALES Se llama sucesió a u cojuto de úmeros dispuestos uo a cotiuació de otro. Podemos cosiderar ua sucesió como
Tema II: Interpolación. Polinomios de Lagrange Diferencias Divididas Interpolación Lineal
 Poliomios de Lagrage Dierecias Divididas Iterpolació Lieal Deiició: es el cálculo de valores para ua ució tabulada, e putos que o se tiee Posició X =?? 4 7 78 48 8 Tiempo Supogamos la cúbica de la siguiete
Poliomios de Lagrage Dierecias Divididas Iterpolació Lieal Deiició: es el cálculo de valores para ua ució tabulada, e putos que o se tiee Posició X =?? 4 7 78 48 8 Tiempo Supogamos la cúbica de la siguiete
5. Aproximación de funciones: polinomios de Taylor y teorema de Taylor.
 GRADO DE INGENIERÍA AEROESPACIAL. CURSO 00. Lecció. Fucioes y derivada. 5. Aproimació de fucioes: poliomios de Taylor y teorema de Taylor. Alguas veces podemos aproimar fucioes complicadas mediate otras
GRADO DE INGENIERÍA AEROESPACIAL. CURSO 00. Lecció. Fucioes y derivada. 5. Aproimació de fucioes: poliomios de Taylor y teorema de Taylor. Alguas veces podemos aproimar fucioes complicadas mediate otras
Figura 6.7: Diagrama de una columna de absorción 32
 39 Ua vez calculados los fraccioaietos se chequea la codició (6.6). Para el flujo de vapores, se obtuvo que y, 997, ietras que para el flujo de líquido se obtuvo que i x i 1,. 6.3 La absorció La absorció
39 Ua vez calculados los fraccioaietos se chequea la codició (6.6). Para el flujo de vapores, se obtuvo que y, 997, ietras que para el flujo de líquido se obtuvo que i x i 1,. 6.3 La absorció La absorció
MEDIDAS DE TENDENCIA CENTRAL. _ xi
 EDIDAS DE TENDENCIA CENTRAL. EDIA ARITÉTICA. Es la medida más coocida y tambié es llamada promedio se obtiee sumado todos los valores de la muestra o població, dividida etre el total de elemetos que cotiee
EDIDAS DE TENDENCIA CENTRAL. EDIA ARITÉTICA. Es la medida más coocida y tambié es llamada promedio se obtiee sumado todos los valores de la muestra o població, dividida etre el total de elemetos que cotiee
APLICACIONES INFORMÁTICAS EN QUÍMICA. Problemas Tema 2.3: Series, representación de funciones y construcción de tablas en HC.
 APLICACIONES INFORMÁTICAS EN QUÍMICA Problemas Tema 2.3: Series, represetació de fucioes y costrucció de tablas e HC Grado e Química º SEMESTRE Uiversitat de Valècia Facultad de Químicas Departameto de
APLICACIONES INFORMÁTICAS EN QUÍMICA Problemas Tema 2.3: Series, represetació de fucioes y costrucció de tablas e HC Grado e Química º SEMESTRE Uiversitat de Valècia Facultad de Químicas Departameto de
EJERCICIOS RESUELTOS. t +
 BXX5744_07 /6/09 4: Págia 49 EJERCICIOS RESUELTOS Calcula la tasa de variació media de la fució f() = + e los itervalos [, 0] y [0, ], aalizado el resultado obteido y la relació co la fució. La fució f()
BXX5744_07 /6/09 4: Págia 49 EJERCICIOS RESUELTOS Calcula la tasa de variació media de la fució f() = + e los itervalos [, 0] y [0, ], aalizado el resultado obteido y la relació co la fució. La fució f()
La ecuación general de los gases es el resumen que engloba a varias leyes que se enunciaron de forma separada:
 ECUACIÓN GENERAL DE LOS GASES PERFECTOS La ecuacó geeral de los gases es el resue que egloba a varas leyes que se eucaro de fora separada: Ley de Boyle - Marotte: Dce que, s se atee la teperatura costate,
ECUACIÓN GENERAL DE LOS GASES PERFECTOS La ecuacó geeral de los gases es el resue que egloba a varas leyes que se eucaro de fora separada: Ley de Boyle - Marotte: Dce que, s se atee la teperatura costate,
ESTIMACIÓN DE VARIANZAS Y PROPORCIONES POBLACIONALES MEDIANTE INTERVALOS DE CONFIANZA
 UNP-Facultad de Igeiería Carreras: Ig. Electróica y Electricista CAPÍTUO 6 ESTIMACIÓN DE VARIANZAS PROPORCIONES POBACIONAES MEDIANTE INTERVAOS DE CONFIANZA 6.1 Itervalo de cofiaza ara la variaza de ua
UNP-Facultad de Igeiería Carreras: Ig. Electróica y Electricista CAPÍTUO 6 ESTIMACIÓN DE VARIANZAS PROPORCIONES POBACIONAES MEDIANTE INTERVAOS DE CONFIANZA 6.1 Itervalo de cofiaza ara la variaza de ua
EJERCICIOS DE RECURRENCIA
 EJERCICIOS DE RECURRENCIA (co alguas solucioes) Resolver la recurrecia = 5 6 =, = y tambié ésta: = =, = Resolvamos la primera E primer lugar otamos que es ua recurrecia lieal, pues pasado todos los térmios
EJERCICIOS DE RECURRENCIA (co alguas solucioes) Resolver la recurrecia = 5 6 =, = y tambié ésta: = =, = Resolvamos la primera E primer lugar otamos que es ua recurrecia lieal, pues pasado todos los térmios
Práctica de Física AJUSTE DE UNA RECTA
 Práctica de Física AJUSTE DE UNA RECTA Calcular el valor medio y error de ua serie de valores Ajustar los datos experimetales mediate ua depedecia lieal La determiació de ua magitud física está sujeta
Práctica de Física AJUSTE DE UNA RECTA Calcular el valor medio y error de ua serie de valores Ajustar los datos experimetales mediate ua depedecia lieal La determiació de ua magitud física está sujeta
Aplicaciones del cálculo integral vectorial a la física
 Aplicacioes del cálculo itegral vectorial a la física ISABEL MARRERO epartameto de Aálisis Matemático Uiversidad de La Lagua imarrero@ull.es Ídice 1. Itroducció 1 2. Itegral doble 1 2.1. Motivació: el
Aplicacioes del cálculo itegral vectorial a la física ISABEL MARRERO epartameto de Aálisis Matemático Uiversidad de La Lagua imarrero@ull.es Ídice 1. Itroducció 1 2. Itegral doble 1 2.1. Motivació: el
PRÁCTICAS Nº 10 Y 11
 PRÁCTICA Nº 10 Y 11 CONTRATE DE HIPOTEI E INTERVALO DE CONFIANZA ETADÍTICA E INTRODUCCIÓN A LA ECONOMETRÍA º LADE CURO 008-09 Profesorado: Prof. Dra. Mª Dolores Gozález Galá Prof. M ª Mar Roero Mirada
PRÁCTICA Nº 10 Y 11 CONTRATE DE HIPOTEI E INTERVALO DE CONFIANZA ETADÍTICA E INTRODUCCIÓN A LA ECONOMETRÍA º LADE CURO 008-09 Profesorado: Prof. Dra. Mª Dolores Gozález Galá Prof. M ª Mar Roero Mirada
Los números complejos
 Los úmeros complejos Los úmeros complejos Forma biómica Defiició z = a + bi, o bie, z = (a, b) siedo a la parte real y b la parte imagiaria. a = r cos α b = r se α Opuesto z = a bi Cojugado z = a bi Represetació
Los úmeros complejos Los úmeros complejos Forma biómica Defiició z = a + bi, o bie, z = (a, b) siedo a la parte real y b la parte imagiaria. a = r cos α b = r se α Opuesto z = a bi Cojugado z = a bi Represetació
Prueba Integral Lapso / Área de Matemática Fecha: MODELO DE RESPUESTA (Objetivos del 01 al 11)
 Prueba Itegral Lapso 016-1 175-176-177 1/7 Uiversidad Nacioal Abierta Matemática I (Cód 175-176-177) Vicerrectorado Académico Cód Carrera: 16 36 80 508 51 54 610 611 61 613 Fecha: 19 11 016 MODELO DE RESPUESTA
Prueba Itegral Lapso 016-1 175-176-177 1/7 Uiversidad Nacioal Abierta Matemática I (Cód 175-176-177) Vicerrectorado Académico Cód Carrera: 16 36 80 508 51 54 610 611 61 613 Fecha: 19 11 016 MODELO DE RESPUESTA
Modelación conceptual
 TEMA 2 Modelació coceptual OBJETIVOS ESPECÍFICOS Defiir y aplicar los coceptos fudaetales relacioados co la represetació de la iforació. Describir las características de la odelació coceptual y su relació
TEMA 2 Modelació coceptual OBJETIVOS ESPECÍFICOS Defiir y aplicar los coceptos fudaetales relacioados co la represetació de la iforació. Describir las características de la odelació coceptual y su relació
CÁLCULO Ejercicios Resueltos Semana 1 30 Julio al 3 Agosto 2007
 CÁLCULO Ejercicios Resueltos Semaa 0 Julio al Agosto 007 Ejercicios Resueltos. Estime el área ecerrada por la curva de ecuació y, el eje X y, para ello, divida el itervalo [0,] e cico partes iguales, y
CÁLCULO Ejercicios Resueltos Semaa 0 Julio al Agosto 007 Ejercicios Resueltos. Estime el área ecerrada por la curva de ecuació y, el eje X y, para ello, divida el itervalo [0,] e cico partes iguales, y
Preguntas más Frecuentes: Tema 2
 Pregutas más Frecuetes: Tema 2 Pulse sobre la preguta para acceder directamete a la respuesta 1. Se puede calcular la media a partir de las frecuecias absolutas acumuladas? 2. Para calcular la media aritmética,
Pregutas más Frecuetes: Tema 2 Pulse sobre la preguta para acceder directamete a la respuesta 1. Se puede calcular la media a partir de las frecuecias absolutas acumuladas? 2. Para calcular la media aritmética,
COLEGIO DE CIENCIAS Y HUMANIDADES ACADEMIA DE MATEMÁTICAS
 COLEGIO DE CIENCIAS Y HUMANIDADES ACADEMIA DE MATEMÁTICAS "Toda cosa grade, majestuosa y bella e este mudo, ace y se forja e el iterior del hombre". Gibrá Jalil Gibrá. Uidad : PROCESOS INFINITOS Y LA NOCIÓN
COLEGIO DE CIENCIAS Y HUMANIDADES ACADEMIA DE MATEMÁTICAS "Toda cosa grade, majestuosa y bella e este mudo, ace y se forja e el iterior del hombre". Gibrá Jalil Gibrá. Uidad : PROCESOS INFINITOS Y LA NOCIÓN
Algunas funciones elementales
 Apédice B Algus fucioes eleetles B Fució poteci -ési U fució poteci -ési es u fució de l for f ( ) dode l se es u vrile y el epoete u úero turl Es l for ás secill de ls fucioes polióics f ( ) Ls fucioes
Apédice B Algus fucioes eleetles B Fució poteci -ési U fució poteci -ési es u fució de l for f ( ) dode l se es u vrile y el epoete u úero turl Es l for ás secill de ls fucioes polióics f ( ) Ls fucioes
TEMA 5: INTERPOLACIÓN
 5..- ITRODUCCIÓ TEMA 5: ITERPOLACIÓ Supogamos que coocemos + putos (x,y, (x,y,..., (x,y, de la curva y = f(x, dode las abscisas x k se distribuye e u itervalo [a,b] de maera que a x x < < x b e y k = f(x
5..- ITRODUCCIÓ TEMA 5: ITERPOLACIÓ Supogamos que coocemos + putos (x,y, (x,y,..., (x,y, de la curva y = f(x, dode las abscisas x k se distribuye e u itervalo [a,b] de maera que a x x < < x b e y k = f(x
Sistemas de Ecuaciones Lineales. M. en I. Gerardo Avilés Rosas
 Sistemas de Ecuacioes Lieales M. e I. Gerardo Avilés Rosas Octubre de 206 Tema 5 Sistemas de Ecuacioes Lieales Objetivo: El alumo formulará, como modelo matemático de problemas, sistemas de ecuacioes lieales
Sistemas de Ecuacioes Lieales M. e I. Gerardo Avilés Rosas Octubre de 206 Tema 5 Sistemas de Ecuacioes Lieales Objetivo: El alumo formulará, como modelo matemático de problemas, sistemas de ecuacioes lieales
3. Volumen de un sólido.
 GRADO DE INGENIERÍA AEROESPACIAL. CURSO 00. Lecció. Itegrales y aplicacioes.. Volume de u sólido. E esta secció veremos cómo podemos utilizar la itegral defiida para calcular volúmees de distitos tipos
GRADO DE INGENIERÍA AEROESPACIAL. CURSO 00. Lecció. Itegrales y aplicacioes.. Volume de u sólido. E esta secció veremos cómo podemos utilizar la itegral defiida para calcular volúmees de distitos tipos
CALIENTE AIRE HÚMEDO
 .- Itroducció.- CALIENTE AIRE HÚMEDO FUEGO AGUA SECO TIERRA FRIO.- Naturaleza eléctrica de la materia.-..- LOS RAYOS CATÓDICOS: La primera evidecia de partículas subatómicas se obtuvo e el estudio de la
.- Itroducció.- CALIENTE AIRE HÚMEDO FUEGO AGUA SECO TIERRA FRIO.- Naturaleza eléctrica de la materia.-..- LOS RAYOS CATÓDICOS: La primera evidecia de partículas subatómicas se obtuvo e el estudio de la
Probabilidad y Estadística 2003 Intervalos de Confianza y Test de Hipótesis paramétricos
 Probabilidad y Estadística 3 Itervalos de Cofiaza y Test de Hipótesis paramétricos Itervalos de Cofiaza Defiició Dada ua muestra aleatoria simple es decir, u vector de variables aleatorias X co compoetes
Probabilidad y Estadística 3 Itervalos de Cofiaza y Test de Hipótesis paramétricos Itervalos de Cofiaza Defiició Dada ua muestra aleatoria simple es decir, u vector de variables aleatorias X co compoetes
6. Sucesiones y Series numéricas Sucesiones numéricas DEFINICIONES
 6. Sucesioes y Series uméricas 6.. Sucesioes uméricas 6... DEFINICIONES Sucesioes de úmeros reales Se llama sucesió de úmeros reales a cualquier lista ordeada de úmeros reales: a, a 2, a 3,..., a,...,
6. Sucesioes y Series uméricas 6.. Sucesioes uméricas 6... DEFINICIONES Sucesioes de úmeros reales Se llama sucesió de úmeros reales a cualquier lista ordeada de úmeros reales: a, a 2, a 3,..., a,...,
ECUACIONES DIFERENCIALES Problemas de Valor Frontera
 DIVISIÓN DE CIENCIAS FÍSICAS Y MATEMÁTICAS DPTO. TERMODINÁMICA Y FENÓMENOS DE TRANSFERENCIA MÉTODOS APROXIMADOS EN ING. QUÍMICA TF-33 ECUACIONES DIFERENCIALES Problemas de Valor Frotera Esta guía fue elaborada
DIVISIÓN DE CIENCIAS FÍSICAS Y MATEMÁTICAS DPTO. TERMODINÁMICA Y FENÓMENOS DE TRANSFERENCIA MÉTODOS APROXIMADOS EN ING. QUÍMICA TF-33 ECUACIONES DIFERENCIALES Problemas de Valor Frotera Esta guía fue elaborada
Soluciones de Ecuación de estado de los gases ideales
 Solucioes de Ecuació de estado de los gases ideales 1. 8 gramos de itrógeo (N ) gaseoso se ecuetra e u taque de 0 L a ua temperatura de 8ºC. Qué presió ejerce? M(N) = 14/g/mol R = 0,08 atm L/ mol La ecuació
Solucioes de Ecuació de estado de los gases ideales 1. 8 gramos de itrógeo (N ) gaseoso se ecuetra e u taque de 0 L a ua temperatura de 8ºC. Qué presió ejerce? M(N) = 14/g/mol R = 0,08 atm L/ mol La ecuació
Convolución. Dr. Luis Javier Morales Mendoza. Procesamiento Digital de Señales Departamento de Maestría DICIS - UG
 Covolució Dr. Luis Javier Morales Medoza Procesamieto Digital de Señales Departameto de Maestría DICIS - UG Ídice.. Itroducció... Aálisis de Sistemas Discretos Lieales e Ivariates e el Tiempo.... Técicas
Covolució Dr. Luis Javier Morales Medoza Procesamieto Digital de Señales Departameto de Maestría DICIS - UG Ídice.. Itroducció... Aálisis de Sistemas Discretos Lieales e Ivariates e el Tiempo.... Técicas
SOLUCIONES EN UN CASO TÍPICO UNIDIMENSIONAL: EL POZO CUADRADO INFINITO
 SOLUCIONES EN UN CASO TÍPICO UNIDIMENSIONAL: EL POZO CUADRADO INFINITO Sea ua partícula de masa m costreñida a ua sola dimesió e el espacio y detro de u segmeto fiito e esa dimesió. Aplicamos tambié el
SOLUCIONES EN UN CASO TÍPICO UNIDIMENSIONAL: EL POZO CUADRADO INFINITO Sea ua partícula de masa m costreñida a ua sola dimesió e el espacio y detro de u segmeto fiito e esa dimesió. Aplicamos tambié el
E a RT. b. Verdadero. El orden total de la reacción es la suma de los exponentes de las concentraciones de la ecuación de velocidad (n = = 3)
 Modelo 04. Preguta A.- La ecuació de velocidad para la reacció A + B C viee dada por la v k A B. Justifique si las siguietes afirmacioes so verdaderas o falsas: a) Duplicar la cocetració de B hace que
Modelo 04. Preguta A.- La ecuació de velocidad para la reacció A + B C viee dada por la v k A B. Justifique si las siguietes afirmacioes so verdaderas o falsas: a) Duplicar la cocetració de B hace que
Tema 8 Límite de Funciones. Continuidad
 Tema 8 Límite de Fucioes. Cotiuidad 1. Operacioes co límites. Los límites de las sucesioes a b, c, d y e so los idicados e la tabla siguiete:, a b c d e - 0 1 Di cual es el límite de: a) lim( a b ) c)
Tema 8 Límite de Fucioes. Cotiuidad 1. Operacioes co límites. Los límites de las sucesioes a b, c, d y e so los idicados e la tabla siguiete:, a b c d e - 0 1 Di cual es el límite de: a) lim( a b ) c)
GUÍA DE ESTUDIO ÁLGEBRA LINEAL
 GUÍ DE ESUDIO ÁLGER LINEL ema. Espacios Vectoriales ) LOS NÚMEROS El sistema de úmeros reales cosiste e u cojuto R de elemetos llamados úmeros reales y dos operacioes deomiadas: adició y multiplicació,
GUÍ DE ESUDIO ÁLGER LINEL ema. Espacios Vectoriales ) LOS NÚMEROS El sistema de úmeros reales cosiste e u cojuto R de elemetos llamados úmeros reales y dos operacioes deomiadas: adició y multiplicació,
Por: Lic. Eleazar J. García. República Bolivariana de Venezuela Tinaco.- Estado Cojedes. INTEGRALES INDEFINIDAS
 Por: Lic. Eleazar J. García. República Bolivariaa de Veezuela Tiaco.- Estado Cojedes. INTEGRALES INDEFINIDAS Usted está familiarizado co alguas operacioes iversas. La adició y la sustracció so operacioes
Por: Lic. Eleazar J. García. República Bolivariaa de Veezuela Tiaco.- Estado Cojedes. INTEGRALES INDEFINIDAS Usted está familiarizado co alguas operacioes iversas. La adició y la sustracció so operacioes
DERIVADA DE FUNCIONES DEL TIPO f ( x) c, donde c es una constante, la derivada de esta función es siempre cero, es decir:
 DERIVADA DE FUNCIONES DEL TIPO f ( ) c Coceptos clave: 1. Derivada de la fució costate f ( ) c, dode c es ua costate, la derivada de esta fució es siempre cero, es decir: f '( ) 0 c. Derivada de ua fució
DERIVADA DE FUNCIONES DEL TIPO f ( ) c Coceptos clave: 1. Derivada de la fució costate f ( ) c, dode c es ua costate, la derivada de esta fució es siempre cero, es decir: f '( ) 0 c. Derivada de ua fució
Formato para prácticas de laboratorio
 Forato para prácticas de laboratorio CRRER PLN DE ESTUDIO CLVE SIGNTUR NOMBRE DE L SIGNTUR TRONCO COMÚN 00-447 ESTÁTIC PRÁCTIC NO. LBORTORIO DE CIENCIS BÁSICS DURCIÓN(HORS) EST-08 NOMBRE DE L PRÁCTIC CENTRO
Forato para prácticas de laboratorio CRRER PLN DE ESTUDIO CLVE SIGNTUR NOMBRE DE L SIGNTUR TRONCO COMÚN 00-447 ESTÁTIC PRÁCTIC NO. LBORTORIO DE CIENCIS BÁSICS DURCIÓN(HORS) EST-08 NOMBRE DE L PRÁCTIC CENTRO
Asignatura: Fisicoquímica I, Termodinámica (Lic. Qca., Ing. Alimentos) Guía de TP: Termómetro de gas. Página 1 de 7.
 Asignatura: Fisicoquíica I, erodináica (Lic. Qca., Ing. Alientos) Guía de P: eróetro de gas. Página 1 de 7 eróetro de gas OBJEIOS Deterinación de la teperatura de un sistea ediante el uso de un teróetro
Asignatura: Fisicoquíica I, erodináica (Lic. Qca., Ing. Alientos) Guía de P: eróetro de gas. Página 1 de 7 eróetro de gas OBJEIOS Deterinación de la teperatura de un sistea ediante el uso de un teróetro
ESTIMACION DE LA PRESION DE CONVERGENCIA, CONSTANTE DE EQUILIBRIO Y FASES DEL GAS NATURAL
 República Bolivariaa de Veezuela Miisterio del Poder Popular para la Educació Superior Uiversidad Nacioal Experimetal Rafael María Baralt Programa: Igeiería y Tecología Proyecto: Igeiería e Gas Profesor:
República Bolivariaa de Veezuela Miisterio del Poder Popular para la Educació Superior Uiversidad Nacioal Experimetal Rafael María Baralt Programa: Igeiería y Tecología Proyecto: Igeiería e Gas Profesor:
Números racionales. Caracterización.
 Números reales Matemáticas I Aplicadas a las Ciecias Sociales 1 Números racioales. Caracterizació. ecuerda que u úmero r es racioal si se puede poer e forma de fracció de úmeros eteros de la forma a b
Números reales Matemáticas I Aplicadas a las Ciecias Sociales 1 Números racioales. Caracterizació. ecuerda que u úmero r es racioal si se puede poer e forma de fracció de úmeros eteros de la forma a b
Actividad: Principio de Pascal
 Nivel: 3º edio Subsector: Ciencias físicas Unidad teática: Ver video Pascal Actividad: Qué es un fluido? Noralente, hablaos de tres estados de la aterial: gas, líquido y sólido. Un fluido está forado por
Nivel: 3º edio Subsector: Ciencias físicas Unidad teática: Ver video Pascal Actividad: Qué es un fluido? Noralente, hablaos de tres estados de la aterial: gas, líquido y sólido. Un fluido está forado por
Matemáticas 1 1 EJERCICIOS RESUELTOS: Funciones de una variable. Elena Álvarez Sáiz. Dpto. Matemática Aplicada y C. Computación
 Matemáticas EJERCICIOS RESUELTOS: Fucioes de ua variable Elea Álvarez Sáiz Dpto. Matemática Aplicada y C. Computació Uiversidad de Catabria Igeiería de Telecomuicació Fudametos Matemáticos I Ejercicios:
Matemáticas EJERCICIOS RESUELTOS: Fucioes de ua variable Elea Álvarez Sáiz Dpto. Matemática Aplicada y C. Computació Uiversidad de Catabria Igeiería de Telecomuicació Fudametos Matemáticos I Ejercicios:
CONVEXIDAD R 2. Conjuntos convexos. Combinación lineal convexa de m puntos. λ x. Ejemplos de conjuntos convexos en R 2
 Cojutos coveos Ejeplos de cojutos coveos e R CONVEXIDAD Cojutos coveos Coveidad de fucioes DEFINICION: U cojuto A es coveo cuado, y A y λ [0,] se cuple λ + ( λ) y A R λ + ( λ) y λ = / y λ = 0 Cojuto coveo:
Cojutos coveos Ejeplos de cojutos coveos e R CONVEXIDAD Cojutos coveos Coveidad de fucioes DEFINICION: U cojuto A es coveo cuado, y A y λ [0,] se cuple λ + ( λ) y A R λ + ( λ) y λ = / y λ = 0 Cojuto coveo:
Capítulo 5 Distribución de esfuerzos en el suelo debido a cargas
 Capítulo 5 Distribució de esfueros e el suelo debido a cargas 5. INTRODUCCIÓN Coo ya se ha explicado ateriorete ua cietació tiee el trabajo de trasferir las cargas de la estructura al suelo, cuado esto
Capítulo 5 Distribució de esfueros e el suelo debido a cargas 5. INTRODUCCIÓN Coo ya se ha explicado ateriorete ua cietació tiee el trabajo de trasferir las cargas de la estructura al suelo, cuado esto
Bloque 3 Tema 12 PRUEBAS ESTADÍSTICAS PARA EL CONTRASTE DE HIPÓTESIS: PRUEBAS PARAMÉTRICAS
 Bloque 3 Tema 1 PRUEBAS ESTADÍSTICAS PARA EL CONTRASTE DE HIPÓTESIS: PRUEBAS PARAMÉTRICAS Hay ocasioes e las que teemos que tomar decisioes relativas a ua població sobre la base de los coocimietos que
Bloque 3 Tema 1 PRUEBAS ESTADÍSTICAS PARA EL CONTRASTE DE HIPÓTESIS: PRUEBAS PARAMÉTRICAS Hay ocasioes e las que teemos que tomar decisioes relativas a ua població sobre la base de los coocimietos que
1. Relaciones de recurrencia homogéneas con coeficiente
 1. Relacioes de recurrecia homogéeas co coeficiete costate 1. Demuestra que la sucesió {a } es ua solució de la recurrecia a = a 1 + 2a 2 + 2 9 si a) a = + 2 b) a = 5( 1) + 2 c) a = 3( 1) + 2 + 2 d) a
1. Relacioes de recurrecia homogéeas co coeficiete costate 1. Demuestra que la sucesió {a } es ua solució de la recurrecia a = a 1 + 2a 2 + 2 9 si a) a = + 2 b) a = 5( 1) + 2 c) a = 3( 1) + 2 + 2 d) a
REGÍMENES FINANCIEROS
 EGÍMEES FIAIEOS are Badía, Hortèsia Fotaals, Merche Galisteo, José Mª Lecia, Mª Agels Pos, Teresa Preixes, Dídac aírez, F. Javier Sarrasí y Aa Mª Sucarrats DEPATAMETO DE MATEMÁTIA EOÓMIA, FIAIEA Y ATUAIAL
EGÍMEES FIAIEOS are Badía, Hortèsia Fotaals, Merche Galisteo, José Mª Lecia, Mª Agels Pos, Teresa Preixes, Dídac aírez, F. Javier Sarrasí y Aa Mª Sucarrats DEPATAMETO DE MATEMÁTIA EOÓMIA, FIAIEA Y ATUAIAL
Estalmat. Real Academia de Ciencias. Curso 2005/2006. Dinámica compleja. Conjuntos de Julia y Mandelbrot. Método de Newton. Miguel Reyes Mayo 2006
 Estalmat. Real Academia de Ciecias. Curso 5/6 Diámica compleja Cojutos de Julia y Madelbrot. Método de Newto. Miguel Reyes Mayo 6 Los úmeros complejos Los úmeros complejos so los úmeros de la forma dode
Estalmat. Real Academia de Ciecias. Curso 5/6 Diámica compleja Cojutos de Julia y Madelbrot. Método de Newto. Miguel Reyes Mayo 6 Los úmeros complejos Los úmeros complejos so los úmeros de la forma dode
Transformada Z. Ejemplos. Ejemplos de cálculo [ ] = [ ] ( ) ( ) 1. Transformada Z. α = α α α si α. α α α
![Transformada Z. Ejemplos. Ejemplos de cálculo [ ] = [ ] ( ) ( ) 1. Transformada Z. α = α α α si α. α α α Transformada Z. Ejemplos. Ejemplos de cálculo [ ] = [ ] ( ) ( ) 1. Transformada Z. α = α α α si α. α α α](/thumbs/56/38404012.jpg) Trasformada Ejemplos Ejemplos de cálculo. Trasformada... Calcular la trasformada, por defiició, idicado la regió de coergecia p u [ ] h h p u cos u Solució: Para calcular la Trasformada por defiició, resulta
Trasformada Ejemplos Ejemplos de cálculo. Trasformada... Calcular la trasformada, por defiició, idicado la regió de coergecia p u [ ] h h p u cos u Solució: Para calcular la Trasformada por defiició, resulta
Técnicas Cuantitativas II Muestra y Estadísticos Muestrales. TC II Muestra y Estadísticos Muestrales 1 / 20
 Técicas Cuatitativas II 2012-2013 Muestra y Estadísticos Muestrales TC II Muestra y Estadísticos Muestrales 1 / 20 Ídice Ídice Cocepto de muestra y Alguos ejemplos de variaza de la media Cocepto de muestra
Técicas Cuatitativas II 2012-2013 Muestra y Estadísticos Muestrales TC II Muestra y Estadísticos Muestrales 1 / 20 Ídice Ídice Cocepto de muestra y Alguos ejemplos de variaza de la media Cocepto de muestra
TEORÍA DE LOS CIRCUITOS II DIAGRAMAS DE BODE
 TEORÍA DE LOS CIRCUITOS II DIAGRAMAS DE BODE Supogamos teer ua plata de trasferecia G(s) (ver la figura), que es estable y a la cual le igresamos ua señal siusoidal r(t) = a. se(ω.t). Se demuestra que
TEORÍA DE LOS CIRCUITOS II DIAGRAMAS DE BODE Supogamos teer ua plata de trasferecia G(s) (ver la figura), que es estable y a la cual le igresamos ua señal siusoidal r(t) = a. se(ω.t). Se demuestra que
